Appunti di termodinamica che completano il libro di testo
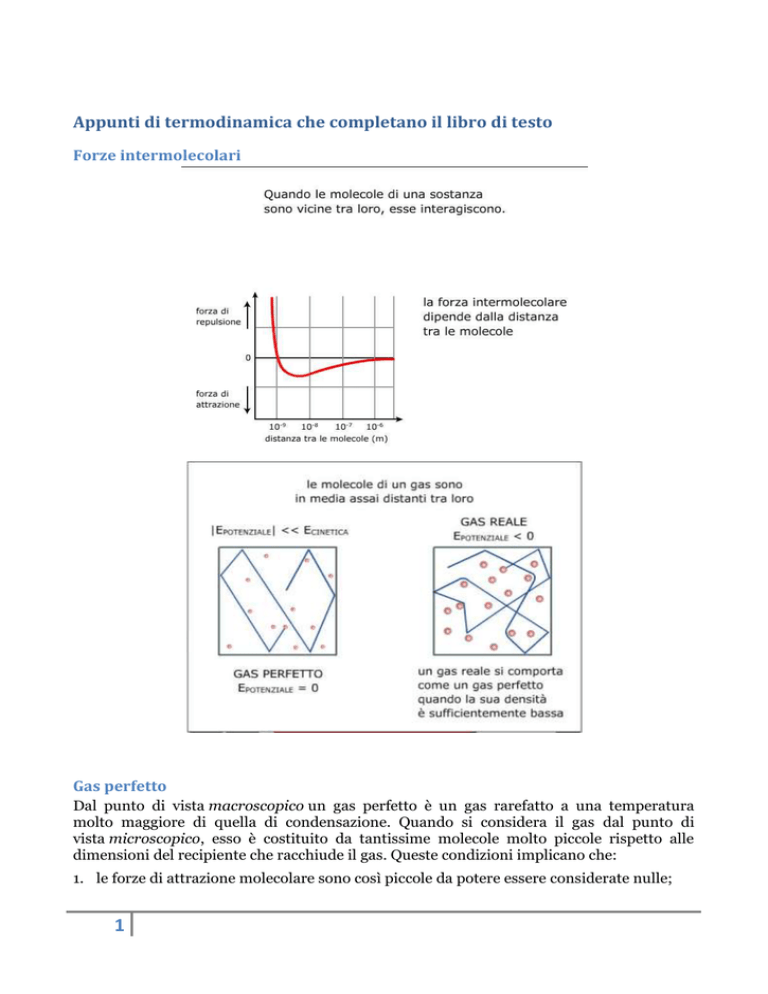
Forze intermolecolari
Gas perfetto
Dal punto di vista macroscopico un gas perfetto è un gas rarefatto a una temperatura
molto maggiore di quella di condensazione. Quando si considera il gas dal punto di
vista microscopico, esso è costituito da tantissime molecole molto piccole rispetto alle
dimensioni del recipiente che racchiude il gas. Queste condizioni implicano che:
1. le forze di attrazione molecolare sono così piccole da potere essere considerate nulle;
1
2. le molecole si muovono continuamente, in modo indipendente le une dalle altre, con un
movimento disordinato e molto veloce detto moto di agitazione termica;
3. esse interagiscono con l’esterno urtando in modo elastico le pareti del recipiente che le
contiene.
L'energia microscopica più importante è l’energia cinetica media Kmedia delle molecole.
Se esse hanno energie cinetiche di traslazione K1, K2, …, KN, l’energia cinetica media
traslazionale è:
Interpretazione microscopica della temperatura
Esiste un legame preciso tra la temperatura e l’energia cinetica media di una molecola
dovuta al moto di traslazione:
Questa formula dice che, all’aumentare della temperatura del gas, le molecole di cui esso è
composto si muovono sempre più velocemente, in quanto aumenta la loro energia cinetica
media. Ci dice cosa succede ad un gas quando lo riscaldiamo o lo raffreddiamo.
Dalla formula precedente, inoltre, possiamo affermare che la << temperatura assoluta>> è
una misura dell’energia cinetica media dei grani microscopici della materia (atomi o
molecole); più precisamente, temperatura assoluta ed energia cinetica media, sono
2
direttamente proporzionali. Dato che l’energia cinetica è una quantità positiva, la
temperatura di 0K è la minima temperatura concepibile e non è possibile raffreddare un
oggetto al di sotto di essa. Allo zero assoluto le molecole di un oggetto sono ferme e non
possono più essere rallentate ulteriormente. Di conseguenza, la temperatura dell’oggetto
non può scendere al di sotto di questa soglia.
Energia interna
L’energia interna di un sistema fisico è l’energia complessiva di tutte le sue componenti
microscopiche, dato che le molecole di un gas rarefatto non interagiscono tra loro
possiedono solo energia cinetica. Le molecole di un gas reale, invece, sono soggette a forze
di coesione molecolare e quindi possiedono anche energia potenziale.
A una certa temperatura T l’agitazione delle molecole di un gas reale è uguale a quella del
gas perfetto; questo ci permette di calcolare la sua energia cinetica totale.
Per calcolare l’energia potenziale del gas, invece:
immaginiamo di «congelare» tutte le molecole nella posizione in cui si trovano a un
certo istante,
poi disgreghiamo il sistema, portando lentamente tutte le molecole lontane l’una
dall’altra.
Per fare ciò dobbiamo compiere un lavoro positivo (forza disgregante e spostamento
sono paralleli e concordi), in modo da vincere le forze di attrazione tra le molecole.
Visto che il lavoro di una forza esterna che disgrega il sistema è positivo, il lavoro compiuto
dalle forze di attrazione molecolare, mentre il sistema si disgrega, è negativo (le forze e gli
spostamenti hanno versi opposti).
L’energia potenziale Epot di un gas reale è uguale al lavoro compiuto dalle forze di
attrazione molecolare quando si disgrega il sistema, portando tutte le molecole lontane
l’una dall’altra.
Siccome il lavoro delle forze intermolecolari è negativo, anche
l’energia potenziale del gas reale è negativa.
Possiamo ora definire l’energia interna del gas reale come:
3
L’energia interna U di un gas è data dalla somma dell’energia cinetica (positiva) e
dell’energia potenziale (negativa) di tutte le molecole.
Questa definizione dell’energia interna, che abbiamo introdotto per i gas, si estende anche
ai liquidi e ai solidi.
Gas, liquidi e solidi
L’energia interna di tutti i corpi è la somma di due contributi.
Il primo, di segno positivo, è dato dall’energia cinetica totale
dei «grani» che costituiscono il sistema. La tendenza
dell’energia cinetica è sempre quella di disgregare o
disordinare il sistema, allontanando tra loro i suoi
componenti.
Il secondo, di segno negativo, è dovuto all’energia potenziale
del sistema e misura l’efficacia delle forze di attrazione che
tendono a legare e ordinare il sistema.
Scambi di energia
Per rappresentare lo stato di un sistema basta un diagramma pressione-volume, dato
che la temperatura si può ricavare dall’equazione di stato
del gas perfetto.
Energia interna
L’energia interna U di un sistema è l’energia complessiva
delle sue costituenti microscopiche.
L’energia interna di un sistema fisico dipende soltanto dalle
condizioni in cui esso si trova e non dalla sua storia passata.
Per esempio, l’energia cinetica delle molecole di un gas
dipende soltanto dalla sua temperatura, mentre il valore
dell’energia potenziale globale delle molecole è determinato
unicamente dalle posizioni reciproche delle singole
molecole. Le molecole si muovono continuamente e urtano
le pareti del recipiente, ma le distanze medie tra di loro non
cambiano se pressione e volume restano invariati. Quindi
l’energia di agitazione termica e l’energia potenziale globale restano invariate nel tempo e a
ogni stato A, B, … di un sistema termodinamico corrisponde un ben definito valore
dell’energia interna.
4
Principio zero della termodinamica
Lo stato del sistema <<gas perfetto>> è descritto da tre grandezze: il volume V del
cilindro, la temperatura T del gas e la pressione p che il gas esercita contro le pareti. Queste
grandezze in un determinato stato devono essere le stesse in tutti i punti del sistema e cioè
il sistema si deve trovare in condizioni di equilibrio termodinamico:
Equilibrio meccanico: non devono essere presenti forze non equilibrate né
all’interno del sistema, né tra il sistema e l’ambiente esterno; in particolare, perché
il volume V non vari nel tempo la risultante delle forze che agiscono sul pistone deve
essere nulla.
Equilibrio termico: la temperatura deve essere uniforme in tutto il fluido.
Equilibrio chimico: la struttura interna e la composizione chimica del sistema
devono rimanere inalterate.
Per verificare l’equilibrio termico vale un criterio generale, indispensabile (dal punto di
vista logico) per confrontare le temperature di oggetti molto distanti tra loro nello spazio o
nel tempo. Questo criterio si chiama principio zero della termodinamica; il nome deriva
dal fatto che, nella costruzione teorica della termodinamica, questo criterio precede gli altri
tre princìpi e ne è fondamento. Storicamente, il principio zero è stato formalizzato per
ultimo e quindi, non potendo cambiare la numerazione già in uso dei princìpi della
termodinamica, per porlo prima degli altri gli è stato assegnato il numero zero.
Il principio zero della termodinamica afferma che, se il corpo A è in equilibrio
termico con un corpo C e anche un altro corpo B è in equilibrio termico con C,
allora A e B sono in equilibrio termico tra loro.
Per esempio, grazie a questo principio è possibile dare un significato fisico preciso alla
frase «mi sono misurato la febbre e ho la stessa temperatura di ieri»: non è possibile
mettere a contatto il tuo corpo di ieri con il tuo corpo di oggi, ma è possibile mettere in
equilibrio termico due volte (ieri e oggi) il tuo corpo con uno stesso oggetto (un
termometro correttamente calibrato).
Rif.: Amaldi – le traiettorie della fisica – Zanichelli
5