12/1/2016
CINETICA CHIMICA
A + B C + D
aspetto termodinamico quale situazione all’equilibrio?
aspetto cinetico con quale velocità si raggiunge l’equilibrio?
La cinetica è lo studio della velocità delle reazioni chimiche.
Misurando la velocità di reazione possiamo studiare il meccanismo della
reazione stessa, cioè individuare gli stadi da cui è costituita.
Fattori che influenzano la velocità di reazione:
1.
natura dei reagenti
2.
concentrazione dei reagenti
3.
temperatura
4.
catalizzatori
5.
radiazioni elettromagnetiche
1
CINETICA CHIMICA
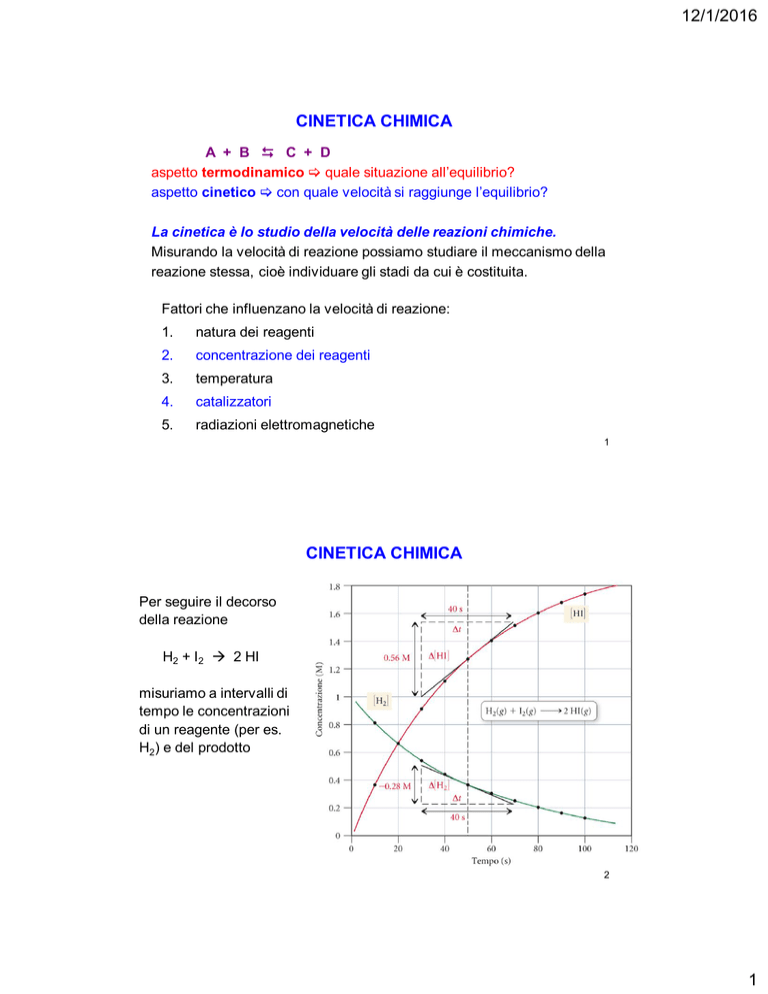
Per seguire il decorso
della reazione
H2 + I2 2 HI
misuriamo a intervalli di
tempo le concentrazioni
di un reagente (per es.
H2) e del prodotto
2
1
12/1/2016
CINETICA CHIMICA
Per la reazione: A + B C + D
definiamo la velocità di reazione:
v = - d[A] / dt = - d[B] / dt =
= d[C] / dt = d[D] / dt
Per una generica reazione: a A + b B c C + d D
definiamo la velocità di reazione:
v = - 1/a d[A] / dt = - 1/b d[B] / dt =
= 1/c d[C] / dt = 1/d d[D] / dt
CINETICA CHIMICA
H2 + I2 2 HI
Velocità di reazione:
v = - d[H2] / dt =
= - d[I2] / dt =
= ½ d[HI] / dt
La velocità istantanea di
reazione è la pendenza
della tangente alla curva
concentrazione-tempo.
4
2
12/1/2016
EFFETTO DELLA CONCENTRAZIONE
Nella reazione
aA+ b B cC + dD
la dipendenza della velocità di reazione dalla concentrazione dei
reagenti è espressa dall’equazione:
v = k [A]m [B]n
equazione cinetica
dove k = costante cinetica, caratteristica della reazione considerata
m = ordine di reazione rispetto ad A (in genere m ≠ a)
n = ordine di reazione rispetto a B (in genere n ≠ b)
m + n = ordine complessivo della reazione
(m e n possono essere positivi, negativi, interi, frazionari, o zero)
La legge cinetica (e quindi i valori di k, m, n) può essere determinata
solo sperimentalmente.
5
EQUAZIONI CINETICHE e COSTANTI di VELOCITA’
6
3
12/1/2016
TEORIA DEL COMPLESSO ATTIVATO
Questa teoria fornisce una relazione
tra aspetto cinetico e termodinamico
di una reazione chimica.
In base a questa teoria si segue il
mutamento energetico a cui vanno
incontro i reagenti nel corso della
reazione, fino alla trasformazione in
prodotti.
Il massimo della curva è detto stato
di transizione, e corrisponde alla
formazione del complesso attivato.
La differenza di energia tra reagenti
e complesso attivato è detta
energia di attivazione Ea.
7
TEORIA DEL COMPLESSO ATTIVATO
reazione endotermica
reazione esotermica
8
4
12/1/2016
CINETICA CHIMICA
L’urto tra due particelle può
portare alla formazione
del prodotto se:
1. l’orientazione dell’urto è
corretta
es: H-I + Cl H-Cl + I
9
CINETICA CHIMICA
L’urto tra due particelle può portare alla
formazione del prodotto se:
1. l’orientazione dell’urto è corretta
2. l’energia posseduta
complessivamente dalle due
molecole è sufficientemente elevata:
ogni reazione è caratterizzata da un
valore di energia di attivazione Ea,
che rappresenta la quantità minima di
energia che i reagenti devono
possedere per trasformarsi in prodotti.
Più alta è la temperatura, maggiore
è la frazione di molecole che hanno
energia almeno pari a Ea.
10
5
12/1/2016
CINETICA CHIMICA
Distribuzione dell’ energia cinetica
in funzione della temperatura
all’aumentare di T
aumenta la frazione
di molecole che
possiedono energia
maggiore di Ea
11
EFFETTO DELLA TEMPERATURA
La dipendenza della costante cinetica dalla temperatura è espressa
dall’equazione:
k = A exp(-Ea/RT)
equazione di Arrhenius
dove T è la temperatura assoluta
R è la costante universale dei gas
Ea è l’energia di attivazione
A è il fattore di frequenza e dipende:
(i) dalla frequenza delle collisioni
(ii) dalla frazione di collisioni con orientazione corretta
il fattore exp(-Ea/RT) corrisponde alla frazione di molecole
che possiedono un’energia sufficiente per reagire
(ed è sempre <1)
12
6
12/1/2016
MECCANISMI DI REAZIONE
Nota l’equazione cinetica, è possibile avanzare delle ipotesi sul
meccanismo di reazione.
In generale una reazione chimica avviene in più passaggi, detti stadi
elementari. Ciascuno stadio elementare ha un suo valore di Ea e una sua
costante cinetica.
L’insieme di tutti gli stadi elementari che portano dai reagenti ai prodotti è
il meccanismo di reazione.
La velocità della reazione è pari alla velocità dello stadio elementare più
lento, lo stadio cinetico determinante (RDS = Rate Determining Step).
Se una reazione decorre in due o più stadi parliamo di intermedi di
reazione, per es. nella reazione A + 2 B Prodotti
i due stadi elementari potrebbero essere:
A + B C
C + B Prodotti
---------------------------e complessivamente:
A + 2 B Prodotti
il composto C è l’intermedio di reazione
13
CATALISI
Un catalizzatore aumenta
la velocità di reazione
modificando il meccanismo
di reazione:
il meccanismo della
reazione catalizzata avrà
un’energia di attivazione
più bassa rispetto alla
reazione non catalizzata.
14
7
12/1/2016
CATALISI
15
CATALISI ETEROGENEA
La reazione
CH2=CH2 + H2 CH3CH3
ha luogo sulla superficie di un
catalizzatore metallico.
16
8
12/1/2016
CATALISI ENZIMATICA
Gli enzimi sono catalizzatori
biologici specifici per un certo
substrato (= molecola sul quale
l’enzima agisce).
Il substrato viene riconosciuto
perché si adatta perfettamente
al sito attivo dell’enzima
(modello chiave-serratura).
17
9