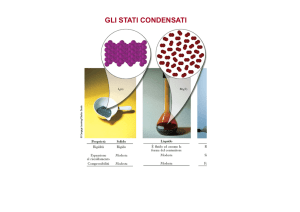
LO STATO LIQUIDO
STATO GASSOSO (ideale): modello di DISORDINE MASSIMO (forze intermolecolari trascurabili, elevate
Ec ⇒ elevato moto molecolare). È possibile una rigorosa trattazione matematica.
STATO SOLIDO (cristallo): modello di ORDINE MASSIMO (forze intermolecolari molto elevate ⇒ moto
molecolare LIMITATISSIMO). È possibile una rigorosa trattazione matematica.
STATO LIQUIDO: ibrido dei due (forze intermolecolari e moto molecolare ELEVATI). Non esiste
trattazione matematica rigorosa. Nel liquido si considera un ordine statistico che si crea e si distrugge
continuamente fra le particelle animate da moti termici (≡ Ec) distribuiti secondo Boltzman (simile a
quella dei gas). ⇒ STRUTTURA DINAMICA caratterizzata da un ORDINE A CORTO RAGGIO (in
contrapposizione ai solidi caratterizzati da un ordine a lungo raggio). Un minimo disordine a corto
raggio determina grande disordine a lungo raggio.
• Una molecola all’interno del liquido si trova in uno stato energetico più
basso rispetto ad una molecola in superficie.
• Ne consegue che il maggior numero possibile di molecole tende a disporsi
all’interno del liquido (la superficie tende a contrarsi).
• La tendenza dei liquidi a mantenere la minima area superficiale è evidenziata
dalla SFERICITÀ DELLE GOCCE (la sfera ha minor rapporto area
superficiale/volume) ⇒ MINORE ENERGIA
TENSIONE SUPERFICIALE
TENSIONE SUPERFICIALE: la forza che agisce sulle molecole presenti all’interfaccia liquido – gas
(es: acqua – aria). La tensione superficiale è di natura elettrostatica: mentre ogni molecola interna
ècompletamente circondata da liquido ed è attratta in ugual misura in tutte le direzioni dalle molecole
vicine, le molecole superficiali risentono solo dell’attrazione esercitata dalle molecole sottostanti; ne
consegue una forza di richiamo, che tende ad attirare le particelle superficiali verso l’interno. L’effetto
è quello di avere una sorta di pellicola superficiale.
EVAPORAZIONE & CONDENSZIONE
EVAPORAZIONE:
transizione liquido → vapore
CONDENSAZIONE:
transizione vapore → liquido
EVAPORAZIONE dal punto di vista MICROSCOPICO:
a)
Le molecole che si trovano sulla superficie del liquido (più
ricche di energia) se hanno Ecin tale da vincere le forze
intermolecolari che le tengono unite alle altre (≡ velocità di
fuga) passano allo stato di vapore.
b) Man mano che le molecole più ricche di energia lasciano il
pelo del liquido, l’Ecin media delle altre molecole diminuisce:
la temperatura del liquido diminuisce, a meno che non si
fornisca calore (Q) per mantenere la temperatura costante.
Numero di molecole
TENSIONE DI VAPORE (≡ Pressione di vapore saturo): è la più importante prorietà dei liquidi.
T = cost
⇒ l’EVAPORAZIONE è un processo ENDOTERMICO e DISORDINANTE
Ecinetica
La sensazione di freddo che si avverte quando si è bagnati è dovuta all’evaporazione dell’acqua (che
sottrae calore al nostro corpo). Per lo stesso motivo, per mantenere la temperatura corporea quando
siamo surriscaldati, ci raffreddiamo sudando: quando Test > Torganismo non è possibile smaltire il calore
per conduzione (il calore non fluisce da corpo freddo a corpo caldo); Il nostro organismo invia sudore
alla cute (in massima parte H2O) che evaporando (ΔHev > 0) sottrae calore al nostro corpo.
ΔHev rappresenta la variazione di entalpia, quindi la quantità di energia termica, sotto forma di calore Q,
necessaria per trasformare 1 mole di liquido in 1 mole di vapore alla pressione di 1 atm.
ΔHev = ΔH°vap - ΔH°liq
Es: H2O(l)
H2O(v)
ΔHev(25°C) = ΔH°(v) - ΔH°(l) = - 241,8 kJ/mol - (- 285,9) kJ/mol = + 44,1 kJ/mol
ΔHev è una misura dell’entità delle forze intermolecolari esistenti tra le molecole del liquido.
Un liquido evapora tanto più facilmente (velocità di fuga minore) quanto più deboli sono le forze
attrattive fra le molecole. Quindi tra due liquidi è più volatile quello che ha maggior tendenza ad
evaporare (minor attrazione tra le molecole ⇒ minor ΔHev.
ΔHev è tanto maggiore quanto maggiori sono le forze di attrazione intermolecolari che le molecole
devono vincere per lasciare il pelo del liquido. Es: etere dietilico, interazione dipolo-dipolo, ΔH°ev = 29.1
kJ/mol; acqua, legame idrogeno, ΔH°ev = 44.1 kJ/mol
La CONDENSAZIONE (processo inverso dell’evaporazione) è ESOTERMICA E ORDINANTE
Es. Pratico: il vapore d’acqua produce ustioni molto più gravi dell’acqua (a parità di temperatura).
H2O(l)
H2O(g)
ΔHcond = - 44.1 kJ/mol
ΔHcond
100°C
Calore ceduto da una mole di H2O(l) che passa da 100°C a 37°C:
Qraffreddamento = 4,184 (J/g•°C) x 18 (g) x 63 (°C) = 4,75 kJ
Calore ceduto da una mole di H2O(v) che passa da 100°C a 37°C:
Qtot = ΔHcond + Qraffreddamento = 44,1 kJ + 4,75 kJ = 48.8 kJ
37°C
(-Q) ceduto da H2O(l)
(-Q + ΔHcond) ceduto da H2O(l)
TENSIONE DI VAPORE ≡ P(vap)
(vap) ≡ Keq
È la pressione parziale del vapore sul liquido quando si è raggiunto l’equilibrio. Se il recipiente che
contiene il liquido è CHIUSO dopo un certo tempo si stabilisce un equilibrio dinamico per cui il n° di
molecole che evaporano = n° molecole che condensano ≡ vevaporazione = vcondensazione
La pressione parziale di vapore all’equilibrio viene detta TENSIONE DI VAPORE e questo stato di
equilibrio si mantiene fino a che la temperatura resta costante.
VISIONE MICROSCOPICA dell’equilibrio: Liq.
vapore
vapore
Evap.
Liquido (a)
vapore
Cond.
Liquido (b)
Liquido (c)
Vap.
(a) Stato di non equilibrio. Inizialmente le molecole con
Ecin maggiore evaporano e stabiliscono una pressione al
di spra del liquido
(b) Dopo un certo tempo, si stabilisce un equilibrio dinamico tra il n° di molecole che lasciano e il n° di molecole che
ritornano nel liquido. A T costante, la pressione gassosa corrispondente all’
all’equilibrio liquido ↔ vapore viene detta
TENSIONE DI VAPORE del liquido considerato.
.
considerato
VISIONE MACROSCOPICA (termodinamica) dell’equilibrio: Liq.
vapore
vapore
vapore
Evap.
Cond.
Liquido (a)
Liquido (b)
Liquido (c)
ΔG < 0
ΔG = 0
ΔG > 0
Vap.
ΔG = RT ln Q/K = RT ln Q/PV
Q = Pressione di vapore istantanea
PV = Keq = Tensione di vapore
Se il recipiente contenente il liquido è aperto non si raggiunge mai l’equilibrio (Q < Keq), quindi il liquido
evapora tutto. Se il liquido è H2O l’evaporazione avviene solo se la pressione parziale di H2O(v) (Q)
nell’atmosfera è minore della tensione di vapore (K = PV) dell’acqua a quella temperatura.
Evaporazione: ⇒ Q < PV ⇒ umidità % (u) < 100% ⇒ (u = (Q/PV) • 100 a T costante)
a) u 100% se Q = PV a 25°C: Q = 23,756 torr = 0.0313 atm. NO EVAPORAZIONE (Equilibrio, ΔG = 0).
b) u 50% se Q = ½ PV a 25°C: Q = 0.0156 atm. Q < PV. EVAPORAZIONE (ΔG < 0).
c) u > 100% se Q > PV a 25°C: CONDENSAZIONE (ΔG > 0) - forte stato di malessere
TENSIONE DI VAPORE E TEMPERATURA
I parametri che regolano l’equilibrio (P e T) sono intensivi, quindi
la TENSIONE DI VAPORE:
- non dipende dalla quantità di liquido, purchè presente;
- non dipende dalla grandezza del recipiente in cui è contenuto.
T1
Numero di molecole
Ad ogni valore di T corrisponde un valore di K(T) ≡ TENSIONE DI
VAPORE. All’aumentare di T aumenta il n° di molecole che hanno
energia cinetica sufficiente (⇒ velocità di fuga) per lasciare il pelo
del liquido vincendo le forze intermolecolari. Quindi aumentando T
aumenta la TENSIONE DI VAPORE ⇒ Keq = PV.
T2 > T1
Energia cinetica
E cinetica
minima per
lasciare il
liquido
Velocità
di fuga
Le curve che correlano la tensione di vapore con la temperatura si ricavano sperimentalmente: si pone
la sostanza liquida in un recipiente chiuso in cui è stato fatto il vuoto e si misura la tensione di vapore
che si stabilisce (a equilibrio raggiunto) alle varie temperature.
TENSIONE DI VAPORE: EQUAZIONE DI CLAUSIUS - CLAPEYRON
> ΔHev ⇒ < forze intermolecolari da vincere per
portare il liquido allo stato di vapore. < Pv (a parità
di T) del liquido, ⇒ < pendenza della curva.
Le curve curva rappresentano le condizioni di
pressione e temperatura in cui liquido puro e suo
vapore sono in equilibrio.
Aumentando la temperatura la pressione di vapore
(Pv) aumenta ⇒ quando la Pv eguaglia il valore
della pressione che insiste sul liquido (Pv = Pest) il
liquido bolle.
Quando Pest = 1 atm, la T tale per cui PV = Pest è chimata TEMPERATURA NORMALE DI EBOLLIZIONE
EQUAZIONE DI CLAUSIUS-CLAPEYRON
Si può ricavare PV a qualsiasi temperatura
Vap.
lnPV
Liq.
Per H2O: PV = 1 atm
T = 373 K
ln
0
2,7x10-3 K-1
All’equilibrio; L
V ⇒ ΔG° = -RTlnKeq = -RTlnPV
ma ΔG° = ΔH° - TΔS° = - RTlnPV ⇒
ΔH°ev
ΔS°ev
+
equazione di una retta: y = lnK; x = 1/T
lnPV = RT
R
Poichè ΔH°ev > 0 (sempre) PV aumenta all’aumetare di T.
Integrando T1
P1; T2
P2 e separando le variabili si ha:
1/T
P2
P1
=
ΔH°ev
R
1 - 1
T1
T2
Noti ΔH°ev e Teb (T1) per P1 = 1 atm si può calcolare PV (P2) a
qualsiasi T (T2), senza ricorrere a dati sperimentali.
DIAGRAMMI DI STATO
Lo stato fisico di una sostanza non dipende solo dalle forze attrattive intermolecolari, ma anche dalla
temperatura e dalla pressione a cui si trova.
Riportando su di uno stesso grafico P = f(T) per i passaggi di stato S ↔ V, L ↔ V, S ↔ L si ottiene il
DIAGRAMMA DI STATO di quella sostanza: rappresentazione grafica in due dimensioni della relazione
tra P e T relativa agli equilibri tra le diverse fasi di sostanza.
DIAGRAMMA DI STATO DI H2O
DIAGRAMMA DI STATO DI CO2
Pendenza linea S ↔ L = dP/dT = ΔH / (T • ΔV) < 0 Pendenza linea S ↔ L = dP/dT = ΔH / (T • ΔV) > 0 la
la fusione del ghiaccio porta ad una diminuzione fusione di CO2 (s) porta ad una aumento di volume:
di volume: un aumento di Pest fa diminuire Tfus.
un aumento di Pest fa aumentare Tfus.
Diagramma di stato CO2: a) CO2 solido (ghiaccio secco) sublima a Pamb perchè P (punto triplo) è > Pamb;
b) nelle bombole in commercio CO2 esiste allo stato liquido perchè è a P piuttosto elevate (T = 25°C P
> 60 atm); c) se Test è > di 31.1°C all’interno delle bombole CO2 esiste allo stato critico.
Ghiaccio secco presenta molti vantaggi rispetto H2O(s): a) capacità di raffreddamento > del ghiaccio; b)
non bagna (a Pamb sublima); c) raggiunge T molto più basse.
DIAGRAMMI DI STATO
S
Nelle porzioni di piano S, L e G la pressione e
la temperatura possono entrambe essere
variate entro certi limiti senza che l’equilibrio
venga turbato (non c’è variazione di fase. Il
sistema ha due gradi di libertà (P e T) e si ha un
equilibrio BIVARIANTE.
L
G
Le tre CURVE definiscono i valori di P e T in cui DUE FASI sono in EQUILIBRIO: ad ogni valore di T corrisponde una
specifica Pequilibrio (Pv). Il SISTEMA è MONOVARIANTE (un solo grado di libertà) si può scegliere un solo parametro senza
alterare l’equilibrio: scelto T, P è univocamente definito e viceversa.
Le tre curve di equilibrio si incontrano nel PUNTO TRIPLO, che individua una coppia di valori in corrispondenza dei quali
si hanno in EQUILIBRIO TRE FASI. Non si può variare nè T nè P senza che l’equilibrio venga turbato: SISTEMA
ZEROVARIANTE.
REGOLA DELLE FASI
v=c–f+2
v = varianza = gradi di libertà; c = n° componenti; f = n° fasi
BIVARIANTE:
MONOVARIANTE:
ZEROVARIANTE:
v = 1 – 1 + 2 = 2 parametri che si possono variare senza alterare l’equilibrio.
v = 1 – 2 + 2 = 1 parametri che si possono variare senza alterare l’equilibrio.
v = 1 – 3 + 2 = 0 parametri che si possono variare senza alterare l’equilibrio.
ISOBARA (P = 1 atm) DI RISCALDAMENTO PER I PASSAGGI DI STATO
Tratto AB: c’è solo solido. Il calore fornito va ad aumentare Ecinetica delle molecole ⇒ T aumenta.
Tratto BC: nel punto B il solido inizia a fondere. Il calore fornito è tale da vincere Ereticolare del solido. Nel tratto BC si ha
l’equilibrio S ↔ L con ΔG° = 0. Ecinetica non varia fino a che tutto il solido è fuso. Epotenziale aumenta (l’energia fornita
sotto forma di calore è usata per rompere le interazioni reticolari del solido).
Tratto CD: c’è solo liquido. Il calore fornito fa aumentare Ecinetica delle molecole ⇒ T aumenta.
Tratto DE: nel punto D il liquido inizia a bollire. Nel tratto DE si ha l’equilibrio L ↔ V con ΔG° = 0. Ecinetica non varia fino
a che tutto il liquido è evaporato. Epotenziale aumenta (l’energia fornita sotto forma di calore è usata per vincere le
interazioni intermolecolari del liquido.
Tratto successivo a E: c’è solo vapore. Il calore fornito va ad aumentare Ecinetica delle molecole ⇒ T aumenta.
D
E
B
A
C
Riscaldamento di un solido (Es: ghiaccio) in
un recipiente chiuso, munito di pistone
mobile, in modo che la P resti costante.
PUNTO DI FUSIONE
SOLIDO → LIQUIDO ⇒
FUSIONE (ΔH°fus = - ΔH°solid)
LIQUIDO → SOLIDO ⇒
SOLIDIFICAZIONE
Alla temperatura alla quale le velocità di fusione e solidificazione si eguagliano si ha EQUILIBRIO
DINAMICO SOLIDO – LIQUIDO
ΔH°fus ⇒ calore richiesto per trasformare una mole di solido in una mole di liquido alla pressione
standard (1 atm).
L’equilibrio in condizioni standard si ha quando ΔG° = 0 = ΔH° - TΔS° da cui
Tfus = PUNTO NORMALE DI FUSIONE (Pest 1 atm) = ΔH°fus/ΔS°fus
Tsolid = PUNTO NORMALE DI SOLIDIFICAZIONE (Pest 1 atm) = (-ΔH°fus) / (-ΔS°fus)
Ma come varia la Tfus se si varia la pressione che grava sul solido? Qualitativamente lo dice Le
Chatelier e quantitativamente l’equazione di Clapeyron generalizzata per tutti i passaggi di stato:
dP/dT = ΔH / (T • ΔV) pendenza tangente alla curva ΔH del passaggio di stato; ΔV = Vf – Vi
ΔH°evap > 0;ΔV = Vvap - Vliq > 0 ⇒ pendenza positiva: PV (liquido) aumenta all’aumentare di T
ΔH°subl > 0; ΔV = Vvap - Vsol > 0 ⇒ pendenza positiva: PV (solido) aumenta all’aumentare di T
ΔH°fus > 0; ΔV = Vliq - Vsol ⇒ due possibilità: pendenza > 0 o < 0:
per H2O(s)
H2O(l)
ΔV < 0
pendenza negativa (caso particolare): > Pest e < Tfus
Le Chatelier:
H2O(s)
H2O(l)
ΔV < 0
Se perturbiamo l’equilibrio aumentando Pest (> 1 atm) il sistema si sposta nella
direzione in cui c’è diminuzione di volume, verso destra: il ghiaccio fonde (per
riavere ghiaccio a quella P occorre diminuire T.
Quindi aumentando Pest H2O(s) fonde a T > 0,00°C
Il comportamento dell’acqua è molto insolito: per la maggior parte delle
sostanze ΔV > 0, quindi pendenza positiva un aumento di Pest fa aumentare Tfus
EBOLLIZIONE (IN UN RECIPIENTE APERTO)
a) Alla Teb si ha formazione di vapore non solo sulla superficie del liquido ma anche all’INTERNO della
massa liquida: passaggio tumultuoso allo stato vapore in molti punti della massa liquida.
b) Quando Pvap all’interno della bolla di vapore eguaglia la Pestla bolla sale in superficie e scoppia
c) Se Pvap all’interno della bolla è minore della Pest, la bolla collassa prima di salire in superficie).
La temperatura di ebollizione di un liquido dipende dalla pressione esterna
Ora sappiamo perchè:
1)
In montagna l’acqua bolle a temperatura inferiore a 100°C, dato che la Pest < 1,00 atm. L’acqua
deve essere scaldata meno perchè la sua Pvap diventi uguale alla Pest: gli alimenti richiedono
tempi di cottura più lunghi.
2)
Nella pentola a pressione l’acqua bolle al di sopra dei 100°C. La pentola è chiusa ermeticamente e
ciò permette alla pressione che grava sull’acqua di raggiungere valori maggiori di 1 atm.
ATTENZIONE!!! La pentola a pressione è si chiusa ermeticamente, ma ha una valvola di sfiato che
entra in funzione quando la pressione di vapore raggiunge un determinato valore (es.: 1.70 atm a
cui corrisponde Teb = 115°C) per il quale la pentola è tarata a resistere. Se lo sfiato fosse intasato
e si continuasse a fornire energia sotto forma di calore, allora T aumenta, Pvap aumenta e la
pentola esplode.
FLUIDO SUPERCRITICO: liquido e gas diventano indistinguibili
STATO CRITICO: Si raggiunge in un recipiente ermeticamente chiuso (saldato, V = costante: es
pentola a pressione con valvola intasata). Se un liquido viene riscaldato in un recipiente
ermeticamente chiuso NON BOLLE MAI ma raggiunge lo STATO CRITICO
H2O
Infatti, riscaldando aumenta la T del liquido, quindi la tensione
di vapore del liquido e la densità del vapore (n° moli/cm3), ma
la densità del liquido diminuisce (il liquido si espande, come
Hg in un termometro).
Alla temperatura (Tcritica) per la quale dvap = dliq (Pcritica) esiste
una sola fase detta FLUIDO SUPERCRITICO
N.B.: a) la curva Pv = f(T) inizia alla Tfusione minima e termina alla Tc; b)
Pc è la massima Pv di un liquido; c) una sostanza che si trovi al di sopra
di Tc e Pc è un fluido supercritico.
C
GAS
H2O
B
SF6: 46°C, 37 atm.
A
Una sostanza che si trova oltre Tc è detta GAS: un GAS (A) NON PUÒ
ESSERE LIQUEFATTO per semplice compressione (non incontra la
curva liquido ↔ vapore). Un gas per essere liquefatto deve essere
prima raffreddato al di sotto della Tc (B) e quindi compresso (C)
Una sostanza che si trova al di sotto di Tc è detta VAPORE (B): PUÒ
ESSERE LIQUEFATTO per semplice compressione.
Se si prende come riferimento Tambiente = 25°C: si definisce GAS una sostanza la cui Tcritica < 25°C
H2, O2, N2 ⇒ non si possono liquefare a 25°C per sola compressione); si definisce VAPORE una
sostanza la cui Tcritica > 25°C (butano, benzene, NH3 ⇒ si possono liquefare a 25°C per sola
compressione) ⇒
(Es:
Il passaggio di stato VAPORE ↔ LIQUIDO ⇒ CONDENSAZIONE (il butano condensa)
Il passaggio di stato GAS ↔ LIQUIDO
⇒ LIQUEFAZIONE
(l’O2 liquefa)
N.B.: come la Tebollizione così anche la Tcritica è controllata dalle forze di attrazione intermolecolari
H2O, NH3 ⇒ liquidi con forti attrazioni intermolecolari: avranno Tc elevate > Tambiente (25°C)
H2, O2, N2 ⇒ liquidi con deboli attrazioni intermolecolari: avranno Tc basse < Tambiente (25°C)
SUBLIMAZIONE: da solido a vapore
Dipende dalla TENSIONE DI VAPORE DI UN SOLIDO
Il passaggio di stato SOLIDO → VAPORE ⇒ SUBLIMAZIONE
Il passaggio di stato VAPORE → SOLIDO ⇒ BRINAMENTO
I solidi hanno una tensione di vapore << dei liquidi. Poche molecole hanno Ecin sufficiente per
abbandonare il solido vincendo Ereticolare spesso assai elevata. Fanno eccezione SOLIDI MOLECOLARI
costituiti da MOLECOLE APOLARI (Es: CO2, I2, naftalina): dalle DEBOLI INTERAZIONI fra molecole
(dipolo indotto – dipolo indotto) ⇒ un’apprezzabile tensione di vapore a Tamb: SUBLIMAZIONE.
SUBLIMAZIONE
SUBLIMAZIONE
Quando sublimazione e brinamento avvengono alla stessa velocità si ha EQUILIBRIO DINAMICO
SOLIDO – VAPORE. Keq = Pv = TENSIONE DI VAPORE DEL SOLIDO.
ΔH°Sub = Entalpia molare standard di SUBLIMAZIONE = calore richiesto a Pcost (1 atm) per trasformare
una mole di solido in una mole di vapore.
ΔH°Sub = ΔH°fus + ΔH°evap
Infatti applicando la legge di Hess:
H2O(l)
ΔH°fus = 6.01 kJ/mol
H2O(s)
sublimazione
brinamento
evaporazione
H2O(l)
H2O(v)
ΔH°evap = 44.1 kJ/mol
condensazione
H2O(s)
H2O(v)
ΔH°Sub = 50.11 kJ/mol
Le curve di sublimazione (Tensione di vapore(solido) = f(T)) si
ricavano sperimentalmente (come le curve di evaporazione): si
pone la sostanza in un recipiente chiuso dove è stato fatto
precedentemente il vuoto e mediante un manometro si misura
la Pv (solido) alle varie T, sino a quando il solido fonde.
N.B.: nelle notti fredde e umide si forma BRINA (H2O(v)
Pv < 4,58 torr (freddo e molto secco), la neve SUBLIMA (H2O(s)
H2O(s)); b) in montagna T < 0°C e
H2O(v))
Come si vede a T = 0.0075°C H2O(s) e H2O(l) hanno la stessa tensione di vapore = 4,58 torr = 6.0x10-3 atm.
A questi valori di P e T sono in equilibrio TRE FASI: PUNTO TRIPLO DELL’ACQUA in cui
H2O(s)
H2O(l)
H2O(v)
N.B.: se su di un blocco di ghiaccio grava una pressione di 6.0x10-3 atm il ghiaccio fonde a T=
+0.0075°C. Perchè allora diciamo che il ghiaccio fonde a 0°C? La Tfus del ghiaccio (e di un solido in
generale) dipende dalla PRESSIONE che su di esso grava. Si definisce PUNTO DI FUSIONE NORMALE
di un solido la T a cui solido e liquido sono in equilibrio alla pressione standard di 1 atm. Ad 1 atm il
ghiaccio fonde a 0,000°C.