a cura del
Centro Regionale di Formazione
per l’Area delle Cure Primarie
Anno XIII / N. 2 - Aprile-Giugno 2009
La prevenzione delle complicanze trombotiche
associate all’uso di estro-progestinici
in età riproduttiva
a cura del Comitato Esecutivo del Ceformed
Consenso europeo sulla diagnosi e la terapia
della rettocolite ulcerosa e del Morbo di Crohn
European Crohn’s and Colitis Organisation (ECCO) 2006-2008
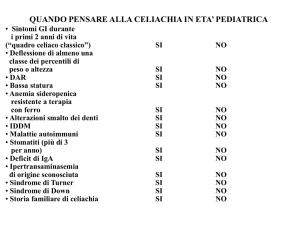
La celiachia vista dal medico
A cura di Roberto Della Vedova - MMG - ASS n. 2 “Isontina”
Percorso diagnostico-assistenziale
per i soggetti affetti da malattia celiaca
Stefano Martelossi - Marco De Carli - Dario Sorrentino - Nicoletta Orzes
Collaboratori di studio: una proposta formativa
omogenea nel FVG grazie a FONDO PROFESSIONI.
Perché è utile l’iscrizione del collaboratore
di studio a Fondo Professioni
A cura di Adriana Fasiolo - MMG - Ceformed
a cura del
Centro Regionale di Formazione
per l’Area delle Cure Primarie
Anno XIII / N. 2 - Aprile-Giugno 2009
Direttore Responsabile Doriano Battigelli
Coordinatore Redazionale Marina Tutta
Gruppo Redazionale L. Canciani, G. Latella, G. Lucchini,
F. Samani, G. Simon, R. Vallini, D. Venier
Stampa e grafica Stella Arti Grafiche - Trieste
Stampato su carta riciclata
Iscrizione al Tribunale di Trieste n. 976 del 13.01.1998
Via Galvani n. 1 - 34074 Monfalcone - tel. e fax 0481 487578
E-mail: [email protected]
http://www.ceformed.it
Convegno: Cuore, droghe e psicofarmaci
Palmanova (UD)
XIII Congresso del Centro Regionale
di Formazione per l’Area delle Cure Primarie
LA SALUTE NEL RESPIRO
Grado (GO)
La prevenzione
delle complicanze trombotiche
associate all’uso di estro-progestinici
in età riproduttiva
3
a cura del Comitato Esecutivo del Ceformed
Consenso europeo
sulla diagnosi e la terapia
della rettocolite ulcerosa
e del Morbo di Crohn
22
European Crohn’s and Colitis Organisation (ECCO) 2006-2008
La celiachia vista dal medico
37
A cura di Roberto Della Vedova - MMG - ASS n. 2 “Isontina”
Percorso
diagnostico-assistenziale
per i soggetti
affetti da malattia celiaca
41
Stefano Martelossi - Marco De Carli - Dario Sorrentino - Nicoletta Orzes
Collaboratori di studio:
una proposta formativa omogenea nel FVG
grazie a FONDO PROFESSIONI.
Perché è utile l’iscrizione
del collaboratore di studio
a Fondo Professioni
56
A cura di Adriana Fasiolo - MMG - Ceformed
Convegno:
Cuore, droghe e psicofarmaci
59
Palmanova (UD)
XIII Congresso
del Centro Regionale di Formazione
per l’Area delle Cure Primarie
LA SALUTE NEL RESPIRO
Grado (GO)
2
61
A cura del Comitato Esecutivo del CEFORMED
CENTRO NAZIONALE DI EPIDEMIOLOGIA,
SORVEGLIANZA E PROMOZIONE DELLA SALUTE
VIALE REGINA ELENA, 299 - 00161 ROMA
TEL. 0649904160- FAX 0649904170
prevenzione tev
Abbiamo voluto pubblicare questa fondamentale Conferenza di Consenso poiché riteniamo che ci siano in materia ancora
grande incertezza, disuguaglianza e inappropriatezza nei comportamenti professionali, che non raramente sfociano in situazioni
di tensione o d’increscioso dissidio tra Medici di Medicina Generale, Ginecologi, Esperti in malattie trombotiche, e che inevitabilmente si rivereberano negativamente nella relazione di alleanza terapeutica medico-paziente.
La Conferenza fornisce raccomandazioni chiare e ben documentate, che convalidano in buona parte il “sentire comune” e l’esperienza di molti Medici di Medicina Generale”: auspichiamo vengano finalmente recepite da tutti i Medici coinvolti nella prescrizione della pillola, nel rispetto del mandato del Codice Deontologico. Ci auguriamo inoltre che questa Conferenza rappresenti la
base per pervenire ad un futuro documento di “Consensus” regionale sulla prevenzione, il controllo di laboratorio e terapia delle
malattie tromboemboliche, condiviso tra i rappresentanti delle Società Scientifiche delle figure professionali coinvolte, come è già
avvenuto per l’ipertensione arteriosa, la fibrillazione atriale, la BPCO e lo scompenso cardiaco.
LA PREVENZIONE DELLE COMPLICANZE TROMBOTICHE ASSOCIATE
ALL’USO DI ESTRO-PROGESTINICI IN ETÀ RIPRODUTTIVA
Documento finale di Consenso
Istituto Superiore di Sanità
19 febbraio 2009
1.1 - La contraccezione con estro-progestinici (estro-progestinici), utilizzata su scala mondiale da milioni di donne da
oltre 40 anni, è efficace e ben tollerata, con bassa frequenza di complicanze.
La “pillola” rappresenta probabilmente la forma universalmente più nota di contraccezione ormonale ed è divenuta il
simbolo sia dei programmi di pianificazione familiare in generale, sia – più specificamente – di contraccezione ormonale.
I programmi di pianificazione familiare, largamente basati sull’utilizzo della pillola anticoncezionale, vengono considerati tra gli interventi di salute pubblica più importanti del ventesimo secolo, tanto che la contraccezione e la pianificazione
familiare sono diventate parte integrante della salute della donna. L’utilizzo di contraccettivi per la prevenzione di gravidanze indesiderate si è ripetutamente dimostrato come un intervento dotato di grande costo-efficacia relativamente alla allocazione di risorse sanitarie.
Negli ultimi 30 anni vi sono stati significativi progressi nello sviluppo di nuove tecnologie contraccettive efficaci, ottimamente tollerate e con sempre meno rischi per la donna, tra cui una transizione dai contraccettivi orali ad alto dosaggio verso
quelli a minor dosaggio ormonale, e dai dispositivi intrauterini inerti a quelli con rilascio di levonorgestrel. (WHO 2004).
Il contenuto di estrogeni dei metodi di contraccezione ormonale combinata si è gradualmente ridotto, e attualmente
viene considerato come standard un contenuto di etinilestradiolo pari o inferiore a 35 microgrammi, mentre i contraccettivi
ormonali contenenti dosi maggiori di estrogeni vengono prescritti solamente in circostanze particolari (per esempio in
donne sottoposte a terapie con farmaci anti-epilettici).
I contraccettivi orali estro-progestinici sono stati oggetto di valutazioni a lungo termine e sono probabilmente tra i farmaci maggiormente studiati. La loro tollerabilità e sicurezza sono ampiamente provate, specie in relazione ai rischi connessi
con una gravidanza indesiderata. Si può affermare che la contraccezione ormonale combinata può essere utilizzata ininterrottamente senza rischi in donne sane non fumatrici, per tutta l’età riproduttiva fino alla menopausa.
I benefici dell’utilizzo di estro-progestinici a scopo contraccettivo riguardano non solo le gravidanze indesiderate evitate, ma la salute della donna in generale. Tra i vantaggi non contraccettivi degli estro-progestinici vanno annoverate la riduzione dei sintomi associati al ciclo mestruale, della durata del sanguinamento e delle perdite ematiche.
In Italia, tra il 1982 e il 2007, parallelamente all’incremento nell’utilizzo di estro-progestinici (dal 5,2% al 16,1%
delle donne in età fertile) si è avuto un decremento delle interruzioni volontarie di gravidanza del 45,9% ( Ministero
della Salute 2008).
3
prevenzione tev
L’utilizzo di estro-progestinici a scopo contraccettivo si associa anche a benefici in termini di riduzione del rischio di
patologie della sfera riproduttiva. È stato osservato che l’assunzione di estro-progestinici si associa a una riduzione del
rischio di sviluppare neoplasie maligne nella misura di 45 ogni 100.000 donne/anno, beneficio che si nota soprattutto nelle
donne tra i 50 e i 59 anni di età. Considerando tipologie specifiche di tumore, numerosi studi hanno mostrato che l’uso della
pillola si associa a una marcata riduzione della frequenza di carcinoma ovarico e dell’endometrio, rispettivamente del 40% e
del 50% e a una riduzione del 50%-80% del rischio relativo di cisti ovariche.
I principali rischi associati all’uso cronico di contraccettivi orali consistono in un aumento della frequenza di tumore al
seno (3 casi in più ogni mille donne che fanno uso di contraccettivi orali per 8 anni), al collo dell’utero (2 casi per mille in più)
e al fegato (0,7 casi per mille in più).
Va inoltre sottolineato che, in relazione al lungo periodo di assunzione di contraccettivi di queste casistiche, le frequenze osservate sono molto basse. Uno studio condotto su 17.000 donne seguite per circa 480.000 anni/donna ha inoltre
osservato che la mortalità totale per le donne che assumono contraccettivi è inferiore rispetto alle donne che non li assumono (rate ratio 0,89; IC 95% 0,77-1,02), mentre in chi fuma più di 15 sigarette al giorno la mortalità raddoppia rispetto alle
non fumatrici (rate ratio 2,14; IC 95% 1,81-2,53).
I dati disponibili mostrano che il rischio di malattie neoplastiche associato all’uso di contraccettivi orali è molto basso, e
comunque non condiziona la sopravvivenza delle donne che ne fanno uso rispetto a quelle che non li assumono.
1.2 - Tra le rare complicanze associate alla contraccezione con estro-progestinici, la più rilevante è la trombosi venosa
(TV). Nelle donne in età fertile si tratta di un evento molto raro. Pur non essendo disponibili dati certi per l’Italia, l’incidenza di trombosi venose è stimabile complessivamente attorno a 4-7 casi l’anno ogni 10.000 donne, 1-2 dei quali
sono attribuibili alla pillola estro-progestinica.
Dati da casistiche europee mostrano una incidenza annuale complessiva di TV in donne in età fertile variabile da 3,6
casi/10.000 in una fascia di età compresa tra 15 e 44 anni. a 7 casi/10.000 in una fascia di età compresa tra 20 e 49 anni.
In altre parole, ogni anno si verificano tra 4 e 7 casi di eventi trombotici venosi ogni 10.000 donne in età fertile.
Il rischio di tromboembolie venose in donne che non assumono estro-progestinici è basso e aumenta con l’età.
Casistiche europee mostrano che l’incidenza di eventi tromboembolici venosi idiopatici varia da 0,5 casi ogni 10.000
donne/anno all’età di 20 anni, fino a 5 casi ogni 10.000 donne/anno all’età di 50 anni. Il rischio di trombosi venosa in gravidanza è intorno a 6 casi ogni 10.000 gravidanze.
I dati di incidenza di trombosi venosa nelle donne italiane provengono essenzialmente da uno studio (Tosetto 2003) i cui
risultati suggeriscono una incidenza annuale complessiva di circa 4 casi
ogni 10.000 donne nella fascia di età compresa tra 18 e 39 anni, dei quali
1-2 possono essere considerati “idiopatici” (cioè non attribuibili a cause
specifiche quali interventi chirurgici o traumi) e 1-2 possono essere attribuibiti all’uso di estro-progestinici. Questo studio italiano è stato effettuato in un’area geografica ristretta (una provincia della regione Veneto),
e la trasferibilità dei risultati al contesto nazionale è limitata.
Il rischio di sviluppare trombosi venose in corso di terapia con estroprogestinici è condizionato sia dalla componente estrogenica (quantità)
che da quella progestinica (tipo di molecola).
Il contenuto di estrogeni del preparato estro-progestinico assunto è
direttamente proporzionale al rischio di trombosi venosa, con odds ratio
(OR) che variano da 1,0 per estro-progestinici che contengono fino a 40
microgrammi, a 1,6 per estro-progestinici con contenuto di estrogeni
pari a 50 microgrammi.
I progestinici cosiddetti di “terza generazione” (a base di desogestrel e gestodene) si associano a un rischio di trombosi venosa circa
doppio rispetto ai progestinici di “seconda generazione” (a base di
norgestrel e levonorgestrel).
1.3 - La contraccezione estro-progestinica produce anche un aumento molto piccolo del rischio di trombosi arteriosa,
stimabile tra 0,06 e 0,4 casi/anno ogni 10.000 donne rispetto a un rischio di base di circa 2 casi ogni 10.000 donne in
età fertile.
In donne sane e non fumatrici il rischio di infarto miocardico non sembra aumentare durante l’utilizzo di estro-progestinici, mentre in donne fumatrici di età superiore a 35 anni, il rischio aumenta, controindicando l’uso di estro-progestinici in
questa popolazione.
Dati estrapolati dal progetto CUORE fanno stimare in un totale di 2.803 i casi annui attesi complessivamente in Italia di
eventi cardiovascolari arteriosi nella fascia di popolazione femminile di età compresa tra 15 e 49 anni.
L’incremento assoluto di rischio di trombosi arteriosa attribuibile alla assunzione di estro-progestinici è estremamente
4
basso: da 0,06 a 0,4 casi per 10.000 pazienti-anno e si concentra essenzialmente tra le donne portatrici di altri fattori di
rischio associati (soprattutto fumo e ipertensione arteriosa).
Nel resto del presente documento, visto il bassissimo rischio arterioso, ci si concentrerà solo sul rischio di trombosi
venosa.
FATTORI INDIVIDUALI
FATTORI INTERCORRENTI
Età
Precedenti episodi trombotici
Familiarità
Obesità (BMI > 30)
Trombofilia ( = aumento della tendenza alla trombosi
causata da ipercoagulabilità del sangue di origine
congenita o acquisita).
Intervento chirurgico
Immobilità prolungata
Traumi
Puerperio
prevenzione tev
2.1 - I principali fattori che aumentano il rischio di trombosi venosa, nelle donne che assumono contraccettivi estroprogestinici, sono:
La stima dell’incremento del rischio di tromboembolismo venoso (TEV) associato alla presenza di fattori di rischio transitori (per esempio: chirurgia, traumi, puerperio, ecc.) in donne utilizzatrici di estro-progestinici è difficilmente quantificabile,
non essendo accuratamente definita nei vari studi la presenza di tali condizioni.
Uno studio caso-controllo “ nested” su quasi 1.000 donne ha osservato un’associazione indipendente tra diverse condizioni (chirurgia, fratture degli arti inferiori, traumi, tumori) considerate globalmente e il rischio di tromboembolismo venoso
in donne utilizzatrici di estro-progestinici (OR 17, 95%CI 6,5-46).
2.2 - Il rischio di trombosi venosa con i contraccettivi estro-progestinici di “terza generazione” (contenenti desogestrel o gestodene come progestinico) è circa DOPPIO rispetto a quelle di “seconda generazione” (contenenti levonorgestrel).
2.3 - Il rischio di trombosi venosa associato all’uso di estro-progestinici è maggiore durante il primo anno in cui una
donna inizia per la prima volta ad assumere un qualunque tipo di contraccettivo estro-progestinici.
Sin dalla fine degli anni Sessanta è stato riconosciuto un aumento del rischio di tromboembolismo venoso durante l’uso
di estro-progestinici, ponendolo in relazione con la quantità di etinil-estradiolo (estrogeno) contenuto negli estro-progestinici.
Tale corrispondenza tra dose di estrogeno e rischio di tromboembolismo venoso non sembra invece più dimostrabile
con dosi di estrogeno inferiori a 50 microgrammi. Gli estro-progestinici di terza generazione (contenenti desogestrel o
gestodene come progestinico) appaiono indurre un maggior rischio trombotico rispetto agli estro-progestinici di seconda
generazione (che contengono levonorgestrel), con un rischio relativo aumentato di circa 1,7 volte e un aumento del rischio
assoluto di TEV di 1,1-1,4 casi per 10.000 donne-anno.
Il rischio assoluto globale di tromboembolismo venoso aumenta in donne con più di 35 anni, fumatrici o sovrappeso
(BMI > 25 kg/m).
Il rischio di tromboembolismo venoso è inoltre maggiore nelle prime utilizzatrici di estro-progestinici e nel primo anno
di utilizzo. Complessivamente, sulla base di questi dati, l’aumento del rischio assoluto di TEV legato all’uso di estro-progestinici varia da +0,4 casi a +1,1 casi per 10.000 pazienti-anno nelle pazienti che utilizzano estro-progestinici con levonorgestrel, e fino a +2,6 casi per 10.000 pazienti-anno nelle pazienti in terapia con estro-progestinici contenenti desogestrel o
gestodene.
L’unico studio che ha finora valutato il rischio trombotico degli estro-progestinici contenenti drospirenone ha mostrato
una incidenza di tromboembolismo venoso sovrapponibile a quella osservata per gli estro-progestinici contenenti levonorgestrel..
La concomitante presenza di anomalie coagulatorie trombofiliche aumenta di circa 4 volte il rischio relativo di tromboembolismo venoso durante assunzione di estro-progestinici.
Nel caso dei due difetti congeniti più frequenti (fattore V Leiden e mutazione G20210A della protrombina, associati a un
rischio relativo di tromboembolismo venoso di circa 7 e 4 rispettivamente), tale rischio relativo aumenta fino a 20 o 30
volte, suggerendo un’interazione di tipo moltiplicativo.
In termini assoluti, il rischio di tromboembolismo venoso resta comunque basso: considerando un’incidenza di base di
tromboembolismo venoso di 1 su 10.000 donne-anno nella fascia di età fertile, si ha un’incidenza di 4 su 10.000 donneanno dovuta agli estro-progestinici, 7 e 4 su 10.000 donne-anno dovuta al fattore V Leiden e alla mutazione G20210A della
protrombina rispettivamente.
La concomitante presenza della mutazione genetica e uso di estro-progestinici aumenta l’incidenza di tromboembolismo venoso fino a circa 30 casi per il fattore V Leiden e 16 casi su 10.000 donne-anno per la mutazione della protrombina.
5
3.1 - Prima di iniziare una contraccezione con estro-progestinici si raccomanda:
a) la raccolta di un’anamnesi personale e familiare con particolare attenzione agli eventi trombotici
prevenzione tev
b) l’offerta attiva di informazione e la discussione con la donna sul rischio individuale di trombosi e sulla possibilità di ridurlo.
3.2 - Non si raccomanda, né prima di prescrivere un contraccettivo estro-progestinico né durante l’uso, l’esecuzione
routinaria di:
a) esami ematochimici generici
b) test generici di coagulazione
c) test specifici per trombofilia (compresi i test genetici)
3.3 - Anche in presenza di anamnesi familiare positiva per eventi trombotici, al fine di prescrivere una contraccezione
estro-progestinica, non si raccomanda l’esecuzione dei test specifici per trombofilia.
3.4 - Al momento della prescrizione, si raccomanda un contraccettivo a minor rischio trombotico (progestinico di II
generazione con 20-30 microgrammi di estrogeno).
Una decisione informata sull’uso degli estro-progestinici necessita di una corretta comunicazione sui rischi, sui benefici e sulle aree di incertezza. La percezione del rischio dipende da come viene comunicata l’informazione; è pertanto appropriato fornire il rischio relativo in termini di rischio assoluto..
Per esempio un rischio relativo di tromboembolismo venoso associato all’uso di estro-progestinici aumentato di 3 volte
comporta un rischio assoluto comunque basso, con un incremento da 1 a 3 eventi per 10.000 anni-donna.
La storia personale di eventi trombotici pregressi (arteriosi e/o venosi) è empiricamente considerata una controindicazione all’uso di estro-progestinici (OMS 2004):
Pertanto le stime sul rischio di ricorrenza in corso di esposizione a estro-progestinici dopo un evento trombotico sono
poche, dato che in tali donne vengono abitualmente consigliati metodi contraccettivi alternativi.
In uno studio prospettico di coorte comprendente 215 donne con una prima trombosi venosa, il tasso di nuovi eventi in
coloro che avevano assunto estro-progestinici dopo la pregressa trombosi (n=58) era 28 per 1.000 pazienti-anno (95%CI
15,9-49,4), mentre era pari a 12,9 per 1.000 pazienti-anno (95%CI 7,9-21,2) nelle donne che non avevano assunto estro-progestinici dopo l’evento.
Su base empirica, un’anamnesi personale positiva per tromboflebiti superficiali viene invece considerata dalle
linee guida OMS una condizione accettabile ai fini della prescrizione di estro-progestinici, con benefici superiori ai
rischi (OMS 2004).
La presenza di una trombofilia ereditaria in donne che assumono estro-progestinici comporta un rischio relativo di
tromboembolismi venosi rispetto a donne non trombofiliche compreso tra 4,8 e 15,6 volte, a seconda del tipo di trombofilia, con una stima del rischio assoluto comunque bassa, pari a 1,5-4,8 eventi per 1.000 donne-anno (assumendo un valore
basale di 3 eventi per 10.000 donne-anno in corso di assunzione di estro-progestinico). Ne consegue che l’esecuzione routinaria di test specifici per ’identificazione di trombofilia genetica non sembra utile, e non viene pertanto accomandata (OMS 2004).
È stato considerato se la presenza di tromboembolismi venosi nella storia familiare potesse essere predittiva della presenza di trombofilia. Un problema rilevante è la definizione variabile nel numero minimo di familiari con eventi richiesto per
definire la storia familiare come positiva o negativa (uno o più di uno? di primo o anche di secondo grado?); differenti definizioni possono comportare differenti stime della probabilità della presenza di una predisposizione trombofilica ereditaria.
Peraltro oggi in Italia le famiglie numerose sono rare e perciò definire positiva la storia familiare solo in presenza di due o più
individui con tromboembolismi venosi può portare alla sottostima della familiarità per il rischio trombotico.
In uno studio trasversale (Cosmi 2003) sono state valutate 479 donne con storia personale negativa per tromboembolismo venoso prima di assumere estro-progestinici e 189 donne con tromboembolismo venoso in corso di terapia con estroprogestinici. La storia familiare per tromboembolismo venoso è stata considerata positiva in caso di eventi in un parente di
6
primo o secondo grado. Nei due gruppi di donne la storia familiare per tromboembolismi venosi aveva una bassa sensibilità e specificità (< 50%) per la presenza di trombofilia congenita.
In conclusione la storia familiare positiva per tromboembolismi venosi di per sé non è predittiva della presenza di
un’alterazione trombofilica (nota) ma può comportare un modesto incremento del rischio trombotico in corso di
assunzione di estro-progestinici.
prevenzione tev
Una storia familiare positiva è stata indicata come un fattore limitante in caso di tromboembolismo venoso in un
consanguineo di primo grado di età inferiore a 45 anni, indipendentemente dall’esecuzione o meno di uno screening di laboratorio per trombofilia.
In studi condotti in famiglie con alterazione trombofilica nota già identificata in seguito all’insorgenza di tromboembolismi venosi in un componente della famiglia, l’incidenza osservata di eventi trombotici associati all’uso di estro-progestinici
è risultata di 4,3-4,6 per 100 donne-anno in soggetti con difetto di anticoagulanti naturali (antitrombina, proteina C ed S) e
1,8-2 per 100 donne-anno in soggetti con fattore V Leiden.
In uno studio familiare nessun evento trombotico è stato osservato in donne portatrici del polimorfismo G20210A del
gene della protrombina durante l’uso di estro-progestinici.
Tali differenze rispecchiano il diverso grado di rischio associato ai vari tipi di trombofilia.
In conclusione, almeno per quanto riguarda i difetti di anticoagulanti naturali e il fattore V Leiden, il rischio assoluto
attribuibile all’assunzione di estro-progestinici in donne trombofiliche con storia familiare positiva per tromboembolismi venosi è compreso tra il 2 e il 4 per 100 donne-anno, quindi aumentato di circa 10 volte rispetto al rischio stimato
in donne trombofiliche con storia familiare negativa identificate nella popolazione generale (pari, come detto, a 1,54,8 per 1.000 donne-anno).
Nonostante i test di trombofilia non siano generalmente raccomandati in donne con storia familiare positiva per tromboembolismi venosi, alla luce dei dati sopra elencati.
si ritiene opportuna l’esecuzione dei test di trombofilia per valutare il rapporto rischio-beneficio della prescrizione di estro-progestinici nelle donne nelle cui famiglie sia già stata identificata un’alterazione trombofilica a
seguito di un evento di tromboembolismi venosi in uno o più membri
In ogni caso viene raccomandata la prescrizione di estro-progestinici di seconda generazione contenenti levonorgestrel, considerati a minor rischio trombotico in base ai dati epidemiologici analizzati nel punto precedente.
TEST DI TROMBOFILIA:
.1 - Rispetto ai più comuni test ematochimici, i test specifici di trombofilia presentano globalmente una maggiore
complessità che si associa a una più alta variabilità dei loro risultati.
Nella pratica corrente è stato riscontrato un elevato tasso di errore diagnostico per ridurre il quale se ne raccomanda l’esecuzione solo in laboratori qualificati.
.2 - In aggiunta a questi limiti, lo scarso valore predittivo dei test di predisposizione genetica o acquisita è il motivo
per cui non se ne raccomanda l’uso di routine.
In considerazione dell’ampio utilizzo, il più delle volte inappropriato, dei test di predisposizione genetica se ne
elencano i tipi e le loro caratteristiche principali.
.3 - I seguenti test identificano una predisposizione genetica alla trombosi:
1. mutazione fattore V Leiden (eterozigote/omozigote);
2. mutazione protrombina G20210A (eterozigote/omozigote);
3. deficit di proteina C;
4. deficit di proteina S;
5. deficit di antitrombina.
7
Le prime due alterazioni sono relativamente frequenti nella popolazione generale (3% circa ciascuna) ma aumentano di
poco il rischio assoluto di trombosi. Le altre tre alterazioni sono invece molto più rare (prevalenza dallo 0,02% allo 0,5%) ma
aumentano più decisamente il rischio assoluto.
prevenzione tev
Altri test disponibili non identificano condizioni genetiche per le quali sia documentato un rischio trombotico
aumentato e sono pertanto in ogni caso sconsigliati.
4.4 - I seguenti test identificano una predisposizione acquisita alla trombosi:
1. anticoagulante tipo lupico (LAC);
2. anticorpi antifosfolipidi;
3. elevati livelli di fattore VIII;
4. omocisteinemia.
Questi fattori di rischio sono più frequenti di quelli precedenti e comportano un aumento di rischio variabile, maggiore
per i primi due e minore per l’iperomocisteinemia e il fattore VIII alto.
Le alterazioni diagnosticabili con i test precedentemente elencati sono più frequenti di quelle genetiche e si associano
ad un aumento di rischio trombotico variabile, maggiore per le prime due e minore per le altre.
I test di laboratorio per la diagnosi delle alterazioni trombofiliche presentano numerosi e importanti limiti metodologici
e di esecuzione. In particolare quelli non basati sull’analisi del DNA presentano, rispetto ad altri test ematochimici, una più
alta complessità dovuta alle possibili interferenze sul risultato finale di variabili preanalitiche, analitiche, fattori fisiologici,
patologie associate e assunzione di farmaci.
Sono caratterizzati inoltre da una più alta variabilità dei risultati. I coefficienti di variazione inter laboratorio (variabilità
dei risultati tra laboratori diversi legata al metodo e alla sua realizzazione, espressa in percentuale) ottenuti nell’ambito dei
programmi di valutazione esterna di qualità sono:
❏
❏
❏
❏
antitrombina = 5-10%,
proteina C = <10% per metodi funzionali cromogenici (più alti per test funzionali coagulativi),
proteina S = 40-50% per test funzionale coagulativo (più bassi per test immunologico che misura la frazione libera),
resistenza alla Poteina C attivata = <20% (più bassi per test di II generazione e per i test basati su principi diversi
all’aPTT),
❏ ricerca LAC = 40-50%,
❏ dosaggio anticorpi antifosfolipidi = 40-50%,
❏ omocisteinemia = <15%.
L’elevata variabilità metodologica determina anche una non trascurabile probabilità di errore diagnostico, ovvero la probabilità di interpretare un livello alterato come normale o viceversa, il che può portare a una gestione impropria del soggetto esaminato.
Gli errori diagnostici ottenuti nell’ambito dei programmi di valutazione esterna di qualità, espressi in termini percentuali
di falsi positivi o falsi negativi, sono:
❏
❏
❏
❏
❏
❏
antitrombina = inferiori al 5%,
proteina C = <10%,
proteina S = <20%,
test di resistenza alla proteina C attivata = <5%,
LAC = <20%,
omocisteina = <10%.
Occorre inoltre sottolineare che sia la variabilità sia l’errore diagnostico sono in genere più alti per valori al di fuori del
range di normalità, quindi proprio per risultati alterati o ai limiti della norma.
I test basati sull’analisi del DNA sono ritenuti più sicuri e sono in genere preferiti; tuttavia anche per questi test vi è una
documentazione del rischio di rilevante errore diagnostico (3-6% per eterozigosi, 15-17% per omozigosi).
I requisiti fondamentali per una corretta esecuzione dei test di trombofilia e per a ssicurare il massimo di affidabilità dei risultati sono i seguenti:
8
1. che i test siano eseguiti presso laboratori qualificati, dotati di personale ben addestrato, formato e con esperienza nel campo dell’emostasi;
3. che i laboratori garantiscano una costante partecipazione a programmi specifici di valutazione esterna di qualità, che consentono di controllare e migliorare sensibilmente la performance del laboratorio stesso;
4. che questi test siano eseguiti solo previa raccolta dell’anamnesi del soggetto, sulla base della quale il risultato
finale potrà essere poi interpretato più correttamente;
5. che i laboratori non si limitino a fornire il risultato (quantitativo o qualitativo) del test, ma anche una sua interpretazione esplicita e corretta e suggeriscano gli eventuali approfondimenti necessari per raggiungere una diagnosi conclusiva.
prevenzione tev
2. che i laboratori assicurino l’applicazione di corrette procedure preanalitiche e analitiche. In particolare si sottolinea l’importanza di una corretta scelta del tipo di test da eseguire;
5. Quali sono le implicazioni cliniche, psicologiche e organizzative in caso di un’applicazione su vasta scala dei test
per la valutazione del rischio trombotico?
5.1 - Sul piano clinico, la loro scarsa predittività li rende a rischio di sovradiagnosi e di eccessiva medicalizzazione in
caso di applicazione su vasta scala.
Un risultato negativo potrebbe essere falsamente rassicurante.
Un risultato positivo potrebbe scoraggiare l’uso di contraccezione estro-progestinica in donne che potrebbero
giovarsene.
È prevedibile che una eventuale applicazione su vasta scala dei test per la diagnosi di alterazioni trombofiliche si associ a
ripercussioni rilevanti sul piano clinico e psicologico individuale, oltre che ovviamente su quello organizzativo del Servizio
sanitario.
Per quanto riguarda le possibili ricadute cliniche va sottolineato che la grande maggioranza delle alterazioni trombofiliche eventualmente diagnosticate avrebbe comunque un basso valore predittivo per la comparsa di eventi trombotici venosi.
Alcune di queste alterazioni, molto frequenti nella popolazione generale, non sarebbero inevitabilmente associate alla
comparsa di eventi trombotici; ciò si verificherebbe in particolare nelle donne giovani, popolazione caratterizzata da un’incidenza molto bassa di eventi trombotici venosi. È stato stimato infatti che più del 70% delle donne portatrici di un test
alterato di resistenza alla proteina C attivata (espressione di mutazione del attore V Leiden) non andranno mai incontro a trombosi.
Inoltre, un risultato positivo dei test potrebbe scoraggiare l’uso di contraccezione estro-progestinica in donne che
potrebbero giovarsene, aumentando di converso il rischio di altre complicanze legate alla mancata
contraccezione.
Al contrario, va tenuto conto che un risultato completamente negativo dello screening potrebbe comportare una falsa
rassicurazione in quanto non potrebbe comunque essere escluso il rischio individuale di una complicanza trombotica.
A questo proposito è stato calcolato che lo screening per la trombofilia sarebbe in grado di identificare solo una
porzione minoritaria di donne con potenziale complicanza tromboembolica venosa in corso di trattamento con
estro-progestinici.
5.2 - In particolare, la mutazione eterozigote del fattore V Leiden o della protrombina (alterazioni che rappresentano
le mutazioni più frequenti) e la carenza di proteina C costituiscono rischio da confrontare con i potenziali benefici
della contraccezione estro-progestinica, da valutare caso per caso.
Invece, il deficit congenito di antitrombina, l’omozigosi e la doppia eterozigoti (fattore V e protrombina) nonché i
difetti multipli costituiscono alterazioni molto rare che comportano un rischio trombotico più alto, tale da sconsigliare l’uso di estro-progestinici.
9
Infine per quanto riguarda la carenza congenita di proteina S non ci sono informazioni sufficienti per una chiara raccomandazione.
prevenzione tev
Sebbene non raccomandabile, l’esecuzione di uno screening per trombofilia è una pratica attualmente discretamente
diffusa e, conseguentemente, una porzione non trascurabile (intorno al 7-10%) delle donne che eseguono tale indagine
riceve una diagnosi di presenza di alterazione trombofilica, genetica o acquisita. Occorre quindi valutare con attenzione
quale consiglio dare a queste donne in merito alla contraccezione con estro-progestinici. Alcune delle alterazioni trombofiliche interagiscono sinergicamente con gli estro-progestinici; tuttavia esse si associano a un diverso grado di rischio trombotico e non devono essere considerate tutte come controindicazione assoluta a tale trattamento.
Il rischio relativo per tromboembolia venosa risulta più basso per alcune alterazioni, ma decisamente più alto per altre
(Reich 2003). Il rischio attribuito alla presenza di una mutazione eterozigote del fattore V Leiden o della protrombina (le due
alterazioni più frequenti) e al difetto di proteina C è relativamente basso (da 2 a circa 7 volte).
La presenza di una di queste alterazioni rappresenta quindi sicuramente un fattore di rischio, che tuttavia deve essere
valutato caso per caso e discusso con l’interessata rispetto ai potenziali benefici della contraccezione, e che può inoltre
orientare verso la somministrazione di prodotti ormonali associati ad un minor rischio trombotico (estro-progestinici di
seconda generazione o a base di solo progestinico).
Viceversa il rischio relativo associato al deficit congenito di antitrombina, alla presenza di omozigosi (della mutazione del
fattore V Leiden o della protrombina), di doppia eterozigosi (contemporanea presenza di mutazione del fattore V Leiden e
della protrombina) o di altri difetti multipli è più elevato pur in assenza di stime affidabili a causa della rarità di queste alterazioni.
La loro presenza comporta comunque un rischio trombotico più alto, che in linea generale porta a sconsigliare l’uso di
estro-progestinici. Tuttavia anche in presenza di queste condizioni va confermata la necessità e il valore di un counselling
adeguato e della valutazione individuale del rapporto rischi-benefici in relazione alle possibili diverse indicazioni al trattamento.
Per quanto riguarda il deficit di proteina S non sono disponibili informazioni sufficienti per dare una chiara raccomandazione.
Analogamente non si hanno informazioni sufficienti per valutare il rischio associato alla presenza del fenomeno LAC e/o
di livelli elevati di anticorpi antifosfolipidi.
Uno studio recente sul trattamento contraccettivo orale in donne con Lupus eritematoso sistemico
ha osservato che tutti gli eventi trombotici registrati durante il trial si erano verificati in donne con livelli alterati di anticorpi antifosfolipidi, indicando un rischio più elevato del trattamento in
presenza di questo tipo di alterazione trombofilica.
5.3 - Sul piano psicologico, l’esecuzione e l’esito positivo dei test sembrano non avere un impatto avverso nella maggioranza delle donne in contesti nei quali era fornito un adeguato counselling pre- e post-test. Pertanto, è fortemente
raccomandato offrire un counselling adeguato nel momento precedente al test e al momento della comunicazione
del risultato.
È da considerare la possibilità che la comunicazione di risultati positivi di test genetici abbia un impatto psicologico
negativo sugli individui esaminati, specie se predisposti ad ansia e depressione e quindi particolarmente vulnerabili.
È prevedibile che l’entità dell’impatto sia correlata alla probabilità di rischio connessa all’alterazione riscontrata, alla gravità della malattia in questione e alla possibilità o meno di controllo e prevenzione.
Per questi aspetti si può considerare che la diagnosi di alterazioni trombofiliche rappresenti una condizione di minor
gravità rispetto ad altre, esistendo in questo caso ampie possibilità di prevenzione e sorveglianza.
Tuttavia la possibilità di un impatto psicologico della comunicazione di risultati alterati non può essere trascurata. I risultati degli studi che hanno valutato l’impatto psicologico dei test genetici per la trombofilia non sono omogenei dal punto di
vista metodologico, per cui non possono fornire un quadro completamente univoco circa i pro e i contro delle procedure di
screening.
Alcune prove indicano che la comunicazione di un esito alterato di test per trombofilia non ha un impatto psicologico
avverso nella grande maggioranza dei soggetti. Va sottolineato però che risultati così tranquillizzanti sono stati ottenuti nell’ambito di un’attività clinica in cui a tutti veniva offerto un adeguato counselling, sia precedentemente all’esecuzione delle
indagini sia al momento della comunicazione degli esiti.
Un counselling adeguato sembra prevenire e minimizzare i potenziali effetti avversi di un esito positivo dello screening,
e allo stesso tempo sembra andare incontro alle esigenze dei pazienti più vulnerabili anticipando i possibili effetti negativi di
una particolare predisposizione all’ansia e/o alla depressione.
10
6. Che informazione dare alle donne che intendono iniziare una contraccezione estro-progestinica sul rischio di
trombosi venosa?
6.1 - Occorre informare la donna sui seguenti argomenti:
prevenzione tev
5.4 - Un medico che applicando le raccomandazioni di questa conferenza di consenso prescriva la contraccezione estro-progestinica senza richiedere l’esecuzione di test di predisposizione genetica segue una buona pratica
clinica.
Sul piano organizzativo, l’inappropriata diffusione di questi test comporta costi non giustificati per il SSN e per i
cittadini.
– la trombosi venosa in età fertile è molto rara;
– la contraccezione estro-progestinica aumenta il rischio di circa 2 volte ma il rischio assoluto rimane molto
basso (1-2 casi all’anno ogni 10.000 donne; a titolo di confronto, il rischio di trombosi venosa in gravidanza è
intorno a 6 casi ogni 10.000 gravidanze);
– il rischio non è uguale in tutte le donne;
– il rischio è più elevato durante il primo anno d’uso;
– il rischio non è uguale per tutti i contraccettivi estro-progestinici
– interventi chirurgici, traumi e immobilità prolungata aumentano il rischio e richiedono che la donna segnali
al medico che sta assumendo un estro-progestinico
– gli stili di vita salutari riducono il rischio trombotico;
– i test per individuare la predisposizione al rischio sono molto usati ma non sono raccomandati.
6.2 - Tutte queste informazioni andrebbero date con l’intento di facilitare una decisione consapevole da parte della
donna riguardo la prescrizione sia di estro-progestinici sia di eventuali test di predisposizione.
Quando si deve informare circa un “rischio”, è importante che chi è deputato a trasmettere l’informazione (medico di
famiglia, ginecologo o altro operatore sanitario) si adoperi affinché l’informazione sia comprensibile a tutti, a prescindere
dal livello culturale; pertanto l’uso di termini tecnici deve essere limitato e sostituito da una terminologia più chiara possibile.
Dichiarare che la contraccezione estro-progestinica aumenta di 2 volte (rischio relativo) il rischio di trombosi venosa
potrebbe essere rischioso per la comprensione se non si specificasse l’entità del rischio assoluto – molto piccolo – in termini
di frequenza.
Nelle valutazioni di rischio/beneficio dell’uso di estro-progestinici, la letteratura scientifica suggerisce il confronto tra
rischio di tromboembolismi venosi in corso di assunzione di estro-progestinici e rischio di tromboembolismi venosi in gravidanza. Tale confronto, sebbene possa essere giudicato poco opportuno in termini etici, riflette tuttavia la realtà, dato che il
rischio assoluto di tromboembolismi venosi in gravidanza (6 casi ogni 10.000 gravidanze) può essere anche il doppio
di quello in corso di contraccezione estro-progestinica.
È importante informare la donna sul fatto che il rischio non è uguale in tutte le donne, perché legato a diversi fattori,
sia individuali sia intercorrenti, che si combinano variamente nei singoli individui e hanno un peso differente nei diversi
momenti in cui la donna si accinge a iniziare una contraccezione estro-progestinica.
Per un’attenta stratificazione del rischio individuale di trombosi venosa è fondamentale la raccolta di un’anamnesi
personale e familiare approfondita, con particolare attenzione agli eventi trombotici.
A questo scopo si raccomanda la collaborazione sul territorio tra la medicina specialistica (ginecologia, consultori,
ospedali) e la medicina di famiglia, essendo il medico di famiglia il depositario più probabile di un’approfondita
anamnesi sia familiare sia individuale della donna che si accinge a iniziare una contraccezione estro-progestinica.
Poiché i lavori inerenti la storia familiare di tromboembolismo venoso, valutati dal nostro panel di esperti, si rifanno
quasi tutti a una metodologia di raccolta dell’anamnesi attraverso un questionario sottoposto alla donna (Cosmi 2003,
Frezzato 1996, Sidney 2004), con i conseguenti bias legati all’interpretazione soggettiva del dato da parte delle donne intervistate, è auspicabile poter ottenere dati migliori attraverso ricerche fondate sull’anamnesi raccolta dai medici di
famiglia, magari anche attraverso l’utilizzo dei loro database.
11
Poiché il rischio di tromboembolismo venoso, per qualunque tipo di terapia estro-progestinica, è più elevato durante il
primo anno d’uso, si raccomanda un più attento monitoraggio della terapia in tale periodo: le donne sono incoraggiate a
sottoporsi a visite di follow-up periodiche programmate soprattutto nel breve periodo all’esordio dell’esperienza
contraccettiva, quindi in particolare nei primi tre mesi e per tutto il primo anno di contraccezione.
prevenzione tev
È necessario soprattutto contattare il medico ogni volta che si presentassero problemi o sintomi inusuali, senza trascurarne l’insorgenza. Si raccomanda, di contro, ampia disponibilità e facile reperibilità da parte dei medici prescrittori durante
questo periodo.
È opportuno informare la donna sul fatto che, dai dati presenti in letteratura, gli estro-progestinici di seconda generazione sembrano indurre un rischio trombotico ridotto rispetto agli estro-progestinici di terza generazione, in modo
che, sulla base del profilo di rischio trombotico individuale, si possa operare una scelta condivisa anche sul tipo di estro-progestinico (tenendo conto anche delle altre differenze tra i diversi tipi di estro-progestinico, quali contenuto di estradiolo –
uguale o inferiore a 50 microgrammi – , tipi di progestinico, possibili effetti collaterali, eventuali costi da sostenere).
Va opportunamente consigliato alla donna che prevede di sottoporsi nell’immediato a interventi chirurgici di alto o
medio rischio di posticipare l’eventuale inizio di una contraccezione estro-progestinica al post-intervento.
Nel caso in cui si preveda, in corso di contraccezione estro-progestinica, un intervento chirurgico ad alto o medio
rischio, è necessario programmare una sospensione degli estro-progestinici almeno 4 settimane prima.
Si raccomanda che la donna comunichi al medico (o ad altro operatore sanitario) che sta facendo uso di estro-progestinici in caso di interventi chirurgici, traumi o di altre situazioni che determinino immobilità prolungata (plegie, ospedalizzazione, allettamenti prolungati per malattia).
Di contro, si raccomanda la raccolta di un’accurata anamnesi specifica circa l’eventuale uso di estro-progestinici
da parte dei sanitari a una donna che ha subito un trauma, che deve sottoporsi ad intervento chirurgico o che è
immobilizzata per qualsiasi causa.
Se l’obesità è un fattore di rischio riconosciuto per trombosi venosa e il suo effetto, come per il fumo, è sinergico all’uso
di estro-progestinici sull’aumento del rischio trombotico, l’associazione tra arteriosclerosi e trombosi venosa è da anni soggetto di animate discussioni da parte della letteratura scientifica internazionale.
Laddove la dislipidemia è stata riconosciuta come fattore di rischio per disordini aterotrombotici, un profilo lipidico sfavorevole si ritiene possa avere un effetto negativo sul rischio di trombosi venosa. Anche l’ipertensione arteriosa e il
diabete sono stati associati alla trombosi venosa, mentre studi recenti hanno interpretato la trombosi venosa come una
manifestazione della cosiddetta sindrome metabolica.
Pertanto, pur in mancanza di prove specifiche per quanto riguarda la dieta e la prevenzione della trombosi venosa, si
raccomanda l’adozione di regimi alimentari tesi a ridurre il peso corporeo in caso di obesità o volti a correggere eventuali patologie coesistenti, quali diabete, ipertensione, dislipidemia. Si raccomanda l’astensione dal fumo. Poiché l’immobilità prolungata, e in misura minore l’ipomobilità, aumentano il rischio di trombosi venosa, si raccomanda la pratica di
un’attività fisica regolare (in particolare le attività che giovano al ritorno venoso, come jogging, cammino sostenuto, bicicletta e nuoto) per ridurre il rischio trombotico, anche se mancano in letteratura prove specifiche.
In caso di lunga permanenza in posizione seduta (con le gambe giù), come durante viaggi prolungati (superiori a 6 ore)
con qualunque mezzo, si raccomanda di praticare esercizi di mobilizzazione delle gambe o anche solo dei piedi e, se
possibile, di alzarsi in piedi e passeggiare, di indossare scarpe e vestiti comodi, di mantenere una corretta idratazione, di non bere alcoolici, di evitare di assumere farmaci ipnoinducenti.
Dato l’aumento di prevalenza dell’obesità e del fumo rispetto al passato nella popolazione femminile, anche adolescente, il momento in cui si informa la donna sui fattori di rischio di tromboembolismo venoso e l’uso di estro-progestinici rappresenta per il medico un’opportunità educativa circa i fattori di rischio modificabili attraverso l’assunzione di adeguati stili
di vita, quali fumo e obesità. Tale obiettivo è da perseguire sia per ridurre il rischio legato alla assunzione di estro-progestinici, sia in termini di salute generale.
7. Quale informazione è necessaria per le donne positive ai test specifici per trombofilia?
In caso di avvenuta esecuzione di test specifici per trombofilia, occorre informare la donna sui seguenti argomenti:
– complessità, variabilità e possibilità di errore diagnostico;
– scarso valore predittivo;
– rischio di rinuncia alla contraccezione estro-progestinica;
– possibilità di falsa rassicurazione e di sovradiagnosi;
– misure di prevenzione della trombosi.
12
Si raccomanda in ogni caso che tutte le informazioni siano offerte attivamente prima della eventuale esecuzione
del test.
È opportuno fornire attivamente tutte le informazioni inerenti i test di predisposizione prima che vengano seguiti, affinché la donna possa operare una scelta informata anche circa l’esecuzione di questi test e sia, quindi, più pronta a gestire le
conseguenze di una eventuale positività.
prevenzione tev
Le donne positive ai test specifici vanno rassicurate sul fatto che le diatesi trombofiliche congenite non sono inevitabilmente associate a un evento trombotico (si tratta di predisposizione, non di malattia).
L’eventuale indicazione o controindicazione alla contraccezione estro-progestinica va valutata singolarmente,
secondo il tipo di alterazione presente e secondo il profilo di rischio complessivo individuale.
Si sottolinea il rischio che la donna rinunci alla contraccezione estro-progestinica anche in un caso di positività in cui essa
non sia, invece, controindicata.
Particolare attenzione va posta in soggetti predisposti all’ansia e alla depressione e quindi particolarmente vulnerabili, soggetti nei quali l’esito del test può indurre stress e preoccupazione.
In ogni caso, la donna va rassicurata circa le ampie possibilità di attuazione di misure di prevenzione della trombosi, tra le
quali: la profilassi primaria nelle situazioni ad alto rischio (come interventi chirurgici, gravidanze, traumi, immobilità prolungata), la correzione dei fattori di rischio modificabili (come l’abitudine al fumo e l’obesità), l’adozione di stili di vita salutari.
Va inoltre sottolineata la possibilità che la donna consapevole della proprio stato di portatrice ha di riconoscere precocemente i segni e i sintomi di un evento trombotico, se opportunamente allertata.
Questa corretta informazione va fornita allo scopo di facilitare la gestione da parte della donna della propria condizione,
attraverso scelte e comportamenti appropriati.
8. Quali misure di politica sanitaria sono auspicabili per la prevenzione delle complicanze trombotiche nelle utilizzatrici di estro-progestinici?
Considerata la carenza di conoscenze epidemiologiche, in particolare italiane, su molti aspetti affrontati dalla conferenza
di consenso, si raccomanda l’esecuzione di studi epidemiologici sul rischio trombotico venoso e sui fattori che lo influenzano, in particolare la contraccezione estro-progestinica.
Tali studi dovrebbero rappresentare una delle priorità del sistema sanitario per il finanziamento della ricerca indipendente.
Le conoscenze sul rischio di trombosi venosa nelle donne in età fertile e sui fattori che lo influenzano, con particolare
riferimento alla contraccezione estro-progestinica, appaiono carenti da diversi punti di vista.
Sono scarsi i dati di buona qualità per identificare l’effettiva incidenza (la frequenza di nuovi casi l’anno) della trombosi
venosa nelle donne in età fertile, in generale e in particolare nella popolazione italiana, in assenza e in presenza di contraccettivi estro-progestinici. Per ottenere una stima ci si fonda spesso su studi retrospettivi e del tipo caso-controllo (nei quali
dai casi di trombosi si risale a posteriori alla eventuale assunzione di contraccettivi) che non sono adatti a misurare accuratamente l’incidenza. Più rari sono gli studi trasversali di comunità (uno italiano condotto a Vicenza), quelli condotti sulle schede di dimissione ospedaliera e infine quelli di coorte prospettici, che raggiungono la maggiore affidabilità. Le stime più
attendibili riguardano l’incidenza globale di trombosi venosa, mentre per i limiti degli studi risultano più incerte le valutazioni delle quote attribuibili ai vari fattori individuali e intercorrenti.
Sono carenti anche i dati sulla prevalenza (la numerosità delle persone affette nella popolazione) delle diverse condizioni
di rischio individuale nella popolazione, in particolare italiana, soprattutto per quanto riguarda le anomalie trombofiliche più
rare, e sull’entità dell’aumento di rischio che i diversi fattori comportano, soprattutto per i fattori di predisposizione acquisita alla trombofilia.
Infine mancano completamente sperimentazioni cliniche controllate e randomizzate, probabilmente per le difficoltà
intrinseche, soprattutto di natura etica, di disegnare studi per misurare e confrontare gli effetti sulla trombosi dei contraccettivi estro-progestinici, ma forse anche per ragioni di tipo commerciale.
Gli studi disponibili sono quindi solo di tipo osservazionale, il che significa che i dati possono essere interpretati in diversi modi e spiega il grado di incertezza che accompagna le differenti stime pubblicate. In generale, negli studi osservazionali,
sono i diretti interessati (nel caso dei contraccettivi, le donne) a scegliere se assumere un farmaco e quale, col risultato che
gli esiti rilevati (per esempio la trombosi) potrebbero essere l’effetto di un determinato farmaco o di altre caratteristiche
personali che si associano più frequentemente con la scelta di assumerlo.
13
Per facilitare la conduzione di studi epidemiologici di buona qualità sulla realtà italiana, i responsabili della formulazione
e della valutazione dei bandi per l’assegnazione di finanziamenti alla ricerca indipendente (ministeri, AIFA, charity, fondazioni eccetera) potrebbero indicare il rischio di trombosi nelle donne in età fertile come uno degli argomenti di interesse prioritario per la sanità pubblica.
prevenzione tev
In considerazione del minor rischio trombotico attribuibile ai contraccettivi estro-progestinici di tipo estrogenico
e contenenti levonorgestrel, si raccomanda la revisione della politica di rimborsabilità con l’inserimento in fascia A
dei prodotti a minor rischio.
I contraccettivi estro-progestinici disponibili in Italia e la loro rimborsabilità da parte del Servizio sanitario sono elencati
nelle tabelle in appendice 1.
In Italia il consumo corrente dei contraccettivi è soprattutto a carico di quelli contenenti 20 o 30 microgrammi di estrogeno,
mentre per quanto riguarda il contenuto di progestinico la prescrizione è così suddivisa:
– prodotti contenenti gestodene 45 %;
– prodotti contenenti drospirenone 25%;
– prodotti contenenti desogestrel 10%;
– prodotti contenenti levonorgestrel 7%.
Attualmente solo i contraccettivi contenenti 30 microgrammi di estrogeno sono in regime di rimborsabilità, poiché a suo
tempo erano stati individuati come “terapeutici”(dismenorrea, cisti ovariche, acne), mentre quelli a 20 microgrammi sono in
fascia C.
Si ritiene perciò raccomandabile l’inserimento in fascia A anche dei contraccettivi a 20 microgrammi di estrogeno e in
particolare di quelli contenenti levonorgestrel, viste le prove di un miglior profilo di rischio trombotico (vedi punti 2 e 3).
In considerazione della grande variabilità dei risultati e del tasso di errore dei test di trombofilia, si raccomanda l’attivazione di politiche di accreditamento e di controllo di qualità dei laboratori a livello regionale.
Alla luce di quanto esposto al punto 4 di questo documento, la variabilità dei risultati e il tasso di errore riscontrati
nell’ambito dei programmi di valutazione esterna di qualità costituiscono una grave preoccupazione di salute pubblica, soprattutto in considerazione del già citato uso inappropriato su larga scala dei test di trombofilia nelle donne italiane che assumono contraccettivi estro-progestinici.
Si raccomanda pertanto che a livello regionale si accreditino per l’esecuzione dei test di trombofilia solo laboratori che
possano dimostrare di:
– impiegare personale specificamente formato, esperto e aggiornato;
– applicare le procedure corrette per la raccolta dell’anamnesi, il prelievo e il trattamento dei campioni, l’esecuzione dell’analisi con il metodo più appropriato;
– fornire una esplicita e corretta interpretazione dei risultati, compreso il percorso per la diagnosi definitiva;
– partecipare a programmi di valutazione esterna di qualità.
È fondamentale che le autorità sanitarie italiane si impegnino in una campagna di comunicazione per informare i
professionisti sanitari sulle presenti raccomandazioni, in particolare relativamente all’uso inappropriato dei test specifici di predisposizione genetica e acquisita.
Si raccomanda che il sistema sanitario si impegni a vari livelli nell’informazione alle donne sull’uso sicuro della
contraccezione estro-progestinica.
L’uso dei test di predisposizione genetica e acquisita alla trombofilia è molto diffuso in Italia in associazione alla prescrizione di contraccettivi estro-progestinici per lo più senza motivazioni appropriate.
Tale pratica è variabile in relazione sia al tipo dei test richiesti sia al momento in cui essi vengono richiesti (prima della
prescrizione, durante l’assunzione dei contraccettivi, alla loro sospensione).
Si ritiene perciò importante e strategico che le raccomandazioni di questa conferenza di consenso vengano diffuse capillarmente ai Medici di Medicina generale ed agli Specialisti (ginecologi ed ematologi in primo luogo) operanti nei diversi contesti
Tale informazione potrà essere diffusa anche con iniziative a carattere regionale e aziendale e potrà, ove ritenuto
utile, essere congiunta ad attività formative specifiche per le diverse categorie.
14
La corretta informazione dei professionisti sarà essa stessa veicolo di comunicazione per le donne, ma si raccomandano
comunque iniziative di diffusione del documento anche a livello del pubblico.
Le campagne di informazione destinate alle donne dovrebbero avere come oggetto più in generale l’uso sicuro della
contraccezione estro-progestinica.
prevenzione tev
Appendice 1
15
prevenzione tev
Appendice 2
Strategie di comunicazione
Nelle raccomandazioni che emergono da questa conferenza di consenso viene più volte sottolineata l’importanza di
effettuare interventi di counselling , in particolare nel caso di prescrizione dei test genetici (counselling pre e post test).
Un intervento come quello raccomandato richiede che i medici abbiano acquisito alcune competenze comunicative di base e che sappiano condurre un colloquio pre e post test con modalità attive.
Queste stesse competenze si rivelano necessarie in tutti gli altri momenti informativi sui rischi di eventi trombotici che
sono raccomandati per consentire alla donna una decisione realmente informata e consapevole nell’assunzione di contraccettivi estro-progestinici e nella prevenzione dei rischi a essi legati.
Al punto 1 è bene sottolineato un primo problema che richiede una buona competenza comunicativa da parte del medico: l’informazione sui rischi di eventi trombotici viene fornita in un contesto comunicativo che dovrebbe anche favorire e promuovere l’uso dei contraccettivi orali estro-progestinici.
16
prevenzione tev
Si tratta di una difficoltà non trascurabile, perché i concetti di rischio (di complicanze) e di beneficio (dell’uso di contraccettivi estro-progestinici, benefici che riguardano, come sottolineato al punto 1, non solo le gravidanze indesiderate evitate
ma la salute della donna in generale) non conducono automaticamente a una valutazione razionale capace di portare ogni
donna a una decisione informata, ma richiedono che il medico faciliti attivamente la decisione affiancando la donna
nella trasformazione dei dati da lui forniti in elementi capaci di mettere in moto quella che viene definita “bilancia
decisionale”.
La semplice comunicazione di dati, statistiche e percentuali non costituisce una reale informazione utilizzabile
nelle decisioni anche perché non garantisce affatto che i dati forniti vengano compresi e utilizzati nella decisione nel
modo atteso.
Per ridurre quello che Gigerenzer (Gigerenzer 2002, Elmore 2005) definisce “il rischio della comunicazione sui rischi”,
cioè la distorsione nella percezione del rischio legata al differente significato che le diverse persone attribuiscono ai
dati numerici, è necessario saper utilizzare modalità comunicative basate sull’ascolto attivo e sull’interazione: l’eccesso di
comunicazioni “in uscita”, che vedono come parte attiva il sanitario e come destinatario muto il paziente, è responsabile del
maggior numero dei malintesi e degli incidenti comunicativi in ambito sanitario.
Il significato che quella particolare donna sta attribuendo a un dato, a una informazione, a una spiegazione deve entrare
a far parte dello scambio comunicativo in modo esplicito, per permettere al sanitario di perfezionare, correggere, ridirigere
il suo intervento.
Lo scambio attivo fra sanitario e paziente si basa su domande di tipo esplorativo o di tipo riflessivo che permettono sia
alla donna sia al sanitario di raggiungere una sufficiente consapevolezza dello stile decisionale abituale di quella persona,
del punto in cui si trova in quel momento nel suo percorso decisionale, di quello che la sta ostacolando, di quello che
potrebbe aiutarla a decidere.
Domande come: “Di solito per lei sapere che un comportamento comporta qualche rischio, anche se molto basso, cosa
fa succedere?” e “Adesso che le ho dato queste informazioni, quali sono i rischi che la preoccupano di più?” aumentano il
livello di consapevolezza della donna rispetto al proprio processo decisionale e permettono al sanitario di selezionare le
informazioni più adeguate per fornire alla donna un quadro equilibrato e utilizzabile dei rischi e dei benefici.
Anche i problemi etici a cui si fa riferimento al punto 6, legati al confronto fra rischio di eventi trombotici in corso di
assunzione di estro-progestinici e rischio di eventi trombotici in gravidanza si riducono se il confronto avviene all’interno di
una valutazione condivisa di ciò che la donna si sente di rischiare, delle sue priorità, dei suoi obiettivi eccetera, in una relazione di accoglienza e rispetto per i valori personali della donna.
Anche questo è reso possibile da una maggiore capacità da parte del sanitario di basare la sua comunicazione sia
sulle domande sia sulle informazioni.
Tutto il processo informativo indicato al punto 6 richiede una particolare attenzione nella scelta delle strategie comunicative: le informazioni raccomandate presentano notevoli difficoltà sul piano dell’efficacia, della comprensibilità e della trasformazione in elementi che favoriscano le decisioni.
I livelli comunicativi su cui si muovono le informazioni raccomandate sono molteplici, e ciascuno di essi produce reazioni e collegamenti mentali non del tutto prevedibili, legati alle esperienze e alla situazione di vita specifica di ogni singola
donna.
L’indagine sulla storia familiare e personale della donna rispetto agli eventi trombotici, proprio perché richiede che la
donna esplori i ricordi di eventi connotati come patologici e pericolosi per la salute, concentra l’attenzione sull’aspetto
“rischio”, spostando la bilancia decisionale nella direzione che porta a evitare ciò che potrebbe essere rischioso, in
modo più o meno significativo a seconda delle caratteristiche personali, della storia, del particolare momento di vita di quella persona.
Anche questo dovrebbe suggerire di evitare di raccogliere questi dati con questionari, in assenza quindi di una interazione fra la donna e il medico.
Le informazioni sulle motivazioni scientifiche che portano il medico a non prescrivere i test di predisposizione genetica
– scarso valore predittivo dei test , rischio di sovradiagnosi e di eccessiva medicalizzazione eccetera (punti 4, 5) – così come
l’informazione apparentemente rassicurante secondo la quale “una storia personale o familiare in cui sono presenti eventi
trombotici non significa che l’uso di estro-progestinici sia sconsigliabile” (punto 6) non sono facilmente assimilabili e traducibili in una decisione informata nel momento in cui è stata risvegliata l’attenzione rispetto al rischio di un evento patologico: l’aspettativa della donna sarà piuttosto quella di cercare il modo per ridurre, controllare, evitare quel rischio. Nei
fatti, in una logica ingenua, insistendo per ottenere la prescrizione dei test specifici o rinunciando al contraccettivo.
17
A questo punto la contrapposizione fra quello che la donna pensa di voler ottenere e quello che il sanitario le propone rischia di ostacolare ulteriormente l’efficacia della comunicazione.
prevenzione tev
Parte della difficoltà nasce dalla perdita di chiarezza rispetto agli obiettivi: l’obiettivo “scelta di un contraccettivo estroprogestinici adeguato e sicuro” – che dovrebbe essere l’obiettivo condiviso verso cui si muovono sanitario e paziente
– si confonde con l’obiettivo impossibile “eliminazione di ogni rischio di tromboembolismo venoso” involontariamente evocato dalle domande sulla storia personale e familiare.
Un colloquio informativo efficace richiede che il medico non si limiti a fornire informazioni, per quanto chiare, corrette,
adeguate e comprensibili, ma sia in grado di attivare e guidare una comunicazione dialogica basata su:
– l’esplicitazione e la condivisione degli obiettivi da raggiungere con quella decisione: anche se l’obiettivo può sembrare scontato, è necessario precisare anche più volte nel corso dello scambio comunicativo con la donna che l’obiettivo è la scelta consapevole di un contraccettivo estro-progestinico che offra la maggior sicurezza possibile anche
rispetto ai rischi di tromboembolismo venoso;
– l’esplorazione delle conoscenze e delle informazioni che la donna già possiede, e che potrebbero trasformarsi in
fattore ostacolante per la comprensione e l’utilizzazione corretta delle nuove informazioni;
– la selezione delle informazioni aggiuntive, fatta a partire dalle informazioni che la donna già possiede (giuste o sbagliate che siano) e proposta in modo graduale per ridurre i rischi di blocco cognitivo da eccesso di informazioni o
da dissonanza cognitiva;
– la verifica del grado di condivisione informativa raggiunto, che si ottiene facilitando l’esplicitazione dei dubbi e
delle perplessità e ribadendo le informazioni già fornite senza aggiungerne di nuove;
– il riassunto degli aspetti informativi che si ritengono essenziali in vista di una decisione informata.
Va inoltre sottolineato che il sanitario non può limitarsi a fornire i dati e le informazioni in modo neutrale, ma è
tenuto a esplicitare la sua convinzione professionale circa la scelta più opportuna, mantenendo tuttavia un atteggiamento di accoglienza rispetto alle perplessità, difficoltà, opinioni differenti della donna, in una posizione relazionale asimmetrica ma non autoritaria che facilita le decisioni e rafforza la relazione di cura.
Un altro gruppo di messaggi raccomandati dalla conferenza di consenso ha invece a che fare con la promozione di comportamenti favorevoli (particolare attenzione nel primo anno di uso dell’estro-progestinico, con monitoraggio della terapia
e visite di follow up periodiche programmate soprattutto nel breve periodo all’esordio della esperienza contraccettiva,
assunzione di uno stile di vita corretto specie in caso di obesità o altre patologie favorenti il tromboembolismo, segnalazione dell’uso di estro-progestinici in caso di traumi o interventi chirurgici eccetera).
L‘efficacia delle comunicazioni di questo tipo, che hanno una valenza prevalentemente educativa e richiedono per questo un buon livello di condivisione di interesse per i temi trattati, dipende in larga misura dalla qualità della relazione
che si è costruita fra il sanitario e il paziente.
Dipende inoltre dal livello di ascolto che il paziente è in grado di dedicare alle parole del sanitario.
Per questo motivo è consigliabile che queste informazioni non vengano proposte durante la fase più attiva del processo decisionale, quella cioè in cui sia il sanitario sia la donna sono impegnati nella corretta collocazione delle informazioni sui rischi e sui vantaggi dell’assunzione di estro-progestinici nel meccanismo della bilancia decisionale, che non solo renderà possibile una decisione consapevole, ma favorirà anche la comparsa della motivazione a mantenere la decisione stessa.
In questa fase, che nella teoria degli stadi del processo del cambiamento descritta da Prochaska e Di Clemente, viene collocata fra lo stadio “precontemplativo” e quello “contemplativo”, il paziente non è pronto a decidere, o è ancora incerto
sulla decisione migliore da prendere.
Un eccesso di informazioni sui rischi o una aggiunta di indicazioni sui comportamenti da assumere a decisione avvenuta
possono prolungare la fase di incertezza e rallentare la decisione, o dar luogo a una pseudodecisione che non si consoliderà con il passaggio agli stadi successivi (determinazione e azione).
L’aggiunta di informazioni di tipo educativo va effettuata perciò preferibilmente dopo che il medico avrà concluso, e consolidato con un riassunto, la prima fase informativa e avrà valutato insieme alla donna a che punto è il processo decisionale.
È necessario segnalare in modo chiaro che si sta aprendo una nuova fase nel colloquio destinata a individuare e
condividere comportamenti consigliabili e sicuri , in modo da riattivare l’attenzione e migliorare l’ascolto.
18
È preferibile anche in questo caso un’attivazione basata su domande riflessive che portino l’attenzione della donna sui
comportamenti che lei già attua o che ritiene, per esperienza o sulla base di indicazioni già ricevute, utili e adeguati e per
ridurre il rischio di trombembolismo venoso: a partire dalle risposte della donna il sanitario inserirà gradualmente indicazioni che correggano, completino, integrino le ipotesi di comportamento della donna.
prevenzione tev
Nel caso in cui il medico decida di prescrivere il test, basandosi sulle raccomandazioni contenute in questa conferenza di consenso, viene più volte sottolineato che la prescrizione richiede un intervento di counselling pre test e un
intervento di counselling da svolgere al momento della comunicazione del risultato (counselling post test).
Interventi di questo tipo non coincidono con la semplice offerta di informazioni, ma richiedono una organizzazione
del colloquio basata su fasi ben precise, che riducano il rischio di malintesi, di errata interpretazione di un eventuale risultato positivo, di eccessiva rassicurazione in caso di esito negativo, eccetera.
A- Fase informativa (centrata sul presente)
1 - Comunicare alla donna la decisione del medico di prescrivere, in quel caso specifico, il/i test;
2 - fornire alcune informazioni su ciò che rende consigliabile quella scelta nel caso specifico (senza eccedere in argomentazioni scientifiche e senza anticipare il tema del significato dei risultati);
3 - chiedere alla donna se ha già informazioni riguardanti i test in oggetto;
4 - completare il quadro informativo sempre in modo selettivo, scegliendo cioè le informazioni realmente indispensabili
e sicuramente comprensibili.
B- Fase orientativa (centrata su ciò che avverrà da lì all’effettuazione del test)
5 - Fornire indicazioni chiare su ciò che la donna dovrà fare per effettuare il test ( dove andare, se il test richiede particolari condizioni, documenti necessari eccetera);
6 - chiedere se possono esserci difficoltà, o se qualcosa non è chiaro e fornire risposte esaurienti ma non eccessivamente ampie;
7 - dare se possibile indicazioni sui tempi di attesa fra il test e la comunicazione dei risultati.
C - Fase di preparazione all’interpretazione dei risultati ( centrata su ciò che avverrà dopo la comunicazione del risultato)
8 - Chiedere se la donna ha già qualche conoscenza sul tipo di risultati che forniscono test del genere;
9 - utilizzare la risposta per completare o correggere eventuali informazioni scorrette;
10 - aggiungere informazioni sul significato di un risultato positivo riducendo per quanto possibile le informazioni a
valenza “non”: le prime informazioni devono essere di tipo affermativo (il test indica predisposizione e non malattia, la possibilità che si verifichi un evento trombotico anche in donne positive è estremamente bassa, uno stile di vita corretto e l’assunzione di alcune precauzioni riduce ulteriormente il rischio, l’assunzione di estro-progestinico viene comunque consigliata nella grandissima maggioranza dei casi facendo attenzione al tipo di estro-progestinico che verrà scelto ); vanno evitate
spiegazioni basate su una negazione (non è sconsigliato l’uso di estro-progestinico, il testo positivo non significa
malattia eccetera) che spesso vengono memorizzate in modo errato;
11 - chiedere se in una ipotesi di questo tipo ( test positivo) la donna pensa di avere preoccupazioni o difficoltà di qualche tipo;
12 - scegliere fra le informazioni già fornite quelle più adatte a rispondere alle specifiche richieste della donna e ripeterle;
solo dopo fornire eventuali altre informazioni aggiuntive;
13 - aggiungere, sempre in termini affermativi, informazioni sul significato di un risultato negativo del test;
14 - concludere con un riassunto sintetico.
Se il colloquio pre test è stato effettuato correttamente, il colloquio post test si modellerà su di esso, partendo dal riassunto finale (punto 14) , che verrà ricordato a inizio colloquio. Le fasi saranno quindi:
1 - ripresa dei punti informativi essenziali forniti nel colloquio per test;
2 - breve esplorazione delle esigenze che la donna avverte dopo la lettura del risultato ( cosa vorrebbe sapere, cosa può
esserle utile, cosa non le è chiaro eccetera);
19
3 - consolidamento delle informazioni e delle indicazioni di comportamento già date in fase di pretest;
4 - indicazione delle tappe successive necessarie per condurre alla scelta di un estro-progestinico adeguato, per definire
momenti di controllo eccetera.
prevenzione tev
Nel caso in cui la donna insistesse per ottenere la prescrizione del test che il medico non ritiene invece di dover
prescrivere, la sola raccomandazione dal punto di vista comunicativo è quella di evitare una contrapposizione
sterile: il medico deve con assertività e convinzione esplicitare le ragioni della sua decisione, ma ovviamente non
ha né il potere né il mandato di impedire alla donna questa scelta o di esprimere giudizi negativi sulla sua decisione. Dovrà quindi effettuare ugualmente il counselling pre test e proporre (e rendere possibile) un counselling
post test effettuato da lui stesso o da un professionista da lui indicato.
Le modalità comunicative indicate non richiedono abitualmente tempi più lunghi rispetto a modalità più spontanee: si
basano su un principio di maggiore efficacia e in molti casi riducono i tempi necessari a correggere malintesi ed errori di
interpretazione.
Gruppo di lavoro
Responsabile scientifico
Alfonso Mele Istituto superiore di sanità – CNESPS, Reparto di epidemiologia clinica e
linee guida,
Roma
Relatori della conferenza
Emilio Arisi Unità operativa di ostetricia e ginecologia, Ospedale Regionale “S. Chiara”,
Trento
Vincenzina Bruni Università degli studi, Firenze
Benilde Cosmi Unità operativa di angiologia e malattie della coagulazione “Marino
Golinelli”, Azienda
ospedaliero-universitaria Policlinico S. Orsola-Malpighi, Bologna
Ernesto D’Aloja Medicina legale, Dipartimento di scienze giuridiche e forensi,
Università di Cagliari,
Cagliari
Valerio De Stefano Istituto di ematologia, Università Cattolica, Roma
Cristina Legnani Unità operativa di angiologia e malattie della coagulazione “Marino
Golinelli”, Azienda
ospedaliero-universitaria Policlinico S. Orsola-Malpighi, Bologna
Ida Martinelli Centro emofilia e trombosi “A. Bianchi Bonomi”, Fondazione IRCCS
Ospedale
Maggiore, Mangiagalli e Regina Elena, Università degli studi, Milano
Salvatore Panico Dipartimento di medicina clinica e sperimentale, Università degli studi Federico II, Napoli
Pio Enrico Ricci Bitti Dipartimento di psicologia, Università degli studi, Bologna
Coautori
Rosanna Abbate Medicina interna, Dipartimento area critica medico chirurgica, Centro trombosi, Azienda
ospedaliero universitaria Careggi, Università di Firenze
Giovanni Battista Allais Centro cefalee della donna, Dipartimento di discipline ginecologiche e ostetriche,
Azienda sanitaria ospedaliera Ospedale infantile regina Margherita-S. Anna, Università di Torino
Chiara Benedetto Dipartimento di discipline ginecologiche e ostetriche, Azienda sanitaria ospedaliera Ospedale infantile regina
Margherita-S. Anna, Università di Torino
Paolo Bucciarelli Centro emofilia e trombosi “A. Bianchi Bonomi”, Fondazione IRCCS Ospedale
Maggiore, Mangiagalli e Regina Elena, Università degli studi, Milano
Angelo Cagnacci Dipartimento integrato materno Infantile, Unità di ginecologia e ostetricia, Azienda
ospedaliero universitaria di Modena
Giancarlo Castaman Dipartimento di terapie cellulari ed ematologia, Centro malattie emorragiche e
trombotiche , Ospedale San Bortolo, Vicenza
Giovanni Cavalli Area ostetrico-ginecologica consultori familiari, Azienda sanitaria locale, Milano
Lino Del Pup Struttura operativa complessa di oncologia ginecologica, Istituto nazionale tumori, Centro
di riferimento oncologico, Aviano, Pordenone
Mariarosaria Di Tommaso Dipartimento di ginecologia, perinatologia e delle riproduzione umana, Università degli studi, Firenze
Fabio Facchinetti Dipartimento materno infantile, Università di Modena e Reggio Emilia
Tiziana Frusca Clinica ostetrica e ginecologica, Università degli studi, Brescia
Franca Fruzzetti I Clinica universitaria di ostetricia e ginecologia, Dipartimento della procreazione e
dell’età evolutiva, Ospedale S. Chiara, Pisa
20
Azienda ospedaliero universitaria di Modena e Reggio Emilia
Alberto Zambon Dipartimento di scienze mediche e chirurgiche, I Clinica medica, Policlinico
universitario, Università di Padova
Elvira Grandone Unità operativa di emostasi e trombosi, IRCCS
Casa sollievo della sofferenza, S. Giovanni Rotondo, Foggia
Paola Mandich Dipartimento di neuroscienze, oftalmologia e
genetica, Sezione di genetica medica,
Università di Genova
Maurizio Margaglione Genetica medica, Dipartimento di scienze biomediche, Università degli studi, Foggia
Marco Marietta Dipartimento di oncologia, ematologia e patologie dell’apparato respiratorio, Unità
operativa complessa di ematologia, Azienda ospedaliero universitaria di Modena
Pasquale Martinelli Cattedra di ginecologia e ostetricia,
Università degli studi Federico II, Napoli
Rossella Nappi Centro di ricerca per la medicina riproduttiva,
Dipartimento di scienze morfologiche,
eidologiche e cliniche e Unità di endocrinologia ginecologica,
IRCCS Fondazione Maugeri, Università degli studi, Pavia
Francesco Nonino CeVEAS, Modena
Simonetta Pagliani medico di medicina generale, Azienda sanitaria locale Milano 2 Melegnano
Anna Maria Paoletti Clinica ginecologica ostetrica e di fisiopatologia della riproduzione umana, Università
degli studi, Cagliari
Fabio Parazzini I Clinica ostetrico ginecologica, Università di
Milano
Paolo Simioni Dipartimento di scienze cardiologiche, toraciche
e vascolari, Clinica medica II, Università di Padova
Daniela Tormene Dipartimento di scienze mediche e chirurgiche, II Clinica medica, Azienda ospedaliera,
Università di Padova
Alberto Tosetto Divisione di ematologia, Centro malattie emorragiche e trombotiche , Ospedale San Bortolo, Vicenza
Andrea Tranquilli Dipartimento di scienze cliniche specialistiche, Università politecnica delle Marche,
Ancona
Armando Tripodi Centro emofilia e trombosi “A. Bianchi
Bonomi”, Fondazione IRCCS Ospedale
Maggiore, Mangiagalli e Regina Elena, Università degli studi,
Milano
Annibale Volpe Cattedra di ginecologia e ostetricia, Struttura
complessa di ostetricia e ginecologia,
Panel giuria
prevenzione tev
Roberto Satolli Editore Zadig, Milano
Sylvie Coyaud D di Repubblica, Milano
Piergiorgio Crosignani Università degli studi, Milano
Gianfranco Domenighetti Università italiana della Svizzera,
Lugano
Serena Donati Istituto superiore di sanità, Roma
Silvia Fargion Università degli studi, Milano
Patrizia Iaccarino Officina Napoli Cochrane, Napoli
Lucio Luzzatto Università di Firenze, Firenze
Marina Maggini Istituto superiore di sanità, Roma
Nicola Magrini CeVEAS, Modena
Pier Mannuccio Mannucci Università degli studi, Milano
Anna Maria Messa Repubblica salute, Roma
Raffaella Michieli Società Italiana di Medicina Generale (segretario nazionale), Venezia
Gualtiero Palareti Università degli studi, Bologna
Silvana Quadrino Istituto CHANGE, Torino
Comitato di scrittura
Roberto Satolli Editore Zadig, Milano
Patrizia Iaccarino Officina Napoli Cochrane, Napoli
Nicola Magrini CeVEAS, Modena
Pier Mannuccio Mannucci Università degli studi, Milano
Raffaella Michieli Società italiana di medicina generale (segretario nazionale), Venezia
Francesco Nonino CeVEAS, Modena
Gualtiero Palareti Università degli studi, Bologna
Silvana Quadrino Istituto CHANGE, Torino
(la bibliografia viene fornita a richiesta; è comunque reperibile al
sito internet
http://www.pnlg.it/cms/files/CC_trombofilia_def_0.pdf)
21
malattie intestinali
Il recente Congresso di Grado (28.5.2009) organizzato dal Ceformed nell’ambito della formazione permanente dei MMG e
PLS del Friuli-Venezia Giulia è stato dedicato alle malattie infiammatorie dell’intestino e alla celiachia, poiché era sentito
diffusamente (anche da parte delle organizzazioni dei pazienti) il bisogno di un aggiornamento delle conoscenze in materia da parte dei medici delle cure primarie, che potesse poi riverberarsi in un auspicato miglioramento della gestione quotidiana. Nell’attesa del CD audio-video integrale del Congresso, e poiché “verba volant sed scripta manent”, “Medicina e
Sanità” ritiene utile ai fini pratici per il MMG fornire qui una sintesi scritta delle attuali evidenze scientifiche sull’argomento
integrata dai concetti fondamentali presentati al Congresso.
CONSENSO EUROPEO
SULLA DIAGNOSI E LA TERAPIA DELLA
RETTOCOLITE ULCEROSA E DEL MORBO DI CROHN
European Crohn’s and Colitis Organisation (ECCO) 2006-2008
RETTOCOLITE ULCEROSA
Definizione: La rettocolite ulcerosa è una condizione infiammatoria cronica che caratterizzata da una flogosi della
mucosa del colon senza granulomi alla biopsia, interessa il retto e una variabile porzione del colon in continuità, ed è caratterizzata da un andamento di solito ricorrente e remittente.
La colite da classificare è il termine utilizzato per la minoranza di casi in cui una distinzione definitiva tra colite ulcerosa,
morbo di Crohn, o altre cause di colite non può essere effettuata in base alla storia, aspetto endoscopico, istopatologie di
biopsie multiple del colon e indagini radiologiche appropriate. La colite indeterminata è un termine riservato ai patologi per
descrivere un campione di colon da colectomia con aspetti di sovrapposizione tra colite ulcerosa e morbo di Crohn.
Diagnosi differenziale tra rettocolite ulcerosa e morbo di Crohn
Aspetti clinici
Rettorragie
Muco o pus nelle feci
Interessamento del tenue
Interessamento del tratto digerente superiore
Masse addominali
Rettocolite ulcerosa
Morbo di Crohn
Comuni
Comuni
No (eccetto l’ileite da reflusso)
No
Rare
Rare
Rari
Sì
Sì
Talvolta nel quadrante
inferiore destro
Comuni
Comune
Comune
Comuni
Rara
Comune (≥ 50%)
Sì
Non comune
Sì
Sì
Comuni
Peggioramento
Manifestazioni extra-intestinali
Ostruzione del tenue
Ostruzione del colon
Fistole e ascessi perianali
Positività degli ANCA-p
Positività degli ASCA
Infiammazione transmurale
Distorsione dell’architettura delle cripte
Criptite e ascessi criptici
Granulomi
Fissure e “skip lesions”
Effetto del fumo di tabacco
Comuni
Rara
Rara
No
Comune (70%)
Rara
No
Sì
Sì
No
Rari
Miglioramento
(Daniel C Baumgart, William J Sandborn, Lancet 2007; 369: 1641–57, modificata)
La diagnosi di rettocolite ulcerosa si basa sull’endoscopia e sull’istologia. A volte è necessario escludere cause infettive o non infettive di colite.
22
Infettive
Batteriche: Campylobacter spp, Salmonella, Shigelle, Clostridium difficile, Escherichia coli enterotossigena, Yersinia
spp, gonococchi, Chlamydia trachomatis, Mycobacterium tuberculosis, micobatteri atipici
Parassitarie: Entamoeba histolytica, Cryptospora spp, Isospora spp, Trichuris trichura, strongiloide
Non infettive
Infiammatorie: diverticolite, colite microscopica (collagenosa e linfocitica), gastroenterite eosinofila, malattia graft
versus host, colite attinica, sindrome di Behçet, sarcoidosi
Tossiche: colite post-diversione chirurgica del colon, colite da perdita di sali biliari, da FANS e altri farmaci, da uso e
abuso di lassativi, da chemioterapia antiblastica
Maligne: cancro colorettale, cancro del tenue, tumori neuroendocrini, linfomi del tenue, tumori metastatici
Vascolari: colite ischemica, vasculite
(Daniel C Baumgart, William J Sandborn, Lancet 2007; 369: 1641–57, modificata)
CLASSIFICAZIONE DELLA RETTOCOLITE ULCEROSA:
malattie intestinali
Cause di enterite e colite diverse dalla rettocolite ulcerosa e dal morbo di Crohn
L’estensione della rettocolite ulcerosa influenza il trattamento del paziente, in particolare le modalità di trattamento e
determina se iniziare una terapia orale e/o topica, il momento d’inizio della terapia e la frequenza della sorveglianza. Si raccomanda quindi una classificazione sulla base delll’estensione della rettocolite ulcerosa, per esempio con la classificazione
di Montreal in proctite ulcerosa (limitata al retto), rettocolite sinistra (fino alla flessura splenica) e rettocolite estesa.
La classificazione della rettocolite ulcerosa sulla base dell’attività della malattia è utile nella pratica clinica e determina il
trattamento. La severità di malattia influenza le modalità di trattamento e determina se non dev’essere iniziata ancora alcuna terapia, o dev’essere effettuata una terapia topica, orale, endovenosa o chirurgica. Gli indici di severità della malattia non
sono ancora adeguatamente validati, ma comprendono parametri clinici, di laboratorio, radiologici ed endoscopici.
Attività della rettocolite ulcerosa
(Truelove e Witts 1985, modificata)
Evacuazioni con o senza sangue/die
Frequenza cardiaca (battiti/minuto)
Febbre (°C)
Emoglobina (g/dl)
VES (mm/ora)
LIEVE
MEDIA
SEVERA
<4
< 90
< 37,5
> 11,5
Normale
4-6
>6
> 90
> 37,8
< 10,5
> 30
< 37,8
> 10,5
< 30
Remissione = ritorno alla normalità clinica, con completa scomparsa dei sintomi (< 3 evacuazioni/die senza sangue)
e guarigione della mucosa del colon all’endoscopia
La classificazione della rettocolite ulcerosa in base all’età di esordio non è utile. È invece importante stabilire la presenza
di una concomitante colangite primaria sclerosante, poiché, aumentando il rischio associato di cancro colo-rettale,
influenza la sorveglianza endoscopica del paziente.
Non ci sono prove per raccomandare l’uso di routine di marker molecolari (genetici, come HLA, ecc. o sierologici, per es.
ANCA, ASCA, ecc.) per la classificazione dei pazienti con rettocolite ulcerosa.
ASPETTI CLINICI E FATTORI DI RISCHIO:
I sintomi della rettocolite ulcerosa dipendono dall’estensione e dalla severità della malattia, e molto spesso includono:
❏ Diarrea sanguinolenta
❏ Rettorragie
❏ Urgenza e tenesmo rettale
❏ Defecazione notturna
23
malattie intestinali
La diarrea (o l’evacuazione di feci molli) per più di 6 settimane differenzia la rettocolite ulcerosa dalla maggior parte delle
diarree infettive. L’esordio della rettocolite ulcerosa è di solito insidioso; i sintomi sono spesso presenti per settimane o
mesi prima della diagnosi. Non frequenti sono i dolori crampiformi addominali e dolorabilità in fossa iliaca sinistra alleviati
dalla defecazione. I sintomi sistemici quali malessere, anoressia, nausea, vomito, febbre, calo ponderale, tachicardia sono
espressione di un attacco severo. La comparsa di fistole perianali ricorrenti o complesse deve fare sospettare sempre un
morbo di Crohn. Nel 10% dei casi ci sono manifestazioni extra-intestinali quali artropatie assiali o periferiche, episclerite ed
eritema nodoso; raramente precedono i sintomi intestinali. Il tromboembolismo è più frequente che nella popolazione
generale, spesso associato a colite estesa e malattia attiva.
Il fumo di tabacco esercita un effetto protettivo nei confronti dello sviluppo di rettocolite ulcerosa ed è associato ad un
decorso più lieve della malattia. Gli ex fumatori hanno invece un rischio aumentato del 70% di sviluppare la malattia, la quale
è spesso più estesa e grave che nei non fumatori.
L’appendicectomia fornisce una qualche protezione se viene eseguita per una “vera appendicite” in età giovanile, prima
dell’esordio della malattia.
L’uso di FANS non selettivi è probabilmente associato al rischio di esacerbazione della malattia, mentre il trattamento a
breve termine con Coxib è probabilmente sicuro.
Una storia familiare di rettocolite ulcerosa o di morbo di Crohn nei parenti di primo grado aumenta di 10-15 volte il
rischio di rettocolite ulcerosa in un altro membro della famiglia.
Fattori psicosomatici:
La rettocolite ulcerosa sembra dovuta all’interazione tra fattori genetici, fattori ambientali (soprattutto flora batterica
intestinale) e tipo di risposta immunitaria.
L’associazione causale presunta tra soli fattori psicologici e comparsa della rettocolite ulcerosa non può essere dimostrata. I disturbi psicologici (soprattutto la depressione) sembrano essere la conseguenza della rettocolite ulcerosa piuttosto
che la sua causa, né sono specifici per questa malattia. C’è tuttavia un’influenza del disagio psichico e dei disturbi dell’umore sul decorso della malattia, per la quale rappresentano anche fattori di rischio di ricaduta. È controverso se anche eventi
esistenziali avversi acuti possano riscatenare la malattia. Tuttavia la maggior parte dei pazienti ritiene che lo stress influenzi
la propria malattia.
Il grado dei disturbi psichici si correla quindi con la severità della malattia, predice la qualità di vita, e influenza il decorso
della malattia.
Il MMG deve valutare accuratamente lo stato psichico dei pazienti, e in particolare la presenza di depressione, sia nei soggetti con malattia attiva che in remissione. Le conseguenze psicologiche della malattia vanno sempre prese in considerazione nelle visite di controllo. Se il paziente lo richiede, va indirizzato a un appropriato trattamento psicoterapico, ove disponibile.
I pazienti devono essere informati dell’esistenza di associazioni di auto-aiuto di soggetti affetti dalla stessa malattia.
ANAMNESI ED ESAME OBIETTIVO:
L’anamnesi deve indagare l’inizio dei sintomi, particolarmente episodi ricorrenti di rettorragia o diarrea muco-sanguinolenta, urgenza, tenesmo, incontinenza fecale, diarrea notturna, dolore addominale, e aspetti di manifestazioni extra-intestinali. Devono essere inoltre indagati l’effettuazione di viaggi recenti, le intolleranze alimentari, i contatti con casi di diarree
infettive, l’uso di farmaci (soprattutto antibiotici e FANS), l’abitudine al fumo, le pratiche sessuali, la pregressa appendicectomia, la storia familiare di malattie infiammatorie intestinali.
L’esame obiettivo deve determinare lo stato di cenestesi, la frequenza cardiaca, la temperatura corporea, l’indice di
massa corporea, la presenza di distensione e dolorabilità addominale, l’aspetto del perineo. Devono essere eseguite l’esplorazione rettale, l’esplorazione della cavità orale, l’esame degli occhi, della cute e delle articolazioni. L’esame obiettivo può
essere normale o non significativo in caso di malattia lieve o moderata.
LA DIAGNOSI DI RETTOCOLITE ULCEROSA:
La diagnosi deriva da una combinazione di anamnesi + valutazione clinica + reperti endoscopici e istologici tipici
(questi ultimi sono essenziali). Dev’essere sempre esclusa una causa infettiva e non infettiva di colite. Se la diagnosi è dubbia, è necessaria una conferma endoscopica + istologica dopo un intervallo di tempo.
La storia natura della rettocolite ulcerosa è caratterizzata da episodi di ricadute e remissioni nel 90% dei casi; la frequenza di ricadute viene valutata nell’arco dei primi 3 anni; le ricadute possono essere frequenti (≥ 2/anno) o infrequenti (=
1/anno).
24
La diagnosi viene cambiata in malattia di Crohn entro 5 anni nel 10% dei casi.
malattie intestinali
Nel 5% dei pazienti il decorso è di tipo continuo, senza remissioni. In un altro 5% si ha un singolo episodio acuto seguito
da una prolungata remissione.
Gli esami di laboratorio e strumentali iniziali devono comprendere:
❏ Routine ematochimica (emocromo, glicemia, creatininemia, elettroliti, bilirubinemìa totale, transaminasi, gamma GT,
fosfatasi alcalina, proteine totali e protidogramma )
❏ sideremia, capacità ferro-legante della transferrina
❏ PCR, VES
❏ Esame delle feci per calprotectina fecale, tossina di Clostridium difficile, esame microbiologico/parassitologico
❏ TSH e anticorpi anti-tireoglobulina/tireoperossidasi
❏ ANCA-p (anticorpi anti-citoplasma dei neutrofili di tipo periferico) e ASCA (anticorpi anti-Saccharomyces cerevisiae)
❏ Ecografia dell’addome e pelvi
Calprotectina fecale
❏ È una proteina legante il calcio derivante dai neutrofili e, in minor misura, dai monociti-macrofagi attivati. Ha proprietà batteriostatiche e fungistatiche
❏ Costituisce il 60% circa delle proteine del citoplasma dei neutrofili
❏ Facile da misurare nelle feci (test ELISA quantitativo); nelle feci la calprotectina resta stabile a temperatura ambiente per 3-7 giorni
❏ Indice aspeficico di “infiammazione intestinale”: viene proposta per discriminare la malattie organiche dell’intestino (con infiltrazione di neutrofili) da quelle funzionali (per esempio il colon irritabile, senza infiltrazione di neutrofili)
❏ Non è specifica però per il tipo di malattia infiammatoria intestinale
❏ il limite di normalità è di < 50 mcg/grammo di feci (nei bambini < 1 anno i valori normali sono più elevati fino a 10
volte); valori nell’adulto > 50 mcg/grammo di feci sono compatibili (sensibilità 84%, specificità 95%) con un enterite o colite di natura da determinare - vedi la classificazione sopra - e indicano la necessità di ulteriori indagini
❏ La concentrazione nelle feci varia con l’uso di FANS, l’età, la contaminazione delle feci con sangue
❏ Incostante aumento in caso di celiachia, neoplasie, colite microscopica, ischemia intestinale, diverticolite
❏ I livelli di calprotectina fecale si correlano con il grado di attività delle malattie infiammatorie intestinali, determinato sia a livello endoscopico (macroscopico) che istopatologico, ed sono in grado di anticipare le ricadute della
malattia con una sensibilità del 90% e una specificità dell’83%
In caso di sospetta rettocolite ulcerosa è necessaria l’esecuzione di una ileo-pancolonscopia, preferibilmente con ileoscopia, con prelievi multipli di mucosa (almeno 2 campioni, da 5 siti, compreso il retto e l’ileo), al fine di stabilire la diagnosi
e l’estensione della malattia.
I pazienti con attacco severo devono essere ospedalizzati e sottoposti a radiografia diretta dell’addome e a rettosigmoidoscopia, evitando la preparazione dell’intestino che può produrre perforazione (la gestione spetta allo specialista).
Abitualmente non sono necessari esami radiologici dell’intestino tenue, tranne nei casi di difficoltà diagnostica all’endoscopia + biopsia (casi da discutere tra specialista gasteoenterologo e radiologo)
I reperti endoscopici caratteristici della rettocolite ulcerosa sono:
❏ L’interessamento continuo e confluente della mucosa del colon a partire dal retto, con chiara demarcazione rispetto
alla mucosa normale
❏ La presenza di ulcere di grandezza diversa
❏ L’eritema diffuso della mucosa
❏ La friabilità e il facile sanguinamento del tessuto
La pancolonscopia di routine non è necessaria nei pazienti con rettocolite ulcerosa in fase di remissione, se non nei controlli periodici previsti dal programma di sorveglianza. La rivalutazione endoscopica è invece appropriata in caso di ricaduta,
o in caso di rettocolite steroido-dipendente o refrattaria o se viene presa in considerazione una colectomia.
La colonscopia virtuale è una tecnica in evoluzione. I dati limitati attuali non dimostrano un suo valore diagnostico nello
stabilire l’estensione della malattia nei pazienti con rettocolite ulcerosa sospettata o diagnosticata.
Il reperto di stenosi del colon in un paziente con rettocolite ulcerosa deve fare sospettare un carcinoma colorettale:
vanno eseguite biopsie multiple e va richiesta una consulenza chirurgica.
25
malattie intestinali
Istopatologia della rettocolite ulcerosa:
❏
❏
❏
❏
❏
❏
❏
❏
Plasmocitosi basale (= Infiltrazione plasmacellulare della parte profonda della lamina propria o sotto le cripte)
Diffusa, massiva infiltrazione cellulare infiammatoria della lamina propria
Diffuse irregolarità architetturali delle cripte, ridotto numero o atrofia delle cripte
Distorsione diffusa della mucosa o delle cripte, atrofia della mucosa o superficie mucosa villosa o irregolare
Aumento generale di neutrofili nelle cripte (ascessi criptali) o nella lamina propria (malattia attiva)
Assenza di granulomi
Gradiente decrescente di infiammazione dal retto-colon distale al colon prossimale
Severa diffusa deplezione di mucina (malattia attiva)
PRINCIPI GENERALI DI TRATTAMENTO DELLA RETTOCOLITE ULCEROSA:
I principi generali da considerare nel trattamento della rettocolite ulcerosa sono:
❏ Il grado di attività della malattia
❏ La distribuzione della malattia (proctite – colite sinistra – colite estesa)
❏ Il tipo di decorso della malattia (frequenza delle ricadute, decorso delle fasi attive, risposta ai precedenti trattamenti,
effetti collaterali, manifestazioni extra-intestinali)
Proctite lieve o moderatamente attiva:
La mesalazina (5- ASA) topica (supposte da 1 g/die o microclimi di schiuma rettale, meno efficaci e meno tollerati) è il
trattamento iniziale di scelta. Produce remissione clinica ed endoscopica entro 2 settimane del 64% e 52% dei pazienti,
rispettivamente. Gli steroidi topici (per esempio beclometasone dipropionato, Topster® 2 supposte da 3 g/die o schiuma
rettale; Clipper® o Klostenal® clismi, idrocortisone, Colifoam® schiuma rettale) sono di seconda scelta, poiché meno efficaci, e vanno usati nei pazienti intolleranti alla mesalazina topica. Se efficace il trattamento va proseguito per almeno 4 settimane e fino a remissione.
È efficace pure la combinazione di mesalazina topica + corticosteroidi topici.
La sola mesalazina orale è meno efficace della terapia topica o combinata.
La combinazione di mesalazina topica e mesalazina orale, oppure di corticosteroide topico e mesalazina orale è più efficace della sola terapia topica, e dev’essere considerata nell’escalation del trattamento.
Pertanto, i pazienti che non migliorano con preparati topici di mesalazina o corticosteroidi devono essere trattati anche
con mesalazina orale o, in alternativa, con prednisone orale, come se la colite fosse più estesa o severa.
I dati attuali non suggeriscono differenze significative di efficacia tra i nuovi aminosalicilati impiegati nella rettocolite
ulcerosa attiva (mesalazina nelle varie preparazioni farmaceutiche a rilascio controllato, a pH 7 o pH 6 - dipendenti, balsalazide, olsalazina). Tuttavia la mesalazina è meglio tollerata della sulfasalazina.
Rettocolite sinistra:
La colite sinistra di lieve o moderata entità dev’essere trattata inizialmente con mesalazina topica combinata con
mesalazina orale (> 2000 mg/die).
I preparati topici di mesalazina o corticosteroidi o la sola mesalazina orale sono meno efficaci della terapia di combinazione.
I corticosteroidi per via sistemica sono appropriati se i sintomi di colite non rispondono rapidamente alla terapia di combinazione. I corticosteroidi a rilascio colico e a bassa biodisponibilità sistemica (beclometasone dipropionato, Clipper®
cpr RM 5 mg, o budesonide, Entocir® cpr RM 3 mg) sono praticamente privi degli effetti sistemici abituali dei cortisonici e
hanno un effetto simile alla mesalazina orale alla dose di 2400 mg.
Una colite sinistra severa è un’indicazione al ricovero ospedaliero.
Rettocolite ulcerosa estesa:
La rettocolite ulcerosa estesa di lieve o moderata severità dev’essere trattata inizialmente con mesalazina orale (> 2000
mg/die) combinata con mesalazina topica (1 g/die). L’uso di aminosalicilati solo per via orale induce remissione soltanto
in una minoranza di pazienti.
I corticosteroidi sistemici sono appropriati se i sintomi di colite attiva non rispondono rapidamente (entro 2 settimane)
alla mesalazina o se il paziente riceve già una terapia di mantenimento appropriata (> 2000 mg/die di mesalazina o immunomodulatori).
26
malattie intestinali
Un regime appropriato può essere quello con prednisolone (Medrol® cpr 16 mg): 3 compresse per la prima settimana, 2
compresse per la seconda settimana, 1 compressa per il mese successivo e quindi riduzione della dose di 4 mg ogni settimana.
Terapie con corticosteroidi inferiori alle 3 settimane o con dosi < 16 mg/die di prednisone sono inefficaci in caso di
malattia attiva. I corticosteroidi a rilascio colico e a bassa biodisponibilità sistemica (beclometasone dipropionato,
Clipper® cpr RM 5 mg, o budesonide, Entocir® cpr RM 3 mg: 3 cpr/die) sono praticamente privi degli effetti sistemici abituali dei cortisonici e sembrano efficaci, ma ci sono ancora scarsi dati.
Una colite estesa severa è un’indicazione al ricovero ospedaliero.
Rettocolite ulcerosa severa di qualsiasi estensione:
La rettocolite ulcerosa severa, di qualsiasi estensione, è una condizione di rischio per la vita e va ospedalizzata.
Trattamento delle ricadute di rettocolite ulcerosa:
I pazienti con ricadute vanno trattati di solito con la terapia che precedentemente era efficace, tuttavia vanno considerati i seguenti fattori:
❏ Effetti collaterali della precedente terapia
❏ Rapidità di effetto
❏ Convenienza
❏ Tempo di ricaduta
❏ Terapia concomitante (ricaduta in corso di trattamento con immunomodulatori o meno)
❏ Aderenza alla precedente terapia
Ogni paziente che ricade entro 3 mesi dopo una terapia che aveva indotto la remissione va trattato con azatioprina
(Azatioprina Wellcome® cpr 50 mg: 2,5 mg/kg/die) o mercaptopurina (Purinethol®, cpr 50 mg: 1,5 mg/kg/die), con il fine
di ridurre ulteriori ricadute precoci. Non è chiaro se la terapia che induce nuovamente la remissione vada poi continuata più
a lungo e ridotta più lentamente, o se debba essere a dosi maggiori sia in fase di induzione che di mantenimento.
Trattamento della rettocolite ulcerosa steroido-dipendente e steroido-refrattaria::
La rettocolite ulcerosa è definita “steroido-dipendente” quando :
❏ Non si riesce a ridurre la dose di corticosteroidi al di sotto di 10 mg/die di prednisolone (o dosi equivalenti di altri cortisonici) entro 3 mesi dall’inzio della terapia cortisonica, a causa della ricorrenza di malattia attiva, oppure:
❏ C’è una ricaduta entro 3 mesi dalla fine della terapia con corticosteroidi.
La rettocolite ulcerosa è definita “steroido-refrattaria” quando i pazienti hanno una malattia attiva nonostante l’assunzione di una dose di prednisolone fino a 0,75-1 mg/kg/die o equivalenti per un periodo di 4 settimane.
La rettocolite ulcerosa steroido-dipendente o steroido-refrattaria è di pertinenza specialistica: va trattata con azatioprina o
mercaptopurina (vedi sopra). La terapia con infliximab (Remicade®, fiale e.v. ad uso ospedaliero da 100 mg: induzione con 5
mg/kg a 0, 2 e 6 settimane, seguite da terapia di mantenimento ogni 8 settimane per un anno) o con adalimumab (Humira®)
è utilizzabile nei pazienti con rettocolite ulcerosa steroido-dipendente o steroido-refrattaria e nei pazienti che non rispondono
all’azatioprina e mercaptopurina. Questi farmaci sono agenti biologici (anticorpi monoclonali anti-Tumor Necrosis Factor alfa) di
per sé abbastanza ben tollerati, ma che comportano nel tempo il rischio di infezioni serie, malattie demielinizzanti e forse di
neoplasie. Possono essere anche considerati altri farmaci, di pertinenza specialistica o l’opzione chirurgica.
LA SORVEGLIANZA DEL CANCRO COLO-RETTALE NELLA RETTOCOLITE ULCEROSA:
I pazienti con rettocolite ulcerosa di lunga durata hanno un rischio aumentato di cancro colo-rettale rispetto alla popolazione generale. Tuttavia tale rischio, elevato nelle indagini epidemiologiche più antiche (+18% dopo 30 anni di malattia),
sembra un po’ ridimensionato nelle indagini più recenti (+2,5%; +7,5%), probabilmente grazie all’uso più esteso di aminosalicilati, al miglioramento del controllo periodico della mucosa, all’effettuazione di colectomie in tempo utile.
Il rischio è massimo nei soggetti con colite estesa, intermedio nei soggetti con colite sinistra, mentre non è aumentato
nei soggetti con sola proctite ulcerosa.
L’’infiammazione persistente ≥ 12 mesi (compresa l’ileite da reflusso) e la familiarità per cancro colo-rettale contribuiscono ulteriormente al rischio.
La presenza di pseudo-polipi del colon, markers di gravità dell’infiammazione, raddoppia il rischio di cancro colorettale.
I pazienti con rettocolite ulcerosa iniziata in età precoce (< 20 anni) o associata a colangite sclerosante primitiva (rischio
7 x) hanno un rischio particolarmente aumentato di cancro colo-rettale.
Il rischio di cancro colo-rettale inizia ad aumentare 8-10 anni dopo l’esordio dei sintomi di rettocolite ulcerosa, e sale
ulteriormente nelle successive decadi di malattia.
27
malattie intestinali
La colonscopia periodica di sorveglianza può permettere la diagnosi precoce di cancro colo-rettale, con conseguente
miglioramento della sua prognosi, anche se manca l’evidenza inoppugnabile che la colonscopia di sorveglianza prolunghi la
sopravvivenza nei pazienti con rettocolite ulcerosa.
Pertanto, un’iniziale colonscopia di screening dev’essere proposta a tutti i pazienti dopo 8-10 anni dall’esordio dei
sintomi clinici di rettocolite ulcerosa, per rivalutare l’estensione della malattia (fattore influente sul rischio di cancro
colo-rettale).
Successivamente, nella rettocolite estesa dev’essere effettuata una colonscopia di sorveglianza ogni 2 anni fino ai
20 anni di malattia, e in seguito ogni anno.
Nella rettocolite sinistra l’iniziale colonscopia di screening può essere effettuata dopo 15 anni dall’esordio dei sintomi
nella colite solo sinistra.
La colonscopia di screening non è necessaria nei pazienti con sola proctite ulcerosa.
Gli intervalli possono essere più brevi nei pazienti con colangite sclerosante primitiva (colonscopia di sorveglianza
annuale a partire dalla sua diagnosi) o altri fattori di grave rischio.
Il reperto di displasia grave in una mucosa piatta o di adenocarcinoma in seguito a una colosonscopia di screening rappresenta un’indicazione alla procto-colectomia. Il reperto di una displasia di basso grado in una mucosa piatta rappresenta
un’indicazione a procto-colectomia o alla ripetizione di colonscopia con biopsie entro 3-6 mesi.
La chemioprevenzione con 5-aminosalicilati può ridurre l’incidenza di cancro colo-rettale nei pazienti con rettocolite
ulcerosa e dev’essere presa in considerazione in tutti i pazienti. Il NNT (numero di pazienti da trattare per evitare un caso) è
di 7 a 30 anni di malattia.
Nei pazienti con colangite sclerosante primitiva va effettuata la chemioprevenzione del cancro del colon con acido ursodesossicolico.
RETTOCOLITE ULCEROSA:
MESSAGGI CHIAVE PER IL MEDICO DI MEDICINA GENERALE
(a cura di Luigi Buri, Alberto Giammarini Barsanti, Dario Bianchini)
Quando il MMG deve sospettarla?
1. Diarrea con sangue misto alle feci, spesso muco, da varie settimane
2. In genere non dolore. E.O. non diagnostico
3. Persona spesso giovane
Che cosa deve chiedere il MMG in caso di sospetto?
1. Esami del sangue con indici di flogosi, ormoni tiroidei, anticorpi anti-transglutaminasi, ANCA-p e ASCA
2. Esame delle feci (microbiologico) e calprotectina fecale
3. Ecografia addome e e pelvi
4. Colonscopia con biopsie per sospetta colite ulcerosa (se diarrea profusa il MMG lascia la decisione allo specialista)
5. Visita specialistica gastroenterologica o ricovero se diarrea e sanguinamento profuso
Che cosa il MMG deve attendersi dallo Specialista?
1. Diagnosi: estensione e gravità della malattia
2. Stazione completa della malattia: intestinale ed extraintestinale
3. Impostazione della terapia
Come dev’essere organizzato il follow-up?
1. Il follow-up è essenzialmente specialistico con visite periodiche: il MMG dev’essere informato dei controlli e
delle terapie
2. Per la sola proctite in terapia con mesalazina è sufficiente la sola gestione del MMG
3. Il MMG controlla la compliance e monitora gli effetti collaterali delle terapie (mesalazina, corticosteroidi,
immunosoppressori): se necessario allerta lo Specialista
4. Se ricomparsa/aggravamento di sintomi intestinali o extraintestinali il MMG allerta lo Specialista. Il MMG può
aumentare la mesalazina sino a 4800 mg/die, aggiungere di mesalazina o iniziare ciclo di Deltacortene 40-60
mg/die o 0,75-1 mg/kg/die
28
Definizioni:
malattie intestinali
MORBO DI CROHN:
Il morbo di Crohn è una malattia infiammatoria cronica transmurale della mucosa che può interessare ogni tratto del
tubo digerente dalla bocca all’ano, derivante dall’interazione tra fattori genetici, ambientali e risposta immunitaria, presente
soprattutto nelle zone sviluppate del mondo. La presentazione tipica comprende il coinvolgimento discontinuo di varie
parti del tubo digerente e lo sviluppo di complicazioni, quali stenosi, ascessi o fistole. L’etiologia precisa è ignota, il trattamento causale non è oggi disponibile
Alla diagnosi, la malattia è localizzata:
❏ All’ileo terminale: 47% dei casi
❏ Al colon: 28% dei casi
❏ All’ileo-colon: 21% dei casi
❏ Alle vie digerenti superiori: 3%
Si definisce “morbo di Crohn localizzato” se interessa < 30 cm del tubo digerente (di solito la valvola ileo-ciecale e il
colon destro), “morbo di Crohn esteso” se interessa > 100 cm del tubo digerente, in qualsiasi sede.
Morbo di Crohn attivo: definito in base al CDAI (Crohn’s Disease Activity Index):
❏ Lieve (CDAI 150-220): pazienti non ospedalizzati in grado di tollerare l’alimentazione orale senza manifestazioni di
disidratazione, né tossicità, dolorabilità addominale, masse addominali dolenti, occlusione intestinale o calo ponderale > 10%, proteina C-reattiva aumentata sopra i limiti della norma.
❏ Moderato (CDAI 220-450): mancata risposta al trattamento della malattia lieve-moderata, sintomi più marcati di febbre, calo ponderale > 10%, dolenzia/dolorabilità dell’addome, nausea o vomito intermittenti, ma non occlusione vera
e propria, o anemia significativa. Proteina C-reattiva aumentata sopra i limiti della norma.
❏ Severo (CDAI > 450): sintomi persistenti nonostante terapia intensiva con corticosteroidi, febbre elevata, vomito persistente, quadro di occlusione intestinale, dolorabilità di rimbalzo, cachessia (BMI < 18 kg/m2) o presenza di un
ascesso. Proteina C-reattiva marcatamente aumentata.
Remissione: Valore di CDAI < 150
Risposta alla terapia: riduzione del valore di CDAI di almeno 100 punti
Ricaduta: Riacutizzazione dei sintomi in un paziente con morbo di Crohn diagnosticato e in remissione clinica, spontanea
o dopo trattamento. La ricaduta dev’essere confermata dai parametri di laboratorio, dall’imaging diagnostico e dall’endoscopia. Il CDAI dev’essere ≥ 150 punti con un aumento di 100 punti rispetto al valore basale. Viene definita “precoce” la ricaduta
entro 3 mesi dalla remissione. Circa il 50% dei pazienti hanno una ricaduta nell’anno successiva a una riacutizzazione.
La ricaduta può essere infrequente (≤ 1/anno), frequente (≥ 2/anno) o continua (sintomi persistenti senza periodi di
remissione).
29
malattie intestinali
Morbo di Crohn steroido-refrattario: Paziente con malattia attiva nonostante terapia con prednisolone alla dose di 0,75
mg/kg/die (o dosi equivalenti di altri corticosteroidi) per 4 settimane.
Morbo di Crohn steroido-dipendente: Pazienti che:
1. Non possono ridurre la dose di prednisolone al di sotto di 10 mg/die o di budesonide sotto i 3 mg/die entro 3 mesi
dall’inizio della terapia corticosteroidea senza avere una ricaduta della malattia
e/o
2. hanno una ricaduta entro 3 mesi dalla sospensione della terapia con corticosteroidi
DIAGNOSI CLINICA E STRUMENTALE DEL MORBO DI CROHN:
I sintomi di morbo di Crohn sono eterogenei, ma di solito comprendono diarrea per più di 6 settimane, dolore addominale, e/o calo di peso. Questi sintomi devono fare porre il sospetto di morbo di Crohn, soprattutto nei pazienti giovani.
Sono pure comuni sintomi sistemici quali malessere, anoressia e febbre. Sangue e muco nelle feci sono meno frequenti che
nella rettocolite ulcerosa. Fistole perianali sono presenti nel 10% dei pazienti al momento della diagnosi iniziale (e una
malattia perianale compare nel 20-80% dei pazienti durante la storia della malattia). I sintomi extraintestinali (artropatie
assiali o periferiche, episclerite ed eritema nodoso) sono frequenti nel morbo di Crohn a localizzazione colica.
Non esiste un singolo gold standard per la diagnosi di morbo di Crohn: la diagnosi deriva dalla combinazione della clinica + esami endoscopici con biopsie + esami radiologici + esami di laboratorio.
L’anamnesi deve indagare l’inizio dei sintomi, particolarmente dolore addominale, febbre, calo ponderale, sintomi notturni, ascessi o fistole perianali, e aspetti di manifestazioni extra-intestinali. Devono essere inoltre indagati l’effettuazione di
viaggi recenti, le intolleranze alimentari, i contatti con casi di diarree infettive, l’uso di farmaci (soprattutto antibiotici e
FANS), l’abitudine al fumo, le pratiche sessuali, la pregressa appendicectomia, la storia familiare di malattie infiammatorie
intestinali.
L’esame obiettivo deve determinare lo stato di cenestesi, la frequenza cardiaca, la temperatura corporea, l’indice di
massa corporea, la presenza di distensione e dolorabilità addominale, l’aspetto del perineo. Devono essere eseguite l’esplorazione rettale, l’esplorazione della cavità orale, l’esame degli occhi, della cute e delle articolazioni.
Gli esami di laboratorio e strumentali iniziali devono comprendere, come per il sospetto di rettocolite ulcerosa:
❏ Routine ematochimica (emocromo, glicemia, creatininemia, elettroliti, bilirubinemìa totale, transaminasi, gamma GT,
fosfatasi alcalina, proteine totali e protidogramma )
❏ sideremia, capacità ferro-legante della transferrina
❏ PCR, VES
❏ Esame delle feci per calprotectina fecale, tossina di Clostridium difficile, esame microbiologico/parassitologico
❏ TSH e anticorpi anti-tireoglobulina/tireoperossidasi
❏ ANCA-p (anticorpi anti-citoplasma dei neutrofili di tipo periferico) e ASCA (anticorpi anti-Saccharomyces cerevisiae)
❏ Ecografia dell’addome e pelvi
In caso di sospetto morbo di Crohn, le procedure strumentali di prima scelta per stabilire la diagnosi sono l’ileocolonscopia con biopsie multiple dell’ileo terminale (e di ogni segmento infiammato del colon) + ecografia per anse
ileali.
Gli aspetti macroscopici del morbo di Crohn all’endoscopia sono:
❏ Il coinvolgimento dell’ileo
❏ Il risparmio del retto (non sempre)
❏ Ulcere profonde lineari confluenti, ulcere aftose
❏ Fissurazioni profonde
❏ Ispessimento sclero-lipomatoso del mesentere
❏ Lesioni “a salto” (“skip lesions”) (malattia segmentale)
❏ Aspetto ad “acciottolato”
❏ Ispessimento della parete intestinale
❏ Stenosi
Gli aspetti microscopici del morbo di Crohn alla biopsia (o nei campioni chirurgici da resezione) sono:
❏ L’infiammazione transmurale
❏ Gli aggregati di cellule infiammatorie, l’iperplasia linfoide transmurale
❏ L’ispessimento della sottomucosa (espansione per fibrosi, obliterazione fibromuscolare, e infiammazione)
❏ Fissurazioni
❏ Granulomi sarcoidei (compresi i linfonodi)
❏ Anormalità nel sistema nervoso enterico (iperplasia delle fibre nervose sottomucose, ganglionite)
❏ Epitelio relativamente risparmiato, comprese le cellule caliciformi e la mucina
30
malattie intestinali
Se all’ileo-colonscopia viene diagnosticato il morbo di Crohn, è necessario effettuare ulteriori indagini per determinare
l’estensione della malattia, tra cui (a seconda della disponibilità, tempi di attesa ed esperienza locale dell’operatore):
❏ Clisma del tenue
❏ Enteroclisi-RMN (forse il metodo di elezione)
❏ Enteroclisi-TAC
❏ Endoscopia con video-capsula
Se si sospetta la presenza di una complicanza extra-murale del morbo di Crohn, quale una fistola o un ascesso, è necessario eseguire un’ecografia, una TAC o una RMN dell’addome (tecnica di elezione).
L’esofagogastroduodenoscopia viene raccomandata soltanto nei pazienti con sintomi gastroenterici superiori; si tratta
quasi sempre di soggetti con morbo di Crohn localizzato già al tenue o al colon.
Non ci sono prove per raccomandare l’uso di routine di marker molecolari genetici. o sierologici, (per es. ANCA, ASCA,
ecc.) o fecali (calprotectina, ecc.) per la stadiazione dei pazienti con rettocolite ulcerosa già accertata endoscopicamente.
Invece i livelli di proteina C-reattiva sono indicatori dell’attività della malattia o di complicanze batteriche, e sono utili per
guidare la terapia e il follow-up.
PRINCIPI GENERALI DI TRATTAMENTO DEL MORBO DI CROHN:
I fattori da considerare nel trattamento del morbo di Crohn sono:
❏ Il grado di attività della malattia
❏ La sede della malattia (ileale, ileo-colica, colica, altre sedi) ed estensione
❏ Il tipo di comportamento della malattia (infiammatorio, stenosante, ascessualizzante, fistolizzante)
❏ Il decorso della malattia (frequenza delle ricadute)
❏ La risposta ai precedenti trattamenti, effetti collaterali, manifestazioni extra-intestinali
Morbo di Crohn a localizzazione ileo-ciecale e a lieve attività:
Il trattamento di prima scelta è la budesonide (Entocir® cpr. 3 mg), alla dose di 3 compresse/die in dose unica al mattino. Produce remissione nel 50-60% dei pazienti entro 8-10 settimane. È da preferirsi al prednisolone poiché ha meno effetti
collaterali, essendo poco o niente assorbito a livello sistemico (non altera il metabolismo osseo e glucidico).
La mesalazina e gli altri 5 aminosalicilati non vengono raccomandati nel morbo di Crohn a localizzazione ileale: hanno un
effetto simile al placebo.
Gli antibiotici (metronidazolo, ciprofloxacina) con o senza mesalazina, e la terapia nutrizionale non hanno nessun ruolo.
Morbo di Crohn a localizzazione ileo-ciecale e a moderata attività:
Il trattamento di scelta è costituito dalla budesonide (come sopra) o dal prednisolone per via orale (1 mg/kg/die); quest’ultimo produce remissione nel 90% dei casi entro 7 settimane. La dose va aggiustata in base alla risposta nell’arco di settimane.
Gli antibiotici (metronidazolo e ciprofloxacina) sono utili solo in caso di sospette complicanze settiche o di malattia perineale.
Morbo di Crohn a localizzazione ileo-ciecale e a severa attività:
Il paziente va ospedalizzato per effettuare un trattamento con corticosteroidi sistemici e, per i pazienti con ricaduta, con
azatioprina/mercaptopurina o methotrexate o infliximab.
Morbo di Crohn a localizzazione colica:
I corticosteroidi sistemici (prednisolone o equivalenti) sono efficaci, mentre la budesonide non ha nessun ruolo del
trattamento del morbo di Crohn a localizzazione colica, a meno che non interessi solo il colon prossimale (con o senza coinvolgimento ileale). Gli immunomodulatori (azatioprina, mercaptopurina o nei soggetti intolleranti methotrexate) sono
agenti risparmianti i cortisonici, utili soprattutto nei pazienti con ricadute.
La sulfasalazina (Salazopyrin EN®, cpr 500 mg) è efficace alla dose di 4000 mg/die (= 8 cpr/die), ma non è di prima scelta, se non nei soggetti con artropatia, a causa degli effetti collaterali. Gli altri 5-aminosalicilati per via orale sono efficaci poco
più del placebo nei pazienti con morbo di Crohn attivo a sede colica e non devono essere usati.
È dubbia l’efficacia della mesalazina topica nel morbo di Crohn del colon sinistro.
Il metronidazolo (10-20 mg/kg/die) e la ciprofloxacina (500-1000 mg/die) inducono una risposta nella malattia del
colon, ma non la remissione: perciò non sono raccomandati come trattamento di prima scelta. Il loro ruolo è nei pazienti
31
malattie intestinali
con morbo di Crohn a localizzazione colica in associazione al corticosteroide per via orale, di cui permettono di ridurre la
dose, e soprattutto nei soggetti con malattia perianale o con ascessi. Possono essere usato fino a 6 mesi o fino a comparsa
di complicazioni (per es. parestesie da metronidazolo, tendinopatie da ciprofloxacina).
Morbo di Crohn a localizzazione estesa nel tenue:
Va trattato con corticosteroidi per via sistemica (vedi sopra) se di moderata o severa attività. L’azatioprina (2-2,5
mg/kg/die), o la mercaptopurina (1-1,5 mg/kg/die) sono pure raccomandate (o, nei soggetti intolleranti o resistenti il
methotrexate, 25 mg/settimana per via orale o intramuscolare), con l’aggiunta di un supporto nutrizionale. L’infliximab
dev’essere preso in considerazione se il trattamento non funziona, benché le soluzioni chirurgiche debbano essere pure
prese in considerazione e discusse (soprattutto nei soggetti con stenosi isolate, fisse e di lunga durata).
Morbo di Crohn a localizzazione esofagea o gastroduodenale:
Va trattato con un inibitore di pompa protonica, se necessario insieme a un corticosteroide sistemico e azatioprina/mercaptopurina o, se non tollerati, a methotrexate. L’infliximab è un’alternativa per i soggetti con malattia refrattaria. La
dilatazione o l’exeresi chirurgica sono appropriate se ci sono sintomi occlusivi.
Ogni paziente con ricadute precoci (< 3 mesi) va trattato con un immunomodulatore (azatioprina, mercaptopurina o
methotrexate). Le opinioni sono discordi se usare lo stesso trattamento precedente e ridurlo più lentamente, usare una
terapia d’induzione più potente, o aumentare la terapia di mantenimento.
I pazienti con morbo di Crohn steroido-dipendente devono essere trattati con immunomodulatori. Se essi non
inducono remissione, va usato l’infliximab o l’opzione chirurgica.
TERAPIA DI MANTENIMENTO DELLA REMISSIONE = PREVENZIONE DELLE RICADUTE:
L’azatioprina (2-2,5 mg/kg/die) e il methotrexate (15 mg/settimana) sono efficaci nel mantenere la remissione del
morbo di Crohn; sono indicati soprattutto nei pazienti con malattia estesa del tenue. Non ci sono studi specifici per la mercaptopurina. La durata del trattamento di mantenimento con azatioprina dev’essere di 4 anni se c’è stata piena remissione.
Le infusioni regolari di infliximab (5-10 mg/kg ogni 8 settimane) sono efficaci nel mantenere la remissione dopo una
terapia di induzione con lo stesso farmaco, nei pazienti senza ascessi o fistole.
Gli aminosalicilati non si sono dimostrati utili nel mantenere la remissione del morbo di Crohn. L’efficacia della sulfasalazina e della olsalazina non è stata determinata.
I cortisonici orali (prednisolone, budesonide) non si sono dimostrati efficaci nel mantenere la remissione del morbo di
Crohn. La budesonide può ritardare le ricadute ma non è efficace a mantenere la remissione dopo i 12 mesi.
Non ci sono prove dell’efficacia degli antibiotici (metronidazolo, ciprofloxacina) nel mantenere la remissione del morbo
di Crohn.
RUOLO DELLA CHIRURGIA NEL TRATTAMENTO DEL MORBO DI CROHN (SINTESI PER IL MEDICO DI MEDICINA GENERALE):
L’evidenza attuale è che la resezione intestinale estesa non è più generalmente necessaria, ed è potenzialmente pericolosa. La tendenza oggi è quella di lasciare l’intestino malato in sede, trattando solo le parti d’intestino responsabili dei sintomi che rendono indispensabile il trattamento chirurgico.
32
malattie intestinali
Pertanto, vanno trattati con chirurgia primaria i pazienti con morbo di Crohn a localizzazione ileo-ciecale con sintomi di
occlusione intestinale.
È dubbio il ruolo della chirurgia primaria del classico morbo di Crohn confinato all’ileo-cieco con un massimo di 40 cm di
ileo coinvolto, sintomi apprezzabili (CDAI > 220) ma non sintomi/segni di occlusione imminente.
Il morbo di Crohn attivo nel tenue con un concomitante ascesso addominale dovrebbe essere preferibilmente trattato
con antibiotici, drenaggio percutaneo o chirurgico seguito eventualmente da resezione.
La stritturoplastica convenzionale è raccomandata quando la lunghezza della stenosi intestinale è < 10 cm. Tuttavia, in
caso di malattia estesa con lunghi segmenti intestinali stenotici in cui la resezione potrebbe compromettere l’effettiva lunghezza del tenue, possono essere tentati interventi di stritturoplastica non convenzionale. Se ci sono stenosi multiple in un
piccolo segmento d’intestino e la lunghezza intestinale è sufficiente a evitare la sindrome dell’intestino corto, è preferibile
procedere a una resezione.
Ci sono alcune prove che un’anastomosi termino-terminale ad ampio lume funzionale è la tecnica preferibile.
Dev’essere il chirurgo a decidere se sottoporre a resezione un ileo terminale affetto da morbo di Crohn trovato incidentalmente durante un intervento per sospetta appendicite. L’insegnamento tradizionale raccomanda la semplice appendicectomia quando il cieco è normale, lasciando in sede l’ileo malato. Questo è probabilmente un principio appropriato per un
chirurgo non esperto di morbo di Crohn, poiché la diagnosi differenziale include l’ileite infettiva (soprattutto da Yersinia
spp). Tuttavia, se la storia del paziente indica la durata di sintomi addominali per più di pochi giorni e il tratto intestinale
infiammato presenta aspetti tipici del morbo di Crohn, tra cui un mesentere ispessito, sclero-lipomatoso, un chirurgo esperto è giustificato nel praticare una resezione primaria dell’ileo terminale.
Non si può ancora concludere definitivamente se una resezione per via laparoscopica consenta al paziente dei benefici
maggiori di una piccola cicatrice. La resezione laparoscopica può non essere appropriata nei casi più complessi.
In caso di morbo di Crohn a localizzazione colica con meno di 1/3 del colon coinvolto, è preferibile procedere alla sola
resezione della parte malata. L’intervento produce una maggiore frequenza di recidive rispetto alla proctocolectomia, tuttavia c’è accordo generale che evitare una stomia permanente dà maggiori benefici che incorrere nel rischio di una ricaduta. Si
possono effettuare due resezioni segmentali del colon nei pazienti con coinvolgimento di entrambe le estremità del colon.
La strutturoplastica del colon non viene raccomandata.
La dilatazione endoscopica delle stenosi è la tecnica preferibile per il trattamento di stenosi brevi lievi o moderat e accessibili, ma va effettuata presso centri esperti.
Per quanto riguarda l’uso concomitante di terapie farmacologiche per il morbo di Crohn da sottoporre a chirurgia, l’azatioprina e l’infliximab non rappresentano fattori di rischio per complicanze chirurgiche. Non è chiaro il tempo ottimale che
deve intercorrere tra trattamento con infliximab e chirurgia (un mese o più? 8 settimane?), mentre l’azatioprina può essere
continuata con sicurezza nel periodo perioperatorio e dopo.
Il prednisolone 20 mg/die o equivalenti per più di 6 settimane rappresenta un fattore di rischio per complicanze chirurgiche, per cui dev’essere ridotto il più possibile.
MORBO DI CROHN:
MESSAGGI CHIAVE PER IL MEDICO DI MEDICINA GENERALE
(a cura di Marco Marino, Giusto Bearzi, Dario R. Sorrentino)
Quando il MMG deve sospettarlo?
1. Dolore addominale in FID
2. Alvo diarroico o alternante, sangue spesso assente
3. Persona spesso giovane
Che cosa deve chiedere il MMG in caso di sospetto?
1. Esami del sangue con indici di flogosi, ormoni tiroidei, anticorpi anti-transglutaminasi, ANCA-p e ASCA
2. Esame delle feci (microbiologico) e calprotectina fecale
3. Ecografia addome e e pelvi
4. Ileo-colonscopia con biopsie per sospetto morbo di Crohn (se diarrea profusa il MMG lascia la decisione allo
specialista)
5. Visita specialistica gastroenterologica o ricovero se diarrea profusa e/o dolore violento
33
malattie intestinali
Che cosa il MMG deve attendersi dallo Specialista?
1. Diagnosi: sede, estensione e gravità della malattia (ileocolonscopia, entero-RMN/clisma del tenue/eco anse
ileali)
2. Stazione completa della malattia: sepsi, malattia extraintestinale/perianale, nutrizione
3. Impostazione della terapia, di concerto con il chirurgo:
- steroidi per os/endovena, azatioprina, farmaci biologici
- resezione, stomia, stritturoplastica
Come dev’essere organizzato il follow-up?
1. Il follow-up è essenzialmente specialistico con visite periodiche: il MMG dev’essere informato dei controlli e
delle terapie
2. Il MMG controlla la compliance e monitora gli effetti collaterali delle terapie (corticosteroidi, immunosoppressori, biologici); se infezioni, febbre, dolore, addome acuto: allerta lo Specialista
4. Se presenza di sintom/segni addominali (diarrea, dolore, perdita di peso) il MMG allerta lo Specialista.
MORBO DI CROHN PERIANALE:
(a cura di Renato Sablich, Massimo Toffolo, Luigi Torricelli)
È una condizione disabilitante che colpisce dal 20% all’80% dei pazienti con morbo di Crohn.
La prevalenza aumenta quanto più è distale la localizzazione intestinale della malattia (è massima quando è coinvolto il
retto).
È generalmente associata a un comportamento di malattia più aggressivo (maggiore uso di steroidi, immunosoppressori, maggiore frequenza di ospedalizzazioni e di interventi chirurgici).
Sono fattori di rischio: il sesso maschile, probabilmente fattori genetici, l’età di insorgenza precoce della malattia.
La gestione del morbo di Crohn perianale è strettamente specialistica e multidisciplinare (fondamentale l’immediata interazione tra gastroenterologo, chirurgo, radiologo).
Per le fistole perianali semplici, è importante sapere se sono sintomatiche o meno.
Manifestazioni anatomo-cliniche:
❏ Skin tags (marasche):
37%
❏ Fistole :
29%
❏ Ascessi:
26%
❏ Ragadi:
19%
❏ Ulcere anali:
16%
❏ Stenosi ano-rettale
9%
❏ Carcinoma anale:
0,7%
La diagnostica comprende le seguenti indagini
❏ Ispezione perineale ed esplorazione rettale
❏ Rettosigmoidoscopia o colonscopia
❏ Ecografia endoanale
❏ RMN
❏ Esplorazione in anestesia
La terapia medica comprende:
❏ Antibiotici (metronidazolo 750-1500 mg/die e ciprofloxacina 500-1000 mg/die): producono una risposta nel 50%
circa dei casi, l’incidenza di recidive è elevata
❏ L’azatioprina (1-2,5 mg/kg/die) o la mercaptopurina (0,75-1,5 mg/kg/die): producono una risposta nel 50% dei casi
❏ La ciclosporina (4 mg/kg endovena): produce una risposta nell’80% dei casi, ma l’incidenza di recidive è elevata
❏ Il tacrolimus (Prograf® 0,20 mg/kg): produce una risposta nel 43% dei casi
❏ Il methotrexate (20-25 mg/settimana IM): produce una risposta nel 50% circa dei casi
❏ L’infliximab (5-10 mg/kg ev): produce una risposta iniziale nell’68% dei casi; mantenimento: 36%
❏ L’adalimumab (160-80 mg → 40 mg/14 gg): produce una risposta iniziale nel 65% dei casi
Il trattamento in acuto della sepsi prevede l’incisione e il drenaggio e il posizionamento di setone.
Il trattamento definitivo prevede varie possibilità chirurgiche (fistulotomia, fistulectomia, flap mucoso, cutaneo o
muscolare, colla di fibrina, plugh, iniezione locale di infliximab, proctectomia, resezione della patologia prossimale)
34
(a cura di Renato Sablich, Massimo Toffolo, Luigi Torricelli)
Quando il MMG deve sospettarlo?
1. Pazienti con pregressa diagnosi di morbo di Crohn intestinale (soprattutto se del colon sinistro)
2. Sintomi e segni di infiammazione perianale
Che cosa deve chiedere il MMG in caso di sospetto?
1. Esami del sangue con indici di flogosi
2. Esame delle feci (microbiologico) e calprotectina fecale
3. Ecografia addome e e pelvi
4. Visita specialistica
Che cosa il MMG deve attendersi dallo Specialista?
malattie intestinali
MORBO DI CROHN PERIANALE:
MESSAGGI CHIAVE PER IL MEDICO DI MEDICINA GENERALE
1. Ristadiazione: sede, estensione, gravità ed eventuali manifestazioni extraintestinali (ileo-colonscopia,
RMN/eco transrettale, esplorazione in anestesia)
3. Terapia medica e stretta collaborazione con il chirurgo (meglio se coloproctologo e con esperienza specifica:
team per le malattie infiammatorie intestinali)
Come dev’essere organizzato il follow-up?
1. Il follow-up è essenzialmente specialistico con visite periodiche: il MMG dev’essere informato dei controlli e
delle terapie
2. Il MMG mantiene un canale di comunicazione con lo specialista e:
- segue l’andamento clinico, controlla la compliance e monitora gli effetti collaterali delle terapie (corticosteroidi,
immunosoppressori, biologici)
- identifica i segni/sintomi generali di allarme: febbre, dolore addominale acuto, alterazione degli esami ematochimici: allerta lo Specialista
. identifica i segni/sintomi perianali di aggravamento/recidiva (tumefazione, dolore, apertura di una fistola,
secrezione purulenta, sanguinamento): allerta lo Specialista
(Burrill Bernard Crohn)
LA COLITE MICROSCOPICA:
È una malattia caratterizzata da diarrea acquosa associata a dolori addominali crampiformi. Il paziente tipico è una
donna di età media, il picco d’incidenza è sui 65 anni. La malattia può però presentarsi in qualsiasi età. Ne è affetto circa il
10% di persone con diarrea acquosa ed esami strumentali del colon negativi: la diagnosi differenziale più frequente è quella
con il colon irritabile.
L’incidenza è di 8 casi/100.000 abitanti e i rapporto maschi-femmine è di 1:4.
L’esordio della malattia di solito è improvviso e simula una diarrea infettiva. Il decorso clinico è però cronico e ricorrente
e di tipo benigno (rari casi di perforazione del colon, non aumento di rischio di cancro colo-rettale). La maggior parte dei
pazienti va incontro a remissione della sintomatologia nel corso di anni.
Spesso i pazienti hanno malattie autoimmuni concomitanti (tiroiditi, celiachia, diabete mellito, artrite reumatoide, asma,
allergie). L’ipotesi più probabile è che si tratti di un’errata risposta immunitaria.
Il clisma opaco e la colonscopia sono normali. Non vi sono particolari alterazioni bio-umorali (VES, PCR nella norma, talvolta ipoalbuminemia).
35
malattie intestinali
L’esame microscopico delle biopsie del colon è il solo mezzo per stabilire la diagnosi.
2 sono le forme istologiche:
1. COLITE LINFOCITARIA: > 25 linfociti intraepiteliali/100 cellule epiteliali
2. COLITE COLLAGENOSICA: infiltrato linfocitario + ispessimento della banda di collagene sottoepiteliale (> 10 micron)
Sovente, ma non necessariamente, vi è progressione dalla forma linfocitaria a quella collagenosica. Sia nella colite linfocitaria che in quella collagenosica vi è un aumento dei linfociti intraepiteliali e un aumento marcato/moderato di cellule
mononucleate nella lamina propria. Gruppi di cellule infiammatorie sono presenti alla base delle cripte, ma l’architettura
delle cripte è ben conservata e non ci sono ascessi criptici.
Si localizza al colon ma anche l’ileo può essere interessato (sempre a livello microscopico).
La causa della malattia è ignota e probabilmente multifattoriale: risposta specifica della mucosa in soggetti predisposti
verso agenti endoluminali nocivi? Sono stati segnalati casi di associazione con l’uso di certi farmaci: acarbosio, acido acetilsalicilico, FANS, lansoprazolo, ranitidina, sertralina, ticlopidina (reazione immunitaria idiosincrasica?). Nella malattia vi è
un’aumentata produzione di ossido nitrico (NO) da parte dell’epitelio del colon (per induzione dell’enzima ossido nitrico
sintetasi), correlata con la severità dei disturbi clinici e del quadro istologico, e che sembra essere coinvolta nella fisiopatologia della diarrea acquosa.
La diarrea acquosa della colite microscopica sembra essere di origine sia secretiva (ridotto riassorbimento di Na+ e Cldovuto alle lesioni epiteliali e e all’ispessimento della lamina propria), sia osmotica (il digiuno riduce la diarrea).
Terapia: (con risultati incostanti):
❏ Budesonide (9 mg/die) o beclometasone dipropionato per os (5 mg/die) per 6-8 settimane (trattamento di prima
scelta). Le recidive alla sospensione sono frequenti.
❏ Mesalazina (2000-4000 mg/die): risposta nel 45-90% dei casi
❏ Azatioprina (2-2,6 mg/kg/die): risposta nell’87% dei casi
❏ Bismuto sottosalicilato (De Nol® cpr 120 mg): richiede dosi elevate, effetti collaterali, poca efficacia
❏ Prednisolone (10-50 mg/die): effetti collaterali sistemici
❏ Probiotici
❏ Buoni risultati nel controllo dei sintomi con loperamide (2-16 mg/die) e colestiramina (4-20 g/die)
COLITE MICROSCOPICA:
MESSAGGI CHIAVE PER IL MEDICO DI MEDICINA GENERALE
(a cura di Elvio Benedetti, Roberto Vallini, Tiziana Del Bianco)
Quando il MMG deve sospettarla?
1. Donna, circa 60 anni, con diarrea acquosa
2. Inizio piuttosto recente
3. Assenza di altri sintomi e segni (sangue, muco, febbre)
Che cosa deve chiedere il MMG in caso di sospetto?
1. Esami del sangue con indici di flogosi, ormoni tiroidei, anticorpi anti-transglutaminasi, ANCA-p e ASCA
2. Esame delle feci (microbiologico) e calprotectina fecale
3. Ecografia addome e e pelvi
4. Colonscopia con biopsie per sospetta colite microscopica
5. Visita specialistica gastroenterologica
Che cosa il MMG deve attendersi dallo Specialista?
1. Diagnosi: ileocolonscopia con biopsie
3. Impostazione della terapia: budesonite, beclometasone, immunosoppressori,
Come dev’essere organizzato il follow-up?
1. Il follow-up è inizialmente specialistico: il MMG dev’essere informato delle terapie
2. Il MMG mantiene un canale di comunicazione con lo specialista e segue l’andamento clinico, controlla la compliance e monitora gli effetti collaterali delle terapie (corticosteroidi, immunosoppressori, biologici): allerta lo
specialista se sintomi/segni di complicazioni
3. Successiva gestione del MMG. Se ricomparsa/aggravamento dei sintomi: inizio mesalazina e aumento della
dose fino a 4000 mg/die. Se insufficiente il MMG allerta lo specialista.
36
La celiachia vista dal medico
A cura di Roberto Della Vedova - MMG - ASS n. 2 “Isontina”
In occasione della giornata di aggiornamento obbligatorio del 28 maggio 2009 abbiamo sondato il livello di conoscenza
dei medici di medicina generale e dei pediatri di libera scelta del Friuli Venezia Giulia della malattia celiaca attraverso la
richiesta a rispondere ad un questionario.
Il questionario era una riedizione aggiornata del questionario utilizzato nel 2000 in occasione della prima campagna di
formazione sulla celiachia e del progetto di ricerca SMAC.
Le risposte sono state numerosi, ben 543 sui circa 1000 medici e pediatri della regione.
Essi hanno dichiarato di assistere circa 1046 persone affette da celiachia, cosicché in media un medico risulta assistere
circa due pazienti celiaci, con un range che va da 0 a 15.
la celiachia
La prevalenza dichiarata di celiaci risulta da questo sondaggio di 1:504 contro 1:1350 del sondaggio del 2000, ad indicare che, in questi 9 anni, sono stati individuate un gran numero di persone affette da celiachia. Tra i pazienti pediatrici la prevalenza sale addirittura a 1:295, e quindi si avvicina di molto alla prevalenza attesa.
Le risposte al questionario evidenziano che, pur dimostrando un sostanziale miglioramento rispetto alle risposte date al
questionario del 2000, vi sono ancora delle lacune da colmare nella conoscenza di questa proteiforme malattia.
In particolare la metà dei medici ancora sottostima la prevalenza della celiachia, mentre è sostanzialmente accettabile la
conoscenza dei principali sintomi e segni che possono essere spia di celiachia e dei quadri clinici non gastroenterici.
La gran parte dei medici conosce i test diagnostici di primo livello e di conferma della malattia, anche se gli aspetti più
innovativi come il significato di marcatori genetici rimane ancora ignoto o confuso.
Le risposte alla domanda che richiedeva di indicare quali sono i cereali che contengono glutine indica che molti medici
non hanno ancora le idee molto chiare o perché ritengono che non conoscono tutti i cereali che contengono glutine oppure
segnalano come contenenti glutine anche mais e riso.
Anche alla domanda su quale sia la quantità massima di glutine tollerata dal celiaco più di un quarto dei medici non ha
risposto e solo la metà ha risposto correttamente.
Vi inoltre una sovrastima, soprattutto da parte dei pediatri del rischio di sviluppare il linfoma.
Possiamo perciò dedurre dai risultati emersi dalle risposte a questo questionario che una giornata di aggiornamento
sulla celiachia era, nonostante i progressi fatti negli ultimi anni quanto mai necessaria, che le lacune maggiori riguardano gli
aspetti più nuovi delle conoscenze sulla celiachia.
La numerosa, attenta e attiva partecipazione alla giornata di aggiornamento del 28 maggio fa ben sperare che molte
delle incertezze di conoscenza emerse dal questionario possano essere state colmate.
Questionario
Sono possibili più risposte per ogni quesito, barrare le risposte che ritenete esatte.
A) Qual è la prevalenza della malattia celiaca?
1.
2.
3.
4.
5.
B) In quale età della vita può manifestarsi clinicamente
la malattia celiaca?
1: 100
1:250
1:1.000
1:5.000
1:10.000
1.
2.
3.
4.
5..
37
Allo svezzamento
Prima dei 2 anni
Prima della pubertà
Comunque prima dei 30 anni
In tutte le età della vita
la celiachia
C) Quali di questi “segni e sintomi” possono essere la
spia di una celiachia.
H) Indica le affermazioni corrette riguardanti l’HLA di
classe seconda DQ2 e DQ8:
1.
2.
3.
4.
5.
1.
2.
3.
4.
Astenia persistente
Anemia sideropenica
Ipertransaminasemia isolata
Epilessia con calcificazioni endocraniche
Artralgie
La prevalenza nella popolazione generale è del 30%
Sono presenti nel 60% dei soggetti con IDDM
La loro assenza esclude la diagnosi di celiachia
La loro presenza è indispensabile per la diagnosi
I) Quali dei seguenti cereali contengono glutine?
D) Quale/i dei seguenti quadri clinici può far parte della
malattia celiaca anche in assenza di sintomatologia
gastrointestinale?
1.
2.
3.
4.
5.
.1.
2.
3.
.4.
.5.
.6.
7.
8.
Tiroidite autoimmune
Poliposi multipla del colon
Dermatite erpetiforme
Poliabortività
Retinite pigmentosa
E) Sono identificabili gruppi a rischio per la MC?
1.
2.
3.
4.
5.
L) Quale è la quantita di glutine tollerata dal soggetto
celiaco ?
Parenti di primo grado di celiaci
Soggetti con diabete tipo 1
Soggetti con sindrome coronarica acuta
Giovani adulti con osteoporosi
Soggetti con cancro al polmone
1.
2.
3.
4.
5.
F) Qual’è, tra i seguenti test, il più sensibile nell’identificare i soggetti con possibile celiachia?
1.
2.
3.
4.
5.
1-2 grammi di farina/die
mezzo panino/die
1 grissino/die
una pizza/settimana
1 pizza/mese
M) Quale è il rischio di sviluppare linfoma in un soggetto
celiaco non trattato (in dieta libera) ?
Anticorpi antiglutine (AGA)
Anticorpi antigliadina deaminati
Test di assorbimento intestinale
Anticorpi antiendomisio (EMA)
Anticorpi antitransglutaminasi (anti-tTG).
1.
2.
3.
4.
G) Quale esame è sempre necessario eseguire per formalizzare la diagnosi di celiachia ed iniziare la dieta
senza glutine?
1.
2.
3.
.4.
5.
Granoturco
Frumento
Avena
Orzo
Riso
Farro
Quinoa
Miglio
stesso della popolazione generale
x 100 volte della popolazione generale
x 3 volte della popolazione generale
x 10 volte della popolazione generale
Numero di assistiti in carico: _________________________
Numero di celiaci seguiti:
Risposte Esatte: A 1; B 5; C tutte; D ,3,4; 1,2,4; F 5;G 4; H
1,2,3; I 2,3,4,6; L 1; M 3
Anticorpi antiglutine
Anticorpi antitransglutaminasi (anti-tTG)
Test di assorbimento intestinale allo xilosio
Biopsia intestinale
Anticorpi antiendomisio
Risposte Esatte: A 1; B 5; C tutte; D 1,3,4; E 1,2,4; F 5;G 4; H
1,2,3; I 2,3,4,6; L 1; M 3
38
DESCRIZIONE DEL CAMPIONE
Questionari
Assistiti
Celiaci
Prevalenza
Totale
(543)
MG
(484)
PLS
(59)
Quali di questi “segni e sintomi” possono essere la spia
di una celiachia?
2000
(215)
Totale
MMG
PLS
2000
Astenia persistente
67,8
66,7
76,3
72,6
Anemia sideropenica
86,9
85,5
98,3
81,9
Ipertransaminasemia
Isolata
38,1
33,1
79,7
23,3
16
9,5
69,5
13
21,7
20,7
30,5
30,2
526845 475490 51355 238965
1046
504
Non
risposto
59
N°medioassistiti
970
872
545
55
174
295
4
177
1350
5
Epilessia con C.E.
1108
934
1138
Artralgie
(Le risposte corrette sono state evidenziate in grassetto)
Totale
1:100
1:250
1:1.000
1:5.000
1:10.000
25
30,2
28
7,3
3,3
MMG
18,8
31,4
31
8,3
3,7
la celiachia
Qual è la prevalenza della malattia celiaca?
Quale/i dei seguenti quadri clinici può far parte della malattia
celiaca anche in assenza di sintomatologia gastrointestinale?
PLS
76,3
20,3
3,4
0
0
2000
Totale
MMG
PLS
2000
Tiroidite autoimmune
79,9
78,5
91,5
45,6
Poliposi multipla colon
15,5
14,3
25,4
17,7
Dermatite erpetiforme
41,6
35,5
91,5
57,7
Poliabortività
42,9
37
91,5
25,6
Retinite pigmentosa
2,3
2,5
1,7
2,8
6,9
27,9
41,9
20,9
7
A quale età della vita può manifestarsi la malattia celiaca?
Totale
MMG
PLS
2000
Allo svezzamento
3,6
3,9
1,7
11,2
Prima dei 2 anni
2,7
2,9
1,7
Prima della pubertà
2,7
2,9
Comunque prima
dei 30 anni
5,1
In tutte le età
della vita
87,3
Sono identificabili gruppi a rischio per la malattia celiaca?
Totale
MMG
PLS
2000
Parenti di I° grado
di celiaci
91
90,3
96,6
-
13,5
Soggetti con
diabete tipo 1
42
34,7
91,5
-
1,7
6,5
Soggetti con
s. coronarica acuta
0
0
0
-
5,8
0
7,4
Giovani adulti con
osteoporosi
38,5
35,7
61
-
86,4
94,9
76,3
Soggetti con
Cancro del polmone
0,1
0,2
0
-
39
Qual è, tra i seguenti test, il più sensibile nell’identificare
i soggetti con possibile celiachia?
Totale
MMG
PLS
2000
Ab antiglutine (AGA)
7,2
7,8
3,4
52,8
Ab antigliadina deaminati
3,6
3,9
1,7
8
0,4
0,4
0,
13,6
Ab antiendomisio (EMA)
14,3
14,3
15,3
54,8
Ab antitransglutaminasi
(anti-tTG)
89
88
96,6
61,1
la celiachia
Test di assorbimento
intestinale
Quali dei seguenti cereali contengono glutine?
Qual esame è sempre necessario eseguire per formalizzare la
diagnosi di celiachia ed iniziare la dieta senza glutine?
Totale
MMG
PLS
2000
Ab antiglutine (AGA)
3,6
4,1
0
25,1
Ab antitransglutaminasi
(anti-tTG)
15,1
15,9
8,5
2
2
2,3
0
7
Biopsia intestinale
84,5
83,1
96,6
71,4
Ab antiendomisio
(EMA)
6
6,8
0
22,1
Test di assorbimento
intestinale allo xlilosio
La prevalenza nella
popolazione generale
è del 30%
Totale MMG
PLS
(39,3%) (42,8%) (10,2%)
21
18
45,8
MMG
PLS
2000
Granoturco
36,3
38,6
16,9
35,3
Frumento
90,2
89
100
91,2
Avena
58,4
55,4
83,1
69,3
Orzo
56,5
52,3
91,5
61,9
Riso
6,6
7,2
1,7
9,3
Farro
42,9
73,9
69,5
-
Quinoa
6
5,8
8,5
-
Miglio
20
18
37,3
-
Qual è la quantità di glutine tollerata dal soggetto celiaco?
(non risposto)
Indica le affermazioni corrette riguardanti l’HLA di classe
seconda DQ2 e DQ8:
(non risposto)
Totale
Totale MMG
PLS
(26,5%) (27,3%) (20,3%)
1-2 grammi di farina/die
48,8
45,6
74,6
-
Mezzo panino/die
3,6
4,1
0
-
1 grissino/die
5,3
6
0
-
Una pizza/settimana
3,1
3,5
0
-
Una pizza/mese
12,5
13,2
6,8
-
Qual è il rischio di sviluppare linfoma in un soggetto celiaco
non trattato (in dieta libera)?
2000
-
(non risposto)
-
Stesso della popolazione
generale
15,8
x 100 volte della
popolazione Generale
Sono presenti nel 60%
dei soggetti con IDDM
19
20
10,2
-
La loro assenza esclude
la diagnosi di celiachia
21
18,6
40,7
-
La loro presenza
è indispensabile
per la diagnosi
9
6,8
20,3
-
2000
-
40
Totale MMG
(16,4%) (18%)
PLS
(3,4%)
2000
-
17,1
5,1
-
9,7
9,3
13,6
x 3 volte della
popolazione Generale
24,3
26,2
8,5
-
x 10 volte della
popolazione generale
34,2
30
69,5
-
-
Percorso diagnostico - assistenziale
per i soggetti affetti da malattia celiaca
DGR 1561 dd. 29.6.2007
Il protocollo è stato elaborato da:
Stefano Martelossi, Marco De Carli°, Dario Sorrentino§ e Nicoletta
Orzes*
SS Gastroenterologia Pediatrica/Clinica Pediatrica, IRCCS “Burlo Garofolo” -Trieste
°SOC Medicina 2°, Azienda Ospedaliero-Universitaria “Santa Maria della Misericordia”- Udine
§Cattedra di Gastroenterologia, Azienda Ospedaliero-Universitaria “Santa Maria della Misericordia” - Udine
*Servizio di Gastroenterologia ed endoscopia digestiva, Ospedale Civile - Gorizia
percorso diagnostico
Regione Friuli Venezia Giulia
Con la collaborazione di:
Giorgio Benedetti
Servizio di Gastroenterologia ed endoscopia digestiva, Azienda Ospedaliera “Santa Maria degli Angeli” - Pordenone
Luigi Buri
U.O. Gastroenterologia ed endoscopia digestiva, Azienda Ospedaliero-Universitaria “Ospedali Riuniti” - Trieste
Renato Cannizzaro
S.O. Gastroenterologia, Centro di Riferimento Oncologico -IRCCS - Aviano
Paola Melli
Clinica Pediatrica, Azienda Ospedaliero-Universitaria “Santa Maria della Misericordia”- Udine
Maurizio Zilli
S.O.C. Gastroenterologia ed endoscopia digestiva, Azienda Ospedaliero-Universitaria “Santa Maria della Misericordia” - Udine
e dell’Associazione Italiana Celiachia – ONLUS – Friuli Venezia Giulia
Abbreviazioni usate nel testo
MC = Malattia celiaca
GFD = Gluten free diet (Dieta priva di glutine)
CEC = Epilessia occipitale con calcificazioni endocraniche
h anti-tTG = Anti-transglutaminasi tessutale umana
EMA = Anticorpi anti-endomisio
AGA = Anticorpi anti-glutine
AAA = Anticorpi anti-actina
ce = Cellule epiteliali
IEL = Linfociti intraepiteliali
LES = Lupus Eritematoso Sistemico
IDDM = Diabete Mellito Insulino-Dipendente
TPO = Tireoperossidasi
INTRODUZIONE:
La malattia celiaca (MC) è definita come intolleranza permanente al glutine contenuto in alcuni cereali (in particolare frumento, orzo e segale) in grado di determinare, in soggetti geneticamente predisposti, un’enteropatia caratterizzata da atrofia dei villi, iperplasia delle cripte ed infiltrato linfocitario intraepiteliale1.
Le alterazioni istopatologiche a livello intestinale determinano la comparsa di malassorbimento, che può essere manifesto con la tipica diarrea e perdita di peso, subclinico con sintomi atipici quali stipsi e dispepsia, oppure può estrinsecarsi con
sintomi extraintestinali come anemia sideropenica o da carenza di acido folico, osteopenia, osteoporosi.
L’intolleranza permanente al glutine geneticamente determinata può manifestarsi anche in completa assenza di sintomi
intestinali con manifestazioni a carico della cute, del sistema nervoso, osteoarticolare ed ematopoietico. In alcuni casi può
essere del tutto silente sul piano clinico, come nei soggetti identificati nel corso di screening (ad esempio familiari di primo
grado di celiaci).
41
percorso diagnostico
Una dieta priva di glutine (GFD) porta alla regressione delle lesioni a carico della mucosa intestinale, consentendo un
regolare assorbimento dei nutrienti. La maggior parte dei celiaci, a patto di osservare strettamente tale dieta, può condurre
una vita regolare, senza alcun tipo di complicanze.
Sebbene sia stata inserita dalla legislazione italiana tra le patologie rare, la celiachia è una malattia frequente, con una
prevalenza negli studi su popolazione generale, pediatrica ed adulta, di 1 caso ogni 100 abitanti 2,3. La maggioranza dei casi
rimane ancor oggi senza diagnosi; in Italia il numero di celiaci conosciuti è di circa 70.000, con una stima di casi totali, realmente presenti sul territorio nazionale, 7-10 volte superiore rispetto a quelli diagnosticati.
Con i mezzi diagnostici attualmente disponibili (anticorpi specifici, esame istologico standardizzato, ricerca genetica) è
possibile, nella maggior parte dei casi, formulare correttamente la diagnosi di celiachia, eliminando le diagnosi basate su
false positività per anticorpi (positività solo degli anticorpi antiglutine o degli anticorpi anti-transglutaminasi di classe IgG, in
soggetti senza deficit di IgA), sulla presenza della sola predisposizione genetica (HLA DQ2/DQ8, presente nel 30% della
popolazione generale) o su una storia clinica presunta di scarsa tolleranza al glutine (meteorismo, “tensione addome”, difficoltà alla “digestione”, scariche) (4).
Una diagnosi precoce della malattia, seguita da un tempestivo allontanamento del glutine dalla dieta, può evitare complicanze temibili e ad elevato impatto sociale, come tumori ed altre malattie invalidanti.
Scopo di questo protocollo è offrire a tutti i medici, e non solo agli specialisti della patologia, delle linee guida semplici
ed applicabili su tutto il territorio regionale, che permettano di identificare tempestivamente il maggior numero di celiaci,
riducendo al minimo le mancate diagnosi ed evitando nel contempo le “false” diagnosi, tuttora numerose.
Il presente documento propone inoltre un percorso assistenziale e di follow-up comune a tutti i soggetti affetti da MC.
L’obiettivo è quello dell’identificazione dei casi oggi misconosciuti, di una diagnosi tempestiva con il conseguente avvio di un
trattamento precoce e di un monitoraggio comune e standardizzato al fine di prevenire le complicanze legate alla malattia.
SINTOMI E COMPLICANZE:
La celiachia è stata considerata una malattia pediatrica ad esordio precoce, ma l’incidenza delle forme ad esordio tardivo
e le diagnosi in età adulta stanno progressivamente aumentando.
Forma classica
La forma classica è solitamente caratterizzata da un esordio precoce, attorno ai 6-24 mesi, con manifestazioni cliniche
legate al malassorbimento. I sintomi sono prevalentemente intestinali, in particolare diarrea cronica, addome globoso, inappetenza, vomito e conseguente arresto della crescita. Possono associarsi segni o sintomi carenziali, quali anemia sideropenica o da deficit di acido folico, deficit emocoagulativi, osteopenia, deficit vitaminici ed edemi.
Forma ad esordio tardivo.
Sempre più spesso la celiachia viene diagnosticata nel bambino più grandicello o in età adulta. In genere, in questi casi, i
sintomi intestinali sono meno specifici (stipsi, dispepsia, dolori addominali ricorrenti) o anche assenti, mentre prevalgono le
manifestazioni extraintestinali (ritardo puberale, bassa statura, osteopenia, osteoporosi, infertilità, poliabortività ed associazione con disordini autoimmuni), come dettagliato nella tabella 1.
Forme silenti
La disponibilità attuale di test sensibili e specifici, a basso costo e a scarsa invasività, oltre a facilitare l’ identificazione
delle forme di malattia con manifestazioni atipiche (come ad esempio infertilità, poliabortività, ecc) ha permesso di identificare forme silenti della malattia (ad esempio familiari di celiaci) che un tempo rimanevano non diagnosticate.
Le complicanze
Le complicanze della celiachia sono strettamente correlate alla mancata diagnosi, alla diagnosi tardiva o alla non aderenza alla dieta di esclusione. Si tratta non solo di complicanze legate al malassorbimento (osteoporosi, bassa statura ecc), ma
anche di patologie autoimmuni5, di gravi alterazioni della parete intestinale, quali digiuno-ileite ulcerativa e sprue collagenosica ed infine di una maggiore probabilità di insorgenza di neoplasie a carico dell’apparato gastroenterico, in particolare
linfomi non Hodgkin a localizzazione intestinale.
Recentemente è stato dimostrato che tali complicanze possono insorgere anche nei pazienti con enteropatia non
severa6.
42
percorso diagnostico
STRUMENTI DIAGNOSTICI
I test da impiegare nel percorso diagnostico della celiachia sono i markers anticorpali e la biopsia intestinale. Sebbene
la biopsia rimanga ancora il “gold standard” per la diagnosi, la sierologia riveste un ruolo altrettanto importante in quanto:
a) permette l’identificazione dei soggetti da sottoporre a biopsia intestinale;
b) consente di pervenire alla diagnosi di certezza, che il paziente si trascina “per tutta la vita”, eseguendo una sola biopsia intestinale, se patologica;
c) aiuta a monitorare l’aderenza alla dieta aglutinata del paziente celiaco.
I criteri ESPGHAN del 1990, riassunti nella tabella 2, permettono di formulare la diagnosi di celiachia senza dover dimostrare la glutinedipendenza della lesione intestinale (che un tempo richiedeva l’esecuzione di 2-3 biopsie), qualora vi sia la
positività degli anticorpi specifici associata alla dimostrazione di danno istologico compatibile con MC(7).
La ripetizione della biopsia intestinale deve oggi essere eseguita, per una diagnosi di certezza, solo nei casi controversi.
CRITERI ESPGHAN 1990 PER LA DIAGNOSI DI CELIACHIA
• Positività per sierologia compatibile con MC
• Danno istologico compatibile con MC
• Risposta clinica e sierologica alla GFD
• Soggetti di età superiore ai 2 anni
• Esclusione di altre condizioni che mimano la MC
Tabella 2
43
percorso diagnostico
MARKERS ANTICORPALI
Anticorpi anti-transglutaminasi
Il test anticorpale risultato più idoneo ad individuare i soggetti con sospetta celiachia è la ricerca degli anticorpi
anti-transglutaminasi di classe IgA, metodica che utilizza l’antigene transglutaminasi tessutale umano ricombinante (h
anti-tTG IgA).
Il test presenta le caratteristiche di un’elevata sensibilità, di una buona specificità, di riproducibilità e di basso costo (8).
La determinazione degli h anti-tTG, viene eseguita con metodica ELISA, una procedura ben standardizzata, altamente
riproducibile e ripetibile in tutti i laboratori di analisi, tramite l’impiego di kit diagnostici commerciali.
Nei soggetti con deficit totale di IgA (IgA < 5 mg/dl), andranno anche ricercati e valutati eventualmente come diagnostici, gli anticorpi antitransglutaminasi di classe IgG (9).
Anticorpi anti-endomisio
Il test che utilizza la ricerca di anticorpi anti-endomisio (EMA) è dotato di maggiore specificità, ma è lievemente meno
sensibile del test h anti-tTG.
Va rilevato che è una metodica di immunofluorescenza, soggetta ad una forte variabilità interindividuale da operatore ad
operatore, con conseguenti problemi di attendibilità e riproducibilità che ne limitano l’utilizzo come test di primo livello.
La positività degli EMA rafforza molto la diagnosi per l’ elevata specificità del test. È infatti stato dimostrato che i
soggetti con positività per anticorpi anti-endomisio ed esame istologico normale hanno un’elevatissima probabilità di sviluppare un’enteropatia negli anni successivi (10).
Anticorpi anti-glutine
Nei bambini di età inferiore ai 2 anni è consigliabile associare alla determinazione degli anticorpi anti-transglutaminasi,
anche la ricerca degli anticorpi anti-glutine (AGA) IgA e degli AGA IgG in caso di deficit totale di IgA.
Gli AGA non devono essere utilizzati per la diagnosi nelle età superiori ai 2 anni per la loro bassa sensibilità e specificità (presenza di numerosi falsi positivi soprattutto in soggetti con allergie, flogosi intestinali e diarrea)(11).
In sintesi:
- Il test anticorpale da eseguire in prima istanza è la ricerca degli h anti-tTG IgA, alla quale va sempre associata la
determinazione dei livelli sierici delle IgA totali.
- Nei soggetti con deficit totale di IgA (IgA < 5 mg/dl), andranno anche ricercati e valutati eventualmente come diagnostici, gli h antitTG IgG.
- Nei bambini di età inferiore ai 2 anni è consigliabile associare la determinazione degli AGA IgA e degli AGA IgG in
caso di deficit totale di IgA.
- Nei bambini di età superiore ai 2 anni, gli AGA non devono essere utilizzati per la diagnosi, per la loro bassa sensibilità e specificità.
BIOPSIA INTESTINALE
La biopsia intestinale viene eseguita nel corso di un’esofagogastroduodenoscopia.
Per la valutazione della biopsia intestinale deve essere utilizzata la classificazione di Marsch modificata da Oberhuber,
che è un grading istologico accettato universalmente (12) (tabella 3).
44
percorso diagnostico
Tutte le lesioni riportate nella tabella sono compatibili con la diagnosi di MC ed autorizzano la formulazione della diagnosi, quando supportate dalla sierologia e dalla clinica.
L’accuratezza diagnostica ottimale per l’interpretazione istologica della biopsia intestinale si raggiunge eseguendo almeno 4 prelievi bioptici intestinali, che vanno esattamente orientati su acetato di cellulosa. Le sedi di tali prelievi devono essere
almeno una al bulbo duodenale e le restanti in seconda e terza porzione duodenale. In questo modo si riduce significativamente il numero di esami di difficile interpretazione (13,14).
In rarissimi casi selezionati (soggetti con forte sospetto clinico e presenza di genetica predisponente, con biopsia normale e/o anticorpi assenti, vedi figura 1), potranno essere di aiuto alla diagnosi indagini sul prelievo bioptico di immunoistochimica (anticorpi monoclonali anti-CD3/CD8, ricerca infiltrato linfocitario gamma/delta) e di produzione in situ di anticorpi anti-tTG, indagini che possono essere effettuate in laboratori specializzati (15).
Nei rari casi di difficile diagnosi, questa dovrà necessariamente basarsi anche e soprattutto sulla risposta clinica alla dieta
aglutinata e sulla dimostrazione della glutine-dipendenza della lesione intestinale.
In sintesi:
- in caso di positività sierologia, un’unica biopsia intestinale (con 4 prelievi nelle sedi su esposte) è sufficiente
per una diagnosi di certezza (“per tutta la vita”);
- in assenza di positività per anticorpi specifici, la diagnosi definitiva dovrà essere confermata dalla ripetizione di una seconda e a volte anche da una terza biopsia dopo challenge per dimostrare la glutine-dipendenza della lesione intestinale
in rari casi selezionati potranno essere di ausilio approfondimenti su prelievo bioptico, eseguibili in laboratori
specializzati.
ANALISI GENETICA:
La malattia celiaca è strettamente associata ad alcuni specifici alleli degli antigeni di istocompatibilità di classe
seconda, noti come HLA DQ2 (presente nel 90-95% dei celiaci) e HLA DQ8 (presente nel 5% dei celiaci). Sembra che
solo il 2% dei soggetti con MC non possieda questi peculiari alleli HLA, che peraltro sono presenti nel 25-30% della
popolazione generale (16).
Sulla base di tali osservazioni è evidente che la presenza di questi alleli ha un alto valore predittivo negativo e un
basso valore predittivo positivo. In altre parole la presenza degli alleli DQ2 e DQ8 è una condizione necessaria, ma non
sufficiente, per la diagnosi di celiachia. La loro ricerca ha lo scopo di escludere la diagnosi piuttosto che di formularla.
Infatti, in loro assenza, la MC è altamente improbabile, mentre nei casi dubbi ( soggetti con forte sospetto clinico in assenza
di anticorpi specifici) la loro presenza può orientare all’esecuzione della biopsia intestinale.
PROTOCOLLO DIAGNOSTICO
Primo obiettivo dell’iter diagnostico è quello di individuare i soggetti con segni e/o sintomi sospetti di celiachia da
sottoporre alla determinazione degli anticorpi anti-transglutaminasi e ai quali proporre, nel caso di positività degli
stessi, l’esecuzione della biopsia intestinale per la conferma diagnostica.
Nel Friuli Venezia Giulia, sulla base di un’esperienza dei General Practitioners inglesi (17), per un anno è stata applicata da
parte dei Medici di Medicina Generale (MMG) e dei Pediatri di Libera Scelta (PLS) la strategia del “case findings” con l’obiettivo
di selezionare sulla base di una griglia di
segni e sintomi, i soggetti da sottoporre al dosaggio degli anticorpi h antitTG. Il 2,5% dei 1488 pazienti selezionati sulla
base della griglia dei sintomi da parte di 66 MMG e 60 PLS è risultato positivo per h anti-tTG e in 32 su 37 casi, la biopsia intestinale ha confermato la diagnosi di celiachia (18).
Data la difficoltà di creare una griglia che sia al contempo sufficientemente semplice ed onnicomprensiva delle svariate
manifestazioni cliniche della celiachia, vengono proposti come ausilio e orientamento per la diagnosi di celiachia sia nell’adulto che nel bambino alcuni criteri clinici, già utilizzati nel Friuli Venezia Giulia (tabelle 4 e 5) (18).
45
46
percorso diagnostico
percorso diagnostico
Una volta selezionati i soggetti con sospetto clinico di celiachia, viene attivato il percorso diagnostico riassunto in figura 1.
Il protocollo proposto, che delinea un iter diagnostico basato su criteri scientifici condivisi, risulta appropriato per porre
od escludere, nella grande maggioranza dei casi, la diagnosi di MC.
L’esame da eseguirsi in prima battuta è la ricerca degli h anti-tTG IgA ed il dosaggio delle IgA totali. Nel caso le IgA
totali dovessero risultare < 5 mg/dl, andranno dosati gli h anti-tTG IgG, che nei soggetti con deficit di IgA si sono dimostrati dotati di elevata sensibilità.
Nei bambini di età inferiore ai 2 anni, come già detto, si esegue anche la ricerca degli AGA IgA o IgG (in caso di deficit di IgA).
47
percorso diagnostico
Positività anticorpi anti-transglutaminasi:
In caso di positività della ricerca degli h anti-tTG si eseguirà la biopsia duodenale e la diagnosi di celiachia sarà confermata se viene riscontrata una lesione duodenale compatibile con la classificazione di Marsch.
Se la sierologia è positiva e la biopsia è normale si procede alla determinazione degli alleli HLA DQ2/DQ8:
- se il soggetto non possiede gli alleli HLA DQ2 e DQ8, gli h anti-tTG sono da considerarsi dei falsi positivi e la diagnosi di
celiachia è quasi certamente da escludere. È noto tuttavia dalla letteratura che esistono rari casi di intolleranza al glutine che non presentano l’aplotipo DQ2/DQ8 (19).
- se invece la ricerca degli HLA DQ2/DQ8 risulta positiva, il caso deve essere inviato presso un centro specialistico di riferimento che avrà essenzialmente due opzioni:
a) monitorare l’andamento degli anticorpi nel tempo e decidere se ripetere eventualmente la biopsia duodenale (utilizzando metodiche più sofisticate);
b) in rari casi fortemente sintomatici, eseguire un trial con dieta aglutinata per valutarne l’impatto sul quadro clinicoanticorpale.
Negatività anticorpi anti-transglutaminasi
In caso di negatività della ricerca degli h anti-tTG, la diagnosi di celiachia è altamente improbabile per l’elevata sensibilità
del test.
Se vi è un forte sospetto clinico (in particolare tutti i sintomi legati al malassorbimento, non altrimenti spiegati), e solo in
questo caso data l’alta prevalenza degli HLA DQ2/DQ8 nella popolazione generale, andrà eseguita la ricerca degli aplotipi
HLA DQ2/DQ8:
- se assenti la diagnosi di celiachia potrà essere definitivamente esclusa;
- se presenti il caso deve essere inviato presso un centro specialistico di riferimento per l’esecuzione, previa rivalutazione della clinica ed eventuale ripetizione degli anticorpi, della biopsia intestinale, utilizzando metodiche più sofisticate,
e per la valutazione di un possibile trial clinico con GFD.
È necessario che i centri di riferimento di terzo livello al quale i rari pazienti con difficoltà diagnostiche dovranno essere
inviati siano in grado di eseguire sulla biopsia intestinale anche indagini di ultrastruttura, immunoistochimica e/o test in
grado di valutare la presenza di “segni di attivazione” mucosale, anche nell’ambito di progetti di ricerca atti a valutare correttamente questi rari casi.
FORMALIZZAZIONE DELLA DIAGNOSI
Un volta definita la diagnosi di celiachia viene avviato un iter di presa in carico del paziente che prevede:
- ricerca di patologia associata e di complicanze legate alla celiachia;
- adeguata istruzione del paziente e della famiglia sull’alimentazione senza glutine;
- informazioni al paziente sull’ esistenza di associazioni di volontariato operanti sul territorio regionale e nazionale.
Ricerca di patologia associata e di complicanze legate alla celiachia
La celiachia si associa frequentemente (fino al 25% dei casi diagnosticati in età adulta) a patologie autoimmuni, alcune
frequenti e asintomatiche all’esordio, come la tiroidite, altre meno frequenti e clinicamente evidenti, come il diabete insulino-dipendente e la sindrome di Sjogren.
Importante pertanto è raccogliere un’accurata anamnesi familiare e ricercare segni subclinici, possibili indicatori di una
malattia autoimmune.
Si consiglia di determinare in tutti i celiaci neo-diagnosticati, gli anticorpi anti-tireoglobulina e anti-tireoperossidasi (TPO)
e di valutare la funzionalità tiroidea per la frequente associazione con la tiroidite. Vanno inoltre ricercate le complicanze
legate principalmente al malassorbimento (anemia sideropenica e da deficit di acido folico, osteopenia, ipocolesterolemia,
ipoalbuminemia).
48
percorso diagnostico
In sintesi :
- esami ematici consigliati alla diagnosi: emocromo, ferritina, albuminemia, folati, calcemia, fosforemia, PTH,
25-OH-vitamina D, glicemia, colesterolo totale e HDL, trigliceridi, transaminasi, fosfatasi alcalina, GT, prove
di funzionalità tiroidea e anticorpi anti-tireoglobulina e anti-TPO.
- la densitometria ossea è indicata nei soggetti diagnosticati in età adulta, anche se non vi è consenso unanime in letteratura.
Alimentazione senza glutine:
Il glutine è una proteina contenuta in alcuni cereali: frumento, farro, orzo, segale, avena. Seguire una dieta senza
glutine significa evitare alimenti contenenti questi cereali e i loro derivati. Si possono utilizzare invece altri tipi alimenti quali: riso, mais, miglio, manioca ed altri.
Il prontuario aggiornato degli alimenti senza glutine in commercio può essere consultato (ed è scaricabile) al sito della Associazione Italiana Celiachia (A.I.C.):
http://www.celiachia.it/aggiornamenti/; lo stesso sito propone pure un “prontuario
mobile”, scaricabile sul cellulare
L’aderenza alla dieta aglutinata è il principio basilare della terapia della celiachia.
La dieta senza glutine dovrà essere rigorosa e mantenuta per tutta la vita per consentire la completa remissione della
malattia e prevenire l’insorgenza di complicanze.
Al paziente andrà ricordato come la dieta naturalmente senza glutine, inserita in una corretta ed equilibrata alimentazione, è priva di effetti collaterali carenziali, ossia è una dieta sana, completa e bilanciata e non determina carenze
nutrizionali.
Non va dimenticato il forte impatto sociale che questa modalità di alimentazione ha in un soggetto abituato ad una
“dieta mediterranea”, in cui il pane e la pasta hanno un significato che va al di là del puro ruolo nutrizionale.
Per tale motivo al momento della comunicazione di diagnosi, ma anche nel corso del follow-up, diventa fondamentale
una corretta e continua informazione.
In questo ambito sarebbe auspicabile una stretta collaborazione tra specialisti dei presidi e dietisti dei Servizi di dietetica
clinica delle ASS, che consenta una adeguata formazione del soggetto e della sua famiglia nel seguire un’alimentazione
priva di glutine.
Ancora oggi, infatti, i dati della letteratura riportano una scarsa compliance alla dieta da parte degli adulti (fino al 5070%), dovuta principalmente ad un’inadeguata informazione ed a problematiche sociali (20,21).
In linea generale andrà favorita una dieta senza glutine “naturale”, ossia utilizzando cibi naturalmente privi di glutine,
andranno date informazioni sui cibi “gluten free” e sul riconoscimento di alimenti sicuramente privi di glutine.
Altre informazioni utili al paziente:
In questo ambito assume particolare importanza portare a conoscenza il paziente e i familiari dell’esistenza di associazioni di volontariato operanti sul territorio regionale e nazionale in grado di dare informazioni e supporto nella vita di tutti i
giorni nel drastico cambio delle abitudini alimentari.
In Friuli-Venezia Giulia è molto attiva la sezione regionale dell’Associazione Italiana Celiachia (A.I.C.) (sito internet:
http://www.celiachia.fvg.it/)
49
percorso diagnostico
MONITORAGGIO DELLA MALATTIA CELIACA:
La presa in carico del paziente affetto da celiachia coinvolge più figure professionali: il Medico di Medicina Generale e il
Pediatra di Libera Scelta assumono un ruolo prioritario, così come la dietista il cui intervento è importante per un corretto
orientamento, specie in caso di eventuali imperfezioni e/o trasgressioni alla dieta aglutinata.
Lo specialista dovrebbe essere interpellato quando vi siano dubbi sulla diagnosi, sull’insorgenza di possibili complicanze,
in caso di una malattia non responsiva alla dieta o comunque in ogni situazione inspiegabile e/o ingestibile.
Il follow-up del paziente celiaco è finalizzato al monitoraggio degli aspetti riassunti nella tabella 6.
FINALITÀ DEL MONITORAGGIO
• Verifica della compliance alla dieta e formazione continua sulla dieta senza glutine
• Identificazione precoce di patologia autoimmune associata
• Monitoraggio di eventuali alterazioni metaboliche (dislipidemia, steatoepatite non alcolica)
• Diagnosi precoce di possibili complicanze neoplastiche (linfoma) e non (malattia celiaca refrattaria, digiuno-ileite
ulcerativa, sprue collagenosica, iposplenismo), in particolare nei casi diagnosticati in età adulta
Verifica della compliance alla dieta senza glutine:
Il primo obiettivo del monitoraggio è quello di valutare la corretta adesione alla dieta priva di glutine.
Tra i diversi test sierologici oggi disponibili, gli h anti-tTG IgA (IgG nei soggetti con deficit totale di IgA) forniscono le
migliori informazioni per monitorare la compliance alla dieta senza glutine. Hanno il vantaggio inoltre di essere una
metodica riproducibile e confrontabile tra i diversi laboratori.
Tra gli altri test sierologici disponibili va segnalato che:
- gli EMA sono dotati di scarsa sensibilità per minime trasgressioni e soggetti a variabilità di risultato operatore dipendente;
- gli AGA sono gravati da numerose false positività e negatività;
- gli anticorpi anti-actina (AAA) potrebbero costituire un marker potenzialmente interessante per monitorare l’aderenza
alla dieta, in quanto sembra che il loro titolo si negativizzi entro i primi 5 mesi di dieta aglutinata. Tuttavia, attualmente, non vi sono in letteratura dati completamente validati, tali da giustificare un loro impiego nel follow-up.
Gli h anti-tTG rientrano nel range della norma nella maggioranza dei casi a sei mesi dall’inizio della dieta. Alcuni
soggetti hanno una negativizzazione più tardiva, dovuta principalmente alle possibili difficoltà iniziali a mantenere una
dieta stretta.
Ne consegue che solo una persistenza della positività dopo un anno di dieta andrà considerata come possibile
segno di trasgressioni.
La mancata negativizzazione del titolo anticorpale, tuttavia, non deve essere sempre conclusiva per una mancata aderenza alla dieta. È stato infatti dimostrato che gli anticorpi possono permanere elevati in un sottogruppo di pazienti, malgrado una rigorosa dieta senza glutine.
Nei casi dubbi, ad esempio persistenza di h anti-tTG elevati dopo un anno con anamnesi negativa per imperfezioni dietetiche, potrà essere ripetuta la biopsia intestinale per valutare la risposta istologica, ma questa dovrà essere riservata a casi
particolari e non essere la norma in considerazione alla segnalazione di persistenza di minime alterazioni macroscopiche e
istologiche anche in soggetti con buona adesione alla dieta aglutinata.
Peraltro piccole e saltuarie trasgressioni non positivizzano gli h anti-tTG.
Ne consegue che per verificare la stretta aderenza alla dieta un passo fondamentale nel monitoraggio del paziente è rappresentato dal counseling che dovrebbe essere effettuato sempre, prima della valutazione degli esami.
L’anamnesi deve essere eseguita in maniera accurata, possibilmente da personale dedicato e formato sull’argomento
con il supporto di una dietista.
In genere un’anamnesi accurata è in grado di fornire elementi utili che correlano bene anche con il danno intestinale.
Il counseling ha inoltre lo scopo di rivedere e ridiscutere con il paziente le abitudini dietetiche e di rafforzare le motivazioni del soggetto celiaco ad osservare una stretta aderenza alla dieta aglutinata.
Monitoraggio delle condizioni cliniche e di patologie associate
Durante i controlli andranno monitorate le condizioni cliniche del paziente, valutato l’accrescimento staturo-ponderale
nei bambini e verificata l’insorgenza di possibili patologie autoimmuni.
50
percorso diagnostico
Va ricordato che il paziente in dieta aglutinata può andare incontro a complicanze metaboliche che sono rappresentate
essenzialmente dalla dislipidemie, dal sovrappeso e dalla steatoepatite non alcolica, con frequenza maggiore rispetto ai
soggetti “non celiaci”.
Queste alterazioni possono essere determinate dal concorrere di più fattori: la ripresa dell’assorbimento intestinale e
una dieta non sufficientemente bilanciata, più ricca in grassi (contenuti anche nei cibi “gluten free”) e più povera di scorie.
Anche per tale motivo al momento della diagnosi e nel follow-up diventano cruciali la raccomandazione di una dieta che
comprenda il più possibile cibi naturalmente privi di glutine e il supporto di una dietista.
Controlli ematochimici (trigliceridi e colesterolo) sono indicati nel corso delle visite programmate.
Frequenza dei controlli
Il monitoraggio dovrebbe essere sistematicamente eseguito a tre mesi, sei mesi e un anno dalla formalizzazione della
diagnosi.
A tre mesi è sufficiente un controllo clinico con verifica della compliance alla dieta da parte del medico di medicina
generale o del pediatra di libera scelta, mentre a sei mesi e un anno andranno eseguiti alcuni esami bioumorali (emocromo,
ferritina, colesterolo totale e HDL, trigliceridi) e la determinazione degli anticorpi specifici (h anti-tTG IgA) e di alcuni markers
di autoimmunità (anticorpi anti-tiroide e TSH).
Successivamente si consiglia un controllo ogni 12-24 mesi con ripetizione degli esami ematochimici. L’obiettivo è quello di valutare la compliance alla dieta, la funzione assorbente intestinale e l’eventuale insorgenza di tiroidite autoimmune.
Altre indagini di laboratorio potranno essere richieste in casi selezionati sulla base di eventuali patologie associate
riscontrate alla diagnosi (anemia, diabete, osteopenia, ecc).
La densitometria ossea, se patologica, andrà ripetuta a distanza di 18 mesi dalla diagnosi.
Si consiglia che il controllo ad un anno dalla diagnosi sia eseguito dallo specialista, così come i controlli dei casi
con persistenza dei sintomi dopo i primi 6 mesi di dieta aglutinata, o con comparsa di nuovi sintomi e/o segni di
aggravamento.
Il monitoraggio consigliato è riassunto nella tabella 7.
Diagnosi precoce delle complicanze:
Oltre alle note conseguenze dovute al malassorbimento, altre rare e possibili complicanze a lungo termine della MC sono
rappresentate da:
51
percorso diagnostico
-
la celiachia refrattaria
la digiunoileite ulcerativa
la spue collagenosica
l’iposplenismo
il linfoma a cellule T
le neoplasie dell’orofaringe-esofago-intestino tenue
Tali complicanze sono rare (< 1%), interessano esclusivamente soggetti diagnosticati tardivamente o che non aderiscono
alla dieta senza glutine e sono tutte caratterizzate dalla mancata risposta alla dieta aglutinata e da gravi sintomi di malassorbimento.
Nei soggetti in cui non vi sia una risposta alla dieta senza glutine oltre a considerare l’ipotesi più probabile, che deve
essere sempre ben indagata, di trovarsi di fronte ad una malattia in fase attiva per trasgressioni volontarie, è importante
escludere le seguenti condizioni:
- intolleranza al lattosio
- insufficienza pancreatica
- intestino irritabile
Tali patologie andranno sempre prese in considerazione in caso di sospetto di una celiachia refrattaria o di altre complicanze.
Nei casi dubbi, dopo la determinazione degli h anti-tTG, e se positivi, dopo una rivalutazione della correttezza della
dieta, anche con la collaborazione della dietista, andrà eseguita la biopsia intestinale.
I rari casi di celiachia refrattaria, come anche le complicanze tumorali della celiachia (linfoma), necessitano per la loro
complessità di essere monitorati da Centri con elevata esperienza nel trattamento di tali patologie.
Gli approfondimenti diagnostici utili nel paziente celiaco con persistenza dei sintomi vengono schematizzati nella figura 2.
ITER DIAGNOSTICO IN CASO DI PERSISTENZA DI SINTOMI GASTROENTERICI
Screening nei familiari
La celiachia ha una chiara e sufficientemente caratterizzata predisposizione genetica (HLA DQ2/DQ8), con una forte
familiarità: concomitanza della patologia nei gemelli omozigoti del 90%, prevalenza nei familiari di primo grado del 10-15%.
52
percorso diagnostico
Ne deriva che tutti i familiari di primo grado, ma anche quelli di secondo grado che presentano una prevalenza simile,
dovrebbero essere sottoposti a screening sierologico, con esecuzione degli anti-tTG IgA e delle IgA totali (anche in questo
caso se sussiste un deficit di IgA totale andranno determinati gli h anti-tTG IgG) e in caso di positività seguire lo stesso iter
diagnostico con esecuzione di biopsia intestinale per confermare la diagnosi.
Follow-up nei familiari risultati negativi allo screening:
È noto peraltro che la positivizzazione degli h anti-tTG può avvenire nel tempo e quindi si rende necessario anche considerare un percorso di follow-up per i familiari risultati negativi allo screening sierologico, con la ripetizione nel tempo degli
anticorpi h anti-tTG.
Le indagini sierologiche andranno programmate ogni 2 anni circa nei soggetti in età pediatrica, anche se asintomatici,
per una diagnosi precoce e una prevenzione della complicanze, come la bassa statura, l’osteopenia o l’anemia e probabilmente anche per la prevenzione di una parte della patologia autoimmune, a forte impatto nell’età di rapido accrescimento,
mentre in età adulta sarà attivata una sorveglianza clinica atta ad identificare precocemente l’eventuale comparsa di segni o
sintomi suggestivi di malattia celiaca.
Determinazione dell’HLA:
Per ridurre il numero dei familiari, risultati negativi allo screening, da sottoporre ad esami sierologici seriati è utile la
determinazione dell’aplotipo HLA DQ2/DQ8. Questo test, permette di definire tra i familiari, i soggetti con predisposizione
genetica alla celiachia, ai quali riservare il follow-up anticorpale. La determinazione dell’aplotipo potrebbe trovare indicazione solo in casi selezionati e nei familiari di 1° grado in età pediatrica.
BIBLIOGRAFIA:
1. Fasano A, Catassi C. Current approaches to diagnosis and treatment of celiac disease: an evolving spectrum. Gastroenterology 2001; 120:636-651.
2. Tommasini A, Not T, Martelossi S, Ventura A, et al. Mass screening for coeliac disease using antihuman transglutaminase antibody assay. Arch Dis
Child 2004; 98:512-5.
3. Volta U, Bellantani S, Bianchi F et al. High prevalence of celiac disease in Italian general population. Dig Dis Sci 2001; 46:1500- 1505.
4. Kaukinen K, Turjanmaa K, Maki M et al. Intolerance to cereals is not specific for coeliac disease. Scand J Gastroenterol 2000; 35: 942-946.
5. Ventura A, Magazzù G, Gerarduzzi T, Greco L. Coeliac disease and the risk of autoimmune disorders. Gut 2002 (Dec); 51 (6): 897.
6. Kaukinen K, Maki M, Partanen J, Sievanen H, Collin P. Celiac disease without atrophy. Dig Dis Sci 2001; 46:879-887.
7. Walker-Smith J, Guandalini S, Schmizt J, Shmerling D, Visakorpi J. Report of working group of European Society for Pediatric Gastroenterology and
Nutrition: revised criteria for diagnosis of celiac disease. Arch Dis Child 1990; 65:909-11.
8. Sulkanen S, Halttunen T et al. Tissue transglutaminase autoantibody enzyme-linked immunoassorbent assay in detecting celiac disease.Gastroenterology 1998; 115:1322-1328.
9. Lenardht A, Martelossi S et al. Role of human-tissue transglutaminase IgG and antigliadin IgG antibodies in the diagnosis of celiac disease in patients
with selective immunoglobulin A deficiency. Dig Liver Disease 2004; 36:730-4.
10. Collin P, Helin H, Maki M et al. Follow-up of patients positive in reticulin and gliadin antibody test with normal small bowel biopsy findings. Scand J
Gastroenterol 1993; 28:595-598.
11. Baldas V, Martelossi S and SIGENP working group. Serological screening of celiac disease: choosing the best test under two years. Abstract. 38 Annual
meeting of the ESPGHAN. Porto, 2005.
12. Oberhuber G, Granditsch G, Vogelsang H. The histopathology of celiac disease: time for a standardized report scheme for pathologist. Eur J
Gastroenterol Hepatol 1999; 11:1185-1194.
13. Ravelli A, Villanacci et al. Variability of Histologic lesions in relation to biopsy site in gluten-sensitive enteropathy. Am J Gastroenterol 2005; 100:177185.
14. Thanasi E, Nenna R et al. Villous atrophy of the duodenal bulb in coeliac disease of children: a multicentre study. Abstract, 38 Annual meeting of the
ESPGHAN. Porto, 2005.
15. Kaukinen K, Peraaho M, Collin P, Partanen J, Woolley N, Kaartinen T, Nuutinen T, Halttunen T, Maki M, Korponay-Szabo I. Small-bowel mucosal transglutaminase 2-specific IgA deposits in coeliac disease without villous atrophy: a prospective and randomized clinical study. Scand J Gastroenterol 2005;
40:564-72.
16. Greco L, Corazza G et al. Genome search in celiac disease. Ann J Hum Genet 1998; 62:669-675.
17. Hin H et al. Coeliac disease in primary care: case findings study BMJ 1999; 318:164-7.
18. Berti I, Martelossi S et al. Celiac disease in primary care: evaluation of a case-finding strategy. Dig Liver Dis 2006;38 (7):461-467.
19. Karell K, Louka AS, et al. HLA types in celiac disease patients not carrying the DQA1*05-DQB1*02(DQ2) heterodimer: results from the European
genetics cluster on celiac disease. Hum Immunol 2003;
64:469-477.
20. Maki M, Collin P. Coeliac disease. Lancet 1997; 349:1755-59.
21. Vahedi K, Mascart F, Mary JY, et al. Reliability of antitransglutaminase antibodies as predictors of gluten-free diet
compliance in adult celiac disease. Am J Gastroenterol 2003; 98:1079-87.
NOTA:
Ad oggi la celiachia, nonostante sia ormai dimostrata un’elevata prevalenza della malattia, è inserita nell’elenco delle patologie rare, anche se il
Ministero della Salute sta rivedendo tale elenco.
Stante la normativa vigente, nella regione FVG la malattia può essere certificata nelle seguenti strutture accreditate:
53
percorso diagnostico
Trieste:
Clinica Pediatrica IRCSS “Burlo Garofolo”
U.O. Medicina Clinica – Azienda Ospedaliero-Universitaria “Ospedali Riuniti”
Udine:
U.O. Medicina 2 – Azienda Ospedaliero-Universitaria “ Santa Maria della Misericordia”
Clinica Pediatrica – Azienda Ospedaliero-Universitaria “Santa Maria della Misericordia”
Pordenone:
U.O. Gastroenterologia - Azienda Ospedaliera “Santa Maria degli Angeli”
S.O.C. Gastroenterologia – Centro Riferimento Oncologico IRCCS - Aviano (con particolare riguardo alle complicanze neoplastiche)
Ai sensi della circolare della Direzione Centrale Salute e Protezione Sociale, Regione autonoma FVG, n. 19100 del 23.10.2008, l’elenco aggiornato delle
strutture abilitate alla certificazione per il riconoscimento del diritto all’esenzione dalla partecipazione alla spesa per la MALATTIA CELIACA (cod. RI0060)
in assistiti in età adulta, residenti nel Friuli Venezia Giulia, va integrato con le seguenti, che si aggiungono a quelle di cui sopra, già abilitate ai sensi delle
deliberazioni giuntali n. 3277/2002, n. 2725/2003, n. 1427/2005 e n. 1480/2007 :
La ridefinizione delle strutture di riferimento per la diagnosi e cura della sprue celiaca viene rinviata alla revisione dell’elenco delle malattie rare a cura
del Ministero della Salute.
Segnaliamo infine i punti di contatto con l’Associazione Italiana Celiachia (AIC) – Sezione Friuli Venezia Giulia:
SEGRETERIA REGIONALE e AIC POINT-PORDENONE
Dal Santo Federica
Via Sandro Pertini 10 - 30026 Portogruaro (VE)
[email protected]
Indirizzo e-mail [email protected]
Cell. 335-7184264 Fax 0421-244303
AIC POINT-UDINE
Lanzutti Luisa
Via D’Aronco 8 – 33050 Castions di Strada (UD)
[email protected]
Tel. 0432-768655 Cell. 335-7185943
AIC POINT-UDINE1
Chiappa Giuliana
Via Massimo Misani 11 – 33100 Udine (UD)
[email protected]
Tel. 0432-401592 Cell. 366-3128062
AIC POINT-TRIESTE
Perspicace Maria
Via Sergio Forti, 24 34148 Trieste (TS)
[email protected]
Cell. 366-3128061
AIC POINT-GORIZIA
Macuz Susanna
Via Morelli, 43 34170 Gorizia
[email protected]
Cell. 366-3127906
54
Reale Andrea
Via Tiepolo, 87 - 33100 Udine
[email protected]
Tel. 0432-471368 Cell. 366-3128060
COMMISSIONE SCUOLE
Toffolini Laura
Via S.Fosca, 28 – Adegliacco - 33010 Tavagnacco (UD)
[email protected]
Cell. 366-3128059
percorso diagnostico
COMMISSIONE GIOVANI
In data 23 Aprile 2009 il Ministero della Salute ha dato annuncio, attraverso diffusione di comunicato stampa, della firma del
Dpcm con i nuovi Livelli Essenziali di Assistenza (LEA) del SSN. Il decreto contiene l’elenco delle prestazioni e servizi erogati
dal SSN, il nomenclatore tariffario dei presidi, delle protesi e degli ausili, oltre che i nuovi elenchi delle malattie croniche e
delle malattie rare esentate dal pagamento del ticket.
I nuovi elenchi, sanciscono, quindi, il preannunciato passaggio della celiachia dall’elenco della malattie rare a quello
delle malattie croniche. Come riporta il comunicato, infatti, “si evidenzia che la celiachia, data l’elevata prevalenza dei casi,
è trasferita nell’elenco delle malattie croniche”.
Il decreto, all’art. 14 “Erogazione di prodotti dietetici” ribadisce che “Il SSN garantisce le prestazioni che comportano l’erogazione di prodotti destinati ad un’alimentazione particolare alle persone affette da malattie metaboliche congenite, da fibrosi
cistica (….) e da morbo celiaco, compresa la variante della dermatite erpetiforme” (comma 1). Oltre che, “i prodotti erogabili
alle persone di cui ai commi 1 e 2, sono elencati nel Registro Nazionale istituito presso il Ministero della Salute, ai sensi dell’articolo 7 del decreto ministeriale 8 giugno 2001. Ai soggetti affetti da morbo celiaco, l’erogazione dei prodotti senza glutineè garantita nei limiti dei tetti massimi di spesa fissati dal medesimo Ministero della Salute” (comma 3). Gli artt 48 e 49, infine, rimandano agli allegati 7 e 8, che sostituiscono i vecchi elenchi delle malattie rare e croniche.
Nell’allegato 8 si individua, infatti, contraddistinta dal codice 059, la celiachia e le prestazioni in esenzione, definite
come “LE PRESTAZIONI SANITARIE APPROPRIATE PER IL MONITORAGGIO DELLA MALATTIA, DELLE SUE COMPLICANZE E
PER LA PREVENZIONE DEGLI ULTERIORI AGGRAVAMENTI “
Resta da chiarire se si debba intendere che la diagnosi resti esclusa dall’esenzione, come la lettura farebbe presupporre e
come già ci era stato anticipato in precedenti incontri al Ministero della Salute. Altro punto da approfondire è la motivazione
della permanenza della dermatite erpetiforme nell’elenco delle malattie rare, contenuto nello stesso decreto come allegato 7.
CELIACI IN FRIULI-VENEZIA GIULIA
Celiaci iscritti in FVG (maggio 2008)
Nuove diagnosi all’anno
Incidenza stimata
1.250
300
1:100
Celiaci possibili in Regione 10.000
55
collaboratori di studio
I medici interessati possono richiedere al CEFORMED il booklet sullo “Scompenso Cardiaco” recentemente pubblicato.
Collaboratori di studio: una proposta formativa omogenea
nel FVG grazie al FONDO PROFESSIONI.
Perché è utile l’iscrizione del collaboratore di studio a Fondo Professioni?
A cura di Adriana Fasiolo - MMG - Ceformed
Nel maggio del 2008 si è dato il via a Gorizia ai primi corsi nel FVG di formazione per i collaboratori di studio del MMG con
la collaborazione di Fondo Professioni.
Ai primi due corsi sulla formazione di base,ne sono seguiti ulteriori due per la sicurezza del lavoratore, con il rilascio
degli attestati RSPP per il datore di lavoro.
Sono ora già programmati altri corsi formativi di secondo livello volti a qualificare le competenze informatiche del collaboratore.
Oggi IL FVG è stata la seconda regione in Italia, dopo la Sicilia, per numero di corsi espletati.
Gli eventi formativi svolti sono stati realizzati grazie al finanziamento promosso da Fondo Professioni.
Che cos’è Fondo Professioni? È un fondo privato per la formazione GRATUITA dei dipendenti degli studi professionali,ovvero dei nostri collaboratori di studio.
Ogni mese, a carico del datore di lavoro (MMG o PLS) viene obbligatoriamente versato un contributo pari allo
0,30%all’INPS in un fondo pubblico che utilizza in modo del tutto aspecifico le risorse destinate alla formazione. Se questa
quota viene indirizzata, a costo zero, a Fondo Professioni, anziché al Fondo dell’INPS,le risorse che ne derivano sono utilizzate da Fondo Professioni per il finanziamento dei corsi di formazione per i nostri dipendenti. Un’opportunità da non
perdere che ci permette di” tarare” la formazione di nostri collaboratori secondo le nostre specifiche necessità attraverso
l’organizzazione autonoma dei corsi.
Come fare per far accedere alla formazione i nostri collaboratori?
È sufficiente comunicare al proprio consulente del lavoro (o commercialista) di aderire a Fondo
Professioni. L’adesione, gratuita, è libera,ovvero non vincolata da alcuna iscrizione associativa. (vedi modulo adesione allegato)
56
collaboratori di studio
È essenziale che, a riscontro dell’avvenuta iscrizione, compaia sul modello DM10 la sigla” FPro”(Fondo Professioni)con la
specifica, sulla colonna accanto, del numero di dipendenti assunti. (vedi esempio a piè di pagina)
Automaticamente la singola quota va ad accumularsi nel Fondo a disposizione dei nostri Studi per la formazione di collaboratori.
Promuovere queste iniziative rappresenta un obiettivo che l ’area del management si è proposta per il 2009 al fine di
dare strumenti di qualificazione professionale omogenea a tutti i dipendenti degli Studi della nostra regione.
COMUNICAZIONE ADESIONE
Il sottoscritto Studio ____________________________________________________________________________________________________
con sede in ____________________________________________________________________________________________________________
via _____________________________________________________________________________________________________________________
COMUNICA
al proprio Studio di Consulenza ______________________________________________
LA PROPRIA DECISIONE DI ADERIRE AL “FONDO PROFESSIONI”
A FAR DATA DAL MESE DI
INVITA QUINDI LO STUDIO DI CONSULENZA A PROVVEDERE ALLE OPPORTUNE COMUNICAZIONI ALL’INPS CON LE MODALITÀ
PREVISTE DALLA CIRCOLARE N° 71 DEL 02/04/2003 E DAL MESSAGGIO N° 5684 DEL 01/03/2004
Lì ________________________________
Timbro e firma________________________________
57
fondo professioni
Dr Massimo Magi Presidente di
FONDOPROFESSIONI
Fondoprofessioni a sostegno dello sviluppo della Medicina Generale
La medicina generale si va sempre più configurando come una professione a livelli di complessità crescente in grado di candidarsi alla gestione generale delle attività di assistenza territoriale. Per questo il vecchio e romantico mito del Medico di Famiglia, professionista solitario ed isolato sta definitivamente tramontando. Una diversa realtà costituita da nuovi fattori
professionali si sta costruendo per sostenere tale evoluzione. In questo innovativo percorso
le “risorse umane” rappresentano un valore fondamentale senza il quale non sarebbe possibile intraprendere una strada di innovazione e sviluppo. Nell’area della Medicina Generale
però molte di queste figure non hanno una qualificazione e formazione, provenendo dai
percorsi più disparati. La condizione di genericità nella identità formativa dei collaboratori di
studio medico, oltre ad essere una connotazione negativa per la crescita della attività professionali, rallenta anche lo svilupparsi di figure nuove in grado di collaborare con il Medico nel
governo di specifiche aree della medicina di famiglia come ad esempio quelle dell’informatica o del settore socio-sanitario.
Fondoprofessioni, fondo interprofessionale per la formazione del Personale di Studio dell’
area degli studi professionali italiani, rappresenta una risorsa ad alto valore aggiunto nel percorso formativo dei dipendenti della medicina generale in grado di sostenere e finanziare
percorsi formativi di qualità con le risorse di cui dispone, generate dallo 0,30 % del monte
salari dei lavoratori iscritti al Fondo e versati senza costi aggiuntivi per i datori di lavoro, con i
contributi obbligatori all’ INPS. Una opportunità alla quale i medici di famiglia italiani e le loro
organizzazioni professionali stanno guardando con sempre maggiore interesse al fine di
rendere sempre più specifica e aderente alle esigenze la formazione dei dipendenti, supportando questo percorso di riorganizzazione della medicina generale. I titolari di studio medico o anche delle varie forme societarie ad essi collegati (cooperative, srl, studi associati, ecc.)
i cui dipendenti sono regolarmente assunti secondo il vigente CCNL, possono utilizzare questa opportunità per definire nuove e più aggiornate competenze professionali dei propri
dipendenti. Lo sviluppo delle attività formative per i Collaboratori di Studio Medico che è
stata avviata dalla FIMMG nella Regione FVG, così come in altre regioni, le risorse messe a
disposizione da Fondoprofessioni, rappresentano condizioni in grado di aprire nuove opportunità per gli studi professionali, per le categorie di lavoratori coinvolte e per la stessa
Regione, orientate a rafforzare nel territorio ruolo e funzioni del Medico di Famiglia e ad
individuare in un momento di crisi occupazionale, nuovi settori di attività lavorativa.
58
Sabato 12 settembre 2009
Palmanova (UD) Centro Congressi
Sabato, 12 settembre
congresso palmanova
“Cuore, droghe e psicofarmaci”
08:30
Registrazione partecipanti
12:20/13:00
Ipertensione arteriosa secondaria a uso
di droghe
D. Battigelli
09:00/09:40
Le cardiomiopatie nei soggetti con dipendenze patologiche
A. Di Lenarda
13:00/14:00
Che cosa possono fare il MMG e lo psichiatra per tutelare il paziente (e se
stessi)?
D. Battigelli, A. Cassin
14:00/15:00
Aritmie e morte improvvisa nei soggetti
in terapia con psicofarmaci
MG. Baldin, A. Cassin
15:00/15:40
La prevenzione del rischio cardiovascolare e metabolico nei pazienti che assumono psicofarmaci
D. Battigelli
09:40/10:20
10:20/11:00
Le sindromi coronariche acute nei soggetti con dipendenze patologiche
A. Di Lenarda
Le aritmie nei soggetti con dipendenze
patologiche e in terapia con metadone
MG. Baldin
11:00/11:40
Le endocarditi infettive nei soggetti con
dipendenze patologiche
MG. Baldin
11:40/12:00
Discussione
15:40/16:00
Discussione
12:00
Pausa
16:00/16:15
Questionario ECM
59
congresso palmanova
Corso a numero chiuso rivolto a :
nr. 100 Medici suddivisi nelle seguenti discipline: Medici Specialisti in Cardiologia, Medici Specialisti in Psichiatria e Medici di
Medicina Generale
Razionale Scientifico ed Obiettivi didattici:
Scopo del convegno è di produrre una rassegna aggiornata di tutte le alterazioni cardiovascolari conseguenti all’abuso/dipendenza di sostanze, all’uso terapeutico di psicofarmaci, fornendo raccomandazioni pratiche per la prevenzione, la
diagnosi precoce e la terapia
ELENCO RELATORI e MODERATORI
Dr.ssa Maria Grazia Baldin
Direttore SOC Cardiologia ASS 5 “Bassa Friulana”
Dr. Doriano Battigelli
Medico di Medicina Generale
Ceformed, Regione Autonoma Friuli-Venezia Giulia”
Dr. Angelo Cassin
Direttore del Dipartimento di Salute Mentale ASS6
Presidente Regionale della Società Italiana di Psichiatria
Dr. Andrea Di Lenarda
Direttore SC Centro Cardiovascolare ASS1
CREDITI FORMATIVI
la Società “Radiovision S.n.c..”, provider dell’Evento, ha provveduto ad inoltrare richiesta di accreditamento al Ministero della
Salute, secondo il Programma Nazionale di Educazione Continua in Medicina.
Importante: l’iscrizione all’incontro non dà automaticamente diritto a tutti gli iscritti all’ottenimento dei crediti ECM. È
necessario che i partecipanti siano presenti in sala per tutta la durata delle sessioni accreditate; che provvedano a firmare i
registri di entrata ed uscita e che riconsegnino, al termine della manifestazione stessa, le schede di valutazione e di apprendimento debitamente compilate.
Come si arriva:
Meeting Point San Marco - Via Scamozzi, 5 - 33057 PALMANOVA (UD)
l’autostrada A4 (da e per Venezia/Trieste uscita casello di Palmanova);
autostrada A23 (da e per Udine/Tarvisio uscita casello di Palmanova);
statale 352;
SEGRETERIA ORGANIZZATIVA
Radiovision di D’Este Guiscardo & C. S.n.c.
Via delle Industrie, 142/B - 30020 – Marcon (VE)
Tel. 0415952420 / 421 - Fax. 0415952422
E mail: [email protected]
CON LA COLLABORAZIONE DI:
CEFORMED
CENTRO REGIONALE DI FORMAZIONE PER L’AREA DELLE CURE PRIMARIE
Via Galvani n. 1 – 34074 MONFALCONE (GO)
tel e fax 0481/487578 - E-mail : [email protected] - sito web : www.ceformed.it
SPONSORS DELL’EVENTO
60
XIII Congresso del Centro Regionale di Formazione
per l’Area delle Cure Primarie
Grado, Palacongressi Giovedì 24 settembre 2009
“LA SALUTE NEL RESPIRO”
Razionale scientifico
congresso grado
CEFORMED
CENTRO REGIONALE DI FORMAZIONE
PER L’AREA DELLE CURE PRIMARIE
Le patologie respiratorie sono oggi fra le principali cause di morbilità e di mortalità a livello mondiale e la loro
incidenza è in continuo aumento: secondo l’Organizzazione mondiale della sanità (OMS)nel 2020 queste malattie
rappresenteranno la terza causa di morte nel mondo. Cento miliardi di euro l’anno, questo è il costo delle malattie
respiratorie in Europa, qualcosa come 118 euro a persona, dovuti in primo luogo alla perdita di ore di lavoro (48,3
miliardi di euro) e ai ricoveri ospedalieri (17,8 miliardi di euro). I costi diretti assorbono circa il 6% del bilancio sanitario totale dell’ Unione Europea. In Italia nel 2006 sono morte 35427 persone per malattie respiratorie e 33275
per tumori maligni di trachea, bronchi e polmoni, per un totale di 68702 decessi. Bronchite cronica e asma bronchiale colpiscono in Italia oltre quattro milioni di persone, pari almeno al 6,4% della popolazione, ma il dato più
preoccupante sulla salute respiratoria degli italiani è però quello della scarsa consapevolezza: un malato su due
non sa di esserlo, il 30% degli asmatici e fino al 75% dei pazienti con bronchite cronica non ha mai ricevuto una
diagnosi.
Questa sottovalutazione evidenzia la necessità di affrontare meglio le tematiche delle malattie respiratorie, a
partire dall’individuazione dei fattori di rischio e dallo studio dell’impatto sui nostri polmoni di fumo e inquinamento. Il miglioramento della qualità dell’aria che respiriamo è certamente uno degli obiettivi perseguibili per la
riduzione dell’incidenza delle malattie croniche respiratorie e per la promozione della salute. La prevenzione, rappresentata dal miglioramento degli stili di vita, in particolare dalla riduzione dell’abitudine al fumo, è l’arma
migliore per combattere i danni ai nostri polmoni ma, anche se la nostra legge antifumo è riconosciuta fra le
migliori del mondo, vi sono ancora in Italia circa 11 milioni di persone dipendenti dal tabacco.
Da tempo reti di esperti, GINA per l’asma e GOLD per la bronchite cronica, hanno approvato delle linee guida di
diagnosi e cura che vengono continuamente aggiornate valutando le migliori evidenze scientifiche disponibili e di
fatto per entrambe le patologie sono praticabili trattamenti efficaci e piani di cura consolidati. Tuttavia ancor’oggi
solo pochi pazienti raggiungono un buon controllo della malattia ed assumono una terapia appropriata, con tutte
le ricadute negative non solo a livello prognostico individuale ma anche collettive per il conseguente incremento
dei costi gestionali diretti ed indiretti determinati dalla patologia.
61
congresso grado
Non è un caso se la valutazione della qualità professionale e la dimostrazione di appropriatezza nella gestione
delle patologie croniche rappresentano oggi tematiche di grande attualità ed interesse per tutto il sistema sanitario. Negli ultimi anni si è osservata una crescente applicazione dei metodi epidemiologici nella programmazione
dei servizi sanitari e sociosanitari, nel “governo clinico” attraverso analisi articolate dei profili prescrittivi e dei percorsi assistenziali, nella valutazione della qualità delle prestazioni erogate e della loro ricaduta in termini clinici ed
economici.
L’audit clinico, processo ciclico di miglioramento della qualità professionale e strumento multidisciplinare e
multiprofessionale per lo sviluppo delle competenze cliniche e della responsabilità pubblica, è la metodologia di
intervento che ci consentirà di raggiungere un miglioramento effettivo delle performance per l’appropriatezza
gestionale delle malattie respiratorie come delle altre patologie croniche.
Nel 2009, anno per la salute del respiro, il tradizionale Congresso del Centro Regionale di Formazione per
l’Area delle Cure Primarie della Regione Friuli Venezia Giulia, giunto alla tredicesima edizione, viene dedicato a
questi importanti aspetti e si rivolge anche ai programmatori, ai responsabili dei servizi sanitari e socio-assistenziali, a tutti gli operatori che lavorano a vari livelli di responsabilità con professionalità in ambito sanitario, nell’
auspicio di un comune passo in avanti verso più appropriati interventi sanitari ed una migliore qualità della vita
per tutti i cittadini.
PROGRAMMA PRELIMINARE
PRIMA SESSIONE (9-11)
L’asma bronchiale: stato dell’arte
1) From the cradle to the grave: l’evoluzione dell’asma dal bambino all’adulto
2) Prendersi cura del paziente asmatico
(presentazione di casi clinici paradigmatici in grande gruppo, interazione con televoto e discussione
guidata)
a. La comunicazione e il counselling
b. La diagnosi
c. La terapia
d. ll monitoraggio
e. Il trattamento delle riacutizzazioni
SECONDA SESSIONE (11-13)
Ambiente e salute
1) La salute del Respiro
2) L’inquinamento dell’aria in Regione FVG
3) Amianto: un percorso di sorveglianza sanitaria in FVG
4) I fattori di rischio ambientali emergenti
TERZA SESSIONE (14.30-17.30)
BPCO: quando il “governo” passa dai dati
1) Alla ricerca dell’appropriatezza diagnostica e terapeutica
2) Prendersi cura del paziente con BPCO
(presentazione di casi clinici paradigmatici in grande gruppo, interazione con televoto e discussione
guidata)
3) Definizione degli indicatori di buone pratiche nella gestione della BPCO
4) BPCO: audit e benchmarking
QUARTA SESSIONE (17.30- 18.30)
La salute non deve andare in fumo…
1) Le evidenze scientifiche
2) L’alleanza tra medico e cittadino
3) Cure primarie e centri antifumo
62
IL CEFORMED INVITA A COMUNICARE ALLA
REDAZIONE DI “MEDICINA E SANITÀ” TUTTE LE
ATTIVITÀ, I PROGETTI, LE SPERIMENTAZIONI,
LE LINEE-GUIDA, I PERCORSI DIAGNOSTICOTERAPEUTICI RIGUARDANTI LE CURE PRIMARIE ELABORATE DALLE AZIENDE SANITARIE,
DAI DISTRETTI O DA REALTÀ PROFESSIONALI
DEL FRIULI VENEZIA GIULIA, AI FINI DELLA
LORO DIVULGAZIONE E DISCUSSIONE NELLA
RIVISTA.
Via Galvani n. 1 - 34074 Monfalcone
tel. e fax 0481 487578
E-mail: [email protected]
http://www.ceformed.it
63
64