Analisi strutturale
Identificazione dei gruppi funzionali: Ammine
Sono sostanze a carattere basico derivate dall’ammoniaca per sostituzione degli
idrogeni con derivati alchilici o arilici. Si distinguono in alifatiche ed aromatiche e a
seconda del num di sostituenti, in primarie, secondarie e terziarie.
Stato fisico
Serie alifatica metil, dimetil e trimetilammina sono gas; termini successivi sono
liquidi (trietilammina p.e. 88.8°C, tri-n-propilammina p.e.155-8°C); quelli superiori
sono solidi (tri-n-dodecilammina p.f. 15.5°C)
Serie aromatica primi termini liquidi altobollenti (Anilina p.e. 182°C) i successivi
sono solidi (N,N-difenilammina p.f.. 119-11°C; N,N-bis(2-naftilammina) p.f.172-3°C.)
Solubilità
Serie alifatica I primi termini sono solubili in H2O, quelli superiori sono immiscibili.
Sono in genere solubili in Et2O.
Serie aromatica sono tutti insolubili in H2O e solubili in Et2O.
Analisi strutturale
Identificazione dei gruppi funzionali: Ammine
Basicità
Sono basi deboli
RNH2+ H2O
RNH3+
+
OH-
𝐾𝑏 =
𝑅𝑁𝐻3+ 𝑂𝐻 −
𝑅𝑁𝐻2
La basicità delle ammine è legata alla particolare struttura dell’atomo di azoto che è
piramidale come nella NH3 e possiede una coppia di elettroni libera ed è questa che ne
determina le proprietà basiche e nucleofile. Il numero e la natura dei gruppi legati
all’azoto sono molto importanti nel determinarne la basicità e la nucleofilia.
Basicità: II > III > I
Questo comportamento è dovuto al fatto che le ammine II, che dovrebbero avere una
basicità intermedia tra le III e le I, quando vengono protonate in ambiente acquoso,
subiscono una migliore solvatazione rispetto alle III. Questo a causa del loro minore
ingombro sterico. Operando in solventi non acquosi si elimina il fenomeno della
solvatazione e quindi i gruppi alchilici esercitano tutta la loro influenza e pertanto la
scala di basicità, come teoricamente previsto, diventa:
Basicità: III > II > I
Analisi strutturale
Identificazione dei gruppi funzionali: Ammine
Basicità della serie aromatica
La delocalizzazione del lone pair dell’N nell’anello aromatico rende le ammine
aromatiche molto meno basiche di quelle alifatiche. La basicità diminuisce
all’aumentare della sostituzione: ArNH2 > Ar2NH > Ar3N
Anilina KB 4.2x10-10; difenilammina KB 7x10-14; trifenilammina neutra
La presenza di sostituenti sull’anello influenza la basicità dell’anilina
Sostituenti elettron-attrattori stabilizzano la base libera (miglior delocalizzazione del
lone pair nell’anello) e riducono la basicità sfavorendo la protonazione dell’N amminico;
Sostituenti elettron-donatori destabilizzano la base libera (peggior delocalizzazione del
lone pair nell’anello) e aumentano la basicità favorendo la protonazione.
Analisi strutturale
Identificazione dei gruppi funzionali: Ammine
Riconoscimento
1.
Ricerca del carattere basico
2.
Reazioni con acido nitroso
3.
Saggio delle carbilammine
4.
Saggio con CS2 (ammine primarie e secondarie alifatiche)
Separazione riconoscimento di ammine primarie, secondarie e terziarie
1.
Metodo dell’acido nitroso
2.
Metodo di Hinsberg
Preparazione dei derivati cristallini
Analisi strutturale
Identificazione dei gruppi funzionali: Ammine
Ricerca del carattere basico
Ammine solubili in H2O si prepara una soluzione acquosa e si misura il pH con
una cartina indicatrice; si osserva un pH basico in funzione dalla forza della base e
dalla quantità di sostanza disciolta
Ammine insolubili in H2O si prova la solubilità in HCl 2M
Analisi strutturale
Identificazione dei gruppi funzionali: Ammine
Reazioni con acido nitroso
La risposta a questo saggio consente di individuare il tipo di ammina, se è primaria,
secondaria o terziaria, e contemporaneamente di distinguere tra alifatiche e
aromatiche.
L’ammina viene disciolta in HCl diluito in una provetta, e la soluzione viene raffreddata
mediante bagno di ghiaccio. Vengono quindi addizionate 4-5 gocce di NaNO2 5% e si
osservano le modifiche dopo l’aggiunta.
2 NaNO2 + 2 HCl → 2 NO+ + H2O + 2 NaCl
Analisi strutturale
Identificazione dei gruppi funzionali: Ammine
Reazioni con acido nitroso: ammine alifatiche primarie
Le ammine primarie alifatiche reagiscono con NaNO2 a freddo con formazione di un
alcool primario e sviluppo di N2 (effervescenza).
RCH2NH2 + NaNO2 + HCl → RCH2OH + N2↑ + 2 H2O + NaCl
Possono dare interferenze:
•
amminoacidi (si forma un α-idrossiacido e N2↑)
•
Ammidi (si forma un acido e N2↑)
•
Idrazidi (si forma un isocianato e N2↑)
Analisi strutturale
Identificazione dei gruppi funzionali: Ammine
Reazioni con acido nitroso: ammine aromatiche primarie
Le ammine primarie aromatiche reagiscono con NaNO2 a freddo ma non si ha sviluppo
di N2. Si formano sali di diazonio che possono essere riconosciuti con il saggio della
copulazione.
Diazotazione
Copulazione
Analisi strutturale
Identificazione dei gruppi funzionali: Ammine
Reazioni con acido nitroso: ammine alifatiche e aromatiche secondarie
Le ammine alifatiche ed aromatiche secondarie formano le N-nitrosoammine, stabili,
insolubili e gialle (si forma un intorbidimento o un precipitato giallo)
Analisi strutturale
Identificazione dei gruppi funzionali: Ammine
Reazioni con acido nitroso: ammine alifatiche terziarie
Non reagiscono con acido nitroso perché il doppietto dell’azoto terziario non è
accessibile allo ione nitrosonio a causa del forte impedimento sterico. Perciò non si
osserva alcuna modifica della sol acquosa dopo l’aggiunta di NaNO2.
Reazioni con acido nitroso: ammine aromatiche terziarie
Le ammine terziarie aromatiche subiscono SEA ad opera dello ione nitrosonio. Si
formano i para-nitroso derivati delle ammine di partenza, di colore rosso-bruno in
ambiente acido e verde in ambiente basico
Analisi strutturale
Identificazione dei gruppi funzionali: Ammine
Riepilogo:
Ammina+HCl+NaNO2
Soluzione limpida con sviluppo di gas incolore (N2) Ammina primaria alifatica.
RCH2NH2 + HNO2 → RCH2OH + N2↑ + H2O
Soluzione rimane limpida senza sviluppo di gas, per aggiunta di β-naftolo si forma il colorante
azoico Ammina primaria aromatica.
Se si separa un olio o un solido giallastro ammina secondaria
Se non si osserva alcuna modifica della sol acquosa dopo l’aggiunta di NaNO2 Ammina
terziaria alifatica.
Se la soluzione assume una colorazione rossa e per aggiunta di NaOH ↓ verde Ammina
terziaria aromatica.
Analisi strutturale
Identificazione dei gruppi funzionali: Ammine
Saggio delle carbilammine: ammine primarie
Le ammine primarie (alifatiche ed aromatiche) in presenza di cloroformio in ambiente
nettamente basico a caldo portano alla formazione di carbilammine (isonitrili)
riconoscibili dal caratteristico odore agliaceo. La reazione procede attraverso la
formazione di diclorocarbeni che agiscono da elettrofili reagendo con le ammine.
Il saggio è estremamente sensibile e viene dato anche da tracce di ammine primarie
presenti come impurezze.
Analisi strutturale
Identificazione dei gruppi funzionali: Ammine
Saggio con solfuro di carbonio (saggio dei senfoli): ammine primarie e secondarie
alifatiche
Le ammine alifatiche primarie reagiscono con CS2 a T ambiente per dare i
corrispondenti alchil-ditiocarbammati.
Questi reagiscono con Ag+ per dare i corrispondenti isosolfocianato (senfoli, odore di
senape) e un precipitato di Ag2S (nero)
ditiocarbammato
Isosolfocianato
(senfolo)
Analisi strutturale
Identificazione dei gruppi funzionali: Ammine
Saggio con solfuro di carbonio
Le ammine aromatiche primarie ed alcune secondarie reagiscono a caldo per formare
le corrispondenti tiouree
Analisi strutturale
Identificazione dei gruppi funzionali: Ammine
Separazione di ammine primarie, secondarie e terziarie
A)
Metodo di Hinsberg - Reazione con cloruro di p-toluensolfonile in ambiente alcalino a freddo
(reazione di Schotten-Baumann)
Ammine primarie
para-toluensolfonammide
primaria
con
proprietà
acide,
nell’ambiente
di
reazione
è
in
forma
anionica
Ammine secondarie
para-toluensolfonammide
secondaria neutra
Ammine terziarie -> -> Non reagiscono
Rimane l’ammina terziaria con proprietà basiche
Analisi strutturale
Derivati cristallini di ammine primarie e secondarie:
•
Benzammidi
•
3,5-dinitrobenzammidi, p- nitrobenzammidi
•
Acetammidi
•
Benzensolfonamidi e p-toluensolfonamidi
•
Ftalimidi e 3-nitroftalimidi
•
N-formilderivati
•
Uree e tiouree sostituite
•
2,4-dinitrofenilderivati
Analisi strutturale
Derivati cristallini di ammine primarie e secondarie:
Analisi strutturale
Derivati cristallini di ammine terziarie:
Analisi strutturale
Identificazione dei gruppi funzionali: Amminoacidi
Composti che contengono contemporaneamente il gruppo -NH2 e –COOH.
Quando questi gruppi sono legati allo stesso carbonio (α) parliamo di α-amminoacidi
costituenti delle proteine.
Ad eccezione della glicina, il carbonio α è asimmetrico a.a. sono otticamente attivi.
Gli a.a. della serie naturale sono a configurazione (L): hanno stereochimica assoluta
correlata a quella della L-gliceraldeide. Secondo la nomenclatura IUPAC la serie
naturale ha configurazione assoluta (S).
Analisi strutturale
Identificazione dei gruppi funzionali: Amminoacidi
Allo stato solido ed in soluzione si trovano prevalentemente nella forma ionica dipolare.
Elevata fusibilità, bassa volatilità, bassa solubilità.
pKa1 acido carbossilico è compreso tra 1.8 e 2.5 più acidi dell’acido acetico (pKa=
4.76)
pKa2 gruppo amminico compreso tra 9 e 9.8.
Analisi strutturale
Identificazione dei gruppi funzionali: Amminoacidi
Stato fisico
Sono solidi cristallini bianchi, inodori, con punti di fusione superiori ai 200°C (non
netti), fusione che si accompagna in genere a decomposizione.
Solubilità
Sono generalmente solubili in H2O ed insolubili in Et2O.
Le soluzioni acquose hanno un elevato momento dipolare, dovuto al fatto che, ad un
determinato valore di pH (punto isoelettrico), gli amminoacidi possono esistere in
forma dipolare o zwitterionica.
Sono composti anfoteri infatti anche qualora non fossero solubili in acqua, lo sono sia
in acidi che in basi diluite. Il pH delle loro soluzioni acquose è neutro (6-7).
Analisi strutturale
Identificazione dei gruppi funzionali: Amminoacidi
reattività
Classe A (più reattivi)
Aldeide o chetone
Alcool
Ammina primaria
Ammide o immide
Ammina secondaria
Estere
Acido carbossilico o
anidride
Acido solfonico
Alogenuro alchilico
fenolo
Nitroderivato
Ammina terziaria
Alogenuro arilico
Saggi di riconoscimento
1.
2.
Saggi delle ammine alifatiche primarie
Saggio con acido nitroso
Saggio delle carbilammine
Saggio con ninidrina
Derivati cristallini
Classe B (meno reattivi)
Nitrile
Analisi strutturale
Identificazione dei gruppi funzionali: Amminoacidi
Saggi di riconoscimento
1.
Saggi delle ammine alifatiche primarie
Saggio con acido nitroso
Saggio delle carbilammine
Analisi strutturale
Identificazione dei gruppi funzionali: Amminoacidi
Saggi di riconoscimento
2.
Saggio con ninidrina (esclusivo degli α-aminoacidi). Si aggiunge la sostanza ad 1
ml di ninidrina e si scalda a fiamma diretta per qualche secondo, si ha in genere
una colorazione azzurro-violetto, ma anche rosso intenso (nel caso degli a.a.
basici) e giallo (per la prolina e l’idrossiprolina).
Analisi strutturale
Identificazione dei gruppi funzionali: Amminoacidi
Saggi di riconoscimento
2.
Saggio con ninidrina.
Analisi strutturale
Identificazione dei gruppi funzionali: Amminoacidi
la prolina non ha gruppi amminici primari e si comporta diversamente colorazione gialla
O
O
H2O
O
H
N
OH
OH
COOH
N
- H2O
OH
+
N
- H2O
O
O
O
O
OH
- CO2
+
N
O
O
COOH
O
O
OH
giallo
In ambiente debolmente alcalino le ammine alifatiche primarie reagiscono con la ninidrina in
maniera simile agli a.a.
O
O
H2O
OH
OH
OH
- H2O
H H
H
N
- H2O
N
H
H
O
O
O
O
R
R
R
N
O
OH
O
O
R
H2N CH2
B
-
H
O
H2O
O
OH
O
O
HO
HO
- H2O
O
NH
N
- H2O
O
O
violetto
O
HO
OH
OH
O
OH
R
- RCHO
H2N
NH
H
OH
O
O
Analisi strutturale
Identificazione dei gruppi funzionali: Amminoacidi
Derivati cristallini
Ammidi:
Benzammidi
3,5-dinitrobenzammidi
p-Toluensolfonammidi
Analisi strutturale
Identificazione dei gruppi funzionali: Amminoacidi
Derivati cristallini
Idantoine:
Per trattamento di un amminoacido con un isocianato si ottiene l’urea disostituita che
può essere trasformata in derivati dell’idantoina.
Analisi strutturale
Identificazione dei gruppi funzionali: Aldeidi e Chetoni
Il gruppo funzionale di aldeidi e chetoni è rappresentato dal carbonile (C=O).
Il carbonio del carbonile ha ibridazione sp2 e la struttura del gruppo è planare (la
geometria trigonale-planare, correlata all’ibridazione sp2 dell’atomo di carbonio, fa sì
che il gruppo carbonilico offra ampi spazi d’accesso per un reagente).
Nelle aldeidi un gruppo carbonilico è legato ad un atomo di idrogeno e a non più di un
radicale, secondo la formula generale:
Nei chetoni, invece, il gruppo carbonilico è legato direttamente a due radicali, secondo
la formula:
Analisi strutturale
Identificazione dei gruppi funzionali: Aldeidi e Chetoni
Gli elettroni impegnati nel doppio legame uniscono due atomi con elettronegatività
molto diversa per cui la nube elettronica π sarà attirata maggiormente dall’atomo di O
(+elettronegativo) con conseguente polarizzazione del C=O. Tale polarizzazione parziale
congiunta alla planarità del gruppo, che lo rende aggredibile sia sopra che sotto il
piano della molecola, rende questa funzione particolarmente reattiva soprattutto nei
confronti delle addizioni nucleofile.
Analisi strutturale
Identificazione dei gruppi funzionali: Aldeidi
Stato fisico
I primi due termini sono gassosi, da C3 a C10 sono liquidi e quelli superiori sono
solidi. Le aldeidi rivelano odore pungente nei termini inferiori mentre i derivati con più
di 9 atomi di carbonio sono utilizzati, per la loro gradevolezza, in profumeria.
Nel caso delle aldeidi aromatiche i termini a basso PM sono liquidi con caratteristico
odore di mandorle amare, quelli a PM più elevato sono solidi.
Solubilità
In funzione delle dimensioni della molecola: i primi due termini sono solubilissimi in
H2O, da C3 a C4 la solubilità è ancora sufficientemente elevata per poi diminuire
notevolmente con l’aumentare del PM.
Le aldeidi aromatiche invece, a meno di altre funzioni idrofile nella molecola, sono
pressoché insolubili in H2O, mentre sono solubili nei solventi organici come Et2O e
CHCl3.
Analisi strutturale
Identificazione dei gruppi funzionali: Chetoni
Stato fisico
I chetoni, meno tossici e aggressivi delle aldeidi, possiedono odore gradevole nei
termini inferiori e medi e sgradevole in quelli superiori. I dieci termini alifatici sono
liquidi volatili di odore gradevole. Da 12 atomi di C in su sono solidi. I derivati
aromatici sono tutti solidi.
Solubilità
I primi 2 termini (acetone e metil-etilchetone) sono solubili in acqua, da 3 a 5 atomi di
C la solubilità decresce e poi si annulla. Sono tutti solubili nei solventi organici (etere).
I termini aromatici sono tutti insolubili in acqua e solubili in etere.
Analisi strutturale
Identificazione dei gruppi funzionali: Chetoni
Saggi di riconoscimento
1. Reattività verso addizione/eliminazione nucleofila al C carbonilico
acido catalizzata
base catalizzata
2. Reazione di ossidazione della funzione aldeidica
Analisi strutturale
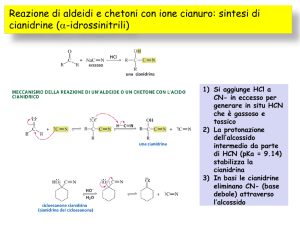
Identificazione dei gruppi funzionali: Aldeidi e Chetoni
Saggi di riconoscimento della funzione carbonilica
Formazione delle ossime
Saggio con 2,4-fenilidrazina
Saggi di riconoscimento della funzione aldeidica
Formazione di composti bisolfitici (anche per chetoni non stericamente ingombrati)
Saggio di Fehling
Saggio di Tollens
Saggio di Angeli e Rimini
Saggio con dimedone
Saggi di riconoscimento della funzione chetonica
Saggio dello iodoformio per i metilchetoni (Lieben)
Analisi strutturale
Identificazione dei gruppi funzionali: Aldeidi e Chetoni
Saggi di riconoscimento della funzione carbonilica
Formazione delle ossime. La reazione può essere catalizzata da sia da acidi che da basi
Analisi strutturale
Identificazione dei gruppi funzionali: Aldeidi e Chetoni
Saggio con 2,4-dinitrofenilidrazina
Si esegue il saggio in ambiente nettamente acido per evitare la precipitazione della 2,4dinitrofenilidrazina, gialla, che simulerebbe il precipitato di 2,4-dinitrofenilidrazone.
Se il composto carbonilico è solubile in acqua si utilizza il reattivo in HCl 2N; se il
composto carbonilico è insolubile in H2O si prepara una soluzione alcolica del
composto da saggiare e si aggiunge una soluzione alcolica di solfato di 2,4dinitrofenilidrazine.
Analisi strutturale
Identificazione dei gruppi funzionali: Aldeidi e Chetoni
Saggio con sodio bisolfito
(aldeidi e chetoni non ingombrati stericamente)
Esecuzione del saggio: Soluzione da saggiare + soluzione di bisolfito + soluzione di
salda d’amido e iodio.
Lo ione bisolfito è in grado di ridurre lo iodio a ioduro:
I2 + SO3= + H2O 2 I- + SO4= + 2 H+
Se è presente il composto carbonilico il colore blu-nero della soluzione rimane
invariato perché il bisolfito reagisce preferenzialmente con il composto carbonilico
piuttosto che con I2.
Se il composto carbonilico è assente il bisolfito reagisce con I2 e la salda d’amido si
decolora.
Analisi strutturale
Identificazione dei gruppi funzionali: Aldeidi e Chetoni
Saggio di Fehling (aldeidi)
Particolarmente adatto per le aldeidi alifatiche, α-ossichetoni e zuccheri riducenti.
Il reattivo si prepara al momento dell’uso mescolando volumi uguali di reattivo Fehling
A (CuSO4.5H2O) e di Fehling B (tartrato di sodio e potassio - sale di Seignette). Si
mescola il reattivo preparato con una soluzione acquosa dell’aldeide. Per riscaldamento
il Cu2+ viene ridotto dall’aldeide a Cu+ che precipita come ossido di rame (Cu2O) rosso.
RCHO + 2 Cu2+ + 5 OH- RCOOH + Cu2O + 3 H2O
La presenza del sale di Seignette serve ad impedire la precipitazione di Cu(OH)2 perché
complessa il Cu2+
Analisi strutturale
Identificazione dei gruppi funzionali: Aldeidi e Chetoni
Saggio di Tollens (saggio dello specchio d’argento) (aldeidi)
Positivo per aldeidi solubili in H2O (zuccheri riducenti). Interferiscono le sostanze
riducenti (amminofenoli, polifenoli)
Anche questo sfrutta il potere riducente delle aldeidi.
Esecuzione del saggio:
si prepara in provetta il reattivo al momento dell’uso mescolando AgNO3 e NaOH 2M
AgNO3 + NaOH AgOH↓ + NaNO3
Si aggiunge NH3 2M per disciogliere il precipitato di AgOH che si è formato.
AgOH + 2 NH3 [Ag(NH3)2]OH
Si aggiunge il composto in esame e si lascia a riposo per 10’ e poi si scalda a 50°C per
5’. In caso positivo si deposita uno strato di Ag metallico (specchio) sulle pareti della
provetta
2 [Ag(NH3)2]OH + RCHO RCOONH4 + 2 Ag + 3 NH3 + H2O
Analisi strutturale
Identificazione dei gruppi funzionali: Aldeidi e Chetoni
Saggio di Angeli e Rimini (aldeidi)
Le aldeidi, in ambiente basico per reazione con N-idrossi-benzensolfonammide,
formano il corrispondente acido idrossammico che può essere evidenziato in ambiente
acido con FeCl3 (sviluppo di una colorazione rosso-violetta).
Esecuzione del saggio:
Una punta di spatola del composto in esame + 3-4 gocce di soluzione etanolica
dell’acido benzensolfoidrossammico + 5 gocce di NaOH 2M . Si scalda per qualche
minuto, si raffredda, si acidifica con HCl 2M e si aggiunge FeCl3.
Analisi strutturale
Identificazione dei gruppi funzionali: Aldeidi e Chetoni
Saggio con dimedone (aldeidi)
Il dimedone in soluzione acquosa in presenza di aldeidi reagisce formando prodotti di
condensazione (condensazione aldolica) insolubili (formazione di una sospensione
lattescente e non di un vero e proprio precipitato).
Analisi strutturale
Identificazione dei gruppi funzionali: Aldeidi e Chetoni
Saggio dello iodoformio - saggio di Lieben (metilchetoni)
Esecuzione del saggio
Il composto carbonilico si scioglie in H2O o diossano, si aggiunge NaOH 2M e quindi
una soluzione di I2 in KI. La formazione di un precipitato giallino indica la presenza di
un metilchetone.
La reazione inizia con la disproporzione dello I2 in ambiente alcalino
I2 + 2 NaOH NaI + NaIO + H2O
L’ipoiodito di sodio reagisce con il metilchetone per dare un triiododerivato che in
ambiente basico si scinde in sale sodico dell’acido e iodoformio, solido giallo insolubile.
Analisi strutturale
Identificazione dei gruppi funzionali: Aldeidi e Chetoni
Saggio dello iodoformio - saggio di Lieben (metilchetoni)
E’ positivo anche per
Acetaldeide
CH3CHO CH3I + HCOO-
Etanolo
CH3CH2OH CH3CHO CH3I + HCOO-
Metilcarbinoli
CH3CHOHR CH3COR CH3I + RCOO-
E’ negativo per
CH3COCH2COOR
CH3COCH2CN
CH3COCH2NO2
La reazione viene data anche da Cl2/NaOH e da Br2/NaOH ma la reazione porta alla
formazione di CHCl3 e CHBr3 liquidi
Analisi strutturale
Identificazione dei gruppi funzionali: Aldeidi e Chetoni
Derivati cristallini
Azometine o basi di Shiff
Derivati idrazonici
Semicarbazoni o tiosemicarbazoni
Dimedon-derivati
Ossidazione delle aldeidi ad acido
Analisi strutturale
Identificazione dei gruppi funzionali: Aldeidi e Chetoni
Derivati cristallini
Azometine o basi di Shiff
Derivati idrazonici
Analisi strutturale
Identificazione dei gruppi funzionali: Aldeidi e Chetoni
Derivati cristallini
Semicarbazoni o tiosemicarbazoni
Dimedon-derivati