Ministero dell’Università e della
Ricerca Scientifica e Tecnologica
Università degli Studi di Palermo
Facolta’ di Farmacia
Dottorato di Ricerca in “Scienze Farmaceutiche”
XVII CICLO Triennio 2002-2005
METODI CHEMIOMETRICI NELLO STUDIO
DEGLI INIBITORI DI HIV-1:
TECNICHE STATITICHE MULTIVARIATE E
MOLECULAR DOCKING
Dottorando:
Dott. Marco Tutone
Docente guida:
Chiar.mo Prof. Anna Maria Almerico
Coordinatore del Dottorato:
Chiar.mo Prof. Gaetano Dattolo
Dipartimento Farmacochimico, Tossicologico e Biologico
INDICE
1. INTRODUZIONE
Pag. 1
2. HIV-1
Pag. 2
3. TRASCRITTASI INVERSA (RT)
Pag. 4
3.1 – Organizzazione molecolare
Pag. 4
3.2 – Inibitori della RT
Pag. 5
3.3 – Mutazioni e resistenze
Pag. 5
4. INTEGRASI (IN)
Pag. 7
4.1 – Organizzazione Molecolare
Pag. 7
4.2 – Inibitori di HIV-1 Integrasi
Pag. 9
5. PROTEASI RETROVIRALE (PR)
Pag. 13
5.1 – Organizzazione molecolare
Pag. 13
5.2 - Inibitori della Proteasi (IP)
Pag. 15
6. SCOPO DEL LAVORO
Pag. 19
7. MATERIALI E METODI
Pag. 20
7.1 – Hardwares e softwares
Pag. 20
7.2 – Analisi QSAR
Pag. 20
7.3 – PCA (Principal Component Analysis)
Pag. 20
7.4 – DA (Discriminant Analysis)
Pag. 21
7.5 - Indice di Similarità
Pag. 21
7.6 – CA (Cluster Analysis)
Pag. 22
7.7 – Regressione Multilineare (BMLR)
Pag. 24
7.8 – Test di Validazione
Pag. 26
7.9 – Docking Molecolare - LigandFit®
Pag. 28
8. RISULTATI E DISCUSSIONE
Pag. 34
8.1 – Analisi multivariata applicata agli NNRTI
Pag. 34
8.2 – Analisi multivariata applicata agli Inibitori della Proteasi
Pag. 42
8.3 – Confronto dei dati di analisi multivariata e docking per NNRTI e inibitori di PR
Pag. 49
8.4 – Considerazioni finali all’analisi comparata tra metodi multivariati e docking
Pag. 55
8.5 – Analisi multivariata applicata agli Inibitori di IN
Pag. 56
9. CONCLUSIONI
Pag. 62
BIBLIOGRAFIA
Pag. 63
Appendice I – Inibitori della Trascrittasi
Pag. 67
Appendice II – Inibitori della Proteasi
Pag. 70
Appendice III – Attività degli inibitori di Integrasi inclusi nello studio
Pag. 75
Appendice IV – Cluster Analysis
Pag. 84
Appendice V – Derivati inclusi nell’analisi QSAR
Pag. 88
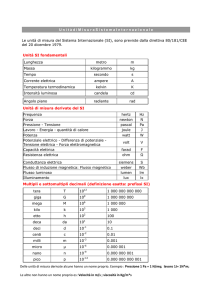
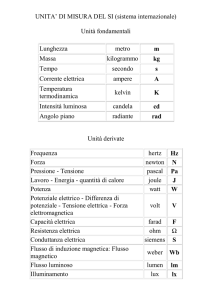
1. INTRODUZIONE
Una significativa riduzione di tempo e costi nella scoperta di nuovi farmaci è sempre stato
uno dei principali obiettivi della ricerca farmaceutica.
E’ noto che1 è necessario sintetizzare in media circa 5000 composti per arrivare ad avere
un solo derivato attivo sul mercato. Con l’avvento della chimica combinatoriale e delle
reazioni in fase solida si è raggiunto un punto di svolta nella ricerca, rendendo disponibili per
rapidi saggi, sia biologici sia computerizzati (High Throughput Screenings), milioni di
composti, sintetizzati in pochi steps, generalmente automatizzati.
Nell’ambito di questo progresso tecnologico anche l’analisi QSAR ed il Docking
Molecolare hanno ricoperto, e ricoprono tuttora, un ruolo di primaria importanza. Pur
trattandosi di indagini che necessitano a priori della sintesi e della valutazione di molecole
potenzialmente attive nei confronti di un bersaglio biologico, queste tecniche hanno permesso
di effettuare enormi passi in avanti.
Infatti, si può tranquillamente sostenere che dagli inizi del novecento ai primi anni ottanta
è stato scoperto un numero di molecole farmacologicamente attive pari a quello trovato dagli
anni ottanta fino ad oggi, cioè da quando la QSAR ed il Docking hanno cominciato ad avere
un’enorme influenza sulle fasi di scoperta e sviluppo dei farmaci.
In quest’ambito si inserisce il mio lavoro di tesi, che prevede l’utilizzo di tecniche di
QSAR e di Docking Molecolare per comprendere le relazioni tra specifici targets biologici ed
i loro potenziali inibitori; in particolare mi sono occupato dello studio di farmaci ad attività
anti-HIV-1.
2. HIV-1
HIV-1 è sicuramente il più noto fra i retrovirus. Oggi il suo ciclo vitale (Figura 1) è
conosciuto nei minimi dettagli, ed i possibili target farmacologici risultano pertanto numerosi.
Si possono distinguere degli ENTRY STEPS, che coinvolgono le glicoproteine dell’envelope
virale, e dei POST-ENTRY STEPS, che coinvolgono prodotti di geni accessori virali e le
proteine cellulari con le quali essi interagiscono.
Figura 1. Ciclo vitale di HIV-1
Il passaggio limitante la velocità dell’infezione retrovirale è spesso l’iniziale adesione del
virione alla cellula, che avviene prima che le glicoproteine dell’envelope virale interagiscano
con specifici recettori della cellula ospite, innescando la fusione. Molti sono i meccanismi
proposti; il più credibile di questi implica l’associazione di regioni cariche positivamente sulle
glicoproteine virali dell’envelope con proteoglicani carichi negativamente (eparansolfato)
presenti sulla superficie cellulare. L’envelope del virione di HIV (native) presenta sulla
superficie un complesso glicoproteico trimerico gp120-gp41, prodotti proteolitici di gp160, un
precursore da 160 kDa. In questo complesso, il fattore di fusione gp41 è nascosto; il legame
della glicoproteina gp120 al recettore CD4 dei linfociti T-Helper produce dei cambiamenti
conformazionali che inducono l’esposizione del loop gp120V3, il quale di conseguenza
interagisce con elementi strutturali di un appropriato corecettore, in genere una delle
numerose proteine G a 7 domini transmembrana, che funzionano da recettore per le
chemochine (CCR5 o CXCR4). (Figura 2)
Figura 2. Fusione del virus con il linfocita CD4
Una volta che il virione si è fuso con la cellula ospite, avviene il poco conosciuto
fenomeno dell’UNCOATING, cioè il rilascio degli acidi nucleici virali dal nucleo del capside
nel citoplasma della cellula ospite. Dopo questa fase, il virus procede alla trasformazione del
proprio genoma da RNA a DNA attraverso un enzima DNA polimerasi-RNA dipendente
[Trascrittasi Inversa (RT)] costitutiva del virus. Nel completamento della trascrizione, il
cDNA virale (a struttura circolare) sintetizzato è traslocato nel nucleo della cellula, dov’è
integrato nel DNA ospite per mezzo dell’enzima Integrasi (IN). Sfruttando poi l’apparato
sintetico della cellula, il virus procede alla sintesi di polipeptidi precursori delle proteine
strutturali, i quali sono poi processati in proteine funzionanti ad opera della Proteasi
retrovirale (PR). L’assemblaggio delle particelle e la maturazione originano virioni pronti ad
iniziare un nuovo ciclo di infezione.
3. TRASCRITTASI INVERSA (RT)
3.1 – Organizzazione molecolare
La Trascrittasi Inversa (RT) è un’eterodimero costituito da due unità polipeptidiche, uno
di 66 kDa (p66) e l’altra di 51 kDa (p51). L’unità polipeptidica p51 deriva dalla p66 per
scissione proteolitica del dominio C-terminale.
La subunità p66 è costituita da due componenti (p15 e p51) ed è suddivisibile in 5 domini:
il dominio della RNAsi-H e 4 sottodomini del dominio polimerasi (pol). La sua
conformazione simile a quella di una mano destra, ha portato a definire tre sottodomini (dita,
palmo, pollice); il quarto sottodominio pol, trovandosi interposto tra il resto del pol e RNAsiH, viene chiamato “connection”. (Figura 3)
Figura 3. Struttura a “mano destra” di RT
Il ruolo dell’unità p51 non è del tutto chiara poiché solo il dominio pol della p66 catalizza
la polimerizzazione. Le due unità polipeptidiche hanno la stessa sequenza aminoacidica, ma
nella p51 manca la componente p15 corrispondente al dominio della RNAsi-H nella p66; ciò
comporta una struttura secondaria differente e di conseguenza i peptidi equivalenti risultano
non attivi. Una tasca di dimensioni sufficientemente grandi per poter accogliere l’ibrido RNADNA si trova tra RNAsi-H e il sito attivo pol della p66; alcuni inibitori come la Nevirapina si
pongono in una tasca profonda del sito attivo pol senza sovrapporsi ad esso. La p51,
diversamente dalla p66, non presenta alcuna cavità ed i residui che si pensa siano coinvolti nel
processo catalitico (Asp185, Asp186, Asp110) sono essenzialmente sommersi, rendendo poco
chiaro il ruolo di questa subunità. Le differenze più evidenti nella posizione relativa e nei
contatti tra domini si riscontrano per il sottodominio “connection”. Nella p66 esso è connesso
con RNAsi-H con l’estremità del pollice e con il collegamento dell’unità p51, mentre nella
p51 è connesso a tutti gli altri tre sottodomini della p51 stessa così come al collegamento della
p66.2
3.2 – Inibitori della RT
A causa dell’importanza di RT nella replicazione di HIV, gli inibitori di questo enzima
sono potenziali agenti terapeutici nella battaglia contro il virus. Una classe di inibitori è
costituita dagli analoghi nucleosidi come AZT, ddI, ddC, d4T. Questi didesossi composti
mancano di un ossigeno in posizione 3’ e causano la terminazione della catena del DNA
quando vengono incorporati nel filamento crescente di DNA. Un’altra classe di composti che
inibisce RT è quella degli inibitori non nucleosidi (NNRTI). E’ stato dimostrato che questi
inibitori si vanno a legare in una tasca che si trova tra due beta foglietti del palmo della p66, a
circa 10 Å di distanza dal sito attivo della polimerasi. La superficie interna di questa tasca è
prevalentemente idrofobica essendo primariamente costituita da leucina, valina, triptofano e
residui di tirosina. Sebbene gli NNRTI siano composti chimicamente diversi, le strutture
cristalline rivelano un modo comune di binding. Studiando il complesso RT-Nevirapina si è
dedotto che il segmento da Tyr181 a Tyr188 assume una forma Ω-loop caratterizzata da due
catene connesse da almeno due legami idrogeno. Gli NNRTI assumono una conformazione
rigida “butterfly–like” che si sovrappone con una conformazione complementare a quella
formata dai residui di Tyr181 e Tyr188 del loop.
Sono stati postulati tre possibili meccanismi per l’inibizione di RT da parte di queste
classi di composti:
1. possibile alterazione della geometria del sito catalitico;
2. possibile chiusura dei sottodomini palmo e pollice, con riduzione della mobilità
del sottodominio pollice;
3. probabile deformazione del punto di aggancio del relativo filamento del sito
attivo polimerasico.
Inoltre le interazioni ligando-proteina possono variare da inibitore a inibitore e non sono
da trascurare le interazioni con le molecole d’acqua di solvatazione anche se la risoluzione
attuale della struttura dei complessi ligando-enzima non permette una precisa collocazione di
queste.
3.3 – Mutazioni e resistenze
Inevitabilmente, la rapida replicazione di HIV e la sua innata variabilità genetica porta a
generazioni di varianti del virus resistenti ai farmaci.
Anche gli NNRTI portano rapidamente all’emergere di ceppi mutanti di HIV-1, e quindi di
resistenza al farmaco,3,4 poiché le mutazioni si verificano in porzioni dell’enzima vicine al
presunto sito di legame degli NNRTI.5,6
Le mutazioni a livello dei residui aminoacidici che circondano la tasca di binding per gli
NNRTI possono dare origine a resistenza al farmaco attraverso meccanismi diversi:7
1. determinando la perdita della interazione ottimale tra l’inibitore e la proteina
(per esempio in Tyr-181, la mutazione Y181C può determinare una diminuzione
dell’interazione di tipo
con gli NNRTI);
2. creando impedimento sterico tra l’inibitore e la proteina (per esempio in Gly190, le mutazioni possono determinare un’interazione sterica repulsiva con
porzioni essenziali degli NNRTI, quale ad esempio l’anello ciclopropile della
Nevirapina);
3. inducendo cambiamenti conformazionali importanti nella tasca di binding in
seguito ad una qualsiasi mutazione.
Con l’eccezione della mutazione E138K, che si produce nella subunità p51, tutte le
mutazioni che determinano resistenza agli NNRTI hanno luogo nella subunità p66 della RT di
HIV-1.
4. INTEGRASI (IN)
4.1 – Organizzazione Molecolare
L’integrazione del DNA virale permette al virus di accedere al corredo genetico della
cellula infettata; questo evento assicura pertanto che sia la cellula madre che le successive
generazioni di cellule figlie esprimano i geni virali, mantenendo pertanto l’infezione allo stato
cronico.8
L’enzima Integrasi (IN) è il responsabile dell’inserimento del genoma virale all’interno
del patrimonio genetico della cellula infettata. HIV-1 Integrasi è una proteina di 32 kDa che
presenta una sequenza altamente similare a quella dei suoi omologhi retrovirali, specie quella
di ASV. E’ presente in vivo sia come monomero, sia come un equilibrio dinamico di dimeri,
trimeri ed oligomeri di ordine superiore. L’organizzazione molecolare del polipeptide
comprende tre domini funzionali indipendenti. (Figura 4)
Figura 4. Struttura molecolare di HIV-1 Integrasi
Il dominio N-terminale (residui 1-50) è caratterizzato dalla presenza di un motivo Zinc
Finger HHCC (12,16-40,43), che ricorda molto da vicino il canonico CCHH presente in un
gran numero di DNA Binding Proteins (DBPs). È stato dimostrato che la regione HHCC lega
ioni Zn2+ stabilizzando pertanto il dominio N-terminale e mediando le interazioni proteinaproteina. Comunque, a differenza della struttura - osservata nelle altre DBPs, il dominio
legante lo zinco di HIV-1 IN presenta una struttura interamente ad -elica.
Il dominio catalitico di HIV-1 IN si estende dal residuo 51 al 212, e presenta un motivo
altamente conservato D,D(35)E, comprendente i residui di Asp64 ed Asp116 separati da
Glu152 mediante 35 aminoacidi nella sequenza primaria; la sostituzione di uno di questi
residui acidi comporta una perdita irreversibile dell’attività enzimatica, dal momento che
molti studi indicano questo dominio come responsabile dell’attività di riconoscimento delle
estremità di DNA virale.9
Il dominio C-terminale (residui 213-288) è quello che presenta meno analogie tra i vari
retrovirus; tuttavia, come risulta dalla perdita di attività dovuta alla sua delezione, è essenziale
nel catalizzare la reazione di integrazione. La sua struttura è composta da due
-foglietti
antiparalleli, arrangiati in maniera simile alle regioni SH3 (Src Homology Region 3), che
mediano la dimerizzazione in soluzione. È stato inoltre dimostrato che il dominio C-terminale
possiede capacità non-specifiche di legame con il DNA.
Lo sviluppo di saggi in vitro per la reazione di integrazione ha rivelato la necessità di un
cofattore metallico, come Mn2+ o Mg2+; tuttavia, a causa della bassa concentrazione
intracellulare di Mn2+ (<10-7 M) rispetto a Mg2+ (~ 10-3 M), si tende generalmente ad
assumere quest’ultimo come il vero cofattore in vivo. Il meccanismo attraverso il quale il
cofattore metallico interviene nella reazione catalizzata dall’enzima non è ben definito,
sebbene sia ormai assodato che a livello della regione D,D(35)E il cambio conformazionale
causato dalla presenza dello ione metallico serva a mantenere il sito catalitico nella giusta
configurazione attiva.
Durante l’infezione del linfocita T CD4 Integrasi entra a far parte del cosiddetto
“Complesso di pre-integrazione” (PIC, Pre-Integration Complex). Questo è costituito da un
insieme di proteine che assiste IN nell’integrazione, e che comprende DNA virale, IN,
proteine della matrice virale (MA), trascrittasi inversa (RT), proteina del nucleocapside (NC),
proteina virale R (Vpr) e proteina intracellulare HMG I(Y).
L’integrazione del DNA virale comprende due singoli passaggi, illustrati nella Figura 5.
Figura 5. Meccanismo di integrazione del genoma virale
La preparazione del segmento di cDNA virale inizia nel citoplasma, dove IN catalizza il
taglio endonucleotidico (3’-Processing) all’estremità 3’-terminale di una sequenza conservata
5’-CA-3’, esponendo due gruppi –OH in 3’. Successivamente il DNA, con legate tutte le
proteine del PIC, viene trasportato all’interno del nucleo, dove avviene la seconda reazione
catalizzata da IN, detta di Strand Transfer. Questa consiste nell’inserzione, tramite attacco
nucleofilo, dei due gruppi –OH liberati durante la reazione precedente, sul genoma della
cellula ospite. La reazione avviene in maniera pressoché sequenza-indipendente, e la scelta
del sito specifico di attacco sembra essere suggerita da caratteristiche del DNA, quali lo stato
di impaccamento della cromatina e la presenza di DNA Binding Proteins. Dal momento che in
posizione 5’ il DNA appena integrato risulta privo di due basi, l’apparato cellulare di
riparazione del DNA provvede a riparare i gaps formati dall’integrazione (5’-Gap repairing).
Una terza attività catalitica di HIV-1 IN, chiamata Disintegrazione, è stata descritta in
vitro; questa reazione è apparentemente opposta a quella di Strand Transfer, e conduce alla
separazione del DNA virale precedentemente integrato e del DNA cellulare. Non vi è
comunque evidenza di un’attività di disintegrazione catalizzata in vivo da Integrasi.
4.2 – Inibitori di HIV-1 Integrasi
L’importante ruolo di IN nel ciclo replicativo di HIV-1 rende la ricerca di inibitori di
questo enzima una promettente strategia per combattere AIDS. Lo sviluppo estensivo di tali
farmaci è iniziato piuttosto recentemente, e ad oggi sono conosciute relativamente poche
classi di inibitori10, classificabili nelle seguenti categorie (Figura 6):
Polianioni (I)
Catecoli e Bis-catecoli (II)
Derivati dell’acido aurintricarbossilico (III)
Curcumine e derivati (IV)
Tirfostine (V)
Cumarine e derivati (VI)
Derivati triazinici (VII)
Derivati chinolinici e stirilchinolinici (VIII)
Arilamidi (IX)
Idrazidi e Salicilidrazidi (X)
Derivati di acidi dichetonici (XI)
Diarilsulfoni (XII)
Indani e spirobiindani (XIII)
Derivati dell’acido cicorico (XIV)
Vari (XV)
SO3SO3-O3S
HO
-O3S
SO3O
SO3-
HN
OH
HO
HN
O
OH
II - Catecoli e Bis-catecoli
NH
O
Me
NH
O
Me O
HN
O
O
HN
HO
OH
OH
I - Polianioni
HOOC
H3CO
OCH3
IV - Curcumine e derivati
HOOC
COOH
O
OH
O
HO
HO
OH
N
H
OH
N
H
CN
III - Acido Aurintricarbossilico e deirvati
CN
HO
OH
OH
OH
V - Tirfostine
O
O
O
O
O
O
HO
N
N
O
HO
OH
O
N
N
H
N
H
OH
O
OH
VI - Cumarine e derivati
VII - Derivati Triazinici
OH
OH
H
N
HOOC
O
N
OH
OH
O
HO
N
H
OH
VIII - Derivati Chinolinici e Stirilchinolinici
HO
OH
IX Arilamidi e Derivati
HO
O
OH
O
O
N
H
COOH
OH
N
H
X - Idrazidi e Salicilidrazidi
O
COOH
HO
XI - Derivati di Acidi Dichetonici
Figura 6. Classi di inibitori di HIV-1 IN
O
H2 N
OH
O
S
NH2
HO
HO
OH
OH
HO
XII - Diarilsulfoni
O
XIII - Indani e Spirobiindani
CO2H
AcO
O
CO2H
O
O
H
O
O
AcO
HO
HO3SO
H
O
O
OCH3
OAc
OAc
Cl
O
XIV - Derivati dell'Acido Cicorico
HO
O
H
XV - Vari
Figura 6 (continua)
Sebbene le attuali conoscenze circa la struttura e la funzione di IN siano alquanto limitate
(non sono disponibili ad oggi né una struttura intatta della proteina con tutti e tre i suoi
domini, né una struttura del complesso enzima/DNA) sono stati effettuati degli esperimenti di
docking dimostranti che l’esame dell’architettura del sito attivo può rivelarsi un metodo utile
per la progettazione di nuovi inibitori. Secondo i risultati di questi esperimenti11 il sito di
legame degli inibitori è formato da Asp64, Cys65, Thr66, His67, Glu92, Asp116, Gln148,
Ile151, Glu152, Asn155, Lys156 e Lys159. (Figura 7)
Questo sito è chiaramente dominato da residui polari, e la sfida nella progettazione di
nuove strutture consiste nel rendere il più forte possibile il legame degli inibitori sfruttando
tutte le interazioni disponibili, specialmente i legami ad H, e minimizzando nel contempo i
conflitti. Un sito di primaria importanza, che può servire da ancora per una forte interazione
dei ligandi, è dato dalle due lisine e dai residui vicinali. Carbossilati, sulfonati e fosfati sono i
gruppi d’elezione per l’interazione a questo livello, ma anche gruppi tetrazolici o catecolici
possono legarsi su questo sito; il legame è virtualmente completato dalle interazioni con
Thr66 ed Hys67.
Figura 7. Sito attivo di HIV-1 IN
Cys65 è occasionalmente coinvolta in interazioni favorevoli, e merita una particolare
attenzione quando si esplora la regione attorno a Thr66, His67 e Glu92, al fine di prevenire
contatti repulsivi con i gruppi carbonilici del backbone proteico. Nella regione attorno allo
ione Mg2+, solamente Asp116 sembra essere disponibile, attraverso il suo gruppo carbossilato,
ad accettare legami ad H nell’interazione con il ligando. Il gruppo carbossilato del terzo
residuo catalitico, Glu152, sembra ottimo per l’accesso a legami, anche se con alcuni ligandi
potrebbe rivelarsi troppo esposto, fuori dal sito attivo, per permettere delle interazioni stabili.
Infine Gln148 sembra costituire la scelta ideale come secondo sito-ancora per stabilizzare le
interazioni di un ligando al sito attivo.
5. PROTEASI RETROVIRALE (PR)
5.1 – Organizzazione molecolare
La prima indicazione che i retrovirus utilizzino una strategia di precursori proteici si è
basata sull’osservazione che cellule infettate da AMV (Avian Myeloblastosis Virus)
producono una proteina iniziale che è molto più grande di quelle trovate nel virus. Questo
precursore è chiamato Gag-protein e include sempre le tre principali proteine del virione:
matrice (MA), capside (CA), nucleocapside (NC).12
Molti retrovirus, compreso HIV-1, iniziano da un precursore Gag per generare proteine
mature più piccole. L’esistenza di un precursore retrovirale implica l’esistenza di una proteasi
capace di idrolizzare i legami peptidici (nello specifico una aspartato proteasi).
Figura 8. Proteasi Retrovirale
Le proteasi eucariotiche come renina, pepsina e catepsina D sono a singola catena con due
motivi Asp-Ser/Thr-Gly nel sito attivo.
Le PR hanno un singolo motivo nella catena perciò per la formazione del sito attivo è
necessaria la presenza di una seconda catena proteica. HIV-1 PR è quindi un enzima dimerico
formato da due polipeptidi associati non covalentemente. Ogni monomero, costituito da 99
aminoacidi, contiene il gruppo aspartato necessario alla catalisi. Gli aminoacidi sono numerati
da 1 a 99 e da 101 a 199, oppure con la notazione 1-1’, dove 101 o 1’ indicano il primo
aminoacido della seconda catena identica alla prima. Studi cristallografici sulla proteasi hanno
permesso di mappare con estrema precisione la struttura del sito attivo che presenta:
Due residui di aspartato (25-25’ oppure 25-125) che giacciono sul “pavimento di
una crepa del sito attivo” e coordinano una molecola d’acqua utilizzata per
idrolizzare il legame peptidico target.
La crepa costituita da aminoacidi idrofobici che partecipano al riconoscimento
del substrato.
La parte superiore della crepa coperta da un lembo mobile.
Una regione della proteina di ogni subunità che forma una β-struttura sopra la
crepa. Questo lembo però non può muoversi per lasciare entrare il substrato.
(Figura 8, 10)12, 13
Figura 9. Mappa genica di HIV-1
La PR è codificata dal gene Pro del virus. Il gene Pro di differenti retrovirus si trova
sempre tra il gene Gag, che codifica per le principali proteine strutturali del virus, ed il gene
Pol, che codifica per la RT e la IN.
Nel caso di HIV-1, i geni Pro e Pol sono nello stesso reading-frame. I reading-frames di Gag e
Pro-Pol si sovrappongono per circa 200 nucleotidi. (Figura 9)
Il precursore Gag-Pro-Pol è indirizzato ai siti di assemblaggio-particelle usando il Gag
targeting signal. La dimerizzazione di questo precursore conduce all’attivazione di PR. E’
stato proposto che piccole quantità di PR dimerica attiva nel precursore Gag-Pro-Pol
rilasciano monomeri di PR che poi dimerizzano e producono svariati cleavage.12
S2
O
S1'
P2
O
S 3'
P1 '
O
H
N
N
H
P3
S3
N
H
O
P3'
H
N
P1
N
H
O
S1
P2'
S2'
Scissile bond
Figura 10. Subsiti di legame nel sito attivo e posizionamento del substrato
Per un efficiente cleavage il substrato della PR deve contenere almeno 7 aminoacidi e
legarsi tramite interazioni ioniche, Van der Waals o legami a idrogeno.14 Analisi di strutture
cristalline hanno mostrato che il substrato legato assume una β-struttura, che consente
l’interazione con lo scheletro peptidico. Nelle β-strutture le catene laterali dell’inibitore si
localizzano nei subsiti di legame presenti nella crepa, assumendo arrangiamento lineare.12, 14
(Figura 10)
Il meccanismo di azione della proteasi è piuttosto semplice (Figura 11) ed è coincidente in
tutto e per tutto con quello delle altre proteine appartenenti alla famiglia delle proteasi. Una
volta inseritosi nel sito recettoriale, il substrato subisce attacco nucleofilo da parte di una
molecola d’acqua sul carbonile del legame amidico target mediato da uno dei residui di
aspartato del sito catalitico. La protonazione dell’azoto amidico porta ad un intermedio
tetraedrico zwitterionico che collassa nei prodotti di idrolisi.
Figura 11. Meccanismo d'azione della proteasi
5.2 - Inibitori della Proteasi (IP)
Sono state studiate e sviluppate numerose classi di composti capaci di inibire la proteasi
virale. La maggior parte è stata progettata in modo da presentare una struttura complementare
al sito di binding ed è costituita da composti peptidomimetici.
Il punto di svolta delle ricerche per un efficace inibitore è stato però l’introduzione di un
gruppo idrossilico nella posizione equivalente al legame amidico. Il gruppo idrossilico spiazza
la molecola d’acqua dal sito attivo e coordina i residui di aspartato mimando lo stato di
transizione (intermedio tetraedrico).12 (Figura 12)
Figura 12. Stabilizzazione di un inibitore nel sito attivo
Tutti gli IP sviluppati sinora, utilizzano questa strategia. Il gruppo idrossilico può essere
presente sotto forma di: idrossietilene, idrossietilamina, idrossietilaminosulfonamide. La
presenza del sostituente –OH è indispensabile per il meccanismo di inibizione della Proteasi,
ma non è sufficiente per la specificità necessaria per legare solo la PR.
Gli inibitori delle Proteasi approvati per uso clinico sono 6 (Figura 13) e presentano tutti
le medesime caratteristiche:
1.
Hanno grandi catene laterali idrofobiche vicino all’idrossile;
2.
Sono più corti della lunghezza del peptide substrato;
3.
Hanno caratteristiche di solubilità elevate in quanto uno dei principali problemi
dei primi IP era la scarsa biodisponibilità dovuta all’eccessiva lipofilia delle
catene laterali;
4.
Si legano ad albumina e α-1 glicoproteina acida.12
Farmaci 1^ Generazione Trade Name
Saquinavir
Invirase® / Fortovase®
Indinavir
Crixivan®
Nelfinavir
Viracept®
Amprenavir
Agenerase®
Ritonavir
Norvir®
Lopinavir / Ritonavir
Kaletra®
O
H2N
H
N
HN
N
H
OH
N
N
O O
Ph
O
N
H
N
H
NH
HO
OH
O
Indinavir
S
N
Ph
S
O
O
NH
N
N
H
H
N
O
Saquinavir
O
Ph
OH
N
N
OH
H
Ph
H
N
N
H
O
O
Ph
H
HO
N
H
O
S
N
Nelfinavir
Ritonavir
O
HN
N
O
O
O
NH
OH
N
HN
O
S
O
O
Ph
HO
Ph
O
HN
O
H2N
Amprenavir
Lopinavir
Figura 13. Farmaci approvati per uso clinico a giugno 2004
Uno dei problemi principali connesso con l’uso degli inibitori peptidomimetici è
rappresentato da severi side-effects, soprattutto in terapie a lungo termine, a carico
dell’apparato cardiovascolare. Ma il problema maggiore connesso all’utilizzo di questi
farmaci è dovuto all’insorgere di mutazioni nella PR che conducono alla farmacoresistenza,
così come avviene per gli inibitori della RT. Tali mutazioni, dovute all’alta velocità di
riproduzione del virus (più di 1010 particelle virali prodotte ogni giorno)13 e alla totale assenza
di attività riparatorie durante la sintesi del DNA-RNA dipendente, possono essere classificate
come primarie e secondarie.
MUTAZIONI PRIMARIE: appaiono di solito rapidamente, sono specifiche per ogni
farmaco e diminuiscono la sensibilità al farmaco localizzandosi nella tasca di legame
riducendo la capacità catalitica dell’enzima;
MUTAZIONI SECONDARIE: solitamente si accumulano nel genoma virale che possiede
già mutazioni primarie. Queste mutazioni conferiscono minore o nessuna riduzione nella
sensibilità al farmaco, ripristinano le capacità di replicazione del virus che porta mutazioni
primarie e possono anche incrementare il livello di resistenza di questi virus. Non compaiono
necessariamente nel sito attivo della proteina. A oggi sono state osservate più di 20 mutazioni
(vedi Tabella 1) a seguito di terapia con IP. Per superare il problema la ricerca si è indirizzata
verso nuovi inibitori non-peptidici, i quali si caratterizzano per uno spettro di azione più
ampio, offrendo anche una migliore biodisponibilità e, probabilmente, minore resistenza.
INIBITORE
PROTEASI
MUTAZIONI
PRIMARIE
MUTAZIONI
SECONDARIE
Indinavir
M46L
V82A F T S
Ritonavir
V82A F T S
Saquinavir
G48V, L90M
Nelfinavir
D30N, L90M
Amprenavir
I50V, I84V
L10I/R/V, K20M/R,
L24I, V32I, M36I,
I54V, A71V/T,
G73S/A, V77I, I84V,
L90M
K20M/R, V32I, I32F,
M36I, M46I/L,
I54V/L, A71V/T, V77I,
I84V, L90M
L10I/R/V, I54V,
A71V/T, G73S, V77I,
V82A, I84V
L10F/I, M36I, M46I/L,
A71V, V77I,
V82A/F/T/S, I84V,
N88D
L10F/I/R/V, V32I,
M46I, I47V, I54V
Tabella 1. Mutazioni associate con la resistenza agli inibitori della Proteasi utilizzati in terapia
6. SCOPO DEL LAVORO
Il progetto di ricerca, che ho svolto presso il Dipartimento Farmacochimico Tossicologico
Biologico, è stato improntato sullo studio degli inibitori dei tre principali enzimi di HIV-1
ossia RT, PR e IN nel tentativo di esplorare le caratteristiche che possono modulare l’attività
biologica tenendo anche conto dei fenomeni connessi all’insorgere della resistenza.
Lo studio effettuato in questi tre anni si è articolato essenzialmente in due parti. La prima
ha riguardato RT e PR, la seconda IN. Tenendo conto del fatto che ormai da diversi anni sono
in commercio inibitori di RT e PR e che, come precedentemente sottolineato, tali farmaci in
terapie a lungo termine conducono a fenomeni di resistenza, mi sono proposto di sviluppare
un metodo per valutare l’eventuale insorgere di questo fenomeno. Partendo da un database di
molecole, descrittori molecolari, indici di similarità e dati di sensibilità e resistenza nei
confronti dei più comuni ceppi mutanti (L100I, K103N, V106A, Y181C per RT; V82A,
V82F, I84V per PR) costruito utilizzando dati di letteratura, ho applicato dapprima tecniche di
analisi statistica multivariata, quali PCA e DA, per sviluppare un modello che potesse
spiegare e prevedere l’eventuale resistenza o suscettibilità di molecole contro i ceppi mutanti.
Successivamente si è effettuato il confronto dei risultati ottenuti dai metodi statistici
multivariati con quelli provenienti da studi di molecular modeling nel tentativo di validare
reciprocamente i dati.
Nella seconda parte del mio dottorato mi sono occupato dello studio degli inibitori
dell’Integrasi. Considerando che in letteratura è presente un’enorme quantità di dati sugli
inibitori di HIV-1 IN, ho cercato di selezionare una serie di strutture rappresentative delle
classi di inibitori più efficaci e di costruire dei modelli che descrivano le attività di 3’Processing e di Strand Transfer in funzione delle loro caratteristiche strutturali. Per IN non
sono disponibili in commercio dei farmaci da utilizzare in terapia e di conseguenza non
esistono dati riguardanti l’insorgere di mutazioni che conducano alla resistenza, per cui non è
ancora possibile sviluppare dei modelli per la valutazione dell’insorgere di resistenza.
7. MATERIALI E METODI
7.1 – Hardwares e softwares
Tutti i calcoli di analisi statistica multivariata e docking sono stati effettuati su
workstations della Silicon Graphics (modelli Indigo2 R4400 e Octane2) e su PC con OS
WinXP Pro.
I softwares utilizzati sono CS ChemDraw Ultra 7.0, TSAR 3.2 (Tools for Structure
Activity Relationships), ASP 3.21 (Automated Similarity Package), VAMP 7.0, CORINA
1.81, CODESSA PRO, Ligandfit®.
7.2 – Analisi QSAR
Lo studio delle relazioni che intercorrono tra la struttura molecolare di un composto e la
sua attività si fonda su un approccio razionale basato sull’assunzione che esistano certe
relazioni tra la struttura molecolare (S) e l’attività biologica (A) dei composti; si cerca cioè di
determinare la funzione f(S,A) che mette in relazione questi due parametri. L’obiettivo finale
degli studi QSAR è quello di comprendere i meccanismi dell’azione farmacologia o
tossicologica, suggerendo nuove prospettive per la sintesi di composti con attività biologica
definita.
Per lo studio delle relazioni QSAR sono state proposte diverse metodologie che si
distinguono tra loro sia per l’impostazione generale nell’approccio al problema, sia per le
modalità con cui sono descritte le molecole (le diverse tipologie di descrittori), sia per i
metodi matematici utilizzati per estrapolarne l’informazione necessaria. Comunque, tutte le
strategie utilizzate accoppiano comunemente la rappresentazione delle strutture molecolari
mediante opportuni descrittori, alla ricerca di relazioni quantitative tra descrittori ed attività
biologica utilizzando principalmente l’analisi statistica multivariata.15
In particolare sono state utilizzate le tecniche PCA, DA, CA, BMLR
7.3 – PCA (Principal Component Analysis)
La PCA è un metodo che può essere usato per ridurre un grande numero di variabili, senza
che ci sia una perdita di informazioni. E’ particolarmente utile per:
ridurre la dimensione di un set di dati, consentendo di visualizzare una grande
quantità di informazioni;
studiare le relazioni tra differenti descrittori;
preparare i dati per ulteriori analisi.
Quando si esegue la PCA su una serie di dati, le variabili originarie sono trasformate in un
nuovo set ortogonale di combinazioni lineari, generato per conservare la varianza dei dati
originari.
PC1 = a(1,1)v1 + a(1,2)v2 + … + a(1,n)vn
PC2 = a(2,1)v1 + a(2,2)v2 + … + a(2,n)vn
PCq = a(q,1)v1 + a(q,2)v2 + … + a(q,n)vn
Ogni componente principale (PC) è una combinazione di variabili iniziali ( ), definita
utilizzando dei loading coefficents (a). La maggior parte della varianza è contenuta nelle prime
PC, la prima PC, infatti, di solito, mostra la varianza più grande. Ogni PC ha un eigenvalue
(autovalore) associato, che mostra quanta varianza è esplicata da quella PC.
7.4 – DA (Discriminant Analysis)
La DA è una tecnica utilizzata per separare due o più classi di composti usando un numero
di variabili esplicative. Le regole di classificazione derivate descrivono una superficie che
separa le classi; può essere utilizzata per prevedere l’appartenenza ad una data classe.
TSAR usa il Mahalanobis distance discrimination algorithm.16 Per default, utilizza una
procedura graduale per selezionare un subset di variabili esplicative ed ottimizzare le regole di
classificazione. La variabile entrante, ad ogni stadio, è quella che dà il maggiore incremento
nella distanza totale di Mahalanobis.
La selezione graduale delle variabili esplicative termina quando lo stopping criterion
selezionato è stato raggiunto. In genere si sceglie lo stopping criterion Automatic che
determina lo stop o quando tutti i punti sono correttamente classificati (nessuna variabile
dovrebbe dare più del 5% di incremento nella distanza totale di Mahalanobis), oppure dopo
che tutte le variabili sono state sommate.
7.5 - Indice di Similarità
La misura della similarità tra due molecole, basata su proprietà fisiche di lipofilia, forma e
potenziale elettrostatico è ottenuta utilizzando un approccio analitico nel quale le funzioni
Gaussiane sono sostituite nelle equazioni di calcolo. Le proprietà sono paragonate attraverso
lo spazio utilizzando un incremento infinitesimale di griglia. La similarità per shape è stata
calcolata utilizzando la modifica di Meyer all’equazione di Carbo. Meyer mostro che
l’equazione di Carbo17 per le densità elettroniche può essere adattata alla misura della
similarità in termini di shape attraverso un semplice algoritmo modificato. Ogni molecola è
rappresentata come un sistema di sfere interconnesse con raggio uguale al raggio di Van der
Waals, centrate sul nucleo atomico. La coppia di molecole sovrapposte è piazzata in una
griglia tridimensionale e una maglia di punti viene esplorata. Alla fine vengono contati:
O1
numero dei punti della griglia che giacciono solo all’interno della molecola 1
O2
numero dei punti della griglia che giacciono solo all’interno della molecola 2
B
numero dei punti della griglia che giacciono all’interno di entrambe le molecole.
Il numero totale dei punti della griglia in ogni molecola è quindi dato da:
T1 = O1 + B
T2 = O2 + B
L’analogo dell’algoritmo dell’indice di Carbo è
B
S c 12
(T1T2 )
1
2
7.6 – CA (Cluster Analysis)
I metodi di CA forniscono informazioni sulla presenza di raggruppamenti, detti clusters,
utilizzando il concetto di similarità. Esso è la trasposizione matematica del concetto di
analogia, e si configura come il complemento del concetto di dissimilarità; infatti per misurare
quantitativamente quest’ultimo si può utilizzare il concetto di distanza, definendo come
dissimili due elementi posti ad una certa distanza tra loro.
Si possono utilizzare molti tipi di distanze. In questo studio si è scelto di utilizzare la
distanza Euclidea, definita come:
P
dEuc
( xsj
xtj ) 2
j 1
dove xsj è l’elemento s j-esimo della matrice delle distanze.
La matrice delle distanze è definita come una matrice n x n (dove n è il numero di
oggetti), in cui in ogni riga, rappresentante un oggetto, vi sono tutte le distanze degli altri
oggetti da quello considerato (essa è ovviamente una matrice simmetrica, ed i suoi elementi
diagonali hanno valore zero, poiché la distanza di ogni oggetto da se stesso è nulla).
Una volta definita la corrispondenza fra distanze e similarità l’algoritmo di clustering
trasforma la matrice delle distanze in matrice di similarità, i cui elementi diagonali hanno
valore uguale ad uno giacché la similarità di ogni oggetto con se stesso è massima.
I metodi di CA sono numerosi, e possono essere suddivisi in metodi gerarchici, e non
gerarchici; i metodi gerarchici, a loro volta, possono essere distinti in agglomerativi e non
agglomerativi. I cluster che ciascun metodo individua sono caratterizzati dalla loro posizione
nello spazio p-dimensionale da un centroide, definito come il vettore delle medie delle
variabili calcolate per gli oggetti assegnati al cluster, e da un centrotipo, definito come
l’oggetto più rappresentativo di un cluster, in virtù della sua minore distanza dal centroide.
Nella formazione dei cluster, ogni oggetto è inizialmente considerato come facente parte
di un cluster formato da un solo membro (se stesso); i cluster vengono in seguito considerati a
gruppi, ed esaminata la loro distanza in termini di similarità, vengono infine fusi insieme.
L’intero processo di clustering segue la procedura riportata nello Schema 1.18
1 - Ricerca degli oggetti più
simili, ossia appartenenti ai
due clusters meno distanti
2 - Amalgamazione dei due
clusters
3 - Ripetizione procedura dal
punto 1
Schema 1. Processo di clustering
I metodi di clustering utilizzati comprendono i seguenti:
1. Ward’s Reciprocal Nearest Neigbors (WRNN) – utilizza l’algoritmo dei
Reciprocal Nearest Neighbors (RNN), che comporta la minor perdita possibile di
informazione;
2. Single Linkage (SL) – utilizza la minima distanza possibile tra due clusters;
3. Group Average (GA) – utilizza la distanza tra le medie pesate dei due clusters;
4. Complete Linkage (CL) – utilizza la massima distanza possibile tra i due clusters.
Indicando con f il cluster ottenuto dalla fusione del cluster s con il cluster t, di
dimensioni rispettivamente ns, nt, ed nf=ns+nt, la simmetria del cluster f con un altro cluster
viene calcolata nei precedenti metodi di clustering secondo:
WRNN: skf
SL: skf
(ns nk ) sks
nf nk
min( sks, skt )
(nt nk ) skt
nf nk
nksst
nf nk
GA: skf
1
(sks
2
CL: skf
max( sks, skt )
skt )
Il risultato di questa procedura viene normalmente rappresentato mediante un grafico detto
dendrogramma, che permette un’analisi altamente informativa della gerarchia delle similarità
tra gli oggetti considerati. (Figura 14)
Figura 14. Esempio di Dendrogramma relativo ad una Cluster Analysis
7.7 – Regressione Multilineare (BMLR)
L’analisi QSAR prevede essenzialmente la soluzione di un problema di regressione
multilineare. Questo può essere espresso in modo compatto e conveniente utilizzando la
notazione di matrice.19, 20, 21 Supponendo che ci siano n proprietà in Y ed n valori calcolati per
ogni descrittore molecolare k nelle colonne di X, allora Yi, Xik ed ei possono rappresentare,
rispettivamente, i valori i-esimi della variabile Y (proprietà), i valori i-esimi di ciascuno dei
descrittori X, ed i valori residui i-esimi ignoti. Ponendo questi termini in una matrice si ha:
Y
Y1
Yn
X
1 X11 X1k
,
1 Xn
Xnk
e
e1
en
Il modello di regressione multipla in notazione matriciale può essere espresso allora come:
Y
Xb e
dove b è il vettore di colonna dei coefficienti (b1 è per l’intercetta) e k è il numero di
coefficienti di regressione ignoti per i descrittori. Ricordando che lo scopo della regressione
multipla è minimizzare la somma dei quadrati dei residui:
min e
2
b
I coefficienti di regressione che soddisfano questo criterio si trovano risolvendo il sistema
di equazioni lineari (moltiplicando entrambi i lati per X’)
X' Y X' Xb
Quando le variabili X sono linearmente indipendenti (una matrice X’X di ordine
massimo) c’è una soluzione unica per il sistema di equazioni lineari. Uno dei modi per
risolvere il suddetto sistema consiste nel moltiplicare entrambi i lati della formula di matrice
per le equazioni normali della matrice inversa X’X per dare:
b
( X' X) 1 X' Y
Un altro modo è risolvere direttamente il sistema suddetto usando la fattorizzazione LS
(indeterminato, n<k) o QR per il sopradeterminato (n>k); questo metodo è più generale, e non
richiede l’inversione di matrice che necessita di lunghi tempi di calcolo. Possono essere usati
anche i metodi di decomposizione del valore singolo, ma di solito tali metodi sono
significativamente più lunghi e diventano vantaggiosi solo quando esiste una forte dipendenza
lineare che diminuirebbe la qualità dei modelli. Il terzo modo per risolvere il problema di
dipendenza lineare di variabili (quando il determinante della matrice X’X è maggiore di zero)
è l’inversione generale della matrice, ma questo è di solito fuori dalla sfera di QSAR.
Un principio fondamentale dei metodi dei minimi quadrati, della regressione lineare
multipla in particolare, è che la varianza della variabile dipendente può essere partizionata
secondo la fonte. Supponendo che una variabile dipendente (proprietà) sia regredita su uno o
più descrittori e che, per convenzione, la variabile dipendente sia scalata, così che la sua
media sia 0, si può calcolare in seguito un’identità base di minimi quadrati, in cui la somma
totale dei quadrati dei valori della variabile dipendente sia uguale alla somma dei quadrati dei
valori predetti più quella dei residui.
In generale:
(y
y)2
( yˆ
y)2
(y
yˆ ) 2
dove il termine di sinistra è la somma totale delle deviazioni quadratiche dei valori osservati
della variabile dipendente dalla media della variabile dipendente, ed i termini sulla destra
sono:
La somma delle deviazioni quadratiche dei valori osservati della variabile
dipendente dalla media della variabile dipendente;
La somma delle deviazioni quadratiche dei valori osservati della variabile
dipendente dai valori predetti, cioè la somma dei residui quadratici.
Oppure, altrimenti:
SSTotal SSModel SSError
Da notare che il valore di SSTotal è sempre lo stesso per ogni particolare insieme di dati,
ma SSModel ed SSError variano con l’equazione di regressione. Assumendo di nuovo che la
variabile dipendente sia scalata, così che la sua media sia zero, i valori di SSModel ed SSError
possono essere calcolati con:
SS Model b' X' Y'
SS Error YY ' b' X' Y'
Assumendo che X’X sia di ordine massimo:
r2
s2
SS Error
SS Total
SS Error
n k 1
1
F( k , n k 1)
SS Model
ks 2
Dove r2 è il quadrato del coefficiente dei correlazione, ossia la misura della bontà del modello,
s2 è una stima imparziale dei residui o della varianza dell’errore ed F è il criterio di Fisher (k,
n-1-1) dei gradi di libertà.
Se X’X non è di ordine massimo, si sostituisce k con l’ordine (X’X)+1.
7.8 – Test di Validazione
Nell’analisi QSAR occasionalmente si ottengono modelli non totalmente affidabili.22 I
problemi dell’affidabilità possono essere classificati come l’overfitting ed i modelli casuali. Il
secondo problema può essere risolto solamente dal giudizio umano e soggettivo basato sulla
giustificabilità di ogni accertamento dell’incertezza di una particolare predizione. Il problema
di overfitting è uno dei problemi più comuni nello sviluppo di ogni tipo di modello, ed è
solitamente risolto usando criteri di validazione obiettivi. Il metodo più comune in
chemiometria è la “Cross Validation” (CV).23
Il metodo più semplice, e più comunemente utilizzato di CV è il metodo Leave-One-Out
(LOO, Escludi-uno). L’idea è di predire il valore di una proprietà di un composto dall’insieme
di dati che a turno è predetto dall’equazione di regressione calcolata per ogni altra
combinazione di dati. Il metodo tende ad includere componenti non necessarie nel modello,
ed è stato modulato24 per essere asintoticamente incorretto. Inoltre il metodo non funziona
bene per dati fortemente clusterizzati23 e sottovaluta l’errore predittivo vero.25
Un altro metodo di CV utilizzato è Leave-Many-Out (LMO, Escludi-molti). A causa della
complessità combinatoriale del calcolo, questo metodo dà luogo a bassa produttività, e quindi
è suscettibile di ulteriori semplificazioni. La valutazione dei risultati di questo tipo di
validazione può essere effettuata utilizzando l’approccio Monte Carlo.23
I test di Randomizzazione26 sono test statistici in cui i dati sono elaborati ripetutamente;
viene calcolato un test statistico (come r2, criterio t, criterio F, etc…) per la permutazione di
ciascun dato. La proporzione delle permutazioni dei dati, con valori di test statistici grandi
quanto il valore dei risultati ottenuti, determina la significatività dei risultati. Per saggiare la
bontà della correlazione multilineare, le permutazioni del vettore Y sono trattate attraverso
procedure di regressione multilineare mantenendo fisse le colonne della matrice X.
A causa di un aumento fattoriale del tempo di calcolo, in dipendenza dalla misura del
vettore Y, il metodo Monte Carlo è stato spesso utilizzato per produrre tests di
randomizzazione.
Tali tests risultano molto validi quando applicati a metodi di regressione, ma nel caso
della DA si è preferito utlizzare tests in grado di descrivere l’abilitiva predittiva del modello
contro la probabilità di assegnazione dei singoli oggetti dovuta al caso. Sono stati utilizzati
quindi i tests di Huberty [proportional chance (Cpro) and maximum chance (Cmax)].27 Il
criterio di proportional chance è calcolato dalla somma dei quadrati della porzione che ogni
gruppo rappresenta del campione (equazione 1). Il criterio di maximum chance è la porzione
di oggetti nel gruppo più grande (equazione 2).
Cpro = p2 + (1 – p)2
(eq. 1)
p = porzione di oggetti in un gruppo
(1-p) = porzione di oggetti nell’altro gruppo
Cmax = (nL/NL) (100)
(eq. 2)
nL = numero di oggetti nel più grande dei due gruppi
NL = numero totale di oggetti nei due gruppi combinati
L’accuratezza della classificazione del modello o minimum hit-rate (min. hit-rate)
dovrebbe essere un quarto piu grande di quella raggiunta dal caso (Cpro and Cmax).
L’altro test di validazione utilizzato per la DA è il chi-square di Pearson (Chi2).28 Il chisquare test di significatività statistica è una serie di formule matematiche che paragonano la
frequenza attualmente osservata di qualche fenomeno (nel nostro campione) con la frequenza
attesa se non ci fosse alcuna relazione tra le due variabili nella popolazione più grande.
Quindi, chi-square testa i risultati attuali contro l’ipotesi nulla e afferma se ci sono differenze
sufficienti per superare una certa probabilità che sia dovuta ad un errore di campionamento.
7.9 – Docking Molecolare - LigandFit®
In passato sono stati proposti numerosi metodi per il docking di ligandi nei siti attivi di
proteine a struttura nota. In generale, i metodi di docking shape-based implicano la
caratterizzazione tridimensionale del sito attivo e la generazione di orientazioni dei ligandi
complementari al volume del recettore. Sono noti diversi metodi per rappresentare il sito
attivo di una proteina e per generare le orientazioni dei ligandi di forma compatibile con il
sito. In uno dei primi pionieristici lavori in questo campo, Kuntz e collaboratori29
rappresentavano la forma del sito attivo utilizzando un set di sfere sovrapposte di diverso
raggio che toccavano la superficie del sito attivo; similmente, i ligandi erano anch’essi
rappresentati da un set di sfere. La sovrapposizione del set di sfere del ligando e del sito attivo
originavano il docking. Più recentemente sono stati sviluppati diversi tipi di algoritmi che
consentono il docking proteina-ligando in cui il ligando è flessibile ma la proteina recettore è
rigida, e l’interazione produce una modificazione del ligando. In questo modo si può predire il
legame tra ligando e proteina e valutare l’energia totale di interazione nella configurazione
ottimizzata di legame.
Nel nostro caso si è deciso di utilizzare LigandFit ®, un modulo del Modeling Envirovment
del software Cerius2 della Accelerys Inc.
LigandFit garantisce un rapido ed accurato protocollo per il docking di piccoli ligandi nei
siti attivi di proteine considerando complementarietà di forma tra ligando e sito attivo.
Impiega un sistema di comparazione delle “shape” usato per primo da Oldfield per il fitting di
molecole attraverso distribuzioni di densità elettronica ottenute dai raggi X.30, 31
La procedura di docking di LigandFit si articola in due stadi:
1. Identificazione della cavità e selezione della regione della proteina come
sito attivo per il docking;
2. Docking dei ligandi nel sito selezionato.
Griglie tridimensionali regolari di punti sono impiegate per l’identificazione del sito e anche
per stimare l’energia di interazione del ligando con la proteina durante il docking. Il primo
stadio (identificazione della cavità) implica l’uso di un algoritmo di “riempimento”. Mentre la
procedura per l’identificazione dei vuoti nella proteina è piuttosto diretta, la determinazione
dei limiti della cavità e della zona di solvatazione risulta più problematica.
Il secondo stadio del metodo (il docking) impiega un protocollo che comporta:
1.
Ricerca conformazionale di ligandi flessibili usando un campionamento
stocastico per selezionare i valori degli angoli di torsione variabili;
2.
Selezione di una orientazione basata sulla comparazione della forma del
conformero del ligando con quella del sito;
3.
Stima della qualità del docking utilizzando un calcolo di energia grid-based per
valutare l’energia di interazione ligando-proteina.
L’algoritmo per l’identificazione della cavità inizia costruendo una griglia rettangolare
con 0.5 Å di spacing. La dimensione della griglia è determinata calcolando l’estensione della
proteina lungo i tre assi cartesiani, ed aggiungendo un limite a questa estensione. Ogni punto
della griglia è poi classificato come punto libero od occupato. I punti occupati sono quelli che
giacciono all’interno della zona di contatto con il più vicino atomo della proteina. La distanza
di contatto è uguale al raggio dell’atomo della proteina (2.5 Å per gli atomi pesanti, 2.0 Å per
gli idrogeni). I grid point esterni a questa distanza di contatto sono considerati free (nonoccupati). Lo step successivo consiste nel dividere i free points in due tipologie: quelli che
costituiranno i siti attivi e quelli che si trovano fuori dai siti attivi. Questo implica
l’eliminazione delle connessioni tra i vari siti, che avviene tramite i punti liberi che giacciono
fuori dalla proteina (Figura 15). I siti attivi distinti potranno essere individuati rimuovendo
questi punti liberi utilizzando un “eraser” (MODALITA’ PROTEIN SHAPE).
Figura 15. Procedura di identificazione delle cavità nella proteina
In taluni casi, è disponibile la struttura sperimentale tridimensionale di un ligando già
dockato nel sito attivo; è allora possibile costruire il sito attivo sulla base della orientazione
nota del ligando. Invece di utilizzare l’eraser, sono considerati tutti i free points che giacciono
dentro il raggio di qualche atomo dal ligando. In genere il raggio degli atomi pesanti del
ligando è convenzionalmente posto uguale a 2.5 Å, mentre il raggio degli atomi di idrogeno è
posto a 2.0 Å (MODALITA’ DOCKED LIGAND).
Una volta identificato il sito attivo si procede al docking dei ligandi. Per un dato ligando,
il metodo prevede una procedura iterativa nella quale sono generate conformazioni random
del ligando per uno specificato numero di volte, NMaxTrials. La procedura mantiene una “Save
List” nella quale sono conservate le strutture con il miglior docking trovate dall’algoritmo. Si
può specificare il numero delle strutture, NSave, da conservare nella Save List. Se la Save List
è piena ed il candidato ha una similarità di shape peggiore di quelli già salvati, questo viene
scartato, altrimenti il candidato è selezionato per il docking. Nella ricerca conformazionale del
ligando si utilizza il metodo Monte Carlo. Durante questa ricerca, la lunghezza dei legami e
gli angoli di legame non vengono modificati, ma sono randomizzati solo gli angoli torsionali
(ad eccezione di quelli negli anelli), perciò le molecole dovrebbero essere minimizzate per
assicurare la corretta lunghezza dei legami e degli angoli di legame. Il limite superiore della
perturbazione diedrale random è di 180° per tutte le torsioni, mentre il limite inferiore dipende
dal numero di atomi rotabili: maggiore è il numero di atomi attaccati al legame, minore è la
dimensione della perturbazione diedrale.
Figura 16. Steps di fitting
Generato il nuovo conformero, il fitting è effettuato in due steps. Dapprima si paragona il
momento di inerzia principale (PMI) non mass-weighted del sito attivo (Figura 16) con il PMI
non mass-weighted del ligando secondo le seguenti equazioni:
PMI: Principal Moment of Inerzia (Px, Py, Pz)
Ratioxy
Ratioxz
Ratioyz
FitPMI
Px
Py
Px
Pz
Py
Pz
ratio2 xy
ratio2 xz
ratio2 yz
Se il valore (FitPMI) è superiore al valore soglia o non è migliore dei fittings
precedentemente effettuati, non viene effettuato alcun processo di docking e si prosegue
esaminando un altro ligando od un altro conformero dello stesso ligando. Se però FitPMI è
migliore dei risultati salvati precedentemente, il ligando è allora posizionato nel binding site
secondo il valore di PMI. Poiché PMI è uno scalare, ci sono quattro possibili posizioni
(“orientazioni”) (Figura 17) per orientare il ligando nel sito attivo; per ogni posa viene
calcolato il corrispondente Docking Score (D) secondo:
D = - (energia di interazione Ligando-Proteina + energia interna del Ligando)
Figura 17. Procedura di docking
L’energia di interazione è calcolata dalla somma dell’energia di Van der Waals e
dell’energia elettrostatica. Per ridurre i tempi di calcolo dell’energia di interazione, che
altrimenti sarebbero troppo lunghi, viene utilizzato un sistema di interpolazione tri-lineare.
L’energia interna del ligando è calcolata come somma delle energie di Van der Waals ed
elettrostatiche. L’energia di Van der Waals è computata usando la stessa funzione utilizzata
per quella di interazione, sommando tutte le coppie di atomi di non legame interni del ligando,
separate da almeno tre legami; stessa valutazione viene effettuata per l’energia elettrostatica.
La procedura di docking fin qui descritta tenta di produrre orientazioni di ligandi che
hanno energia di interazione favorevole con la proteina. Mentre le funzioni di energia
impiegate per questo scopo tendono a favorire orientazioni ragionevoli dei ligandi, non sono
però derivate per predire affinità di legame o per selezionare un ligando piuttosto che un altro.
Quindi, bisogna utilizzare delle funzioni di scoring empiriche per priorizzare i ligandi dockati
(LIGSCORE1, LIGSCORE2, PLP1, PLP2, PMF, LUDI).
LIGSCORE, funzione di scoring rapida e semplice, è fittata con GFA (Genetic Function
Algorithm) e fornisce l’affinità di binding, in termini di pKi. I descrittori utilizzati sono tre:
LIGSCORE1
pK i
VdW
(C pol ) Totpol 2
VdW è espressa in Kcal/mol, C+pol è espressa in Å2, Totpol2 è espressa in Å4; questi ultimi
due rappresentano descrittori di superficie, ma mentre C+pol esprime le interzioni attrattive
tra ligando e proteina, Totpol2 esprime anche interazioni repulsive. Equazioni similari sono
usate per LIGSCORE a seconda del descrittore VdW utilizzato (LIGSCORE1, LIGSCORE2)
o del force field (CFF o Dreiding).32
PLP (Piecewise Linear Potential) è anch’essa una funzione di scoring rapida e semplice,
e viene espressa in unità arbitrarie di energia; la relazione con l’affinità di binding è del tipo:
pKi
PLP
Essa tiene conto dei donatori e degli accettori di H, nonché delle interazioni non polari.
Esistono due forme della funzione PLP (1 e 2): la differenza consiste nel diverso tipo di
interazioni che vengono considerate quando si calcola ELigando-Proteina. In PLP1 si considerano
ESterica ed EHbond, mentre in PLP2 il contributo è dato da ERepulsive o EDispersive che provengono
da interazioni ligando-donatore o accettore-accettore ed in genere da tutti gli altri tipi di
interazioni.33, 34
PMP (Potential of Mean Force) è una funzione definita come la somma delle interazioni
di energia libera fra tutte le coppie interatomiche del complesso ligando-proteina. Gli scores
vengono riportati in unità di energia arbitraria; maggiore è il valore di –PMF, maggiore è
l’affinità del ligando. In genere la relazione di energia è data da:
ΔGBind
dove
ε
PMF_score
ε
35
è uno scaling factor.
LUDI è una funzione di scoring proposta da Bohm. E’ data dalla somma di cinque
contributi:
1. contributo proveniente dai legami H ideali;
2. contributo proveniente dalle interazioni ioniche perturbate;
3. contributo proveniente dalle interazioni lipofile;
4. contributo dovuto alla perdita di entropia rotazionale e traslazionale del ligando;
5. contributo dovuto al freezing dei gradi di libertà interni.
La relazione di energia viene espressa in kcal/mol ed è data da:
LUDI_score = k ΔGbind
dove k assume il valore di -77.33 mol/kcal.29
Tali funzioni empiriche utilizzano modelli di regressione [Multi Linear Regression (MLR) o
(GFA)] per fittare i coefficienti su un set di termini fisicamente opportuni al fine di riprodurre
le affinità di binding sperimentali di un training set di complessi ligando-proteina noti.
8. RISULTATI E DISCUSSIONE
8.1 – Analisi multivariata applicata agli NNRTI
Più di 30 differenti classi di NNRTI sono state descritte fino ad oggi. In questo studio
sono stati utilizzati cinquantacinque derivati NNRTI, le cui strutture sono riportate in
Appendice I. La selezione include la maggior parte dei derivati presenti correntemente nel
database del National Institute of Allergy and Infectious Diseases (NIAID),36 e derivati
descritti in letteratura.37 Sono stati presi in considerazione i composti più attivi di ogni classe.
La Tabella 2 mostra per i derivati oggetto di studio i dati di sensibilità/resistenza contro i più
comuni ceppi mutanti di RT. I derivati con resistant ratio >15 (Attività sul ceppo mutante
Formattato: Italiano (Italia), Non
Evidenziato
/Attività sul wt) sono considerati come resistenti (R); i derivati con resistant ratio <15 sono
considerati come suscettibili (S).38
I composti sono stati inizialmente disegnati come rappresentazioni 2D utilizzando
ChemDraw Ultra 7.0 e le strutture 3D sono state ottimizzate con metodi semiempirici
(MNDO o PM3) utilizzando i moduli CORINA e COSMIC di TSAR 3.2. Per i derivati chirali
per i quali la stereochimica della forma attiva non è nota sono stati presi in considerazione
entrambi gli enantiomeri (cfr derivati 5/6; 27/28; 33/34; 43/44; 48/49).
È stato inizialmente calcolato un pool di più di 80 descrittori, tra i quali sono stati
selezionati 11 descrittori da includere nel database che meglio identificano le caratteristiche
molecolari che possono essere correlate con l’attività biologica (volume ellissoidale, loglog P,
donatori di legami H, accettori di legami H, lipolo totale, area superficiale, calore di
formazione, ELUMO, EHOMO, momento di dipolo totale, energia totale in acqua).39 (Tabella 3)
La selezione di variabili strutturali è stata fatta considerando le numerose strutture
cristallografiche di HIV-1 RT complessato con NNRTI, le quali supportano il ben noto
binding mode delle differenti classi di NNRTI. In particolare il
Since resultant correlation matrix gave coefficients <0.7, meaning that no significant 0.9.
correlation was found the whole set of descriptors could be used.
volume ellissoidale, che è definito dal momento di inerzia, e l’area superficiale accessibile
danno informazioni circa le proprietà steriche delle molecole, log P è una tipica variabile
QSAR, correlata con il profilo idrofobico/idrofilico dell’inibitore e nel nostro caso può essere
correlato a questo tipo di interazione nel sito attivo, il lipolo totale è una misura della
distribuzione lipofilica nello spazio 3D ed è calcolato dalla somma atomica dei valori di log
P,40 il numero di donatori/accettori di legami H fornisce altre informazioni circa la capacità
dell’inibitore di stabilizzare la propria interazione nel “binding pocket” dell’enzima, il dipolo
totale dà informazioni circa le caratteristiche elettroniche, ELUMO e EHOMO sono variabili
Formattato: Italiano (Italia), Non
Evidenziato
Formattato: Italiano (Italia), Non
Evidenziato
energetiche che classificano il set di inibitori in termini di abilità a comportarsi come
nucleofili o elettrofili, come ci si aspetta per il processo di inibizione. Altre variabili
energetiche sono il calore di formazione, che classifica il set di inibitori in termini di stabilità
termodinamica relativa ed è ampiamente usato negli studi chemometrici e l’energia totale in
acqua, che classifica il comportamento degli inibitori in ambiente fisiologico.
Tabella 2. Resistenza (R)a/Suscettibilità (S)b dei derivati inclusi nel database verso i mutanti di RT selezionati
Entry
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
19
20
21
22
23
24
25
26
27
28
29
30
31
32
33
34
35
36
37
38
39
40
41
42
43
44
45
46
47
48
49
50
51
52
53
54
55
Derivati
(+)12-OXOCALANOLIDE
21-AAP-BHAP
ADAM-II
AN-29-PNU-32945
BENZOTHIADIAZINE-2(R)
BENZOTHIADIAZINE-2(S)
BM-510836
CALANOLIDE-A
COMPD-1
COMPD-2
COMPD-36
COSTATOLIDE
DABO-12e
DAMNI-6D
DELAVIRDINE
DIHYDROCOSTATOLIDE
DPC-082
DPC-961
E-EBU-dM
EFAVIRENZ
GCA-186
HBY-097
INOPHYLLUM-B
IPPH
L-697661
L-737126
LOVIRIDE(R)
LOVIRIDE(S)
MKC-442
MSA-300
NEVIRAPINE
NPPS
NSC-625487(R)
NSC-625487(S)
PBD
PBO-13B(R)
PBO-13B(S)
PEQ
PHS
PNU-142721(R)
PNU-142721(S)
PNU-32945
PPO-13I(R)
PPO-13I(S)
QM-99639
S-2720
SEFAVIRENZ
TGG-II-23A(R)
TGG-II-23A(S)
TIVIRAPINE
TNK-6123
TTD-6G
UC-781
UC-84
UK-129485
L100I K103N V106A Y181C
R
R
S
S
R
R
R
R
S
R
R
S
S
S
R
R
R
R
R
S
S
R
S
R
R
R
R
S
S
R
S
S
R
R
R
R
S
R
R
S
S
S
S
S
S
R
R
S
S
S
S
S
S
R
S
S
R
S
S
R
R
S
R
R
R
S
R
R
S
R
S
R
Ref.
36
37b
37b
37b
37c
37c
37f
37a
37
37a
37b
36
37a
37g
38c, 38d
36
37b
37b
38a, 38b
36, 38d, 38c
37f
37f
37a
37a
38a, 38b
37a
38a, 38b
38a, 38b
37a
37a
36
37a
37a
37a
37a
37b
37b
37a
37a
37b
37b
37b
37b
37b
37b
38a, 38b
37b
37a
37a
38a, 38b
37b
37h
37a
38a, 38b
37a
a
R>15 resistant ratio (Attività sul ceppo mutante /Attività sul wt); bS<15 resistant ratio.
Tabella 3. Database dei descrittori molecolari utilizzati nel caso dei derivati NNRTI.
Entry
Descrittori
1
2
3
4
5
6
7
8
9
10
11
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
19
20
21
22
23
24
25
26
27
28
29
30
31
32
33
34
35
36
37
38
39
40
41
42
43
44
45
46
47
48
49
50
51
52
53
54
628.9
3000
1652.6
614.3
763.5
763.5
578.3
654.3
351.4
300.8
5434.5
654.9
691
743.5
3450.6
623.4
638.3
735.3
839.3
674.7
875
1002.9
712.4
3281.9
1012.3
807.7
702.8
702.8
638.1
2512.9
421.9
601.2
375.9
375.9
1793.4
804.1
806.7
876.9
584.6
1636.5
913.8
524.2
612.2
612.2
553.7
539.3
737.5
494.4
494.4
682.2
511.3
451.3
1420.7
1610.2
3.2
2.4
4.4
4.8
2.8
2.8
4.8
3.3
1
1.5
2
3.3
3.5
4.3
0.7
3.4
3
3
2.8
3.6
3.1
2.4
3.8
4.8
1.3
1.8
2.9
2.9
2.2
3.4
1.9
2.8
4.1
4.1
3
4.1
4.1
3.3
2.8
3.2
3.2
4.4
3.5
3.5
1.8
2.8
4.7
2.9
2.9
3.8
3.1
1.7
4.6
1.1
0
2
0
1
2
2
0
1
0
1
3
1
1
0
3
1
2
2
1
1
1
1
1
0
2
2
2
2
1
3
1
0
0
0
1
0
0
2
0
1
1
0
0
0
0
1
1
0
0
1
1
0
1
1
5
4
8
2
2
2
1
5
3
1
4
5
3
4
4
5
1
1
3
2
3
4
5
4
3
3
2
2
3
5
3
4
1
1
3
3
3
2
4
4
4
2
3
3
4
3
2
3
3
2
3
4
3
4
5.51
17.72
7.09
13.19
9.28
9.28
6.86
5.33
4.4
6.28
19.97
5.33
8.15
13.28
10.59
4.93
6.13
7.08
11.25
5.48
11.39
2.1
8.93
7.2
15.68
10.77
5.29
5.29
9.49
14.28
1.98
7.1
4.69
4.69
7.48
5.2
5.2
9.88
9.14
3.71
3.65
7.45
4.15
4.15
6.32
5.95
4.64
6.84
6.84
3.54
6.92
5.96
4.9
13.32
403.8
515.5
547.3
351.4
339.5
339.5
322.6
410.9
265.5
235
-143.82
-8.08
-282.18
60.09
25.05
25.05
38.24
-167.61
-4.28
51.25
-0.859
-0.63
-0.783
-0.16
-0.672
-0.672
-0.599
-0.763
-0.706
-0.311
-8.922
-8.831
-9.42
-8.878
-9.276
-9.276
-8.728
-8.826
-9.479
-7.909
8.45
5.59
2.42
3.01
3.77
3.77
2.44
6.25
5.53
2.37
-4748.8
-5692.5
411.3
358.2
377.3
492.3
415.5
297.7
300.7
373.6
297.6
389.5
369.6
426
455.3
358.2
311.9
351.4
351.4
345.4
396.6
287.4
244.5
279.5
279.5
370.9
356.7
356.7
339.8
366.5
304.8
304.4
318.3
321.7
321.7
309.8
322.4
311.9
313.8
313.8
345.9
375.7
304.6
367.4
370.7
-167.61
-49.34
64.29
10.13
-195.2
-198.04
-81.49
-102.35
-120.15
-104.31
-63.41
-118.05
131.06
-0.77
-26.68
-38.49
-38.49
-89.08
-3.11
87.9
6.97
29.32
29.32
-11.47
10.96
10.96
115.59
-114.99
72.63
72.03
149.51
62.54
62.54
-32.82
2.74
-57.06
-14.2
-14.2
74.37
-131.61
12.13
12.25
-128.3
-0.764
-0.23
-0.87
-0.636
-0.705
-0.803
-0.529
-0.19
-0.749
-0.185
-0.844
-0.86
-0.888
-0.781
-0.99
-0.424
-0.424
-0.218
-0.586
-0.564
-1.404
-0.785
-0.785
-0.267
-0.475
-0.476
-0.501
0.212
-0.472
-0.427
-0.279
-0.746
-0.746
-1.121
-1.015
-1.07
-0.746
-0.746
-0.616
-0.68
-1.048
-0.948
-0.419
-8.827
-9.245
-9.582
-8.559
-8.932
-9.318
-9.196
-9.374
-9.454
-9.37
-8.454
-8.803
-8.641
-8.197
-9.349
-8.671
-8.671
-9.406
-8.369
-8.902
-10.395
-8.972
-8.972
-8.458
-8.964
-8.964
-8.922
-8.984
-8.545
-8.558
-9.099
-9.078
-9.078
-9.528
-8.747
-9.23
-9.285
-9.285
-8.4
-9.054
-9.584
-8.494
-8.573
6.26
4.11
4.99
7.65
6.92
3.69
4.04
4.12
5.36
3.9
5.45
6.27
3.99
3.36
3.77
2.65
2.65
3.56
5.42
3.19
9.37
3.21
3.21
1.73
2.31
2.32
2.15
3.8
5.9
2.15
4.18
3.57
3.57
5.65
2.84
5.69
3.55
3.55
3.33
3.7
5.35
5.51
6.54
-4776.9
-3665.4
-4270.9
-5603
-4805.4
-5102.7
-4491.2
-4011.1
-4590.7
-4166.5
-3959
-5132.1
-4650.8
-4265.1
-4014.4
-4199.5
-4199.5
-3854.8
-4705.8
-3258.8
-3338.6
-3633.9
-3633.9
-4310.4
-4115.2
-4115.3
-3808.9
-4082.7
-3530.7
-3530.7
-3128.3
-3704
-3704
-4385.8
-3620
-4463.7
-3284.9
-3284.9
-3511.2
-3978.7
-3913.7
-3839.4
-4354.3
55
536.8
3.6
0
4
5.19
334
112.75
-0.599
-8.495
2.53
-3762.5
-3440.1
-3774.8
-3774.8
-3259
-4776.9
-3396.7
-2601.4
1. Volume ellissoidale (Å3), 2. log P, 3. numero di danatori di H, 4. numero di accettori di H, 5. lipolo totale, 6. area superficiale (Å2), 7.
calore di formazione (kcal mol-1), 8. ELUMO (eV), 9. EHOMO (eV), 10. momento di dipolo totale (Debye), 11. energia totale (eV).
Formattato: Giustificato, Interlinea
singola
L’intero set di 11 descrittori e 55 composti è stato utilizzato per effettuare una PCA. La
Tabella 4 riporta la matrice di 11 PC con la loro composizione in termini di variabili originali,
insieme alla frazione di varianza spiegata, la frazione totale di varianza spiegata e l’autovalore
della matrice di covarianza corrispondente a ogni componente, quest’ultimo valore è uguale
alla frazione di varianza spiegata dal numero di variabili usate. Le prime 4 PC, che hanno
autovalore superiore a 1 e che spiegano il 73.7% della varianza sono state selezionate per
ulteriori calcoli. Nella prima PC le variabili che hanno maggiore importanza sono il volume
ellissoidale (+0.39), l’area superficiale (+0.45) e l’energia totale in acqua (-0.46). Queste
variabili chiaramente riflettono l’importanza dell’approccio sterico al binding pocket e il
comportamento delle molecole all’interno del citoplasma. Nella seconda PC le caratteristiche
elettroniche hanno un peso maggiore: ELUMO (+0.45), EHOMO (+0.45), dipolo totale (-0.47)
riflettono l’importanza del π-stacking durante l’interazione farmaco-recettore. Log P e il
calore di formazione hanno una grande importanza nella terza e nella quarta PC (+0.59, +0.44
e +0.38, -0.58 rispettivamente), analogamente il numero di donatori di H (-0.41) assume
importanza nella terza PC e ELUMO (+0.47) nella quarta. Ma dal momento che la frazione di
varianza spiegata dalla terza e dalla quarta PC è piuttosto bassa queste variabili non sono
certamente le più rilevanti.
Tabella 4. Risultati della PCA sul set di descrittori selezionato e sugli indici di similarità
Descrittore
1
2
3
4
5
6
7
8
9
10
11
Frazione di varianza spiegata
Varianza totale spiegata
Autovalore
PC1
0.386
-0.140
0.278
0.331
0.288
0.450
-0.227
-0.027
0.094
0.293
-0.457
0.327
0.327
3.602
PC2
0.238
0.034
0.302
-0.262
0.223
0.124
0.281
0.454
0.453
-0.467
0.075
0.194
0.521
2.137
PC3
0.259
0.589
-0.408
0.272
-0.224
0.267
0.385
-0.150
0.225
0.025
-0.010
0.120
0.642
1.325
PC4
-0.319
0.438
-0.150
-0.027
-0.083
0.213
-0.581
0.473
-0.037
-0.153
-0.203
0.095
0.737
1.046
Shape
Frazione di varianza spiegata
Varianza totale spiegata
Autovalore
PC1
0.529
0.529
29.130
PC2
0.118
0.647
6.491
PC3
0.091
0.739
5.050
PC4
0.045
0.784
2.498
Lipofilia
Frazione di varianza spiegata
Varianza totale spiegata
Autovalore
PC1
0.947
0.947
52.1
PC2
0.024
0.971
1.33
Formattato: Tipo di carattere: 10 pt,
Italiano (Italia)
Formattato: Tipo di carattere: 10 pt,
Italiano (Italia)
Formattato: Tipo di carattere: 10 pt,
Italiano (Italia)
PC5
0.034
0.819
1.892
PC6
0.029
0.848
1.608
PC7
0.020
0.869
1.137
PC8
0.019
0.889
1.082
Poiché la similarità molecolare è uno degli strumenti più utili nell’approccio
computazionale per identificare molecole che si legano allo stesso sito recettoriale, sono stati
calcolati anche gli indici di similarità in termini di caratteristiche steriche (shape) e potenziale
lipofilico39. Infatti la shape può fornire informazioni sull’accessibiltà e sull’interazione con il
sito attivo, mentre la lipofilia può essere importante non solo per l’interazione con il binding
site, il quale è stabilizzato dalle caratteristiche idrofobiche dell’inibitore, ma anche per la
biodisponibilità. Ancora una PCA è stata effettuata sulle matrici degli indici di similarità e il
numero di PC significative è stato determinato come in precedenza (autovalore > 1): otto PC
nel caso degli indici di similarità per shape e 2 nel caso degli indici di similarità secondo la
lipofilia. Le componenti principali selezionate sono state incluse separatamente in una
Discriminant Analysis con lo scopo di fornire l’assegnazione a una delle due classi: Sensibili
(S) o Resistenti (R).
E’ noto che una singola mutazione nel binding pocket degli NNRTI può condurre ad un
elevato livello di resistenza. Le mutazioni che sono state selezionate sono K103N e Y181C,
associate con un tipo di resistenza soprattutto nei confronti degli NNRTI di prima
generazione37b, inclusi i farmaci Nevirapina (31) e Delavirdina(15), e V106A e L100I che
causano resistenza anche con i farmaci di nuova generazione, sebbene da bassa a intermedia
nel caso di Delavirdina (15) e Efavirenz (20).41,42 Inizialmente sono stati inclusi nella DA
soltanto i derivati per i quali sono disponibili dati di sensibilità/resistenza. I risultati sono
schematizzati nella Tabella 5. Gli hit-rates ottenuti sono tutti elevati (≥ 80.9) specialmente per
i composti sensibili: i derivati sono stati assegnati alla vera classe con poche eccezioni. Questi
risultati sono particolarmente interessanti nel caso dei due mutanti più frequenti (L100I e
K103N) quando vengono considerati le PC derivate dai descrittori e dagli indici di similarità
per shape. Le PC derivate dagli indici di similarità per lipofilia hanno significatività statistica
solo nel caso di L100I. Prendendo in considerazione le PC derivate dai descrittori, è rilevante
osservare che nel caso di L100I e K103N, le prime due componenti principali evidenziano
l’importanza delle caratteristiche steriche ed elettroniche nell’insorgere della resistenza. Nel
caso di Y181C ancora una volta la prima PC è coinvolta insieme alla terza e alla quarta PC e
quindi i descrittori log P, calore di formazione, ma anche ELUMO e donatori di H. Nel caso
della mutazione V106A la seconda , la terza, la quarta PC sono tutte di relativa importanza,
così si può assumere che le caratteristiche elettroniche giocano un ruolo di primaria
importanza.
Tabella 5. Risultati della DA basati sui PC per I descrittori e gli indici di similarità per le classi R e S
Descrittori
Predetti
Tot.
Hit
Rate
R
S
1
7
85.7%
R
6
0
10
100%
L
S
10
6
11
1
Totale
17
94.1%
0 Variabili incluse PC1, PC2, PC4
13.24;
df=1,
p<0.001
0
Chi2
I
Cpro 51.5% min. hit-rate=64.3%
Cmax 58.8% min. hit-rate=73.5%
4
15
73.3%
R
11
0
8
100%
K
S
8
11
12
1
Total
23a
82.6%
0 Variabili incluse PC1, PC2, PC4
11.24; df=1, p<0.001
3
Chi2
N
Cpro 52.7% min. hit-rate=65.8%
Cmax 65.2% min. hit-rate=81.5%
0
4
100%
R
4
0
5
100%
V
S
5
4
5
1
Total
9
100%
0 Variabili incluse PC2, PC3, PC4
9;
df=1,
p<0.01
6
Chi2
A
Cpro 50.5% min. hit-rate=63.1%
Cmax 55.5% min. hit-rate=69.4%
1
8
87.5%
R
7
1
12
91.6%
Y
S
11
8
12
1
Total
20a,b 90.0%
8 Variabili incluse PC1, PC3, PC4
13.24; df=1,
p<0.001
1
Chi2
C
Cpro 52.0% min. hit-rate=65.0%
Cmax 60.0% min. hit-rate=75.0%
aa
Entry esclusa: 3. bEntry esclusa: 11
Indice di similatità
SHAPE
Hit
Predetti
Tot.
Rate
R
S
0
7
100%
7
0
10
100%
10
7
10
17
100%
PC4, PC6, PC7
17;
df=1,
p<0.001
51.5% min. hit-rate=64.3%
58.8% min. hit-rate=73.5%
2
16
87.5%
14
0
8
100%
8
14
10
24
91.6%
PC3, PC4, PC5, PC8
13.24; df=1,
p<0.001
55.5% min. hit-rate=69.7%
66.7% min. hit-rate=83.3%
0
4
100%
4
0
5
100%
5
4
5
9
100%
PC3
9;
df=1, p
<0.01
50.5% min. hit-rate=63.1%
55.5% min. hit-rate=69.4%
3
8
62.5%
5
1
13
92.3%
12
6
15
21b
80.9%
PC2, PC3, PC5, PC6, PC7
7.28; df=1, p<0.01
52.8% min. hit-rate=66.0%
61.9% min. hit-rate=77.3%
Indice di similatità
LIPOFILIA
Hit
Predetti
Tot.
Rate
R
S
1
7
85.7%
6
1
10
90.0%
9
7
10
17
88.2%
PC2
9.74; df=1,
p<0.01
51.5% min. hit-rate=64.3%
58.8% min. hit-rate=73.5%
1
16
93.7%
15
7
8
12.5%
1
22
2
24
66.7%
PC1
0.27; df=1,
p<1
55.5% min. hit-rate=69.7%
66.7% min. hit-rate=83.3%
2
4
50.0%
2
0
5
100%
5
2
7
9
77.8%
PC1, C2
3.21;
df=1,
p<0.1
50.5% min. hit-rate=63.1%
55.5% min. hit-rate=69.4%
2
9
77.8%
7
7
13
46.1%
6
14
8
22
59.1%
PC1, PC2
1.31; df=1, p<1
51.6% min. hit-rate=64.5%
59.0% min. hit-rate=73.7%
Considerando la validità statistica dei risultati ottenuti, sono stati effettuati nuovi calcoli
includendo questa volta anche i derivati per i quali i dati di sensibilità/resistenza non sono
noti. La procedura di classificazione implica l’inserimento dei vari composti nelle classi S o
R. I dati riportati in Tabella 6 mostrano che è possibile fornire previsioni di attività per un
elevato numero di derivati assegnando fino a 10 composti alla classe R, mentre ci si può
attendere che anche un elevato numero di composti inseriti nella classe S, può conservare la
propria attività nei confronti dei ceppi mutanti. In generale i migliori risultati sono stati
ottenuti nel caso di L100I e K103N per i quali si è ottenuto il maggior numero di assegnazioni
soprattutto quando sono state utilizzate le PC provenienti dai descrittori. Mentre per V106A le
previsioni sono meno significative probabilmente a causa del limitato numero di dati input.
I risultati ottenuti dalla DA possono essere così riassunti:
Il paragone dei risultati per tutti i mutanti di RT mostra che una consistente
classificazione come S è raggiunta nel caso dei derivati 33, 34, 40, 41, 48, 49,
55 e come R nel caso dei composti 5, 6, 17, 51, 54. I derivati 4 e 42 e 24 sono
generalmente classificati come sensibili, ma le assegnazioni sono controverse
contro K103N (4, 42) o contro V106A (24).
I derivati 23 e 41 sono predetti sempre nella stessa classe.
Per quanto riguarda i tre farmaci in commercio, la Delavirdina (15) viene
generalmente identificata correttamente con la sola eccezione nel caso del
mutante Y181C quando si considera l’indice di similarità per shape e;
Efavirenz (20) è generalmente classificato correttamente dai PC derivati dai
descrittori, mentre la Nevirapina (31) viene correttamente classificata nel caso
del mutante V106A.
Nel caso di PNU-142721, il solo composto sotto trials clinici per il quale sono
disponibili dati di sensibilità/resistenza differenti per i due stereoisomeri [40
configurazione R; 41 configurazione S], le analisi che tengono conto dei
descrittori e degli indici di similarità per shape riescono a discriminare tra i due
isomeri. Per gli altri composti chirali inseriti nello studio, non vengono rilevate
differenze sostanziali, confermando i dati biologici ottenuti sulla miscela di
isomeri.
Tabella 6. Classificazione dell’intero set di NNRTI nelle classi R and S
Entry
L100I
DESCRITTORI
K103N
V106A
Y181C
L100I
K103N
R
1
R
R
S
S
R
2
R
R
R
S
S
3
SHAPE
V106A
S
R
R
4
S
5
6
7
S
8
R
9
S
10
S
R
R
R
S
S
R
S
R
S
R
R
R
R
Y181C
R
R
R
R
S
R
R
S
11
12
R
13
R
S
R
R
S
S
R
14
S
R
S
S
15
S
R
R
R
S
R
16
R
R
S
S
R
R
R
R
S
17
R
18
S
R
S
19
S
R
R
R
R
R
S
S
R
S
S
R
R
R
R
R
R
20
R
21
R
R
22
S
R
23
R
R
24
S
25
S
26
S
S
R
R
S
S
S
R
R
R
R
R
R
R
S
R
S
S
R
R
27
S
R
S
28
S
R
S
29
R
R
R
R
R
S
R
R
R
R
S
S
S
S
S
S
S
S
30
S
31
S
R
32
S
R
R
R
R
R
R
33
S
S
34
S
S
35
S
36
S
S
37
S
S
S
S
R
S
S
38
39
R
40
S
41
S
42
R
S
R
S
S
S
S
S
S
R
S
S
R
43
S
S
S
S
S
S
44
S
S
S
S
S
S
45
S
R
S
R
46
S
47
R
48
S
49
S
50
R
R
R
S
R
S
S
R
R
R
R
R
S
R
S
R
S
R
R
R
R
51
R
R
R
52
S
R
R
53
R
R
S
54
R
R
R
55
S
Corretto
S
Predetto
R
R
Misclassificato Classe
Opposta
Misclassificato
Classe No-Data
S
R
8.2 – Analisi multivariata applicata agli Inibitori della Proteasi
Lo studio sugli inibitori della Proteasi è stato effettuato invece su un set combinato di
cinquantuno inibitori, sia di tipo peptidomimetico sia di tipo non peptidico.
Anche in questo caso la selezione include la maggior parte dei derivati attualmente
presenti nel database del National Institute of Allergy and Infectious Diseases (NIAID)36 e i
derivati di letteratura per i quali è stata riportata l’attività inibitoria contro HIV-1.43 (vedi
Tabella 7) E’ stato considerato solo il derivato più attivo appartenente ad ogni classe chimica.
Tabella 7. Resistenza (R)a/Suscettibilità (S) b verso i mutanti di PR selezionati
Entry
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
19
20
21
22
23
24
25
26
27
28
29
30
31
32
33
34
35
36
37
38
39
40
41
42
43
44
45
46
47
48
49
50
51
a
Derivati
33_DER_CYCLOURETHAN
(R)6H-1,3-DIOS-4D
AG_1350
AHPBA_38
AHPBA_48
AMPRENAVIR
A_77212
BILA_2185_BS
BMS_186318
CAGEDIM_3C
CYANGUAN_8I
CYCLOSULFAMIDE_25
CYCLOUREA_1
CYCLOUREA_10A
CYCPRTR_11
DHP_13Y
DMP_450
DPC_681
DUPLCTERM_4
EGCg
ESC_14
HEA_19
INDINAVIR
ISOQUIN_URETH_ANALOG_2
I_12
KNI_272
LASINAVIR
LC_3
LOPINAVIR
LY_289612-ANAL1
LY_314163
LY_326188
L_689502
MANNAR_9F
MANNOPYRANOSIDE_18
MW_583
NELFINAVIR
PALINAVIR
PARACYCLOPHANE_DER_1
RITONAVIR
R_87366
SAQUINAVIR
SD_146
SE_063
SYN_DIMERIC_DHP_17
TELINAVIR
THP_19
THP_20
TIPRANAVIR
TMC_126
UREATRICL_9
V82A
V82F
I84V
R
S
S
R
R
R
S
R
R
S
R
R
R
S
S
R
S
R
R
S
S
S
S
S
S
Ref.
43a°
43b
43c
43d
43e
43f, 43g., 44a, 43q, 44b
43h
43i, 44c
43j, 44c
43k
43l
43m
43m
43n
43o
43p
43q, 43r 44d
43s
43t
43u
43v
43w
43x, 43y, 43q, 44b, 944e
43z
43aa
43ab, 43ac, 44c, 44f
43ad, 43ae
43af
43ag, 43s, 44g
43ah, 43ai
43aj
43ak
43al, 43am
43an
43ao
43ap
43aq, 43ar, 44h, 44c, 44f
43as, 44f
43at
43au, 44f, 944c
43av
43q, 43aw, 44e
43q, 43ax,
43ay
43az
43ba,43bb 44c
43bc
43bc
43bd, 43be, 44c, 44f
43bf
43bg
R>2.1 resistant ratio (Attività sul ceppo mutante /Attività sul wt); bS<2.1 resistant ratio.
Nel tentativo di classificare questo set di composti sulla base della loro attività contro i più
comuni mutanti di PR43,44, i derivati con resistant ratio > 2.1 sono stati considerati come
resistenti (R), i composti con ratio < 2.1 sono stati considerati come suscettibili (S). Anche in
questa occasione le molecole sono state disegnate inizialmente come rappresentazioni 2D
utilizzando ChemDraw e poi ottimizzate come strutture tridimensionali attraverso metodi
semiempirici (MNDO o PM3) utilizzando i moduli CORINA e COSMIC di TSAR 3.2.
Tabella 8. Database dei descrittori molecolari utilizzati nel caso degli inibitori della Proteasi.
Entry
Descrittori
1
2
3
4
5
6
7
8
9
10
11 12
7.76
543.72
2334.60
4.00
5.44
6.16
13.00
8
1.10
87.50
2
7
1
-19.12
538.06
4882.70
6.22
8.17
11.93
9.63
11
1.23
116.48
2
7
2
3
-4.81
522.66
2777.70
7.90
3.19
17.74
10.31
10
1.37
85.18
4
5
4
-28.03
588.82
3658.70
3.19
6.04
36.39
12.69
14
1.39
111.92
4
5
5
-14.37
465.65
1682.20
5.73
4.40
20.95
9.43
8
1.42
97.06
4
5
-18.36
449.62
2677.00
8.60
2.66
7.22
9.93
12
1.62
85.82
3
7
6
25.38
624.37
4785.00
5.47
7.02
8.69
15.36
21
1.45
114.67
4 10
7
-10.97
601.50
3440.20
6.97
4.42
14.50
12.26
13
1.33
95.38
3
6
8
9
-30.32
654.52
5672.60
2.84
3.16
16.49
15.43
18
1.50
114.33
5
9
10
114.97
503.97
1406.60
1.99
5.36
5.16
6.31
10
1.13
96.67
4
6
11
28.03
466.07
1683.90
3.61
7.40
2.21
9.24
9
1.29
78.50
2
4
20.70
554.47
2559.70
8.48
4.18
7.08
11.11
12
1.26
109.65
4
9
12
25.58
439.96
1276.40
6.40
5.69
11.37
9.46
10
1.21
89.67
2
5
13
14
35.88
527.54
2196.70
7.46
7.33
5.63
9.57
10
0.99
104.33
4
5
15
166.59
661.40
5609.20
1.56
4.71
4.69
13.08
17
1.06
126.67
6
6
16
-12.44
436.77
1231.40
6.12
4.24
2.12
7.56
7
1.60
74.47
3
4
17
-10.45
473.48
1190.30
6.75
4.94
7.52
8.81
8
1.24
90.00
4
3
-8.39
624.30
5044.50
6.71
4.51
12.81
13.91
17
1.65
117.57
5
7
18
34.39
757.32
5098.70
1.93
4.93
24.98
16.89
19
1.45
135.33
6
8
19
20
4.88
381.55
1360.60
3.40
3.02
3.36
6.09
4
1.34
99.83
8 11
21
9.55
531.55
3072.10
8.28
2.59
7.01
10.50
12
1.38
93.07
2
8
22
-30.20
634.33
4103.50
5.41
5.30
21.30
14.70
17
1.60
113.08
5
6
23
-17.27
574.53
3283.90
4.42
3.46
14.53
10.91
12
1.17
99.92
4
7
-20.97
553.13
2689.40
8.37
3.80
3.73
11.03
11
1.39
96.73
3
7
24
-58.66
667.91
4336.60
7.34
-1.42
20.15
15.74
18
1.25
149.93
7 14
25
26
-8.13
576.67
2848.10
6.42
1.71
19.20
13.01
14
1.35
108.68
4
7
27
-22.59
636.54
3387.50
4.34
3.34
21.48
16.96
20
2.28
112.75
4
9
28
-5.60
606.24
4290.80
5.70
6.43
35.81
11.65
13
1.11
120.75
3
6
29
-19.59
584.23
2282.60
4.02
4.99
19.42
13.33
15
1.39
104.50
4
5
-52.24
559.94
2513.60
9.56
4.02
20.76
11.37
13
1.39
113.57
4
6
30
-56.18
611.36
2293.60
9.86
2.80
13.97
12.71
14
1.46
123.22
4
9
31
32
-21.58
547.83
3624.10
9.05
2.28
8.61
11.63
12
1.38
95.00
3
7
33
-21.93
649.01
4697.40
5.31
4.77
25.50
13.24
16
1.17
110.08
4
8
34
38.26
648.52
2536.00
11.41
4.36
14.57
11.58
13
1.16
146.67
6
8
35
6.88
274.55
476.65
6.34
-0.22
8.65
5.40
4
1.86
58.00
4
6
3.89
517.52
2470.20
7.66
3.67
12.94
8.95
11
1.12
98.08
4
6
36
-4.60
554.21
3247.50
5.43
4.64
12.62
10.60
10
1.38
87.55
4
5
37
38
-4.95
650.88
5730.00
8.71
4.37
23.11
13.50
15
1.18
117.58
4
8
39
-29.83
641.01
2843.10
2.37
4.39
32.44
16.75
12
1.48
128.08
6
8
40
-21.89
654.06
4217.90
1.08
5.47
4.03
15.76
18
1.35
112.10
4
7
41
-24.57
526.63
2286.90
3.20
-0.02
22.42
11.09
12
1.38
115.58
5
8
-37.39
599.86
4227.50
2.94
2.99
16.21
12.19
13
1.21
114.58
5
7
42
-3.03
720.55
5298.90
10.55
7.60
5.18
11.92
12
0.79
141.33
6
7
43
44
20.33
474.24
1469.00
8.13
4.82
8.45
8.34
8
1.11
93.17
4
4
45
51.44
646.76
3011.00
8.40
6.15
4.93
12.44
17
1.17
127.00
2
8
46
-60.07
555.19
3836.70
4.86
2.62
19.34
12.53
14
1.67
108.42
5
6
47
4.44
492.98
2005.00
6.86
5.19
5.23
7.64
8
1.10
85.83
3
3
36.83
526.00
2441.60
5.29
5.07
8.24
7.29
8
1.00
89.00
3
4
48
-2.60
554.90
5695.80
6.29
6.03
9.64
9.67
11
1.23
114.48
2
6
49
50
2.79
502.48
3097.50
9.41
3.47
9.38
10.24
13
1.36
93.48
2
9
51
335.51
473.62
2805.20
8.25
3.49
12.31
6.62
7
0.97
86.92
3
5
2
3
1. Energia totale (eV); 2. Area superficiale accessibile (Å ); 3. Volume ellissoidale (Å ); 4. Momento di dipolo totale (Debye); 5. log P; 6.
Lipolo totale; 7. Φ (flessibilità ); 8. Numero di legami rotabili; 9. Indice di Balaban, 10, Indice Elettrotopologico di Kier; 11, Numero di
donatori di H; 12. Numero di accettori di H.
È stato inizialmente calcolato un pool di più di 80 descrittori, tra i quali sono stati
selezionati 12 descrittori da includere nel database che meglio identificano le caratteristiche
molecolari che possono essere correlate con l’attività biologica. (Tabella 8)
La selezione di variabili strutturali è stata fatta considerando le numerose strutture
cristallografiche di HIV-1 PR complessato con gli inibitori, le quali supportano il ben noto
binding mode delle differenti classi di inibitori di PR. In particolare il volume ellissoidale e
l’area superficiale accessibile per quanto riguarda le caratteristiche steriche, log P e lipolo
totale per quanto riguarda le caratteristiche idrofobiche, il momento totale di dipolo e
l’energia totale n in vacuo per le caratteristiche energetiche, il numero di donatori e accettori
di legami H. Sono stati scelti anche dei descrittori della classe degli indici topologici quali
l’indice di flessibilità Φ il quale è correlato con il grado di linearità e la presenza di cicli o
ramificazioni;45 il numero di legami rotabili, l’indice di Balaban,46 somma degli stati
elettrotopologici di Kier,47,
48
e l’indice topologico di Kier-Hall. Quest’ultimo descrittore
codifica informazioni circa la flessibilità, dimensioni, ramificazioni e forma delle molecole.
Su questo set di dodici descrittori è stata effettuata una PCA. I primi 4 PC, con autovalore
> 1 e che spiegano il 77.2% della varianza, sono stati selezionati per ulteriori analisi. (vedi
Tabella 9)
Tabella 9. Risultati della PCA sul set di descrittori selezionato e sull’indicei di similarità (shape)
Descrittori
1
2
3
4
5
6
7
8
9
10
11
12
Frazione di varianza spiegata
Varianza totale spiegata
Autovalore
PC1
0.142
-0.407
-0.346
0.092
0.022
-0.246
-0.417
-0.404
-0.083
-0.388
-0.224
-0.285
0.405
0.405
4.859
PC2
0.354
0.249
0.253
0.054
0.562
-0.153
-0.031
0.049
-0.538
0.159
-0.192
-0.228
0.165
0.570
1.979
PC3
0.245
-0.008
-0.044
0.426
-0.346
-0.243
-0.194
-0.140
-0.349
0.269
0.381
0.426
0.109
0.679
1.307
PC4
-0.376
0.050
0.069
0.722
0.043
-0.133
0.072
0.137
0.109
-0.015
-0.514
0.099
0.093
0.772
1.117
Shape
PC1 PC2 PC3 PC4 PC5 PC6 PC7 PC8 PC9 PC10 PC11 PC12
Frazione di varianza spiegata 0.209 0.160 0.132 0.058 0.047 0.040 0.033 0.027 0.026 0.022 0.022 0.020
0.209 0.369 0.501 0.559 0.606 0.646 0.679 0.706 0.733 0.755 0.776 0.796
Varianza totale spiegata
10.653 8.175 6.730 2.974 2.377 2.058 1.672 1.387 1.343 1.125 1.110 1.006
Autovalore
Nella prima PC le variabili che hanno maggiore importanza sono l’area superficiale
accessibile (-0.41), Φ (-0.42) ed il numero di legami rotabili (-0.40). Questo riflette
l’importanza dell’approccio sterico al binding pocket e in particolare la necessità di un alto
grado di flessibilità per raggiungere interazione adatte. Nella seconda PC, log P (+0.56)
sottolinea l’importanza della lipofilia nel binding mode dovuta alla presenza delle tasche
idrofobiche S/S’ che consentono la corretta sistemazione dell’inibitore. Nella stessa PC,
l’indice di Balaban gioca un ruolo notevole (-0.54). PC3 è ben rappresentata in termini di
momento di dipolo (+0.43) e numero di accettori di H (+0.43): questo mostra come le
caratteristiche elettroniche, ma principalmente la capacità di formare legami H rappresenta un
elemento fondamentale per l’inibizione del processo proteolitico. Queste considerazioni
possono essere estese alla quarta PC dove i loadings più alti sono stati trovati per il momento
di dipolo (+0.72) e il numero di donatori di H (-0.51).
Anche nel caso degli inibitori della proteasi sono stati calcolati gli indici di similarità per
shape. Un’altra PCA è stata fatta sulla matrice degli indici di similarità e il numero di PC
significative (12 PC) è stato determinato come sopra (autovalore > 1).(vedi Tabella 9)
Come per RT vengono considerati i dati di attività contro i più comuni ceppi mutanti.(vedi
Tabella 7) I mutanti che sono stati scelti sono V82A, V82F e I84V poiché tutte queste
mutazioni sono nel sito attivo dell’enzima e sono state riscontrate nella maggior parte dei
pazienti che ricevono il trattamento con PI già approvati dal FDA. Inoltre per questi mutanti
sono stati trovati in letteratura il maggior numero di dati in singola mutazione: questa scelta
consente di costruire un modello più semplice. Prima la DA è stata effettuata considerando a
turno solo i derivati per i quali i dati sensibilità/resistenza erano disponibili. I risultati della
DA sono riportati nella Tabella 10, ed in generale mostrano una elevata significatività
statistica dal momento che in quattro analisi su sei hit-rate = 100%: tutti gli inibitori sono
assegnati alla classe vera di appartenenza. Solo nel caso delle mutazioni V82A e V82F,
quando si considerano i descrittori, il test Chi2 non respinge la null-hypothesis, anche se i test
di Huberty danno risultati statisticamente significativi. Per questi mutanti gli indici di
similarità sembrano dare delle informazioni migliori per definire sensibilità o resistenza dei
derivati.
Nel caso del mutante I84V, PC2 e PC3 supportano l’importanza della lipofilia e della
capacità di formare legami H nello sviluppo della resistenza, mentre il peso del momento di
dipolo (+0.43) può essere correlato alla rilevanza delle interazioni elettroniche e di non
legame nel sito attivo. Tutti questi dati sono in accordo con le informazioni strutturali
disponibili circa la natura della resistenza.49
Considerando la validità statistica dei risultati ottenuti, sono stati effettuati nuovi calcoli
includendo questa volta anche i derivati per i quali i dati di sensibilità/resistenza non sono
noti. La procedura di classificazione implica l’inserimento dei vari composti nelle classi S o
R. I dati riportati in Tabella 11 mostrano che è possibile fornire previsioni di attività per un
elevato numero di derivati. I migliori risultati sono stati ottenuti nel caso del mutante I84V per
il quale sono state trovate il maggior numero di assegnazioni (fino a 32 molecole classificate).
Tabella 10. Risultati della DAa basati sui PC per i descrittori e gli indici di similarità per le classi R e S
V
8
2
A
V
8
2
F
I
8
4
V
Descrittori
Predetti
Hit
Tot.
R
S
Rate
1
4
75.0%
R
3
1
4
75.0%
S
3
4
4
Totale
8
75.0%
Variabili incluse PC1, PC2
2;
df=1;
p<0.20
Chi2
50.0%
min. hit-rate=62.5%
Cpro
50.0%
min. hit-rate=62.5%
Cmax
0
5
100%
R
5
2
4
50.0%
S
2
7
2
Totale
9
77.8%
Variabili incluse PC2, PC4
3.2;
df=1;
p<0.10
Chi2
50.6%
min. hit-rate=63.2%
Cpro
55.5%
min. hit-rate=69.4%
Cmax
0
3
100%
R
3
0
5
100%
S
5
3
5
Totale
8
100%
Variabili incluse PC2, PC3
8;
df=1;
p<0.01
Chi2
53.1%
min. hit-rate=66.4%
Cpro
62.5%
min. hit-rate=78.1%
Cmax
Shape
Predetti
R
S
0
4
0
4
4
4
Tot.
4
4
8
Hit
Rate
100%
100%
100%
8;
50.0%
50.0%
5
0
5
df=1;
p<0.01
min. hit-rate=62.5%
min. hit-rate=62.5%
0
5
100%
4
100%
4
4
9
100%
9;
50.6%
55.5%
3
0
3
df=1;
p<0.01
min. hit-rate=63.2%
min. hit-rate=69.4%
0
3
100%
5
100%
5
5
8
100%
8;
53.1%
62.5%
df=1;
p<0.01
min. hit-rate=66.4%
min. hit-rate=78.1%
I risultati possono essere riassunti come segue.
Il paragone dei risultati per tutti i mutanti della proteasi mostra che in numerosi casi è
stata raggiunta una classificazione consistente come S (cfr. derivati 34, 38, 45, 50) e come R
nel caso dei composti 4, 10, 16, 44, 46. Tali risultati possono essere di rilevante interesse dal
momento che si può supporre che per i derivati predetti come S, la presenza di qualsivoglia
mutazione non implica necessariamente l’insorgere di resistenza, mentre l’opposto diviene
realmente rilevante per le molecole predette come R. Inoltre nel caso della mutazione I84V, i
derivati 27 e 29 sono sempre classificati come R. Questi risultati possono essere giustificati
considerando l’alto grado di similarità strutturale tra le molecole che sono classificate in
maniera consistente. Ciò è confermato anche dall’analisi dei descrittori che hanno maggior
importanza nelle PC incluse nella DA. Per quanto riguarda i derivati per i quali esistono dati
in letteratura, nella maggior parte dei casi si ottiene una corretta classificazione confermando
così la rilevanza del modello. Nel caso dei descrittori, è stato possibile effettuare un maggior
numero di assegnazioni, probabilmente poiché il set scelto rende conto in maniera ottimale
dei fattori più importanti per determinare resistenza e suscettibilità.
Nel caso delle mutazioni V82A e V82F, i derivati con attività nota contro i mutanti
selezionati sono classificati correttamente con poche eccezioni.
In particolare quando viene considerata la mutazione V82A, le molecole che sono
classificate come R (escludendo solo il derivato 46) sono non peptici e questo suggerisce che
l’approccio non peptidico potrebbe essere poco proficuo per la progettazione di farmaci attivi
contro ceppi che presentano questa mutazione per questa mutazione. Infatti tutte le molecole
che sono classificate come sensibili sono di tipo peptidomimetico.
Per quanto concerne i farmaci disponibili in commercio, è interessante notare che LPV
(29) e RTV (40) sono sempre classificati correttamente, APV (6) è classificato nella classe
opposta solo nel caso della mutazione I84V.
Tabella 11. Classificazione dell’intero set di NNRTI nelle classi R and S. Legenda: vedi Tabella 6
Entry
1
Descrittori
V82A
V82F
R
Shape
I84V
S
3
R
4
R
5
R
6
R
S
S
7
S
R
S
S
R
S
R
S
9
10
11
S
R
R
R
I84V
R
S
S
R
R
S
R
R
R
12
V82F
R
2
8
V82A
R
S
13
R
14
S
15
S
16
R
17
R
R
18
S
19
S
S
S
S
R
S
R
S
R
R
R
R
R
R
R
R
S
S
S
S
R
S
S
20
R
S
21
S
R
S
R
R
23
R
R
S
24
S
25
R
S
26
S
S
27
R
R
R
28
S
R
R
29
R
R
R
S
31
S
32
S
33
S
R
34
S
S
35
R
R
R
22
30
S
S
S
R
S
S
R
S
R
S
R
R
R
R
S
R
R
S
R
S
S
R
36
R
37
S
S
R
S
S
R
38
S
S
S
S
S
S
R
S
R
R
S
R
R
R
S
S
39
40
S
41
42
S
S
S
S
S
43
S
S
S
S
S
44
R
R
45
S
S
S
46
R
R
R
47
R
48
R
49
S
50
51
R
S
R
R
R
R
S
S
R
S
S
8.3 – Confronto dei dati di analisi multivariata e docking per NNRTI e inibitori di PR
Si è iniziato ricercando nel Brookhaven Protein Databank i files relativi alle strutture della
PR e della RT di HIV-1 che presentassero singola mutazione. Come riportato nella Tabella 12
è stato impossibile selezionare una struttura idonea per i mutanti di V106A e L100I a causa
della mancanza di strutture cristallografiche del singolo mutante nel PDB. Inoltre per
mantenere l’omogeneità nelle conformazioni, in entrambi i casi, sono state scelte strutture che
presentassero lo stesso ligando cristallizzato. Secondo la procedura riportata nella sezione
materiali e metodi, sono state sfruttate le due modalità di ricerca dei siti al fine di valutare
meglio l’interazione ligando-proteina. Esempi di cavità ottenute nel caso di RT e di Pr sono
riportati in Figura 18. Come si può notare dalla Tabella 13 il rapporto fra la dimensione dei
siti del ceppo mutante con il wild type indica una leggera variazione nell’ampiezza del
binding site. Nella maggior parte dei casi la mutazione determina una riduzione del sito attivo,
solo nel caso della mutazione V82F ed in modalità PROTEIN SHAPE si ha un netto
incremento della cavità a disposizione del ligando.
PROTEASI
TRASCRITTASI INVERSA
Tabella 12. Strutture del Protein Data Bank selezionate per il docking.
In rosso le proteine mutate, in giallo i wild type
LIGANDO
MUTAZIONE
PDB FILE RISOLUZIONE
EFAVIRENZ
K103N
1IKV
3.00
EFAVIRENZ
K103N
1FKO
2.90
NEVIRAPINA
K103N
1FKP
2.90
PNU142721
K103N
1KX
2.80
EFAVIRENZ
Y181C
1JKH
2.50
TNK-651
Y181C
1JLA
2.50
NEVIRAPINA
Y181C
1JLB
3.00
EFAVIRENZ
WILD TYPE
1FK9
2.50
DUPONT XV638
V82F/I84V
1BWA
1.90
DUPONT SD146
V82F/I84V
1BWB
1.80
TIPRANAVIR
V82F/I84V
1D4S
2.50
A77003
V82A
1HVS
2.25
DMP450
I84V
1MER
1.90
DMP323
I84V
1MES
1.90
DMP323
V82F
1MET
1.90
DMP323
V82F/I84V
1MEU
1.90
A77003
WILD TYPE
1HVI
1.80
DMP323
WILD TYPE
1QBS
1.80
Tabella 13. Dimensioni dei siti attivi calcolati con LIGANDFIT. In basso sono espressi i rapporti fra le
dimensioni dei siti attivi delle proteine mutate e le dimensioni dei siti attivi dei WT
FREE POINTS
DOCKED
PROTEIN
PDB ID
LIGAND
SHAPE
CEPPO
1FK9
1716
1979
WILD TYPE
RT
1FKO
1688
1856
K103N
1JHK
1558
1774
Y181C
1HVI
6934
1663
WILD TYPE
1QBS
4153
2014
WILD TYPE
PR
1HVS
6954
1453
V82A
1MES
4167
1997
I84V
1MET
4029
3167
V82F
RT
PR
MUTAZIONE
Y181C
K103N
I84V
V82F
V82A
RATIO
1JKH/1FK9
1FKO/1FK9
1MES/1QBS
1MET/1QBS
1HVS/1HVI
DL
0.910
0.980
1.003
0.970
1.003
PS
0.900
0.937
0.990
1.570
0.870
Figura 18. Esempi di siti attivi ottenuti con LIGANDFIT®
Si è passati poi alla fase di scoring. Sono state utilizzate tutte le funzioni di scoring
disponibili in LIGANDFIT, per valutare tutti i possibili contributi energetici dell’interazione
ligando proteina. (cfr. sezione 7.9) Normalmente, si procede prendendo in considerazione il
conformero con il valore più alto, ma nel nostro caso anche i conformeri che presentano un
valore di docking basso potrebbero indicare una bassa interazione ligando-proteina correlabile
al possibile insorgere di resistenza. Per semplificare, allora, l’enorme quantità di dati prodotti
dallo scoring delle molecole si è deciso di prendere in considerazione, per l’analisi comparata
che si vuole effettuare in seguito, gli scores maggiori (MAX), quelli minori (MIN) e la media
degli scores (MEDIA) relativi ad ogni inibitore analizzato.
Si è deciso poi di calcolare la somma algebrica degli scores:
Q = score ( proteina mutata) – score ( proteina nativa)
In questa modo si possono classificare i derivati oggetto dello studio come suscettibili o
resistenti. Infatti se Q>0 si può ipotizzare che il composto dockato sia potenzialmente attivo
(S) nei confronti della proteina mutata rispetto alla proteina nativa, se Q<0 si può ipotizzare
che il composto dockato sia potenzialmente non attivo (R) nei confronti della proteina mutata
rispetto alla proteina nativa. Le funzioni di scoring vengono considerate separatamente, il
composto è assegnato come R o S sulla base del fatto che almeno due dei tre valori Q siano
concordanti. Questo tipo di interpretazione ha anche il vantaggio di poter confrontare i
descrittori che definiscono le singole funzioni di scoring con i descrittori usati per l’analisi
statistica multivariata. Nella Tabella 14 vengono riportate le percentuali di assegnazioni
corrispondenti tra analisi multivariata e docking nel caso di RT, mentre in Tabella 15 vengono
riportate quelle ottenute nel caso di PR.
Tabella 14. Percentuali di assegnazioni corrispondenti tra analisi multivariata e docking per RT
DOCKED LIGAND
LIGSC1 LIGSC2
DESCRITTORI
PLP1
PLP2
PMF
LUDI
K103N
42
47.60%
30.90%
50.00%
50.00%
47.60%
45.20%
Y181C
34
61.70%
61.70%
58.80%
52.90%
44.10%
44.10%
TOT
SIMILARITA'
PLP1
PLP2
TOT LIGSC1 LIGSC2
PMF
LUDI
K103N
31
48.40%
35.40%
41.90%
41.90%
29.00%
29.00%
Y181C
27
51.80%
59.20%
55.50%
51.80%
44.40%
37.00%
PROTEIN SHAPE
DESCRITTORI
PLP1
PLP2
PMF
LUDI
K103N
42
50.00%
54.70%
52.38%
40.40%
50.00%
57.14%
Y181C
34
61.70%
58.80%
50.00%
50.00%
35.20%
44.10%
TOT
LIGSC1 LIGSC2
SIMILARITA'
PLP1
PLP2
TOT LIGSC1 LIGSC2
PMF
LUDI
K103N
31
45.16%
58.00%
41.90%
29.00%
45.16%
48.40%
Y181C
27
59.20%
59.20%
55.50%
55.50%
37.00%
33.30%
In una prima analisi si nota che per gli inibitori di RT, essendo il sito di legame degli
NNRTI molto circoscritto ed in genere completamente occupato dagli inibitori, i risultati sono
paragonabili in entrambe le modalità di ricerca dei siti con l’eccezione dei dati ottenuti per la
mutazione K103N in modalità DOCKED LIGAND a confronto con i dati ottenuti dall’analisi
dei descrittori. Nel caso della RT, LIGSCORE 1 e 2 uniformemente forniscono gli scores più
alti nel caso di Y181C e nel caso di K103N rispettivamente. Infatti tali funzioni tengono in
considerazione contributi energetici di natura sterica ed elettronica in accordo con i descrittori
aventi il maggior peso nelle PC. (cfr. Tabella 4)
Per PR le percentuali migliori sono ottenute in modalità DOCKED LIGAND. Questo può
essere giustificato dal fatto che il ligando cristallizzato ed in genere tutti gli inibitori di PR
non vanno ad occupare completamente il sito attivo dell’enzima, ma si limitano al massimo ad
occupare 4 delle 6 tasche disponibili, per cui la modalità protein shape calcolando un sito di
binding di dimensioni più grandi fa si che il docking dei ligandi fornisca valori di score
variabili. LUDI è lo score che da i risultati maggiormente concordanti per V82A e V82F e
questo è pienamente in accordo con i dati multivariati. Infatti La funzione LUDI comprende,
come detto prima, contributi energetici derivanti da legami H ideali e interazioni lipofile,
proprietà chimico fisiche espresse in log P, µ e donatori di H, cioè i descrittori con maggior
peso nelle PC che definiscono ogni singola mutazione. Nel caso di I84V, ma in generale per
tutte e tre le mutazioni considerate, le percentuali più elevate si ottengono mediamente
quando i dati di docking vengono confrontati con quelli ottenuti dagli indici di similarità. (cfr.
Tabella 10)
Tabella 15. Percentuali di assegnazioni corrispondenti tra analisi multivariata e docking per PR
DOCKED LIGAND
LIGSC1
LIGSC2
DESCRITTORI
PLP1
PLP2
PMF
LUDI
V82A
35
45.70%
45.70%
49.00%
45.70%
46.00%
60.00%
V82F
38
50.00%
47.30%
50.00%
50.00%
42.10%
57.80%
I84V
40
57.50%
60.00%
43.00%
53.00%
43.00%
50.00%
TOT
LIGSC1
SIMILARITA'
LIGSC2 PLP1
PLP2
PMF
LUDI
V82A
21
33.30%
28.50%
43.00%
42.80%
48.00%
52.30%
V82F
20
60.00%
55.00%
60.00%
55.00%
50.00%
65.00%
I84V
20
45.00%
45.00%
45.00%
45.00%
70.00%
25.00%
TOT
PROTEIN SHAPE
LIGSC1
LIGSC2
DESCRITTORI
PLP1
PLP2
PMF
LUDI
V82A
35
51.40%
48.50%
43.00%
45.70%
43.00%
51.40%
V82F
38
52.60%
55.20%
36.80%
34.20%
42.10%
47.30%
I84V
40
45.00%
47.50%
55.00%
55.00%
47.50%
50.00%
TOT
LIGSC1
SIMILARITA'
LIGSC2 PLP1
PLP2
PMF
LUDI
V82A
21
57.10%
57.10%
38.00%
23.80%
52.00%
66.60%
V82F
20
40.00%
50.00%
40.00%
35.00%
50.00%
50.00%
I84V
20
35.00%
40.00%
60.00%
40.00%
35.00%
50.00%
TOT
I risultati riportati nelle Tabelle 14 e 15 possono essere meglio compresi se si visualizza il
tipo di interazione che i derivati classificati rispettivamente come S e R instaurano con i siti
attivi degli enzimi mutati, tenendo anche conto delle modificazioni avvenute nel sito attivo
delle proteine. Nelle Figure 19 e 20 sono riportati l’insieme delle molecole classificate S e R
nei confronti delle varie mutazioni oggetto di studio.
Come si può notare, la mutazione in posizione 103 della RT conduce ad un consistente
restringimento del sito attivo, così le molecole che vengono coerentemente classificate come
resistenti sono quelle più voluminose del set, mentre quelle che vengono classificate come
sensibili presentano dimensioni ridotte e possono quindi assumere la tipica conformazione a
farfalla degli NNRTI necessaria per la comparsa dell’attività inibitoria. Nella mutazione in
posizione 181 invece la perdita dell’anello aromatico della tirosina, oltre a condurre al
restringimento del sito attivo, comporta la perdita da parte degli inibitori della capacità di
effettuare interazioni π così come è stato dimostrato nel caso della Nevirapina e Delavirdina.50
Infatti le molecole che vengono coerentemente classificate come R hanno una struttura
analoga a quella dei due inibitori e tendono quindi ad assumere una conformazione simile ai
due farmaci.
Molecole classificate Resistenti
Molecole classificate
Suscettibili
103N
103N
K103
K103
Molecole classificate
Resistenti
Y181
181C
Figura 19. NNRTI: Interazioni delle molecole S e R nei siti attivi
Nel caso di PR le mutazioni V82A e I84V conducono ad una riduzione della lipofilia della
tasca di legame così che le molecole che vengono classificate come resistenti,
indipendentemente dal fatto che presentino struttura peptidica o non peptidica, incorporano
delle grosse porzioni lipofile che riducono la loro capacità di interazione. Considerazioni di
tipo opposto possono essere fatte nel caso della mutazione V82F. Infatti la presenza del
residuo aromatico della fenilalanina aumenta la lipofilia del subito S/S’ così che le molecole
che presentano porzioni lipofile sono quelle che vengono coerentemente classificate come
sensibili.
Molecole class. Suscettibili
Molecole class. Resistenti
Molecole class. Resistenti
V82
84V
I84
82A
82A
V82
I84
84V
Molecole class. Suscettibili
Molecole class. Resistenti
82F
V82
82F
V82
V82
82F
82F
Figura 20. Inibitori di PR: Interazioni delle molecole S e R nei siti attivi
V82
8.4 – Considerazioni finali all’analisi comparata tra metodi multivariati e docking
In questa prima parte del dottorato si è messo a punto un metodo per correlare i risultati
ottenuti mediante QSAR e molecular docking per sets selezionati di inibitori della trascrittasi
e della proteasi di HIV-1. E’stato messo in evidenza come generalmente sia possibile valutare
l’eventuale insorgere di resistenza nei confronti dei mutanti selezionati che inducono
modificazioni significative del sito di binding. Questi risultati contribuiranno sicuramente allo
sviluppo della progettazione di nuovi inibitori potenzialmente attivi nei confronti di ceppi
mutati.
8.5 – Analisi multivariata applicata agli Inibitori di IN
Ho iniziato il lavoro conducendo una ricerca bibliografica per selezionare le molecole,
appartenenti al svariate classi strutturali, da cui è stato scelto un set di 450 composti, tra i più
attivi nei confronti di HIV-1 IN (Cfr. Appendice III).
Dal momento che un tale set di strutture risulta inadeguato per gli studi QSAR, a causa
della disomogeneità di dati da analizzare e della eterogeneità delle strutture a disposizione, si
è deciso di applicare metodi di esplorazione multivariata (Multivariate Exploratory
Techniques), allo scopo di individuare un numero opportuno e limitato di molecole su cui
condurre le successive analisi chemiometriche. La tecnica utilizzata è stata CA, che permette
di utilizzare il concetto di distanza per raggruppare elementi con proprietà simili all’interno di
un cluster.
In una prima fase tutte le 450 molecole sono state inserite in uno storage del software
CODESSA PRO. Le strutture vengono inizialmente ottimizzate per la visualizzazione in
modalità 3D. Successivamente si è utilizzato il software MOPAC 7 per l’ottimizzazione della
struttura attraverso un processo di minimizzazione dell’energia fino ad arrivare ad un valore
di gradiente RMS preimpostato: in questo caso è stato applicato l’operatore Hamiltoniano
PM3 con un gradiente RMS pari a 0.01. Infine per ciascuna molecola del set, sono stati
calcolati tutti i descrittori disponibili, inserendoli in una matrice. I descrittori calcolati sono
stati quindi utilizzati per condurre CA.
CODESSA PRO è in grado di calcolare per ciascuna struttura diverse centinaia di
descrittori, tra i quali alcuni risultano ridondanti, in quanto derivano da manipolazioni
matematiche di altri più rappresentativi. Altri, invece, sono correlati ad un particolare tipo di
atomi (es. alogeni), e non risultano pertanto comuni a tutte le molecole. Si è perciò effettuata
una selezione tra tutti quelli disponibili per mettere in evidenza i descrittori contenenti
un’informazione utilizzabile nel caratterizzare le singole strutture. Si rende così possibile
l’applicazione degli algoritmi di clustering alla matrice dei descrittori. Per effettuare questo
processo di selezione ci si è basati inizialmente sul raggruppamento in classi proposto dal
Theoretical Background di CODESSA PRO, che suddivide l’intera mole di descrittori nelle
seguenti categorie:
●
●
●
●
Costituzionali
Topologici
Geometrici
Elettrostatici
●
●
●
●
CPSA (Charged Partial Surface Area)
Quanto-chimici
Correlati agli Orbitali Molecolari
Termodinamici
Successivamente si sono analizzati i descrittori inclusi in ciascuna classe, con particolare
attenzione a quelli che forniscono informazioni circa le connettività degli atomi nella
molecola ed i parametri di distribuzione di carica o di energia, specie a livello delle aree
superficiali. Con questo procedimento si è pervenuti infine alla selezione di 38 descrittori
molecolari, comuni a tutte le molecole prese in esame, da utilizzare nella conduzione della
CA come parametri esprimenti le peculiarità di ciascuna molecola. (Tabella 16)
NA
NC,r
NB
NAr
W
Tabella 16. Descrittori selezionati
Numero totale di atomi
Numero relativo di atomi di C
Numero totale di legami
Numero di legami aromatici
Indice di Wiener
m
Indice di connettività di Randic
m
Indici topologici semplici di Kier e Hall
m
Parametro di forma di Kier (m=1, 2, 3)
Indice di flessibilità di Kier
J
Indice di connettività di Balaban
IA,B,C
VM
P
T1 E
Momenti principali di inerzia
T2
E
0
H
Volume Molecolare
Parametro di polarità
Indice topologico elettronico per gli atomi
Indice topologico elettronico per i legami
f
HOMO
LUMO
Calore di formazione
Contenuto energetico dell’ HOMO
Contenuto energetico del LUMO
Momento dipolare della molecola
MinNAC
MaxNAC
CSA
PSA
PSAM
PPSAM
NSAM
NPSAM
Minima carica atomica netta
Massima carica atomica netta
Area superficiale carica
Area superficiale parziale
Area superficiale carica positivamente
Area superficiale parziale carica positivamente
Area sperficiale carica negativamente
Area superficiale parziale carica negativamente
In letteratura vengono forniti generalmente due tipi di dati di attività per gli inibitori di
HIV-1 Integrasi, espressi entrambi in M, relativi sia alle reazioni di 3’-Processing che di
Strand Transfer. Tuttavia sono presenti dei casi in cui è fornito un solo dato di attività relativo
ad una delle due reazioni catalizzate dall’enzima. Non è stato perciò possibile generare
clusters validi per lo studio di entrambi i tipi di attività enzimatica; ad un approccio
incompleto si è pertanto preferito effettuare due CA distinte, una comprendente tutte le
molecole per le quali sono disponibili dati relativi al 3’-Processing, ed una per le molecole per
cui si dispone dati relativi allo Strand Transfer.
Le due matrici dei descrittori (relativi a 375 molecole per 3’-Processing ed a 305 derivati
per Strand Transfer) sono state in seguito importate nel pacchetto TSAR 3.2. Per entrambi i
tipi di attività sono state eseguite quattro CA distinte, utilizzando tutti gli algoritmi di
clustering messi a disposizione dal software, e mantenendo in tutte le analisi la misura della
distanza euclidea. Si sono poi effettuate le analisi successive su campioni di molecole
rappresentativi dell’intero set esaminato. Si sono scelte pertanto, attraverso l’esame del
dendrogramma di ciascuna analisi, dei set di 30, 35, 40 e 50 molecole corrispondenti ai
centrotipi di altrettanti clusters individuati, a vari valori di treshold di distanza euclidea.
(Tabella 17)
Strutture
Str.Tr.
Strutture
3'-Proc.
Tabella 17. Valori di distanza euclidea
30
35
40
50
30
35
40
50
WRNN
SL
CL
GA
0.124
0.397
0.397
0.456
0.118
0.417
0.417
0.442
0.108
0.44
0.44
0.42
0.08
0.37
0.37
0.382
0.126
0.445
0.244
0.338
0.109
0.47
0.228
0.316
0.1
0.486
0.21
0.296
0.09
0.414
0.189
0.276
I set di molecole sono stati analizzati con CODESSA PRO, per costruire i modelli QSAR.
I dati di attività relativi al saggio enzimatico in vitro sull’enzima purificato, sono stati espressi
come pIC50. Ad un approccio classico (del tipo Leo e Hansch), che prevede la correlazione dei
dati di attività con una serie di descrittori scelti a priori, si è preferito utilizzare un approccio
che sfruttasse al massimo le potenzialità del software CODESSA, che consente di cercare la
migliore correlazione possibile, lineare o multilineare, attraverso l’utilizzo dei migliori
descrittori selezionabili tra tutti quelli disponibili.
Attraverso questa procedura (BMLR, Best Multilinear Regression) sono state ottenute una
serie di equazioni per tutti i set di molecole. Queste includono un numero variabile di
descrittori molecolari e predicono le attività delle strutture corrispondenti con diverso grado di
precisione e con qualche eccezione rappresentata dagli outliers. Non tutte le equazioni
risultano tuttavia attendibili allo stesso modo, in quanto i valori di r e r2cv non conferivano
validità statistica, cosicché si è preferito restringere il campo di ricerca ai set di 40 molecole
per le attività di 3’-Processing e di 30 molecole per lo Strand Transfer, ottenuti mediante
l’algoritmo del Complete Linkage. (Tabella 18) Questa procedura assicura che i cluster siano
scelti massimizzando la distanza euclidea tra i singoli casi, in maniera tale che i centrotipi
sono rappresentativi del maggior numero possibile di casi. Inoltre questi set di molecole
offrono il miglior compromesso tra il numero di descrittori utilizzati nella relazione, il numero
di molecole esaminate ed il numero di casi non validi.
Cluster
3'-Proc.
Str. Tr.
Com.Link.
Com.Link.
Tabella 18. Modelli QSAR selezionati
N° Strutture
N° Descr.
r2
r2cv
40
30
8
6
0.81
0.89
N° Outliers
0.7
0.8
0
0
Il primo modello (Figura 21) è relativo alla reazione di 3’-Processing, e consta di 8
descrittori, per un totale di 40 molecole.
Figura 21. pIC50 Osservati vs Predetti per 3’-Processing
Riesce a prevedere i valori di attività per tutte le molecole con buona validità statistica
2
(r =0.81; r2cv=0.7), secondo la seguente equazione:
pIC50=74.429 + 0.177 HOLUGAP -15.321 MC_MAX +2.403 AIFCONT_1 -0.312 NATM_N
+34.193 1RI_MAX +0.237 KSHP_2 -0.348 HMIN +37.382 HDSA2TM_A
dove:
HOLUGAP è la differenza in termini di energia tra HOMO e LUMO della molecola,
grandezza indicativa della capacità di ionizzazione della molecola;
MC_MAX è la massima energia di scambio per il legame H-C;
AIFCONT_1 è l’indice di informazione sulla composizione atomica media di ordine 1,
fondato sul concetto matematico di entropia e di contenuto di informazione, avente la
proprietà di possedere un valore indipendente dalla numerazione dei vertici del grafo;
NATM_N è il numero di atomi di azoto;
1RI_MAX è l’indice di massima reattività elettronica per l’atomo di carbonio;
KSHP_2 è il parametro di forma di Kier di ordine 2, derivato dal grafo molecolare senza
tenere conto dei legami ad idrogeno, normalizzato sul numero totale di atomi della
molecola, che dà una rappresentazione dell’intera molecola;
HMIN è il numero minimo di siti accettori e donatori di legami ad H;
HDSA2TM_A è un indice, riferito al numero di siti accettori di legami ad idrogeno, del
rapporto tra l’area superficiale dei siti H-donatori e l’area superficiale totale.
Dal tipo di descrittori utilizzati in questa equazione è possibile ipotizzare per la comparsa
dell’attività inibitoria un notevole contributo di fattori di tipo elettronico, quali la
distribuzione di carica all’interno della molecola, il grado di reattività dei singoli atomi o la
composizione atomica media; emerge come determinante inoltre il ruolo del legame ad
idrogeno, rappresentato sia dal parametro di distribuzione dei siti H-donatori all’interno della
molecola, che dalla presenza di un numero minimo di siti accettori di legami ad idrogeno. Da
non sottovalutare infine il ruolo degli atomi di azoto, il cui doppietto di non legame potrebbe
fornire una base per legami aggiuntivi.
Il secondo modello (Figura 22), relativo alla reazione di Strand Transfer, consta di 6
descrittori.
Figura 22. pIC50 Osservati vs Predetti per per Strand Transfer
Esso può essere utilizzato per prevedere l’attività di un set di 30 molecole (Cfr. Appendice
IV) con una buona approssimazione, valutata attraverso il valore di r2=0.89 (r2cv=0.8).
L’equazione è la seguente:
pIC50= -6.030 + 93.911 HDCA2TM_A +0.378 CO_CI_MAX -412.938 O_ERI_AVG
-0.942 HDCA2 +0.007 WNSA1M -0.004 MNO_POL_A
dove:
HDCA2TM_A è un indice, riferito al numero di siti accettori di legami ad idrogeno, del
rapporto tra la superficie carica dei siti H-donatori e l’area superficiale totale;
CO_CI_MAX è il massimo valore di interazione coulombiana tra gli atomi di C ed O;
O_ERI_AVG è un parametro che esprime il valore medio di reattività elettrofilica per
l’atomo di ossigeno;
HDCA2 è il rapporto tra la superficie carica dei siti donatori di legami ad idrogeno,
calcolata secondo Zefirov, e la superficie molecolare totale;
WNSA1M è un parametro che esprime il rapporto pesato tra l’area superficiale carica
negativamente e l’area superficiale totale;
MNO_POL_A è invece il fattore di polarizzabilità alfa, ossia il fattore di proporzionalità
tra il momento dipolare indotto su una molecola ed il campo elettrico in cui la
molecola è immersa.
Come nel caso precedente relativo alle attività di 3’-Processing, in questo modello sono
presenti dei descrittori che forniscono informazioni sulla distribuzione dei siti donatori o
accettori di legami ad idrogeno sulla superficie della molecola, come HDCA2TM_A o
HDCA2. A differenza del precedente, però, nella reazione di Strand Transfer assumono
maggiore importanza le forze di interazione tra cariche localizzate sugli atomi di C ed O,
come lasciano intendere CO_CI_MAX ed O_ERI_AVG. Indicativa, a tal proposito, è inoltre
la presenza di parametri che definiscono l’importanza delle superfici cariche negativamente o
del momento dipolare, come WNSA1M o MNO_POL_A.
In questa seconda parte del lavoro di dottorato è stato possibile proporre un set di
molecole, rappresentative delle classi più attive di inibitori di HIV-1 IN riportate in
letteratura. Si sono sviluppati dei modelli QSAR che riescono a prevedere con buona
approssimazione l’attività dei derivati selezionati in funzione di un buon numero di
descrittori. I risultati di questo lavoro, quindi, oltre ad aver contribuito a chiarire l’interazione
dell’enzima Integrasi con i suoi inibitori, possono fornire delle linee guida per la sintesi di
nuovi composti che posseggano caratteristiche strutturali adeguate a massimizzarne la
performance farmacologica.
9. CONCLUSIONI
Durante il mio dottorato di ricerca mi sono occupato dello studio degli inibitori dei tre
principali enzimi di HIV-1 ossia RT, PR e IN nel tentativo di esplorare le caratteristiche che
possono modulare l’attività biologica. Lo studio effettuato si è articolato in due parti. La
prima ha riguardato RT e PR, la seconda IN.
Nella prima parte mi sono proposto di sviluppare un metodo per valutare l’eventuale
insorgere di resistenza o suscettibilità di due diversi set di molecole contro i più comuni ceppi
mutanti di RT (L100I, K103N, V106A e Y181C) e PR (V82A, V82F, I84V). Nell’analisi dei
dati, ottenuti dalle tecniche chemiometriche utilizzate (PCA, DA) e dal docking molecolare
(LIGANDFIT), si è potuta evidenziare una coincidenza tra i descrittori che assumono
maggiore importanza nelle PCA e quelli che costituiscono i contributi energetici che
determinano i valori di score. Inoltre è stato possibile osservare che nel caso degli inibitori di
RT le molecole che vengono classificate come resistenti presentano dimensioni maggiori di
quelle classificate come sensibili e che l’interazione π risulterebbe di fondamentale
importanza nella modulazione dell’attività. Mentre nel caso degli inibitori di PR si è potuto
osservare che in relazione al tipo di mutazione, la presenza di porzioni lipofile voluminose
potrebbe definire il comportamento come suscettibili oppure resistenti: in questo caso è di
fondamentale importanza la visualizzazione delle interazioni sul sito attivo cosi come
possibile con le tecniche di docking.
Nella seconda parte mi sono occupato degli inibitori di IN. Non è stato possibile in questo
caso effettuare uno studio sul possibile insorgere della resistenza in quanto non esistono
ancora farmaci disponibili in commercio e non sono perciò noti dati riguardanti la possibile
comparsa di mutazioni. L’obiettivo è stato allora quello di selezionare e classificare una serie
di strutture rappresentative delle classi di inibitori più efficaci. Si sono sviluppati dei modelli
QSAR che riescono a prevedere con buona approssimazione l’attività dei derivati selezionati
in funzione di un buon numero di descrittori (in tutti i modelli NStrut./NDesc.≤5), il cui
significato può essere correlato alle caratteristiche strutturali della molecola. Si è evidenziata
l’importanza di alcuni parametri, come l’abbondanza di siti donatori od accettori di legami ad
idrogeno, che risultano necessari al fine di garantire una stabile interazione ligando-enzima.
Le tecniche chemiometriche e di docking utilizzate durante il mio dottorato di ricerca
nello studio degli inibitori di HIV-1 si sono rivelate essere di particolare interesse e possono
fornire delle linee guida per la sintesi di nuovi composti con caratteristiche strutturali
adeguate a massimizzarne l’interazione farmaco-recettore e quindi di conseguenza l’attività
biologica.
BIBLIOGRAFIA
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
19
20
21
22
23
24
25
26
27
28
29
30
31
32
33
34
35
36
37
Seydel, J.; Schaper, K. Chemische Struktur und Biologische Aktivität von Wirkstoffen
Weinheim; Verlag Chemie 1979
Condra, J.; Emin, E.; Gotlib, L.; Graham, J.; Schlabach, A.; Wolgang, J.; Colonno, R.;
Sardana, V. Antimicrob. Agents Chemother., 1992, 36, 441.
De Clerq, E. Biochem. Pharmacol., 1994, 47, 155.
De Clerq, E. Int. J. Immunother., 1994, 10, 145.
Nanni, R.; Ding, J.; Jacobo-Molina, A.; Hughes, S.; Arnold, E. Perspect. Drug Discovery
Design, 1993, 1, 129.
Tantillo, C.; Ding, J.; Jacobo-Molina, A.; Nanni, R.;Boyer, P.; Hughes, S.; Pauwels, R.;
Andries, K.; Jansen, P.; Arnold, E. J. Mol. Biol., 1994, 243, 369.
Tong, L.; Cardozo, M.; Jones, P.-J.; Adams, J. Bioorg. Med. Chem. Lett., 1993, 7, 721.
Asante-Appiah, E.; Skalka, A. M. Antivir. Res., 1997, 36, 139
Pommier, Y.; Marchand, C.; Neamati, N. Antivir. Res., 2000, 47, 139
Akimov, D. V.; Filimonov, D. A.; Poroikov, V. V. Pharm. Chem. J., 2002, 36, 575
Sotriffer, C.; Ni, A.; McCammon, J.A. J. Med. Chem., 2000, 43, 4109
Swanstrom, R.; Erona, J. Pharm. Ther., 2000, 86, 145.
Menendez-Arias, L. TRENDS in Pharm. Sci., 2002, 8, 381.
Leung, D.; Abbenante, G.; Fairlie, D. J. Med. Chem., 2000, 43, 305.
Todeschini, R. Introduzione alla Chemiometria, EdiSesm, 1998
Manly, B. Factor Analysis. In Multivariate statistical methods. A primer. Chapman and
Hall 1986, Chapter 7.
Carbo, R.; Leyda, L.; Arnau, M. Int. J. Quant. Chem. 1980, 17, 1185-1189.
TSAR 3.2 Reference Guide, Oxford Molecular, 1998
web address: http:\\www.statsoft.com/textbook/stathome.html
Darlington, R. B. Regression and Linear Models, McGraw-Hill, 1990
Neter, J.; Wassermann, W.; Kutner, M. H. Applied Linear Regression Models (2nd ed.),
Homewood, IL: Irwin. 1989
Eriksson, L.; Johansson, E.; Muller, M.; Wold, S. J. Chemometr., 2000, 14, 599
Xu, Q. S.; Liang Y. Z. Chemom. Intell. Lab. Syst., 2001, 56,1
Stone, M. J. R. Stat. Soc., B. 1977, 38, 44
Martens, H. A.; Dardenne, P. “Validation and verification of regression in small data
sets”, 1998, 44, 99
Edington, E. S. Randomization tests, Marsel Dekker Inc., New York and Basel, 1981, 195
Huberty, C.; Psychol. Bull. 1984, 95, 156-169.
http://www.georgetown.edu/faculty/ballc/webtools/web_chi.html
Venkatachalam, C. M.; Jiang, X.; Oldfield, T.; Waldaman, M. J. Mol. Graph. Model.,
2003, 21, 289
Oldfield, T. Acta Cryst. 2001, D57, 82
Oldfield, T. Acta Cryst. 2001, D57, 696
LigandFit User Manual, Accelerys Inc, 2003
Verkhivker, G.; Bouzida, D.; Gehlhaar, D.; Rejto, P.; Arthurs, S.; Colson, A.; Freer, S.;
Larson, V.; Luty, B.; Marrone, T.; Rose, P. J. Comp. Aid. Mol. Des., 2000, 14, 731
Gehlhaar, D.; Verkhivker, G.; Rejto, P.; Sherman, C.; Fogel, D.; Fogel, L.; Freer, S.
Chem. Biol., 1995, 2, 317
Muegge, I.; Martin, Y. J. Med. Chem., 1999, 42, 791
web address: http://www.niaid.nih.gov/daids/dtpdb
Dati ricavati dai seguenti articoli e note citate in essi: (a) De Clercq, E. Med. Res. Rev.,
1996, 16, 125. (b) Campiani, G.; Ramunno, A.; Maga, G.; Nacci, V.; Fattorusso, C.;
Catalanotti, B.; Morelli, E.; Novellino, E. Curr. Pharm. Design, 2002, 8, 615. (c) Corbett,
J.; Gearhart, L.; Ko, S.; Rodgers, J.; Cordova, B.; Klabe, R.; Erickson-Viitanen, S. Bioorg.
Med. Chem. Lett., 2000, 10, 193. (d) Tramontano, E.; Piras, G.; Mellors, J.; Putzolu, M.;
38
39
40
41
42
43
Bazmi, H.; La Colla, P. Biochem. Pharm., 1998, 56, 1583. (e) Xu, Z.; Buckheit Jr., R.;
Stup, T.; Flavin, M.; Khilevich, A.; Rizzo, J.; Lin, L.; Zembower, D. Bioorg. Med. Chem.
Lett., 1998, 8, 2179. (f) Balzarini, J. Biochem. Pharm., 1999, 58, 1. (g) Silvestri, R.;
Artico, M.; Massa, S.; Marceddu, T.; De Montis, F.; La Colla, P. Bioorg. Med. Chem., 10,
2000, 253. (h) Arranz, M. Bioorg. Med. Chem., 1999, 7, 2811. (i) Buckheit, R.; White, E.;
Fliakas-Boltz, V.; Russell, J.; Stup, T.; Kinjerski, T.; Osterling, M.; Weigand, A.; Bader,
J. Antimicrob. Agents Chemother., 1999, 43, 1827. (l) Zembower, D.; Liao, S.; Flavin, M.;
Xu, Z.; Stup, T.; Buckheit, R.; Khilevich, A.; Mar, A.; Sheinkman, A. J. Med. Chem.,
1997, 40, 1005.
Dati ricavati dai database disponibili nei seguenti siti web: (a) http://
www.mediscover.net/antiviralintro.cfm; (b) http://resdb.lanl.gov/Resist DB/default.htm;
(c) http://hivdb.stanford.edu/; (d) http://www.hivresistanceweb.com/.
I descrittori molecolari sono stati calcolati secondo i metodi e le equazioni riportate su
TSAR 3.2 Reference Guide, Oxford Molecular Limited (1998).
Viswanadhan, V.; Ghose, A.; Revankar, G.; Robins, R. Atomic J. Chem. Inf. Comput. Sci.
1989, 29, 163-172.
Bacheler, L., Jeffrey, S., Hanna, G., et al., J Virol. 75, 4999-5008 (2001).
Petropoulos, C. J., Parkin, N. T., Limoli, K.L., et al., Antimicrob. Agents Chemother. 44,
920-8 (2000).
Dati ricavati dai seguenti articoli e note citate in essi: (a) Ghosh, A.; Swanson, L.;
Chunfeng, L.; Hussain, K.; Cho, H.; Walters, E.; Holland, L.; Buthod, J. Bioorg. Med.
Chem. Lett 2002., 12, 1993-1996. (b) Lee, Y.; Lee, Y.; Lee, J.; Kim, S.; Lee, C.; Park, H.
Bioorg. Med. Chem. Lett. 2000, 10, 2625-2627. (c) Munroe, J.; Hornback, W.; Campbell,
J.; Ouellette, M.; Hatch, S.; Muesing, M.; Wiskerchen, M.; Baxter, A.; Su, K.;
Campanale, K. Bioorg. Med. Chem. Lett. 1995, 5, 2885-2890. (d) Takashiro, E.;
Nakamura, Y.; Miyamoto, S.; Ozawa, Y.; Sugiyama, A.; Fujimoto, K. Bioorg. Med.
Chem. 1999, 7, 2105-2114. (e) Takashiro, E.; Hayakawa, I.; Nitta, T.; Kasuya, A.;
Miyamoto, S.; Ozawa, Y.; Yagy, R.; Yamamoto, I.; Shibayama, T.; Nakagawa, A.; Yabe,
Y. Bioorg. Med. Chem. 1999, 7, 2063-2072; (f) St Clair, M.; Millard, J.; Rooney, J.;
Tisdale, M.; Parry, N.; Sadler, B.; Blum, M.; Painter, G. Antiviral Res. 1996, 29, 53-56.
(g) Wilkerson, W.; Akamike, E.; Cheatham, W.; Hollis, A.; Collins, R.; De Lucca, I.;
Lam, P.; Ru, Y. J. Med. Chem. 1996, 39, 4299-4312. (h) Kempf, D.; Marsh, K.; Paul, D.;
Knigge, M.; Norbeck, D.; Kohlbrenner, W.; Codacovi, L.; Vasvanonda, S.; Bryant, P.;
Wang, X.; Wideburg, N.; Clement, J.; Plattner, J.; Erickson, J. Antimicrob. Agents
Chemother. 1991, 35, 2209-2214. (i) Doyon, L.; Croteau, G.; Thibeault, D.; Poulin, F.;
Pilote, L.; Lamarre, D. J. Virol. 1996, 70, 3763-3769. (j) Bechtold, C.; Patick, A.; Alam,
M.; Greytok, J.; Tino, J.; Chen, P.; Gordon, E.; Ahmad, S.; Barrish, J.; Zahler, R.; Lin, P.;
Colonno, R. Antimicrob. Agents Chemother. 1995, 39, 374-379. (k) Hilgeroth, A.; Wiese,
M.; Billich, J. Med. Chem. 1999, 42, 4729-4732. (l) Jhadv, P.; Woerner, F.; Lam, P.;
Hodge, N.; Eyermann, C.; Man, H.; Daneker, W.; Bacheler, L.; Rayner, M.; Meek, J.;
Erickson-Viitanen, S.; Jackson, D.; Calabrese, J.; Schadt, M.; Chang, C. J. Med. Chem.
1998, 41, 1446-1455. (m) Schaal, W.; Karlsson, A.; Ahlsen, G.; Lindberg, J.; Andersson,
H.; Danielson, H.; Classon, B.; Unge, T.; Samuelsson, B.; Hulten, J.; Hallberg, A.;
Karlen, A. J. Med. Chem. 2001, 44, 155-169. (n) Han, Q.; Chang, C.; Li, R.; Ru, Y.;
Jadhav, P.; Lam, P. J. Med. Chem. 1998, 41, 2019-2028. (o) Martin, S.; Dorsey, G.; Gane,
T.; Hillier, M. J. Med. Chem. 1998, 41, 1581-1597. (p) Hage, S.; Prasad, V.; Boyer, F.;
Domagala, J.; Ellsworth, E.; Gajda, C.; Hamilton, H.; Markoski, L.; Steinbaugh, B.; Tait,
B.; Lunney, E.; Tummino, P.; Ferguson, D.; Hupe, D.; Nouhan, C.; Grachek, S.;
Saunders, J.; VanderRoest, S. J. Med. Chem. 1997, 40, 3707-3711. (q) Jadhav, P.; Ala, P.;
Woerner, F.; Chang, C.; Garber, S.; Anton, E.; Bacheler, L. J. Med. Chem. 1997, 40, 181191. (r) Hodge, C.; Aldrich, P.; Bacheler, L.; Chang, C.; Eyermann, C.; Garber, S.; Grubb,
M.; Jackson, D.; Jadhav, P.; Korant, B.; Lam, P.; Maurin, M.; Meek, J.; Otto, M.; Rayner,
M.; Reid, C.; Sharpe, T.; Shum, L.; Winslow, D.; Erickson-Viitanen, S. Chem. Biol. 1996,
Formattato: Italiano (Italia)
Codice campo modificato
Codice campo modificato
Codice campo modificato
3, 301-314. (s) Kaltenbach, R. III; Trainor, G.; Getman, D.; Harris, G.; Garber, S.;
Cordova, B.; Bacheler, L.; Jeffrey, S.; Logue, K.; Cawood, P.; Klabe, R.; Diamond, S.;
Davies, M.; Saye, J.; Jona, J.; Erickson-Viitanen, S. Antimicrob. Agents Chemother. 2001,
45, 3021-3028. (t) Alterman, M.; Andersson, H.; Garg, N.; Ahlsen, G.; Lovgren, S.;
Classon, B.; Danielson, H.; Kvarnstrom, I.; Vrang, L.; Unge, T.; Samuelsson, B.;
Hallberg, A. J. Med. Chem. 1999, 42, 3835-3844. (u) Yamaguchi, K.; Honda, M.; Ikigai,
H.; Yukihiko, H.; Shimamura, T.; Inhibtory Effects of (-)-Antiviral Res. 1992, 53, 19-34.
(v) Ghosh, A.; Krishnan, K.; Walters, E.; Cho, W.; Cho, H.; Koo, Y.; Trevino, J.; Holland,
L.; Buthod, J. Bioorg. Med. Chem. Lett. 1998, 8, 979-982. (w) Beaulieu, P.; Wernic, D.;
Abraham, A.; Anderson, P.; Bogri, T.; Bousquet, Y.; Croteau, G.; Guse, I.; Lamarre, D.;
Liard, F.; Paris, W.; Thibeault, D.; Pav, S.; Tong, L. J. Med. Chem. 1997, 40, 2164-2176.
(x) Dorsey, B.; Levin, R.; Mcdaniel, S.; Vacca, J.; Guare, J.; Darke, P.; Zugay, J.; Emini,
E.; Schleif, W.; Quintero, J.; Lin, J.; Chen, I.; Ostovic, D.; Anderson, P.; Huff, J. J. Med.
Chem. 1994, 37, 3443-3451. (y) Farese-Di Giorgio, A.; Rouquayrol, M.; Greiner, J.;
Aubertin, A.; Vierling, P.; Guedj, R. Antivir. Chem. Chemother. 2000, 11, 97-110. (z)
Ghosh, A.; Lee, H.; Thompson, W.; Culberson, C.; Holloway, M.; Mckee, S.; Munson, P.;
Duong, T.; Smith, A.; Darke, P.; Zugay, J.; Emini, E.; Schlief, W.; Huff, J.; Anderson, P.
J. Med. Chem. 1994, 37, 1177-1188. (aa) Nair, A.; Bonin, I.; Tossi, A.; Welsh, W.;
Miertus, S. J. Mol. Graph. Model. 2002, 21, 171-179. (ab) Kageyama, S.; Mimoto, T.;
Murakawa, Y.; Nomizu, M.; Ford, Jr H.; Shirasaka, T.; Gulnik, S.; Erickson, J.; Takada,
K.; Hayashi, H.; Broder, S.; Kiso, Y.; Mitsuya, H. Antimicrob. Agents Chemother. 1993,
37, 810-817. (ac) Kato, R.; Mimoto, T.; Fukazawa, T.; Morohashi, N.; Kiso, Y. USP
5,932,550; Chem Abst. 2001, 134, 311436, . (ad) Cozens, R.; Bold, G.; Capraio, H.;
Fassler, A.; Mestan, J.; Lang, M.; Poncioni, B.; Stover, D.; Rosel, J. Antivir. Chem.
Chemother. 1996, 7, 294-299; (ae) Lazdins, J.; Bold, G.; Capraro, H.; Cozens, R.; Fassler,
A.; Flesch, G.; Klimkait, T.; Lang, M.; Mestan, J.; Poncioni, B.; Rosel, J.; Stover, D.;
Tintelnot-Blomley, M.; Walker, M.; Woods-Cook, K. Schweiz Med. Wochenschr 1996,
43, 1849-1851. (af) Marastoni, M.; Bazzaro, M.; Salvatori, S.; Bortolotti, F.; Tomatis, R.
Bioorg. Med. Chem. 2001, 9, 939-945. (ag) Molla, A.; Vasavanonda, S.; Kumar, G.;
Sham, H.; Johnson, M.; Grabowski, B.; Denissen, J.; Kohlbrenner, W.; Plattner, J.;
Leonard, J.; Norbeck, D.; Kempf, D. Virology 1998, 250, 255-262. (ah) Shepherd, T.;
Jungheim, L.; Baxter, A. Bioorg. Med. Chem. Lett. 1994, 4, 1391-1396. (ai) Jungheim, L.;
Shepherd, T.; Baxter, A.; Burgess, J.; Hatch, S.; Lubbenhusen, P.; Wiskerchen, M.;
Muesing, M. J. Med. Chem. 1996, 39, 96-108. (aj) Munroe, J.; Shepherd, T.; Jungheim,
L.; Hornback, W.; Hatch, S.; Muesing, M.; Wiskerchen, M.; Su, K.; Campanale, K.;
Baxter, A.; Colacino, J. Bioorg. Med. Chem. Lett. 1995, 5, 2897-2902. (ak) Hornback, W.;
Munroe, J.; Shepherd, T.; Hatch, S.; Muesing, M.; Wiskerchen, M.; Colacino, J.; Baxter,
A.; Su, K.; Campanale, K. Bioorg. Med. Chem. Lett. 1995, 5, 2891-2896. (al) Thompson,
W.; Fitzgerald, P.; Holloway, M.; Emini, E.; Darke, P.; Mckeever, B.; Schleif, W.;
Quintero, J.; Zugay, J.; Tucker, T.; Schwering, J.; Homnick, C.; Nunberg, J.; Springer, J.;
Huff, J. J. Med. Chem. 1992, 35, 1685-1701. (am) Ho, D.; Toyoshima, T.; Mo, H.;
Kempf, D.; Norbeck, D.; Chen, C.; Wideburg, N.; Burt, S.; Erickson, J.; Singh, M. J.
Virol. 1994, 68, 2016-2020. (an) Pyring, D.; Lindberg, J.; Rosenquist, A.; Zuccarello, G.;
Kvarnstrom, I.; Zhang, H.; Vrang, L.; Unge, T.; Classon, B.; Hallberg, A.; Samuelsson, B.
J. Med. Chem. 2001, 44, 3083-3091. (ao) Murphy, P.; O’Brien, J.; Gorey-Feret, L.; Smith
III, A. Bioorg. Med. Chem. Lett. 2002, 12,1763-1766. (ap) Smith III, A.; Hirschmann, R.;
Pasternak, A.; Yao, W.; Sprengeler, P.; Holloway, K.; Kuo, L.; Chen, Z.; Darke, P.;
Schleif, W. An Orally Bioavailable J. Med. Chem. 1997, 40, 2440-2444. (aq) Kaldor, S.;
Kalish, V.; Davies, J., Shetty, B.; Fritz, J.; Appelt, K.; Burgess, J.; Campanale, K.;
Chirgadze, N.; Clawson, D.; Dressman, B.; Hatch, S.; Tatlock, J.; Et, A. J. Med. Chem.
1997, 40, 3979-3985. (ar) Fujiwara, T.; Sato, A.; El-Farrash, M.; Miki, S.; Abe, K.; Isaka,
Y.; Kodama, M.; Wu, Y.; Chen, L.; Harada, H.; Sugimoto, H.; Hatanaka, M.; Hinuma, Y.
Antimicrob. Agents Chemother. 1998, 42, 1340-1345. (as) Lamarre, D.; Croteau, G.;
44
45
46
47
48
49
Wardrop, E.; Bourgon, L.; Thibeault, D.; Clouette, C.; Vaillancourt, M.; Cohen, E.;
Pargellis, C.; Yoakim, C.; Anderson, P. Antimicrob. Agents Chemother. 1997, 41, 965971. (at) Ettmayer, P.; Billich, A.; Hecht, P.; Rosenwirth, B.; Gstach, H. J. Med. Chem.
1996, 39, 3291-3299. (au) Kempf, D.; Marsh, K.; Denissen, J.; Mcdonald, E.;
Vasavanonda, S.; Flentge, C.; Green, B.; Fino, L.; Park, C.; Kong, X.; Wideburg, N.;
Saldivar, A.; Ruiz, L.; Kati, W.; Sham, H.; Robins, T.; Stewart, K.; Hsu, A.; Plattner, J.;
Leonard, J.; Norbeck, D. Proc. Natl. Acad. Sci. USA 1995, 92, 2484-2488. (av) Komai, T.;
Yagi, R.; Suzuki-Sunagawa, H.; Sakurai, M.; Higashida, S.; Sugano, M.; Handa, H.;
Mohri, H.; Yasuoka, A.; Oka, S.; Yabe, Y.; Nishigaki, T.; Kimura, S.; Shimada, K. Biol.
Pharm. Bull. 1997, 20, 175-180. (aw) Billich, A.; Scholz, D.; Charpiot, B.; Gstach, H.;
Lehr, P.; Peichl, P.; Rosenwirth, B. Antivir. Chem. Chemother. 1995, 6, 327-336. (ax) Ala,
P.; Deloskey, R.; Huston, E.; Jadhav, P.; Lam, P.; Eyermann, C.; Hodge, C.; Schadt, M.;
Lewandowski, F.; Weber, P.; Mccabe, D.; Duke, J.; Chang, C. J. Biol. Chem. 1998, 273,
12325-12331. (ay) Patel, M.; Rodgers, J.; Mchugh, Jr. R.; Johnson, B.; Cordova, B.;
Klabe, R.; Bacheler, L.; Erickson-Viitanen, S.; Ko, S. Bioorg. Med. Chem. Lett. 1999, 9,
3217-3220. (az) Hilgeroth, A.; Billich, A.; Lilie, H. Eur. J. Med. Chem. 2001, 36, 367374. (ba) Getman, D.; Decrescenzo, G.; Heintz, R.; Reed, K.; Talley, J.; Bryant, M.;
Clare, M.; Houseman, K.; Marr, J.; Mueller, R.; Vazquez, M.; Shieh, H.; Stallings, W.;
Stegeman, R. J. Med. Chem. 1993, 36, 288-291. (bb) Bryant, M.; Getman, D.; Smidt, M.;
Marr, J.; Clare, M.; Dillard, R.; Lansky, D.; Decrescenzo, G.; Heintz, R.; Houseman, K.;
Reed, K.; Stolzenbach, J.; Talley, J.; Vazquez, M.; Mueller, R. Antimicrob. Agents
Chemother. 1995, 39, 2229-2234. (bc) Gayathri, P.; Pande, V.; Sivakumar, R.; Gupta, S.
Bioorg. Med. Chem. 2001, 9, 3059-3063. (bd) Turner, S.; Strohbach, J.; Tommasi, R.;
Aristoff, P.; Johnson, P.; Skulnick, H.; Dolak, L.; Seest, E.; Tomich, P.; Bohanon, M.;
Horng, M.; Lynn, J.; Chong, K.; Hinshaw, R.; Watenpaugh, K.; Janakiraman, M.;
Thaisrivongs, S. J. Med. Chem. 1998, 41, 3467-3476. (be) Molla, A.; Mo, H.;
Vasavanonda, S.; Han, L.; Lin, C.; Hsu, A.; Kempf, D. Antimicrob. Agents Chemother.
2002, 46, 2249-2253. (bf) Ghosh, A.; Kincaid, J.; Cho, W.; Walters, D.; Krishnan, K.;
Hussain, K.; Koo, Y.; Cho, H.; Rudall, C.; Holland, L.; Buthod, J. Bioorg. Med. Chem.
Lett. 1998, 8, 687-690. (bg) Han, W.; Pelletier, J.; Hodge, N. Tricyclic Ureas: a New
Class of HIV-1 Protease Inhibitors. Bioorg. Med. Chem. Lett. 1998, 8, 3615-3620
Dati ricavati dai seguenti articoli e dai database disponibili sui seguenti siti web: (a)
Partaledis, J.; Yamaguchi, K.; Tisdale, M.; Blair, E.; Falcione, C.; Maschera, B.; Myers,
R.; Pazhanisamy, S.; Futer, O.; Cullinan, A. J. Virol. 1995, 69, 5228-5235. (b)
http://www.hivresistanceweb.com/; (c) http://srdata.nist.gov/hivdb/resistance2_losalamo
s_HIVPR_inhibitors.html; (d) Klabe, R.; Bacheler, L.; Ala, P.; Erickson-Viitanen, S.;
Meck, J. Biochemistry 1998, 37, 8735-8742. (e) http://hivdb.stanford.edu/cgibin/PIResiNote.cgi; (f) http://www.mediscover.net/antiviralintro.cfm; (g) Sham, H.;
Kempf, D.; Molla, A.; Marsh, K.;. Kumar, G.; Chen, C.; Kati, W.; Stewart, K.; Lal, R.;
Hsu, A.; Betebenner, D.; Korneyeva, M.; Vasavanonda, S.; McDonald, E.; Saldivar, A.;
Wideburg, N.; Chen, X.; Niu, P.; Park, C.; Jayanti, V.; Grabowski, B.; Granneman, G.;
Sun, E.; Japour, A.; Leonard, J.; Plattner, J.; Norbeck, D. Antimicrob. Agents Chemother.
1998, 42, 3218-3224. (h) Patick, A.; Mo, H.; Markowitz, M.; Appelt, K.; Wu, B.; Musick,
L.; Kalish, V.; Kaldor, S.; Reich, S.; Ho, D.; Webber, S. Antimicrob. Agents Chemother.
1996, 40, 292-297.
Hall, L.; Kier, L. The Molecular Connectivity Chi Indexes and Kappa Shape Indexes in
Structure-Property Modelling. In Reviews in computational chemistry. Lipkowitz and
Boyd 1992, Chapter 9
Balaban, A. Chem. Phys. Lett. 1982, 89, 399-404.
Hall, L.; Mohney, B.; Kier, L. J. Chem. Inf. Comput. Sci. 1991, 31, 76-82.
Kier, L.; Hall, L. Pharm. Res. 1990, 7, 801-807.
Swanstrom, R.; Erona, J. Pharmacol. Therap. 2000, 86, 145-170.
Appendice I – Inibitori della Trascrittasi
O
O
O
O
O
O
Cl
Cl
O
H
N
O
O
N
S
O
O
O
N
N
N
H
O
O
O
(2) 21-AAP-BHAP
(1) 12-OXOCALANOLIDE
O
(3) ADAM-II
OH
N
S
N
Cl
Cl
NH
O
S
O
N
H
(5) BENZOTHIADIAZINE-2(R)
(4) AN-29-PNU-32945
N
NH
O
S
N
H
O
O
(6) BENZOTHIADIAZINE-2(S)
(7) BM-510836
N
H
N
N
O
C
O
N
H
O
N
O
N
O
O
N
O
H
N
O
N
F
NH
N
S
OH
N
O
(8) CALANOLIDE-A
O
S
(9) COMPD-1
(10) COMPD-2
(11) COMPD-36
O
O
O
N
O
O
N
O
HN
O2 N
OH
O
(12) COSTATOLIDE
N
(13) DABO-12e
H
N
(14) DAMNI-6D
O
S
O
O
O
N
H
N
F
N
O
O
O
N
H
N
F3 C
F
NH
OH
N
H
(15) DELAVIRDINE
(16) DIHYDROCOSTATOLIDE
(17) DPC-082
O
Appendice I – Continua
O
O
H
N
HN
O
F3 C
F3 C
O
Cl
N
O
O
NH
O
N
H
N
H
O
O
(20) EFAVIRENZ
(19) E-EBU-dM
(18) DPC-961
N
Cl
(21) GCA-186
H
O
N
N
S
N
N
S
O
N
N
O
O
N
O
O
O
OH
O
(24) IPPH
(23) INOPHYLLUM-B
(22) HBY-097
Cl
O
N
O
H
N
Cl
O
N
H
O
O
NH2
NH2
Cl
Cl
S
O
Cl
N
H
N
H
N
H
O
(25) L-697661
NH2
Cl
Cl
O
O
(28) LOVIRIDE(S)
(27) LOVIRIDE(R)
(26) L-737126
O
O
Cl
H
O
S
N
O
NH
N
H
N
N
H
N
N
N
OH
N
O
O
(30) MSA-300
(29) MKC-442
(31) NEVIRAPINE
F
NO2
O
F
F
O
F
S
S
S
N
N
N
(32) NPPS
N
(33) NSC-625487(R)
(34) NSC-625487(S)
N
N
O
O
O
N
O
O
O
N
H
O
(35) PBD
O
(36) PBO-13B(R)
O
(37) PBO-13B(S)
Appendice I – Continua
O
O
N
N
S
O
N
S
Cl
H
H3 C
NH
H
O
O
N
Cl
N
N
Cl
CH3
N
N
O
N
H
O
N
NH2
NH2
(41) PNU-142721(S)
(40) PNU-142721(R)
(39) PHS
(38) PEQ
C
N
N
N
O
N
O
S
N
F
N
O
O
S
N
O
O
N
O
C
N
(42) PNU-32945
H
N
(45) QM-99639
(44) PPO-13I(S)
(43) PPO-13I(R)
S
O
Cl
F3 C
N
O
N
N
O
O
Cl
O
O
O
N
H
S
(47) SEFAVIRENZ
(46) S-2720
(49) TGG-II-23A(S)
(48) TGG-II-23A(R)
O
S
O
H
N
O
S
HN
N
N
O
N
S
S
N
O
O
N
C
N
Cl
(52) TTD-6G
(51) TNK-6123
(50) TIVIRAPINE
Cl
N
N
O
S
O
O
H
N
N
H
S
O
O
N
N
N
O
Cl
O
(53) UC-781
(54) UC-84
(55) UK-129485
Appendice II – Inibitori della Proteasi
OH
HO
O
N
O
F
F
H
N
H
O
O
O
F
O
NH
O
S
O
N
O
O
O
(2) 6H-1,3-DIOS-4D
(1) 33_DER_CYCLOURETHAN
H
S
OH
O
H
H
N
N
S
O
HO
OH
N
H
HO
O
NH
O
N
HN
(3) AG_1350
O
(4) AHPBA_38
O
O
OH
O
O
HO
O
N
HN
OH
S
N
H
O
O
N
Cl
O
H2N
HN
(6) AMPRENAVIR
(5) AHPBA_48
N
O
Ph
O
O
H
O
HO
OH
N
H
NH
HN
OH
H
N
O
O
Ph
O
S
NH
N
N
(8) BILA_2185_BS
(7) A_77212
OH
O
OH
N
O
O
Ph
N
H
NH
N
O
OH
OH
N
O
OH
Ph
HN
O
HO
(9) BMS_186318
Ph
(10) CAGEDIM_3C
Ph
Appendice II – Continua
HO
HO
N
N
N
N
O
O
S
N
Ph
Ph
Ph
OH
HO
N
O
O
Ph
(11) CYANGUAN_8I
HO
OH
(12) CYCLOSULFAMIDE_25
H
N
O
Ph
H
N
N
N
Ph
O
N
N
N
O
O
OH
HO
Ph
N
Ph
Ph
Ph
HO
(13) CYLOURA_1
Ph
OH
(14)CYCLOURA_10A
O
NH
H2N
H
NH
HO
Ph
O
H
O
Ph
OH
S
H
H
O
O
OH
HN
N
H
H
OH
Ph
O
H
(16) DHP_13Y
(15) CYCPRTR_11
F
NH2
H2 N
O
H
N
O
N
H
O
HO
N
N
NH
Ph
Ph
H2N
N
OH
HO
S
O
O
(17) DMP_450
(18) DPC_681
OH
Ph
OH
Ph
O
HO
OH
O
HN
O
H
N
H
N
N
H
O
O
O
HO
O
OH
OH
O
O
OH
OH
OH
(19) DUPLCTERM_4
(20) EGCg
Appendice II – Continua
O
O
S
O
Ph
N
O
HO
O
H
N
NH
N
H
N
O
HN
N
H
O
Ph
OH
O
O
O
H
(22) HEA_19
(21) ESC_14
H
Ph
N
OH
OH
OH
H
N
N
H
H
N
O
O
N
N
S
O
N
H
O
O
O
O
H
Ph
NH
(23) INDINAVIR
(24) ISOQUIN_URETHAN_ANALOG_2
OH
N
N
O
O
O
S
O
O
O
N
N
N
H
HN
O
N
H
HN
S
H
N
OH
S
S
O
OH
N
Ph
N
N
N
O
O
O
NH
HO
OH
O
(25) I_12
(26) KNI_272
O
O
O
O
OH
NH
O
Ph
O
O
OH
HN
Ph
O
NH
O
N
O
O
O
NH
HN
N
O
Ph
(27) LASINAVIR
(28) LC_3
O
HN
N
O
NH
S
Ph
O
O
O
Ph
Ph
HN
O
HO
O
O
HN
O
(29) LOPINAVIR
HN
NH
HO
(30) LY_289612_ANAL1
Appendice II – Continua
Ph
O
F
HN
S
O
S
O
O
O
HN
O
Ph
H
N
N
H
O
N
O
S
HO
H
OH
O
N
H
H
H
S
HN
O
S
O
(32) LY_326188
(31) LY_314163
F
F
O
O
OH
H
N
O
OH
O
OH
H
N
N
O
H
N
Ph
N
H
OH
HO
O
O
OH
O
O
F
F
(33) L_689502
(34) MANNAR_9F
O
O
HN
Ph
OH
H
N
H
N
O
HO
O
O
Ph
O
O
OH
OH
HO
(36) MW_583
(35) MANNOPYRANOSIDE_18
Ph
O
S
NH
Ph
O
H
N
O
O
H
N
HO
N
H
N
N
H
N
H
OH
N
O
OH
O
H
N
(38) PALINAVIR
(37) NELFINAVIR
O
O
S
N
O
HN
Ph
H
N
O
H
N
O
N
H
O
N
H
Ph
N
H
N
N
H
O
O
OH
O
Ph
Ph
O
HO
N
H
O
S
N
(39) PARACYCLOPHANE_DER_1
(40) RITONAVIR
Appendice II – Continua
NH2
O
O
H2 N
H
HN
OH
H
N
N
O
O
N
Ph
H
Ph
N
O
N
O
O
N
OH
H
N
HN
O
O
NH
N
H
(41) R_87366
N
(42) SAQUINAVIR
N
H
N
O
O
O
H2N
N
H
N
H
N
H
N
N
N
NH
O
Ph
Ph
HO
N
OH
N
Ph
Ph
(44) SE_063
NH
(43) SD_146
OH
HO
N
OH
O
O
HO
Ph
HO
N
O
O
N
N
N
H
HN
O
Ph
Ph
O
O
O
O
NH2
(46) TELINAVIR
O
(45) SYN_DIMERIC_DHP_17
N
HN
HN
NH2
N
HN
N
F
O
O
N
Ph
O
H
N
O
N
N
S
OH
Ph
N
Ph
O
N
Ph
Ph
OH
(49) TIPRANAVIR
OH
(47) THP_19
N
(48) THP_20
NH
Ph
O
O
HO
N
S
O
O
O
H
N
H
N
Ph
HN
O
H
O
O
Ph
HO
OH
O
(50) TMC_126
(51) UREATRICL_9
H
O
F
F
Appendice III – Attività ( M) degli inibitori di Integrasi inclusi nello studio
ID
Derivati
3'-Proc.
Str. Tr.
1
1,3-DCQA
0.68
1.08
2
1,4-DCQA
9.51
7.8
3
1-MO-3,5-DCQA
0.47
0.47
4
3,4-DCQA
0.25
0.46
5
3,5-DCQA
0.64
0.66
6
3-DCQA
87.8
45.8
7
4,5-DCQA
0.79
0.54
8
Bis-cinnamoyl-benzene 12a
0.8
Non Disponibile
9
Bis-cinnamoyl-benzene 12b
30
Non Disponibile
10
Arylamide 97
33
33
11
Arylamide 98
350
350
12
Arylamide 99
350
350
13
ATC Derivate 125
4
Non Disponibile
14
ATC Derivate 126
7
Non Disponibile
15
ATC Derivate 127
32.8
23
16
ATC Derivate 128
49.7
43.9
17
ATC Derivate 133
61.8
68.5
18
ATC Derivate 134
25.6
27.2
19
Aurintricarboxylic Acid (ATC)
10
Non Disponibile
20
Bis-cathecol 64
110
110
21
Bis-cathecol 65
100
100
22
Bis-cathecol 66
21.4
5.4
23
Bis-cathecol 67
0.5
Non Disponibile
24
Bis-cathecol 68
1.7
Non Disponibile
25
Bis-cathecol 69
7
Non Disponibile
26
Bis-cathecol 70
36
Non Disponibile
27
Bis-cathecol 71
0.5
Non Disponibile
28
Bis-cathecol 72
35
Non Disponibile
29
Bis-cathecol 73
35
Non Disponibile
30
Bisarylamide 105
0.98
0.81
31
Bisarylamide 106
200
200
32
Bisarylamide 107
0.23
0.11
33
Bisarylamide 108
200
200
34
Caffeic Acid
200
200
35
Caffeic Acid Derivate 89
9
4
36
Caffeic Acid Derivate 90
1.38
4.71
37
CAPE
7
19
38
CAPE-Amide 74
100
100
39
CAPE-Amide 75
33
33
40
CAPE-Amide 76
Non Disponibile
4
41
Chalcone 10a
1.3
Non Disponibile
42
Chalcone 10b
20
Non Disponibile
43
Chalcone 10c
100
Non Disponibile
44
Chalcone 10d
2.3
Non Disponibile
45
Chicoric Acid Amide 25
4.1
4.1
46
Chicoric Ester 6
9.8
6.2
47
Chicoric Ester 7
33.3
4.6
48
Chicoric Ester 13
38.4
7.8
49
Chicoric Ester 14
24.8
7.6
50
Chicoric Ester 15
0.4
0.4
51
Chicoric Ester 16
27.5
7.5
52
Chicoric Ester 17
27.5
6.5
53
Chicoric Ester 18
10.1
10.1
Bibliografia
1
2
3
4
1
5
1
1
1
5
1
2
4
6
54
Chicoric Ester 19
2.5
3.2
55
Chicoric Ester 20
2.8
3.8
56
Chicoric Ester 24
2.1
2.8
57
Chicoric Ester 27
4.2
1.7
58
Chicoric Ester 28
3.3
1.7
59
Chlorogenic Acid
142
142
60
Chloroparallelic Acid
2.2
1.6
61
Chloroquine
13.1
5.7
62
Cosalane
25
Non Disponibile
63
Cosalane Derivate 130
100
Non Disponibile
64
Cosalane Derivate 131
2.2
Non Disponibile
65
Cosalane Derivate 132
2.2
Non Disponibile
66
Coumarin 8
43.4
38.8
67
Coumarin 9
80.6
69.2
68
Coumarin10
46
20.5
69
Coumarin 11
34
11.1
70
Coumarin 12
3
1.2
71
Coumarin 13
141
75
72
Coumarin 14
198
76
73
Coumarin 15
100
50
74
Coumarin 16
58
12
75
Coumarin 17
66
54
76
Coumarin 18
100
148
77
Coumarin 19
75
133
78
Coumarin 20
29
23
79
Coumarin 21
19
16
80
Coumarin 22
14
13
81
Coumarin 23
10
9.5
82
Coumarin 24
5.5
3.7
83
Coumarin 25
8.5
14
84
Coumarin 26
8
Non Disponibile
85
Coumarin 36
121
122
86
Coumarin 37
35.7
22.5
87
Coumarin 117
1.5
0.8
88
Coumarin 118
0.4
0.3
89
Coumarin 119
7.5
2.7
90
Coumarin 120
10.5
12
91
Coumarin 121
4.2
3.5
92
Coumarin 122
7
1.8
93
Cumarin 123
50
24
94
Curcumin
95
40
95
Curcumin Derivate 11a
100
Non Disponibile
96
Curcumin Derivate 11b
0.7
Non Disponibile
97
Curcumin Derivate 11c
100
Non Disponibile
98
Curcumin Derivate 11d
100
Non Disponibile
99
Curcumin Derivate 79
6
3.1
100
101
Cyclovalone 7a
Cyclovalone 7b
100
0.9
Non Disponibile
102
Cyclovalone 7c
1
Non Disponibile
103
Cyclovalone 7d
0.2
Non Disponibile
104
Cyclovalone 7e
0.2
Non Disponibile
105
Cyclovalone 7f
0.2
Non Disponibile
106
Derivate 139
6.1
6.1
107
Derivate 140
8.3
4
108
Derivate 141
11.6
4.9
109
Derivate 142
1.1
0.9
2
1
7
1
7
4
8
Non Disponibile
4
1
110
Diarylsulfone 151
51.8
111
Diarylsulfone 152
60
59
76
112
Diarylsulfone 153
6.5
6.1
113
Diarylsulfone 154
4.5
4.9
114
Diarylsulfone 155
25.9
21.9
115
Diarylsulfone 156
0.6
1.3
116
Diarylsulfone 157
20.9
18.6
117
Diarylsulfone 158
29.8
29.5
118
Diarylsulfone 159
55
83
119
Diarylsulfone 160
67.5
65.6
120
Diarylsulfone 161
2.9
2.5
121
Diarylsulfone 162
70
64.2
122
Dihydronaphtoic Acid
172
172
123
Dihydronaphtoic Derivate 17
5.4
4.7
124
Dihydronaphtoic Derivate 19
53.3
62.4
125
Dihydronaphtoic Derivate 20
200
200
126
Dihydronaphtoic Derivate 21
200
200
127
Dihydronaphtoic Derivate 23
58.4
52.7
128
Doxorubicin
0.9
2.4
129
Hydrazide 5
46
33
130
Hydrazide 18
100
100
131
Hydrazide 24
70
57.5
132
Hydrazide 25
100
100
133
Hydrazide 26
100
100
134
Hydrazide 109
2.07
0.73
135
Hydrazide 110
9.1
5.8
136
Hydrazide 111
2.3
1.1
137
Hydrazide 112
200
200
138
Hydrazide 113
100
100
139
Hydrazide 114
100
100
140
Hydrazide 115
6.7
5.2
141
Hydrazide 116
100
100
142
Hydroxylated Aromatic Derivate 77
0.8
0.1
143
Hydroxylnaphtylquinone
5.7
2.5
144
Indane 8a
3
Non Disponibile
145
Indane 8b
86
Non Disponibile
146
L-Chicoric Acid
0.15
0.15
147
Mitoxantrone
3.8
8
148
NSC48240
0.026
0.021
149
NSC49858
0.294
0.188
150
NSC229488
0.229
0.202
151
NSC246119
0.371
0.283
152
NSC310217
0.002
0.002
153
NSC371056
0.030
0.017
154
NSC626436
0.177
0.103
155
NSC632901
0.182
0.101
156
NSC641547
0.224
0.135
157
NSC642710
0.005
0.005
158
159
160
Primaquine
Quercetin
Quinic Acid
15.3
19.4
3.6
11
Non Disponibile
Non Disponibile
161
Rosmarinic Acid
9
4
162
Salicylhydrazide 1
2.07
0.73
163
Sclicylhydrazide 18
288
167
164
Salicylhydrazide 19
192
155
165
Salicylhydrazide 29
0.6
2.8
5
1
9
1
4
1
10
1
8
11
166
Salicylhydrazide 30
0.9
0.6
167
Salicylhydrazide 31
0.8
0.6
168
Salicylhydrazide 32
1.4
2.6
169
Salicylhydrazide 33
0.6
0.9
170
Salicylhydrazide 34
0.9
7.4
171
Salicylhydrazide 35
0.8
0.6
172
Salicylhydrazide 36
0.5
0.5
173
Salicylhydrazide 37
2
2
174
Salicylhydrazide 38
2.7
2
175
Salicylhydrazide 39
293
293
176
Salicylhydrazide 40
293
293
177
Stictic Acid
4.4
2.9
178
Stirylquinoline 12
100
100
179
Stirylquinoline 13
2.2
3.4
180
Stirylquinoline 14
3.7
2.8
181
Stirylquinoline 15
3.7
2.8
182
Stirylquinoline 16
3
Non Disponibile
183
Stirylquinoline 17
2.4
1
184
Stirylquinoline 18
0.8
Non Disponibile
185
Stirylquinoline 19
0.3
0.4
186
Stirylquinoline 20
0.26
Non Disponibile
187
Stirylquinoline 21
2.7
0.6
188
Sulfonic Acid 144
0.47
0.29
189
Sulfonic Acid 145
3.4
2.7
190
Sulfonic Acid 146
27.9
14.3
191
Sulfonylamide 147
28.6
14
192
Sulfonylamide 148
24
19
193
Sulfonylamide 149
49
23.6
194
Sulfonylamide 150
48.3
13.7
195
Suramin
0.25
0.09
196
Tetrahydroxycurcumin
300
300
197
Tyrphostin 80
1.9
0.8
198
Tyrphostin 81
0.4
0.2
199
Tyrphostin 82
0.8
0.4
200
Tyrphostin 83
3.3
1.9
201
Tyrphostin 84
0.7
0.6
202
Tyrphostin 85
0.5
0.2
203
Tyrphostin 86
1.4
1.1
204
Virensic Acid
4.6
6.5
205
Virensic Acid Derivate 138
42.2
28.1
206
3-Aryl-1,3-Diketo Derivate 4a
100
2
207
3-Aryl-1,3-Diketo Derivate 7a
7.8
1.83
208
3-Aryl-1,3-Diketo Derivate 7b
7.2
1.28
209
3-Aryl-1,3-Diketo Derivate 7c
82
6.5
210
3-Aryl-1,3-Diketo Derivate 10b
65
0.52
211
3-Aryl-1,3-Diketo Derivate 10e
Non Disponibile
0.48
212
3-Aryl-1,3-Diketo Derivate 13b
35
0.65
213
3-Aryl-1,3-Diketo Derivate 13h
40
40
214
3-Aryl-1,3-Diketo Azo-derivate 2
100
0.48
215
3-Aryl-1,3-Diketo Azo-derivate 4
100
2
216
3-Aryl-1,3-Diketo Azo-derivate 8
100
0.26
217
3-Aryl-1,3-Diketo Azo-derivate 9
70
0.32
218
3-Aryl-1,3-Diketo Azo-derivate 10
100
0.36
219
3-Aryl-1,3-Diketo Azo-derivate 11
100
1.53
220
3-Aryl-1,3-Diketo Azo-derivate 12
100
6.1
1
12
1
8
1
13
14
221
3-Aryl-1,3-Diketo Azo-derivate 13
100
8.5
222
3-Aryl-1,3-Diketo Azo-derivate 14
100
24
223
3-Aryl-1,3-Diketo Azo-derivate 15
100
25
224
3-Aryl-1,3-Diketo Azo-derivate 16
100
1.5
225
3-Aryl-1,3-Diketo Azo-derivate 17
85
3.5
226
4-Aryl-2,4-Dioxobutanoic Derivate 1
Non Disponibile
0.17
227
4-Aryl-2,4-Dioxobutanoic Derivate 2
Non Disponibile
5.67
228
4-Aryl-2,4-Dioxobutanoic Derivate 3
Non Disponibile
0.22
229
4-Aryl-2,4-Dioxobutanoic Derivate 4
Non Disponibile
0.18
230
4-Aryl-2,4-Dioxobutanoic Derivate 5
Non Disponibile
0.1
231
4-Aryl-2,4-Dioxobutanoic Derivate 6
Non Disponibile
0.16
232
4-Aryl-2,4-Dioxobutanoic Derivate 7
Non Disponibile
0.5
233
4-Aryl-2,4-Dioxobutanoic Derivate 8
Non Disponibile
0.5
234
4-Aryl-2,4-Dioxobutanoic Derivate 9
Non Disponibile
0.1
235
4-Aryl-2,4-Dioxobutanoic Derivate 10
Non Disponibile
0.1
236
4-Aryl-2,4-Dioxobutanoic Derivate 11
Non Disponibile
1
237
4-Aryl-2,4-Dioxobutanoic Derivate 12
Non Disponibile
0.1
238
4-Aryl-2,4-Dioxobutanoic Derivate 13
Non Disponibile
0.25
239
4-Aryl-2,4-Dioxobutanoic Derivate 14
Non Disponibile
0.1
240
4-Aryl-2,4-Dioxobutanoic Derivate 15
Non Disponibile
0.15
241
4-Aryl-2,4-Dioxobutanoic Derivate 16
Non Disponibile
0.14
242
4-Aryl-2,4-Dioxobutanoic Derivate 17
Non Disponibile
0.1
243
4-Aryl-2,4-Dioxobutanoic Derivate 18
Non Disponibile
0.1
244
4-Aryl-2,4-Dioxobutanoic Derivate 19
Non Disponibile
0.1
245
5-CITEP
168.1
690
246
6-Aryl-Dioxoesenoic Derivate 8a
7.9
7
247
6-Aryl-Dioxoesenoic Derivate 8b
50
65
248
6-Aryl-Dioxoesenoic Derivate 8c
61
72
249
6-Aryl-Dioxoesenoic Derivate 8d
56
67
250
6-Aryl-Dioxoesenoic Derivate 8e
22
41
251
6-Aryl-Dioxoesenoic Derivate 8f
76
92
252
6-Aryl-Dioxoesenoic Derivate 11a
8.9
7.5
253
6-Aryl-Dioxoesenoic Derivate 11b
85
90
254
6-Aryl-Dioxoesenoic Derivate 11c
87
95
255
6-Aryl-Dioxoesenoic Derivate 11d
73
88
256
6-Aryl-Dioxoesenoic Derivate 11e
38
50
257
6-Aryl-Dioxoesenoic Derivate 11f
57
45
258
Bis-2,6-benzylidene 14i
0.5
0.9
259
Bis-2,6-benzylidene 14l
0.5
1.1
260
Bis-2,6-benzylidene 14o
1.7
2.2
261
Bis-2,6-benzylidene 15a
0.3
0.5
262
Bis-2,6-benzylidene 15b
0.4
0.6
263
Bis-2,6-benzylidene 15c
0.5
0.4
264
Bis-2,6-benzylidene 15d
0.7
1.1
265
Bis-2,6-benzylidene 15e
1.4
2.3
266
Bis-2,6-benzylidene 15f
6
9
267
Bis-2,6-benzylidene 15g
0.7
0.5
268
Bis-2,6-benzylidene 16
1.6
0.9
269
Bis-2,6-benzylidene 17a
0.3
0.7
270
Bis-2,6-benzylidene 17b
0.2
0.5
271
Bis-2,6-benzylidene 18a
3
4
272
Bis-2,6-benzylidene 18b
1
1.6
273
Bis-2,6-benzylidene 19a
0.2
0.4
274
Bis-2,6-benzylidene 19b
1.3
1
275
Bis-2,6-benzylidene 19c
0.2
0.3
276
Bis-2,6-benzylidene 19d
0.2
0.3
277
Bis-2,6-benzylidene 20a
2.8
4.3
15
16
17
18
278
Bis-2,6-benzylidene 20b
0.7
1.2
279
Bis-2,6-benzylidene 20c
2.6
1.9
280
Bis-2,6-benzylidene 20d
0.2
0.2
281
Bis-cathecol 1
1.3
Non Disponibile
282
Bis-cathecol 2
2.1
Non Disponibile
283
Bis-cathecol 3
23
Non Disponibile
284
Bis-cathecol 4
13
Non Disponibile
285
Bis-cathecol 5
76
Non Disponibile
286
Bis-cathecol 6
500
Non Disponibile
287
Bis-cathecol 7
84
Non Disponibile
288
Bis-cathecol 8
157
Non Disponibile
289
Bis-cathecol 9
500
Non Disponibile
290
Bis-cathecol 10
500
Non Disponibile
291
Bis-cathecol 11
138
Non Disponibile
292
Bis-cathecol 12
500
Non Disponibile
293
Bis-cathecol 13
22
Non Disponibile
294
Bis-cathecol 14
21
Non Disponibile
295
Caffeoylpyrrolidine Derivate 1
39.2
Non Disponibile
296
Caffeoylpyrrolidine Derivate 2
25.2
Non Disponibile
297
Caffeoylpyrrolidine Derivate 3
27.9
Non Disponibile
298
Caffeoylpyrrolidine Derivate 4
33.8
Non Disponibile
299
Caffeoyltetrahydrofuran Derivate 1
32.3
Non Disponibile
300
Caffeoyltetrahydrofuran Derivate 2
47.4
Non Disponibile
301
Caffeoyltetrahydrofuran Derivate 3
22.4
Non Disponibile
302
Caffeoylnaphtalene Sulfonamide 3
11.9
Non Disponibile
303
Caffeoylnaphtalene Sulfonamide 4
24.6
Non Disponibile
304
Caffeoylnaphtalene Sulfonamide 5
12.2
Non Disponibile
305
Caffeoylnaphtalene Sulfonamide 6
8.6
Non Disponibile
306
Caffeoylnaphtalene Sulfonamide 7
4.5
Non Disponibile
307
Caffeoylnaphtalene Sulfonamide 8
7.9
Non Disponibile
308
Caffeoylnaphtalene Sulfonamide 9
20.4
Non Disponibile
309
Caffeoylnaphtalene Sulfonamide 10
19.5
Non Disponibile
310
Caffeoylnaphtalene Sulfonamide 11
19.3
Non Disponibile
311
Caffeoylnaphtalene Sulfonamide 12
20.4
Non Disponibile
312
Caffeoylnaphtalene Sulfonamide 13
19.8
Non Disponibile
313
Calcomine Derivate 2
5.8
7.3
314
Calcomine Derivate 3
2.7
3.2
315
Calcomine Derivate 4
0.4
0.7
316
Calcomine Derivate 5
0.5
0.7
317
Calcomine Derivate 6
0.2
0.33
318
Calcomine Derivate 7
1
1
319
Calcomine Derivate 8
0.5
0.5
320
Calcomine Derivate 9
0.5
1
321
Calcomine Derivate 10
0.3
0.7
322
Calcomine Derivate 11
2
4
323
Calcomine Derivate 12
2.7
1.3
324
Calcomine Derivate 13
4
0.6
325
Calcomine Derivate 14
3
1
326
Calcomine Derivate 15
5
2.3
327
Calcomine Derivate 19
1
2.5
328
Calcomine Derivate 20
0.8
1
329
Calcomine Orange
0.35
0.35
330
Carbonyl J
4
4
331
Cathecol Maleic Anhydride 7
3.8
Non Disponibile
332
Cathecol Maleic Imide 6
15.5
Non Disponibile
333
Cathecol Pyrrolidine 4
5.3
Non Disponibile
334
Cathecol Succinic Derivate 3
23.6
Non Disponibile
19
20
21
22
23
335
Cathecol Succinic Derivate 4
19.1
Non Disponibile
336
Compound 4a
0.33
Non Disponibile
337
Compound 4b
0.37
Non Disponibile
338
Compound 4c
2.23
Non Disponibile
339
Compound 4d
0.83
Non Disponibile
340
Compound 9
1.97
Non Disponibile
341
Compound 14
0.97
Non Disponibile
342
Compound 19
10
Non Disponibile
343
Compound 22a
0.83
Non Disponibile
344
Compound 23a
0.23
Non Disponibile
345
Compound 27a
10
Non Disponibile
346
Compound 27b
10
Non Disponibile
347
Compound 27c
10
Non Disponibile
348
Compound 29
10
Non Disponibile
349
Compound V98
206
Non Disponibile
350
Compound V99
74
Non Disponibile
351
Compound V100
22.4
782
352
Compound V101
250
250
353
Compound V102
208
Non Disponibile
354
Compound V103
143.7
Non Disponibile
355
Compound V104
0.9
201.3
356
Compound V165
0.9
16.1
357
Compound V545
20.5
3.5
358
Galloylpyrrolidine 1
12.4
Non Disponibile
359
Galloylpyrrolidine 2
15.6
Non Disponibile
360
Galloyltetrahydrofuran 1
7.4
Non Disponibile
361
Galloyltetrahyrofuran 2
4.7
Non Disponibile
362
Integracide 1
5
9
363
Integracide 3
5
15
364
Integracide 4
10
14
365
Integracide 5
2
5.6
366
Integracide 24
5
12
367
Integracide 25
Non Disponibile
12
368
L-708,906
20.5
3.5
369
Lithospermic Acid
Non Disponibile
1.4
370
Luteolin
Non Disponibile
11
371
NSC9169
200
200
372
NSC44181
23
13
373
NSC97318
13
14
374
NSC103668
88
105
375
NSC114690
60
69
376
NSC127625
200
200
377
NSC128439
32
39
378
NSC134135
16
42
379
NSC134142
39
50
380
NSC134144
21
44
381
NSC134173
60
59
382
NSC134191
55
65
383
NSC134215
23
21
384
NSC138557
30
30
385
NSC156987
200
200
386
NSC224283
200
200
387
NSC348893
149
140
388
NSC382139
200
200
389
NSC621109
32
28
390
NSC624906
200
200
24
25
20
26
16
27
28
391
NSC642629
200
200
392
NSC686564
200
200
393
P3 Compound
60
533
394
P4 Compound
392
784
395
P12 Compound
21.7
365
396
P13 Compound
6.5
15.1
397
Quinoline 1
2.4
Non Disponibile
398
Quinoline 11
0.9
Non Disponibile
399
Quinoline 12
6.5
Non Disponibile
400
Quinoline 14
5
Non Disponibile
401
Quinoline 15
5
Non Disponibile
402
Quinoline 16
5
Non Disponibile
403
Quinoline 18
1.5
Non Disponibile
404
Quinoline 19
6.5
Non Disponibile
405
Quinoline 26
2.3
Non Disponibile
406
Quinoline 27
0.7
Non Disponibile
407
408
409
410
411
412
413
414
415
416
417
418
419
420
421
422
423
424
Spirobiindane 1
Spirobiindane 2
Spirobiindane 3
Spirobiindane 4
Spirobiindane 5
Spirobiindane 6
Spirobiindane 7
Spirobiindane 8
Spirobiindane 9
Spirobiindane 10
Spirobiindane 11
Spirobiindane 12
Spirobiindane 13
Spirobiindane 14
Spirobiindane 15
Spirobiindane 16
Spirobiindane 17
Spirobiindane 18
17
243
200
200
200
200
35
275
11
6.28
3.14
47
44
200
420
2.8
32
1.4
5
243
200
200
200
200
6
231
10
3.12
1.78
53
25
200
350
2
12
0.35
425
Spirobiindane 19
200
200
426
Styrylquinoline Derivate 9
100
100
427
Styrylquinoline Derivate 10
5.3
2.1
428
Styrylquinoline Derivate 11
1.9
5.1
429
Styrylquinoline Derivate 12
3.4
3
430
Styrylquinoline Derivate 13
4.1
11
431
Styrylquinoline Derivate 14
1.2
1.7
432
Styrylquinoline Derivate 15
3.5
2.2
433
Styrylquinoline Derivate 16
1.4
1.2
434
Styrylquinoline Derivate 17
1.6
1.6
435
Styrylquinoline Derivate 18
3.2
3.2
436
Styrylquinoline Derivate 19
3.7
2.8
437
Styrylquinoline Derivate 20
2.4
1
438
Styrylquinoline Derivate 21
2.8
3.7
439
Styrylquinoline Derivate 22
0.9
3.3
440
Styrylquinoline Derivate 23
0.3
0.4
441
Styrylquinoline Derivate 24
0.7
1.7
442
Styrylquinoline Derivate 25
4.9
4.5
443
Styrylquinoline Derivate 26
1.3
1.2
444
Styrylquinoline Derivate 27
4
4.9
445
Styrylquinoline Derivate 28
100
100
446
Styrylquinoline Derivate 29
100
100
447
Styrylquinoline Derivate 30
2.3
1.5
448
Thalassiolin A
Non Disponibile
0.4
16
29
30
31
32
449
Thalassiolin B
Non Disponibile
43
450
Thalassiolin C
Non Disponibile
28
Bibliografia all’Appendice III
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
19
20
21
22
23
24
25
26
27
28
29
30
31
32
Neamati, N.; Sunder, S.; Pommier, Y. Drug Discov. Today, 1997, 2, 487.
McDougall, B.; King, P.J.; Wu, B. W.; Hostomsky, Z.; Reinecke, M. G.; Robinson, W. E. Antimicrob.
Agents Ch., 1998, 42, 140.
King, P. J.; Ma, G.; Miao, W.; Jia, Q.; McDougall, B. R.; Reinecke, M.; Cornell, C.; Kuan, J.; Kim, T.;
Robinson, E. J. Med. Chem., 1999, 42, 497
Artico, M.; Di Santo, R.; Costi, R.; Novellino, E.; Greco, G.; Massa, S.; Tramontano, E.; Marongiu, M.E.;
De Montis, A.; La Colla, P. J. Med. Chem., 1998, 41, 3948
Zhao, H.; Neamati, N.; Mazumder, A.; Sunder, S.; Pommier, Y.; Burke, T. R. J. Med. Chem., 1997, 40,
1186.
Lin, Z.; Neamati, N.; Zhao, H.; Kiryu, Y.; Turpin, J. A.; Aberham, C.; Strebel, K.; Kohn, K.; Witvrouw, M.;
Pannecouque, C.; Debyser, Z.; De Clercq, E.; Rice, W. G.; Pommier, Y.; Burke, T. R. J. Med. Chem., 1999,
42, 1401.
Zhao, H.; Neamati, N.; Hong, H.; Mazumder, A; Wang, S.; Sunder, S.; Milne, G. W. A.; Pommier, Y.;
Burke, T. R. J. Med. Chem., 1997, 40, 242.
Mazumder, A.; Neamati, N.; Sunder, S.; Schulz, J.; Pertz, H.; Eich, E.; Pommier Y. J. Med. Chem., 1997,
40, 3057.
Zhao, H.; Neamati, N.; Sunder, S.; Hong, H.; Wang, S.; Milne,G. W. A.; Pommier, Y.; Burke, T.R. J. Med.
Chem., 1997, 40, 937.
Hong, H.; Neamati, N.; Wang, S.; Nicklaus, M.; Mazumder, A.; Zhao, H.; Burke Jr., T.; Pommier, Y.; Milne
G. J. Med. Chem., 1997, 40, 930.
Neamati, N.; Hong, H.; Owen, J. M.; Sunder, S.; Winslow, H. E.; Christensen, J. L.; Zhao, H.; Burke, T.;
Milne, G. W. A.; Pommier, Y. J. Med. Chem., 1998, 41, 3202.
Mekouar, K.; Mouscardet, J. -F. J. Med. Chem., 1998, 41, 2846.
Pais, G. C. G.; Zhang, X.; Marchand, C.; Neamati, N.; Cowansage, K.; Svarovskaia, E.S.; Pathak, V.K.;
Tang, Y.; Micklaus, M.; Pommier, Y.; Burke, T.R. J. Med. Chem., 2002, 45, 3184.
Zhang, X.; Pais, G. C. G.; Svarovskaia, E. S.; Marchand, C.; Johnson, A. A.; Karki, R. G.; Nicklaus, M. C.;
Pathak, V. K.; Pommier, Y.; Burke, T. R. Bioorg. Med. Chem. Lett., 2003, 13, 1215.
Wai, J.; Egbertson, M.; Payne, L.; Fisher, T.; Embrey, M.; Tran, L.; Melamed, J.; Langford, H.; Guare Jr.,
J.; Zhuang, L.; Grey, V.; Vacca, J.; Holloway, M.; Naylor-Olsen, A.; Hazuda, D.; Felock, P.; Wolfe, A.;
Stillmock, K.; Schleif, W.; Gabryelski, L.; Young, S. J. Med. Chem., 2000, 43, 4923.
Pluymers, W.; Pais, G.; Van Maele, B.; Pannecouque, C.; Fikkert, V.; Burke, T. R.; De Clerq, E.; Witvrouw,
M.; Neamati, N.; Debyser, Z. Antimicrob. Agents Ch., 2002, 46, 3292.
Costi, R.; Di Santo, R.; Artico, M.; Roux, A.; Ragno, R.; Massa, S.; Tramontano, E.; La Colla, M.; Loddo,
R.; Marongiu, E.; Pani, A.; La Colla, P. Bioorg. Med. Chem. Lett., 2004, 14, 1745.
Costi, R.; Di Santo, R.; Artico, M.; Massa, S.; Ragno, R.; Loddo, R.; La Colla, M.; Tramontano, E., La
Colla, P.; Pani, A. Bioorg. Med. Chem., 2004, 12, 199.
Dupont, R.; Jeansdon, L.; Mouscardet, J. -F.; Cotelle, P. Bioorg. Med. Chem. Lett., 2001, 11, 3175.
Hwang, D. J.; Kim, S. N.; Choi, J. H.; Lee, Y. S. Bioorg. Med. Chem., 2001, 9, 1429
Xu, Y. W.; Zhao, G. S.; Shin, C. G.; Zang, H. C.; Lee,C. K.; Lee, Y. S. Bioorg. Med. Chem., 2003, 11,
3589.
Maurer, K.; Tang, A. H.; Kenyon, G. L; Leavitt, A. D. Bioorg. Chemistry, 2000, 28, 140.
Lee, J. Y.; Yoon, K. J.; Lee, Y. S. Bioorg. Med. Chem. Lett., 2003, 13, 4331.
Reinke, R. A.; King, P. J.; Victoria, J. G., McDougall, B. R.; Ma, G.; Mao, Y.; Reinecke, M. G.; Robinson,
E. J. Med. Chem., 2002, 45, 3669.
Pannecouque, C.; Pluymers, W.; Van Maele, B.; Tetz, V.; Cherepanov, P.; De Clerq, E.; Witvrouw, M.;
Debyser, Z. Curr. Biol., 2002, 12, 1169.
Singh, S. B.; Ondeyka, J. G.; Schleif, W. A.; Felock, P.; Hazuda, D. J. Nat. Prod., 66, 1338.
Tewtrakul, S.;Miyashiro, H.; Nakamura, N.; Hattori, M.; Kawahata, T.; Otake, T.; Yoshinaga, T.; Fujiwara,
T.; Supavita, T.; Yuenyongsawad, S.; Rattanasuwon, P.; Dej-Adisai, S. Phytother. Res., 2003, 27, 232.
Chen, I.; Neamati, N.; Nicklaus, M.; Orr, A.; Anderson, L.; Barchi Jr., J.; Kelley, J.; Pommier, Y.;
MacKerell Jr A. Bioorg. Med. Chem., 2000, 8, 2385.
Benard, C.; Zouhirim, F.; Normand.Bayle, M.; Danet, M.; Desmaele, D.; Leh, H.; Mouscardet, J. -F.;
Mbemba, G.; Thomas, C. -M.; Bonnenfant, S.; Le Bret, M.; D’Angelo, J. Bioorg. Med. Chem. Lett., 2004,
14, 2473.
Molteni, V.; Rhodes, D.; Rubins, K.; Hansen, M.; Bushman, F. D.; Siegel, J.S. J. Med. Chem., 2000, 43,
2031.
Zouhiri, F.; Mouscardet, J. -F. J. Med. Chem., 2000, 43, 1533.
Rowley, D. C.; Hansen, M. S. T.; Rhodes, D.; Sotrier, C. A.; Ni, H.; McCammon, A.; Bushman, F.D.;
Fenical. W. Bioorg. Med. Chem., 2002, 10, 3619.
Appendice IV – Cluster Analysis
Algoritmo di clustering utilizzato: Ward’s Reciprocal Nearest Neighbors
Distanza utilizzata: Distanza Euclidea
Standardizzazione dei dati: Media/Deviazione standard
3’-Processing
3’-Processing:
Distanza Massima di Amalgamazione: 60,946
Treshold per la selezione dei set:
Strand Transfer
30 strutture: 0.124
35 strutture: 0.118
40 strutture: 0.108
50 strutture: 0.08
Strand Transfer
Distanza Massima di Amalgamazione: 55,659
Treshold per la selezione dei set:
30 strutture: 0.126
35 strutture: 0.109
40 strutture: 0.10
50 strutture: 0.09
Algoritmo di clustering utilizzato: Single Linkage
Distanza utilizzata: Distanza Euclidea
Standardizzazione dei dati: Media/Deviazione standard
3’-Processing
3’-Processing:
Distanza Massima di Amalgamazione: 9,6692
Treshold per la selezione dei set:
30 strutture: 0,397
35 strutture: 0,417
Strand Transfer
40 strutture: 0.44
50 strutture: 0,37
Strand Transfer
Distanza Massima di Amalgamazione: 8,3261
Treshold per la selezione dei set:
30 strutture: 0,445
35 strutture: 0,47
40 strutture: 0,486
50 strutture: 0,414
Algoritmo di clustering utilizzato: Complete Linkage
Distanza utilizzata: Distanza Euclidea
Standardizzazione dei dati: Media/Deviazione standard
3’-Processing
3’-Processing:
Distanza Massima di Amalgamazione: 9,6692
Treshold per la selezione dei set:
30 strutture: 0,397
35 strutture: 0,417
40 strutture: 0.44
50 strutture: 0,37
Strand Transfer
Distanza Massima di Amalgamazione: 30,246
Treshold per la selezione dei set:
30 strutture: 0,244
35 strutture: 0,228
40 strutture: 0,21
50 strutture: 0,189
Strand Transfer
Algoritmo di clustering utilizzato: Group Average (Weighted Mean)
Distanza utilizzata: Distanza Euclidea
Standardizzazione dei dati: Media/Deviazione standard
3’-Processing
3’-Processing:
Distanza Massima di Amalgamazione: 12,803
Treshold per la selezione dei set:
30 strutture: 0.456
35 strutture: 0,442
40 strutture: 0,420
50 strutture: 0,382
Strand Transfer
Distanza Massima di Amalgamazione: 16,943
Treshold per la selezione dei set:
30 strutture: 0,338
35 strutture: 0,316
40 strutture: 0,296
50 strutture: 0,276
Strand Transfer
Appendice V – Derivati inclusi nell’analisi QSAR
3’-Processing
HO
HO
O2N
NO2
O
OH
HO
OH
O
OH
NO2
NO2
16
OH
HOOC
O
O
O
OH
H3CO
OCH3
O
N
H
1
N
H
H3CO
O HO2C
CO2H
OCH3
O
31
AcO
OAc
O
O
OH
AcO
OAc
Cl
COOH
46
HOOC
HO
Cl
62
63
O
O
O
O
HO
O
OH
OH
2
OH
O
OH
C5H13
C5H13
O
66
HO
OH
O O
O
90
HO
O
OH
O
2
87
HO
O
HO
OH
OH
HO
OH
97
99
O
O
O
O
O
O
OH
S
O
O
HO
NH2
OH
OH
O
O
116
124
130
APPENDICE V - Continua
OH
O
O
O
O
N
H
OH
NH2
O
HO
SH
OH
149
143
131
OH
OH
O
O
O
S
O
S
N
H
N
S
S
Cl
NH
N
HN
N
O
O
O
192
O
H
N
S
O
NO2
N
NH
N
N
164
N
HO
NH2
O
COOH
O
N3
194
O
OH
O
O
OH
O
N3
O
N3
O
218
COOH
220
HO
OH
207
HO
O
N
O
O
HO
O
O
HO
HO
CF3
255
HO
O
OH
HO
O
O
OH
HO
O
284
OH
O
276
OH
HO
O
N
H
O
O
AcO
SO2NHCH2CH2
N
H
296
AcO
302
APPENDICE V - Continua
Cl
OH
OH
OH
OH
O
OH
HO
-O3S
N
H
OH
SO3-
N
H
N
HO
N
O
O
330
HS
N
O
O
OH
N
O
331
O
O
355
OH
HO
O
O
O
O
OH
OH
NH2
OH
HO
O
OH
OH
HO
N
361
OH
O
OH
372
O
NO2
NH
H
N
HO
N
OH
N
H
O
NH2
O
O
384
391
OH
OH
HOOC
N
H
N
OH
HOOC
N
OH
OH
OH
O
OH
397
403
OH
H2N
OH
NH2
O2N
HO
NO2
HO
408
411
OH
HO3S
SO3H
HO
412
SH
APPENDICE V - Continua
Strand Transfer
O HO2C
CO2H
HO
O
AcO
OAc
O
O
HO
AcO
OAc
O
OH
47
O
OH
O
O
OH
HOOC
O
OH
OH
O
1
O
O
O
OH
O
O
O
O
O
O
OH
OH
OH
O
O
O
67
OH
OCH3
HO
O
OH
OH
72
O
OH
OH
C5H13
C5H13
70
HO
O
O
O
O
O
S
O2N
S
NO2
90
O
O
OH
O O
O
HO
OH
O
O
O
O
O
OMe
116
118
HO
O
O
OH
N
H
NH2
SH
NH2
OH
O
O
OH
OH
N
H
131
N
H
130
162
HO
O
O
O
N
NH
N
OH
CH3
HO3S
167
NO2
SO3H
188
127
APPENDICE V - Continua
O
S
O
S
S
H
N
O
N
N
S
NH
NH
N
O
HN
N
N
O
O
N
191
NH2
194
O
O
HO
OH
N
H
O
O
N
H
OH
CN
CN
N3
HO
OH
O
OH
OH
198
N3
O
O
N3
O
O
OH
215
OH
N3
O
O
N3
O
220
218
O
OH
NC
O
O
N
OH
O
O
224
O
N
O
246
O
OH
O
HO
252
HO
OH
OH
O
O
HO
-O3S
N
H
SO3-
N
H
O
330
OH
HO
OH
276
O
O
OH
O
OH
OH
O
OH
O
OH
NH2
HO
HO
OH
OH
N
OH
371
O
384
APPENDICE V - Continua
OH
OH
H2N
HO3S
NH2
SO3H
HO
HO
408
412
OH
HO
O
HO
O
HO
O
OSO3-
OH
450
O