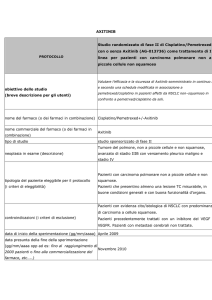
TOPOTECAN per l'indicazione: in associazione a cisplatino per
carcinoma della cervice uterina recidivante dopo radioterapia e
nelle pazienti di stadio IVB (12-04-2010)
Specialità: Hycamtin® (Glaxosmithkline Spa)
Forma farmaceutica:
•
5 FL 5 ml INFUSIONE EV 4 mg - Prezzo: euro 1845
ATC: L01XX17
Categoria terapeutica: Altri agenti antineoplastici
Fascia di rimborsabilità:
Indicazioni ministeriali:
NUOVA INDICAZIONE:
Topotecan in associazione con cisplatino è indicato nelle pazienti affette da carcinoma della
cervice uterina recidivante dopo radioterapia e nelle pazienti allo stadio IVB della malattia. Le
pazienti con precedente esposizione a cisplatino richiedono un prolungato intervallo libero da
trattamento prolungato per giustificare il trattamento con tale associazione.
Topotecan in monoterapia è indicato nel trattamento di:
▪
pazienti affetti da carcinoma metastatizzato dell’ovaio dopo esito negativo della terapia di prima linea
o delle successive terapie.
▪
pazienti affetti da carcinoma polmonare a piccole cellule recidivante per i quali non è considerato
appropriato un ulteriore trattamento con il regime terapeutico di prima linea (vedere paragrafo 5.1).
Decisioni PTORV
Data riunione: 12-04-2010
Decisione: Non Inserito
Nota Ufficiale: Non inserito
Commenti:
Il trattamento di prima linea è ormai rappresentato da radioterapia associata a cisplatino. Il comparator
utilizzato nello studio clinico in II linea, cisplatino in monoterapia, non rappresenta quindi allo stato
attuale il miglior comparator, perché già ampiamente utilizzato in prima linea. Anche nello stesso studio
registrativo circa la metà delle pazienti arruolate, era stata trattata con cisplatino in I linea, quindi è
presumibile una miglior risposta dell’associazione nel confronto in II linea. Un recentissimo studio ha
confrontato diverse associazioni di chemioterapici, tra cui cisplatino + topotecan arrivando alla
conclusione che essi sono sostanzialmente sovrapponibili in termini di sopravvivenza complessiva rispetto
a vinorelbina/cisplatino, gemcitabina/cisplatino, paclitaxel/cisplatino. La doppietta cisplatino + topotecan
è peraltro gravata da maggiori effetti collaterali ematologici. Il costo per ciclo di trattamento con
topotecan + cisplatino risulta essere molto elevato rispetto agli altri regimi d’associazione disponibili,
anche in virtù dell’elevato spreco di farmaco. In Italia infatti, a differenza di altri Paesi, la formulazione in
fiale è disponibile solo al dosaggio da 4 mg, con un conseguente spreco di farmaco pari a circa il 60% del
contenuto per ogni ciclo di trattamento per paziente.
Caratteristiche del prodotto
L’attività antitumorale di topotecan comporta l’inibizione della topoisomerasi-I, un enzima strettamente
coinvolto nella duplicazione del DNA, in quanto allenta la tensione torsionale generata davanti alla forcella
di replicazione in movimento. Topotecan, che è un analogo semisintetico dell'alcaloide camptotecina,
inibisce la topoisomerasi-I mediante la stabilizzazione del complesso covalente tra l’enzima e il filamento
interrotto di DNA, che costituisce un intermedio del processo catalitico. A livello cellulare, l’effetto
dell’inibizione della topoisomerasi-I da parte di topotecan è l’induzione di filamenti singoli, interrotti, di
DNA associati alla proteina.
Nella formulazione endovena per l'indicazione del trattamento del cancro alla cervice uterina, in
associazione a cisplatino, la dose iniziale raccomandata di topotecan è di 0,75 mg/m²/die somministrata
come infusione endovenosa giornaliera della durata di 30 minuti nei giorni 1, 2 e 3. Il cisplatino viene
somministrato come infusione endovenosa nel giorno 1 alla dose di 50 mg/m²/die e dopo la
somministrazione della dose di topotecan. Questo schema di trattamento è ripetuto ogni 21 giorni per 6
cicli o fino alla progressione della malattia. Prima della somministrazione del primo ciclo di topotecan, i
pazienti devono avere un valore di base della conta dei neutrofili ≥ 1,5 x 109/l/die, una conta delle
piastrine ≥ 100 x 109/l ed un livello di emoglobina ≥ 9 g/dl (dopo trasfusione, se ritenuta necessaria).
L’uso di topotecan, inoltre, deve essere limitato ad unità specializzate nella somministrazione di
chemioterapia citotossica e deve essere somministrato solo sotto la direzione di un medico esperto
nell’uso della chemioterapia. Per quanto riguarda le dosi successive Topotecan non deve essere
somministrato ulteriormente se il valore della conta dei neutrofili, delle piastrine e il valore di emoglobina
non rientrino nei range sopra descritti validi per l'inizio del primo ciclo di chemio. La pratica standard in
oncologia per il controllo della neutropenia prevede sia la somministrazione di topotecan con altri
trattamenti (ad esempio Granulocyte - Colony Stimulating Factor, G-CSF), sia la riduzione della dose per
mantenere i valori della conta dei neutrofili. Se viene scelta la riduzione della dose per i pazienti che
presentano una neutropenia grave (conta dei neutrofili inferiore a 0,5 x 109/l) per 7 o più giorni, od una
neutropenia grave associata a febbre o infezione o che, a causa della neutropenia, hanno dovuto
ritardare il trattamento, la dose nei cicli successivi deve essere ridotta del 20% a 0,60 mg/m²/die, (o,
successivamente, ulteriormente ridotta fino a 0,45 mg/m²/die, se necessario). Le dosi devono essere
ridotte in modo simile se la conta piastrinica si riduce al di sotto di 25 x 109/l [1].
Inquadramento della patologia
Nel periodo 1998-2002 il tumore della cervice uterina ha rappresentato l'1,6% di tutti i tumori
diagnosticati tra le donne, mentre in termini di mortalità ha rappresentato lo 0,6% dei decessi
neoplastici. È necessario ricordare però che una quota rilevante di decessi sono definiti "utero non
specificato" (2,6% di tutti i decessi oncologici) e che una parte di questi possono essere tumori della
cervice uterina. Le stime per l'Italia indicano un totale di 3418 nuovi casi diagnosticati ogni anno, mentre
per quanto riguarda la mortalità nel 2002 si sono verificati 370 decessi per tumore della cervice uterina
oltre a 1756 decessi per tumore dell'utero non diversamente specificato. I tassi di incidenza sono
abbastanza omogenei tra le varie aree italiane con un rapporto di circa 2 tra aree con i tassi più elevati e
quelle con i tassi più bassi [2].
A partire dai dati del Registro Tumori della regione Veneto del 2003, [3], si può stimare che mediamente
in tutto il Veneto si verifichino ogni anno circa 22000 nuovi casi di tumore nella popolazione adulta e il
tumore all'utero, quindi anche della cervice uterina, rientra tra le prime quattro sedi che colpiscono
principalmente la popolazione femminile: si stimano, infatti, 671 casi/anno (età>14 anni) nella regione
Veneto. Inoltre, nella fascia d'età della donna compresa tra i 50 e i 60 anni, il tumore all'utero appare
essere la terza sede più frequente di tumore dopo mammella e colon-retto, con una incidenza del 6-7%
(circa 340 casi per anno).
L'infezione da papillomavirus umano (HPV) e lo sviluppo di una neoplasia cervicale sono fortemente
associati. L'infezione da HPV è legata a tutti i gradi di neoplasia cervicale intraepiteliale (CIN) e al cancro
invasivo della cervice. Le cellule precursori (displasia cervicale, CIN) si trasformano in un cancro cervicale
invasivo nel corso di molti anni. Le CIN di grado I, II e III corrispondono alla displasia cervicale lieve,
moderata e grave. La CIN III, che include la displasia grave e il carcinoma in situ, è difficile che
regredisca spontaneamente e, se non trattata, può alla fine invadere la membrana basale, trasformandosi
in un carcinoma invasivo. Il carcinoma a cellule squamose è responsabile dell'80-85% di tutti i cancri
cervicali; gli adenocarcinomi sono responsabili della maggior parte dei restanti casi. Il carcinoma a cellule
squamose invasivo, di solito resta localizzato e si diffonde in sede loco-regionale per un considerevole
periodo di tempo; le metastasi a distanza si verificano tardivamente. Le percentuali di sopravvivenza a 5
anni sono dell'80-90% per lo stadio I, del 50-65% per lo stadio II, del 25-35% per lo stadio III e dello 015% per lo stadio IV. Quasi l'80% delle recidive si manifesta entro 2 anni. Più del 90% dei casi
asintomatici di CIN può essere accertato in fase preclinica con l'esame citologico del Pap test ottenuto
direttamente dalla cervice. Le pazienti a più alto rischio per una neoplasia cervicale sono, con molte
probabilità, quelle seguite con minore regolarità.
Trattamenti alternativi
Secondo parere clinico, lo standard attuale di trattamento della malattia avanzata in prima linea è
rappresentata da radioterapia + cisplatino [4].
Nelle pazienti che recidivano si usano oramai le associazioni di chemioterapici. L'associazione in esame
topotecan + cisplatino illustrata nei dati di efficacia ha dimostrato una maggior risposta terapeutica
rispetto al cisplatino in monoterapia ma è da considerare che quasi il 60 % delle pz trattate erano già
state sottoposte precedentemente a chemioradioterapia a base di cisplatino. Ne deriva, quindi, che il
comparator cisplatino in monoterapia in questo caso non sia il miglior trattamento con cui misurare la
risposta dell'associazione topoteca + cisplatino.
Viceversa, l'associazione paclitaxel + cisplatino, considerato un possibile trattamento alternativo da trial
clinico [5], ha dato una differenza non significativa sulla mortalità confrontato con cisplatino da solo, ma
in questo caso solo il 30% delle pz nella precedente terapia aveva già ricevuto l'associazione radioterapia
+ cisplatino. Dunque tale effetto di cisplatino nel gruppo di controllo è da considerarsi superiore. Inoltre,
tra le pazienti trattate precedentemente con chemioradioterapia in entrambi i bracci, maggiori sono le pz
che hanno risposto al trattamento cisplatino + paclitaxel (32%) rispetto a quelle che hanno risposto al
cisplatino in monoterapia (5%).
Altre associazioni che comprendono cisplatino + vinorelbina, cisplatino + gemcitabina sono state
confrontate insieme alle due già citate sopra [6] e possono rappresentare altre alternative di cura
possibili, ma, sebbene tutti i farmaci riportati anche in tabella siano già presenti in PTORV, nessuno di
essi è registrato in Italia per l'indicazione terapeutica specifica del tumore avanzato o recidivante della
cervice uterina; solo la vinorelbina riporta l'estensione di indicazione nell'elenco AIFA dei farmaci con uso
consolidato per il trattamento dei tumori solidi nell'adulto.
Si riporta, inoltre, uno schema terapeutico presente nell'elenco regionale per i farmaci oncologici ad alto
costo per il cancro alla cervice uterina: l'associazione a tre ifosfamide + paclitaxel + cisplatino. Tuttavia i
dosaggi utilizzati nella pratica clinica e proposti in questo elenco variano leggermente rispetto a quelli che
si trovano nel trial clinico [7].
L'FDA approva il topotecan in formulazione endovena in associazione al cisplatino negli adulti affetti da
carcinoma della cervice uterina recidivante o persistente e nello stadio IVB della malattia; aggiunge come
nota importante la possibilità di somministrazione di tale associazione solo se le pz contano al baseline
almeno 1500 neutrofili/mm3 e almeno 100000 piastrine/mm3.
Secondo il BNF il topotecan è dato mediante infusione endovenosa o nella formulazione orale nel cancro
metastatico all'ovaio quando la prima linea o comunque le terapie successive hanno fallito. Riporta però
la raccomandazione dello Scottish del novembre 2007 in merito all'utilizzo ristretto dell' associazione
topotecan/cisplatino per quelle pz affette da cancro della cervice uterina recidivante dopo radioterapia e
allo stadio IVB, ma che non sono mai state trattate prima con cisplatino.
STUDI/FONTI DI
DATI
PFS
OS
OVERALL
RESPONSE
RATE
[5], RCT: cisplatino
vs
cisplatino+paclitaxel
2,8mesi
vs
4,8mesi
#Differenze non
statisticamente
significative
8,8mesi
vs
9,7mesi
#Differenze
non
statisticamente
significative
19%
vs
36%
#Differenze non
statisticamente
significative
[6], RCT: cisplatino +
paclitaxel
vs
cisplatino + vinorelbina,
cisplatino +
gemcitabina, cisplatino
+ topotecan
5,82 mesi
vs
3,98 mesi, 4,70
mesi, 4,57 mesi
#Differenza
statisticamente
significativa solo
per l'associazione
cisplatino +
gemcitabina
(vedi dati di
efficacia)
12,87 mesi
vs
9,99 mesi,
10,28 mesi,
10,25 mesi
#Differenze
non
statisticamente
significative
(vedi dati di
efficacia)
cisplatino* + vinorelbina*
[6]
RCT:
cisplatino+paclitaxel
vs
cisplatino + vinorelbina
5,82 mesi
vs
3,98 mesi
(P=0,06)
#Differenze
non
statisticamente
significative
(vedi dati di
efficacia)
#Differenze
statisticamente
non significative
(vedi dati di
efficacia)
cisplatino + gemcitabina
[6]
RCT:
cisplatino+paclitaxel
vs
cisplatino +
gemcitabina
5,82 mesi
vs
4,70 mesi
(P=0,04)
#Differenze
non
statisticamente
significative
(vedi dati di
efficacia)
#Differenze
statisticamente
non significative
(vedi dati di
efficacia)
CHEMIOTERAPICI IN
ASSOCIAZIONE
cisplatino*+paclitaxel**
[5], [6]
29,1%
vs
25,9%, 22,3%,
23,4%
RCT: ifosfamide +
15,4 mesi
59%
7,9 mesi vs 6,3
cisplatino + paclitaxel
vs
vs
mesi
vs
13,2 mesi
33%
(P=0,023)
ifosfamide + cisplatino
(P=0,048)
(P=0,002)
* la vinorelbina e il cisplatino riportano l'estensione di indicazione al carcinoma della cervice uterina e dei tumori solidi
in generale nell'elenco AIFA dei farmaci con uso consolidato per il trattamento dei tumori solidi nell'adulto
ifosfamide + paclitaxel +
cisplatino (TIP/c)***
[7]
** il paclitaxel riporta l'estensione di indicazione al carcinoma dell'endometrio e della cervice metastatica nell'elenco
AIFA
dei
farmaci
con
uso
consolidato
per
il
trattamento
dei
tumori
solidi
nell'adulto
*** associazione presente nell'elenco Sirfac per i farmaci oncologici ad alto costo
Linee guida di trattamento esistenti
Le linee guida NCCN (v.1.2010), [8], raccomandano l'associazione topotecan + cisplatino, con
categoria 2A, nel trattamento in prima linea di pazienti affette da cancro della cervice uterina in stadio
avanzato IVB o recidivante in sedi multiple se sono già state esposte precedentemente all'utilizzo
di cisplatino durante la chemio-radioterapia, a fianco di altre tre associazioni:
paclitaxel/cisplatino (categoria 1)
carboplatino/paclitaxel (categoria 2A)
cisplatino/gemcitabina (categoria 2B)
Se, invece, le pazienti non sono mai state sottoposte prima a trattamento chemioterapico a base di
cisplatino e risultano, inoltre, non candidabili alla radioterapia o alla chirurgia vengono raccomandati i
seguenti chemioterapici in prima linea in monoterapia:
cisplatino, (preferito come singolo agente) (categoria 2A)
carboplatino (categoria 2A)
paclitaxel (categoria 2A)
I livelli di evidenza previsti dal NCCN sono i seguenti :
1: raccomandazioni basate su elevati livelli di evidenza e unanime consenso
2 A: raccomandazioni basate su livelli di evidenza di livello inferiore, inclusa l’esperienza clinica, e
unanime consenso
2 B: raccomandazioni basate su livelli di evidenza di livello inferiore, inclusa l’esperienza clinica, e
consenso non unanime (ma senza disaccordo rilevante)
3: raccomandazioni basate su alcune evidenze, ma gravati da opinioni molto discordi
Le linee guida NGC, [9], propongono per le donne di stadio IVB o con carcinoma alla cervice recidivante
l'utilizzo di chemioterapici in associazione:
cisplatino + topotecan preferibilmente per pz con PS 0-2 e limitatamente ai pz naïve all'utilizzo
precedente di cisplatino (grado di raccomandazione B)
cisplatino/paclitaxel (grado di raccomandazione B)
Il grado di raccomandazione B previsto dalle linee guida NGC è il seguente: livello di evidenza che include
studi classificati come 2++, direttamente applicabili alla popolazione target e che dimostrano una
consistenza globale di risultati; o si tratta di evidenze estrapolate da studi classificati come 1++ o 1+
Studi 2++: review sistematiche di alta qualità di caso controllo o di studi di coorte con basso rischio di
bias e un'alta probabilità che la relazione sia casuale
Studi 1++, studi 1+: metanalisi di alta qualità o comunque ben condotte, review sistematiche, o RCT con
un bassissimo o comunque basso rischio di bias.
Dati di efficacia
Il primo studio riportato a cui fa riferimento l'EMEA per valutare il profilo di efficacia e sicurezza
dell'associazione topotecan + cisplatino e per autorizzarne l'utilizzo confronta l'associazione in esame
verso il solo cisplatino, ed a sua volta è suddiviso in due pubblicazioni. La prima inerente al profilo di
efficacia e sicurezza dove si dimostrano risultati favorevoli per la coppia topotecan + cisplatino rispetto al
cisplatino in monoterapia in termini di OS, HR: 0,76 (95%IC, 0,593-0,979), valutato come end-point
primario, che di PFS (4,6 mesi in CT vs 2,9 mesi in CPT; p=0,014) che di tasso di risposta (27% in CT vs
13% in CPT; p=0,004 [10]. Nella seconda pubblicazione vengono riportati i dati sulla QoL in seguito a
somministrazione di appositi questionari valutati in base ad alcune scale di valutazione. In questo articolo
si dimostra che la coppia CT non ha prodotto riduzioni significative nella QOL rispetto al CPT in
monoterapia e questo effetto è rimasto stabile nel corso del tempo [11]. Si fa notare però che molto
probabilmente il cisplatino non è il miglior comparator per misurare l'efficacia dell'associazione topotecan
+ cisplatino dal momento che la metà circa delle pz erano già state sottoposte al suo utilizzo in
concomitanza della radioterapia e dunque è ovviamente auspicabile una migliore risposta nelle pazienti
del braccio associato rispetto a quelle del cisplatino in monoterapia.
L'attuale standard di trattamento in seconda linea è rappresentato dalle associazioni cisplatino +
vinorelbina, cisplatino + paclitaxel, cisplatino + paclitaxel + ifosfamide.
Il Gruppo Oncologico Ginecologico GOG ha condotto quindi uno studio per valutare la chemioterapia
combinatoria a base di cisplatino ottimale per la cura del cancro avanzato (stadio IVB) o persistente della
cervice uterina. Questo trial prevedeva inizialmente due bracci: paclitaxel/cisplatino (PC) vs
vinorelbina/cisplatino (VC); in un secondo momento sono stati aggiunti la gemcitabina/cisplatino (GC) e il
topotecan/cisplatino (TC). Sono stati randomizzati ai 4 bracci un totale di 472 pazienti maggiorenni,
affette da un cancro alla cervice uterina di stadio IV B, recidivante, non più candidabili al trattamento con
chirurgia e/o radioterapia, con cancro istologicamente definito di tipo squamoso, adenosquamoso o
adenocarcinoma e con 0≤PS≤1. Le pazienti dovevano avere recuperato buone condizioni dopo eventuali
precedenti cure chirurgiche, radioterapiche o chemioradioterapiche, ma non essere mai sottoposte
precedentemente a sola chemioterapia. I 4 regimi di trattamento e dosaggio, descritti nella tabella,
dovevano essere somministrati per un massimo di 6 cicli ogni 21 giorni per i non responder e per coloro
che presentavano una stabilità della malattia. Per coloro, invece, che raggiungevano una risposta anche
solo parziale con un livello accettabile di tossicità era permessa la continuità del trattamento a loro
assegnato oltre i 6 cicli. Le dosi di farmaco potevano essere aggiustate in base a eventuali effetti avversi
o ai pz veniva somministrata una terapia di supporto con G-CSF durante i cicli di chemio successivi. Di
tutti i pz del braccio di riferimento PC il 56,3% hanno completato i 6 cicli di terapia, rispetto al 41,7%,
42,9% e 47,8% di VC, GC, TC, rispettivamente. É stato esplorato con un complesso modello
proporzionale Cox multifattoriale anche il potenziale significato di alcuni fattori prognostici quali lo stato
della malattia, la locazione delle lesioni target per la terapia, l'età, la razza, il PS ed eventuali precedenti
esposizioni al cisplatino.
Si riportano nel dettaglio il numero di pz e le percentuali corrispondenti di responders ai vari regimi di
trattamento: 30 pz, di cui 27 risp. parziale e 3 risp. totale, (29,1%) per VC; 28 pz, di cui 20 risp. parziale
e 8 risp. totale, (25,9%) per VC; 25 pz, di cui 24 risp. parziale e 1 risp. totale, (22,3%) per GC; 26 pz, di
cui 24 risp. parziale e 2 risp. totale, (23,4%) per TC. Tutti i restanti risultati sono elencati in tabella.
Sebbene quasi la totalità dei risultati sopra esposti sia non statisticamente significativo, possiamo
ricavare comunque alcune importanti informazioni: VC, GC e TC non sono superiori al PC in termini di
risposta antitumorale, sopravvivenza media e progressione libera da malattia e, inoltre, la differenza
nella sopravvivenza media emersa dal PC rispetto agli altri tre bracci è un valore comunque da
considerare nella pianificazione di un trattamento e nella progettazione di eventuali trial futuri. La
complessa analisi sui fattori prognostici ha mostrato che l'età non era significativa in questi dati. Il PS
della pz, invece, è apparso essere il fattore prognostico più forte scoperto per OS e PFS. E' anche
possibile che una precedente esposizione della paziente al cisplatino sia associato ad un aumento di
rischio di morte, come indicato in altri studi [10], ma tale relazione non sembra essere così rilevante in
questa analisi [6].
Referenza
Pazienti e trattamento
Disegno/Fase
Misure di esito
RCT,
prospettico,
in aperto,
controllo attivo/
fase III
End-point
primario:
d) OS
End-point
secondario:
e) tasso di risposta
(PR+CR)
f) PFS
g)QOL (stesso
disegno del
precedente studio)
Risultati principali
Jadad
score
End-point primario:
3*
d) sopravvivenza media e Hazard
Ratio rispetto a PC:
PC: 12,87 mesi (95% IC, 10,02 a
16,76)
VC: 9,99 mesi (95% IC, 8,25 a
12,25);
HR=1,15
(95% IC, 0,79 a 1,67), (P=0,71)
GC: 10,28 mesi (95% IC, 7,62 a
11,60);
HR=1,32 (95%
IC, 0,91 a 1,92), (P=0,90)
TC: 10,25 mesi (95% IC, 8,61 a
11,66);
HR=1,26
(95% IC, 0,86 a 1,82), (P=0,89)
End-point secondario:
e) percentuale di risposta e Odds
Ratio rispetto a PC:
PC: 29,1%
VC: 25,9%
OR=1,17 (95% IC, 0,54 a
2,58)
GC: 22,3%
OR=1,43 (95% IC, 0,65 a
3,19)
TC: 23,4%
OR=1,34 (95% IC, 0,61 a
2,98)
f) sopravvivenza media libera da
progressione e hazard ratio
rispetto a PC:
PC: 5,82 mesi (95% IC, 4,53 a
7,59)
VC: 3,98 mesi (95% IC, 3,19 a
5,16);
HR=1,36
(95% IC, 0,97 a 1,90), (P=0,06)
GC: 4,70 mesi (95% IC, 3,58 a
5,59);
HR=1,39 (95%
IC, 0,99 a 1,96), (P=0,04)
TC: 4,57 mesi (95% IC, 3,71 a
5,75);
HR=1,27
(95% IC, 0,90 a 1,78), (P=0,19)
*Jadad Scale: strumento per la verifica della qualità della pubblicazione; si basa sulla considerazione che i tre elementi principali che devono essere riportati per avere maggiori garanzie
sulla buona qualità di uno studio clinico siano la randomizzazione, la condizione di doppia cecità, e la gestione dei drop-out. Si considerano buone le pubblicazioni che ottengono almeno 3
punti, mentre si considerano di scarsa qualità quelle che raggiungono un punteggio uguale o inferiore a due.
Monk B.J. et al,
Journal of Clinical
Oncology 2009
[6]
472 pz≥18 anni, carcinoma recidivante della cervice uterina, avanzato
(stadio IVB), squamoso, adenosquamoso e adenocarcinoma; alcune pz
già esposte a radioterapia o chemioradioterapia, ma non chemioterapia;
0≤PS≤1
Braccio di riferimento:
- paclitaxel EV 135mg/m2 nell'arco di 24 ore +
cisplatino EV 50mg/m2 nel giorno 2
ogni 21 giorni (PC)
[118]
Bracci di confronto:
- vinorelbina EV 30mg/m2 nei giorni 1 e 8 + cisplatino EV 50mg/m2 nel
giorno 1
ogni 21 giorni (VC)
[117]
- gemcitabina EV 1,000mg/m2 nei giorni 1 e 8 + cisplatino EV 50mg/m2
nel giorno 1
ogni 21 giorni (GC)
[119]
- topotecan EV 0,75 mg/m2 nei giorni 1,2 e 3 + cisplatino EV 50mg/m2
nel giorno 1
ogni 21 giorni (TC)
[118]
Durata trattamento: max 6 cicli ogni 21 gg per i non responder, inclusi
coloro con malattia stabile
PS: performance status; G-CSF: granulocite colony stimulating factor; OS: sopravvivenza globale; CT o TC: cisplatino/topotecan; CPT: cisplatino; HR: hazard ratio; CR: risposta completa;
PR: risposta parziale; QOL: qualità della vita; PC: paclitaxel/cisplatino; VC: vinorelbina/cisplatino; GC: gemcitabina/cisplatino.
Dati di sicurezza
Il profilo di sicurezza della coppia cisplatino/topotecan studiato nel trial principale dell'EMEA [10] verso il
cisplatino in monoterapia ha dimostrato essenzialmente eventi legati alla mielosoppressione, più frequenti
e più severi nel braccio CT rispetto a quello CPT, e che son stati la ragione più comune di alcuni ritardi
nella somministrazione dei cicli successivi di chemioterapia. Tali carenze erano curabili con antibiotici o
aggiustamenti di dosi previsti dal protocollo oppure anche con la somministrazione di filgrastim prima dei
successivi cicli di trattamento. La trombocitopenia è un comune evento avverso della terapia di
combinazione cisplatino/topotecan ed ha il potenziale di condurre a complicazioni in termini di
sanguinamenti/emorragie fatali e dunque, il rischio di emorragie dovrebbe essere preso in considerazione
quando si sceglie di sottoporre un paziente a tale trattamento.
Tra le tossicità non ematologiche, anche i disturbi cardiovascolari sono stati significativamente più alti tra
i pz del braccio CT, rispetto al braccio CPT; così anche per la tossicità muscoloscheletrica e per le
stomatiti, sebbene queste ultime abbiano interessato solo 8 pz del gruppo CT. Due pazienti nel braccio
CT sono morte per un embolo polmonare, ritenuto comunque non correlato alla terapia.
Nonostante le maggiori tossicità generate dal trattamento con CT piuttosto che CPT, coloro che hanno
condotto lo studio considerano che il beneficio apportato nella risposta antitumorale dalla coppia
chemioterapica rispetto al cisplatino in monoterapia prevalga sull'aumentato rischio di eventi avversi
ematologici.
Nel recente trial di Monk [6] che aveva l'obiettivo di valutare quale fosse la combinazione chemioterapica
migliore a confronto del paclitaxel/cisplatino nel carcinoma della cervice uterina avanzato e persistente si
è verificata una minore soppressione del midollo osseo nel gruppo GC. Vi è evidenza di una relazione tra
la tossicità di grado 3 o maggiore e il tipo di regime somministrato per la leucopenia (P<0,0001),
neutropenia (P<0,0001), trombocitopenia (P<0,0001), anemia (P=0,02) e infezione (P=0,04). Per tutti
questi eventi avversi citati si riportano in tabella le percentuali. Infine, la percentuale di eventi di
alopecia di grado 2 è stata significativamente maggiore nel braccio PC (54%), rispetto a VC (9%), GC
(7%) o TC (26%) (P<0,0001).
NEUTROPENIA
GRADO 3 E 4
TROMBOCITOPENIA
GRADO 3 E 4
Long III
et al,
Journal
CT: 70% vs
CT: 31,3% vs CPT:
of Clin
CPT: 1,4%
3,4%
Oncol
2005
[10]
CT: cisplatino + topotecan; CPT: cisplatino
NEUTROPENIA
FEBBRILE
MORTI CORRELATI
ALLA TERAPIA
CT: 17,7%
CPT: 7,5%
una paziente è morta
per complicazione
emorragica
probabilmente
aggravata dalla
trombocitopenia indotta
dal trattamento CT
vs
LEUCOPENIA NEUTROPENIA TROMBOCITOPENIA ANEMIA
MORTI CORRELATE
ALLA TERAPIA
11 casi fatali si sono
verificati nello studio con
Monk et
attribuzione al tipo di
al,
CT: 70,6%
CT: 82,6%
CT: 34,9%
terapia anche se non è
Journal vs
vs
vs
stata scoperta
GC: 43,1%
GC: 42,2%
GC: 28,4%
of Clin
un'associazione
Oncol
VC: 67,9%
VC: 78,3%
VC: 7,5%
statisticamente
2009
PC: 63,4%
PC: 78,2%
PC: 6,9%
significativa tra il tipo di
[6]
regime somministrato e
le morti legate al
trattamento (P=0,84)
CT: topotecan + cisplatino; GC: gemcitabina + cisplatino; VC: vinorelbina + cisplatino; PC: paclitaxel +
cisplatino
CT:
34,9%
vs
GC:
33,9%
VC:
29,2%
PC:
16,8%
Indicazione studi in corso
Nel Registro Governativo americano sono in corso due studi [12] il primo dei quali sponsorizzato dal
gruppo GOG che ha condotto anche lo studio registrativo principale del topotecan. Tale studio randomizza
in aperto le pazienti affette da carcinoma persistente, recidivante dopo radioterapia o di stadio avanzato
IVB a 4 bracci di trattamento in cui si confronta la sopravvivenza globale delle pz trattate con paclitaxel in
combinazione con cisplatino o topotecan vs l'aggiunta di bevacizumab a tali associazioni. Di tale studio si
prospetta la fine nel dicembre 2011. Il secondo trial descritto prevede, invece, il trattamento della stessa
categoria di pazienti con idralazina valproato e magnesio valproato aggiunti all'associazione cisplatino +
topotecan vs placebo e se ne prospetta il temine nel dicembre 2010.
L'Osservatorio Sperimentazioni Cliniche dell'AIFA [13] sta conducendo uno studio prospettico, di fase II,
multicentrico e non randomizzato in cui valuta la chemioterapia neoadiuvante con topotecan e cisplatino
settimanali (topocis) nel trattamento del carcinoma spinocellulare della cervice uterina in stadio
localmente avanzato.
Registro /
Nazione
Clinicaltrials
USA
[12]
Clinicaltrials
USA
[12]
Pazienti e trattamento
450 pz ≥18anni, cancro cervice uterina
recidivante dopo eventuale
chemioradioterapia o di grado avanzato IVB,
di tipo squamoso, adenosquamoso,
adenocarcinoma, PS 0-1
Braccio di riferimento:
- paclitaxel IV nel giorno 1 + cisplatino IV
nel giorno 1 o 2
Bracci sperimentali:
- paclitaxel IV nel giorno 1 + cisplatino IV +
bevacizumab IV nel giorno 1 o 2
- paclitaxel IV nel giorno 1 + topotecan IV
nei giorni 1-3
- paclitaxel IV + bevacizumab IV nel giorno
1 + topotecan nei giorni 1-3
cicli ripetuti ogni 21 giorni in assenza di
progressione della malattia
143 pz≥18anni, cancro recidivante alla
cervice uterina dopo eventuale
chemioradioterapia, metastatico, PS 0-2
Trattamento:
- cisplatino + topotecan + idralazina
valproato orale + magnesio valproato
orale
vs
- cisplatino + topotecan + placebo
6 cicli ripetuti ogni 21 giorni
Disegno/Fase
Misure di
esito
Note
RCT,
multicentrico/
fase III
End-point I:
OS, frequenza
e gravità di
eventi avversi
associati
End-point II:
PFS, RR
in
reclutament
o
RCT,
doppio cieco,
multicentrico/
fase III
End-point I:
PFS
End-point II:
OS, RR,
sicurezza
in
reclutament
o
Altri report HTA
Lo Scottish Medicine Consortium [14] ha deciso di autorizzare l'utilizzo dell'associazione
topotecan/cisplatino per le pazienti con carcinoma della cervice uterina recidivante dopo radioterapia e
per le pazienti con stadio IVB della patologia solo se naive al cisplatino. Il report dello Scottish Medicines
Consortium (SMC) pubblicato nel Novembre 2007 riporta e valuta 2 analisi che la ditta ha effettuato a
partire dallo studio principale (cisplatino+topotecan VS cisplatino).
Il produttore ha stimato l'aspettativa di vita con Kaplan-Meier e sviluppato un'analisi di Costo-Utilità. I
dati riferiti alla progressione della malattia e agli eventi avversi sono stati quelli dello studio principale e
sono state utilizzate fonti referenziate (secondo SMC) per quanto riguarda la stima dei costi per la
somministrazione della malattia e per la cura degli eventi avversi. Sono state utilizzate 2 diverse fonti per
reperire le stime delle utilità, una da dati di letteratura, l'altra dallo studio pilota.
Nella 1° analisi sono stati individuati 2 sottogruppi di popolazione:
1. cisplatino naive in cui è stata stimata una sopravvivenza oltre 36 mesi;
2. pazienti sottoposte precedentemente a chemioradioterapia con alle spalle un intervallo di tempo
libero da cisplatino di almeno 180 giorni all'entrata in studio (SCFI) in cui è stata stimata una
sopravvivenza a 18 mesi.
In questa prima valutazione, considerando entrambi i sottogruppi è stato stimato un ICER=£24.115/QALY
che decresce fino a £17.740/QALY qualora si considerino le stime di utilità presenti nello studio pilota.
Nell'analisi per sottogruppi, si trova un ICER=£15.545/QALY nel gruppo cisplatino naive e uno di
£34.080/QALY per la SCFI. Le criticità di questo primo set di analisi erano riferite alla sottostima dei costi
degli eventi avversi (essendo stati considerati solo quelli più costosi) e a quelli di somministrazione
(essendo stati considerati solo i costi del personale sanitario). Inoltre SMC ha espresso perplessità circa le
stime di sopravvivenza in SCFI, considerando queste non abbastanza robuste da dimostrarne la
significatività statistica.
Nel secondo set di analisi topotecan/cisplatino è stato confrontato con paclitaxel/cisplatino attraverso un
confronto indiretto. La popolazione trattata con topotecan era naive al cisplatino, viceversa i pazienti
trattati con paclitaxel avevano ricevuto nel 24% dei casi un precedente trattamento chemioterapico, tra
cui poteva figurare anche il cisplatino.
La ditta in questo setting aveva stimato che topotecan fosse dominante (meno costoso e più efficace)
rispetto a paclitaxel. SMC in questo scenario ha ritenuto non validi i risultati presentati dalla ditta in
quanto non ha considerato confrontabili i 2 gruppi a causa delle differenze nella precedente esposizione a
cisplatino. Inoltre lo studio su topotecan aveva riportato migliori esiti per il gruppo naive introducendo un
bias in favore del regime con topotecan. I limiti nell'analisi indiretta compromettono i risultati per questo
confronto e infatti le evidenze presentate non sono state considerate attendibili.
In conclusione, quindi, SMC giudica Costo-Efficace solo l'associazione topotecan/cisplatino quando
confrontato col solo cisplatino per le donne cisplatino naive.
Il NICE [15] in un documento del 2009 ha espresso lo stesso giudizio dello SMC, autorizzando l'utilizzo
dell'associazione topotecan/cisplatino per le pazienti naive al cisplatino, con carcinoma della cervice
uterina recidivante dopo radioterapia o con stadio IVB della patologia.
La popolazione in esame era formata da pazienti con carcinoma della cervice uterina recidivante dopo
radioterapia e per le pazienti in stadio IVB.
I costi per i trattamenti sono stati calcolati considerando il possibile spreco del prodotto e facendolo
variare tra un massimo ed un minimo. Le analisi presentate dalla ditta sembrano essere le medesime di
quelle del report di SMC per cui sono stati presentati un modello con orizzonte temporale di 36 mesi per il
confronto topotecan/cisplatino vs cisplatino con dati presi dal trial GOG-0179 e uno di 24 mesi per il
confronto tra topotecan/cisplatino vs paclitaxel/cisplatino attraverso un confronto indiretto con dati presi
da 2 diversi trial GOG-0179 e GOG-0169. Le utilità sono state stimate come prima sia da dati dei trial
(attraverso un algoritmo) sia da precedenti lavori di letteratura. I risultati presentati dalla ditta erano
favorevoli al trattamento con topotecan.
Il NICE ha stimato che dal confronto tra topotecan/cisplatino vs paclitaxel/cisplatino l'ICER variava tra
£59.000/QALY - £117.000/QALY a seconda dello spreco del farmaco (in alcuni scenari, variando anche
altre variabili il trattamento con topotecan risultava addirittura essere dominato).
Tuttavia considerando solo la popolazione cisplatino naive, dal confronto tra topotecan/cisplatino vs
cisplatino è stato stimato un ICER variabile tra £26.800/QALY - £34.000/QALY a seconda dello spreco del
farmaco.
Dai confronti indiretti vs il trattamento con paclitaxel topotecan risultava dominato, ma i confronti sono
stati ritenuti poco attendibili alla luce dell'alto numero di pazienti precedentemente trattati con cisplatino;
le stime dunque non sono state ritenute attendibili.
Alla luce anche dell'incertezza relativa alla migliore efficacia di topotecan/cisplatino vs gli altri trattamenti,
il trattamento è stato consigliato solamente nelle pazienti naive al cisplatino.
Sottolineiamo che i costi dei farmaci sembrano molto diversi nella nostra realtà; infatti in Inghilterra il
topotecan è disponibile anche in fiala da 1 mg, con la possibilità di ridurre notevolmente lo spreco di
farmaco. In Italia è disponibile solo la formulazione da 2 mg.
Inoltre il costo per ciclo di trattamento con paclitaxel/cisplatino (con un dosaggio di 175 mg/m2 per il
paclitaxel e di 50 mg/m2 per il cisplatino) è di £1.116 (circa 1238 euro) in Inghilterra, mentre in Veneto il
trattamento con paclitaxel, considerando il prezzo di aggiudicazione della gara regionale (di circa 45 euro
per una fiala da 300 mg) e un dosaggio di poco inferiore (135 mg/m2 per paclitaxel e 50 mg/m2 per
cisplatino) risulta avere un costo per ciclo pari a circa 55 euro, vale a dire 22 volte in meno il costo
trovato da SMC. Nel Costing template del NICE non sono riportati i costi per il paclitaxel e quindi non è
stato possibile avere una controprova.
Le analisi economiche presentate nei 2 report, proiettate alla nostra realtà sembrerebbero molto più
negative di quanto già visto in precedenza [15].
Il rapporto di HTA della Autorità Sanitaria Francese (HAS; Haute Autorité de Santé) [16] esprime parere
favorevole al rimborso del farmaco per l'indicazione in esame. Per quanto riguarda il giudizio in merito al
valore terapeutico, l’agenzia ha attribuito un miglioramento (Amélioration du Service Médicale Rendu,
ASMR) di livello IV (minore).
* Il report HTA francese classifica il beneficio terapeutico apportato dal trattamento su una scala da I a V, dove I è
considerato un beneficio significativo mentre V rappresenta l'assenza di miglioramento.
Referenza
SMC
[14]
Metodologia /
tipo di analisi
Analisi di costo
utilità, Modello
di Kaplan-Meier
Confronti
1)
topotecan+cisplatino
VS cisplatino
2)
topotecan+cisplatino
VS paclitaxel +
cisplatino
(confronto indiretto)
Nazione
/ punto
di vista
Scozia /
SSN
Pazienti / time horizon
Misura
efficacia
/ misura
di costo
Risultati
pz con carcinoma cervice uterina
recidivante dopo radioterapia e
allo stadio IVB:
1) distinguendo tra le pz cisplatino
naive e le pz SCFI
2) pz cisplatino naive nel braccio
cisplatino/topotecan VS pz che
hanno ricevuto precedentemente
chemioradioterapia (non
necessariamente cisplatino) nel
braccio cisplatino/paclitaxel
QALY /
Costi
diretti
sanitari
l'associazione
topotecan/cisplatino risulta
costo-efficace confrontata
col solo cispaltino per le
pazienti cisplatino naive
QALY /
Costi
diretti
sanitari
l'associazione
topotecan/cisplatino non è
raccomandata come utilizzo
di terapia costo-efficace
pz con carcinoma cervice uterina
recidivante dopo radioterapia e
allo stadio IVB:
1)
1) distinguendo tra le pz cisplatino
topotecan+cisplatino
naive e le pz SCFI
Analisi di costo
VS cisplatino
time horizon 36 mesi
NICE
utilità,
2)
UK / SSN
2) pz cisplatino naive nel braccio
[15]
analisi di costo
topotecan+cisplatino
cisplatino/topotecan VS pz che
efficacia
VS paclitaxel +
hanno ricevuto precedentemente
cisplatino
chemioradioterapia (non
(confronto indiretto)
necessariamente cisplatino) nel
braccio cisplatino/paclitaxel
time horizon 24 mesi
SCFI: pz con un intervallo di tempo libero da cisplatino di almeno 180 giorni all'entrata in studio
Analisi economiche
Non sono disponibili analisi economiche per l'indicazione oggetto di valutazione.
Popolazione target
Non è stato possibile reperire dei dati epidemiologici precisi per il Veneto, pertanto si è proceduto ad una
stima della popolazione eleggibile utilizzando quanto riportato nel registro tumori [2] e attraverso le
stime del report di HAS [16]. Per la popolazione femminile complessiva per il Veneto (e quindi per il
denominatore) invece si è utilizzato il sito della Regione in cui vengono riportate le statistiche regionali
[17]. Riportiamo di seguito i passaggi logici utilizzati per le stime.
1) Sul sito della Regione si è visto che la popolazione femminile (tutte le classi di età) era uguale a
2.492.285.
2) Sul sito del registro tumori invece si è vista che l'incidenza del tumore alla cervice era di 8,6 x
100.000; pertanto alla luce di questo dato si è calcolata un incidenza complessiva per il carcinoma
uguale a (2.492.285 x 8,6)/100.000 = 214 casi incidenti in un anno (approssimato per difetto).
3) Dal sito di HAS si sono presi tutti i passaggi logici (bene spiegati nel report) attraverso cui l'Ente
Francese ha provveduto a fare la stima delle pazienti con carcinoma alla cervice recidivante alla
radioterapia o che fossero nello stato IVB. HAS utilizzando dati di letteratura e il parere di esperti, ha
stimato che:
a. il 5% delle pazienti fossero in stadio IV e che tutte quelle in questo stadio fossero recidivanti;
b. il 10% delle pazienti fossero in stadio III e che 2/3 di queste (circa 67%) fossero recidivanti;
c. il 25% delle pazienti fossero in stadio II e che il 25% di queste fossero recidivanti;
d. il 60% delle pazienti fossero in stadio I e che tra il 10%-15% di queste fossero recidivanti.
Pertanto sostituendo la popolazione per il Veneto di 214 casi incidenti, con quella di HAS (di 3.387) e
utilizzando gli stessi passaggi logici si ha che:
a. Pazienti in stadio IVB e recidivanti = (214 x 5%) = 11.
b. Pazienti in stadio III e recidivanti = (214 x 10% x 67%) = 14.
c. Pazienti in stadio II e recidivanti = (214 x 25% x 25%) = 13.
d. Pazienti in stadio I e recidivanti (minimo) = (214 x 60% x 10%) = 13 .
e. Pazienti in stadio I e recidivanti (massimo) = (214 x 60% x 15%) = 19.
Si stima dunque che le pazienti eleggibili in un anno potrebbero essere comprese all'incirca tra 51 e 57.
Inoltre da quanto emerso l'incidenza per questo tipo di tumore sembra essere in continuo e costante calo
alla luce della crescente attenzione per la prevenzione dello stesso.
Analisi dei costi (costi delle alternative, potenziale impatto di budget etc.)
Tra le alternative proposte per la cura del carcinoma recidivante della cervice uterina o in stadio avanzato
IVB l'associazione topotecan + cisplatino si presenta come la soluzione terapeutica più ad alto costo e
proporzionalmente con maggior spreco calcolato. Per il calcolo dello scarto di ogni farmaco, infatti, si è
ipotizzato di usare la quantità strettamente correlata al dosaggio da somministrare e di scartare il resto
del flacone secondo indicazione da scheda tecnica, per cui i prodotti chemioterapici in questione devono
essere infusi subito dopo l'apertura e la cui qualità microbiologica non viene assicurata a distanza di ore.
Questo discorso è valido nel momento in cui la struttura ospedaliera non sia attrezzata per
somministrazioni concomitanti o consecutive in vari pazienti anche per indicazioni diverse da quelle in
esame, ammortizzando in tal modo gli sprechi.
Si ricorda che i dosaggi considerati per il calcolo dei costi della tripletta ifosfamide + cisplatino +
paclitaxel, riportata nell'elenco regionale degli oncologici ad alto costo, variano leggermente dai dosaggi
utilizzati nello studio di riferimento. Si calcolano i costi all'ospedale per ciclo di terapia e per 6 cicli che è
la massima durata di trattamento riportata nel trial di Monk [6].
Principio attivo
Dosaggio
Costo
all'ospedale per
ciclo di terapia
Costo
all'ospedale per
6 cicli di terapia
topotecan: 0,75
mg/m2 nei giorni 1,2,3
topotecan ev.* +
cisplatino: 50 mg/m2
€ 681,52
€ 4089,12
cisplatino**
nel giorno 1
ogni 21 giorni
paclitaxel: 135 mg/m2
(infusione lenta nelle
24 ore del giorno 1)
paclitaxel** +
€ 55,43
€ 332,58
cisplatino: 50 mg/m2
cisplatino**
(subito dopo il
paclitaxel)
ogni 21 giorni
vinorelbina: 30 mg/m2
nei giorni 1 e 8
vinorelbina** +
cisplatino: 50 mg/m2
€ 158,88
€ 953,28
cisplatino**
nel giorno 1
ogni 21 giorni
gemcitabina: 1g/m2
nei giorni 1 e 8
gemcitabina +
€ 219,16
€ 1314,96
cisplatino: 50 mg/m2
cisplatino**
nel giorno 1
ogni 21 giorni
ifosfamide: 5000 mg
(IC, 24 ore) nel giorno
1
ifosfamide* +
paclitaxel: 175 mg/m2
paclitaxel** +
€ 147,74
€ 886,44
nel giorno 2
cisplatino** (TIP/c)
cisplatino: 75 mg/m2
nel giorno 2
ogni 21 giorni
*prezzo ex-factory iva esclusa, fornito da ditta produttrice (listino marzo 2010)
** per cisplatino, paclitaxel, vinorelbina sono stati considerati i prezzi da gara regionale
Il prezzo della gemcitabina è al 50% iva esclusa (da banca dati Farmadati, marzo 2010)
Spreco
per ciclo
Note
€
445,47
-Per il calcolo del dosaggio è stata considerata
una superficie corporea di 1,8m2
-Ipotizzando di non recuperare il disavanzo delle
confezioni si sprecano 2,65 mg di topotecan e
10 mg di cisplatino per somministrazione
€ 9,57
-Per il calcolo del dosaggio è stata considerata
una superficie corporea di 1,8m2
-Ipotizzando di non recuperare il disavanzo delle
confezioni i si sprecano 57 mg di paclitaxel e 10
mg di cisplatino per somministrazione
€ 16,77
€ 21,9
€ 14,69
-Per il calcolo del dosaggio è stata considerata
una superficie corporea di 1,8m2
-Ipotizzando di non recuperare il disavanzo delle
confezioni si sprecano 12 mg di vinorelbina e 10
mg di cisplatino per somministrazione
-Per il calcolo del dosaggio è stata considerata
una superficie corporea di 1,8m2
-Ipotizzando di non recuperare il disavanzo delle
confezioni si sprecano 400 mg di gemcitabina e
10 mg di cisplatino per somministrazione
-Per il calcolo del dosaggio è stata considerata
una superficie corporea di 1,8m2
-Ipotizzando di non recuperare il disavanzo delle
confezioni si sprecano 15 mg di cisplatino e 85
mg di paclitaxel per somministrazione; nessuno
scarto, invece, per l'ifosfamide
Bibliografia
1. Riassunto delle caratteristiche del prodotto (accesso del 26/1/2010)
2. www.registri-tumori.it (accessi 28/1/2010, 23/3/2010)
3. www.registrotumoriveneto.it (accesso del 28/1/2010)
4. Eifel P.J., Nat Clin Prat Oncol. 2006 May; 3(5): 248-55
5. Moore et al., J Clin. Oncol. 2004 Aug; 22(15): 3113-19
6. Monk et al., J Clin. Oncol. 2009 Oct 1; 27(28): 4649-55
7. Mountzios et al., Ann Oncol 2009 Aug; 20(8): 1362-8
8. www.nccn.org (v.1.2010) (accesso del 26/1/2010)
9. www.guideline.gov (accesso del 26/1/2010)
10. Long HJ 3rd et al., J Clin. Oncol. 2005 Jul; 23(21): 4626-33
11. Monk BJ. et al., J Clin. Oncol. 2005 Jul; 23(21):4617-25
12. www.clinicaltrials.gov (accesso del 27/1/2010)
13. www.agenziafarmaco.it (accesso del 27/1/2010)
14. www.scottishmedicines.org.uk (accesso del 28/1/2010)
15. www.nice.org.uk (accesso del 28/1/2010)
16. www.has-sante.fr (accesso del 28/1/2010)
17. http://statistica.regione.veneto.it (accesso del 23/3/2010)
SINTESI
Caratteristiche del prodotto
L’attività antitumorale di topotecan comporta l’inibizione della topoisomerasi-I, un enzima strettamente
coinvolto nella duplicazione del DNA, in quanto allenta la tensione torsionale generata davanti alla forcella
di replicazione in movimento. Topotecan, che è un analogo semisintetico dell'alcaloide camptotecina,
inibisce la topoisomerasi-I mediante la stabilizzazione del complesso covalente tra l’enzima e il filamento
interrotto di DNA.
Nella formulazione endovena per l'indicazione del trattamento del cancro alla cervice uterina, in
associazione a cisplatino, la dose iniziale raccomandata di topotecan è di 0,75 mg/m²/die somministrata
come infusione endovenosa giornaliera della durata di 30 minuti nei giorni 1, 2 e 3. Il cisplatino viene
somministrato come infusione endovenosa nel giorno 1 alla dose di 50 mg/m²/die e dopo la
somministrazione della dose di topotecan. Questo schema di trattamento è ripetuto ogni 21 giorni per 6
cicli o fino alla progressione della malattia. Prima della somministrazione del primo ciclo di topotecan, i
pazienti devono avere un valore di base della conta dei neutrofili ≥ 1,5 x 109/l/die, una conta delle
piastrine ≥ 100 x 109/l ed un livello di emoglobina ≥ 9 g/dl (dopo trasfusione, se ritenuta necessaria).
Inquadramento della patologia
Il cancro cervicale è essenzialmente una malattia trasmessa sessualmente. L'infezione da papillomavirus
umano (HPV) e lo sviluppo di una neoplasia cervicale sono fortemente associati. L'infezione da HPV è
legata a tutti i gradi di neoplasia cervicale intraepiteliale (CIN) e al cancro invasivo della cervice. Le
cellule precursori (displasia cervicale, CIN) si trasformano in un cancro cervicale invasivo nel corso di
molti anni. Il carcinoma a cellule squamose invasivo, di solito resta localizzato e si diffonde in sede locoregionale per un considerevole periodo di tempo; le metastasi a distanza si verificano tardivamente. A
partire dai dati del Registro Tumori della regione Veneto del 2003 si può stimare che mediamente in tutto
il Veneto si verifichino ogni anno circa 22000 nuovi casi di tumore nella popolazione adulta e il tumore
all'utero, quindi anche della cervice uterina, rientra tra le prime quattro sedi che colpiscono
principalmente la popolazione femminile: si stimano, infatti, 671 casi/anno (età>14 anni) nella regione
Veneto. Inoltre, nella fascia d'età della donna compresa tra i 50 e i 60 anni, il tumore all'utero appare
essere la terza sede più frequente di tumore dopo mammella e colon-retto, con una incidenza del 6-7%
(circa 340 casi per anno). Secondo un recente rapporto dell'AIRTUM la stabile tendenza alla diminuzione
della mortalità per tumore in Italia, al netto dell'invecchiamento della popolazione confermata per i
tumori di utero, mammella, retto e la ripresa del calo di incidenza dei tumori della cervice uterina,
rappresentano i risultati più significativi a testimonianza dell'importanza di una solida cultura della
prevenzione attiva.
Trattamenti alternativi
Secondo parere clinico, lo standard attuale di trattamento della malattia avanzata in prima linea è
rappresentata da radioterapia + cisplatino.
Nelle pazienti che recidivano si usano oramai le associazioni di chemioterapici: paclitaxel + cisplatino,
considerato un possibile trattamento alternativo da trial clinico; altre associazioni che comprendono
cisplatino + vinorelbina, cisplatino + gemcitabina e cisplatino + topotecan (in esame) sono state
confrontate insieme a quella appena citata. Nessuno di essi è registrato in Italia per l'indicazione
terapeutica specifica del tumore avanzato o recidivante della cervice uterina; solo la vinorelbina riporta
l'estensione di indicazione nell'elenco AIFA dei farmaci con uso consolidato per il trattamento dei tumori
solidi nell'adulto. Si riporta un'altro soluzione terapeutico presente nell'elenco regionale per i farmaci
oncologici ad alto costo per il cancro alla cervice uterina: l'associazione a tre ifosfamide + paclitaxel +
cisplatino.
Linee guida di trattamento esistenti
Le linee guida NCCN (v.1.2010) raccomandano l'associazione topotecan + cisplatino, con categoria
2A, nel trattamento in prima linea di pazienti affette da cancro della cervice uterina in stadio avanzato
IVB o recidivante in sedi multiple se sono già state esposte precedentemente all'utilizzo di
cisplatino in monoterapia, a fianco di altre tre associazioni:
paclitaxel/cisplatino (categoria 1)
carboplatino/paclitaxel (categoria 2A)
cisplatino/gemcitabina (categoria 2B)
Le linee guida NGC, propongono per le donne di stadio IVB o con carcinoma alla cervice recidivante
l'utilizzo di chemioterapici in associazione:
cisplatino + topotecan preferibilmente per pz con PS 0-2 e limitatamente ai pz naïve all'utilizzo
precedente di cisplatino (grado di raccomandazione B)
cisplatino/paclitaxel (grado di raccomandazione B)
Dati di efficacia
Il recente trial di Monk confronta tra loro quattro associazioni: paclitaxel/cisplatino (PC) vs
vinorelbina/cisplatino (VC), gemcitabina/cisplatino (GC), topotecan/cisplatino (TC). Sebbene quasi la
totalità dei risultati sopra esposti sia non statisticamente significativo, possiamo ricavare comunque
alcune importanti informazioni: VC, GC e TC non sono superiori al PC in termini di risposta antitumorale,
sopravvivenza media e progressione libera da malattia e, inoltre, la differenza nella sopravvivenza media
emersa dal PC rispetto agli altri tre bracci è un valore comunque da considerare nella pianificazione di un
trattamento e nella progettazione di eventuali trial futuri. La complessa analisi sui fattori prognostici ha
mostrato che l'età non era significativa in questi dati. Il PS della pz, invece, è apparso essere il fattore
prognostico più forte scoperto per OS e PFS. E' anche possibile che una precedente esposizione della
paziente al cisplatino sia associato ad un aumento di rischio di morte, come indicato in altri studi, ma tale
relazione non sembra essere così rilevante in questa analisi.
Dati di sicurezza
Dal trial principale EMEA emergono eventi legati alla mielosoppressione più frequenti e più severi nel
braccio CT rispetto a quello CPT, e che son stati la ragione più comune di alcuni ritardi nella
somministrazione dei cicli successivi di chemioterapia. La trombocitopenia è un comune evento avverso
della terapia di combinazione cisplatino/topotecan ed ha il potenziale di condurre a complicazioni in
termini di sanguinamenti/emorragie fatali e dunque, il rischio di emorragie dovrebbe essere preso in
considerazione quando si sceglie di sottoporre un paziente a tale trattamento.
Tra le tossicità non ematologiche, anche i disturbi cardiovascolari sono stati significativamente più alti tra
i pz del braccio CT rispetto al braccio CPT.
Anche nel recente trial di Monk si registra il peggior profilo di sicurezza a carico della coppia topotecan +
cisplatino, specialmente a livello ematologico. Il miglior profilo, invece, tra le 4 associazioni a confronto lo
dimostra gemcitabina + cisplatino.
Indicazione studi in corso
Nel Registro Governativo americano sono in corso due studi. Il primo randomizza in aperto le pazienti
affette da carcinoma persistente, recidivante dopo radioterapia o di stadio avanzato IVB a 4 bracci di
trattamento in cui si confronta la sopravvivenza globale delle pz trattate con paclitaxel in combinazione
con cisplatino o topotecan vs l'aggiunta di bevacizumab a tali associazioni. Il secondo trial descritto
prevede, invece, il trattamento della stessa categoria di pazienti con idralazina valproato e magnesio
valproato aggiunti all'associazione cisplatino + topotecan vs placebo. Prospettive di termine studi
rispettivamente negli anni 2011 e 2010.
Altri report HTA
Lo Scottish Medicine Consortium ha deciso di autorizzare l'utilizzo dell'associazione topotecan/cisplatino
per le pazienti con carcinoma della cervice uterina recidivante dopo radioterapia e per le pazienti con
stadio IVB della patologia. Secondo l'organo scozzese il suo utilizzo deve essere limitato a quelle pazienti
che non sono mai state precedentemente esposte a cisplatino nella chemioradioterapia.
Il NICE raccomanda l'utilizzo di topotecan in associazione con cisplatino nel trattamento di cancro alla
cervice uterina recidivante o di stadio IVB solo per donne che non hanno precedentemente ricevuto
cisplatino. Coloro che in passato l'avessero già ricevuto e che al momento sono in trattamento con
l'associazione topotecan/cisplatino dovrebbero avere la possibilità di continuare la terapia fino a che non
si reputi appropriato terminarla. Il parere è stato positivo nonostante la terapia non sembra sse Costo-
Efficace perché si considerava un gruppo molto ristretto di pazienti (tra 40 e 60 in un anno per Inghilterra
e Galles insieme), con una sopravvivenza inferiore ai 24 e per i quali l'utilizzo di topotecan garantiva una
sopravvivenza aggiuntiva maggiore di 3 mesi rispetto all'alternativa.
Il rapporto di HTA della Autorità Sanitaria Francese (HAS; Haute Autorité de Santé) esprime parere
favorevole al rimborso del farmaco per l'indicazione in esame.
Analisi economiche
Non sono disponibili analisi economiche per l'indicazione oggetto di valutazione.
Popolazione target
Non essendo presente in letteratura, alcun documento epidemiologico che permetta di individuare
chiaramente il numero di pazienti potenzialmente eleggibili in Veneto con il topotecan, cioè i pazienti con
carcinoma alla cervice recidivante alla radioterapia o in stadio IVB, sulla base di quanto riportato nel
report di HTA francese di HAS, delle stime di incidenza presenti nel sito dei Registri Tumori Italiani e dei
dati sulla numerosità della popolazione femminile in Veneto, presenti sul sito della Regione, si è stimata
una popolazione eleggibile compresa tra circa 51 e 57 pazienti. Inoltre da quanto emerso nei Registri
Tumori, il carcinoma sembra essere in costante calo.
Analisi dei costi (costi delle alternative, potenziale impatto di budget etc.)
Tra le alternative disponibili per la cura del carcinoma recidivante della cervice uterina o in stadio
avanzato IVB, l'associazione topotecan + cisplatino si presenta come la soluzione terapeutica con costo
più alto (681 € per ciclo) e proporzionalmente con maggior spreco calcolato (445€ per ciclo).
Bibliografia
18. Riassunto delle caratteristiche del prodotto (accesso del 26/1/2010)
19. www.registri-tumori.it (accessi 28/1/2010, 23/3/2010)
20. www.registrotumoriveneto.it (accesso del 28/1/2010)
21. Eifel P.J., Nat Clin Prat Oncol. 2006 May; 3(5): 248-55
22. Moore et al., J Clin. Oncol. 2004 Aug; 22(15): 3113-19
23. Monk et al., J Clin. Oncol. 2009 Oct 1; 27(28): 4649-55
24. Mountzios et al., Ann Oncol 2009 Aug; 20(8): 1362-8
25. www.nccn.org (v.1.2010) (accesso del 26/1/2010)
26. www.guideline.gov (accesso del 26/1/2010)
27. Long HJ 3rd et al., J Clin. Oncol. 2005 Jul; 23(21): 4626-33
28. Monk BJ. et al., J Clin. Oncol. 2005 Jul; 23(21):4617-25
29. www.clinicaltrials.gov (accesso del 27/1/2010)
30. www.agenziafarmaco.it (accesso del 27/1/2010)
31. www.scottishmedicines.org.uk (accesso del 28/1/2010)
32. www.nice.org.uk (accesso del 28/1/2010)
33. www.has-sante.fr (accesso del 28/1/2010)
34. http://statistica.regione.veneto.it (accesso del 23/3/2010)