Mimetismo molecolare
Applicazioni diagnostiche e terapeutiche
Anziana memoria
Seguendo le nostre metafore, risulta inevitabile
incontrare un altro paradosso immunologico, che da
molto tempo affascina i clinici e i ricercatori: gli effetti
dell’invecchiamento sul sistema linfocitario.
Sebbene sia stato ampiamente documentato, che le
cellule B e T perdano la loro abilità nel rispondere agli
stimoli antigenici e mutagenici con l’età, tuttavia è
stato osservato che la frequenza, con la quale
compaiono fenomeni autoreattivi è più alta rispetto ai
soggetti giovani.
TeB
Nell’anziano diminuiscono i linfociti T naïve e
le sottopopolazioni B (in particolare i B-CD5).
Ma si osserva anche un aumento delle risposte
autoimmuni dovuto a un cambiamento nel
repertorio B e/o a processi di induzione della
tolleranza.
Tali spiegazioni rispecchiano un atteggiamento
deduttivo, che male si adatta alle metafore
immunologiche.
Memoria come malattia
Spostando
l’interesse
verso
un
modello
immunopatologico uniforme, alcuni autori hanno
posto l’accento sul ruolo svolto dalle memorie
linfocitarie, soprattutto quelle generate in un passato
lontano, anche remoto.
Tali memorie svolgono una funzione critica nella
genesi dell’autoimmunità, in quanto possono essere
riattivate da molteplici fattori, tra i quali la perdita
delle integrità tissutali, con presentazione di autoantigeni, che esasperano la tolleranza, mediante il
mimetismo molecolare.
Malattia come memoria
In base a questo modello, dunque, la memoria
linfocitaria assume un ruolo critico nella genesi delle
malattie autoimmuni.
Un esempio: i pazienti con myastenia gravis producono
risposte
contro
i
recettori
dell’acetilcolina,
determinando debolezza muscolare debilitante.
Nel 60% dei casi, circa, i soggetti mostrano i primi
sintomi dopo i 40 anni, a seguito di una riattivazione
delle risposte conseguite in epoche precedenti.
Malattia come risposta
La memoria dei linfociti non può essere
considerata una traccia inerte del passato, con
la quale apprendiamo che una infezione è stata
superata e che a un nuovo contagio l’individuo
risponde con maggiore prontezza ed efficacia.
Le cellule T di memoria, infatti, durante e
dopo una risposta, possono promuovere
condizioni
immunopatologiche
anche
evolutive.
Campylobacter
Le varie specie di campylobacter (jejuni,
fetus, coli, lardis) sono responsabili di
molte forme di enterocolite: tra queste il
jejuni è di gran lunga il più frequente.
Il periodo di incubazione varia dai 3 ai 5
giorni (con un rango complessivo da 1 a
10).
Evoluzione
Di solito la sintomatologia diarroica si
esaurisce in 1-4 giorni, ma in alcuni
pazienti possono insorgere complicazioni
a breve e lungo termine, tra cui una
sindrome simil-tifoide, l’artrite reattiva e, in
una piccola percentuale di casi,
convulsioni febbrili e meningite.
Sorgenti di infezione
Il microrganismo può essere escreto con le feci fino a 7
settimane dopo la scomparsa dei sintomi.
Le fonti di maggiore contaminazione sono
rappresentate dagli alimenti, tra cui l’acqua, il latte e il
cibo in generale (soprattutto il pollame, per l’elevata
temperatura corporea, che ne favorisce la
moltiplicazione).
Fonti non infrequenti possono essere gli animali
domestici, quali cani, bestiame e volatili, attraverso il
materiale fecale.
Forme cliniche
L’incidenza maggiore di questa infezione
viene raggiunta nei mesi estivi.
Le forme asintomatiche sono molto
comuni, soprattutto nei paesi in via di
sviluppo. I portatori cronici sono stimati
nell’ordine dello 0,5% della popolazione
generale.
Patogenesi
Le feci liquide sono dovute alla secrezione di liquido
isotonico da parte del piccolo intestino, la quale eccede
le capacità di riassorbimento a valle.
A questo proposito, almeno due tossine sono implicate
nel meccanismo patogenetico, l’enterotossina (labile al
calore e simile a quella di e.coli), non elaborata da tutti
i ceppi, e la verotossina (shigella-simile e coli-simile)
isolata dai pazienti con diarrea e responsabile dei
fenomeni ulcerativi che si riscontrano nelle
campylobacteriosi.
Manifestazioni cliniche
La più comune è data dalla diarrea acquosa, con
feci verdi, occasionalmente accompagnata a
dolore addominale, malessere generale e febbre.
L’infezione è, generalmente, autolimitante, ma
i bambini e le persone anziane possono andare
incontro a disidratazione.
I pazienti immunocompromessi manifestano
diarrea cronica.
Sintomi da campylobacter jejuni (Epidemiology Bulletin State Of Alaska No.
23
September 16, 1983 Campylobacter: An Enteric Organism Worth considering
Insorgenza rapida di febbre, malessere, cefalea e mialgia
Comparsa di sintomi intestinali: nausea, vomito, crampi
addiminali e perdita di appetito
Entro le 24 ore compare la diarrea: feci acquose, spesso con
presenza di muco, sangue e verdi (per la presenza di bile).
I sintomi possono durare da 2 giorni ad alcune settimane
(raramente oltre le 3)
Il 25% dei casi mostra una recidiva.
Le complicazioni più importanti sono rappresentate da:
artrite reattiva, spondiloartrite e GBS.
Mai visto un caso peggiore di
diarrea
Il pensiero è: perchè la sindrome di
G-B insorge dopo una infezione da
campylobacter jejuni?
Jean-Baptiste Carpeaux
Head of Ugolino (AICT)
LPS di C. jejuni stimolano una
risposta immunitaria indirizzata
anche contro i gangliosidi, per
mimetismo molecolare
Gangliosides
Sindrome di G-B
Poliradiculoneuropatia
demielinizzante acuta periferica,
grave, a evoluzione rapida e di
origine
SUBTIPO
CARATTERISCHE
CLINICHE
EMG
ANATOMIA
PATOLOGICA
Polineuropatia
demielinizzante
infiammatoria acuta.
PDIA
Soprattutto adulti; recupero
rapido, anticorpi antianti-GM1
Demielinizzante.
Attacco iniziale nelle
cellule di Schwann;
lesione diffusa della
mielina, attivazione dei
macrofagi e infiltrazione di
linfociti
Neuropatia assonale
motoria acuta
NAMA
Bambini e adulti giovani;
recupero rapido; antianti-GD1a
Assonale
Attacco iniziale nei noduli
motori di Ranvier,
abbondanti macrofagi
periassonali
Neuropatia assonale
sensitivosensitivo-motoria
aguda.
(NASMA)
Principalmente adulti,
recupero lento e incompleto
Assonale
Simile a NAMA, con
interessamento maggiore
dei nervi e delle radici
sensitive; lesione
assonale intensa
Sindrome di M. Fisher.
(SMF)
Adulti e bambini; rara;
oftalmoplejia, atassia e
areflessia; antianti- GQ1b.
Demielinizzante
Caratteristiche simili a
PDIA.
Quadro clinico
Parestesie a progressione ascendente, simmetrica
Areflessia
Dolore: paravertebrale, artromialgie, assiale.
Síntomi sensitivi poco evidenti: parestesie distali
Paralisi facciale bilaterale
Possibile coinvolgimento della deglutizione,
respirazione, etc.
Variante clinica di Miller-Fisher
Oftalmoplegia
Areflessia
Atassia
Campylobacter e celiachia
Uno degli esempi più studiati, nell’ambito del
mimetismo molecolare è il ruolo della risposta mnesica
al campylobacter jejuni, nella genesi di diverse
condizioni patologiche.
Tra queste, molto interessante, è la celiachia. Tale
forma di enteropatia, che si esprime con alterazioni
nella mucosa del piccolo intestino, è dovuta a fattori
immunogenetici individuali (prediposizione HLA-DQ2
e/o HLA-DQ8) e ambientali.
Mimetismo e celiachia
L’aspetto ambientale della celiachia è legato al
mimetismo molecolare, peraltro ben studiato,
tra particolari agenti infettivi e glutine, con il
tramite degli enterociti, che presentano
ambedue gli antigeni ai linfociti attivati.
Le cellule T, memorizzando la risposta a virus e
batteri, svolgono una funzione citotossica
sull’epitelio mucoso dell’intestino, da cui
deriva la sintomatologia celiaca in senso lato.
Neuro-celiachia
Tra i disturbi, va considerata la possibilità di un
coinvolgimento neurologico di natura autoimmune,
che si manifesta a livello dei gangliosidi, ossia di
glicosfingolipidi, abbondantemente espressi nel sistema
nervoso periferico, compreso quello presente nel tratto
gastro-intestinale.
Alcune osservazioni concordano sulla possibilità che la
risposta linfocitaria agli agenti infettivi dell’intestino
svolga un ruolo fondamentale nella evoluzione della
celiachia, anche attraverso uno stato di autoimmunità
anti-gangliosidi.
Neuropatia periferica
Il campylobacter jejuni, negli individui
predisposti (DQ2-DQ8), può stimolare una
risposta attiva nei confronti degli enterociti.
Gli enterociti presentano antigeni simili tra
glutine e batterio, ma anche nei confronti delle
porzioni simili dei gangliosidi, le cui estreme
conseguenze si evidenziano con atrofia dei villi
(celiachia) e con alterazioni delle fibre nervose
(neuropatie periferiche).
Anti-GM1 nella celiachia
In questi casi, è stato osservato che la gliadina è
in grado di legare molecole di GM1, peraltro
molto espresse alla superficie dell’epitelio
intestinale, determinando una risposta antiganglioside, insieme a quella anti-gliadina.
In pratica, la gliadina funziona da aptene nei
confronti di GM1, in modo del tutto
indipendente dal ruolo svolto dalle
transglutaminasi.
Immunogenetica della
celiachia
• Aplotipo ancestrale A1-B8-DR3-DQ2
• Si può accompagnare a manifestazioni cutanee
(dermatite herpetiforme) e neurologiche (sindrome
cerebrale, neuropatia periferica)
• Legata a risposta linfocitaria verso glutine contenuto in
grano, orzo e segale
• Risposta Th1, con atrofia dei villi (anti-gliadina e antitransglutaminasi)
28
Celiachia e adenovirus
Sequenza di 12 AA in comune tra adenovirus 12 E1B e
peptide A gliadina del grano (sequenza virale 384-395)
Esposizione a Ad 12 sensibilizza l’individuo alla
gliadina
Il meccanismo effettore è rappresentato dalla presenza
di linfociti T reattivi sull’epitopo in comune
29
Ipotesi patogenetica della celiachia
Infezione da
adenovirus
gliadina
Legame con HLA di
classe II (DQ2-DQ8)
Attivazione
linfociti T
gamma/delta
Legame con
TG
ENTEROPATIA
Mimetismo molecolare tra
gliadina e superantigeni batterici
30
Recettori adenovirus
La subunità CD51 della integrina αV mostra diverse
funzioni (recettore adenovirale e angiogenesi)
CD46 è il recettore di Ad11 (soprattutto nelle
patologie dell’occhio), Ad3, Ad35, Ad37, insieme al
virus del morbillo, HHV-6, streptococcus e neisseriae
Tutte le specie di adenovirus (eccetto il B) utilizzano il
CAR, come recettore
31
ADENOVIRUS
Adesione via CAR,
internalizzazione via integrine
33
ANTI-CD51
•applicazione della 30LM nella terapia delle risposte immunitarie
specifiche
•uso delle soluzioni idroalcooliche, per la possibilità della
dinamizzazione
•frequenza di assunzione giornaliera, nella misura di una volta al
giorno
•quantità minima: due gtt/nebulizzazioni/cc
•periodo di 2 mesi
•uso delle potenze ascendenti, per inibire la funzione e delle
potenze discendenti, per stimolare una funzione
ANTI-CD51
34
Miller Fischer
La sindrome di Miller Fischer, caratterizzata da atassia,
areflessia tendinea e oftalmoplegia è stata descritta per
la prima volta, dagli autori, nel 1956.
È una patologia acuta, auto-limitante, ma con pochi
dati osservazionali.
Può essere associata alla risposta ad agenti infettivi o a
malattia autoimmuni e tumorali, con evidenze
radiologiche e immunologiche, che suggeriscono un
coinvolgimento sia centrale, sia periferico.
Anti-gangliosidi
Più comunemente, si evidenziano anti-gangliosidi IgG
del tipo anti-GQ1b, i quali mostrano una interessante
reattività crociata con antigeni di campylobacter jejuni
ed Haemophilus influenzae.
In ambedue i casi infettivi, è comunque la memoria
immunitaria a svolgere un ruolo patogenetico
rilevante, nella genesi della sindrome, la quale sembra
dovuta
ad
alterazioni
della
trasmissione
neuromuscolare, dovuta all’azione citotossica dei
linfociti T specifici, sulla base del mimetismo
molecolare.
VacA di HP
Alcuni autori hanno dimostrato, nella
sindrome di Miller Fischer, la presenza di una
risposta indirizzata contro la VacA (citotossina
vacuolizzante), espressa da Helicobacter pylori.
In uno studio condotto su 12 pazienti, è stata
osservata la presenza di anticorpi IgG antiVacA nel liquido cerebro-spinale in 8 casi.
Caso clinico
Un uomo di 31 anni manifestò una neurite ottica 2 settimane
dopo un disturbo diarroico, seguito da molteplici alterazioni, quali
disartria, diplopia, atassia, parestesie e lieve disautonomia.
Risultarono nella norma la risonanza cerebrale e il liquido cefaleorachidiano.
Gli studi della conduzione nervosa erano inizialmente normali e
successivamen
e alterati, per una lieve riduzione dell’ampiezza sensoriale. Venne
ipotizzato, in questo caso, un mimetismo molecolare tra
gangliosidi GQ1b e campylobacter jejuni, risultando una risposta
su ambedue i determinanti antigenic.
Guillain-Barré
Associata al riscontro di anticorpi anti-gangliosidi, i
quali sono l’espressione di una memoria linfocitaria,
rivolta alle porzioni omologhe di agenti infettivi, quali
il campylobacter jejuni e, probabilmente, haemophilus
influenzae e mycoplasma pneumoniae.
Molto interessante l’osservazione, che il mimetismo
molecolare, di solito studiato su epitopi peptidici, nel
caso della sindrome di Guillain-Barrè può riguardare
anche strutture batteriche costituite da carboidrati.
Mielite trasversa
Una ragazza di 17 anni sviluppò i sintomi
di una mielite trasversa 7 giorni dopo
una infezione intestinale, dimostrata
dalla coprocoltura.
Raggiunse un alto titolo di anticorpi antiGM1,
parallelamente
agli
anticampylobacter.
CMV e EBV
Le polineuropatie demielinizzanti, dunque sono
classificate tra le malattie autoimmuni, innescate da
agenti infettivi, per mimetismo molecolare.
Oltre al campylobacter, sono stati considerati anche il
cytomegalovirus e il virus di Epstein-Barr.
Nel caso del CMV, i gangliosidi coinvolti sono i GM2,
associati alla sindrome di Guillain-Barré, come i GM1.
Interessante l’osservazione che i gangliosidi GM1 sono
simili a GD1a, tanto da indurre una reattività crociata
Malattie demielinizzanti
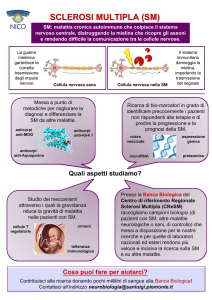
Una delle forme più comuni è la sclerosi multipla, la
quale può determinare perdita della visione, disturbi
motori e sensitivi e danno cognitivo.
Il decorso clinico assume un andamento alternante,
con fasi di remissione e riacutizzazione, oppure un
andamento progressivo, più grave
Sono state descritte anche forme miste. L’ipotesi del
mimetismo molecolare, indotto dallo stimolo infettivo,
concilia le diverse etiologie con un unico processo
patogenetico, mediato da linfociti specifici.
Mielina
La mielina è una sostanza che
riveste i nervi, con una funzione
molto vicina al rivestimento dei fili
elettrici (agendo come isolante) così
da impedire che l’impulso elettrico
si disperda, e assicurando una
conduzione efficiente degli impulsi
nervosi. Sono proprio la velocità e
l'efficienza con le quali questi
impulsi vengono condotti che
permettono
l'esecuzione
di
movimenti armonici, rapidi e
coordinati, con poco sforzo conscio.
Sintomi
I sintomi della SM sono molteplici.
La loro varietà dipende dal fatto che
le lesioni demielinizzanti (placche)
tipiche della malattia possono
colpire aree diverse del sistema
nervoso centrale (encefalo, midollo
spinale e nervo ottico). A seconda
della sua localizzazione, una placca
può causare per esempio un disturbo
motorio a un arto inferiore, un
problema di vista o un formicolio a
mano
e
braccio.
Epstein-Barr virus
EBV è uno dei più comuni agenti patogeni, con un forte
potenziale tumorigenico, nonostante rimanga silente e
persistente anche nella popolazione in apparente buona
salute, stabilendo un delicato equilibrio con il sistema
immunitario dell’ospite.
Negli individui con profilo immunogenetico predisponente,
il virus può indurre uno stato di autoimmunità, nel quale i
linfociti T citotossici aggrediscono la mielina, come è stato
osservato negli studi epidemiologici retrospettivi e
prospettici. Sono stati riscontrati, inoltre, significativi titoli
anticorpali anti-EBV nel siero e nel liquido cerebrospinale.
Importante
Secondo altri autori, anche i batteri intestinali
rappresentano un potenziale innesco infettivo, nei
confronti della sclerosi multipla.
Brain. 2005 Jul;128(Pt 7):1649-66. Epub 2005 May
4.Inflammation and primary demyelination induced
by
the
intraspinal
injection
of
lipopolysaccharide.Felts PA, et al.
J Nat Toxins. 2000 Aug;9(3):281-97.Cholera toxin and
related enterotoxins: a cell biological and
immunological perspective.de Haan L, Hirst TR.
HLA A3, B7, DR2
Ci sono almeno due componenti da considerare nelle
malattie
autoimmuni:
la
predisposizione
immunogenetica e gli elementi ambientali, che sono in
grado di stimolare una risposta da parte dei linfociti.
Tra
questi,
dobbiamo
ammettere
che
le
immunizzazioni da vaccino equivalgono alle infezioni,
nella induzione di una risposta, che in ambedue i casi
si indirizza sui costituenti del sé, per mimetismo
molecolare.
Questo fenomeno è ammesso anche per la sclerosi
multipla.
Immunizzazione HBV
Sulla base delle associazioni riportate da studi
osservazionali, tra vaccinazione per HBV e malattia
demielinizzante autoimmune, sono state osservate
somiglianze di sequenze aminoacidiche tra il piccolo
antigene di superficie (sHBsAg), la proteina basica della
mielina (MBP) e la glicoproteina mielinica degli
oligodendrociti (MOG).
Tali omologie possono determinare una reattività
crociata, tale da indurre una risposta autoimmune con
le strutture molecolari sopra menzionate, come è stato
osservato nel 29% dei soggetti vaccinati per HBV.
Polimerasi
Alcuni autori hanno evidenziato che le polimerasi
virali, anche se in concentrazione molto bassa, tale da
non poter avere un’azione enzimatica, possono essere
inavvertitamente prodotte nel vaccino ricombinante.
Tali enzimi hanno un forte potere immunogeno e un
mimetismo molecolare con la proteina basica della
mielina, tali da indurre una condizione di
autoimmunità, che rappresenta, potenzialmente, un
vero e proprio azzardo nella pratica vaccinatoria
corrente.
HBV e mielina
Un uomo di 46 anni, con alto titolo di HBsAg, ebbe tre
attacchi acuti di mielite trasversa demielinizzante, associata a
segni di irritazione meningea, ciascun episodio mostrò una
buona risposta alla terapia corticosteroidea.
Nel liquido cerebrospinale si riscontrarono elevati livelli di
HBsAg e di linfociti T helper inducer, con risposta specifica
nei confronti della proteina basica della mielina, durante le
fasi acute. I complessi immunocircolanti, costituiti da
anticorpi e antigeni virali, scomparvero dopo il trattamento,
insieme alla remissione dei sintomi.
Ciò indica la presenza di una risposta autoimmune sulla
mielina, innescata da HBV, per mimetismo molecolare.
Latte e mielina
Un altro aspetto interessante è la reattività crociata tra la
glicoproteina mielinica degli oligodendrociti (MOG: myelin
oligondendrocyte glycoprotein) e un dominio N-terminale
omologo della proteina di latte vaccino butirofillina.
È stata osservata, infatti, la presenza di anticorpi anti-butirofillina
nel siero e nel liquido cerebrospinale di pazienti con sclerosi
multipla, in percentuale superiore a quanto rilevato nei soggetti
sani.
In un interesante esperimento, dal significato profondamente
omeopatico, è stato dimostrato che il trattamento preventio con
butirofillina impedisce la perdita di mielina, nei topi infettati con
il virus della encefalite allergica.
HHV-6 e mielina
Anche HHV-6 (human herpes virus 6) può avere un
ruolo importante nella sclerosi multipla, come
suggeriscono gli studi condotti su base immunologica e
molecolare, soprattutto nelle fasi di riacutizzazione
della forma ad andamento alternante (relapsingremitting).
È stata trovata, infatti, una sequenza omologa tra la
proteina basica della mielina (residui 96-102, che
risultano determinanti autoantigenici) la proteina U24
del virus (residui 4-10).
Coronavirus 229E e mielina
Osservazioni analoghe sono state riportate a proposito
del coronavirus 229°.
Studiando i linfociti T di 16 pazienti con sclerosi
multipla, attivati verso la proteina basica della mielina,
è stata osservata un’alta reattività crociata anche verso il
coronavirus 229E, a differenza di quanto riscontrato
nei 14 soggetti del gruppo di controllo, in cui la
risposta anti-virus non agiva contro la mielina.
Altri agenti innescanti
Altri agenti infettivi, che sono stati considerati
nell’ambito del mimetismo molecolare con la mielina,
sono haemophilus influenzae (reattività crociata con
MAG), acynetobacter sp. e pseudomonas aeruginosa
(reattività crociata con MOG)
Olson JK, et al. Innate and adaptative immune
requirements for induction of autoimmune
demyelinating disease by molecular mimicry. Mol
Immunol 2004 Feb; 40(14-15): 1103-8.
SCLEROSI MULTIPLA
Costituzione HLA: DR2-DQ1
Innesco infettivo: mycoplasma e chlamydia
pneumoniae, campylobacter, borrelia, coli e proteus,
haemophilus, meningococco, HBV vaccino, morbillo
v., bordetella pert., helicobacter p. streptococcus spp.,
superantigeni, γ/δ linfoc.
Mimetismo molecolare: agenti infettivi e mielina
Malattia psorica evolutiva
55
Malattie demielinizzanti
Distruzione primitiva della mielina con cilindrasse integro
SOSTANZA BIANCA
Lesione occupante spazio a margini netti
Rigonfiamento mielina
distruzione
fagocitosi
gliosi
56
57
58
Placche attive
59
NORMALE CONDUZIONE
60
ANORMALE CONDUZIONE
61
RMN cervelletto
62
RMN del nervo ottico
63
RMN emisferi cerebrali
CEREBRUM
64