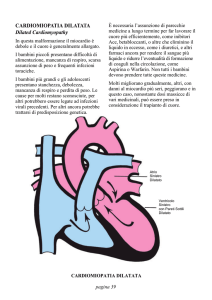
CARDIOMIOPATIE FELINE
Luca Ferasin
CLASSIFICAZIONE
Il termine cardiomiopatia identifica una malattia del miocardio per la quale non e’
possibile definire una causa determinante (malattia idiopatica). Nella diagnosi
differenziale di cardiomiopatia vengono escluse malattie congenite, patologie
miocardiche a carattere infiammatorio (miocardite) e tutte le forme di danni miocardici
secondari ad altre patologie (es ipertiroidismo, acromegalia, stenosi aortica, ipertensione
arteriosa) o a cause iatrogene (cardiomiopatie indotte da corticosteroidi).
Nel gatto, le cardiomiopatie possono presentarsi in forme estremamente diverse e, a
tutt’oggi, non esiste un consenso unanime tra cardiologi che definisca chiaramente i
criteri per una corretta classificazione. Nell’attivita’ clinica quotidiana, per motivi pratici
e didattici, le patologie idiopatiche del miocardio del gatto vengono classificate in base ai
rilievi ecocardiografici come forma “ipertrofica” (suddivisa in “ostruttiva” o “nonostruttiva”), “restrittiva”, “dilatativa” e “aritmogenica del ventricolo destro”. Tuttavia, le
anomalie ecocardiografiche non sempre rientrano nei criteri stabiliti per la diagnosi delle
forme “classiche” elencate sopra e si preferisce usare il termine “cardiomiopatia nonclassificata”.
Cardiomiopatia ipertrofica (Hypertrophic cardiomyopathy, HCM).
L’HCM e’ la malattia cardiaca piu’ comune nel gatto. E’ caratterizzata da ipertrofia
concentrica del miocardio in assenza di cause identificabili di sovraccarico pressorio
(pressure overload) come stenosi aortica e ipertensione sistemica. Altre cause di
ipertrofia miocardica da escludere sono: ipertiroidismo, acromegalia e recente
somministrazione di corticosteroidi.
L’eziologia dell’HCM e’ sconosciuta anche se, in una linea di gatti Maine Coon allevati
in California, e’ stato possibile idientificare l’ereditarieta’ della malattia. Alcune forme di
sospetta HCM ereditabile sono state descritte nell’ American Shorthaired, Ragdoll,
Norwegian Forest e British Shorthair. L’ipertrofia del miocardio comporta ridotta
distensibilta’ del ventricolo con consegente disfunzione diastolica.
La diagnosi ecografica di HCM viene supportata dalla presenza di ipertrofia del
ventricolo sinistro piu’ o meno accompagnata da ipertrofia del ventricolo destro. Un setto
interventricolare e/o una parete ventricolare sinistra con uno spessore uguale o superiore
a 6 mm in diastole vengono comunemente definiti “ipertrofici”. Le misure dovrebbero
essere ottenute da immagini del ventricolo sinistro in sezione trasversale ottenute in Mmode da una proiezione parasternale destra, con la linea di riferimento passante
simmetricamente tra i muscoli papillari. In casi di ipertrofia severa, ed in particolare nel
caso di ipertrofia pronunciata dei muscoli papillari, una scansione monomodale del
ventricolo sinistro non e’ possibile. In tal caso, le misurazioni dovrebbero essere eseguite
da registrazioni bi-modali a fine diastole. Per alcuni cardiologi, la presenza di ipertrofia
dei muscoli papillari o di segmenti della parte ventricolare o del setto o la completa
obliterazione del lume ventricolare al termine della sistole sono elementi sufficienti per
una diagnosi di cardiomiopatia ipetrofica. Un’altra anomalia ecocardiografica
comunemente osservate nei casi di HCM e’ la dilatazione atriale sinistra o, piu’
raramente, una dilatazione bi-atriale. L’ostruzione dinamica dell’outflow sinistro viene
osservata in circa il 40% dei casi di HCM (cardiomiopatia ipertrofica ostruttiva o
HOCM). L’ostruzione e’ in genere causata da una ipertrofia segmentale della parte
prossimale del setto interventricolare che interferisce con il getto sistolico in
corrispondenza dell’origine dell’aorta causando parziale ostruzione e turbolenza del
flusso. Un’ altra causa di ostruzione dinamica e’ rappresentata da un movimento anomalo
del lembo mitralico anteriore in sistole (systolic anterior motion o SAM). In presenza di
SAM, e’ possibile notare una lesione iperecogena dell’endocardio a livello della parte
prossimale del setto interventricolare, riferibile a tessuto fibroso cicatriziale causato dal
ripetitivo contatto del lembo valvolare con il setto. L’esatto meccanismo della SAM e’
sconosciuto, ma si ritiene possa essere causato dalla distorsione dell’apparato valvolare
mitralico a seguito dell’ipertrofia, in particolare a livello dei muscoli papillari. SAM e’
accompagnata da insufficienza mitralica all’inizio della sistole, rilevabile al colorDoppler o spectral Doppler. Un’altra tipicala anomalia rilevabile all’esame Doppler e’
l’inversione del rapporto E:A nel flusso transmitralico (E<A).
All’esame anatomopatologico, l’ipertrofia del ventricolo puo’ presentarsi in diverse
forme:
1) ipertrofia diffusa ed assimmetrica: queste forme coinvolgono porzioni del setto
interventricolare e la parete antero-laterale e posteriore del ventricolo;
2) ipertrofia segmentale: l’ipertrofia coinvolge segmenti non contigui del ventricolo
(per es. setto interventricolare o parete posteriore del ventricolo);
3) ipertrofia prossimale del setto: caratterizzata da una protuberanza che invade
l’outflow sinistro;
4) Ipertrofia diffusa: coinvolge sia il ventricolo sinistro che il setto interventricolare;
L’esame istopatologico e’ caratterizzato da una tipica disorganizzazione delle fibre
miocardiche con miocardiociti orientati in direzione obliqua o perpendicolare tra loro,
anziche’ essere allineati in linee parallele come nel miocardio normale. Quadri di
arteriosclerosi con parziale o totale obliterazione del lume sono spesso osservabili a
livello delle arterie coronarie. La colorazione tricromica permette inoltre di rilevare aree
di fibrosi del miocardio.
Cardiomiopatia restrittiva (Restrictive cardiomyopathy, RCM)
La RCM rappresenta la seconda forma piu’ comune di cardiomiopatia nel gatto. Nella
RCM, non si osserva ipertrofia del setto o della parete posteriore del miocardio. La
dilatazione atriale e’ generalmente piu’ drammatica di quella osservata nell’HCM. Anche
in questo caso l’eziologia e’ sconosciuta, anche se in cardiologia umana l’RCM e’ stata
associata a patologie come amiloidosi, emocromatosi e fibrosi endocardica.
L’esame ecografico rileva una marcata dilatazione atriale sinistra o biatriale in assenza di
una concomitante ipertrofia miocardica o anomalie valvolari. Aree iperecogene a livello
endocardico sono caratteristiche e rappresentano lesioni fibrotiche tipiche della RCM. Le
lesioni fibrotiche, a volte, sono impercettibili; altre volte, invece, sono talmente
imponenti da formare ponti di tessuto che collegano aree diverse del miocardio o che
attraversano addirittura il lume del ventricolo sinistro, mimando anomali fasci
moderatori. Secondo l’autore, la cardiomiopatia del bando moderatore (Moderator Band
Cardiomyopathy) non e’ altro che una forma bizzarra di RCM, caratterizzata da una
banda di tessuto acinetico ed iperecogeno che attraversa il lume ventricolare, connettendo
la parete posteriore con il setto. Queste lesioni endocardiche possono talvolta causare
obliterazione parziale o totale dell’apice ventricolare. Ipertrofia segmentale o aree di
assotigliamento del miocardio sono anch’esse comuni e spesso rendono la diagnosi di
RCM molto difficile. Una significativa insufficienza mitralica e’ assai rara nell’ RCM,
dove la dilatazione atriale e’ prevalentemente attribuibile alla disfunzione diastolica
dovuta alla perdita di elasticita’ del miocardio ventricolare. L’esame Doppler del flusso
transmitralico e’ caratterizzato da un quadro “restrittivo” con una velocita’ di picco
dell’onda E esageratamente elevata (E >>A). E’ doveroso ricordare, pero’, che un attento
esame del flusso transmitralico in questi pazienti non e’ sempre possibile, in particolare
quando le onde A ed E convergono tra loro in conseguenza dell’aumentata frequenza
cardiaca.
All’esame autoptico le lesioni principali sono caratterizzate dalla dilatazione atriale (o biatriale) e dalle lesioni fibrotiche cicatriziali dell’endocardio che spesso formano ponti di
tessuto tra i muscoli papillari ed il setto o tra il setto e la parte posteriore del ventricolo.
L’ipertrofia miocardica, se presente, e’ localizzata a piccoli segmenti del setto o della
parete ventricolare destra o sinistra. L’esame istopatologico, rileva la presenza di tessuto
fibroso e di granulazione a livello delle lesioni cicatriziali, facilmente evidenziabili con
l’uso della colorazione tricromica. Queste lesioni sono maggiormente estese a livello
endocardico, ma possono anche penetrare strati profondi del sottostante miocardio. La
presenza di cellule infiammatorie mononucleate attorno alle lesioni cicatriziali e’
abbastanza comune (endomiocardite focale), cosi’ come quadri di necrosi dei
miocardiociti, fibrosi interstiziale e arteriosclerosi di arterie coronarie con obliterazione
totale o parziale.
Cardiomiopatia dilatativa (Dilated Cardiomyopathy, DCM)
La DCM e’ caratterizzata da dilatazione del ventricolo sinistro che appare assottigliato e
ipocontrattile. La disfunzione miocardica e’ accompagnata da drammatica dilatazione
dell’atrio sinistro. Spesso, simili lesioni sono osservabile simultaneamente a livello del
cuore destro, con conseguente dilatazione di tutte e quattro le camere cardiache. In
passato, la DCM ha rappresentato la seconda forma piu’ comune di cardiomiopatia del
gatto ma dal 1987, anno della scoperta dell’associazione tra cardiomiopatia felina e
deficienza dietetica di taurina e del pronto intervento delle ditte mangimistiche che hanno
aumentato di circa dieci volte il livello di taurina nei mangimi destinati al consumo
felino, questa patologia e’ praticamente scomparsa. Forme di cardiomiopatia associate a
insufficienza dietetica di taurina sono talvolta osservate in gatti alimentati con cibo per
cani o con diete casalinghe povere in taurina (per es. diete vegetariane). La carenza di
taurina nella dieta puo’ anche causare lesioni retiniche irreversibili, a differenza delle
lesioni miocardiche che possono essere completamente risolte con correzione dietetica e
terapia di supporto.
La diagnosi ecografica e’ basata sulla presenza di dilatazione del ventricolo sinistro
(diametro a fine sistole ≥14 mm) ed una ridotta frazione di accorciamento (≤ 28 %) ed
una significativa dilatazione dell’atrio sinistro. Molto spesso il ventricolo e l’atrio destro
risultano anch’essi dilatati.
All’esame patologico, la principale lesione osservata nella DCM e’ la dilatazione marcata
del lume ventricolare (spesso bilaterale) e significativo aumento del peso del cuore
(ipertrofia eccentrica). La parete ventricolare appare normale o assottigliata, in particolare
a livello dell’apice (“aneurisma ventricolare”). Una fibrosi focale puo’ essere talvolta
osservata. L’esame istopatologico e’ caratterizzato da necrosi miocardica focalizzata o
diffusa e degenerazione dei miocardiociti con quadri di granulazione, vacuoli
sarcoplasmatici e citolisi. Infine, e’ possibile osservare lesioni arteriosclerotiche a livello
delle arterie coronarie.
Cardiomiopatia aritmogenica del ventricolo destro (Arrhythmogenic Ventricular
Cardiomyopathy, ARVC)
L’ARVC e’ una rara malattia del miocardio caratterizzata da drammatiche lesioni a
carico del ventricolo e atrio destri, che appaiono estremamente dilatati e ipocinetici. La
parete del ventricolo destro si presenta piu’ sottile del normale, mentre il ventricolo e
l’atrio sinistro appaiono pressoche’ normali. A differenza delle altre forme di
cardiomiopatia felina, associate molto spesso a segni di insufficienza cardiaca sinistra,
l’ARVC determina la comparsa di un quadro di insufficienza cardiaca congestizia destra.
Nell’uomo, forme severe di aritmia ventricolare precedono la comparsa dell’insufficienza
cardiaca nell’ARVC, e possono causare morte improvvisa, soprattutto in giovani atleti.
Simili aritmie sono state osservate dall’autore in seguito a registrazioni Holter in gatti
affetti da ARVC.
L’esame ecocardiografico e’ caratterizzato da una drammatica dilatazione del ventricolo
e atrio destri. La parete de ventricolo destro appare pressoche’ immobile, mentre il setto
interventricolare, a seguito del sovraccarico pressorio e volumetrico, produce un
caratteristico movimento paradosso verso il lume ventricolare sinistro in diastole. Una
attenta valutazione morfologica dovrebbe escludere la presenza di displasia tricuspidale,
mentre l’esame Doppler dovrebbe escludere un rigurgito tricuspidale elevato e
compatibile con un quadro di ipertensione polmonare.
Le principali lesioni autoptiche sono rapprentate da un’evidente dilatazione ventricolare e
atriale destra. La parete del miocardio appare molto assottigliata, tanto da apparire quasi
trasparente in alcune aree. L’esame dell’apparato valvolare dev’essere eseguito molto
attentamente per escludere un quadro di displasia tricuspidale. Le lesioni istopatologiche
possono coinvolgere tutte e quattro le camere cardiache, ma le lesioni principali sono a
carico del ventricolo destro che presenta fibrosi dell’endocardio e infiltrazione fibro-
adiposa del miocardio, accompagnata da degenerazione e scomparsa dei miocardiociti.
Come in altre forme di cardiomiopatia, e’ possibile osservare una modesta infiltrazione di
cellule infiammatorie attorno alle lesioni miocardiche.
Cardiomiopatia non classificata (Unclassified cardiomyopathy, UCM)
La diagnosi di UCM viene eseguita quando, al termine di un attento esame
ecocardiografico, le lesioni osservate non corrsispondono con nessuna delle
cardiomiopatie descritte in precedenza. La diagnosi di UCM e’ pertanto una diagnosi per
esclusione. E’ possibile che alcune forme di UCM siano riconducibili a lesioni
ischemiche del miocardio (infarto del miocardio), in particolare a carico della parete
posteriore del ventricolo sinistro, con conseguente necrosi e fibrosi del tessuto
interessato. Questee aree ischemiche appaiono assottigliate e ipocinetiche all’esame
ecocardiografico e, se coinvolte nella scansione monomodale del ventricolo sinistro,
possono determinare un’incorretta valutazione della frazione di accorciamento.
ASPETTI CLINICI, ELETTROCARDIOGRAFICI E RADIOGRAFICI
Se la classificazione delle cardiomiopatie feline risulta difficile all’esame
ecocardiografico, tanto piu’ e’ difficile risalire al tipo di cardiomiopatia in corso sulla
base dei reperti anamnestici o semiologici. Pazienti affetti da forme diverse di
cardiomiopatia possono presentarsi con segni clinici pressoche’ identici, con la sola
eccezione della cardiomiopatia aritmogenica del ventricolo destro (ARVC). In base ad
uno studio retrospettivo eseguito su oltre 100 gatti affetti da cardiomiopatia, il segno piu’
comune e’ rappresentato dal soffio cardiaco. Altri segni clinici, inclusa la loro prevalenza
nelle diverse forme di cardiomiopatia, sono riportati in tabella 1.
La paralisi degli arti posteriori (o piu’ raramente la paralisi degli arti anteriori)
rappresenta una delle classiche complicazioni della cardiomiopatia felina: il
tromboembolismo arterioso. Frammenti di trombi formatisi all’interno delle cavita’
cardiache (per lo piu’ atrio e ventricolo sinistri), in seguito ad un flusso sanguigno
rallentato o stagnante, possono distaccarsi ed embolizzare l’aorta a livello delle sue
diramazioni. Il sito piu’ comune di embolismo e’ la triforcazione aortica con conseguente
riduzione di flusso a livello delle arterie iliache e paralisi o paresi degli arti posteriori.
Meno frequentemente, l’embolismo si presenta a livello di arteria succlavia sinistra o
tronco brachiocefalico con conseguente paralisi o paresi degli arti anteriori. L;esame
ecografico, in questi casi, rivela a volte la presenza di un trombo a livello dell’atrio o
ventricolo sinistri. Si ritiene inoltre che la presenza di contrasto ecografico spontaneo
(“smoke”) in queste cavita’ rappresenti un fenomeno di aggregazione ematica che
precede la formazione del trombo.
Alcune anomalie possono essere riscontrate anche all’esame elettrocardiografico (tabella
2), anche se la modesta sensibilita’ e specificita’ di questo test non risultano
particolarmente utili al raggiungimento di una diagnosi di cardiomiopatia felina. Al
contrario, la registrazione Holter (24h ECG) permette di rilevare anomalie in quasi la
totalita’ dei gatti affetti da cardiomiopatia, in particolare in corso di ARVC. Purtroppo,
questa indagine diagnostica non viene eseguita di routine, in particolare per la difficile
interpretazione dei tracciati.
Le principali lesioni osservate alla radiografia del torace sono riportate in tabella 3.
Anche se la radiografia del torace permette di facilitare la diagnosi di insufficienza
cardiaca congestizia, e’ molto difficile, se non addirittura impossibile, differenziare i
diversi tipi di cardiomiopatia. Tra i vari miti da sfatare nella diagnosi di cardiomiopatia
felina, va incluso il tipico “cuore di San Valentino” (Valentine’s heart) osservabile in
radiografie in proiezione dorso-ventrale in gatti affetti da HCM. In realta’, la morfologia
del “cuore di San Valentino” e’ dovuta alla presenza di una significativa dilatazione biatriale, che risulta molto piu’ comune nei casi di RCM.
La prognosi e’ estremamente variabile e dipende dalla tempestivita’ della diagnosi. In
linea generale, gatti affetti da forme asintomatiche di HCM sopravvivano piu’ a lungo dei
gatti in cui la diagnosi di HCM e’ accompagnata da segni clinici e/o quadri radiografici di
insufficienza cardiaca. Gatti affetti da RCM tendono a sopravvivere meno dei gatti con
HCM, mentre la diagnosi di DCM o ARVC e’ spesso accompagnata da prognosi infausta.
L’aspettativa di vita di gatti affetti da cardiomiopatia puo’ essere estrapolata dai dati
riportati in tabella 4.
Tabella 1 Segni clinici riscontrati all’esame fisico in 106 gatti affetti da cardiomiopatia
(Ferasin et al 2003)
Soffio
Dispnea
Tachicardia (HR >200 bpm)
Letargia
Ritmo di galoppo
Ipotensione (BP<120 mmHg)
Perdita di peso
Ascite
Aritmia
Collasso
Suoni respiratori anormali
Paresi degli arti posteriori
Bradicardia (HR <100)
Suoni cardiaci ridotti
Assenza di segni clinici (*)
Degenerazione retinica
Totale
(n=106)
N. %
59 55.7
50 47.1
31 29.2
21 19.8
19 17.9
15 14.1
13 12.3
12 11.3
11 10.4
10 9.4
9
8.5
8
7.5
6
5.7
5
4.7
3
2.8
2
1.9
HCM
(n=61)
N. %
44 72.1
22 36.1
16 26.2
8
13.1
7
11.5
4
6.6
7
11.5
1
1.6
4
6.6
4
6.6
5
8.2
6
9.8
1
1.6
0
0
3
4.9
0
0
RCM
(n=22)
N. %
8
36.4
12 54.5
7
31.8
3
13.6
5
22.7
4
18.2
5
22.7
5
22.7
3
13.6
4
18.2
3
13.6
2
9.1
3
0.7
2
9.1
0
0
0
0
DCM
(n=11)
N. %
1
9.1
9
81.8
6
54.5
7
63.6
5
45.4
6
54.5
1
9.1
6
54.5
2
18.2
2
18.2
1
9.1
0
0
2
18.2
2
18.2
0
0
2
18.2
UCM
(n=11)
N. %
6
54.5
7
63.3
1
9.1
3
27.3
1
9.1
0
0
0
0
0
0
2
18.2
0
0
0
0
0
0
0
0
1
9.1
0
0
0
0
MBCM
(n=1)
N. %
0
0
1
100
1
100
0
0
1
100
1
100
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
(*) assenza si segni clinici riferibili a malattioa cardiaca; bpm= battiti al minuto; BP=
pressione arteriosa sistolica
Tabella 2 Anomalie elettrocardiografiche riscontrate in 106 gatti affetti da cardiomiopatia
(Ferasin et al 2003)
Totale
(n=106)
N.
%
41 38.7
HCM
(n=61)
N.
%
26 42.6
RCM
(n=22)
N.
%
8
36.4
DCM
(n=11)
N.
%
3
27.3
UCM
(n=11)
N.
%
4
36.4
MBCM
(n=1)
N.
%
0
0
ECG normale
Disturbi di conduzione
LAFB
19 17.9
17 27.9
1
4.5
0
0.0
1
9.1
0
3rd degree AV block
5
4.7
1
1.6
2
9.1
1
9.1
1
9.1
0
LBBB
3
2.8
2
3.3
1
4.5
0
0.0
0
0.0
0
RBBB
3
2.8
1
1.6
2
9.1
0
0.0
0
0.0
0
1st degree AV block
1
0.9
0
0.0
1
4.5
0
0.0
0
0.0
0
2nd degree AV block
1
0.9
0
0.0
0
0.0
0
0.0
1
9.1
0
Anomalie morfologiche
LV enlargement pattern
21 19.8
15 24.6
1
4.5
2
18.2
3
27.3
0
LA enlargement pattern
12 11.3
4
6.6
2
9.1
3
27.3
1
9.1
0
RV. enlargement pattern
9
8.5
7
11.5
0
0.0
2
18.2
0
0.0
0
RA enlargement pattern
8
7.5
4
6.6
2
9.1
2
18.2
0
0.0
0
Disturbi del ritmo
VPC
7
6.6
3
4.9
3
13.6
1
9.1
0
0.0
0
SVT
7
6.6
2
3.3
2
9.1
3
27.3
0
0.0
1
VT
4
3.8
2
3.3
2
9.1
0
0.0
0
0.0
0
Atrial standstill
3
2.8
0
0.0
1
4.5
0
0.0
2
18.2
0
SVPC
2
1.9
1
1.6
1
4.5
0
0.0
0
0.0
0
Legenda: LAFB: left anterior fascicular block; AV block: atrio-ventricular block; LV: left ventricle; LA:
left atrium; RV: right ventricle; RA: right atrium; VPC: ventricular premature complex; SVT:
supraventricular tachycardia; VT: ventricular tachycardia; SVPC: supraventricular premature complex
0
0
0
0
0
0
0
0
0
0
0
100
0
0
0
Tabella 3 Lesioni radiologiche osservate in 106 gatti affetti da cardiomiopatia (Ferasin et
al 2003)
Radiografia del torace nei limiti
della norma
Cardiomegalia
Versamento pleurico
Edema polmonare
Dilatazione atriale sinistra
Dilatazione atriale destra
Ascite
Total
(n=106)
HCM
(n=61)
RCM
(n=22)
DCM
(n=11)
UCM
(n=11)
MBCM
(n=1)
N.
19
%
17.9
N.
14
%
23.0
N.
3
%
13.6
N.
0
%
0.0
N.
2
%
18.2
N.
0
%
0
71
31
28
25
21
12
67.0
29.2
26.4
23.6
19.8
11.3
36
4
14
11
6
1
59.0
6.6
23.0
18.0
9.8
1.6
16
12
9
1
2
5
72.7
54.5
40.9
4.5
9.1
22.7
11
10
4
11
11
6
100.0
90.9
36.4
100.0
100.0
54.5
7
5
1
1
1
0
63.6
45.5
9.1
9.1
9.1
0.0
1
0
0
1
1
0
100
0
0
100
100
0
Tabella 4 Tempi di sopravvivenza in 73 gatti affetti da cardiomiopatia (Ferasin et al
2003)
Dead
Alive
Survival ≤30days
Survival > 30 days
Total
(n=73)
N
46
27
19
54
Median (dead)
Median (alive)
Median (total)
days
125
1144
300
%
63.0
37.0
26.0
74.0
HCM
(n=43)
N
23
20
6
a
37
Days
180
913
492
%
53.5
46.5
14.0
86.0
RCM
(n=16)
N
12
4
7
9
days
21
1277
c
132
%
75.0
25.0
43.8
56.3
DCM
(n=8)
N
8
0
6
b
2
days
11
0
c
11
%
100.0
0.0
75.0
25.0
UCM
(n=5)
N
3
2
0
5
%
60.0
40.0
0.0
100.0
Days
670
1397
d
925
Lettere diverse indicano differenza statistica significativa tra i gruppi (a,b; P<0.001) (c,d:
P<0.05)
MBCM
(n=1)
N
0
1
0
1
days
0
1685
1685
%
0.0
100.0
0.0
100.0
Bibliografia
Ferasin L, Sturgess CP, Cannon MJ, Caney SMA, Gruffydd-Jones TJ, Wotton PR (2003)
Feline idiopathic cardiomyopathy. A retrospective study of 106 cats (1994-2001).
Journal of Feline Medicine & Surgery 5, 151-159
Fox PR (2003) Prospective, double-blinded, multicenter evaluation of chronic therapies
for feline diastolic heart failure: interim analysis. American College of Veterinary
Internal Medicine Annual Conference, Charlotte USA
Harvey AM, Battersby IA, Faena M, Fews D, Darke PGG, Ferasin L (2005)
Arrhythmogenic right ventricular cardiomyopathy (ARVC) in two cats. Journal of Small
Animal Practice 46; 151-156
MacDonald KA, Kittleson MD, Larson RF, Kass P, Klose T, Wisner ER (2006) The
effect of ramipril on left ventricular mass, myocardial fibrosis, diastolic function, and
plasma neurohormones in Maine Coon cats with familial hypertrophic cardiomyopathy
without heart failure. Journal of Veterinary Internal Medicine; 20:1093–1105
Ployngam T, Tobias AH, Smith SA, Torres SMF, Ross SJ (2006) Hemodynamic effects
of methylprednisolone acetate administration in cats. American Journal Veterinary
Research; 67: 583-587
Sturgess CP, Ferasin L (2003) Cardiopathies felines. De l’usage des IECA chez le chat.
L’Action Veterinarie 12 March 2003: 1-7
Sturgess CP, Ferasin L (2007) Clinical experience of the use of pimobendan in 10 cats (in
press)
Taillefer M, Di Fruscia R (2006) Benazepril and subclinical feline hypertrophic
cardiomyopathy: A prospective, blinded, controlled study. Canadian Veterinary Journal;
47:437–445