Emorragia
Emorragia: fuoriuscita di sangue dai vasi in seguito alla loro rottura.
Se l’accumulo di sangue avviene in una cavità sierosa si parla di:
Emotorace –pleura
Emopericardio -pericardio
Emoperitoneo -peritoneo
Emartro -articolazione
Ematoma: massa solida dovuta ad accumulo di sangue in un tessuto
Emorragie più piccole (su cute e mucose) vengono chiamate:
Petecchie -molto piccole (1-2 mm diametro)
Porpore - sino a circa 1 cm diametro
Ecchimosi -più estese e rigonfie
Eziologia:
- traumi
-Stati patologici dei vasi (aterosclerosi, aneurismi-dilatazioni circoscritte della parete
vascolare, varici-dilatazione vene conseguenti insufficienza delle valvole venose)
-Tumori erosivi che aggrediscono la parete vasale
- ipertensione (emorragie della retina e cerebrali)
-Diatesi emorragiche (gruppo di disordini clinici che hanno in comune la tendenza al
sanguinamento; generalmente caratterizzate da un deficit delle piastrinetrombocitopenia- e/o fattori della coagulazione-emofilia e malattia di von Willebrand)
- ipovitaminosi (scorbuto-carenza di vitamina C; carenza di vitamina K) infiammazione,
erosione della parete a seguito di neoplasie);
1
- congestione cronica (nei capillari);
- infezioni (tubercolosi)
Emorragia
Significato clinico
Dipende:
-dalla quantità di sangue perduto: la perdita fino anche al 20% del volume sanguigno
o la perdita cronica di quantità anche più elevate può avere scarse conseguenze
sull’adulto sano. Perdite superiori possono dare origine a shock emorragico
(ipovolemico);
-dalla velocità della perdita: la perdita cronica di sangue all’esterno dell’organismo
(ulcera peptica, sanguinamento mestruale) può portare a carenza di ferro; al
contrario, quando i globuli rossi restano all’interno del corpo, come nel caso di
emorragie all’interno del corpo, il ferro può essere riutilizzato per la sintesi di
emoglobina
-dal luogo in cui l’emorragia si verifica: sanguinamenti piccoli possono essere letali a
livello cerebrale (aumento della pressione intracranica e erniazione)
2
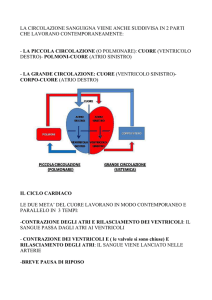
Trombosi
L’aspetto patologico dell’emostasi è la trombosi che può essere considerata una
inappropriata inattivazione del processo emostatico, come la formazione di
una massa solida di sangue (trombo) in un vaso non danneggiato o l’occlusione
trombotica di un vaso in seguito ad un danno non grave.
Patogenesi della trombosi: tre i fattori che predispongono alla formazione del
trombo, la cosidetta triade di Virchow:
4) Alterazioni della parete vascolare (Danno endoteliale); inducono adesione e
attivazione delle piastrine, della coagulazione (cuore, arterie).
5) Alterazioni del flusso (flusso rallentato o turbolento); le piastrine
aderiscono più facilmente e i fattori della coagulazione sono più concentrati.
La trombosi venosa (flebotrombosi) è, infatti, più frequente di quella
arteriosa; inoltre le valvole delle vene favoriscono trombosi perché producono
vortici e pozze di sangue stagnante.
6) Alterazioni del sangue (ipercoagulabilità); Dovute ad alterazioni di fattori
anticoagulanti e procoagulanti.
In generale devono verificarsi almeno due della condizioni suddette affinché si
verifichi trombosi. Il danno vascolare può essere, anche da solo, responsabile
della patogenesi della trombosi
3
4
Trombosi
Evoluzione del trombo:
2) Propagazione: il trombo può accumulare quantità crescenti di piastrine e
fibrina (propagarsi) provocando occlusione vascolare;
3) Embolizzazione: i trombi possono staccarsi e arrivare ad altre sedi
circolatrorie;
4) Dissoluzione: I trombi possono essere rimossi dalla attività fibrinolitica;
5) Organizzazione e ricanalizzazione: i trombi possono indurre infiammazione e
fibrosi (organizzazione) e possono infine essere ricanalizzati, cioè viene
ristabilito il flusso di sangue oppure possono essere incorporati sotto forma
di un ispessimento della parete vascolare.
Implicazioni cliniche:
7) Causano ostruzione delle arterie o delle vene
8) Sono una fonte possibile di emboli
1) Trombi delle vene profonde arti inferiori Þ embolia polmonare
2) Trombi delle arterie Þ infarto del miocardio o cerebrale
5
Evoluzione del trombo
6
7
8
Trombosi
Prevenzione e terapia della trombosi:
Aspirina: agisce sulla ciclossigenasi e, quindi, impedisce la sintesi di prostaciclina
(vasodilatazione, inibizione della attivazione delle piastrine) nell’endotelio e di
trombossano (vasocostrizione, attivazione delle piastrine) nelle piastrine. La
azione dell’aspirina sulla COX è irreversibile ma le cellule endoteliali-dotate di
nucleo- possono risintetizzare nuovo enzima e, quindi, prostaciclina. Farmaco
antitrombogeno.
Eparina: anticoagulante di rapido effetto. Facilita la formazione dei complessi
trombina/anti-trombinaIII
farmaci dicumarolici (Warfarin): anticoagulanti a effetto ritardato. Sono
antagonisti della vitamina K, necessaria per la modificazione di alcuni fattori
della coagulazione (protrombina-FII-, FVII, FIX, FX, proteina C, proteina S)
detti, appunto, vitamina K dipendenti.
tPA ricombiante (Urochinasi e streptochinasi): attivatore della fibrinolisi. Molto
efficace nella terapia di trombi formati da poco.
9
CID
La coagulazione Intravascolare Disseminata
è
caratterizzata
dalla
formazione
generalizzata di trombi di fibrina nella
microcircolazione
che
appaiono
improvvisamente o subdolamente, può
essere la conseguenza di diverse patologie
che vanno da complicanze ostetriche a
neoplasie maligne in stato avanzato. In
conseguenza della estesa coagulazione
intravascolare, si verifica consumo di
piastrine e fattori della coagulazione, viene
attivato il sistema della fibrinolisi, e alla
fine evolve in un serio problema emorragico.
La CID non è una malattia primaria, ma la
potenziale complicanza di condizioni che
portano ad una attivazione generalizzata di
trombina
10
Embolia
Un embolo è una massa intravascolare di natura solida, liquida o gassosa che viene
trasportata dal sangue in una sede lontana dall’origine.
Di fatto, il 99% degli emboli sono tromboemboli, provengono cioè da trombi; la
rimanente percentuale è rappresentata da:
masserelle di cellule neoplastiche;
Embolia lipidica: gocce di grasso (frammenti di midollo osseo conseguenti a
fratture)
Embolia gassosa: bolle d’aria o di azoto (manovre ostetriche, traumi toracici,
malattia da decompressione)
Embolia da liquido amniotico: ingresso di liquido amniotico nella circolazione
materna (parto)
Corpi estranei (pallottole)
Implicazioni cliniche:
Ostruzione parziale o totale di vasi. La conseguenza di questo evento è la necrosi
ischemica del tessuto distale, nota come infarto. L’evoluzione clinica dipende
dalla sede dove sono localizzati gli emboli:
circolazione polmonare: Þ embolia polmonare (embolia venosa)
11
circolazione sistemica: Þ embolia sistemica (embolia arteriosa)
(Trombo)Embolia polmonare:
Più frequente causa di morte nei pazienti ospedalizzati: Deriva da embolia venosa a
livello delle vene profonde degli arti inferiori (poplitee, femorali, iliache).
Rarissimi gli emboli da trombi delle vene superficiali. Gli emboli, vengono
trasportati in vasi di calibro sempre maggiore (non esiste infatti embolia
venosa) e, dopo avere attraversato il cuore destro, arrivano al circolo
polmonare. In base alle dimensioni l’embolo può:
occludere l’arteria polmonare principale;
porsi a cavallo della biforcazione;
arrivare fino alle più piccole diramazioni delle arterie polmonari
L’importanza delle conseguenze dipende da:
dimensioni dell’embolo
calibro dell’arteria ostruita
numero degli emboli (si possono avere anche emboli multipli da frammentazioni
di una grande massa trombotica
Condizione respiratoria e cardiaca di base del paziente
Implicazioni cliniche: si va da forme silenti (60-80% dei casi) dovuti a piccoli emboli,
che vengono rapidamente rimossi per fibrinolisi, a forme mortali (5% casi)
dovuti ad interessamento di oltre il 60% dell’intera sezione arteriosa polmonare
per un grande embolo (per es a sella) o per tanti simultanei piccoli emboli. Nel
10% dei casi si ha infarto del polmone, conseguente a ischemia, e fibrosi)
12
13
(Trombo)Embolia sistemica:
Si riferisce agli emboli arteriosi. Determinata da frammentazione di trombi nelle
cavità cardiache:
ventricolo sn (per infarto del miocardio)
Atrio dx o sin (per malattia reumatica)
Il rischio di embolizzazione è aumentato da
aritmie cardiahce,
Presenza di placche aterosclerotiche
Aneurismi
Protesi valvolari
Implicazioni cliniche: infarto.
Sedi principali di localizzazione
estremità inferiori
Encefalo
Visceri (rene, milza, inestino)
Arti superiori
14
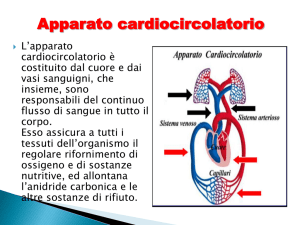
Struttura normale dei vasi
I vasi arteriosi e venosi hanno morfologia differente che riflette distinte situazioni
funzionali a seconda delle diverse localizzazioni-distanza dal cuoreArterie: hanno parete più spessa per le onde pressorie alle quali sono sottoposte
Vene: hanno diametro maggiore ma una parete molto più sottile.
I componenti strutturali delle pareti vasali sono:
- endotelio;
- muscolo liscio;
-tessuto connettivo (fibre elastiche, collageno, proteoglicani).
Nelle arterie di medio e grosso calibro si individuano bene
(Tonaca) intima: è presente un rivestimento
di cellule endoteliali e un sottilissimo strato
di tessuto connettivo sotto-endoteliale;
l’intima è separata dalla media per mezzo
di una densa membrana elastica (lamina
elastica interna)
(Tonaca) media: costituita da cellule
muscolari lisce; delimitata all’esterno
da una densa membrana elastica (lamina
elastica esterna);
(Tonaca) avventizia: costituita da
tessuto connettivo e vasa vasorum.
15
Aterosclerosi
Con il termine di arteriosclerosi (indurimento delle arterie) si indicano tre malattie
diverse che diminuiscono l’elasticità delle arterie con tre diversi meccanismi
ü L’aterosclerosi, una malattia delle arterie di grosso e medio calibro; essa
comincia nell’intima, dove produce le tipiche placche ripiene di materiale
necrotico simile a farinata (athére) dette placche ateromasiche o
aterosclerotiche; è questa la malattia che la gente comune intende quando dice,
erroneamente, arteriosclerosi.
ü L’arteriosclerosi; che interessa le piccole arterie;
ü La malattia di Mönckeberg, piuttosto rara che consiste nella calcificazione
della media delle grosse arteria.
16
L’aterosclerosi spesso inizia nell’infanzia, ma i sintomi sono evidenti durante l’età
media o più tardi quando le lesioni arteriose determinano danni organici.
Principali conseguenze sono:
- Infarto del miocardio
- Infarto cerebrale
- Aneurisma aortico
17
Patogenesi:
18
19
Ipossia
Ischemia
Carenza di O2
Carenza di O2
Carenza nutrienti
Aumento cataboliti
Ischemia è conseguente ad un inadeguato apporto ematico. Se il danno non è
reversibile determina morte cellulare e necrosi.
Ischemia
Localizzata
Generalizzata
Infarto
Shock
20
Infarto
Infarto: area di necrosi ischemica in un particolare tessuto dovuta al blocco
dell’apporto arterioso o del drenaggio venoso.
Ictus: infarto cerebrale
TIA: attacco ischemico transitorio (cerebrale)
Gangrena: necrosi ischemica delle estremità (complicanza del diabete mellito)
Cause
Trombosi e embolia (99%)
Varie (placche ateromasiche)
Fattori che influenzano lo sviluppo di un infarto:
natura dell’apporto vascolare: alcuni tessuti hanno doppia irrorazione (polmoni,
fegato) altri no (milza e rene)
velocità di sviluppo dell’occlusione: (x es lenta: permette vie alternative di
perfusione)
sensibilità dell’organo all’ipossia:
neuroni: danno irreversibile dopo 3-4 min
miocardio: 20-30 min
contenuto di ossigeno nel sangue: ipossiemia (pressione parziale di ossigeno nel
21
sangue ridotta ), anemia, congestione sistemica, insufficienza respiratoria
Effetti: da trascurabili a morte del paziente (infarto del miocardio e cerebrale)
Shock
Lo shock, o collasso cardiocircolatorio, è una ipoperfusione sistemica dovuta a
riduzione della gittata cardiaca o del volume di sangue effettivamente
circolante. Il risultato finale è ipotensione, seguita da insufficiente perfusione
tessutale e ipossia cellulare. L’ipoperfusione inizialmente causa solo danno
cellulare reversibile, ma la persistenza dello shock alla fine provoca danno
irreversibile ai tessuti e può culminare nella morte del paziente.
E’ la conseguenza comune ad una serie di eventi clinici potenzialmente mortali:
Gravi emorragie;
traumi o ustioni estese;
Infarti del miocardio di certa entità;
Embolia polmonare massiva;
Sepsi microbica.
22
Patogenesi dello shock
23
Patogenesi:
ü shock cardiogeno: mancato funzionamento della pompa del miocardio (Þ
riduzione della gittata cardiaca);
ü
shock ipovolemico: perdita di volume ematico o plasmatico (Þ riduzione della
gittata cardiaca);
ü
shock settico: risultato della diffusione e dell’estensione all’intero flusso
sanguigno di una infezione inizialmente localizzata (ascessi, polmoniti,
peritoniti). Nello shock endotossico, LPS determina, mediante TNF, IL-1 e IL-6,
vasodilatazione sistemica (ipotensione);
Riduzione della contrattilità miocardica;
Danno ed attivazione endoteliale diffusa, che provocano adesione
leucocitaria sistemica e lesioni ai capillari degli alveoli polmonari
(sindrome da deficit respiratorio)
Attivazione del sistema della coagulazione che culmina nella CID
24
Patogenesi dello shock settico
25