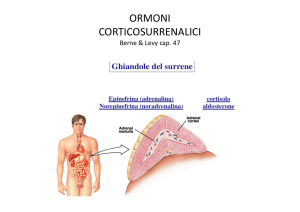
Ghiandola surrenalica
Cenni anatomo funzionali e
corticosurrene
• Le ghiandole surrenaliche sono essenziali
per la sopravvivenza.
p
p
• Svolgono un ruolo importante nella
regolazione adattativa allo stress
• Nel mantenimento dell’equilibrio
idroelettrolitico
• Nel controllo della PA
Anatomia funzionale
• Le ghiandole surrenaliche sono localizzate
al di sopra dei reni
reni, misurano 3/5 cm e
pesano 1,5-2,5 gr.
• Nella
N ll ghiandola
hi d l surrenalica
li sii di
distinguono
ti
la corticale di derivazione mesodermica e
la midollare di derivazione neurodermica
(sottopopolazione della cresta neurale).
• La corticale (di derivazione mesodermica)
sintetizza
i t ti
glucocorticoidi,
l
ti idi mineralcorticoidi
i
l ti idi
e androgeni (rappresnta il 90% dell’intera
ghiandola)
• La midollare più interna (restante 10%)
sintetizza catecolamine (adrenalina e
noradrenalina)
d
li ) iin risposta
i
t allo
ll stimolazione
ti l i
simpatica diretta.
• Vascolarizzazione: arterie sovrarenali
superiori media e inferiore
• Drenaggio venoso: la vena di destra nella
cava inferiore e per la vena sin nella renale
sin
Ormoni della corticale surrenalica
• L
La zona glomerulare
l
l
contiene
ti
abbondante
bb d t
reticolo endoplasmatico liscio ed è l’unica
fonte del mineralcorticoide aldosterone
• La zona fascicolata contiene abbondanti
gocce lipidiche e produce i glucocorticoidi
eg
gli a
androgeni
d oge
• La zona reticolare si sviluppa dopo la
nascita verso i 3 anni di età
nascita,
età, produce
glucocorticoidi e androgeni
©2006 UpToDate®
©2006 UpToDate® • www.uptodate.com
Licensed to Maurizio Poli
Server: WEB006
e mail this to a colleague
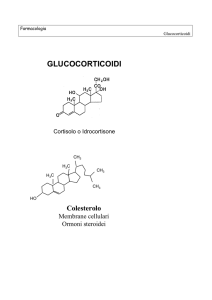
Chimica e biosintesi
• La steroidogenesi inizia con la
conversione del colesterolo in
pregnenolone
• Il colesterolo viene rilasciato dall’azione
dall azione
dell’enzima colesterolo esterasi,
• È convertito in pregnenolone dall’azione
dell’enzima
dell
enzima di clivaggio della catena
laterale citocromo P450 (P450scc)
• Il colesterolo per divenire substrato per la
P450scc deve passare dalla membrana
mitocondriale esterna a quella interna
• Questo passaggio è mediato dalla sterod
acute regulatory protein
• La conversione a pregnenolone è il primo di
una serie di passaggi per la sintesi di ormoni
steroidei
• Le
L cellule
ll l che
h costituiscono
tit i
di
diverse zone
surrenaliche presentano aspetti enzimatici
specifici:
ifi i quindi
i di ormonii specifici
ifi i
(glucocorticoidi, mineralcorticoidi o
androgeni)
d
i)
Anomalie nella biosintesi degli
ormoni steroidei
Qualsiasi carenza nella cascata degli
eventi enzimatici che portano alla sintesi
dei glucocorticoidi,
glucocorticoidi mineralcorticoidi o
androgeni porta a una patologia severa
che può
ò manifestarsi
f
gìà
ìà in utero ((deficit
f
g
di desmolasi)) o tardivamente
congenito
nella vita adulta
Le carenze di q
questi enzimi comportano
p
una alterata sintesi del cortisolo, una
mancata inibizione del feedback
negativo del rilascio di ormone e una
aumentata conversione del colesterolo
a pregnenolone
A seconda del deficit enzimatico presente si
avranno quadri
d i clinici
li i i diff
differenti:
ti
1) deficit enzimatico di 21 idrossilasi:
- ridotto cortisolo e aldosterone, perdita di
sodio per deficit di mineralcorticoidi,
virilizzazione per eccessiva produzione di
androgeni
2) Deficit di 11betaidrossilasi: eccesso di
11deossicortisolo: eccesso di attività
mineralcorticoide, ritenzione di acqua e Sali.
3) 11betaidrossisteroidodeidrogenasi
11b id
i
id d id
i tipo
i
2 inibito da un composto della liquirizia:
eccesso di attività mineralcorticoide
Sintesi degli ormoni steroidei
• L
La produzione
d i
ormonale
l può
ò essere regolata
l t
acutamente o cronicamente
• La
L regolazione
l i
acuta
t risulta
i lt nella
ll produzione
d i
rapida di steroidi in risposta al bisogno
immediato e avviene in pochi minuti
• La regolazione cronica (durante un digiuno
prolungato o una malattia cronica) richiede la
sintesi degli enzimi coinvolti nella steroidogenesi
per incrementare la capacità di sintesi delle
cellule
Sintesi e rilascio dei glucocorticoidi
• Il rilascio
il
i di cortisolo
ti l è pulsatile
l til e sotto
tt lla
stimolazione di ACTH, segue un ritmo
circadiano particolarmente sensibile alla
luce, al sonno, allo stress e alla malattia. Il
rilascio di cortisolo è massimo durante le
prime ore del risveglio con un decremento
dei livelli progressivo
• La stimolazione da parte di ACTH è
mediata dal legame con la proteina G
Metabolismo dei glucocorticoidi
• Il cortisolo, lipofilo, nei liquidi biologici si
prevalentemente in forma coniugata
g
trova p
o legato a proteine di trasporto.
• Prevalentemente è legato alla una
alfadueglobulina: transcortina che viene
sintetizzata a livello epatico (stimolata
(
g estrogeni
g
e ridotta da malattie
dagli
epatiche) o albumina. Solo 1-10% è libero.
• Gli ormoni steroidei diffondono facilmente
attraverso
tt
lle membrane
b
cellulari
ll l i
• Alte concentrazioni di ormoni steroidei si
trovano nel tessuto adiposo dove è presente
la 5alfa reduttasi che converte gli androgeni
circolanti in estrogeni
• Il metabolismo degli steroidi avviene nel
f
fegato
t è in
i misura
i
minore
i
nell rene (d
(dove
vengono eliminati coniugati)
Sintesi e rilascio dei
mineralcorticoidi
• La sintesi e il rilascio di aldosterone sono
prevalentemente regolati
p
g
dall’angiotensina
g
II e dal potassio estracellulare, solo in
minima parte dall’ACTH
dall ACTH.
• I componenti del sistema renina
angiotensina aldosterone rispondono
p
alle riduzioni del volume
rapidamente
intravascolare e della perfusione renale
Metabolismo dei mineralcorticoidi
• Minimo legame con le proteine
plasmatiche
• Metabolizzato
M t b li
t nell ffegato
t ed
d escreto
t con lle
urine
Sintesi e rilascio degli androgeni
surrenalici
• Comprende il DHEA e DHEAS
• Controllato da ACTH
• La sintesi del diidrotestosterone e del
17b t estradiolo
17beta
t di l coinvolge
i
l numerosii
enzimi
• Il controllo e la regolazione del rilascio
degli steroidi sessuali surrenalici non è
totalmente chiaro
Effetti cellulari degli ormoni
steroidei
Gli effetti possono essere distinti in
genomici e non g
g
genomici
Effetti
Eff
tti non genomici:
i i non coinvolgono
i
l
direttamente la trascrizione genica
Effetti specifici degli ormoni della
corticale surrenalica
• Gl
Glucocorticoidi:
ti idi influenzano
i fl
il metabolismo
t b li
intermedio, stimolano la proteolisi e la
gluconeogenesi inibiscono la sintesi delle
gluconeogenesi,
proteine muscolari e aumentano la
mobilizzazione degli acidi grassi
grassi.
• Modulano la risposta immune, aumentano la
sintesi delle citochine antiinfiammatorie
• Nel sistema nervoso centrale modulano la
percezione e possono produrre cambiamenti
corportamentali
Mineralcorticoidi
• Gli effetti specifici dell’aldosterone
consistono nell’aumentare la sintesi dei
canali del sodio nella membrana apicale,
nell’aumentare
nell
aumentare la sintesi e l’attività
l attività della
sodio/potassio atipiasi, nell’acidificare le
urine e nell’alcalinizzazione
nell alcalinizzazione del plasma
plasma.
• L’aldosterone p
promuove l’ipertrofia
p
e la
fibrosi cardiaca
Malattie da iperproduzione di
corticosteroidi
• L’eccesso
L eccesso di glucocorticoidi può essere
dovuto a iperproduzione da parte di un
tumore surrenalico o a iperstimolazione
della sintesi e del rilascio di glucocorticoidi
da parte di ACTH
C
prodotto da un tumore
p
o da un tumore ectopico
p
ipofisario
• Nella sindrome di Cushing
g corticotropinadipendente l’aumento cronico di ACTH
causa un ingrandimento bilaterale
(iperplasia) della corticale surrenalica.
• La
L produzione
d i
di corticotropina
ti t i può
ò essere
anche ectopica (tumore a piccole cellule del
polmone)
• Con il termine malattia di Cushing viene
riservato alla sindrome causata
d ll’
dall’eccessiva
i secrezione
i
di corticotropina
ti t i
da parte di tumori ipofisari
Diagnosi
• L’ipersecrezione di cortisolo viene
confermata
f
t misurando
i
d l’escrezione
l’
i
d
dell
cortisolo urinario su un periodo di 24h
• Una valutazione funzionale della
p
del sistema implica
p
la
responsività
somministrazione di desametasone a basse
questo test il desametasone viene
dosi. In q
somministrato per 2 giorni (a dose bassa) o
(quando somministrato
nell’arco della notte (q
ad alte dosi) e la concentrazione di cortisolo
e u a viene
e e misurata
su a a nelle
e e 24 h. L’effetto
e e o
nell’urina
consiste nel sopprimere il rilascio di ACTH e
la produzione di cortisolo se l’asse
l asse HPA
funziona
Carenza di glucocorticoidi Addison
• La carenza di glucocorticoidi può risultare
dalla mancanza di stimolazione di ACTH
(d fi it secondario)
(deficit
d i )od
da alterazioni
lt
i i
surrenaliche (deficit primario)
• La sommistrazione esogena di analoghi
sintetici dei glucocorticoidi sopprime anche
il CRH e l’ACTH; quindi una sospensione
i
improvvisa
i d
dell ttrattamento
tt
t sii può
ò
manifestare come una condizione di
insufficienza
Diagnosi
• Dosaggio ormonale specifico: cortisolo ore
gg ACTH
9 e ore 22,, dosaggio
• Test di stimolo con ACTH
• Dosaggio
D
i QE (i
(iperpotassiemia),
t
i i ) azotemia,
t i
bicarbonati (lieve acidosi) emocromo
(eosinofilia)
• Ad anti surrene
• Esami strumentali
Trattamento
• Trattare
a a e la
a causa
• Terapia sostitutiva con steroidi; nella crisi
ac ta tra 2
acuta:
2-3
3 lt di sol
soluzione
ione salina
salina,
iniezione intravenosa di desametazone
(lunga emivita 12-24H) o idrocortisone
((100 mg
g ogni
g 6 ore p
per le p
prime 24h))
• Mantenimento con terapia orale
• Se
S insufficienza
i
ffi i
surrenalica
li primitiva
i iti
trattare con fludrocortisone
(mineralcorticoide)
Eccesso di aldosterone
• L’
L’eccessiva
i produzione
d i
di aldosterone
ld t
può
ò
essere classificata come primitiva,
secondaria, terziaria o
pseudoiperaldostreronismo
• Iperaldosteronismo primario (Conn) è
sostenuto
soste
uto da u
un ade
adenoma
o ap
primario
a o
secernente (determina ipertensione e
ipokaliemia)
• Secondario: renina dipendente (ascite)
Deficit di aldosterone
• La carente produzione di aldosterone può
p
,
essere classificata come primitiva,
secondaria o pseudo.
• Se primitiva risulta dalla distruzione della
ghiandola dovuta a infezione, danno o
processi autoimmuni, da disordini genetici
(
(leucoadrenodistrofia)
)
• Secondario a IR