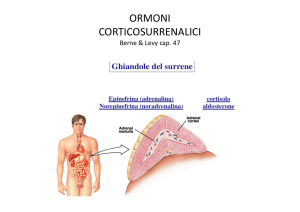
Le ghiandole surrenali
Situate in corrispondenza del polo renale
superiore ed adiacenti ad esso.
La vascolarizzazione deriva direttamente
dall’aorta, dalle arterie renali e dalle
arterie freniche.
Le vene surrenaliche di destra confluiscono
direttamente nella cava inferiore, quelle di
sinistra sono tributarie della vena renale
omolaterale.
Surreni
Costituiti da:
• ZONA CORTICALE
90%
(derivazione mesodermica)
• ZONA MIDOLLARE
10%
(derivazione neuroectodermica)
Compartimenti funzionali della
corteccia surrenale
glomerulare
fascicolare
ORMONE SECRETO
aldosterone
cortisolo
DHEA
FATTORI DI
sistema reninaangiotensina
ACTH
ACTH
ZONA
PRINCIPALE
CONTROLLO
reticolare
Ghiandola surrenale
12x
Caratteristiche delle cellule
secernenti steroidi
1. Colesterolo
accumulato in gocce
lipidiche
2. Abbondante Reticolo
Endoplasmatico liscio
3.Mitocondri particolari
• creste tubolari
• sferici
Ghiandole
Surrenali
• Corticale
– Glomerulare,
Fascicolata, Reticolare
– Mineralcorticoidi,
Glucocorticoidi,
Androgeni
• Midollare
– Adrenalina e
Noradrenalina
– Origine:
Neuroectoderma
Zona glomerulare
Zona fascicolata
Zona reticolare
Midollare
20x
Zona glomerulare
• Gruppi di cellule con nuclei
grandi e densi
• Abbondante sER
• Mineralcorticoidi
• Aldosterone
– Regola il sistema reninaangiotensina nel rene
128x
Zona Fascicolata
• Cellule chiare organizzate in fasci
– Spongiociti
• Citoplasma appare vacuolato perché
ricco gocce lipidiche
• sER, Mitocondri sferici
• Ormoni glicocorticoidi
– Cortisolo, sotto controllo Ipotalamo
– Metabolismo dei carboidrati
– Piccole quantità di ormoni sessuali,
androgeni
Zona Reticolare
• Cordoni di cellule che
formano una rete.
• Secernono androgeni
• Meno lipidi che nella
fascicolata più colore.
• Mitocondri allungati con
meno creste tubulari.
• Granuli di Lipofuscina
• Spessore varia a
seconda delle condizioni
fisiologiche.
Midollare del Surrene
• Cellule cromaffini
Granuli che si colorano di
giallo-marrone
• Sali di cromo
•
•
•
•
Citoplasma granulare
Basofilo
Secernono adrenalina
e noradrenalina
198x
Sintesi degli ormoni steroidei
ACTH: ormone
adreno
corticotrofico
PK: protein
chinasi
STAR: Steroidogenesis acute
regulator
Convertito a
pregnenolone
da citocromo
P450
11
Colesterolo Ormoni steroidei
12
Biosintesi degli ormoni steroidei
Colesterolo
Pregnenolone
17-OH pregnenolone
deidroepiandrosterone
Progesterone
17-OH progesterone
Androstenedione
11-deossi corticosterone
11-deossi cortisolo
Testosterone
Corticosterone
Cortisolo
Androgeni,19C
Glucocorticoidi, 21C
Aldosterone
Mineralocorticoidi, 21C
Estradiolo
13
Estrogeni, 18C
Secrezione degli ormoni steroidei
• Non immagazzinabili, liberati nel plasma appena sintetizzati
• Liposolubili, richiedono proteine di trasporto:
– Glucocorticoidi: -globulina (la sua presenza determina
la permanenza in circolo)
– Mineralocorticoidi: albumina (rapidamente eliminati)
– Androgeni: captati da gonadi e trasformati in altri
ormoni sessuali
• Il livello di ormone circolante è determinato da
– Velocità di sintesi
– Presenza della proteina di trasporto
• Semivita nel plasma più lunga degli ormoni non-steroidei e
non-tiroidei (non hanno proteine di trasporto)
14
Glucocorticoidi e cortisolo
• Sotto controllo di ACTH
– Ritmo diurno (10x la mattina vs la sera)
– Proteina di trasporto: Cortisol binding protein (CBG)
– T1/2=100 min
• EFFETTI:
– Aumento di gluconeogenesi, glicogeno, lipolisi, biosintesi proteica
(come glucagone, ma più lento)
• Può causare diabete
– Soppressione di risposta immunitaria ed infiammatoria
(specialmente cortisone)
• PATOLOGIE PRINCIPALI
– Morbo di Addison: insufficienza surrenalica ipoglicemia,
intolleranza a stress, debolezza, ipotensione
– Sindrome di Cushing: eccesso di glucorticoidi
(somministrazione farmacologica o adenoma delle surrenali)
iperglicemia, catabolismo delle proteine, perdita di massa
corporea
Mineralocorticoidi
• Sotto controllo del sistema renina-angiotensina
– Stimolato da ipotensione, dieta priva di sali
– Inibito da ipertensione, dieta ricca di sali
• EFFETTI:
– Stimolazione del trasporto attivo di Na+ nel
rene
• PATOLOGIE:
– Sindrome di Conn (aldosteronismo primario)
ipertensione, basso K+, alto Na+
Fisiopatologia e clinica
corticosurrenalica
• Insufficienza
corticosurrenalica
• Sindromi da iperfunzione
surrenalica
Insufficienza corticosurrenalica
Inadeguata secrezione di ormoni della
corteccia surrenale, in particolare di
cortisolo,
come
conseguenza
della
distruzione di più del 90% della corticale
del surrene (iposurrenalismo primario) o di
un deficit della secrezione ipofisaria di
ACTH (iposurrenalismo secondario*) o della
secrezione
ipotalamica
di
CRH
(iposurrenalismo terziario)
*spesso secondario a terapia prolungata con corticosteroidi
in malattie infiammatorie, allergiche, autoimmuni
Ipersurrenalismo (sindrome di Cushing)
♦ ↑ glucocorticoidi:
■ Esaltato catabolismo proteico nei muscoli→
diminuzione della massa muscolare degli arti (braccia e
gambe sottili)
■ Deposito di grassi nelle guance e nel tronco
■ Ipertensione arteriosa
■ Iperglicemia → diabete
■ Anormalità mentali
■ Faccia lunare
♦ ↑ gli androgeni → pseudopubertà precoce nel
maschio prepubere o pseudoermafroditismo nella
femmina
♦ ↑ aldosterone
Ipersurrenalismo o sindrome di Cushing
a) Viso a luna piena
b) Deposito di adipe a livello del tronco. Le
striature scure sono prodotte dal
catabolismo delle proteine a livello cutaneo
Iposurrenalismo (morbo di Addison)
Cause: distruzione autoimmune della corteccia
Sintomi:
■ Astenia (facilità a stancarsi)
■ Ipotensione→ collasso cardio-circolatorio
■ Ipoglicemia
■ Difficoltà a concentrarsi, instabilità emotiva e
depressione
■ Pigmentazione della cute (male bronzino), per
↑ACTH → ↑ MSH
RISPOSTA SINERGICA ALLO STRESS DA PARTE
DEL SURRENE
- Corteccia del surrene (glucocorticoidi), regolata
per via neuroumorale
- Midollare del surrene (catecolamine),regolata per
via nervosa (risposta rapida)
I glucocorticoidi aumentano il rilascio di ADRENALINA
Insufficienza corticosurreralica cronica
primitiva o Morbo di Addison: etiologia
• Adrenalite autoimmune
• Tubercolosi
19%
• Altre
–
–
–
–
–
–
–
–
80%
1%
Istoplasmosi, blastomicosi, sarcoidosi
Emocromatosi, amiloidosi
Malattie opportunistiche associate all’AIDS
Adrenomielodistrofia
Carcinomi metastatici
Deficit congenito familiare dei glucocorticoidi
Resistenza isolata ai glucocorticoidi
Iatrogene: ketoconazolo, mitotate, aminoglutemide,
metirapone
Morbo di Addison
La forma più frequente è quella autoimmune
caratterizzata da un’infiltrazione di linfociti T
citotossici, che porta all’atrofia bilaterale della
corticale dei surreni.
Sono stati individuati anticorpi circolanti contro la
21-idrossilasi ( raramente 17α-idrossilasi).
Talvolta si associa ad altre malattie autoimmuni:
• SPA di tipo 1 (m.di Addison, ipoparatiroidismo,
candidosi mucocutanea)
• SPA di tipo 2 (m. di Addison, tiroidite di
Hashimoto, DM1)
M. Di Addison: patogenesi
Distruzione o atrofia primaria del
corticosurrene
→
riduzione
dei
corticosteroidi (cortisolo) → inefficace
controregolazione
ipotalamo-ipofisaria→
aumento della secrezione di CRH e dei
peptidi
derivanti
dalla
proopiomelanocortina
ACTH
e
MSH
(responsabile della melanodermia).
All’ipocortisolismo si associa
ipoaldosteronismo.
M. Di Addison: quadro clinico
•
•
•
•
•
•
•
•
•
•
•
•
Astenia e adinamia intensa
Stato depressivo e apatia
Anoressia
Disturbi gastrointestinali (vomito, diarrea, dolori
crampiformi)
Dimagramento
Disordini elettrolitici (iperpotassiemie, iposodiemia)
Disidratazione
Ipotensione arteriosa (vertigini in ortostatismo e
lipotimie)
Desiderio di cibi salati
Ipoglicemia
Iperazotemia (da riduzione del filtrato glomerulare)
Melanodermia (iperpigmentazione)
M. Di Addison: terapia
Terapia sostitutiva: somministrazione
di dosi adeguate di idrocortisone o
cortisone acetato; a volte utile
l’associazione con farmaci ad azione
mineraloattiva (fluoroidrocortisone)
Sindromi da iperfunzione
surrenalica
La SINDROME di CUSHING è una
condizione di iperfunzione corticosurrenalica caratterizzata da una
prevalente iperincrezione di cortisolo.
Sindrome di Cushing
• ACTH-dipendente
– Morbo di Cushing
(ipersecrezione ipofisaria di ACTH)
– Sindrome da ACTH ectopico
12%
( es. carcinoma a chicco d’avena del polmone)
• ACTH-indipendente
68%
– Adenoma surrenalico
10%
– Carcinoma surrenalico
8%
– Iperplasia surrenalica micronodulare
1%
– Iperplasia surrenalica macronodulare < 1%
Sindrome di Cushing: quadro clinico
•
•
•
•
•
•
•
•
•
•
Obesità centripeta
Pletora facciale (facies lunare)
Ridotta crescita lineare (nel bambino)
Oligo-menorrea
Irsutismo
Ipertensione
Ridotta tolleranza glicidica
Impotenza
Osteopenia con fratture
Debolezza muscolare miopatia
94%
84%
80%
76%
73%
72%
67%
67%
59%
58%
Sindrome di Cushing: terapia
Chirurgica :
– asportazione adenoma ipofisario ACTHsecernente
– asportazione
adenoma
surrenalico
monolaterale cortisolo-secernente
– Surrenectomia bilaterale in caso di
iperplasia nodulare bilaterale (seguita da
terapia cortisonica sostitutiva)
Sintesi dei mineralcorticoidi
Zona glomerulosa
Stimoli:
- ACTH
- Angio II
Azione dell’aldosterone sui
tubuli renali
Sistema renina-angiostensina
aldosterone
Angiotensin
Converting Enzyme
Anti-ipertensivi
Iperaldosteronismo
• Primitivo (Sindrome di Conn)
• Secondario
Fisiopatologia
iperalosteronismo primitivo
(S.di Conn)
↑ aldosterone → ↑ rit Na+ → ↑ perdita k+
↓
↓ renina
↓
↓ angio II
Iperaldosteronismo primitivo (S. di Conn)
• Aumentata ed inappropriata produzione di
aldosterone → ritenzione Na, ipertensione
arteriosa, bassa renina plasmatica, ipo k
• Epidemiologia
- 2 % degli ipertesi
- F/M: 2 - 2,5/1 (adenoma; iperplasia M=F)
-Età: tutte (prev. 3a - 4a decade)
Iperaldosteronismo primitivo (S. di Conn)
• Anatomia patologica
– Adenoma (50%)
– Carcinoma (molto raro)
– Iperplasia bilaterale (nodulare o diffusa) (50%)
• Idiopatica
• Sensibile ai glucocorticoidi (ACTH“iperdipendente”)
• Iperplasia monolaterale (molto rara)
Iperaldosteronismo primitivo (S. di Conn):
Quadro Clinico
• Ipertensione arteriosa (da lieve a grave,
prevalentemente diastolica)
• Ipopotassiemia
• Alcalosi, tetania (rara)
• Poliuria, polidipsia (insensibilità ADH)
• Aritmie cardiache (ipertensione art., ipoK)
• Cefalea
• Edemi generalmente assenti
Iperaldosteronismi secondari
• Con ipertensione arteriosa
renina)
(> produzione di
– Ipertensione nefrovascolare
– Ipertensione maligna
– Reninoma
• Senza ipertensione arteriosa(> volume plasmatico
(edemi)/< K+)
–
–
–
–
–
–
–
Scompenso circolatorio
S.nefrosica
Cirrosi epatica
Tubulopatie renali
Diarrea, vomito
Abuso di diuretici, lassativi
S. di Bartter
midollare surrenalica
La midollare è la parte centrale delle ghiandole
surrenali.
È una struttura altamente specializzata del sistema
nervoso simpatico.
Di origine neuroectodermica, fa parte del sistema
simpatocromaffine e sintetizza catecolamine:
adrenalina (80%), noradrenalina e, in piccola
quantità, dopamina.
Cenni di Embriologia
Il tessuto cromaffine della midollare surrenalica e
dei gangli del sistema nervoso simpatico ha
un’origine comune, dalla cresta neurale.
I precursori del sistema simpatico, i simpatogoni,
originano dalla cresta neurale migrano ventralmente
differenziandosi nei neuroblasti paravertebrali e
preaortici. Da queste cellule originano quelle
gangliari e i feocromoblasti.
La midollare del surrene origina dai feocromoblasti,
migrano dai gangli simpatici nella corticale
surrenale formando degli agglomerati cellulari da
cui origina la midollare surrenale.
Il flusso ematico a livello della midollare
surrenalica deriva dall’arteria frenica
inferiore, derivante dall’aorta, dall’arteria
renale e dal sistema portale
corticomidollare che origina dalla zona
reticolare della corteccia surrenale.
NH2
Tirosina (alpha metilparatirosina)
OH
CO2H
Tirosina idrossilasi
(cAMP protein kinase, Glucocorticoid)
Sistema APUD
(amine precursor uptake
and decarboxylation)
Diidrossifenilalanina (DOPA)
Decarbossilasi aminoacida
L-aromatica
Dopamina
OH
Dopamina b-idrossilasi
OH
NH2
OH
Norepinefrina
Feniletanolamina
N-metiltransferasi (PNMT)
Epinefrina
OH
OH
H
N
OH
CH3
La
rimozione
delle
catecolamine
avviene
principalmente attraverso il meccanismo di
captazione
delle
stesse
nel
terminale
presinaptico chiamato uptake-I.
Le catecolamine possono anche essere rimosse
dal
tessuto
extraneuronale
uptake-2,
specialmente dal fegato e dal rene, dove sono
metabolizzate.
Le catecolamine vengono metabolizzate dalla
Catecol-O-metiltransferasi
(COMT),
che
converte la NE in normetanefrina e la
epinefrina in metanefrina e dalla monoammino
ossidasi (MAO) che converte la metanefrina e
normetanefrina in acido vanilmandelico e la NE
e E in acido 3,4 diidrossi mandelico.
Le catecolamine sono immagazzinate in
granuli secretori attivamente da una
pompa
H++
ATP
e
proteine
trasportatrici
quali
la
vesicular
monoamine transporters (VMATs)
Ruolo fondamentale dei recettori adrenergici
a livello periferico
I recettori alpha hanno un effetto eccitatorio con
l’eccezione del tratto gastrointestinale, dove producono
effetti inibitori.
I recettori beta producono effetti inibitori eccezione fatta
del cuore, dove hanno uno stimolo eccitatorio.
Recettori alfa- Adrenergici
Sottotipo
Agonisti
1
2
epinefrina
norepinefrina
Fenilefrina
Metossamina
Clonidina
a-metil NE
Antagonisti
Fentolamina, Fenossibenzamina
Prazosina
Yohimbine
Terazosina
rauwolscine
Secondi
Messaggeri
Fosfatidilinositolo
↑ del Ca2+ intracellulare
↓ dell’AMP ciclico
↓ o ↑ del Ca2+ e dello scambio
Na + /H +
Effetti
sistemici
Vasocostrizione,
rilassamento intestinale,
contrazione uterina,
midriasi
↓ della NE presinaptica,
aggregazione delle
plasmacellule,
vasoconstizione, ↓ secrezione
insulinica
Recettori beta- Adrenergici
Sottotipo
Agonisti
b1
b2
Isoprotenerolo, Epinefrina, NE
Denopamina
Terbutalina, Clenbuterolo
Albuterolo
Antagonisti
Propanololo, Nadololo, Timololo
Metoprololo
ICI 118551
Atenololo
Secondi
messaggeri
↑ dell’AMP
ciclico
↑ dell’AMP
ciclico
Effetti
Sistemici
↑ frequenza cardiaca
↑ contrattilità
↑ lipolisi
↑ secrezione di
renina
Rilassamento della
muscolatura liscia
↑ glicogenolisi nel
muscolo scheletrico
↑ NE presinaptica
Recettori b3 adrenergici aumentano la
termogenesi a livello del tessuto
adiposo bruno ed aumentano la lipolisi
Qualsiasi
tumore
che
produce,
immagazzina e secerne catecolamine
ed innesca la patologia caratterizzata
da
un
eccessivo
rilascio
di
catecolamine, può essere considerato
un feocromocitoma ed essere trattato
come tale indipendentemente dalla sua
localizzazione
Feocromocitoma
•La più importante malattia della midollare surrenale
è il Feocromocitoma.
• Nella ghiandola surrenale si ha 85%- 90% dei tumori
• Le localizzazione extra surrenale può essere trovata in
organi che originano dalla cresta neurale –Corpo carotideo,
chemorecettori aortici, gangli simpatici, organo di
Zuckerkand- e sono detti paraganglioma, chemodectoma.
• Incidenza del 0.8 x 100000 per anno
•La frequenza è uguale in entrambi i sessi, sono più
frequenti tra i 30 e i 50 anni.
•Il 10% dei casi sono bilaterali nella forma sporadica .
•Il 50% dei casi sono bilaterali e generalmente
intrasurrenalici nella forma familiare .
Forma familiari di Feocromocitoma I
Neoplasia Endocrina Multipla tipo 2a (Sindrome di Sipple):
• Mutazione del protoncogene RET Chr 10q11.2
•Carcinoma midollare della tiroide, Iperparatiroidsmo
Neoplasia Endocrina Multipla tipo 2b:
• Mutazione del protoncogene RET Chr 10
• Carcinoma midollare della tiroide, neuromi della mucosa,
ganglioneuroma intestinale, megacolon, habitus Marfanoide