27/02/12 Nomi e formule
dei composti
La necessità di una nomenclatura!
sità eces o e n
a
l
c
a ha
nivo
iplin odo u ncetto
c
s
i
o
m
d
c
i
n
i
n
o
ert e!!!! Og dicare
un c
di in efinito ta azion
er
d
ben o una c
AD OGGI SONO STATE CARATTERIZZATE CIRCA 50 MILIONI DI MOLECOLE da qui la necessità di ricorrere ad un linguaggio
convenzionale per indicare una determinata sostanza
Il problema è stato risolto nel 1787 acce7ando il tra7ato di Lavoisier: “Metodi della nomenclatura chimica”. In questo elaborato vengono fissaE i principi per elaborare il nome di una sostanza a par?re dalla sua composizione 1 27/02/12 Dai simboli alchemici alle formule
chimiche!
Assenza di corrispondenza tra simbolo e caraCeris?che della sostanza Salgemma CHIMICAMENTE SONO LA STESSA SOSTANZA “Cloruro di Sodio” NaCl!
Sale marino Da dove si parte?!
come e
r
a
v
r
e
s
o os
Dobbiam no tra loro gli ina
si comb !! !!
elemen1
Vennero presi come riferimento l’ H e l’ O in quanto formano una grande quan?tà di compos? Si va quindi a definire un Rapporto di Combinazione 2 27/02/12 Rapporti di combinazione!
Elemen? Rapporto nel composto Idrogeno e fluoro 1:1 Idrogeno e ossigeno 2:1 Idrogeno e azoto 3:1 Idrogeno e carbonio 4:1 Il concetto di valenza!
“La VALENZA è il numero di atomi di idrogeno (H) che un atomo di un certo elemento è in grado di legare” edere
o a v i m
a
i
And atomi d scun E
a
quan no lega ci
e
idrog nto!!!! e
elem
Elemento H che riesce a legare Valenza fluoro 1 MONOvalente ossigeno 2 BIvalente azoto 3 TRIvalente carbonio 4 TETRAvalente ADESSO PROVIAMO A SCRIVERE LE RISPETTIVE
FORMULE CHIMICHE
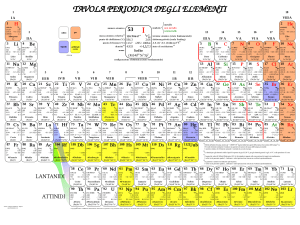
3 27/02/12 !"#$%&#'()"%*!+
1
IA
&#$
1
1
-1
Idrogeno
'(#)
4.002602
Simbolo
2
IIA
*+#,
6.941
1.0
9.012182
1
Litio
1.5
4
Elettronegativita
2
Massa
atomica
1.00794
2.20 1
-1
Idrogeno
Berilio
numero de
ossidazione
Nome
Metelli alcalini
Metalloidi
Metelli alcalino-terrosi
Non metalli
Metelli di transizione
Alogeni
Metelli
Gas nobili
4
5
6
7
IIIB
IVB
VB
VIB
VIIB
1.31 2
Sodio
Magnesio
2#$3
4.#1% 56#1$ 7(#11
8#1)
40.078
44.95592
47.867
50.9415
0.82 1
1.00 2
1.36 3
1.54 4
1.63 5
Potassio
Calcio
Scandio
Titanio
Vanadio
J#)3
85.4678
87.62
88.90585
0.82 1
0.95 2
1.22 3
Rubidio
Stronzio
Ittrio
8
9
Cesio
0.89 2 1.1
Bario
17
VIIA
4#=
-#?
C#@
VIII
12
IB
IIB
15.9994 18.998403 20.1797
3.04 2
3.98 -1
Ossigeno
Fluoro
5,3
Carbonio
Azoto
1.61 3
F#$;
4
-4
Silicio
1.90
Alluminio
5,3
2.19 -3
5#$=
Fosforo
63.546
65.38
1.90 2,1 1.65 2
1.33 4 1.6
5
Niobio
2.16 6,4 1.9 7,4
Molibdeno
Technezio
102.90550
2.2 4,3 2.28 3
Rutenio
Rodio
178.49
3 1.3
Lantanio
180.94788
4 1.5
Afnio
5
Tantalio
183.84
186.207
2.36 6,4 1.9
Tungsteno
190.23
4 2.2
Renio
4
Rame
69.723
72.64
74.92160
1.81 3
2.01 -4
2.18 -3
106.42
Zinco
4,2
112.411
114.818
118.710
2.20 4,2 1.93 1
1.69 2
1.78 3
Cadmio
Indio
1.96 -4
Paladio
Argento
Argon
5+#), *9#); 29#)=
5,3
4,2
Stagno
Arsenico
78.96
6,4,2
2.55 -2
79.904
2.96
-1
5,3,1
83.798
3.00 0,2
121.760
5,3
-3
Antimonio
1.9
127.60 126.90447 131.293
-1
6,4,2
0, 6,4,2
2.66 7,5,3,1 2.60
-2
Tellurio
Iodio
Xenon
2.1
FP#?@ DA#?3 &0#@% 7E#@$ FI#@1 *(#@) F>#@, DP#@; H:#@=
192.217
195.084 196.96657
2.28 4,2 2.54 3
Iridio
Germanio
107.8682
2.20 4
Osmio
Galio
0
Cloro
Krypton
101.07
Nichel
39.948
-1
Zolfo
N+#;,
98.9062
Cobalto
4E#$? D9#$@
35.453
3.16 7,5,3,1 -
M#;)
95.96
Ferro
6,4,2
-2
0
Neon
B9#,% -I#,$ />#,1 76#,) HA#,, HK#,; FL#,= D0#,? 4L#,@ M:#,3 5:#;% 5I#;$ 7+#;1
92.90638
Manganese
32.065
2.58
-
Bromo
91.224
Cromo
-+#$%
14.0067
3.04 --3
4
49#1, /:#1; <+#1= 4>#1? -(#1@ 4A#13 B:#)% G.#)$ G+#)1 D"#))
51.9961 54.938045 55.845 58.933195 58.6934
1.66 6,3 1.55 7,4,2 1.83 3,2 1.88 3,2 1.91 2
<#3
12.0107
2.04 3 2.55 -4
Boro
11
0
Elio
Selenio
Zirconio
132.90545 137.327 138.90547
0.79 1
16
VIA
DE#$) 5(#$,
10
4"#;; *.#;= '.#;? &S#?1 7.#?) R#?, H+#?; C"#?= M9#??
6
15
VA
26.981539 28.0855 30.973762
3
0.93 1
39.0983
14
IVA
*#;
Lantanidi e attinidi
-
13
IIIA
10.811
22.989769 24.3050
HI#)? 59#)@
5
Numero
atomico
&#$
-.#$$ /0#$1
3
&+#1
1.00794
2.20
2
18
VIIIA
Platino
Oro
200.59
204.3833
207.2
208.98040 208.9824 209.9871 222.0176
2.00 2,1 1.62 3,1 2.33 4,2 2.02
Mercurio
Thallio
Piombo
3
2.0 4,2 2.2
Bismuto
Polonio
-1
Astato
2.2
40
Radon
<9#@? H.#@@ D6#@3 HS#$%, !I#$%; 50#$%= *K#$%? &"#$%@ /P#$%3 !"#$$% H0#$$$ 4:#$$1 OAP#$$) )O#$$, OAQ#$$; #/Y$$= OA"#$$? OA>#$$@
7
223.0197 226.0254 227.0278
0.7
1
Francio
0.9
2 1.1
Radio
Attinio
3
261.11
262.11
-
-
-
Ruterfordio
-
Dubnio
263.12
262.12
-
-
-
Seaborgio
Bohrio
264
266.1378
-
-
Hassio
-
-
Meitnerio
269
-
272
-
-
277
-
-
284
-
Darmstadtio Roentgenio Copernicio
-
289
-
Ununtrio
-
288
-
)OHURYio
-
292
-
-
Ununpentio
293
-
/LYHUPRUio
-
294
-
Ununseptio
-
-
Ununoctio
4+#;@ F9#;3 -L#=% FT#=$ 5T#=1 UA#=) GL#=, 7I#=; !W#== &>#=? U9#=@ 7T#=3 JI#?% 'A#?$
Lantanidi
6
140.116 140.90765 144.242
144.9127
1.12 4,3 1.13 3
1.14 3
1.13 3
Praseodimio Neodimio
Prometio
Cerio
150.36
151.964
1.17 3 1.2
Samario
157.25
3,2 1.2
Europio
3
Gadolinio
158.92535 162.500 164.93032 167.259 168.93421 173.054
1.1
3
Terbio
1.22 3
Disprosio
1.23 3 1.24 3
Holmio
Erbio
1.25 3 1.1
Tulio
3
Itterbio
174.9668
1.27 3
Lutezio
7K#3% F.#3$ O#31 -Q#3) FA#3, DT#3; 4T#3= *V#3? 4S#3@ U"#33 <T#$%% /L#$%$ ->#$%1 '9#$%)
Attinidi
7
232.03806 231.03588 238.02891 237.0482 244.0642 243.0614
1.3
Torio
4 1.5
5
Protattinio
1.38 6
1.36 5
Uranio
Nettunio
1.28 4 1.13 3
Plutonio
Americio
247
247.0703 251.0796
1.28 3 1.3
Curio
3 1.3
Berkelio
3
Californio
252.03
1.3
3 1.3
Einstenio
L'unità di massa atomica (uma) vale 1/12 della massa dell'isotopo 12 dell carbonio (IUPAC - 2010).
257.0951
258.01
3 1.3
Fermio
3
Mendelevio
259.1009 260.1053
1.3
3
Nobelio
1.3
3
Laurenzio
http://profmokeur.ca © Ivan Noels - 2012
Nomenclatura IUPAC dei composti
binari!
IUPAC
Interna1onal Union of Pure and Applied Chemistry I compos1 binari sono tuI quelli forma1 da due soli elemen1 4 27/02/12 Composti binari dell’ossigeno!
Prendono il nome di OSSIDI Ossido di magnesio Nella formula chimica si fa precedere all’ossigeno l’elemento a cui esso è legato Nel nome, invece, si indica l’elemento a cui l’O è legato dopo l’espressione “Ossido di……….” Composti binari dell’ossigeno!
In base al Epo di elemento (metallo o non metallo) a cui l’ossigeno è legato, possiamo disEngue due classi di composE Ossidi basici Ossidi acidi • Metallo + Ossigeno • Non metallo + ossigeno Nella nomenclatura TRADIZIONALE sono deS ANIDRIDI 5 27/02/12 Esempio "1!
CuO Cu2O Ossido di rame Ossido di dirame Questa è la nomenclatura IUPAC, ma se volessi indicarli con quella TRADIZIONALE? La regola dice che si deve: Aggiungere il suffisso –OSO per indicare il composto che si forma con valenza minore ; Aggiungere il suffisso –ICO per indicare il composto che si forma con valenza maggiore. Esempio "1!
CuO Cu2O Ossido di rame Ossido di dirame Quant’è la valenza del Rame nei due ComposE? (II) (I) Ossido RAMEICO Ossido RAMEOSO 6 27/02/12 Esempio "2!
SnO SnO2 Come a7ribuisco il nome? Si indica ogni elemento aggiungendo i prefissi: MONO-­‐ DI-­‐ TRI-­‐ TETRA-­‐ PENTA-­‐ ESA-­‐ Monossido di stagno Diossido di stagno OPPURE: Ossido di stagno (II) Ossido di stagno (IV) Esempio "3!
FeO Fe (II) Fe2O3 Fe (III) Monossido di Ferro Triossido di diferro Ossido ferroso Ossido ferrico 7 27/02/12 Esempio "4!
CO Monossido di Carbonio Anidride carbonosa CO2 Diossido di carbonio Anidride carbonica RICAPITOLANDO!
• Gli ossidi si indicano: Elemento + O; • Si chiamano “Ossido di …….”aggiungendo il nome del metallo o del non metallo presente; NOMENCLATURA IUPAC UElizzo i prefissi: Mono-­‐ Di-­‐ Tri-­‐ Tetra-­‐ Penta-­‐ etc…. Per indicare il numero di ciascun elemento che forma il composto NOMENCLATURA TRADIZIONALE Se un elemento possiede più valenze uElizzo il suffisso –oso per indicare il composto in cui tale elemento è presente con valenza minore, ed –ICO per il composto in cui lo stesso si presenta con valenza maggiore. Se il composto è formato da non metallo + ossigeno si parla di anidride 8 27/02/12 Per Casa….. • STUDIARE DA 88 A 95 •
•
•
•
ESEMPIO SVOLTO PAG 92 (a, c) PROVA TU PAG 93 (a, c) DOMANDE E PROBLEMI PAG 93 (a, e) ESEMPI SVOLTI PAG 95 (sia gli esempi che i prova tu) 9