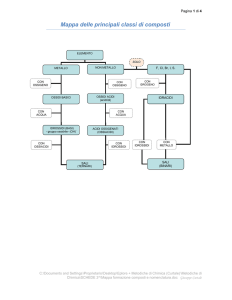
COMPOSTI INORGANICI
(MexOY)
+O2
METALLI
OSSIDI
BASICI
+H2O
IDROSSIDI
(idrossido di Me)
mono…
di…
tri
tetra……
(ossido di…..Me)
monossido…
biossido…
+ H2
IDRURI
(MexHy)
(idruro di Me)
diidruro….
n.o. -1
(MexNMey)
SALI
(……ato di… Me (n.o.)
……ito di …Me (n.o.)
+H2
Solo per Elem. VII gr. + S
NON METALLI
+O2
IDRACIDI
(ac……..idrico) oppure
Come composti binari dell’idrogeno
….uro di idrogeno
OSSIDI +H2O
ACIDI o
ANIDRIDI
OSSIACIDI
(ac. ……ico
ac……..oso)
numero di ossidazione: carica formale di un atomo ottenuta assegnando gli
elettroni Regole:
dei legami covalenti polari all’atomo più elettronegativo che forma il
legame. E’1. la
caricadiche
l’atomo
avrebbesostanza
se il legame
ionico.
Es. H2O,
Il numero
ossidazione
di qualunque
allo stato fosse
elementare
è ZERO
H2O2
(Cl2, N2)
2. Gli elementi più elettronegativi assumono numero di ossidazione negativo, e
la grandezza del numero di ossidazione corrisponde + o – alla valenza o al
numero dei legami a coppia di elettroni.
Nel caso 3.inLa cui
glideiatomi
nel
legame
dello
somma
numeri coinvolti
di ossidazione
degli
elementisono
presenti
in unastesso
qualunqueelemento
(stessa elettronegatività)
gli elettroni
equamente
divisi(OF
tra
i due
molecola o ione deve uguagliare
sempre lavengono
carica complessiva
della specie.
2,
2 )
atomi cheAlO
formano
il legame covalente puro e il n.o. è 0. Es. O2
4. Metalli (gr I A: n.o. 1+; gr. II A: n.o. 2+;gr. III A: Al: n.o. 3+; F: n.o. 1; O quasi sempre n.o. -2 tranne nei perossidi dove ha n.o. -1)
Gli indici devono
ridotti
ai minimi
termini,
per es.
alhacomposto
che si
5. L’ H haessere
sempre n.o.
+1, tranne
negli idruri
dei metalli
dove
n.o. -1
forma tra calcio ed ossigeno, che hanno, rispettivamente, numero di
ossidazione +2 e 2, si otterrebbe la formula Ca2O2, mentre la formula
corretta è CaO.
COMPOSTI BINARI DELL’OSSIGENO
METALLO
NonMETALLO
+ OSSIGENO
=
=
OSSIDI ACIDI o ANIDRIDI
OSSIDI BASICI
(Me o) nMey
+ OSSIGENO
x
O
x
y
Elemento con elettronegatività minore a sn seguito dall’ossigeno, la somma dei numeri di
ossidazione deve essere 0, quindi se gli elementi hanno n.o. diversi, un elemento deve essere
presente con un numero di atomi equivalente al n.o. dell’altro e viceversa
OSSIDI METALLICI
l’ossigeno è molto più elettronegativo dei metalli, tutti gli ossidi sono
composti ionici,solidi a temperatura ambiente
Nomenclatura IUPAC
Na2O
CaO
MgO
FeO
Fe2O3
Cu2O
CuO
Ag2O
Ossido di disodio
Ossido di calcio
Ossido di magnesio
Ossido di ferro
Triossido di diferro
Ossido di dirame
Ossido di rame
Ossido di diargento
N.B. l’ossigeno ha sempre n.o. -2
Notazioni di Stock
Ossido di ferro (II)
Ossido di ferro (III)
Ossido di rame (I)
Ossido di rame (II)
Nomenclatura tradizionale
Ossido di sodio
Calce viva
Ossido di magnesio (magnesia)
Ossido ferroso
Ossido ferrico
Ossido rameoso
Ossido rameico
Ossido d’argento
OSSIDI dei non METALLI
le anidridi sono composti covalenti più o meno polari, che a temperatura
ambiente possono essere solidi, liquidi o gassosi
Nomenclatura IUPAC
Notazioni di Stock
Nomenclatura tradizionale
Gr.IV A: CO
CO2
Monossido di carbonio
Biossido di carbonio
Ossido di carbonio (II)
Ossido di carbonio (IV)
Anidride carbonica
Gr.V A:
N2O
NO
N2O3
NO2
N2O5
Monossido di diazoto
Monossido di azoto
Triossido di diazoto
Biossido di azoto
Pentossido di diazoto
Ossido di azoto (I)
Ossido di azoto (II)
Ossido di azoto (III)
Ossido di azoto (IV)
Ossido di azoto (V)
Protossido di azoto
Monossido di azoto
Anidride nitrosa
Ipoazotide
Anidride nitrica
P2O3
P2O5
Triossido di difosforo
Pentossido di difosforo
Ossido di fosforo (III)
Ossido di fosforo (V)
Anidride fosforosa
Anidride fosforica
Gr.VI A: SO2
SO3
Diossido di zolfo
Triossido di zolfo
Ossido di zolfo (IV)
Ossido di zolfo (VI)
Anidride solforosa
Anidride solforica
Gr.VII A: Cl2O
Cl2O3
Cl2O5
Cl2O7
monossido di dicloro
Triossido di dicloro
Pentossido di dicloro
Eptossido di dicloro
Ossido di cloro (I)
Ossido di cloro (III)
Ossido di cloro (V)
Ossido di cloro (VII)
Anidride ipoclorosa
Anidride clorosa
Anidride clorica
Anidride perclorica
Eccezione OF2 = l’ossigeno ha n.o. +2, perché il fluoro è più elettronegativo
dell’ossigeno.
COMPOSTI BINARI DELL’IDROGENO
METALLO o Non METALLO
=
+ IDROGENO
IDRURI
Me (o Non Me)Hx
N.B.Idruri metallici H ha n.o.-1
Idruri non metallici H ha n.o. +1
ALOGENO (o ZOLFO)
=
+ IDROGENO
IDRACIDI
H alogeno (o zolfo)
COMPOSTI BINARI DELL’IDROGENO
IDRURI
Nomenclatura IUPAC
Notazione di Stock
Nomenclatura tradizionale
NaH
LiH
Idruro di sodio
Idruro di litio
CaH2
Diidruro di calcio
AlH3
BH3
Triidruro di alluminio
Triidruro di boro
FeH2
FeH3
Diidruro di ferro
Triidruro di ferro
NH3
PH3
AsH3
Triidruro di azoto
Triidruro di fosforo
Triidruro di arsenico
Ammoniaca
Fosfina
Arsina
CH4
SiH4
Tetraidruro di carbonio
Tetraidruro di silicio
Metano
Silano
Borano
Idruro di ferro (II)
Idruro di ferro (III)
Idruro ferroso
Idruro ferrico
N.B. Con i metalli l’idrogeno ha n.o. -1, mentre nei composti con i non metalli ha n.o. +1
COMPOSTI BINARI DELL’IDROGENO
IDRACIDI
Gli idracidi sono composti covalenti polari ed a temperatura ambiente sono
tutti gassosi, tranne HF, che è liquido a causa del legame a ponte di idrogeno
Nomenclatura IUPAC
HF
HCl
HBr
HI
H2S
Floruro di drogeno
Cloruro di idrogeno
Bromuro di idrogeno
Ioduro di idrogeno
Solfuro di idrogeno
Nome tradizionale
Acido fluoridrico
Acido cloridrico (acido muriatico)
Acido bromidrico
Acido iodidrico
Acido solfidrico
COMPOSTI TERNARI
OSSIDI BASICI + H2O
=
IDROSSIDI
Meyx(OH)y
(Idrossido di……nome del metallo)
OSSIDI ACIDI + H2O
=
OSSIACIDI
HxNonMeyOz
(Acido + suffisso ICO alla radice
nome del non metallo, il numero degli
atomi di ossigeno vengono precisati
con prefissi monoosso, diosso…inoltre
per individuare perfettamente il
composto si aggiunge traparentesi il
n.o. del non metallo)
N.B. OH- è da considerare uno ione covalente e come per tutti gli ioni il n.o. equivale al valore alla carica
Negli ossiacidi, l’idrogeno ha sempre n.o. +1, mentre l’ossigeno n.o. -2; conoscendo questi due
valori è facile ricavare il n.o. del non metallo.
IDROSSIDI
il gruppo ossidrile (OH) si comporta come se avesse numero di ossidazione 1. Gli idrossidi sono tutti composti ionici e sono pertanto tutti solidi a
temperatura ambiente.
Nomenclatura IUPAC
Notazione di Stock
Nomenclatura tradizionale
NaOH
KOH
Idrossido di sodio
Idrossido di potassio
Soda caustica
Potassa caustica
Mg(OH)2
Ca(OH)2
Diidrossido di magnesio
Diidrossido di calcio
Idrossido di magnesio
Idrossido di calcio
Al(OH)3
Triidrossido di alluminio
Idrossido di alluminio
Fe(OH)2
Fe(OH)3
CuOH
Cu(OH)2
Diidrossido fi ferro
Triidrossido di ferro
Idrossido di rame
Diidrossido di rame
Idrossido di ferro (II)
Idrossido di ferro(III)
Idrossido di rame (I)
Idrossido di rame (II)
Idrossido ferroso
Idrossido ferrico
Idrossido rameoso
Idrossido rameico
OSSIACIDI
piccola differenza di elettronegatività esistente tra questi elementi, gli
ossiacidi sono composti covalenti polari solidi o liquidi a temperatura
ambiente
Nomenclatura IUPAC
Nomenclatura tradizionale
HBO2
H3BO3
Ac. diossoborico (III)
Ac.triossoborico (III)
Ac. boroso
Ac. borico
H2CO3
Ac. triossocarbonico (IV)
Ac carbonico
HNO2
HNO3
H3PO3
H3PO4
Ac. diossonitrico (III)
Ac triossonitrico (V)
Ac. triossofosforico (III)
Ac.tetraossofosforico (V)
Ac.
Ac.
Ac.
Ac.
H2SO3
H2SO4
Ac.triossosolforico (IV)
Ac.tetraossosolforico (VI)
Ac. solforoso
Ac. solforico
HClO
HClO2
HClO3
HClO4
Ac.monossoclorico (I)
Ac.diossoclorico (III)
Ac.triossoclorico (V)
Ac.tetraossoclorico (VII)
Ac.
Ac.
Ac.
Ac.
H2CrO4
H2Cr2O7
Ac. tetraossocromico (VI)
Ac.eptaossocromico (VI)
Ac. cromico
Ac.bicromico
nitroso
nitrico
fosforoso
fosforico
ipocloroso
cloroso
clorico
perclorico
A volte, il grado di idratazione (numero di molecole d'acqua
addizionate all'ossido di partenza) non è unico: si utilizzano in
questo caso i prefissi “meta-” “piro-” “orto-” per differenziare
le specie acide risultanti (il prefisso “orto-” viene in genere
omesso)
P2O5 + 1 H2O = HPO3 ac. metafosforic
P2O5 + 2 H2O = H4P2O7 ac. pirofosforico
P2O5 + 3 H2O = H3PO4 ac. ortofosforico
DECOMPOSIZIONE DEGLI ACIDI IN ACQUA
Quando questi composti vengono disciolti in acqua, l’acqua, che è un solvente polare, rompe il
legame tra ossigeno ed idrogeno, oppure tra idrogeno e non metallo, mandando in soluzione
ioni H+ ed anioni costituiti da tutti gli altri atomi della molecola di partenza.
HClO4 → H++ ClO4H3 B O3 → 3H++ B O33-
H2CO3 → 2H++ CO32H4 S iO4 → 4H++ SiO44O
O
H
H
C
O
O
H2CO3
H
Cl
O
O
O
HClO4
Cl
H
HCl
S
H
H
H2S
Decomposizione in acqua degli acidi ternari
Negli acidi ternari gli anioni che vanno in soluzione sono anioni poliatomici, formati dal non
metallo ed dall’ossigeno legati da legame covalente, ed hanno tante cariche negative quanti sono
gli ioni H+che si liberano.
Nomenclatura anioni binari
Negli acidi binari gli anioni che vanno in soluzione sono anioni monoatomici,
formati dal non metallo, ed hanno tante cariche negative quanti sono gli ioni H+
che si liberano. Esempio:
HCl → H++ Cl-
H2S → 2H++ S2-
Nomenclatura degli anioni monoatomici
Sia la nomenclatura tradizionale, che quella ufficiale, stabiliscono che
il nome dell’anione monoatomico si ottiene aggiungendo la desinenza
uro al nome del non metallo.
Ad esempio: F- anione fluoruro; Cl- anione cloruro; Br- anione
bromuro; I- anione ioduro; S2- anione solfuro; Se2- anione seleniuro.
Nomenclatura anioni poliatomici
Nomenclatura IUPAC
Il nome dell’anione si
ottiene precisando, coi
soliti prefissi, il numero
degli atomi di ossigeno
presenti, attribuendo la
desinenza ato al nome del
non metallo ed indicando
tra parentesi il suo numero
di ossidazione
Nomenclatura tradizionale
Acido ternario
Ipo…….oso
..…….oso
……….ico
Per……..ico
Anionepoliatomico
→
→
→
→
Ipo……..ito
……….ito
……ato
Per…….ato
Anione monossoclorato (I) ClO- ← Acido monossoclorico HClO acido ipocloroso → ClO- anione ipocloroso
IUPAC
Tradizionale
SALI
COMPOSTI BINARI
METALLO + Non METALLO e derivano dalla reazione tra acido binario e idrossido
N.B. per conoscere la formula del sale che verrà a formarsi bisogna scrivere prima le
reazioni di decomposizione in acqua, si uniscono poi il catione metallico con l’anione non
metallico e L’H+ con l’OH- a formare acqua
HCl → H+ + ClNaOH → Na+ + OH-
Na+ + Cl-+ H+ + OH-→ NaCl + H2O
Nomenclatura IUPAC
Si scrive prima il nome del non metallo, terminante in URO, poi si aggiunge di ed il nome del
metallo; ciascun nome viene preceduto dai soliti prefissi che indicano il numero di atomi presenti
per ciascun elemento
Nomenclatura tradizionale
Se il metallo ha un sola numero di ossidazione: nome non metallo terminante in URO + di nome
metallo (es. cloruro di sodio [NaCl], fluoruro di potassio [KF]);
b) se il metallo ha due numeri di ossidazione: nome non metallo terminante in URO + nome
metallo terminate in OSO, per il numero di ossidazione più basso; nome non metallo terminante
in URO + nome metallo terminate in ICO per il numero di ossidazione più alto
SALI
COMPOSTI TERNARI
METALLO + Non METALLO + OSSIGENO e derivano dalla reazione tra un acido ternario e un
idrossido
Ca(OH)2 → Ca2+ + 2 OHH3BO3 → 3 H+ + BO33-
3Ca(OH)2 + 2H3BO3 → Ca3(BO3)2 +6H2O
Nomenclatura IUPAC
Si scrive per primo il nome del non metallo, terminante in ATO, con l’indicazione, tra parentesi,
del suo numero di ossidazione; quindi si aggiunge di ed il nome del metallo, avendo cura di
indicare, con le solite desinenze, il numero di atomi di ossigeno presenti nell’anione ed il numero
di atomi del metallo
Nomenclatura tradizionale
La nomenclatura di un sale ternario si ottiene indicando per primo il nome dell’anione
poliatomico, ricavabile dalla reazione di decomposizione in acqua dell’acido, e poi quello del
catione metallico. se il metallo ha due numeri di ossidazione di utilizzano le solite desinenze
OSO, per il numero di ossidazione minore ed ICO per il numero di ossidazione maggiore.
Numeri di ossidazione di alcuni elementi
Gruppo del sistema
periodico
Elementi
Numero di ossidazione
Li, Na,K
+1
Be,Mg, Ca,Sr, Ba
+2
3
B
Al
+3
+3
4
C
Si
+2, +4
+4
5
N, P
As, Sb
Bi
-3, +3, +5
-3, +3, +5
+3
6
O
S
-2 (-1)
-2, +4, +6
7
F
Cl
Br
I
-1
-1, +1, +3, +5, +7
-1, +1, +5
-1, +1, +5, +7
Cr
+2, +3
+6
+2, +3, +4
+6, +7
+2, +3
+2, +4
+1, +2
+1
+1, +3
+2
1
2
Mn
Elementi di transizione
Fe, Co, Ni
Pt
Cu, Hg
Ag
Au
Zn, Cd
pentafluoruro di fosforo
bromuro di sodio
tricloruro di alluminio
tetraossosolfato (VI) di disodio
ossido di azoto
Diidrogenotetraossofosfato (V) di potassio
clorato di sodio
ossido ferrico
anidride solforosa
ioduro di idrogeno
idrossido di bario
carbonato di alluminio (III)
NaClO3
Fe2O3
SO2
HI
Ba(OH)2
Al2(CO3)3
PF5
NaBr
AlCl3
Na2SO4
NO
KH2PO4
Triossoclorato di sodio
Triossido di diferro
Diossido di zolfo
Ioduro di idrogeno
Diidrossido di bario
Triossocarbonato (IV) di alluminio