DIDATTICA INTERATTIVA
06/03/2013
Alessia Giofrè
LABORATORIO DI CITOMETRIA A FLUSSO
Prof.ssa Bonaccorsi
Vedremo diverse applicazioni di questa tecnica che è la citometria che sfrutta uno strumento
che è il citometro e sostanzialmente serve a caratterizzare cellule, popolazioni cellulari sia
del sangue periferico, quindi cellule dei sistemi vitali, leucociti, ma anche cellule di altra
derivazione, di tessuti diversi, ad esempio le cellule tumorali stesse che sono caratterizzate.
I tessuti devono essere comunque processati perché le cellule devono essere sospese e da
una sospensione monocellulare si può ottenere un campione che può essere poi analizzato
tramite citometria. Quindi possiamo analizzare sia cellule in sospensione, sia le cellule del
sangue che cellule di tessuti che devono essere ovviamente prima processate. I tessuti
devono essere disgregati, ma la sospensione cellulare che si ottiene può essere analizzata
tramite il citometro, quindi, caratterizzate tramite il citometro.
Ma cosa significa caratterizzare una popolazione cellulare? Significa, in primis, andare ad
evidenziare quelli che sono i marker che identificano una determinata popolazione, quelli
che possono essere le molecole che vengono espresse selettivamente da una determinata
popolazione e che quindi la caratterizzano, permettono di identificarla per esempio nel
sangue periferico.
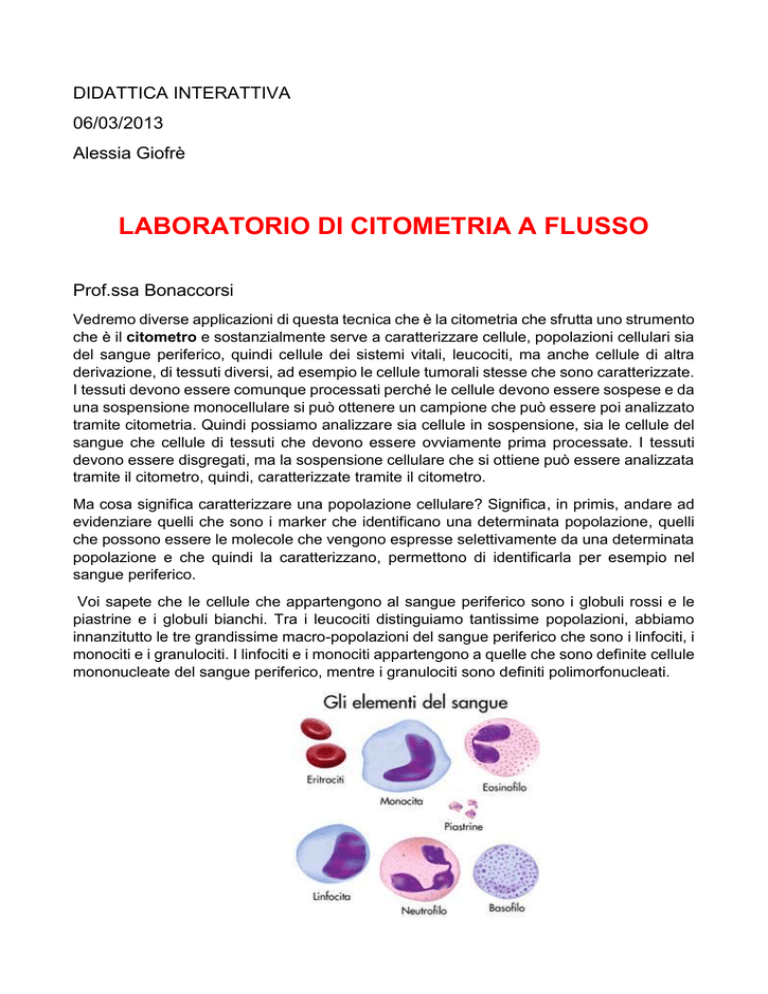
Voi sapete che le cellule che appartengono al sangue periferico sono i globuli rossi e le
piastrine e i globuli bianchi. Tra i leucociti distinguiamo tantissime popolazioni, abbiamo
innanzitutto le tre grandissime macro-popolazioni del sangue periferico che sono i linfociti, i
monociti e i granulociti. I linfociti e i monociti appartengono a quelle che sono definite cellule
mononucleate del sangue periferico, mentre i granulociti sono definiti polimorfonucleati.
Tra le mononucleate (quindi monociti e linfociti) e, in particolare, tra i linfociti definiamo altre
sotto-popolazioni : i linfociti T e i linfociti B, che sono cellule dell’immunità specifica, del
sistema immunitario specifico e poi abbiamo le cellule natural killer, le famose cellule NK
che sono più recenti nell’ordine di scoperta, di identificazione e sono una popolazione di
linfociti particolari rispetto alle altre due perché non appartengono all’immunità specifica,
sono sempre linfociti, ma appartengono all’immunità innata .
Questo per farvi capire che nel sangue periferico esistono tante popolazioni di leucociti e
tante sottopopolazioni di linfociti, ciascuna delle quali può essere caratterizzata attraverso
l’analisi di marker ben precisi, per esempio abbiamo detto che i linfociti si distinguono in T,
B e natural killer. I T si caratterizzano per l’espressione di questa molecola che è il CD3; i B
sono caratterizzati dal CD19 e le NK dal CD56+, CD3- . Tra i T possiamo distinguere
popolazioni molto importanti dell’immunità cellulo-mediata, che sono i linfociti T helper e i
linfociti T citotossici; entrambi, in quanto linfociti T, saranno sempre positivi per questa
molecola che è il CD3 che caratterizza tutti i linfociti. Quindi saranno CD3+, ma le due
sottopopolazioni di T che avranno funzionalità diverse, avranno anche un fenotipo diverso,
quindi una diversa espressione di molecole di superficie. Infatti, i CD3 T helper
esprimeranno i CD4, i CD3 linfociti T citotossici esprimeranno CD8. Quindi saranno entrambi
CD3+, ma l’uno sarà CD8+, CD4- che saranno i linfociti T citotossici, i T helper saranno
CD3+, CD8 –, CD4+.
Si distingueranno queste molecole per questi marker, quindi si distingueranno per quello
che è definito il fenotipo, cioè l’espressione di queste molecole di superficie, di questi
marker. Solitamente ad una distinzione di fenotipo corrisponde anche una distinzione
funzionale. Infatti, queste cellule nell’ambito della loro attività funzionale nel sistema
immunitario svolgeranno ruoli completamente diversi e quindi per questo distingueremo i
linfociti helper dai linfociti T citotossici. Gli helper saranno di ausilio all’immunità mediata dai
linfociti T e linfociti B producendo citochine. I linfociti citotossici svolgeranno essi stessi
un’azione infettrice, cioè andranno ad agire direttamente con azione citotossica, cioè lesiva
sulle cellule infettate da virus, patogeni in generale, sulle cellule che il sistema immunitario
deve combattere. Quindi ad una distinzione fenotipica corrisponde quasi sempre una
distinzione funzionale. È per questo che si vogliono caratterizzare tutte le popolazioni
cellulari perché hanno una differente funzionalità nell’ambito del sistema immunitario.
Questa caratterizzazione funzionale si può andare poi a caratterizzare per citometria.
Si possono andare, infatti, a caratterizzare non solo molecole di superficie per citometria,
ma si possono andare anche ad identificare le diverse molecole solubili, come per esempio
le citochine che vengono ad essere prodotte in maniera diversa dalle varie popolazioni del
sangue periferico. Queste citochine vengono prodotte nel citoplasma e possono essere
dedectate tramite citometria quando sono ancora nel citoplasma mediante quella che viene
chiamata marcatura intra citoplasmatica, cioè si utilizza un reagente come quelli che si
utilizzano per la marcatura di superficie, che viene fatto penetrare all’interno del citoplasma
dove va a dedectare le citochine, le molecole presenti ancora all’interno del citoplasma.
Come viene fatto entrare questo reagente? Sostanzialmente, la metodica in questo caso
chiamata appunto marcatura intra citoplasmatica si differenzia dalla marcatura di superficie
che è quella che caratterizza appunto le molecole espresse sulla membrana citoplasmatica,
perché prevede una procedura di permeabilizzazione della cellula; procedura che avviene
successivamente al fissaggio. II fissaggio permette alle cellule di rimanere inalterate durante
la permeabilizzazione. La permeabilizzazione si effettua con un detergente che proprio,
volgarmente, provoca dei fori sulle membrane cellulari. Questi fori permettono l’entrata del
reagente, che deve andare a dedectare all’interno della cellula la sua molecola target.
Quindi, questi fori, sostanzialmente questa permeabilizzazione permette anche una
detection di molecole che sono contenute all’interno della cellula. Quindi, questa è la
differenza della marcatura di superficie da quello che è chiamato fenotipo di superficie che
caratterizza solo e che avviene in assenza di permeabilizzazione e può caratterizzare le
molecole che sono espresse all’esterno della cellula. La marcatura intra citoplasmatica
consente anche la detection di citochine, quindi di molecole coinvolte non solo nella
caratterizzazione di un determinato subset, cioè di una determinata popolazione di cellule,
ma anche nell’attività funzionale, quindi caratterizza una vera e propria funzione delle
cellule; in questo caso la produzione di citochine. Quindi, può determinare qualitativamente
e quantitativamente quanto queste cellule, funzionalmente, sono abili a produrre queste
citochine.
Fino a questo momento abbiamo visto due applicazioni della citometria:
- l’immuno- fenotipo di superficie (abbiamo visto come caratterizzare per esempio i linfociti
T);
- la produzione di citochine intra citoplasmatica.
Abbiamo una terza applicazione molto recente della citometria: la possibilità di andare a
determinare qualitativamente e quantitativamente anche citochine o molecole solubili in
generale che vengono rilasciate all’esterno delle cellule, possono essere rilasciate in un
fluido biologico quale può essere per esempio un essudario infiammatorio , qualsiasi fluido
ottenuto ex vivo oppure possono essere dei tamponi ottenuti dalla coltura in vitro di cellule
del sistema immunitario o di cellule tumorali per esempio. Quindi, molecole solubili rilasciate
dalle cellule che vengono coltivate in vitro.
Fino a pochi anni fa, la prerogativa di misurare molecole solubili era appannaggio di una
tecnica che non utilizzava il citometro, che si chiama tecnica ELISA e che utilizza uno
spettrofotometro. Ormai da una decina di anni è possibile svolgere questa misurazione, per
esempio, di citochine nei liquidi biologici che prima era appannaggio solo dell’Elisa.
Per terminare il quadro delle applicazioni della citometria volevo fare un accenno alle
possibili metodiche applicate a scienze diverse dall’immunologia. Abbiamo detto che serve
ad esempio per caratterizzare cellule tumorali, ma può caratterizzare anche l’attività di
farmaci antitumorali utilizzati in terapia e in fase di sperimentazione. Ad esempio, tramite
citometria si possono fare analisi delle molecole prodotte durante l’apoptosi, ad esempio
l’analisi dell’apoptosi può essere fatta attraverso l’analisi della miessina(???). Questo è un
test che permette di valutare se un farmaco ha indotto un’attività pro-apoptotica e si può
fare tramite una marcatura con questi reagenti per la miessina e lettura sempre allo
spettrofotometro; quindi, è un modo per valutare farmaci pro-apoptotici. Ancora un aspetto
molto interessante è legato per esempio all’attività di molti farmaci citostatici (i farmaci usati
in oncologia sono farmaci citostatici), significa che bloccano la proliferazione cellulare che
è alterata a livello tumorale bloccando le cellule in una determinata fase del ciclo cellulare
in cui non avviene la proliferazione. Questa analisi del ciclo cellulare che determina uno
stato di citostasi, può essere effettuata tramite il citometro, andando ad utilizzare dei
reagenti che vanno a marcare il DNA e che quindi permettono di rivelare le varie fasi del
ciclo cellulare: quindi questa è un’ulteriore applicazione che si aggiunge a quelle
precedentemente dette della citometria.
Ma tutte queste applicazioni come vengono effettuate?
Quello che vedrete in questa prima fase è come viene preparato il campione per essere poi
letto attraverso lo strumento che è il citometro. Che cosa utilizza la citometria? Abbiamo
detto che la citometria è un’applicazione trasversale, è un’applicazione che sfrutta uno
strumento che deriva dall’immunologia, ma in realtà la sua applicazione è trasversale
perché offre approcci di interesse anche a tante altre scienze mediche di laboratorio. Cioè,
è uno strumento che in realtà si basa su principi che vengono forniti dall’immunologia, ma
che svolge analisi che possono essere usate anche da altre scienze biomediche.
In realtà, lo strumento principale che fornisce l’immunologia, qual è? E’ lo strumento che
permette la detection tramite citometria, l’anticorpo. Cosa sono gli anticorpi? Abbiamo detto
che sono strumenti dell’immunologia, perché? Perché sono molecole solubili che vengono
prodotte proprio da cellule del sistema immunitario. Sono molecole solubili che vengono
prodotte dai linfociti B, quindi come tali i linfociti B appartenendo all’immunità specifica
producono delle molecole che sono esse stesse dotate di un’elevatissima specificità. E
proprio questa caratteristica della specificità rende queste molecole molto utili e molto
interessanti dal punto di vista diagnostico e di ricerca, perché li rende degli strumenti sonda
molto importanti. Proprio in relazione alla loro elevatissima specificità, gli anticorpi riescono
a discriminare e a legarsi solo all’antigene che ne ha indotto la produzione. Cioè l’antigene
è capace di stimolare il linfocita B a produrre gli anticorpi e sarà l’unico e il solo antigene a
poter legare quel determinato anticorpo. Capite bene che questa assoluta specificità rende
questi anticorpi degli strumenti molto utili, molto importanti come sonde qualitative perché
fa si che queste molecole possano discriminare in un campione biologico anche tra antigeni
leggermente diversi tra loro andandosi a legare soltanto all’antigene specifico e quindi
andando a rilevare qualitativamente quell’antigene. In realtà, essi sono anche degli
strumenti quantitativi di misurazione dell’antigene perché realmente l’affinità di legame per
l’antigene… Perché una caratteristica molto importante che rende questi anticorpi strumenti
molto importanti, è l’elevata capacità di queste molecole di legarsi all’antigene anche
quando questo è presente in concentrazioni molto basse in soluzione perché riesce a
legarsi all’antigene in maniera direttamente proporzionale, cioè sostanzialmente una
determinata quantità dell’anticorpo lega sempre una stessa quantità dell’antigene. Quindi,
sostanzialmente conoscendo la quantità di anticorpo che viene ad essere utilizzato in una
determinata reazione si può risalire alla quantità di antigene. Sostanzialmente, l’anticorpo
non è solo una sonda qualitativa, ma è anche una sonda quantitativa: viene definito una
sonda quali-quantitativa, perché conoscendo la quantità di anticorpo che reagisce in una
determinata reazione si può risalire alla quantità di antigene. Quindi, perché vi sia una
reazione stechiometrica, vi è un rapporto direttamente proporzionale fra l’antigene che
reagisce con l’anticorpo. Capite che in questo contesto l’anticorpo può essere utilizzato in
diverse applicazioni proprio come sonda. Ma per completare il quadro di preparazione di un
campione per la lettura al citometro, per essere dedectato dal citometro un anticorpo deve
essere una sonda quali-quantitativa. Per andare a determinare una molecola in particolare,
dev’essere legato ad una molecola che lo renda tracciabile, che renda l’anticorpo
monitorabile dal citometro; questa molecola è il fluorocromo.
Il fluorocromo è una molecola che si lega all’anticorpo e si dice che l’anticorpo viene
coniugato con il fluorocromo e che rende questo anticorpo tracciabile, perché il fluorocromo
è una molecola che ha la caratteristica di assorbire una radiazione ad una determinata
lunghezza d’onda che è specifica per lo stesso ed emetterne un’altra. Questa radiazione
che viene emessa dal fluorocromo, viene dedectata dallo strumento citometro, da un
sensore specifico e quindi serve, viene associata alla presenza dell’anticorpo con il quale
questo fluorocromo è legato. Quindi il fluorocromo assorbendo ed emettendo lunghezze
d’onda rende l’anticorpo cui è legato visibile dal citometro. Quindi, rende possibile la
tracciabilità degli anticorpi che vengono utilizzati per caratterizzare tutte queste molecole
che in definitiva caratterizzano tutte le popolazioni che sono prese in esame o anche le
citochine in esame. Sostanzialmente, questa è la preparazione di un campione che deve
essere analizzato al citometro e prevede proprio la marcatura con questi anticorpi. E come
viene fatta questa preparazione? Se portassimo le cellule non marcate, senza l’anticorpo
per una lettura al citometro, vedremmo quando il citometro emette la radiazione laser che
colpisce le cellule, vedremmo un’apposizione di parametri che sono in relazione alla
morfologia delle cellule, perché in base alla diversa morfologia delle cellule il raggio laser
che viene emesso dal citometro, viene diffratto in modo diverso in base alla dimensione
delle cellule, ma se non fossero marcate con il fluorocromo, le cellule non emetterebbero
nessun altra radiazione. Marcando, invece, nella fase preparatoria le cellule con l’anticorpo
specifico, per il marker che vogliamo evidenziare legato al fluorocromo, le rendiamo visibili
dal citometro e le rendiamo fluorescenti solo nel caso in cui siano positive al marker in
esame. Quindi come si fa? Si utilizzano questi anticorpi. Adesso vi farò vedere come si
utilizzano questi anticorpi e come si marcano le cellule per leggerle al citometro.
Gli anticorpi li conserviamo sempre in frigorifero perché sono termolabili. Sono conservati in
boccettine opache, perché l’anticorpo per poter essere dedectabile è legato al fluorocromo,
dal citometro viene eccitato assorbendo una radiazione a una determinata lunghezza
d’onda, e questo permette al fluorocromo di emettere un’altra radiazione, cioè solo nel
momento in cui ha assolto una radiazione. Sono opache perché se fossero esposte alla
luce bianca potrebbero in qualche modo assorbire una determinata lunghezza d’onda ed
emettere, perdere la loro fluorescenza, quindi è come se scaricassimo il fluorocromo (detto
in maniera volgare); per questo sono conservati in recipienti opachi. Quando vengono
aggiunti alle cellule durante la marcatura, vengono coperti fino al momento della lettura con
della carta stagnola proprio per limitare al massimo la loro esposizione alla luce.
Solitamente, cosa si fa quando si decide un setting sperimentale? Si decide con quali
anticorpi andare a marcare, a caratterizzare la cellule del campione in esame.
Facciamo un esempio di una caratterizzazione di linfociti, quindi una caratterizzazione di
cellule B, cellule T e cellule NK. In questo caso, avremo bisogno per caratterizzare i linfociti
T di un anticorpo per esempio contro il CD3 (che è un buonissimo marker per caratterizzare
i linfociti T); volendo distinguere anche tra i linfociti T helper e T citotossici, dovremmo avere
a disposizione anche o un CD4 o un CD8 e poi ovviamente i CD4+, CD3+ saranno per gli
helper, i CD3+, CD4- per esclusione saranno i citotossici, quindi non è necessario utilizzarli
contemporaneamente. Ma almeno uno dei due tra CD4 e CD8 dobbiamo usarlo e per
esclusione deduciamo l’altra popolazione. In questo caso, io ho immaginato di utilizzare il
CD4. Ancora per caratterizzare i linfociti B, utilizzeremo un CD19. Infine, per caratterizzare
i linfociti NK (unica popolazione di linfociti appartenenti all’immunità innata; gli altri due
appartengono all’immunità specifica) sarà necessario … Gli NK non si caratterizzano per
un marcatore in particolare, ma per l’espressione di CD56, che però dev’essere associata
ad una mancata espressione di CD3, perché le cellule NK sono CD56+, ma in realtà anche
alcuni T sono 56+; quindi bisogna distinguere tra tutti i 56+, quelli che sono CD3 -, quelle
saranno le cellule NK. Quindi, in questo caso è necessaria una marcatura multi parametrica,
biparametrica in cui si utilizza sia l’anticorpo con CD3, che con CD56. Per fare una
marcatura a quattro colori, con quattro anticorpi, è necessario che nel setting sperimentale
vi siano questi anticorpi a disposizione, ma che questi anticorpi siano marcati con
fluorocromi diversi, cioè con fluorocromi che assorbendo una determinata lunghezza
d’onda, emettano in regioni diverse dello spazio. Che possano quindi essere dedectate
queste lunghezze d’onda emesse dai fluorocromi in maniera diversa, da diversi sensori del
citometro; in modo che il citometro possa distinguere come diverse tutte le emissioni di
questi diversi fluorocromi e attribuirli ad anticorpi diversi. Quindi, ho questi quattro anticorpi
legati a fluorocromi che vengono detectati da sensori diversi nel citometro, io potrò leggerli
tutti assieme, cioè in unica provetta, in un unico campione io potrò leggere
contemporaneamente questi quattro anticorpi. Infatti, io ho immaginato di utilizzare un CD3
marcato con Fitc che noi abbiamo, un CD19 marcato con PE che è un fluorocromo diverso
e che è compatibile con il Fitc, perché viene acquisito da due sensori diversi, quindi il
citometro li distingue come diversi, il CD56 con la PC che emette ancora ad un’altra
lunghezza d’onda, il CD4 con il PE ciamina 7. Sono tutti fluorocromi diversi quindi li posso
usare contemporaneamente. Usando anticorpi coniugati con fluorocromi diversi il citometro
leggerà, distinguerà questi segnali con diversi sensori e potrà attribuirli alla presenza di
anticorpi diversi.
Si utilizzano queste provette, che sono quelle utilizzate in citometria o anche per la coltura
in vitro delle cellule. Quando si utilizzano in citometria è necessario che le cellule vengono
prima lavate, venga aggiunto un tampone come può essere il PBS, che è un tampone fosfato
a pH controllato, che viene aggiunto in queste provette. Quindi le provette vengono
sottoposte a centrifugazione. Il lavaggio significa aggiungere un tampone alle cellule e
sottoporle a centrifugazione. Dopo la centrifugazione, (durante la centrifugazione le cellule
girano ad alta velocità e per la forza centrifuga, le cellule si depositano sul fondo della
provetta, quindi le cellule formeranno un pellet cellulare. La provetta potrà essere decantata
in questo modo e le cellule rimarranno sul fondo mentre il tampone verrà eliminato. Per
risospendere le cellule nella piccolissima quantità di tampone che rimane perché sono 100
microlitri, sarà un volume che arriva circa a questo livello, basterà fare questo gesto (la agita
piano), le cellule si risospenderanno nel tampone e a quel punto saranno pronte per la
marcatura, cioè saranno pronte per l’aggiunta del mix di anticorpi che vogliamo utilizzare
per la marcatura. Si aggiungeranno i 3 – massimo 10 microlitri di anticorpo per la marcatura
che verrà effettuata a 4 °C, quindi a freddo e al buio perché abbiamo detto che l’anticorpo,
il fluorocromo è sensibile alla luce, per 20 minuti. Dopo di che sarà semplicemente
necessario lavare di nuovo il campione per allontanare l’eccesso di anticorpo che non ha
reagito perché in eccesso, quindi dev’essere allontanato dalla provetta. Si aggiungerà
nuovamente il PBS, si centrifugherà, le cellule si raccoglieranno nuovamente come pellet,
si decanterà e il campione sarà pronto per la lettura al citometro. Ovviamente si cercherà
sempre di preservare il campione dall’esposizione eccessiva alla luce bianca. A questo
punto avrete il campione pronto per la lettura al citometro.
Questo si può fare partendo dal sangue periferico. Più spesso preferiamo lavorare con le
cellule mononucleate del sangue periferico, che sono private di globuli rossi, piastrine e
granulociti. Come facciamo a privare le cellule del sangue periferico da queste popolazioni?
Tramite una separazione su gradiente (che è l’ultima metodica che vi mostrerò in questo
laboratorio) che prevede l’utilizzo di una sostanza molto densa che è questo gradiente,
sopra la quale viene stratificata la sospensione contenente il sangue , che sostanzialmente
è sangue diluito con PBS, sangue o buffy coat diluiti con PBS che vengono stratificati su
questo liquido molto denso e che quindi fanno sì che le varie popolazioni cellulari si possano
dividere a seconda delle dimensioni: i globuli rossi attraverseranno il gradiente di ficoll e si
distribuiranno come pellet sul fondo della provetta; le cellule mononucleate del sangue
periferico si distribuiranno come un anello bianco (proprio perché sono leucociti, quindi sono
tutti bianchi) all’interfaccia tra il ficoll e il PBS. Noi andremo semplicemente a raccogliere
questo anello e troveremo le cellule mononucleate.
Come si effettua la stratificazione?
Dopo stratificazione, i globuli rossi si sono depositati sul fondo, poi il ficoll, cioè il liquido ad
alta densità che abbiamo utilizzato per la separazione, qui è stato stratificato il sangue diluito
con il PBS e all’interfaccia fra le due fasi si è depositato un anello bianco che contiene 3
mononucleate (linfociti e monociti, abbiamo eliminato tutti i rossi che spesso interferiscono
con le analisi di citometria e abbiamo eliminato i granulociti e anche le piastrine).
Bisogna fare attenzione perché le due fasi si possono alterare facilmente. Questo è quello
che si ottiene dopo mezz’ora di centrifugazione a velocità abbastanza elevata e senza il
freno. Quando noi mettiamo in centrifuga si ottengono velocità abbastanza elevate, per
comodità si utilizza un freno che fa fermare la centrifuga più velocemente.
Con la metodica di separazione su gradiente bisogna evitare di mettere il freno perché
altrimenti una frenata brusca determinerebbe l’alterazione della distribuzione delle due fasi.
Vi faccio vedere un esempio di stratificazione. Si mette il ficoll, generalmente se ne mettono
20 ml e sopra si stratificano 30 ml di sangue diluito. Nella distribuzione delle due parti
quando si stratifica bisogna fare attenzione a inclinare la provetta e far avvenire questa
prima fase di deposizione del sangue molto lentamente, altrimenti le due fasi non si
separano in maniera stratificata ma tendono a mischiarsi l’un l’altro. Quindi, inclinando la
provetta e andando molto piano è possibile far sì che rimangano separate le due fasi. Vedete
che c’è un’interfase tra le due, ed è proprio in quel punto che si verranno a distribuire tutte
le cellule mononucleate. Dopo la centrifugazione andremo a raccogliere quell’anello, le
cellule si dovranno lavare più volte per allontanare i residui di ficoll e poi saranno pronte per
l’analisi in vitro, per essere congelate, oppure per l’analisi in citometria direttamente.
Vi faccio vedere il laboratorio.
Vi faccio vedere per prima cosa la centrifuga. Abbiamo detto che i ficoll e i lavaggi devono
effettuarsi centrifugando.
Questo è lo strumento per la centrifuga. Nel rotore vengono inserite le provette nei vari rack,
che sono diversi in base alle diverse provette che si vogliono centrifugare. Qui, impostiamo
diversi parametri:
-
La temperatura, perché a seconda dell’analisi che si vuole fare, utilizziamo una
temperatura diversa (ad esempio dato che la densità del ficoll dipende dalla
-
-
-
temperatura, si utilizza una temperatura a 25°C, perché temperature più basse
altererebbero la densità del ficoll; invece, per fare lavaggi cellulari si centrifuga a
freddo, a 4°C);
gli RTM daranno la misura della rotazione della centrifuga (gli RTM dipendono
sempre dal raggio della centrifuga, quindi non sono equivalenti per tutte le
centrifughe);
la velocità di centrifugazione in G (quello è un parametro che non dipende dal raggio,
quindi in qualsiasi centrifuga voi lavoriate, non c’è bisogno di conversione, è uguale
in tutte le centrifughe);
i minuti di centrifugazione;
la possibilità di inserire il freno che dev’essere assolutamente eliminato qualora si
facciano metodiche di ficoll.
In laboratorio abbiamo poi cappe sterili che sono cappe a flusso laminare in cui viene
controllata la contaminazione all’interno delle cappe; preserva il materiale che state
lavorando, non preserva voi dal materiale con cui lavorate; quindi, sostanzialmente, è una
cappa che serve per le colture cellulari, non è una cappa microbiologica. E’ una cappa
controllata per quello che si sta lavorando.
Ci sono incubatori dove conserviamo le colture in vitro, che sono a temperatura e percettore
di CO2 controllata, 37° di temperatura e circa 5% di temperatura ogni volta che l’incubatore
viene aperto.
Poi vi sono i microscopi, la criogenia e i frigoriferi della criogenia.
Vediamo l’altra zona di conservazione dei campioni. Questa è la stanza di criogenia dove
congeliamo le cellule. L’orizzontale è un congelatore a -80°C, le cellule sono conservate
per tanti anni in soluzione di congelamento oppure ancora per più tempo in azoto nei
contenitori blu dove la temperatura raggiunge i -160°C. Quindi o -80°C per qualche mese,
o in azoto a -160°C.
Prof. Gori
In laboratorio studiamo queste cellule. Avete visto come si fa ad isolare un tipo cellulare.
Qui vediamo come analizzarle. Esistono due strumentazioni, che sono:
-
L’analizzatore
L’analizzatore con capacità di sorting (qua possiamo analizzare e una volta viste le
cellule che si trovano in soluzione, possiamo prenderle e separarle, portarle
all’interno di provette fino a quattro tipi cellulari e farne un uso successivo.
Uno studio funzionale ad esempio dei linfociti T helper. Prendiamo i linfociti T helper, li
portiamo in laboratorio, una volta separati, e ci facciamo studi di tipo funzionale; li
mettiamo in coltura, gli mettiamo le citochine, li mettiamo con altre cellule, dei modelli
sperimentali che ci permettono di studiare la funzionalità delle cellule del nostro
organismo.
Come funziona un analizzatore? Un citometro a flusso?
Ci sono 3 componenti importanti in un citometro a flusso:
-
Componente ottica;
Componente fluidica;
Componente elettronica.
La componente ottica è data da laser. La fonte luminosa per noi importante è data dal
laser perché il laser è potente (possiamo raggiungere potenze elevate), focalizzare il
punto luce, in un punto molto piccolo. Le cellule sono piccole; se dobbiamo colpire le
cellule, dobbiamo illuminarle per studiarle e dev’essere una luce molto piccola
focalizzata in un punto piccolino. Le cellule che noi normalmente analizziamo, i linfociti
sono intorno a 7 micron circa, i granulociti, invece, sono più grandi 12-15 micron. Una
prima cosa che possiamo fare per studiare le cellule bianche è quello di identificarne
quantomeno la dimensione nell’immediatezza.
Cosa fa un citometro a flusso per analizzare le dimensioni dei leucociti? I laser possono
essere 1, 2, 5, 7, tutto dipende dalla capacità dello strumento. Più laser ci sono, più
complesso è lo strumento, più colori riesce a leggere. Potrebbe essere infinito il numero
di laser. In questo caso ne abbiamo tre, di cui uno piccolino che ci permette di eccitare
e colpire le cellule ed ha una lunghezza d’onda di 375 nm, quindi va più verso
l’ultravioletto, mentre gli altri due uno è verde e uno è rosso.
Le cellule le facciamo passare attraverso una sorta di imbutino, si chiama Noz. Una sorta
di imbutino in ceramica con al vertice un forellino calibrato di 70 micron. Se prendete un
imbuto e lo mettete sotto l’acqua, appena versate il liquido nell’imbuto, il liquido non va
a finire direttamente nel buco, ma comincia a ruotare intorno alle pareti, fino ad essere
raccolto giù formando una sorta di vortice. Questo fa la stessa cosa. Se introduciamo in
questo imbutino il nostro liquido di trasporto, che dev’essere una soluzione isotonica,
quindi può essere una soluzione fisiologica, un tampone, PBS per mantenere le cellule
in vita e mantenere la loro forma perché altrimenti se fosse acqua distillata le cellule si
romperebbero per osmosi, quindi dobbiamo mantenerle integre. Se introduciamo liquido
attraverso tutti e due i forellini, non facciamo altro che creare questo vortice all’interno
dell’imbutino, che deve avere una determinata pressione in maniera tale che quando
andiamo ad introdurre il campione dall’alto, questo campione viene avvolto da una sorta
di manicotto idrodinamico e lo indirizziamo perfettamente lungo il forellino di 70 micron,
in maniera tale che possa uscire attraverso questo forellino e allineare le cellule una
dietro l’altra come se fossero in fila indiana. Questo perché dobbiamo avere l’opportunità
lateralmente di colpire le cellule con il laser e fare le nostre misurazioni. Ecco il nostro
liquido di uscita, io gli metto il dito e mi bagno il dito perché non è un filo, è un liquido che
cade dall’imbutino e va a finire giù attraverso cui verranno trasportate le nostre cellule.
Lo sto illuminando con un laser proprio per mettervelo in evidenza. Allora le cellule
cadono da qua, il laser le colpisce lateralmente, ad un certo punto la nostra cellula
cadendo viene colpita dal laser, da questa luce, da questo lato formerà un cono d’ombra
che sarà tanto più grande, quanto più grande sarà la cellula; tanto più piccolo (il cono
d’ombra), quanto più piccola sarà la cellula. Quindi, meno luce c’è più grande è la cellula,
più luce c’è più piccola è la cellula. Questo parametro che noi andiamo a leggere è la
dimensione della cellula e si chiama forward scatter (quindi scatter davanti, al punto in
cui viene colpito dal laser). Primo parametro, questi dati di intensità di luce, vengono
elaborati, vengono raccolti da un sensore, che è un fotodiodo e che trasforma l’energia
fotonica in energia elettrica, vengono elaborati e vengono rappresentati elettronicamente
su un sistema di assi cartesiani.
Abbiamo la possibilità di controllare un altro parametro importante che è la complessità
della cellula. Voi considerate, facciamo gli estremi, un linfocita e un granulocita. Il
linfocita, come ben sapete, è piccolo, è formato all’interno quasi completamente da
nucleo, citoplasma ne ha poco; il granulocita ha molto più citoplasma, oltre ad essere
più grande, è pieno di granuli, il nucleo è plurilobato, ci sono i mitocondri in evidenza,
l’apparato di Golgi in evidenza, quindi ha una complessità maggiore rispetto al linfocita
e quando lo colpiamo con il laser lateralmente, tutti gli organuli che ci sono all’interno
rifletteranno luce dappertutto rispetto ad un linfocita che, invece, è meno complesso.
Questa luce, noi la raccogliamo e la misuriamo con un sistema non più dallo stesso lato,
perché non sarebbe la stessa misura, ma a 90° (ormai da 40 anni con l’esistenza della
citometria), quindi raccogliamo questa luce e la misuriamo e la quantizziamo, questa
misurazione della complessità della cellula viene detta come parametro SSC, cioè side
scatter, cioè scatter laterale. Il primo era davanti, questo è laterale al punto da cui parte.
Viene raccolta e mandata a questo trasduttore elettronico che non è altro che un
fotomoltiplicatore, ovvero raccoglie l’intensità fotonica che è bassa, non è molto alta
come nel primo caso dell’FSC, amplifica questo segnale e viene letto, gli permette di
quantizzarlo. Come vedete, ce ne sono diversi di fotomoltiplicatori, sono distribuiti sia in
un ottagono, sia in un trigono perché ogni laser avrà i suoi fotomoltiplicatori. Tre laser,
tre gruppi di fotomoltiplicatori. Questo significa che mi permette di misurare tante cose.
Ogni cellula per distinguersi dall’altra, ha delle caratteristiche recettoriali diverse.
Facciamo un esempio pratico, linfociti T e linfociti B. I linfociti T, sulla loro superficie,
hanno il CD3 come recettore, mentre i linfociti B hanno il CD19. Non possiamo trovare il
CD19 come recettore sui CD3, così come viceversa, quindi distinguiamo perfettamente
le due popolazioni. Ma come facciamo a distinguerle? Come facciamo a capire quali
sono i linfociti T e quali i linfociti B? Ci mettiamo le cellule con degli anticorpi monoclonali.
Cosa sono gli anticorpi monoclonali? Sono delle immunoglobuline specifiche verso quel
recettore, quindi si possono legare solo a quel recettore. Quindi un anticorpo
monoclonale anti-CD3, si può legare solo al CD3, non si può legare al CD19, così come
l’anti-CD19 si può legare solo al CD19 e non al CD3. Ma per rivelarli, una volta che
abbiamo legato l’anticorpo, come facciamo? Non potremmo fare in nessuna maniera, se
non precedentemente aver utilizzato un anticorpo monoclonale coniugato con un
fluorocromo.
Il colore che noi andiamo a identificare, lo andiamo a rivelare nella stessa posizione
dell’SSC, sempre come side scatter, sempre a 90°. A 90°con fotomoltiplicatori, poniamo
davanti dei filtri, perché il colore non sapremmo come fare ad identificarlo (verde, rosso
e via dicendo), dobbiamo trovare un sistema. Questi apparecchi riescono a rivelare
l’intensità di luce, ma non il colore. E allora, a questo punto mettiamo dei liquidi
interferenziali che bloccano per esempio tutte le lunghezze d’onda tranne il verde. Quello
che passa sarà solo il verde. Qua blocchiamo tutte tranne il rosso, quindi qua leggiamo
solo il rosso e così via. Il principio è quello. Quindi l’intensità di luce ci darà la quantità di
cellule che emettono verde o rosso o blu.
Come funziona, invece, il discorso sorting? … sul trasduttore che vibrando, mi forma
delle piccole goccioline, quindi questo liquido, vibrando ad alta velocità non fa altro che
formare delle goccioline che vediamo nel monitor. Questo è il monitor e la telecamera
che mi sta controllando il flusso. Infatti, se io muovo il flusso di liquido, muovendo
solamente un tubicino, ecco che si vede il flusso perché è influenzato da questo disturbo;
si vede il flusso che si muove e che va avanti e indietro. Quelle sono le goccioline che
si vengono a formare nelle quali statisticamente dovrebbero trovarsi le cellule (perché il
principio è questo).
E cosa facciamo noi tramite il software? Non facciamo altro che identificando la
popolazione che vogliamo studiare, per esempio CD3, non facciamo altro che caricare
le goccioline di una determinata carica, proprio perché è una soluzione isotonica, ionica,
quindi è possibile caricarla positivamente o negativamente e la facciamo attrarre
attraverso queste placche di depressione alle quali applichiamo una differenza di
potenziale e, a quel punto, la cellula che è caricata, mettiamo positivamente, viene
attratta a destra o a sinistra e quindi abbiamo la possibilità di buttarla nelle provette di
raccordo. Praticamente, applichiamo la tensione alle placche, mettiamo in corso il test
(non le tocco le placche, altrimenti ci rimarrei attaccato, perché c’è un’alta tensione che
viene liberata!). Ecco che lo stream centrale è suddiviso in altri quattro, due da un lato e
due dall’altro. E quindi lo stream si è suddiviso in altri quattro steams, attraverso cui viene
deviato il campione e buttato in una delle provette in cui abbiamo deciso dove raccogliere
quella determinata popolazione.
Passiamo rapidamente ad un’analisi del campione, di quello che avete già visto.
Sangue intero: non ho separato come avete visto tramite gradiente di concentrazione
per ottenere le cellule mononucleate. Ho preso il sangue intero, periferico, l’ho marcato
con l’anticorpo monoclonale che mi interessava, e ho lisato i globuli rossi, in modo da
lasciare solo i globuli bianchi. Ho lasciato linfociti, monociti e granulociti. Questi che
vedete all’origine degli assi si chiamano debree delle membrane rotte di globuli rossi,
piastrine, sono molto piccoli, quindi si trovano all’origine degli assi perché abbiamo detto
che FSC ci identifica proprio la dimensione, SSC la complessità; quindi sono i corpuscoli
più piccoli e meno complessi. Ma noi non li consideriamo nemmeno; noi dobbiamo
andare a considerare le prime cellule reali che ci identificano, in questo caso, i linfociti,
cioè ci fanno vedere proprio che sono linfociti e sono le cellule più piccole rispetto alle
altre e meno complesse rispetto alle altre; quelle più grandi e più complesse sono i
granulociti; nel mezzo ci troviamo i monociti.
Mettiamo che vogliamo fare un’analisi linfocitaria e vogliamo vedere CD3 e CD19. Ho
detto alla macchina in questo caso, di farmi vedere in questo citogramma solo i linfociti;
sto facendo solo un’analisi dei linfociti. Ho cimentato questi linfociti con un anticorpo antiCD3 e un anticorpo anti-CD19. Anti-CD3 è coniugato con questo fluorocromo che si
chiama Vesit(???). Invece, con il fluorocromo Fitche ho marcato con anti-CD19, quindi i
linfociti B. Dico poi alla macchina di analizzarmi queste popolazioni che sono positive
per sp liberanti CD3; queste positive per anti-CD19. Saprò quanti sono i linfociti T e
quanti i linfociti B. Nel quadrante IV abbiamo l’82,2% di linfociti B, nel quadrante I
abbiamo il 13,3% di linfociti T. E questi nel quadrante III che sono? Sono tutti linfociti.
Abbiamo preso i linfociti T, i linfociti B, ci mancano i natural killer. Con due anticorpi
monoclonali, sappiamo anche che i natural killer sono 4,4%.
In quest’altro tubino abbiamo voluto analizzare sempre dei linfociti, quelli che
mostravano il recettore per CD4 e quelli che mostravano il recettore per CD8. Sapete
quali linfociti T sono questi? CD4 sono gli helper e CD8 i citotossici. Stesso sistema,
diversi i fluorocromi, ma questo non ha nessuna importanza perché a noi alla fine
interessa l’analisi. In questo caso, il fluorocromo è APC. I CD4 sono il 61,4%; i CD8 sono
il 18,6 %. Se andiamo a sommare 18,6 + 61,4 ci dà circa 80, che è il totale dei linfociti T
che abbiamo visto prima. E nel quadrante I che linfociti abbiamo? Non sono T perché
non sono né CD4, né CD8, sono i B e i natural killer.
Altre due cose che possiamo fare con la citometria a flusso.
Studio della ploidia, quindi studio del DNA delle cellule. Se volete studiare una ploidia
dovete cercare di colorare il DNA. Come si colora il DNA? Si colora con dei fluorocromi
specifici per il DNA, come lo ioduro di…. Siccome è un ciclo cellulare formato da tre fasi
importanti: G0-G1, S ed G2 -M. Il contenuto di DNA della G0-G1 è metà del contenuto della
G2-M. Noi possiamo distinguere tutto ciò con la fluorescenza, con l’intensità del fluorocromo
perché si lega in maniera diretta, stechiometrica al DNA. Quanto se ne lega alla G0-G1 che
avrà un colore X, in maniera doppia si lega alla G2-M. Quindi, avrà un’intensità di colore che
se è X nella G0-G1, sarà 2X nella G2-M. Tutte le cellule che si trovano nel mezzo saranno
cellule in fase di sintesi.
Vediamo un esempio. Questo è un ciclo cellulare di un tessuto. E’ chiaro che non possiamo
passare solo linfociti o cellule del sangue, ma qualsiasi tipo di cellula. L’importante è che
queste cellule siano in una sospensione monocellulare. Se prendiamo un tessuto, non è che
possiamo prendere il pezzetto di tessuto e passarlo qui, prima dobbiamo sminuzzare,
prenderlo monocellulare e una volta che è in trascrizione lo facciamo passare attraverso il
citometro e lo analizziamo.
Se questa è la fase G0-G1 che avrà un X intensità di fluorescenza, al doppio dell’intensità di
fluorescenza del canale 50 in questo caso, quindi al centro, avremo la G2-M. Tutte le cellule
che si trovano all’interno di queste 2 fasi, saranno cellule in fase di sintesi.
Un’altra possibilità nuova. Fino ad oggi abbiamo visto solamente puntini, non abbiamo mai
visto una cellula; oggi abbiamo la possibilità di farlo, abbiamo una nuova strumentazione.
Finalmente, alla citometria a flusso abbina una telecamera ad altissima velocità e man mano
che passano le cellule in fila indiana, gli fa una fotografia. Mi permette di vedere la cellula
com’è dal punto di vista morfologico, come si distribuisce il fluorocromo sulla superficie della
cellula (se è verde, se è rosso) e dove si distribuisce e il …, cioè il colore interno, le varie
particelle interne della cellula, la complessità della cellula.
È una novità che ha cambiato il modo di vedere e di lavorare in citometria a flusso!!!












