Giovedi 15 Novembre 2012
1°ora PATOLOGIA GENERALE
Prof. LACONI
(Carlo Sanna)
Autoimmunità e Malattie Autoimmuni
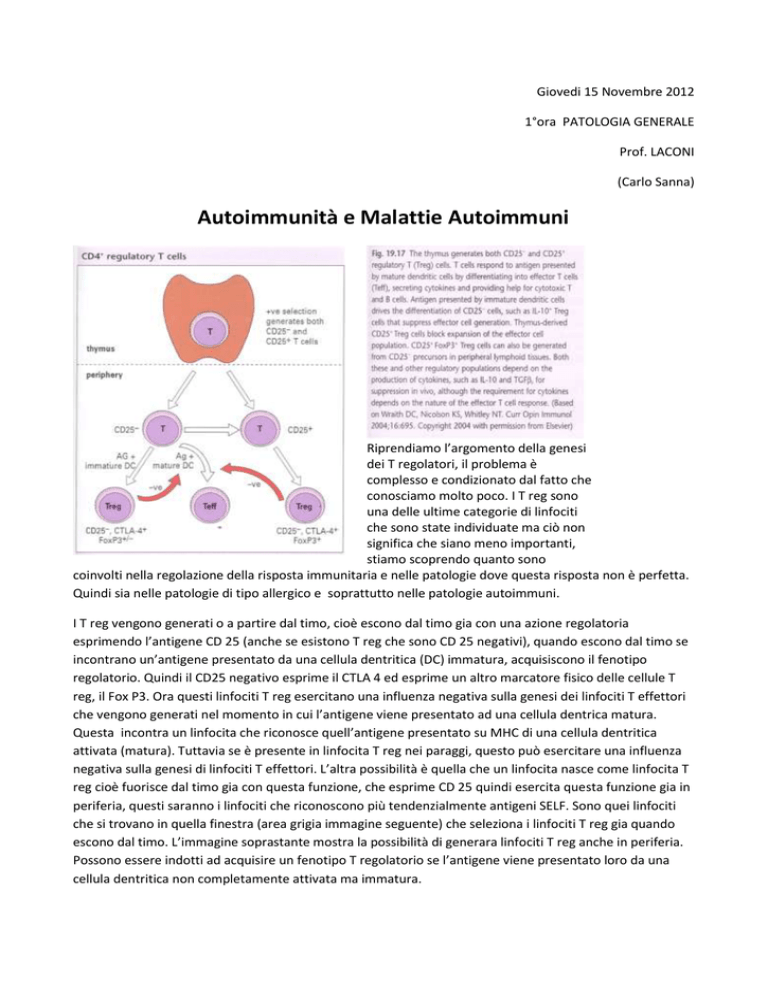
Riprendiamo l’argomento della genesi
dei T regolatori, il problema è
complesso e condizionato dal fatto che
conosciamo molto poco. I T reg sono
una delle ultime categorie di linfociti
che sono state individuate ma ciò non
significa che siano meno importanti,
stiamo scoprendo quanto sono
coinvolti nella regolazione della risposta immunitaria e nelle patologie dove questa risposta non è perfetta.
Quindi sia nelle patologie di tipo allergico e soprattutto nelle patologie autoimmuni.
I T reg vengono generati o a partire dal timo, cioè escono dal timo gia con una azione regolatoria
esprimendo l’antigene CD 25 (anche se esistono T reg che sono CD 25 negativi), quando escono dal timo se
incontrano un’antigene presentato da una cellula dentritica (DC) immatura, acquisiscono il fenotipo
regolatorio. Quindi il CD25 negativo esprime il CTLA 4 ed esprime un altro marcatore fisico delle cellule T
reg, il Fox P3. Ora questi linfociti T reg esercitano una influenza negativa sulla genesi dei linfociti T effettori
che vengono generati nel momento in cui l’antigene viene presentato ad una cellula dentrica matura.
Questa incontra un linfocita che riconosce quell’antigene presentato su MHC di una cellula dentritica
attivata (matura). Tuttavia se è presente in linfocita T reg nei paraggi, questo può esercitare una influenza
negativa sulla genesi di linfociti T effettori. L’altra possibilità è quella che un linfocita nasce come linfocita T
reg cioè fuorisce dal timo gia con questa funzione, che esprime CD 25 quindi esercita questa funzione gia in
periferia, questi saranno i linfociti che riconoscono più tendenzialmente antigeni SELF. Sono quei linfociti
che si trovano in quella finestra (area grigia immagine seguente) che seleziona i linfociti T reg gia quando
escono dal timo. L’immagine soprastante mostra la possibilità di generara linfociti T reg anche in periferia.
Possono essere indotti ad acquisire un fenotipo T regolatorio se l’antigene viene presentato loro da una
cellula dentritica non completamente attivata ma immatura.
Domanda: Quindi i linfociti T reg non
esprimono CD 25?
Risp: Se parliamo di regole generali CD 25 è un
marker tipico dei T regolatori però badate che
ci sono anche T regolatori CD 25 negativi,
stanno emergendo in letteratura, quindi non
esistono dogmi anche se finora quello che è
comunemente ritenuto è che il CD 25 sia un
marcatore dei T reg, però non è che la
funzione regolatoria sia legata all’espressione
del CD 25.
L ‘omportanza del gene Fox P3 viene illustrata dal fatto che esiste una condizione da deficit di FoxP3
denominata: Immune-disfunction, polyendocrinopathy, enteropathy, X-linked, (IPEX), in cui manca la
possibilità di esprimere questo gene. Se vogliamo, attualmente è il gene che viene considerato più critico
(?) nella funzione T regolatoria, però badate anche qui ci sono eccezzioni. I marcatori sono molto utili,
sarebbero più utili se ne sapessimo di più. Per esempio sapere quanti T regoltori ci sono in circolo, quanti ce
ne sono all’interno di una massa tumorale, in una risposta di tipo allergico, ci può dare informazioni su
quale è la patogenesi di quella malattia, perche potrei cominciare a capire se è un deficit dei T regolatori a
sostenere queste patologie oppure, se i T regolatori in quel caso non centrano nulla. Non possiamo fidarci
dei marcatori di cui ancora non conosciamo la funzione precisa, se utilizzo come marcatore ..X.. e poi
magari non è così rischio di prendere delle grosse cantonate dal punto di vista clinico. Nel senso che uno
che ha pochi linfociti che esprimono CD 25 penso che abbia pochi T reg, invece può darsi che ci siano T reg
che non esprimono CD 25. I marcatori sono molto utili però prendendoli un pochino con le pinze, il discorso
è lo stesso con i marcatori neoplastici.
Domanda: non pervenuta
Risp: il CD25 negativo che viene dal timo non è T regolatorio, è un T naive che non ha la caratteristica di
essere regolatorio, lasciate perdere i marcatori, allo stato attuale il marcatore più attendibile è forse la
FoxP3 che però presenta popolazioni con FoxP3 di segno negativo. Quindi non è detto che anche questo sia
un marcatore assoluto, ancora non si capisce quale sia il significato di questi marcatori. Il concetto è che
escono dal timo linfociti che hanno gia una definita funzione regolatoria che sono affini ai nostri antigeni
self, tutti gli altri che sono la maggioranza dei linfociti T CD4+ (..esistono anche CD8+ con funzione
regolatoria, ma non complichiamo le cose..), i T reg classici sono i T CD4 positivi. Escono dal timo senza
funzione regolatoria, ma possono acquisirla in periferia, quando viene presentato loro l’antigene da una
cellula dendritica immatura che non ha uno stato di attivazione tale da mandare messaggi per differenziare
un linfocita in T effettore.
I linfociti T in periferia possono acquisire funzione regolatoria o effettrice in base al micro ambiente in cui
operano, per cui se i linfociti T reg in un ambiente in cui vi è:
una bassa presenza di ligandi per il TLR,
bassi livelli di costimolazione,
bassi livelli di interleuchina 2,
bassi livelli di citochine infiammatorie di altro genere come le IL-6 ,
i linfociti T tendono a mantenere un fenotipo T regolatorio. Ma nel tempo il fenotipo può cambiare. Se la
situazione cambia e c’è un alto livello di stimolazione TLR, e aumentano gli altri livelli, il linfocita può essere
indotto a perdere la funzione T regolatoria a favore della T effettrice. Quindi è un sistema molto plastico,
molto dinamico e risente degli influssi ambientali.
Questa immagine parla di ligandi per i TLR che possiamo assimilare anche ad una condizione di presenza di
micro organismi che sono classici ligandi di TLR, anche se non unici. Abbiamo detto che tra i ligandi per TLR
ci sono sostanze liberate dalle cellule durante il danno, (DAMP) quindi in una situazione di danno in
generale abbiamo la maturazione della cellula presentante l’antigene da una forma immatura, forma in cui
c’è una parziale attivazione, ad una forma completamente matura, in grado di attivare una funzione
effetrice dei linfociti T stimolandoli poi all’espansione clonale. Però contemporaneamente questa cellula
presentante l’antigene matura, secerne delle citochine pro-infiammatorie che attiveranno altre cellule
dentritiche e anche altri tipi di cellule come quelle epiteliali nella cute per esempio. Se l’attivazione della
cellula avviene in assenza del legame TLR, quelle cellule subiscono solo una maturazione parziale, le
possiamo assimilare alle precedenti, allora l’incontro di queste con il linfocita specifico per quell’antigene
che stanno presentando risulterà in un differenziamento di tipo T regolatorio. Questo meccanismo è stato
ipotizzato avere un ruolo nelle infezioni, sarebbe un fattore protettivo nello sviluppo di patologie
autoimmuni. Tramite questo meccanismo dovremmo riuscire a differenziare linfociti potenzialmente autoreattivi nel fenotipo T regolatorio in periferia. Ogni episodio infettivo sarebbe per noi una occasione per
liberarci di potenziali linfociti T auto-rattivi, differenziandoli in T reg, perché durante l’episodio infettivo,
grazie all’ambiente citochinico pro-infiammatorio, noi induciamo i nostri tessuti ad una maggiore
espressione di molecole self, molecole MHC che esprimono maggiore quantità di molecole self. Per cui
eventuali linfociti autoreattivi hanno maggiore probabilità di incontrare gli antigeni self in una condizione in
cui la risposta però non sara in un linfocita T effettore ma T regolatore. Quindi è un’opportunità il contatto
con agenti infettivi per “liberare” i nostri tessuti dalla presenza di eventuali linfociti T auto-reattivi che
potrebbero diventare linfociti T effettori e noi invece gli facciamo diventare T reg in periferia (non nascono
come regolatori nel timo). Lo schema nell’immagine indica la presenza del focolaio infiammatorio con la
reazione immunitaria nei confronti di quel microorganismo (all’interno dell’ellisse che ha tracciato nelle
nuove slide) con i linfociti T effettori in grado di eliminare quel microorganismo, nel tessuto circostante in
cui il microorganismo non è arrivato si diffonderanno dei messaggi chimici che indurranno un maggiore
differenziamento verso T regolatori, e questo serve a proteggere i nostri tessuti dalla reazione
infiammatoria. Se questa dovesse propagarsi, non distingue tra i tessuti self e non-self, distruggerebbe
tutto, quindi e un modo per noi per confinare la presenza di T effettori solo nel territorio in cui sono
presenti i segnali di pericolo. In questo modo nel tessuto circostante cerchiamo di indurre una risposta più
regolatoria che non effettrice. Questo sarebbe il significato dell’induzione del fenotipo T regolatorio. Questi
sono meccanismi che operano continuamente nei tessuti di frontiera come la mucosa intestinale, la cute..
dove ovviamente siamo continuamente di fronte al dilemma: “scatenare o meno la risposta
infiammatoria..??” perché abbiamo la barriera nei confronti del territorio esterno e siamo continuamente a
contatto con antigeni non self, ma devo saper quante armi mettere in gioco e dove limitarne invece
l’azione.
Vediamo adesso cosa succede a carico delle cellule B, fino adesso abbiamo parlato delle cellule T come
coinvolte eventualmente nelle patologie autoimmuni, possono contribuire anche le cellule B. Abbiamo
nell’immagine soprastante due condizioni nella stessa cellula B che riconosce attraverso il suo TCR un
antigene self, se questa cellula non ha una costimolazione da una cellula T conteporaneamente diciamo che
ciò non avrà conseguenze dal punto di vista pratico, dal punto di vista della produzione di auto-anticorpi
contro l’antigene self. Ma se contemporaneamente all’incontro con l’antigene da parte del TCR, questa
cellula B viene stimolata da un linfocita T che riconosce un antigene che ha parti in comune con l’antigene
riconosciuto attraverso il TCR, allora questo linfocita B specifico per un antigene self che cross reagisce con
un antigene esogeno, questo linfocita potrà generare quantità importanti di anticorpi che riconosceranno
anche antigeni self. Questo è il classico meccanismo della cross reattività tra un antigene self ed un
antigene esogeno che può essere uno dei meccanismi in cui noi produciamo auto-anticorpi.
(Le 2 slide seguenti le ha saltate)
Vediamo l’immunità innata e acquisita
rispetto al loro ruolo nell’origine delle
patologie autoimmuni. Anche l’immunità
innata nonostante non sia specifica come
quella acquisita ha dei meccanismi
attraverso cui può distinguere tra strutture
potenzialmente pericolose e strutture che
invece non lo sono. In particolare attraverso
i pattern molecolari PAMPs, noi nasciamo
già con questi recettori che ci aiutano ad
identificare i pericoli. Esistono meccanismi
di riconoscimento di patogeni attraverso un
processo molto dispendioso di sintesi e
selezione di recettori Ag-specifici.
Queste sono le premesse per le malattie auto immuni. Studiando il funzionamento normale del sistema
immunitario si è cercato di capire l’origine delle malattie auto-immuni, facendo riferimento a quanto detto
precedentemente non dovrebbe sorprenderci che si possano verificare queste patologie A.I. per via del
fatto che la distinzione non è così semplice. Qual è l’evidenza del coinvolgimento della risposta immunitaria
in queste malattie? Ci sono metodi di induzione sperimentale, badate questo è molto indicativo, cioè si può
indurre autoimmunità iniettando autoAg + adiuvante stimolando il sistema immunitario nella maniera
adeguata. Questo ci dice quanta suscettibilità noi abbiamo nelle malattie autoimmuni, cioè se noi siamo
esposti ad autoAg nella maniera sbagliata l’autoimmunità può insorgere.
Tireoglobulina + adiuvante che induce una
patologia simil tiroidite di Hashimoto nei polli. Sono
modelli sperimentali di particolari specie di animali
che una volta sviluppati si utilizza sempre quella
specie. In questa condizione, come anche nella
vera tiroidite di Hashimoto compaiono autoAb
contro la tireoglobulina e la perossidasi.
Probabilmente possiamo indurre auto immunità
nei confronti di qualunque antigene, questo vuol
dire che noi abbiamo linfociti auto reattivi
potenzialmente, sia linfociti T che B, cioè linfociti
che possono riconoscere in maniera
sufficientemente attivante antigeni self. Ci sono
poi modelli di autoimmunità spontanea come quello del così detto topo NOD in cui si sviluppa un diabete
simile a quello di tipo 1, cioè insulino dipendente (IDDM) in seguito ad insulite delle cellule β del pancreas
mediata da cellule T, molto simile al IDDM umano in cui compaiono anticorpi e cellule T anti-insulina e antiGAD (acido glutammico decarbossilato). Inoltre il ruolo degli anticorpi in queste patologie è illustrato dal
fatto che ci sono auto anticorpi della madre che devono essere di tipo IgG che possono passare la barriera
placentaria verso il feto, si avrà una patologia anche fetale dell’organo bersaglio di questi anticorpi. Quindi
se sono anticorpi anti tiroide si avrà una patologia anche fetale a livello tiroideo, e ovviamente verrà meno
dopo la nascita salvo che il bambino abbia imparato a sua volta a produrre autoAb ma questo in genere non
succede. In corso di gravidanza quindi anche il feto subisce l’effetto degli autoAb tessuto specifici, questo ci
dice che la patologia è legata alla presenza di autoAb.
Questi nel grafico sono polli obesi che sono
suscettibili alla patologia autoimmune di
tipo tiroideo, se si effettua una
tiroidectomia si vede che scompaiono gli
auto Ab quindi gli Ab sono legati alla
presenza dell’autoAg. Se non viene fatto
nessun trattamento alla nascita vi è un
certo livello di Ab anti tireoglobulina. Se si
opera una emitiroidectomia, cioè si asporta
metà della tiroide, si ha addirittura un
aumento degli Ab anti tireoglobulina
probabilmente per il trauma del
trattamento chirurgico e quindi per la
liberazione maggiore di Ag che generano
una maggiore quantità di Ab. Se si fa una
sham tiroidea, cioè una tiroidectomia finta,
praticamente si apre l’animale e si fa tutto
quello che necessità una tiroidectomia ma
non si toglie l’organo, gli Ab rimangono ad
un livello di controllo.
Se invece fate una tiroidectomia vera, scompaiono anche gli Ab anti tireoglobulina, quindi evidentemente
gli Ab sono generati a seguito dello stimolo antigenico.
A cosa sono legate le patologie autoimmuni?
Sono le classiche patologie dette multifattoriali, in cui sicuramente esiste un componente genetica
testimoniata dal fatto che c’è un’associazione con HLA, ma non solo, anche con altri geni legati alla risposta
immunitaria come il CTLA-4 e in genere quando vengono coinvolti questi meccanismi che operano a livello
centrale nello stabilire tra self e non-self. In realtà il sistema immunitario si preoccupa più del self che del
non-self, cioè il sistema immunitario ha come riferimento il self, per cui più o meno tutto quello che non è
presente diventa non-self, ma il realtà il non-self non esiste. Il sistema immunitario fotografa il self, tutto
ciò che non è parte di questa immagine diventa estraneo, il non-self non è una parte presente con cui il
sistema immunitario fa i conti. Contribuisce a stabilire la nostra identità dal punto di vista organico. In
genere quando si tratta di meccanismi centrali che presiedono al riconoscimento della nostra identità, le
patologie autoimmuni che si possono verificare sono diverse perché il meccanismo è generale e gli errori
che posso fare nel riconoscimento del self possono essere a diversi livelli e a carico di diversi tessuti.
Mentre invece quando le patologie autoimmuni sono tessuto specifiche, è probabile che siano legate a
particolari antigeni: nel caso del diabete l’insulina, nel caso della tiroidite la tiroide, però vedremo che
spesso autoimmunità della tiroide vuol dire maggiore frequenza di altre patologie autoimmuni. Quindi in
questo caso non è l’Ag tiroideo che viene gestito in maniera errata ma è il meccanismo complessivo che
presiede alla separazione che evidentemente non avviene.
C’è una componente ormonale?
FORSE… alcune patologie hanno incidenza superiore nel sesso femminile rispetto a quello maschile, con
poche eccezioni in senso contrario. Quando si parla di differenze tra i sessi la prima cosa a cui si pensa sono
gli ormoni, abbiamo anche già accennato al fatto che il sistema immunitario nel sesso femminile debba
avere qualche cosa che lo differenzia da quello maschile se non altro perché c’è l’evento della gravidanza a
cui il sesso femminile deve essere predisposto ad andare incontro e che implica qualche meccanismo di
base in maniera diversa. Non sarà mai sottolineato a sufficienza il fatto che anche qui c’è una grossa
componente ambientale, le patologie autoimmuni stanno aumentando nel corso di poche generazioni, e
quindi le cause non possono essere geniche per giustificare questo aumento. C’è qualche cosa che sta
cambiando nel modo in cui il nostro sistema immunitario si confronta con l’esterno, e quindi nuove
patologie infettive, comunanza antigenica, l’utilizzo di adiuvanti (espressione MHC) anche in questo caso
patologie infettive che ci espongono ad adiuvanti, i microorganismi sono adiuvanti che stimolano la risposta
immunitaria in generale. Attivazione policlonale dei linfociti per esempio in seguito all’esposizione a virus
come l’EBV che attiva i linfociti in maniera aspecifica, potendo attivare cloni che potrebbero risultare essere
costituiti da popolazione self reattive. Quindi un’attivazione aspecifica della risposta immunitaria potrebbe
essere responsabile.
Nel grafico vedete un esempio di cosa significhi familiarità
questi sono familiari di soggetti che hanno diverse patologie autoimmuni; i familiari sani dei pazienti con
tiroidite di Hashimoto, nel sangue del 50% di questi familiari troviamo anche qui Ab anti tiroide e Ab contro
la mucosa gastrica responsabili dell’anemia perniciosa. Questi Ab sono presenti anche nel 10% della
popolazione normale di controllo, cioè soggetti ne pazienti, ne familiari.
Gli anticorpi sono Ab anti IgG. Anche nelle altre patologie gli Ab contro l’organo bersaglio sono
maggiormente presenti, ma ci sono Ab anche contro tessuti non specifici di quella patologia. Si ha una
sindrome che predispone alla sintesi di autoAb contro diversi tessuti e che si focalizza contro il tessuto
specifico.
Nella tabella precedente vi è l’associazione tra malattie autoimmuni e HLA.
Il Rischio Relativo è il rischio che corre una popolazione che ha quella caratteristica rispetto alla
popolazione generale di sviluppare quella malattia. Significa che se nella popolazione generale trovate
1/1000 individui che ha la tiroidite di Hashimoto, in soggetti che hanno l’aplotipo HLA DR11 ce ne saranno
3,2/1000. Cioè questi soggetti rischiano 3,2 volte di più lo sviluppo di tiroidite rispetto alla popolazione
generale che per definizione è 1. Il rischio in generale per qualunque patologia con questo tipo di studio è
sempre posto uguale ad 1 nella popolazione generale. Per definizione. Quando si parla di rischio relativo si
fa sempre un rapporto tra quanto rischia la popolazione generale e quanto rischia la popolazione con quella
caratteristica che stiamo studiando. Quindi è un numero assoluto, puro, essendo un rapporto. Per esempio
nella spondilite anchilosante l’aplotipo B27 è correlato ad un rischio relativo del 87,4%, è uno dei casi più
eclatanti. C’è una associazione tra aplotipi e patologie, ciò non significa che chi ha quell’aplotipo avrà
sempre quella malattia. Non è che se si ha un sospetto di spondilite anchilosante si fa l’HLA, l’HLA non
aggiunge nulla alla diagnosi, si fa diagnosi con la clinica, non con l’ HLA, HLA potrebbe eventualmente
rinforzare la diagnosi. Sono solamente associazioni, da non usare in maniera inappropriata.












