STATI DELLA MATERIA
STATO SOLIDO
Hanno volume e forma propri, ciò dipende dai legami, che esistono tra particelle ( quindi
conferiscono un volume proprio) e dal fatto che le stesse non sono libere di muoversi liberamente,
né di modificare la posizione reciproca, ma solo di oscillare intorno alla posizione di equilibrio (nei
solidi l’energia cinetica conferisce alle particelle solo la possibilità di oscillare). I solidi possono
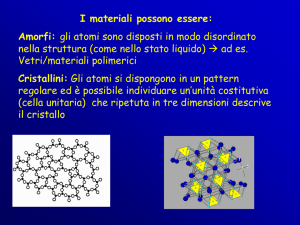
essere amorfi, oppure cristallini. I solidi cristallini sono formati da unità microscopiche di forma
compatibile con quella del cristallo (cella elementare) e si sfaldano secondo piani preferenziali. La
forma del minerale è dunque da considerarsi come la ripetizione infinite volte di uno stesso motivo,
mentre il reticolo cristallino è una ripetizione di punti, tale che ciascun punto abbia sempre lo stesso
intorno di punti. Esso risulta assegnato se fissiamo con 3 vettori non complanari la lunghezza di 3
traslazioni elementari. Da qui si ottiene la cella elementare, la cui ripetizione definisce il cristallo.
Differenza tra solidi cristallini e amorfi
Solidi cristallini
La struttura intera dei cristallini si
chiama RETICOLO CRISTALLINO:
- distribuzione ordinata di punti la cui
unità
si
chiama
CELLA
ELEMENTARE, la quale si ripete
infinite volte nello spazio. La forma
esterna (abito) rispecchia la forma della
cella elementare. I solidi cristallini
fondono a temperatura costante.
fluorite
Solidi amorfi
La struttura del solido amorfo è
costituita da particelle distribuite a
caso, come nei liquidi, ma a differenza
di essi le particelle in questi solidi sono
ferme.
I solidi amorfi passano gradualmente
dallo stato solido al liquido.
© Laura Condorelli 2013
Pag. 1
Differenza tra calore e temperatura
Calore
È una forma di energia ; qualcosa che passa da
un corpo ad un altro, U.M. : Joule.
Temperatura
È una proprietà del sistema legata alla velocità
di movimento delle particelle. U.M : gradi.
E= 3/2KT
Passaggi di stato
Calore latente di fusione:
Calore assorbito a temperatura costante durante il processo di fusione. Quando il solido diventa
liquido assorbe il calore dall’ambiente per fondere. Il calore latente viene restituito quando si passa
da stato liquido a solido (quando nevica la temperatura si alza).
Calore latente di evaporazione:
Calore assorbito da parte del sistema a temperatura costante durante il processo di evaporazione nel
passaggio da liquido a gas. Anche in questo caso quando il gas diventa liquido il calore viene
restituito all’ambiente.
Nei solidi cristallini le particelle sono disposte in modo regolare nel reticolo cristallino. Questi
solidi fondono a temperatura costante. Quando inizio a scaldare un solido le particelle assorbono
energia termica, aumentando le vibrazioni (trasformando quindi l’energia termica in cinetica), che si
manifesta con un aumento della temperatura del cristallo. Si arriva ad un punto in cui l’energia
cinetica supera l’energia di legame e il solido comincia a fondere. Durante tutta questa fase il calore
fornito non aumenta l’energia cinetica, ma servirà a rompere ogni legame fino a ché tutto il solido si
sarà liquefatto.
Nei solidi vetrosi non esiste una struttura cristallina e gli atomi sono disposti disordinatamente
(liquido congelato).
© Laura Condorelli 2013
Pag. 2
Solidi ionici (NaCl)
Ai nodi del reticolo cristallino stanno cationi e anioni, tenuti insieme da
un legame ionico molto forte, il ché rende ragione dell’elevato punto di
fusione (mentre il passaggio dallo stato liquido a quello gassoso è facile).
Hanno alta solubilità in acqua (sono solubili quando l’energia liberata con
l’idratazione supera quella reticolare, cosa assai difficile in genere per i
carbonati e solfati di calcio e di bario), sono cattivi conduttori elettrici allo
stato solido, mentre conducono bene in soluzione. Sono rigidi, duri, ma
facilmente sfaldabili
Solidi metallici (rame)
Ai nodi del reticolo cristallino sono tutti ioni dello stesso segno
(Na+, K+…). Gli elettroni di valenza sono invece liberi di muoversi,
costituendo una specie di gas elettronico che avvolge gli ioni e li
tiene uniti. Tutti questi atomi hanno basso potenziale di
ionizzazione e gli elettroni sono dotati di alta mobilità, il ché
conferisce a questi solidi un’elevata conducibilità elettrica e termica Il colore più chiaro indica la
(dovuta allo spostamento di elettroni ad alta energia, dopo che disposizione degli elettroni
hanno assorbito calore). I legami sono estesi a tutto il cristallo, di
conseguenza questi solidi hanno elevata resistenza meccanica. Sono
inoltre sono duttili e malleabili (è facile ridurli in fili e in lamine). I
punti di fusione sono variabili.
Solidi covalenti (diamante e grafite)
Ai nodi sono atomi neutri uniti con legame covalente, come ad esempio il
diamante (C). Hanno punti di fusione molto elevati, sono insolubili e non
conduttori (ad eccezione della grafite, che viene usata come elettrodo).
Solidi molecolari (ghiaccio)
Ai nodi sono molecole tenute insieme da legami intermolecolari di tipo di
Van der Waals, hanno dunque basso punto di fusione, sono cattivi
conduttori e solubilità variabile.
© Laura Condorelli 2013
Pag. 3
STATO LIQUIDO
Le molecole sono in grado di scorrere, cambiare la loro posizione reciproca, ma mai la distanza media,
poiché sono legate tra loro (ciò conferisce al liquido un volume proprio, anche se la forma sarà quella del
recipiente). Molto importante è la scarsa dipendenza del volume dalla pressione (i liquidi sono cioè
incomprimibili), le molecole di liquido si muovono, hanno energia cinetica di movimento, che è uguale a
quella dei gas alla stessa temperatura, ma le forze attrattive intermolecolari superano l’energia cinetica
(media).
Evaporazione è il passaggio da liquido a vapore e riguarda
le particelle alla superficie del liquido che abbiano energia
cinetica maggiore dell’energia di legame. Se il recipiente è
chiuso si crea un equilibrio tra il numero di particelle che
evaporano e il numero di particelle che da vapore tornano
allo stato liquido (condensazione). L’evaporazione dipende
dai seguenti fattori:
Natura del liquido : più forti sono i legami, più
difficile sarà l’evaporazione.
Temperatura: aumenta infatti l’energia cinetica
media.
Pressione esercitata dal gas sulla superficie del
liquido. Se questa aumenta, aumenta anche il numero
di particelle che condensano, poiché aumenta il
numero di urti contro la superficie del liquido .
Tra evaporazione e condensazione si crea un equilibrio
dinamico, tale che il numero di particelle che evaporano sarà
uguale al numero di particelle che da vapore tornano allo stato
liquido. Creando il vuoto è possibile misurare ad ogni temperatura
la pressione alla quale si manifesta l’equilibrio, che è detta
tensione di vapore del liquido. Essa aumenta con andamento
esponenziale quanto più aumenta la temperatura. Se al contrario
non viene predisposto il vuoto, all’equilibrio la pressione sarà
data dalla tensione di vapore sommata alla pressione atmosferica,
in modo che la pressione parziale del liquido sia comunque
uguale alla tensione di vapore.
Ebollizione
Se aumento la temperatura aumento anche l’evaporazione e la tensione di vapore. Ad una certa temperatura
l’evaporazione non avviene più solo alla superficie del liquido, ma in tutta la massa del recipiente, dove si
vedono bolle di vapore. Durante questo processo la temperatura è costante. Il punto di ebollizione dipende
dalla natura del liquido e dalla pressione esterna, poiché se la pressione esterna è maggiore della tensione di
vapore le bolle non riescono a spostare l’aria soprastante e il liquido non bolle. L’ebollizione invece avviene
quando la pressione esterna è uguale alla tensione di vapore (questo è il motivo per cui nella pentola a
pressione l’acqua bolle ad una temperatura maggiore rispetto a 100°C e i cibi cuociono prima; in montagna
invece l’acqua bolle prima, ma i cibi fanno fatica a cuocere).
La costanza della temperatura è dovuta al fatto che l’energia cinetica delle particelle è già quella massima
possibile a quella pressione e quindi il calore fornito serve solo ad allontanare le particelle. La quantità di
calore assorbito durante il processo di evaporazione è detto calore latente di evaporazione.
© Laura Condorelli 2013
Pag. 4
STATO GASSOSO
TEORIA CINETICA
Mentre la termodinamica si occupa di aspetti macroscopici, la teoria
cinetica dei gas prende in considerazione l’aspetto microscopico, cioè su
base statistica, ovvero tenendo presenti i valori medi, dal momento che
il gas risulta composto da un gran numero di particelle, ognuna delle
quali può comportarsi in modo autonomo.
La teoria cinetica dei gas in considerazione i gas ideali, simili a quelli
reali, ma in condizioni particolari, ovvero lontani dal punto di fusione e
a bassa concentrazione. In queste condizioni, infatti, il volume delle
singole particelle del gas (covolume) è trascurabile rispetto al volume
occupato dall’intera massa di gas e le forze attrattive tra particelle non
hanno luogo. I presupposti della teoria cinetica sono che:
1. Il gas sia composto da
particelle piccole.
2. Le particelle siano in
costante movimento.
3. Le particelle, urtandosi,
non perdano energia
cinetica.
Proprietà dei gas:
1. Espansione: il gas può espandersi.
2. Pressione: le particelle del gas esercitano una pressione sulle pareti interne del recipiente che lo
contiene. Tale pressione (P= F/cm2) si misura in
mmHg (peso di una colonnina di 1mm di Hg su una superficie di 1 cm2)
kgp/cm2 (peso equivalente ad un kgp su una superficie di 1 cm2)
atm (peso di una colonnina di 760 mm di Hg su una superficie di 1 cm2)
pascal (peso di 1 Newton su una superficie di 1 m2)
3. Bassa densità con valori intorno a 10-2 g/l
4. Capacità di diffondere
Le proprietà fisiche di un gas che obbedisca alla teoria cinetica sono la concentrazione molare, la pressione e
la temperatura. Si considerano condizioni standard la pressione pari a 1 atm e la temperatura di 25°C. La
materia allo stato gassoso occupa un volume che è 1000 volte maggiore rispetto a quello dei liquidi, in queste
condizioni le particelle sono lontane tra loro e si muovono liberamente fino a che non si urtano o urtano
contro le pareti del recipiente (pressione).
Aumentando il numero di molecole aumenta anche P ∞ [ ] (molarità)
la pressione.
La pressione aumenta anche se si aumenta la P ∞ T
temperatura, poiché essa aumenta l’energia cinetica Ecm = ½ mv2
media (quindi la velocità media) delle particelle.
Ecm = ½ mv2 n (per un numero n di particelle)
La pressione, al contrario,
proporzionale al volume.
© Laura Condorelli 2013
è
inversamente PV= 2/3n
Pag. 5
LEGGI SUI GAS
LEGGE DI BOYLE (ISOTERMA)
A temperatura costante se si
diminuisce il volume di un
gas la pressione aumenta.
Immaginiamo di dimezzare il
volume
di
un
gas,
mantenendolo alla stessa
temperatura. Gli urti contro
le pareti del recipiente
aumenteranno, aumentando
la pressione.
Il grafico è il seguente
Pressione e volume sono tra loro inversamente proporzionali, ovvero il loro
prodotto è costante.
LEGGE DI CHARLES (ISOBARA)
Se consideriamo la temperatura
in °C, la formulazione della
legge di Charles è: a pressione
costante, per ogni aumento di
temperatura di 1 °C, il volume
di un gas aumenta di 1/273 del
volume del gas a 0°C. Le
variabili
sono
temperatura
(indipendente)
e
volume
(dipendente). V0, ovvero il
volume del gas a 0°C
rappresenta il termine noto,
ovvero l’ordinata del punto di
ascissa zero e il valore di
1/273V0
rappresenta
il
coefficiente angolare, ovvero la
crescita della funzione.
Spostando l’asse delle ordinate V0= volume del gas a 0°C
in modo da farlo coincidere con t= temperatura in °C
l’intersezione della retta con α= 1/273
l’asse
delle
ascisse
(temperatura, t = -273°C), si V= V0 (1+αt) = V0+V0t/273
poichè
α= 1/273
ottiene una retta passante per Ponendo V=0 (punto di intersezione con l’asse delle ascisse), si avrebbe
l’origine degli assi.
V0 (1+αt)=0
poichè V0 ≠0 per definizione (vol del gas a 0°C)
Riscaldando un gas, il volume
aumenta in modo proporzionale 1+αt =0
quindi
1+t/273=0
all’aumento della temperatura t/273=-1
quindi
t= -1/273)= -273°C
assoluta. Infatti aumentando la
temperatura, se la pressione ponendo T=t+273 ottengo il secondo grafico
rimane costante il gas si V=KT
espande.
© Laura Condorelli 2013
Pag. 6
Quando T=0 il gas avrebbe idealmente volume pari a zero. Lo zero assoluto è quindi definito come la
temperatura alla quale i gas avrebbe volume zero, ma questa condizione non può essere raggiunta, sia
sperimentalmente, sia teoricamente (esiste comunque il volume stesso delle particelle).
LEGGE DI GAY-LUSSAC (ISOCORA)
Se consideriamo la temperatura
in °C, la formulazione della
legge di Gay-Lussac è: a
volume costante, per ogni
aumento di temperatura di 1
°C, la pressione di un gas
aumenta di 1/273 della
pressione del gas a 0°C. Le
variabili sono temperatura
(indipendente) e pressione
(dipendente). P0, ovvero la
pressione del gas a 0°C
rappresenta il termine noto,
ovvero l’ordinata del punto di
ascissa zero e il valore di
1/273P0
rappresenta
il
coefficiente angolare, ovvero la
crescita della funzione.
Spostando l’asse delle ordinate P0= pressione del gas a 0°C
in modo da farlo coincidere con T= temperatura in °C
l’intersezione della retta con β= 1/273
l’asse
delle
ascisse
(temperatura, t = -273°C), si P= P0 (1+βt) = P0+P0t/273
poichè β= 1/273
ottiene una retta passante per Ponendo P=0 (punto di intersezione con l’asse delle ascisse), si avrebbe
l’origine degli assi.
P0 (1+βt)=0
poichè P0 ≠0 per definizione (press. del gas a
Riscaldando
un
gas,
la 0°C)
pressione aumenta in modo
proporzionale all’aumento della 1+βt =0
quindi
1+t/273=0
temperatura assoluta. Infatti t/273=-1
quindi
t= -1/273)= -273°C
aumentando la temperatura, se
il volume rimane costante la ponendo T=t+273 ottengo il secondo grafico
pressione aumenta.
P=KT
D’estate infatti si deve diminuire la pressione degli pneumatici.
Quando T=0 il gas avrebbe idealmente pressione pari a zero. Lo zero assoluto è quindi definito come la
temperatura alla quale il gas avrebbe pressione zero, ma questa condizione non può essere raggiunta, sia
sperimentalmente, sia teoricamente.
LEGGE DI DALTON
In una miscela di gas la pressione totale è data dalla somma delle pressioni parziali di ciascun gas, essendo la
pressione parziale definita come la pressione che quel gas eserciterebbe, se occupasse da solo l’intero
volume. La pressione parziale di un gas A si calcola con la formula
PpA = Ptot Xa (dove XA= nA/ntot, ovvero la frazione molare di A)
In una miscela costituita dai gas A, B, C
Ptot= PpA+PpB+PpC
© Laura Condorelli 2013
Pag. 7
LEGGE DI AVOGADRO
Volumi uguali di gas, nelle stesse condizioni di pressione e temperatura, contengono lo stesso numero di
molecole (6,022 1023). Il volume occupato da una mole di gas in condizioni standard è detto volume molare
ed è pari a 22,414l.
EQUAZIONE GENERALE DEI GAS PERFETTI
Tenendo in considerazione le variabili dei gas, ovvero pressione, temperatura e volume, per una mole di gas
qualsiasi la loro relazione sarà
PV/T= R
(costante dei gas perfetti, pari a 0,0821 atm l/ K)
Per n moli di gas avremo
PV=nRT
© Laura Condorelli 2013
Pag. 8