I BIOCOMPOSTI
Acqua H2O
È il composto max abbondante in esseri viventi e costituisce praticamente il solvente
universale del protoplasma (complesso di sostanze che compongono la cellula vivente).
È un solvente polare.
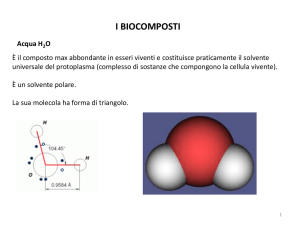
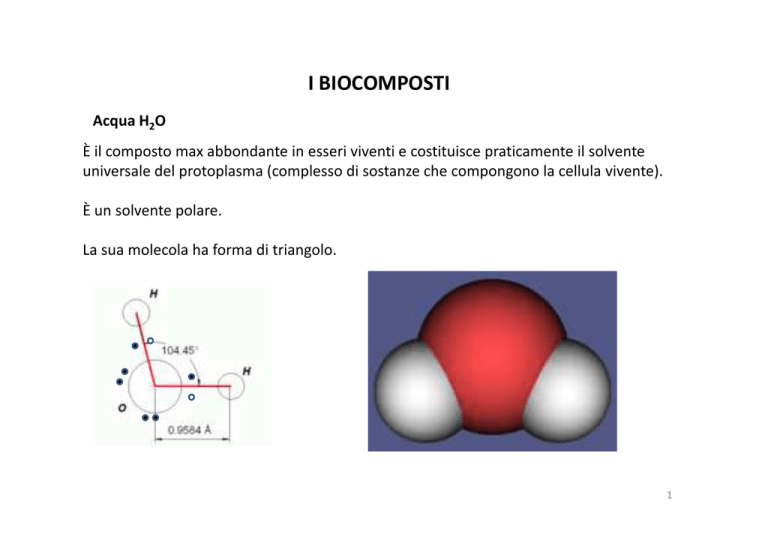
La sua molecola ha forma di triangolo.
1
Nome IUPAC
monossido di diidrogeno, idrossido di idrogeno, ossano
Caratteristiche generali
Massa molecolare (uma)
18.0153 g/mol
Aspetto
liquido incolore, inodore
Proprietà chimico-fisiche
Densità liq (g/cm3, in c.s.)
0.999972 a 277.15 K (4 °C)
Temperatura di fusione (K)
273.15 (0.00°C)
Temperatura di ebollizione (K)
373.15 (100.00 °C)
273.16 K (0.01 °C)
611.73 Pa
647 K (374 °C)
2.2064 × 107 Pa
Punto triplo
Punto critico
Tensione di vapore (Pa) a 293.15 K
Cp,m(J·K-1mol-1)
2338.54
Calore specifico
75.3
2
Dato che l'ossigeno ha una elettronegatività maggiore, il vertice della molecola ospita
una parziale carica negativa, mentre le estremità recano una parziale carica elettrica
positiva (dipolo elettrico).
δ-
δ+
H
O
H
δ
+
δ+
H
O
δ
H
-
δ+
H
O
H
δ
δ-
+
δ+
Le cariche fanno sì che le molecole vengano attratte reciprocamente l'una
dall'altra (legame idrogeno) e spiega molte delle proprietà fisiche tipiche
dell'acqua come p. es. i relativamente alti punto di fusione e di ebollizione, è
infatti richiesta una maggiore energia (rispetto a sostanze meno polari) per
rompere i legami idrogeno che tengono unite le molecole le une alle altre (es. il
metano CH4, simile per PM ma incapace di formare legami idrogeno, è un gas a
temperatura ambiente).
3
L’acqua è parzialmente dissociata
2H2O ⇄ H3O+ + OH-
Kw= 10-14
pH=cologaritmo della attività degli ioni idrossonio
4
Pressione osmotica
La pressione osmotica si sviluppa quando una membrana semipermeabile separa due
soluzioni una delle quali contiene un soluto che non può passare attraverso la
membrana, come accade nel caso di una cellula. L'acqua può attraversare la
membrana e lo farà passando nel compartimento dove è presente il soluto non
permeabile nel tentativo di uguagliare le attività ad entrambi i lati della membrana.
Questo causa un aumento della colonna d'acqua sul lato che contiene il soluto. Si
definisce pressione osmotica (p) la pressione da esercitare per impedire che la
colonna d'acqua si innalzi.
Π = ρgh
h
5
Per una cellula, se l'acqua entra nella cellula la soluzione è
detta Ipotonica cioè la concentrazione delle sostanze disciolte
è minore nella soluzione che nella cellula. La cellula tenderà ad
espandersi ed eventualmente scoppiare.
Se l'acqua esce dalla cellula, la soluzione è detta ipertonica
cioè concentrazione delle sostanze disciolte è maggiore nella
soluzione che nella cellula. La cellula si contrarrà.
Integratori salini, in genere isotonici.
6
7
RT
Π=−
ln (a1 )
V
Dove a1 è l’attività del solvente
Attraverso varie ipotesi semplificative, per Π si può arrivare alla
espressione di Vant’Hoff:
Π = RT ∑ ci
Dove ci (i≠
≠1) è è la concentrazione
dell’i-esimo soluto
esempio: acqua di mare (35 g/L di NaCl)
35
Π = 0 . 082 * 298 *
* 2 = 29 . 5 atm
58
8
Sali minerali
I più comuni ioni di sali inorganici presenti in soluzione in forma
dissociata sono:
Cationi: Na+, K+, Ca2+, Mg2+, …
Anioni: Cl-, NO3-, SO42-, PO43-, CO32-, …
9
Amminoacidi
Gli amminoacidi (o aminoacidi) sono molecole organiche che nella loro struttura
recano sia il gruppo funzionale dell'ammina (-NH2) sia quello dell'acido
carbossilico (-COOH).
In biochimica il termine amminoacidi si riferisce più spesso agli L-α-amminoacidi,
di formula generica NH2CHRCOOH, cioè quelli il cui gruppo amminico ed il cui
gruppo carbossilico sono legati allo stesso atomo di carbonio (chiamato carbonio
α) in configurazione L (con l'unica esclusione della glicina achirale in cui -R = -H).
10
Una molecola che ammette un'immagine speculare non sovrapponibile a sé è
detta chirale. Al contrario, una molecola che invece è sovrapponibile alla propria
immagine speculare è detta achirale.
Esempi di chiralità sono una mano - destra o sinistra - o una vite, che può avere
il filetto che ruota in senso orario o antiorario.
11
GLICERALDEIDE
L
D
12
I gruppi NH2 e COOH possono ionizzarsi in
soluzione acquosa. L’amminoacido è caricato
positivamente (-NH3+) a bassi pH e
negativamente (COO-) ad alti pH.
Ad un pH intermedio (punto isoelettrico o pHi)
l’amminoacido si comporta come uno ione
dipolare, con carica risultante nulla.
13
pH
14
Proteine
Rappresentano i composti organici più abbondanti nella cellula. Tutte le proteine
contengono C (≈50%w), H (≈7%w), O (≈23%w) ed N (≈16%w).
Possono contenere anche S (max 3% w).
Il peso molecolare varia tra 6,000 ad oltre 1,000,000.
Dal punto di vista chimico, una proteina è un polimero (o macromolecola) di residui
amminoacidici, uniti mediante un legame peptidico (proteina semplice), spesso in
associazione con altre molecole e/o ioni metallici (proteina coniugata).
‘
Per PM inferiore a 10,000 si
parla in genere di peptidi o
polipeptidi.
‘
15
Gli amminoacidi che compaiono nelle proteine di tutti gli organismi
viventi sono 20 (studi recenti suggeriscono che questo numero
potrebbe aumentare fino a 23) e sono sotto controllo genetico
(l'informazione del tipo e della posizione di un amminoacido in una
proteina è codificata nel DNA).
Talvolta, nelle proteine compaiono anche altri amminoacidi, più
rari, detti occasionali.
In natura sono stati finora scoperti oltre 500 amminoacidi
diversi che non fanno parte di proteine e svolgono ruoli biologici
diversi. Alcuni sono stati addirittura trovati nelle meteoriti.
16
Vediamo i 20 amminoacidi essenziali (ordinari):
Amminoacidi idrofobi
Glicina (Gly, G)
Alanina (Ala, A)
Leucina (Leu, L)
Valina (Val, V)
17
Triptofano (Trp, W)
Fenilalanina (Phe, F)
Metionina (Met, M)
Isoleucina (Ile, I)
18
Amminoacidi idrofili idrossilici
Serina (Ser, S)
Treonina (Thr, T)
Tirosina (Tyr, Y)
19
Amminoacidi idrofili ammidici
Asparagina (Asn, N)
Glutammina (Gln, Q)
20
Amminoacidi idrofili acidi
Acido aspartico (Asp, D)
Acido glutammico (Glu, E)
21
Amminoacidi idrofili basici
Lisina (Lys, K)
Arginina (Arg, R)
Istidina (His, H)
22
Altri amminoacidi
Cisteina (Cys, C)
Prolina (Pro, P)
23
24
25
Per capire quante proteine si possono formare con 20 diversi tipi
di amminoacidi, basta immaginare quante parole possiamo
comporre con le 21 lettere dell'alfabeto, inoltre, proteine che
contengono lo stesso tipo e numero di amminoacidi possono
differire dall'ordine in cui questi sono situati nella struttura della
molecola.
Una minima variazione nella sequenza degli amminoacidi di una
proteina (cioè nell'ordine con cui i vari tipi di amminoacidi si
susseguono) può portare a variazioni nella struttura
tridimensionale della macromolecola che possono rendere la
proteina non funzionale.
26
27
NEL CSAO DLELE
POINERTE QTEUSO
NON E’ VREO!
28
Gli amminoacidi entrati a far parte di una catena vengono
chiamati residui.
La sequenza di amminoacidi nella catena costituisce la
struttura primaria.
Dalle interazioni fra i vari gruppi presenti, la proteina
assume una particolare struttura (conformazione nativa
o struttura secondaria).
29
La struttura secondaria consiste nella conformazione spaziale
delle catene e può essere:
A spirale (alfa elica), mantenuta e consentita da
legami a idrogeno.
Le α eliche si formano quando un certo numero di
residui amminoacidici consecutivi adottano coppie
di angoli di legame compresi fra -60° e -45°. Lo
scheletro del polipeptide risulta arrotolato attorno
ad un asse centrale, mentre i gruppi laterali -R dei
residui amminoacidici sporgono radialmente
all'esterno dell'elica.
30
Ogni giro completo dell'elica corrisponde ad una
distanza di 5,4 Å lungo l'asse, il che implica che
vengano coinvolti 3.6 amminoacidi ogni giro.
Le α eliche finora trovate sono destrorse e
rappresentano circa un quarto della struttura
secondaria di tutte le proteine.
All'interno dell'α elica ogni legame peptidico
partecipa ad un legame idrogeno tra l'idrogeno
attaccato all'azoto elettronpositivo e l'ossigeno
carbonilico del quarto residuo amminoacidico
successivo.
Dunque ogni giro d'elica è unito a quelli
adiacenti da tre o quattro legami idrogeno, il
che rende particolarmente stabile la struttura.
31
Planare (o a foglietto beta)
È una struttura planare.
I piani si dispongono, nella struttura β, a
zig zag con un angolo di circa 120°. I
residui amminoacidici -R sporgono al di
sopra e al di sotto del foglietto
alternativamente. Anche in questo caso si
vengono a formare legami a idrogeno,
perpendicolari all'asse, per stabilizzare la
struttura, ma questo avviene tra foglietti
β diversi, separati anche da molti
aminoacidi.
32
33
A triplice elica (es collagene)
34
Le interazioni fra le catene laterali determinano una struttura
compatta tridimensionale con ripiegamento dell’intera catena
proteica (struttura terziaria).
La catena proteica tende a disporsi in modo da orientare i
gruppi R polari dei residui verso l’esterno, dove vengono
solvatati dall’acqua e i gruppi R idrofobi verso l’interno.
35
La struttura terziaria può essere fibrosa (in genere elevato
contenuto di alpha elica, molecole rigide a forma di
bastoncello) o globulare (conformazione spaziale molto
complessa, compatta, con cavità di dimensioni ridotte e
forma ben definita).
Le strutture secondaria e terziaria delle proteine possono essere
distrutte per azione di vari agenti (denaturazione) sia fisici che
chimici, ad esempio opera di acidi, alcooli, calore, solventi e
agenti chimici, luce ultravioletta, agitazione meccanica etc.
La denaturazione può essere reversibile o irreversibile.
36
Le proteine coniugate sono legate ad un gruppo di natura non
proteica (gruppo prostetico).
Nucleoproteine: il gruppo prostetico è un acido nucleico.
Glicoproteine: il gruppo prostetico contiene un carboidrato o un
suo derivato.
Fosfoproteine: il gruppo prostetico contiene fosforo.
Lipoproteine: il gruppo prostetico è un lipide.
37
Carboidrati (o glucidi)
Sono composti da C, H ed O con formula Cx(H2O)y. La desinenza
generale è –osio ed essendo chimicamente delle aldeidi o dei
chetoni, possono essere suddivisi in aldosi e chetosi.
aldeide
chetone
38
I glucidi sono i più importanti e veloci fornitori di energia
biochimica.
Sono le principali molecole di riserva energetica della
maggior parte degli esseri viventi (costituiscono anche molti
componenti strutturali delle cellule vegetali, che sono
formate per il 40% da cellulosa, il composto organico più
abbondante della biosfera).
I carboidrati si suddividono inoltre in monosaccaridi (o zuccheri
semplici), disaccaridi e polisaccaridi.
39
Monosaccaridi
40
I pentosi, gli esosi e gli eptosi hanno un sufficiente
numero di atomi tale da potersi chiudere ad anello per
reazione tra il carbonile e l'ossidrile legato al penultimo
atomo di carbonio della catena.
L'anello può essere costituito da cinque atomi (quattro di
carbonio e uno di ossigeno) o da sei atomi (cinque di
carbonio e uno di ossigeno) .
41
Ognuna delle due forme esiste in due configurazioni
diverse, dette α e β, a seconda che il nuovo gruppo OH, ottenuto dall'apertura del doppio legame
carbonilico, giaccia al di sotto o al di sopra del piano
medio della molecola.
42
*
*
*
*
* *
Interconversione tra le diverse forme del D-glucosio
La forma aperta è al centro, a sinistra ci sono le forme
cicliche furanosiche, a destra le forme cicliche
piranosiche; in alto le forme cicliche α, in basso le β.
43
Disaccaridi
Costituiti dall’unione di due monosaccaridi con perdita
di una molecola d’acqua.
Presente nell’orzo ed alcuni cereali
germinati.
44
Il comune zucchero
da tavola, presente
in barbabietola e
canna da zucchero.
Lo zucchero del
latte.
45
Polisaccaridi
46
47
La molecola della cellulosa (componente strutturale principale
delle piante) è una lunga catena non ramificata di sub-unità del
glucosio con un PM da 50,000 a più di un milione.
Sebbene il legame glicosidico nella cellulosa avvenga fra gli atomi
di C 1 e 4, le sub-unità sono legate diversamente che nell’amilosio:
48
Lipidi
I lipidi (detti anche grassi, dal greco lypos, grasso) sono molecole
organiche, raggruppate sulla base delle loro proprietà comuni di
solubilità: sono insolubili in acqua (per questo si definiscono
idrofobi), mentre sono solubili in solventi organici non polari
(nelle molecole lipidiche i gruppi non polari idrofobi sono
prevalenti su quelli idrofili).
A seconda del grado di complessità, i lipidi si suddividono in 3
categorie:
•lipidi semplici (trigliceridi, cere, terpeni);
•lipidi complessi (fosfolipidi);
•lipidi derivati (steroidi).
49
Lipidi semplici
Gliceridi e trigliceridi
I gliceridi sono esteri del glicerolo con acidi grassi.
glicerolo (1,2,3 propantriolo)
L'acido grasso è formato da un gruppo carbossilico e
da una catena idrocarburica.
50
Un trigliceride è un lipide costituito da una molecola di
glicerolo a cui sono legati 3 acidi grassi.
51
I triglicèridi sono i lipidi più abbondanti di origine naturale, e
costituiscono i grassi animali e gli oli vegetali.
Servono soprattutto come deposito per l'energia prodotta e
immagazzinata a livello di tessuto adiposo.
Spesso i 3 acidi grassi sono differenti. Gli acidi grassi sono i
lipidi più semplici e comuni, e possono differire per la
lunghezza e/o il tipo di legame tra gli atomi di carbonio, legami
che possono essere tutti singoli, e allora si parla di acidi grassi
saturi, oppure no, e in questo caso si parla di acidi grassi
insaturi (monoinsaturi se c'è un solo doppio legame,
polinsaturi altrimenti).
52
Sono stati isolati, da varie cellule e tessuti, più di 500 tipi di acidi
grassi, e si può notare che quasi sempre questi hanno un numero
pari di atomi di carbonio, solitamente compreso tra 12 e 20.
Le insaturazioni impediscono alle molecole di compattarsi
saldamente e di solidificare a temperatura ambiente.
La maggior parte dei grassi vegetali è composta da oli insaturi,
mentre i grassi animali si dividono: nei pesci prevalgono i grassi
insaturi, negli animali terrestri quelli saturi (burro).
La margarina è solida perché i grassi sono parzialmente saturati
tramite processo di idrogenazione.
53
Cere
Le cere (in biochimica) sono esteri di alcoli superiori
monovalenti (cioè a lunga catena e con una sola funzione
alcolica) con acidi grassi anch’essi a lunga catena (C30-C40).
54
Terpeni
I terpeni sono costituiti da multipli dell'unità isoprenica
(isoprenoidi).
La loro struttura contiene cioè uno scheletro idrocarburico
rispondente alla formula (C5H10)n. sulla catena si trovano poi funzioni
ossigenate come –OH, -CHO etc).
55
trans
cis
56
Appartengono ai terpeni alcune vitamine (A, E, etc).
57
Lipidi complessi
Fosfolipidi
Sono simili ai triglicèridi dal punto di vista strutturale, ma
contengono un gruppo fosfato. Il risultato finale è che ogni
fosfolipide ha una testa idrofila e una coda idrofoba.
Il gruppo X può essere uno zucchero
58
Questa particolare struttura li rende idonei a formare le
membrane biologiche che avvolgono le cellule e gli organuli
cellulari.
In un ambiente liquido le molecole di fosfolipidi si
dispongono con i gruppi idrofili rivolti sia verso la soluzione
acquosa interna alle cellule, sia verso quella esterna, relativa
all’ambiente circostante. Invece le code idrofobe si
attraggono tra loro occupando una posizione mediana.
I fosfolipidi sono i principali componenti della frazione
lipidica delle membrane cellulari.
59
Lipidi derivati
steroidi
Sono lipidi policiclici derivati del ciclopentano
peridrofenantrene. I loro scheletri carboniosi sono piegati per
formare quattro anelli uniti tra loro. Sono sempre costituiti da
tre anelli a sei lati e un anello a cinque lati. Comprendono il
colesterolo, calciferolo (vitamina D2), testosterone,
progesterone, cortisone.
60
Esempio: Colesterolo
61
Nucleotidi
I nucleotidi sono degli esteri fosforici dei nucleosidi, costituiti da
tre sub-unità:
• Una base azotata (purina o pirimidina);
• uno zucchero a cinque atomi di carbonio (pentosio) (base +
zucchero costituiscono un nucleoside);
• un gruppo fosfato.
62
I nucleotidi sono i monomeri degli acidi nucleici (DNA e RNA).
La presenza del residuo fosforico conferisce carattere
fortemente acido ai nucleotidi (per questo noti anche come
acido adenilico o acido guanilico).
L'aggiunta di uno o di due altri residui fosforici nella catena
(fosforilazione ossidativa) produce i nucleosidi di- e trifosfato
(NDP e NTP), fondamentali nel metabolismo energetico della
cellula.
63
basi
Le basi puriniche adenina e guanina si ritrovano sia nel
DNA sia nell’RNA.
64
Le basi pirimidiniche Citosina e Timina si ritrovano nel DNA,
mentre nell'RNA troviamo citosina e Uracile.
65
pentosi
Il DNA contiene il D-2-deossiribosio, l’RNA contiene il D-ribosio.
66
I nomi dei nucleotidi sono abbreviati in codici standard di tre o
quattro lettere.
Una d iniziale sta per "deossi-", cioè indica che il nucleotide in
questione è un deossiribonucleotide.
Nel caso di un ribonucleotide semplicemente non c'è la d.
La seconda lettera indica il nucleoside corrispondente alla
nucleobase (G, A, T, C, U).
La terza e la quarta lettera indicano la lunghezza della catena
di gruppi fosfato attaccata (mono-, di- e tri-, abbreviati in M,
D,T) e la presenza del gruppo fosfato (P).
67
Ad esempio, la deossicitosina trifosfato è abbreviata
con dCTP (la d perché è un deossiribonucleotide, la C
perché è una citosina, TP perché è un tri-fosfato).
68
69
polinucleotidi
Due sono i polinucleotidi importanti: gli acidi ribonucleici (RNA) e
gli acidi deossiribonucleici (DNA). In entrambi, le unità
mononucleotidiche sono legate allo stesso modo da ponti fosfodiesterei 3’-5’.
Dal punto di vista chimico, DNA ed RNA sono polimeri
organici le cui unità ripetitive sono nucleotidi.
70
71
Il DNA contiene le basi azotate A, C, G e T ed è il portatore
dell’informazione genetica.
Il DNA di quasi tutti gli esseri viventi, ad eccezione di alcuni virus, è
a doppia elica, cioè costituito da 2 catene elicoidali (cromosomi)
avvolte l’una sull’altra intorno ad uno stesso asse.
Le due catene hanno polarità opposte: esse vanno dall’estremità 5’
a quella 3’ in direzioni opposte.
72
Watson e Crick
73
74
Rosalind Franklin
75
Le due ossature zucchero-fosfato, fortemente idrofile, si
dispongono all’esterno della struttura e le coppie di basi
idrofobe sono impilate all’interno e disposte
perpendicolarmente rispetto all’asse longitudinale.
Le basi di un filamento sono appaiate alle basi dell’altro in
maniera selettiva attraverso legami a idrogeno.
La doppia elica consente il massimo numero possibile di legami
ad idrogeno, rendendo la struttura molto stabile.
76
77
La sequenza delle basi contiene
l’informazione genetica, leggibile
attraverso il codice genetico che ne
permette la traduzione in
amminoacidi.
Ogni tipo di base presente su un
filamento forma un legame con la
base posta sul filamento opposto
(appaiamento complementare).
Le basi puriniche formano legami
idrogeno con le basi pirimidiniche:
A può legare solo T
G può legare solo C.
78
79
80
Replicazione del DNA
Il DNA è in grado di autoreplicarsi se si trova nelle adatte condizioni:
la doppia elica si svolge e ciascun filamento funziona da stampo per
la sintesi di un filamento a lui complementare.
81
In un eucariote la replicazione del DNA inizia
contemporaneamente in migliaia di punti di origine:
82
Nei batteri (e in molti virus) il DNA è circolare e pare che
come tale venga replicato. Due forcelle di replicazione
prendono origine nello stesso punto e si allontanano da
esso in entrambe le direzioni contemporaneamente, fino
a quando si incontrano.
83