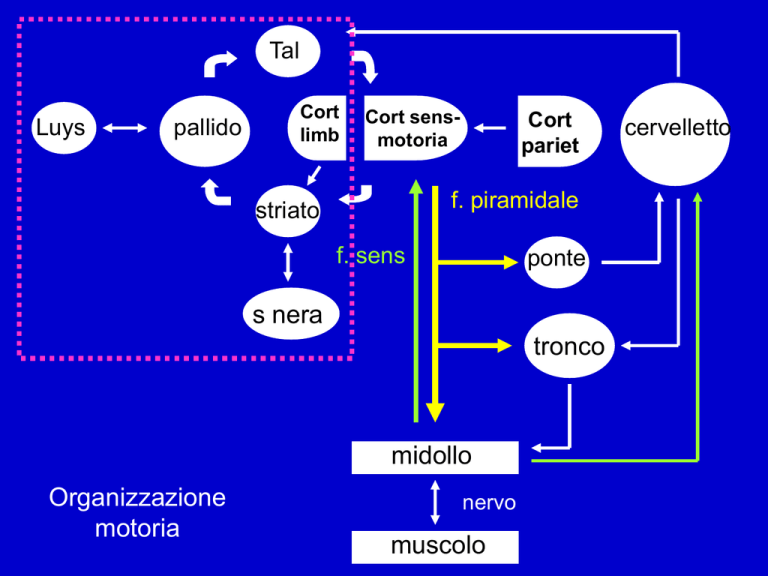
Tal
Luys
pallido
Cort
limb
Cort sensmotoria
Cort
pariet
f. piramidale
striato
f. sens
ponte
s nera
tronco
midollo
Organizzazione
motoria
nervo
muscolo
cervelletto
Il sistema extrapiramidale
Svolge differenti funzioni motorie: facilita e
rende più rapidi i movimenti, è coinvolto nel
dare avvio ai movimenti, regola la motilità
volontaria globale del corpo, regola la postura,
governa la motilità involontaria che accompagna i
movimenti volontari nonchè le modificazioni
mimiche e gestuali che accompagnano gli stati
emotivi.
E’ coinvolto nella attività psichica, specie nella
regolazione delle funzioni esecutive, del
comportamento e dell’affettività
Association
cortex
Limbic cortex
Association
cortex
ext
int
reticulata
compacta
Circuiti dei gangli della base
(modificata da Schmidt e Thews)
Gangli della base e funzioni
motorie
D1
D2
+D1,-D2
--
+
(glu)
(glu)
---
(Rev.Neurol. Suppl 1, 7S37, 2002)
+
Indirect
path
La via diretta riduce, la via
indiretta aumenta l’inibizione
di GPi sul talamo.
Direct
path
(GABA
Enk)
(GABA
Sub P)
(DA)
_
(GABA)
(GABA)
(glu)
+
Vie diretta e
indiretta nei
gangli della base
_
La perdita della attività
DAergica nigro-striatale riduce
la inibizione che la dopamina
esercita sui neuroni D2, che
che aumentano la attività e
inibiscono il GPe.
Il tono inibitorio di GPe su
STN è perciò ridotto, e STN
viene attivato.
STN attiva GPi, che inibisce il
talamo
La trasmissione tra questi circuiti è modulata
dall’input colinergico (Warren et al, Brain 128:239, ’05)
Gangli della base e funzioni
psichiche
Circuiti paralleli nei gangli della base
(1)
Alexander, Delong e Strick (Ann.Rev. Neurosci, 9: 357, 1986) e
Cummings (Arch. Neurol 50:873, 1993) descrivono cinque
circuiti paralleli, che partono da differenti aree corticali e
convergono su differenti porzioni del pallido e del talamo prima
di ritornare alla corteccia; sottendono differenti funzioni:
•
•
•
•
•
motore (motilità)
oculomotore (movimenti saccadici)
prefrontale dorsolaterale (funzioni esecutive)
orbitofrontale (comportamento)
cingolato anteriore (affettività e motivazioni)
Circuiti paralleli nei gangli della base
(2)
Più semplicemente, François et al (Brain 127:
2055, 2004) considerano tre circuiti:
• motore, dalla corteccia motoria, premotoria e
sensorimotoria, responsabile di ipercinesie
• associativo, dalla corteccia associativa parietale e
frontale, responsabile di deficit attentivi e
iperattività motoria
• limbico, dalla corteccia orbitofrontale, cingolata
anteriore e insulare, responsabile di
comportamenti stereotipati, tics,ossessività;
anormale anche nell’autismo (“social brain”: Mc
Alonan et al, Brain 128:268, ’05)
In primates, bicucullin
(GABA A antagonist)
Injections in ext
globus pallidus induce
dyskinesia, attention
deficit-hyperactivity
or stereotyped
behavior according to
the site of injection
François et al ,
Brain 127:2055,04
Modello di disturbo ossessivo-compulsivo.
Il segnale catturato dal circuito non consente di spostare l’attenzione
su un altro comportamento a causa di un feed-back positivo legato
alla prevalenza della via diretta, che inibisce il pallido interno e
provoca una eccessiva attivazione talamo-corticale
(Saxena et al, Brit.J.Psychiat. 173, suppl 35, pag.26,1998)
Sindrome di lentezza ossessiva (Hymas et al., ’91)
- Il 29% dei pazienti con disturbo ossessivo-compulsivo mostrano un
rallentamento dei movimenti non imputabile ai rituali compulsivi
- gli aspetti più comuni sono:
- perdita della fluidità dei gesti;
- esitazione ad iniziare un movimento;
- compromissione dei movimenti sequenziali degli arti superiori, della
scrittura, della parola e della marcia;
- ipertono di tipo rigido, con troclea
- intrusione di movimenti involontari nei movimenti volontari;
- deficit nei test che esplorano la capacità di rapidi cambiamenti di
strategie comportamentali
Sistema extrapiramidale e emozioni
Caratteristica dei sintomi extrapiramidali è il
peggioramento dei disturbi con il carico
emotivo. Il fenomeno è evidente soprattutto
per le ipercinesie (tremore, tics, discinesie), ma
si osserva anche per il “freezing”. Altre volte
forti emozioni liberano comportamenti motori
inaspettati.
Il legame è assicurato dalle connessioni fra il
lobo limbico e lo striato
Sintomatologia delle lesioni
extrapiramidali
Sintomatologia delle patologie
extrapiramidali (1)
Si manifestano con la sindrome parkinsoniana
(acinesia e “freezing” della marcia,
bradicinesia, modificazioni della postura e
riduzione dei riflessi posturali,
impoverimento della motilità involontaria,
ipomimia, ipertono con rigidità muscolare) o
con comparsa di movimenti abnormi (tremore,
discinesie, corea, atetosi, ballismo, etc) che
rappresentano l’alternanza di differenti
assetti posturali.
Sintomatologia delle patologie
extrapiramidali (2)
Talora le due serie di sintomi sono
associate: per esempio tremore e
ipocinesia nella m. di Parkinson,
ipocinesia e ipercinesie da l-dopa nelle
fasi tardive di trattamento della m. di
Parkinson, ipocinesia e irrequietezza
motoria (acatisia) nelle impregnazioni
da farmaci neurolettici.
Postura flessoria
parkinsoniana
Ipertono extrapiramidale (rigidità)
L’aumento del tono è distribuito in maniera
relativamente uniforme in tutti i muscoli (anche se
prevale nei flessori), e la resistenza al movimento
passivo non cambia con il variare della velocità né
con il grado di escursione articolare.
Genera la impressione di un giunto troppo stretto
(rigidità cerea); a volte è interrotta da cedimenti
ritmici, come se l’articolazione fosse costituita da
un ingranaggio dentato (fenomeno della ruota
dentata di Negro).
Aumenta durante un movimento attivo in un altro
segmento corporeo
Fenomeno della ruota dentata (da Mumenthaler))
Various types of
increased tone
(da Mumenthaler)
Patologie dei gangli della
base
Patologie più frequenti del sistema
extrapiramidale
- tremore essenziale
- s. parkinsoniane
- degenerative (“presinaptici)
- non degenerative (“postsinaptici)
- tics
- distonie
- m. di Huntington
- m. di Wilson
Sindromi parkinsoniane
•
•
M. Parkinson Idiopatica
•
Parkinsonismi secondari
– Vascolare
– Farmaco-indotto
– Emi-atrofia-parkinsonismo
– Idrocefalo NT o NC
– Ipossia, intossicazione da
CO
– Infettivo (encefalite
letargica, AIDS, PML)
•
– Metabolico (insuff. epatica
cronica, ipoparatiroidismo)
– Psicogenico
– Da tossine (manganese,
MPTP)
– Da tumori
– Da traumi cranici
Parkinsonismi atipici (“Parkinson-plus”)
– Atrofia Multisistemica
– Paralisi Sopranucleare Progressiva
– Degenerazione Cortico-Basale
– M. da corpi di Lewy
– M. di Hallervorden-Spatz
– Atrofia dentato-rubro pallido-luysiana
– Lytico-Bodig (PD+D+ALS di Guam)
Malattie Eredo-degenerative
– M. di Parkinson ereditaria (dominante, 1,
da sin-nucleina; recessivo, 2, da parkina)
– M. di Huntington (variante di Westphal)
– M. di Wilson
– Atassia spinocerebellare tipo 2 e 3
– M. metaboliche (Niemann-Pick, ceroidolipoofuscinosi, Gaucher)
Differenti tipi di s. parkinsoniana
La s. parkinsoniana si osserva sia nella malattia di Parkinson
idiopatica che negli altri parkinsonismi degenerativi o
secondari
Nella m. di Parkinson idiopatica la s. parkinsoniana si
accompagna spesso a tremore; l’esordio è di solito
asimmetrico; vi sono numerosi sintomi non motori (disturbi
dell’olfatto, disturbi del sonno, depressione, sudorazione,
aumento della secrezione sebacea clinicamente poco
significativi; in fase avanzata si può associare a demenza.
Carattere comune dei parkinsonismi degenerativi e secondari
è la tendenza ad una sindrome parkinsoniana ipertonicorigida, senza o con scarso tremore, tendenzialmente
simmetrica, di solito associata o preceduta da altri rilevanti
segni neurologici
S. parkinsoniane degenerative
Come tutte le malattie degenerative, sono dovuti a una
alterazione del meccanismo di degradazione delle
proteine ad opera del sistema ubiquitina-proteasomi. Si
formano peptidi neurotossici che si accumulano all’interno
dei neuroni.
Nella m. di Parkinson, nella atrofia sistemica multipla,
nella m. a corpi di Lewy diffusi e nella m. di HallervordenSpatz si accumula alfa –sinucleina; nella paralisi
sopranucleare progressiva nella degenerazione
corticobasale (come nella demenza frontotemporale) si
accumula proteina tau iperfosforilata
Le proteine dei parkinsonismi degenerativi
La alfa-sinucleina è una proteina che
mantiene la integrità delle vescicole
sinaptiche e il loro trasporto dal soma
all’assone
La proteina tau è associata alla
formazione e alla stabilizzazione dei
microtubuli
La malattia di Parkinson
da Jenner, 2006
Corpi di Lewy
(oss. Palladini)
Lewy bodies in Parkinson disease contain α-synuclein and ubiquitin
(Arawaka et al, Neurology 51:887,98)
10 mm
Hematoxylin-eosin
Anti-synuclein
antibody
Anti-ubiquitin
antibody
Increased concentration
of melanin and alpha-synuclein
triggers a cascade leading to
intracellular aggregates and cell
death
(Halliday et al Brain 128:2654, 2005)
s. nigra
Lewy bodies
locus ceruleus
dorsal n. of vagus
Malattia di Parkinson idiopatica
E’ caratterizzata da
-
esordio abituale dopo i 50 anni
bradicinesia
ipomimia (“facies impassibile”)
rarità dell’ammiccamento
rigidità
tremore a riposo (3-6 Hz)
distribuzione asimmetrica
instabilità posturale tardiva
buona risposta alla l-dopa
La caratteristica istopatologica è la perdita neuronale nella
sostanza nera (pars compacta). I neuroni residui mostrano
inclusioni citoplasmatiche eosinofile, i corpi di Lewy
UK PD Soc. Brain Bank clinical diagnostic criteria, 1
•
FASE 1: diagnosi di Sindrome Parkinsoniana
Bradicinesia + Almeno uno dei seguenti
A) Rigidità
B) Tremore a riposo 4-6 hz
C) Instabilità posturale
•
FASE 2: criteri di ESCLUSIONE per MP idiopatica
•Storia di ictus
•Traumi cranici ripetuti
•Encefalite
•Crisi oculogire
•Trattamento con neurolettici
•Familiarità
•Remissione
•Paralisi dello sguardo
•Segni cerebellari e/o segni piramidali e/o segni vegetativi
•Esposizione a tossici
•Demenza
UK PD Society Brain Bank clinical diagnostic criteria, 2
•
FASE 3: criteri a SOSTEGNO di MP idiopatica
Sono richiesti un minimo di TRE tra:
•Esordio monolaterale
•Persistente asimmetria
•Tremore a riposo
•Disturbo progressivo
•Durata della malattia >10 anni
•Risposta eccellente alla L-Dopa
•Risposta alla L-Dopa duratura (>5 anni)
•Discinesie da L-Dopa
Altri disturbi della m. di Parkinson idiopatica
•
•
•
•
olfatto: nel 90% dei soggetti (e nel 10 % dei familiari sani), è presente
iposmia di cui raramente i pazienti si lamentano; precoce, precede il
disturbo motorio; più frequente e più pronunciato che nella MSA e PSP
sonno: nel 70% disturbato, frammentato e insoddisfacente. Il disturbo
più importante è il “REM behavior disorder” (sogni vividi e comportamento
motorio agitato nel sonno REM) che compare prima dei segni motori; è
però più frequente e precoce nella MSA. La sonnolenza diurna è in gran
parte legata alla terapia, specie dopaminergica
disturbi psichici: depressione (40 % dei casi) anche precoce ma di solito
“minore” e mescolata con la compromissione motoria; deterioramento
cognitivo tardivo (20 % dei casi); comportamenti “edonistici” compulsivi
come gioco d’azzardo, ipersessualità, non sempre con successo, assunzione
smodata di farmaci (“edonistic dysregulation”; 4% dei casi)
disturbi autonomici: ipotensione ortostatica, stipsi, iperattività
detrusoriale (più raramente iporeflettività), sudorazione, aumentata
secrezione sebacea, disfunzione erettile
(v. Aurilia et al, JND 2: 26, 2006)
The non-motor symptom complex of Parkinson's disease
•
•
•
•
•
•
•
•
•
•
•
•
•
•
•
•
•
•
•
•
•
•
•
•
•
•
•
Neuropsychiatric symptoms
Depression, apathy, anxiety
Anhedonia
Attention deficit
Hallucinations, illusion, delusions
Dementia
Obsessional behaviour (usually drug induced),
repetitive behaviour
Confusion
Delirium (could be drug induced)
Panic attacks
Sleep disorders
Restless legs and periodic limb movements
Rapid eye movement (REM) sleep behaviour
disorder and REM loss of atonia
Non-REM-sleep related movement disorders
Excessive daytime somnolence
Vivid dreaming
Insomnia
Sleep disordered breathing
Autonomic symptoms
Bladder disturbances
Urgency
Nocturia
Frequency
Sweating
Orthostatic hypotension
Falls related to orthostatic hypotension
Coat-hanger pain
•
Sexual dysfunction
•
Gastrointestinal symptoms (overlaps
with autonomic symptoms)
•
•
•
•
•
•
•
•
•
•
•
Hypersexuality (likely to be drug induced)
Erectile impotence
Dry eyes (xerostomia)
Dribbling of saliva
Ageusia
Dysphagia and choking
Reflux, vomiting
Nausea
Constipation
Unsatisfactory voiding of bowel
Faecal incontinence
•
Sensory symptoms
•
Other symptoms
•
•
•
•
•
•
•
•
•
Pain
Paraesthesia
Olfactory disturbance
Fatigue
Diplopia
Blurred vision
Seborrhoea
Weight loss
Weight gain (possibly drug induced)
(Adapted from Lancet Neurol 5:235, 2006)
Bladder control and basal ganglia
(Herzog et al, Brain 129: 3366, 06)
ACC
•ACC
FLC
Neural activity in ACC and FLC in bladder fullness
Cortical centres of urinary bladder control in
stimulation OFF condition (A) and ON
stimulation (B) ACC:ant cingulate cortex;
LFC: lat frontal cortex; PAG: periaqueductal
grey; PMC: pontine micturition centre
Influence of STN-DBS on cortical centres of urinary bladder control ON condition (B). in stimulation OFF condition (A) and stimulation
D1
D2
+D1,-D2
--
+
(glu)
(glu)
---
(Rev.Neurol. Suppl 1, 7S37, 2002)
+
Indirect
path
La via diretta riduce, la via
indiretta aumenta l’inibizione
di GPi sul talamo.
Direct
path
(GABA
Enk)
(GABA
Sub P)
(DA)
_
(GABA)
(GABA)
(glu)
+
Vie diretta e
indiretta nei
gangli della base
_
La perdita della attività
DAergica nigro-striatale riduce
la inibizione che la dopamina
esercita sui neuroni D2, che
che aumentano la attività e
inibiscono il GPe.
Il tono inibitorio di GPe su
STN è perciò ridotto, e STN
viene attivato. L’iperattività di
STN è il marchio del
Parkinsonismo.
STN attiva GPi, che inibisce il
talamo
Patogenesi della m. di Parkinson
• l’ interpretazione attuale (in attesa di ulteriori precisazioni)
è basata sulla presenza di due circuiti motori dallo striato
(matrice) al pallido interno (via diretta, recettori
dopaminergici D1 e via indiretta, recettori D2)
• la prevalenza tonica della via indiretta sottende i segni
motori “difettuali” (bradicinesia e rigidità); la iperattività
fasica della via diretta è responsabile delle ipercinesie
• la malattia prende origine dalla degenerazione dei neuroni
della sostanza nera compacta, che da origine alla proiezione
dopaminergica sulla matrice dello striato; a sua volta, la
sostanza nera compacta è controllata da una proiezione
dopaminergica dagli striosomi
• la compromissione degli altri circuiti dei gangli della base
(associativo e limbico) è responsabile dei sintomi non motori
Patogenesi della bradicinesia
• Vi è iperattività della via indiretta D2 striato
(aumenta -) > pallido esterno (riduce -) > subtalamo
(aumenta +) > pallido interno/ sostanza nera
compacta (aumenta -) > talamo (riduce +) > corteccia
disattivata
• la iperattività del pallido interno inibisce
tonicamente il talamo, che disattiva la corteccia
Questo determina
• deficit di elaborazione del programma motorio prima
dell’inizio del movimento
• deficit di integrazione sensorimotoria
• il disturbo è maggiore per movimenti generati
internamente e per i programmi motori complessi
Patogenesi della rigidità
La disattivazione della corteccia modifica gli effetti
discendenti e determina:
• aumento di efficienza delle afferenze dai fusi
neuromuscolari (terminazioni secondarie, gruppo II) per
ridotta inibizione discendente dai nuclei ceruleo e del rafe
• ridotta azione inibitoria degli interneuroni spinali Ib, che
ricevono le afferenze dagli organi tendinei di Golgi e
modulano la attivazione dei muscoli agonisti e sinergisti
• ridotta azione inibitoria degli interneuroni Ia, che ricevono le
afferenze primarie dai fusi e sottendono la inibizione
reciproca degli antagonisti
• aumento delle reazioni di accorciamento e allungamento e
delle risposte riflesse “long loop”
Patogenesi del tremore
• Attività neuronale aberrante nel pallido
interno (Parè et al Neuroscience 35:217,
1990; Taha et al J.Neurosurg. 86:642,
1997)
• sviluppo di scariche ritmiche nel talamo
ventrale (Lenz et al J.Neurosci.
8:754,1988)
Patogenesi delle fluttuazioni motorie e delle
ipercinesie tardive
le fluttuazioni dipendono da
• vita media della L-Dopa relativamente breve (60-90 minuti)
• alterazioni postsinaptiche della espressione genica dei recettori
dopaminergici in conseguenza della stimolazione pulsata
• ridotto numero di terminazioni dopaminergiche striatali nelle fasi
avanzate
• ridotta capacità di tamponare le fluttuazioni plasmatiche della LDopa
le ipercinesie derivano (in maniera simile alla corea e
all’emiballismo) da improvvise iperinibizioni di STN da parte di
GPe, che variano la entità e la sequenza temporale dell’output
talamico verso la corteccia
(Lieberman et al, Neurology 51:1057,1998; Obeso et al, Neurology 55,
suppl 6, pag 87, 2000)
+
(glu)
(glu)
---
(Rev.Neurol. Suppl 1
7S37, 2002)
+
Indirect
path
Direct
path
(GABA
Enk)
(GABA
Sub P)
(DA)
_
(GABA)
(GABA)
(glu)
+
Vie diretta e
indiretta nei
gangli della base
_
Ipercinesie
La via diretta riduce, la via
indiretta aumenta l’inibizione
di GPi sul talamo. Si è visto
che l’iperattività di
STN è il marchio del
Parkinsonismo.
Nelle ipercinesie (così come
nella corea-emiballismo)
inibizione che GPe esercita
su STN subisce improvvise
fluttuazioni, che cambiano la
entità e la sequenza della
attivazione talamo-corticale
Caratteristiche delle fluttuazioni motorie
• brevi: “freezing”, cinesie paradosse
• medie: iniziano con il “wearing off” ; sono
imprevedibili, talora legate a fluttuazioni sella
emotività; possono essere facilitate da dosi basse e
frequenti di L-Dopa (“yo-yoing”); peggiorano nel
pomeriggio
• lunghe: all’inizio del trattamento con L-Dopa (due
settimane per valutare il’effetto); durante la
sospensione (“drug holiday”), nella fase iniziale e dopo
due settimane; nella donna giovane in fase
premestruale
(Quinn, Neurology 51: suppl 2, S25-S29, 1998)
Caratteristiche delle ipercinesie
• claudicatio distonica: spasmi nell’arto inferiore più compromesso,
in soggetti non trattati, indotti dall’esercizio
• delle fasi “off”: di aspetto distonico; relativamente stabili;
dolorose; all’inizio del mattino; all’inizio della dose; durante i
periodi di “wearing off” e di “off”
• difasiche: di aspetto coreico e talora ballico; fluttuanti; non
dolorose; stereotipate; compaionio a inizio e fine dose, aumentano
aumentando la dose di L-Dopa; si espandono fino a coprire l’intero
periodo di azione della L-Dopa (dal blocco alla ipecinesia, senza
intermezzi)
• di picco: coreiche, talora distoniche; fluttuanti; non dolorose;
talora limitate a faccia e collo
(Quinn, Neurology 51:suppl 2, S25-S29, 1998)
Altre fluttuazioni
• Cognitive: rallentamento ideativo in fase “off”, accelerazione in fase
“on”
• Vegetative: sudorazione, temperatura corporea, pressione arteriosa,
senso della fame, eruttazione, disfagia, nausea, stipsi e anismo,
funzione vescicale, erezione, funzione respiratoria, tosse,
arrossamento del viso, acatisia, gambe senza riposo
• Umore: depressione, ansia, irritabilità, apatia, raramente
allucinazioni in fase “off”, ; euforia, ipersessualità, ipomania e talora
blocco mutacico in fase “on”
• Dolore: in genere legato alla distonia e presente in fase “off”; più
raro in fase “on”, e legato alla distonia di picco
(Quinn, Neurology 51, Suppl 2, S25, ‘98; Jimenez et al, Neurology 52:210,’99)
Patogenesi delle allucinazioni
• Compaiono maggiormente in soggetti anziani, con altri disturbi
della acuità (cataratta, degenerazione maculare) e declino
cognitivo, sotto l’effetto di trattamenti con dopaminergici e
anticolinergici
• anche se le cellule amacrine della retina usano dopamina come
neurotrasmettitore, e la sensibilità visiva al contrasto è ridotta
nella m. di Parkinson, l’origine delle allucinazioni è centrale
• si manifestano principalmente con la sensazione di una presenza
estranea o con la presenza di persone o animali alla periferia del
campo visivo; durano pochi secondi o minuti. Nel 10% vi sono anche
allucinazioni uditive
• migliorano con la clozapina
• compaiono nelle fasi avanzate anche senza l’uso di farmaci
(Neurology 66:93,2006)
Malattia di Parkinson idiopatica: sporadica o
ereditaria?
Nella maggior parte dei casi la malattia è sporadica.
Sono però in corso di identificazione numerose forme ereditarie:
- forme dominanti, da mutazioni del gene PARK1 (SNCA, che codifica la
proteina alfa-sinucleina) e PARK8 (LRRK2, leukin-rich repeat kinase 2,
proteina dardarina, 5-15 % dei casi familiari, 1-2 % dei casi sporadici
nella popolazione europea; varianti di questa mutazione sono presenti
nei nord-africani, negli ebrei Ashkenazi e nei cinesi);
- forme recessive: geni PARK2 (parkina, enzima del gruppo ubiquitinkinase), PARK6 (DJ-1, sensore intracellulare dello stress ossidativo) e
PARK7 (PINK-1, protein-kinase mitocondriale); altre forme recessive
(PARK3, PARK9, PARK10, PARK11) attendono ancora la identificazione
del gene e della proteina.
Le forme recessive sono decisamente più frequenti quando la malattia
esordisce in età giovanile. Inoltre, le forme sporadiche potrebbero
essere malattie familiari a esordio molto tardivo
Table 1 Familial forms of Parkinson’s disease: genes, chromosomal loci, and mode of inheritance
Locus/gene
Chromosom
al location
Inherita
nce
pattern
PARK-1/ -synuclein
4q21–q23
AD
Late onset
PARK-2/parkin
6q25.2–q27
AR
Juvenile onset, slow progression, focal
dystonia
PARK-3
2p13
AD
Late onset
Formerly PARK-4/ -synuclein
triplication
4q21–q23
AD
Early onset, rapid progression, postural
tremor, late dementia
PARK-5//UCHL-1
4p14
AD
Late onset
PARK-6/PINK-1
1p35–p36
AR
Early onset, slow progression
PARK-7/DJ-1
1p36
AR
Early onset, slow progression
PARK-8/LRRK-2
12p11.2–
q13.1
AD
Late onset
PARK-10/unknown
1p32
Late onset
PARK-11/unknown
2q36–q37
Late onset
NA/synphilin-1
NA/NR4A2
*
Clinical features
5q23.1–
q23.3
AD
Late onset
2q22–q23
AD
Late onset
AD, autosomal dominant; AR, autosomal recessive.
(Hague et al, JNNP 76: 1058, 2005)
* Susceptibility genes: Tau-MAPT, FGF20, NR4A2-Nurr1, glucocerebroside GBA (JND 2:7, 06)
Non tutti i sintomi della m. di Parkinson
sono ben controllati dalla L-Dopa
Sintomi controllati
• ipocinesia
• rigidità
Sintomi poco o non controllati
•
•
•
•
•
•
•
•
tremore
iposmia
instabilità posturale
episodi di “freezing”
disturbi del sonno
disturbi autonomici
disturbi dell’umore
deterioramento cognitivo
I parkinsonismi
Differenti tipi di s. parkinsoniana
La s. parkinsoniana si osserva sia nella malattia di Parkinson
idiopatica che negli altri parkinsonismi degenerativi
- atrofia sistemica multipla
- paralisi sopranucleare progressiva
- degenerazione cortico-basale
- malattia da corpi di Lewy diffusi
- m. di Hallervorden-Spatz
- atrofia dentato-rubra-pallido-luysiana
Carattere comune dei parkinsonismi degenerativi, è la tendenza ad
una sindrome parkinsoniana ipertonico-rigida, senza o con scarso
tremore, tendenzialmente simmetrica, di solito associata, fino
dall’esordio o nel corso della evoluzione, con segni di
compromissione di altri sistemi neurologici. La condizione
neurologica è analoga ma assai variabile nei parkinsonismi
secondari.
Le associazioni sindromiche dei parkinsonismi
degenerativi
Mostrano usualmente sintomi associati alla s. parkinsoniana la
- atrofia sistemica multipla, segni cerebellari e vegetativi: disartria, anterocollo, s.
ipertonico-rigida talora asimmetrica,talora tremore asimmetrico, riduzione dei
movimenti oculari verso l’alto, disturbi dell’equilibrio, disturbi vegetativi,
denervazione dello sfintere anale, segni piramidali, REM behavior disorder
- paralisi sopranucleare progressiva, disturbi dei movimenti oculari e demenza:
demenza, s. ipertonico rigida simmetrica, riduzione dei movimenti oculari verso il
basso e l’alto, frequenti cadute, postura estensoria
- degenerazione cortico-basale, demenza e aprassia: demenza, ipocinesia
asimmetrica degli arti superiori, aprassia con segno della“mano straniera”, distonia
segmentale, mioclono
- malattia da corpi di Lewy diffusi, demenza e psicosi: demenza con allucinazioni,
psicosi, andamento fluttuante , s. ipertonico-rigida lieve e tardiva, intolleranza alla ldopa
- malattia di Hallervorden-Spatz, distonia e regressione giovanili : recessiva,
esordio a 10-20 a. con rigidità, distonia, coreoatetosi, segni piramidali, retinite
pigmentosa, atrofia ottica, regressione e demenza
- atrofia dentato-rubro-pallido-luysiana, atassia, mioclono giovanili: atassia,
coreoatetosi, mioclono, crisi convulsive, disturbi psichici
S. parkinsoniane secondarie
Le più comuni sono i parkinsonismi tossici (da MPTP, impregnazione
di neurolettici, flunarizina, clebopride), vascolare (“lower body
parkinsonism”), anossico, da tumori, da epatopatie acquisite.
Non rispondono alla l-dopa e mostrano un Dat-scan normale. Le
forme iatrogene si ricostruiscono in base alla storia psichiatrica e
farmacologica; quelle vascolare e anossica mostrano lesioni
cerebrali multiple (sostanza bianca emisferica e gangli della base)
all’esame di risonanza. Anche quella da tumori richiede le immagini.
Le degenerazione epatocerebrale acquisita mostra (oltre alla
epatopatia, spesso con shunt porta-cava) iperintensità T1
bilaterale nel pallido (deposizione di manganese?); migliora con il
trapianto.
Va anche ricordata la m. di Creutzfeldt-Jakob.
Secondary parkinsonisms
(Obeso et al, Lancet Neurology 5: 75, 2006)
•
Infectious
Cranial trauma
•
•
•
Encephalitis lethargica and other viral
infections (eg, AIDS, PML)
Prion disease
Neurosyphilis
Toxoplasmosis
•
•
•
Striatal variant of dementia pugilistica
Chronic subdural haematoma
Mid-brain trauma
•
•
•
•
•
•
Carbon monoxide
Cyanide
Carbon disulphide
MPTP
Manganese
Solvents
•
•
•
•
•
•
Hypoxia
Hypoparathyroidism
Familial basal ganglia calcification
Extrapontine myelinolysis
Chronic liver failure
Wilson's disease
•
•
Dopamine-receptor blockers
Classic neuroleptics (eg,
phenothiazines, butyrophenones)
Atypical antipsychotics (eg,
risperidone, olanzapine)
Dopamine-depleting drugs (eg,
tetrabenazine)
Other drugs (eg, valproic acid, calcium
channel blockers)
•
•
•
•
•
•
•
•
Huntington's disease
SCA mutations
FTDP-17
Neuroacanthocytosis
Dentatorubropallidal-luysian atrophy
Normal pressure hydrocephalus
Haemiatrophy–hemiparkinson syndrome
Psychogenic
•
•
•
•
•
Toxic
Drug induced
Brain tumours
Supratentorial and brainstem tumours
Arteriovenous malformations
Vascular lesions
Metabolic
Miscellaneous
(PML=progressive multifocal
leucoencephalopathy; MPTP=1-methyl-4pnenyl-4-propionoxypiperidine; FTDP17=frontotemporal dementia with
parkinsonism linked to chromosome)
La risposta farmacologica nei parkinsonismi
degenerativi
Solo nella m. di Parkinson idiopatica si
osserva una buona risposta
terapeutica alla terapia con l-dopa.
Gli altri parkinsonismi degenerativi
vengono perciò globalmente definiti
“non l-dopa rispondenti”
DIFFERENTE RISPOSTA TERAPEUTICA
Parkinson idiopatico (IPD)
Atrofia multisistemica (MSA)
Paralisi sopranucleare progressiva (PSP)
Atrofia cortico basale (CBD)
Parkinsonismo Vascolare (VPD)
IPD
LEVODOPA
DA-AGONISTI
MOVIMENTI
INVOLONTARI
DISTONIE
MSA
PSP CBD VPD
Immagini SPECT-Dat-scan
Non deficit dell’attività
dopaminergica
(Parkinson iatrogeno)
Deficit bilaterale dell’attività
dopaminergica presinaptica, di
entità nettamente prevalente
a destra (MdP idiopatica)
F-dopa PET scan in LRRK2 dardarin-linked (Park 8) familial PD
(Khan et al, Brain 128:2786;2005)
Scintigrafia miocardica
Rapporto scintigrafico Heart/Mediastinum in vari parkinsonismi
(Nagayama et al, JNNP 76: 249, 2005)
Scintigrafia miocardica
Msa: captazione normale
MP: captazione ridotta
Parkinsonismi degenerativi
Atrofia sistemica multipla
• E’ una malattia sporadica caratterizzata clinicamente da una
variabile combinazione di segni parkinsoniani, autonomici,
cerebellari e piramidali; rapporto M:F 1:0.9
• patologicamente da perdita cellulare, gliosi e presenza di
inclusioni citoplasmatiche, positive per alfa- sinucleina, nella glia
di molte strutture cerebrali e spinali
• le due principali presentazioni motorie sono parkinsoniana (PMSA, 66%) e cerebellare (C-MSA, 34%)
• l’età di inizio media è 55 a. (47-63 a.)
• la durata media, assai minore che nel Parkinson idiopatico, è 4
a. (1-5 a.)
• nel periodo di stato sono presenti segni parkinsoniani (100%),
autonomici (96%), cerebellari (78%), piramidali (54%)
(Geser F. and the European MSA Study Group, Mov. Dis 21:179,
2006)
La atrofia sistemica multipla (MSA) è una alfa-sinucleinopatia
ed è il più frequente parkinsonismo degenerativo dopo la m. di
Parkinson idiopatica
Quali sono i “campanelli d’allarme”?
- scarsa o solo iniziale risposta alla l-dopa
- discinesie da l-dopa orofaciali e cervicali
- disartria sproporzionata
- “REM behavior disorder”
- stridore notturno
- cadute frequenti
- s. parkinsoniana simmetrica
- anterocollo sproporzionato
- difficoltà nello sguardo verso l’alto
- mioclono riflesso
- incontinenza urinaria
- ipotensione posturale
- disturbi dell’equilibrio
- riflessi profondi vivaci
- acrocianosi (“dusky hands”)
- denervazione dello sfintere anale (EMG)
(Nessuno è obbligatorio)
Dusky, violaceous fingers typical of multiple system atrophy, due to
impaired neurovascular control (from Reich: Neurology, 60:719, 2003)
Valsalva maneuver
MSA: syncope on standing
(Iani et al, Epilepsia 37:690,96)
MSA: segno della croce
(degenerazione dei fasci discendenti)
(Riccioni Roberto, NMed, osservazione Colonnese)
1
2
3
4
(MSA segue)
(MSA segue)
Hot cross buns
Flair MRI in pMSA (“striatonigral degeneration”):
linear lateral putaminal hyperintensities
Axial T2 (A–B) and fluid attenuated inversion recovery (FLAIR) (C–D) MRI. The patient (A–C) has posterior/lateral putamen
hypointensity (iron deposition) (A–B). The patient’s FLAIR (C) shows linear lateral putamen hyperintensities (arrows), seen
better on FLAIR than on T2 (B), absent on FLAIR from an age-matched healthy control (D).
From: Block: Neurology, Volume 56(9).May 8, 2001.1200
Risonanza dell’encefalo e scintigrafia miocardica nella MSA
(da A. Antonini, JND 3: 5, 2007)
MSA: atrofia del cervelletto e del ponte
La atrofia sistemica multipla (MSA) non sempre
esordisce come un parkinsonismo
La modalità di esordio può essere:
- extrapiramidale
“degenerazione striato-nigrale”
-cerebellare
“atrofia olivo-ponto-cerebellare”
- autonomica
“m. di Shy-Drager”
L’esordio avviene fra i 35 e i 75 anni (media 55 a.); entro 5 anni vi è
una grave compromissione motoria o l’obbligo della carrozzella. La
morte sopravviene in media dopo 9-10 anni
La caratteristica istopatologica è la presenza di inclusioni gliali
citoplasmatiche (oligodendrociti)
Paralisi sopranucleare progressiva (PSP)
E’ una “taupatia”caratterizzata da
- esordio tardivo (fra 55 e 70 anni, in media 66 anni; mai prima dei 40 )
- s. parkinsoniana acinetico-rigida, simmetrica
- movimenti oculari saccadici rallentati, ipometrici e a lunga
latenza, prima per i verticali e poi per gli orizzontali
- postura estensoria del capo
- andatura a basi allargate e instabile
- instabilità posturale con frequenti cadute già nel primo anno
- demenza.
La morte sopravviene 5-6 anni dopo l’esordio.
La caratteristica istopatologica è degenerazione neurofibrillare taupositiva e perdita neuronale nei gangli della base e nel tronco
PSP:
atrofia del
Cervelletto
e del tronco
M. Maria
Teresa, PSP:
atrofia del
mesencefalo
M. Maria
Teresa, PSP:
atrofia del
mesencefalo
PSP: hummingbird and Mickey mouse signs
Figure 1 MRI of the brain in clinically definite PSP. (A) Sagittal T1-MRI through the brainstem demonstrating
volume loss in the midbrain with relative preservation of the pons. The upper border of the midbrain has lost
its normal convex appearance giving it the appearance of a hummingbird (or penguin) in side profile. (B) On
axial T1-weighted imaging, the dorsal midbrain is markedly reduced in volume giving rise to a "Mickey Mouse"
appearance (JNNP Practical Neurology 2007;7:186-190)
Degenerazione cortico-basale
E’una “taupatia”caratterizzata da
- esordio fra 45 e 75 anni, durata 3-12 anni
- ipocinesia con ipertono rigido asimmetrico
- distonia focale
- deficit sensitivo corticale
- aprassia con segno della “mano straniera”
- deterioramento cognitivo
- tremore d’azione
- mioclono
La caratteristica istopatologica è perdita neuronale,
gliosi e acromasia (neuroni rigonfi, che non si colorano
per la sostanza di Nissl) nella corteccia frontoparietale; filamenti di tau nei neuroni e nella glia
Degenerazione
cortico-basale
(T. Sandra,
Vol. 6,9)
Degenerazione
cortico-basale
(T. Sandra)
SINDROMI PARKINSONIANE:
ETA’ DI INSORGENZA
ESORDIO DELLA SINTOMATOLOGIA
EXTRAPIRAMIDALE
40
ATROFIA MULTISISTEMICA
45
50
55
PARALISI SOPRANUCLEARE
PROGRESSIVA
MSA
DEGENERAZ. CORTICO BASALE
60
65
M. PARKINSON.
IDIOPATICA
70
75
80
PSP
PARKINSON VASCOLARE
CBD
VPD
(modificata da S. Ruggieri)
DEMENZA A C. DI LEWY
I tremori
Quali tipi semeiologici di tremore?
- a riposo
- intenzionale
- posturale
- “task specific”
- distonico
Quali categorie eziologiche di tremore?
- essenziale (familiare, “senile”); il più frequente: 30 / 1000
- parkinsoniano
- cerebellare
- neuropatico
- rubrale (di Holmes)
- distonico
- ortostatico primario
- farmacologico (litio, antidepressivi,
simpaticomimetici , valproato)
- ipertiroideo
- fisiologico
- psicogeno
Tremore essenziale
D.F. Domenico (vol. 7,4)
prova con propranololo
Tremore essenziale
.
Il tremore essenziale (posturale e intenzionale,
spesso familiare, dominante), colpisce le mani (talora
in maniera asimmetrica), il capo e la voce mostra un
Dat-scan normale e non risponde alla l-dopa. Alcuni
pazienti sviluppano tardivamente segni cerebellari,
parkinsoniani o cognitivi.
Risponde scarsamente ai barbiturici (primidone e
fenobarbital) e ai betabloccanti (propranololo) ad
alcuni dei nuovi antiepilettici (topiramato,
gabapentin), all’alprazolam, , alla nimodipina.
Un bicchiere di vino all’inizio del pasto può essere
utile, in circostanze particolari
Le altre sindromi
ipercinetiche
Distonie
Sono costituite da contrazioni lente e sostenute di gruppi muscolari
specifici, che determinano movimenti torsionali, all’inizio intermittenti e
poi consolidati in posture abnormi. Possono sovrapporsi movimenti
alternati rapidi (tremore distonico).
Sono posti in relazione con un deficit dei meccanismi inibitori segmentali
(p. es, dell’inibizione reciproca) per sbilanciamento dei circuiti dei gangli
della base /(iperattività della “via diretta”).
Possono essere generalizzate, segmentali o focali.
Vi sono forme genetiche (gene DYT1, crom. 9q34, mutazione eterozigotica
della proteina TOR1 o TorsinaA), più frequenti negli ebrei Ashkenazi,
forme secondarie a malattie degenerative o metaboliche (p.e.
acantocitosi), forme tossiche (neurolettici, l-dopa), etc.
Le manifestazioni più frequenti sono il blefarospasmo, la distonia cervicale
(torcicollo), i crampi professionali.
Le forme localizzate vengono trattate con la tossina botulinica
Posizione distonica
della mano
Distonia:
mani e collo,
con gesto
antagonista
I tics (1)
Sono movimenti improvvisi e rapidi che riproducono in
maniera ripetitiva un gesto o un atteggiamento mimico.
il movimento è naturale, imitabile e parzialmente
controllabile dalla volontà.
Sono preceduti e accompagnati da un vissuto
spiacevole di coazione.
Sono frequenti nell’adolescenza, con andamento
ricorrente. Possono consolidarsi, divenendo un
caratteristica gestuale del soggetto.
Farmaci utili sono aloperidolo, pimozide, tiapride,
risperidone, clozapina, pergolide, clonidina
I tics (2)
La malattia di Gilles de la Tourette, dominante e a penetranza
incompleta, inizia prima dei 15 anni. E’ caratterizzata da tics
multipli, che si arricchiscono e si susseguono con sempre nuove
componenti. Il repertorio è inesauribile, con tendenza a ritorni
ciclici.
Si associano vocalizzazioni, che in un terzo dei casi consistono
nella emissione di parole sconce (coprolalia), associate a gesti
volgari (coproprassia).
Compaiono inoltre comportamenti o meccanismi mentali di tipo
ossessivo (toccare, contare, ripensare, etc.
I disturbi si accentuano con le emozioni, mentre si attenuano
durante attività motorie complesse (danzare, guidare, etc)
Sintomatologia extrapiramidale e emozioni
Caratteristica dei sintomi extrapiramidali è il
peggioramento dei disturbi con il carico emotivo.
Il fenomeno è evidente soprattutto per le
ipercinesie (tremore, tics, discinesie), ma si
osserva anche per il “freezing”. Altre volte forti
emozioni liberano comportamenti motori
inaspettati.
Il legame è assicurato dalle connessioni fra il
lobo limbico e lo striato
Patologie ereditarie dei gangli
della base
Malattia di Huntington
E’ una malattia genetica autosomica dominante dovuta alla
ripetizione (> di 39 volte) della tripletta CAG (citosina-adenosinaguanina), gene IT15, cromosoma 4. Mostra atrofia della corteccia e
dello striato.
Si manifesta con disturbi psichiatrici, deterioramento cognitivo,
ipotonia, movimenti coreici.
L’esordio è in età adulta e l’andamento è progressivo. Nella fase
preclinica è presente un deficit di riconoscimento delle emozioni
negative (ira, disgusto, paura, tristezza)*
La diagnosi è confermata dalla atrofia dello striato nelle
neuroimmagini e dal test genetico. Non vi sono terapie
* (Johnson et al, Brain 130:1733,2007)
Corea di Huntigton
Soggetto normale
TC (7-5-86)
T. Antonia,
Corea di Huntington
(atrofia della testa
del caudato)
Malattia di Wilson
E’ una malattia genetica autosomica recessiva dovuta ad una
alterazione del metabolismo del rame. Vi è ridotto tasso
plasmatico di ceruloplasmina (la proteina che trasporta il rame),
ridotta escrezione biliare con aumento della escrezione urinaria di
rame, aminoaciduria, accumulo di rame nei tessuti.
Si manifesta in età giovanile con deterioramento cognitivo, psicosi,
distonia, “tremore a battito d’ali”, cirrosi epatica. Attorno alla
cornea l’anello verdastro di Kayser-Fleischer. Il fegato mostra ,
già in fase preneurologica, una cirrosi macronodulare
Nella fase “neurologica” compaiono lesioni strutturali dei gangli
della base.
Si cura con dieta (niente crostacei, fegato, cacao, frutta
secca…), penicillamina, tetramolibdato di ammonio
Pose ginniche
L. Francesca
m. di Wilson
Il sorriso
L. Francesca
m. di Wilson
TC: ipodensità
dei gangli della base
L. Francesca (vol.7, 4)
m. di Wilson
Risonanza magnetica
L. Francesca
m. di Wilson
Anello di Kayser-Fleischer: l’anello bruno-dorato alla periferia
delle cornee dei due occhi risalta sul colore grigio -blu delle iridi
(da Finelli, Neurology 45: 1261, 1995)
Kayser-Fleischer corneal ring in Wilson disease
A. Marked Kayser-Fleischer corneal ring superiorly and inferiorly. B. Same eye 12 years after
successful treatment with d-penicillamine. Note marked regression of the ring, which has
virtually disappeared inferiorly. Two unrelated small iris nevi at 4.00 and 7.30 (arrowheads)
(From Heckmann et al., Neurology 55: 280, 2000)












