Immunologia Oveview e fagocitosi
riferimenti
____
Overview
____
PROF DIELI
March 12, 2012
• [email protected]
• unipa.it/DOTTIMMUNOFARMACOLOGIA
• 091/655-591/5902/5900
• 2 prove in itinere: 15/06 18/07 12/09 24/09 20/12 17/01
• 30 risposta muiltipla, 1 risposta aperta
• 3/4 maggio I prova in itinere
• 5/6 giugno II prova in itinere
• testi consigliato: (in ordine di prezzo)
• patologia generale - pontieri russo frati
• immunologia male brostoff roth
• immunologia cellulare e molecolare abbas lichtman
• kuby immunologia goldsby kindt
• immunologia partham
• www.nature reviews in immunology
• htto://www.nature.com/nri
____
• antigene: sono sostanze verso cui la risposta immunitaria è rivolta. è riconosciuto dall'anticorpo;
è una molecola di qualsiasi natura che è riconosciuta dai recettori dei linfociti B o T. può essere
self: in condizioni di patologie autoimmunitarie la risposta immunitaria è rivolta verso sostanze
proprie dell'organismo. ; esistono antigeni nella capsula di alcuni batteri che non sono in grado di
indurre risposte immunitarie da soli.
• immunogeno: sostanza che se somministrata induce una risposta immunitaria.
• epitopo: porzione dell'antigene che interagisce con BCR TCR
• Immunogenicità: estraneità, peso molecolare (tanto piu è elevato, tanto più è immunogenica),
complessità chimica (maggiore complessità, maggiore immunogenicità), degradabilità (velocità di
degradazione, è immunogenica se è poco degradabile), dose e via di somministrazione
(fondamentale affinchè questa molecola sia immunogenica. Esempio: non tutte le vie di
somministrazione di molecole inducono risposte immunitarie: la via endovenosa non induce
risposta immunitaria. funzionano meglio via intramuscolare e intradermica. Dosi molto basse o
molto elevate di molecole estranee non inducono risposta immunitaria, ma inducono l'individuo
ad abituarsi alla molecola e a tollerarla. una dose intermedia è una dose che può causare
immunogenesi, quindi è difficile trovare la giusta quantità affinchè si smuova il sistema
immunitario. Esempio: ogni giorno veniamo a contatto con molti germi,virus e batteri, ma la
concentrazione è troppo bassa per indurre risposta immunitaria).
• esempi di strutture antigeniche: possono contenere singoli o multipli epitopi.
• Aptene , molto semplice a livello di struttura chimica; PM 150-200 Da= sostanza antigenica ma
non immunogenica. per scatenare la risposta bisogna collegarlo ad un carrier affinchè sia
riconosciuto.
• Polisaccaridi: costituiti da uno stesso antigene che si ripette piu volte nella molecola; i
lipopolisaccaridi sono contenuti in pareti cellulari, che inducono risposta immunitaria, ma non
possono creare una memoria immunologica.
• Proteine: i migliori immunogenetici in natura: PM elevato, complessa a livello chimico, e
rispecchia le caratteristiche dell'immunogenicità. gli antigeni presenti nelle proteine non risultano
necessariamente dalla struttura primaria, ma l'antigene è frutto della composizione terziaria.
l'antigene proteico può essere lineare (sequenza di amminoacidi in successione riconosciuti come
antigene, una proteina può avere più strutture riconosciute come antigene); oppure può essere
conformazionale (l'antigene strutturale è riconosciuto dall'anticorpo nella forma di legami S-S
(l'epitopo è il legame S-S) , cioè dalla conformazione che assume la molecola nello spazio, non dalla
sequenza amminoacidica.)
• anticorpi monoclonali: anticorpi somministrati per il riconoscimento di particolari molecole
prodotte da agenti tumorali o patogeni; quindi riconosce selettivamente le molecole "maligne"
salvando le cellule e le molecole sane. l'anticorpo monoclonale si crea in laboratorio e si costruisce
in maniera tale che riconosca una particolare molecola. per costruire un anticorpo monoclonale
bisogna conoscere l'antigene che si vuole eliminare.
____
1
caratteristiche di
immunità innata
ed acquisita
____
vie di penetrazione
dei microrganismi
____
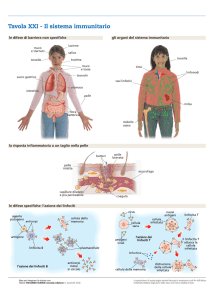
• Immunità: i romani definivano immuni gli evasori fiscali, che erano immuni alle tasse -.• immunità Innata: presente fin dalla nascita, non specifica, rapida, assenza i memoria; è composta
da barriere naturali (cute; mucose: la mucosa delle vie respiratorie è ciliata, che muovendosi e
secernendo mucina che produce muco, intrappolano i microrganismi, e attraverso vari meccanismi
vengono espulsi; la mucosa dello stomaco, che crea un ambiente acido che non favorisce la vita dei
microrganismi; la saliva, le lacrime, secrezioni nasali; barriere chimiche del sangue come il
lisozima), fagociti, mediatori solubili (complemento: proteine presenti in forma inattiva del
sangue, che dopo la l'attivazione della prima, questa attiva le proteine simili a cascata inducendo
l'eliminazione del microrganismo estraneo; nel sangue sono presenti anche le defensine), recettori
per profili molecolari (questi recettori che si trovano sui fagociti o simili; hanno come ligandi dei
substrati che fanno tipicamente parte di componenti estranee, Es.: mannosio si trova nella parete
batterica, viene riconosciuto, fagocitato, eliminato; lipopolisaccaride si trova su tutti i gram
negatici, e assente su cellule self, quindi il fagocita riconosce il batterio riuscendo a distinguerlo da
una cellula self.) questi recettori non sono clonalmente distribuiti
• immunità Acquisita: questo tipo di immunità deriva da una risposta che viene acquisita in seguito
a interazione con l'antigene, è quindi antigene-specifica, lenta (giorni), memoria; è composta da
linfociti, BCR (recettore delle cellule b) TCR (recettore dei linfociti T) e molecole solubili
(anticorpi); ogni cellula ha un recettore che ha una singola specificità antigenica = un linfocita- un
recettore-un antigene: per questo i recettori dei linfociti vengono detti clonalmente distribuiti
• NB: memoria e specificità vanno di pari passo.
• Vaccino: servono ad indurre una risposta immunitaria che ci proteggera per tutta la durata della
vita ( non sempre dura tutta la vita, bisognano particolari circostanze) nei confronti di specifici
antigeni. se utilizzo una molecola di antigene A per crearne la memoria immunogenetica
attraverso un vaccino, il corpo non avrà memoria per molecole di antigene B.
• memoria immunologica: in seguito all'interazione con un antigene, si crea una memoria
antigenica: questa memoria serve a velocizzare la risposta nel momento in cui si ripresenti lo
stesso antigene, offrendo una risposta immunitaria più efficiente. la memoria immunologia è
migliore nei confronti di antigeni recenti o passati se particolarmente intensi; per crearsi ha
bisogno di tempo (2-3 settimane prima di attivarsi).
• antitetanica: nonostante si sia stati vaccinati nei confronti del tetano, e quindi dovremmo
possedere anticorpi contro la tossina del tetano, l'antitetanica(che non è altro che anticorpi contro
la tossina del tetano) viene somministrata perchè la memoria indotta dalla vaccinazione può non
durare o affievolirsi, a causa di alcune condizioni particolari.
• recettori clonalmente distribuiti: si fa riferimento al clone in quanto un clone è un derivato
identico da una singola cellula. se una cellula viene stimolata da un antigene, acquisisce proprietà
immunogeniche che prima non aveva. tutte le cellule che derivano per mitosi da quella cellula che
per prima ha riconosciuto l'antigene avranno già acquisita la proprietà recettoriale di riconoscere
lo stesso antigene più velocemente. i fagociti non hanno recettori clonalmente distribuiti perchè i
recettori che possiede sono generici, che non vengono a crearsi o modificarsi in seguito
all'interazione con particolari ligandi, ma che sono sintetizzati dalla nascita e presenti su dei
fagociti stessi.
____
• penetrano prevalentemente attraverso le vie delle mucose o degli epiteli.
• un microrganismo puo infettare un individuo attraverso le vie aeree, inalando delle spore o delle
goccioline. questo si verifica quando si è in un ambiente chiuso e si sta a stretto contatto con delle
fonti aeree di microrganismi. alcune malattie infettive che sono tipiche del periodo invernale
hanno un contagio favorito perchè in inverno si sta piu spesso al chiuso.
• l'infezione attraverso la via gastrointestinale è una misura di infezione tipica dei paesi poco
sviluppati, e queste infezioni si verificano in seguito all'ingerimento di acqua inquinata.
• l'infezione può trasmettersi le vie sessuali.
• l'infezione attraverso la cute, se è integra è molto raro. ma la cute non è mai integra. lesioni
minuscole della cute favoriscono lo scaturire di infezioni. esempio: abrasioni (antrace), ferite
(tetano), contatto con animali o morsi di insetti (zanzare zecche - Malaria e malattia di lime. zecca
morde il cervio, succhia agente eziologico e nel morso successivo infetta il nuovo ospite).
• la flora batterica è una via di sbarramento delle infezioni. induce la produzione di citochine che
mantengono l'omeostasi del tratto genitale femminile e gastrointestinale
____
2
fagocitosi
____
• capacità di alcune cellule di riconoscere un agente estraneo, o segnale di pericolo, tramite
recettori per profili molecolari, capacità di legarlo, di internalizzarlo e di eliminarlo. nella
fagocitosi è possibile riconoscere certe fasi:
• (migrazione) riconoscimento; FAGOCITOSI; uccisione del microrganismo.
• la fagocitosi è operata dai granulociti macrofagi e dai monociti polimorfonucleati; i monociti
si trovano nel sangue, e per poter fagocitare un microrganismo entrato attraverso la cute e
depositato nel connettivo, il fagocita deve prima MIGRARE dalla sua sede nel sangue fino al luogo
dell'infezione.
____
3
migrazione
____
• come fa a capire il fagocita la direzione verso cui deve migrare?
• ESISTONO DELLE CELLULE che si trovano a livello dei tessuti, e non solo al livello del
sangue.monocita=se circola nel sangue; macrofago= se è nei tessuti; ma si tratta della stessa cellula.
il nostro organismo ha la caratteristica di disporre di macrofagi in diversi tessuti. vengono
chiamati con nomi differenti in base alla loro sede anatomica: SNC= microglia; fegato=cellule di
******.
• i macrofagi residenti nei tessuti, nel momento dell'infezione, iniziano a produrre citochine e
chemiochine (mediatori chimici) responsabili del richiamo e del reclutamento orientato dei
monociti macrofagi. le cellule residenti nei tessuti sono quindi i primi a dare l'allarme richiamando
altre cellule con la loro attivazione.
• chemiochine= citochine con funzione di far migrare in maniera orientata alcune cellule. è una
migrazione che avviene "contro gradiente di concentrazione": dal punto in cui la concentrazione
di chemiochine è minore al punto in cui la concentrazione di chemiochine è maggiore. questo
fenomeno mediato dalle chemiochine è detto chemiotassi.
• il fagocita si trova quindi nel vaso, e deve migrare in un tessuto. la fuoriuscita dal vaso è un
fenomeno complicato, che avviene attraverso tappe sequenziali che comprendono l'interazione tra
endotelio vascolare e cellula stessa. normalmente un leucocita prende contatto con le cellule
endoteliali attraverso due molecole: 1 espressa dall'endotelio: e-selectina; e i glicolipidi sul
leucocita. questo legame tra queste due molecole è debole. il legame con la e-selectina è subito
interrottoa causa di molte ragioni (rotolamento fisiologico del leucocita), che lo spinge avanti,
dove può avere un altro legame debole con un altra e-selectina, e così via. questo processo è detto
ROLLING, e comprende: interazione, distacco, flusso, interazione, distacco, flusso etc...
• il leucocita per uscire dal vaso deve fermarsi e legare saldamente all'endotelio. il leucocita si
arresta al livello della cellule endoteliali prossime alla sede di infezione. qui intervengono le cito e
le chemiochine. queste molecole prodotte in sede di infiammazione permettono l'arresto del
leucocita attraverso legami piu stabili.
• le citochine inducono l'espressione di alcune MOLECOLE DI ADESIONE, che inducono
all'espressione di tali molecole da parte dell'endotelio. queste molecole sono indicate come icam,
(intercellular adhesion molecules) e vcam. queste molecole legano a livello del leucocita delle
molecole dette INTEGRINE in maniera debole.
• quindi: ROLLING MEDIATO DA E-SELECTINA E GLICOLIPIDI, ADESIONE MEDIATA DA
MOLECOLE DI ADESIONE ICAM E INTEGRINE
• l'affinità di legame tra icam e integrine è molto bassa, occorre quindi che accada qualcosa
affinchè aumenti l'affinità di legame e non si verifichi di nuovo il rotolamento ( che allontanerebbe
il leucocita)
• questo ruolo di evitare il rotolamento è svolto dalle chemiochine. i leucociti hanno dei recettori
per le chemiochine; queste, legandosi ai recettori dei leucociti, agiscono aumentando l'affinità
delle integrine del leucocita per le icam: si realizza quindi una reazione stabile che provoca
l'arresto del leucocita che non rotola più.
• tra le integrine, una delle piu importanti è la LFA1. una malattia da immunodeficienza, dovuta al
gene che esprime in maniera errata questa proteina.
• una volta arrestato, il leucocita deve attraversare l'endotelio vascolare: come?
• DIAPEDESI. il leucocita modifica la sua conformazione, e si insinua tra due cellule endoteliali
grazie alla formazione di uno pseudopodio; la condizione essenziale per il passaggio di un leucocita
attraverso il vaso è che le cellule endotelali siano separate (normalmente sono strettamente adese):
affinchè avvenga deve esserci un aumento della permeabilità vascolare; i mediatori dell'aumento
della permeabilità vascolare sono le citochine, che inducono il distaccamento di due endociti
adiacenti.
• una volta uscito dal vaso il leucocita si ritrova a contatto con il tessuto connettivo, e per muoversi
all'interno di esso per raggiungere la sede di infezione deve superare una trama molto fitta di
materiale extracellulare e condrociti. deve quindi degradare la matrice connettivale, grazie a degli
enzimi litici (metallo proteasi e collagenasi), per attraversarla fino al rarriungimento della sede di
infezione guidato dalla chemiotassi.
• tutte le azioni biologiche del fagocita, che vanno dall'espressione di molecole di membrana, dal loro
cambiamento di forma, all'acquisizione della capacità di movimento, alla formazioni di enzimi litici sono tutte
innescate da reazioni date interazioni tra citochine e/o chemiochine con i ligandi di membrana del leucocita
stesso.
____
4
riconoscimento
____
internalizzazione
(fagocitosi)
____
• il riconoscimento avviene grazie a recettori per profili molecolari non clonalmente distribuit(i i
TLR sono esposti sulla superficie di tutti i macrofagi), detti recettori Toll-Like (TLR) - i recettori toll
erano stati trovati nella drosophila (zzappagghione)
• .questi recettori rispettano il self, e riconoscono strutture tipiche di entità non self. i recettori
toll-like sono 9-10, nell'uomo, ed alcuni sono espressi come catena singola, altri come dimeri.
• ad esempio: tlr1 si trova espresso insieme a tlr2
• il primo scoperto TLR4, riconosce lipopolisaccaride batterico (tipico dei gram negativi)
• il TLR9 riconosce DNA ricco di isole di citosina e guanina, presenti generalmente nel DNA di molti
virus e batteri, e quasi assenti in quello umano
• TLR3 lega rna a doppia elica
• i recettori tlr dopo aver legato il ligando, cambiano di conformazione sul versante interno,e
riescono a prendere contatto con proteine chinasi inducendo una cascata di reazioni di
trasduzione del segnale, che arriva fino al nucleo. questa trasduzione dal punto di vista pratico
induce la modulazione delle molecole espresse sulla membrana (il leucocita esprime molecole solo
utili), e tutti gli alti fenomeni della fagocitosi (internalizzazione, lisi del microrganismo), e altre
cose, tra cui il ripristino dei tessuti danneggiati sia dal passaggio del leucocita stesso (con
produzione di fattori di crescita) sia dall'antigene.
• la porzione intracitoplasmatica del tlr deve essere tale da poter permettere il contatto con
proteine chinasi.purtroppo però le porzioni intracitoplasmatiche sono corte, e quindi per far si che
avvenga questa interazione tra le code dei tlr e le chinasi sono necessari delle proteine mediatrici,
dette adattatori: CD14, CD36 ect...
• alcuni recettori tlr sono espressi intracitoplasmaticamente (tlr 3,7,8,9) in alcuni endosomi.
questi recettori sono importanti per le infezioni intracellulari: virus (organismi intracellulari
obbligati).
• altri recettori che fungono da sensori intracitoplasmatici sono RIG1 (riconosce dna virale) NOD2
(sensori del citosol, che sembrano implicati anche in parecchi fenomeni autoimmunitari, lega in
genere peptidoglicani batterici.
• N.B.: non tutti i recettori, sia tlr che altri, NON SEMPRE SONO ESPRESSI SULLA MEMBRANA, possono anche
essere presenti all'interno della cellula: le cellule attraverso la macropinocitosi e la micropinocitosi
possono internalizzare molecole attraverso una "fagocitosi generalizzata", e quindi, se si trovano
microrganismi all'interno, devono essere in grado di riconoscerlo attraverso recettori intracellulari.
• altri recettori per profili molecolari : CD4 (nei macrofagi per il virus HIV); recettore per il
mannosio [molti batteri sono mannosilati]; DC-SIGN (dc, perchè scoperto all'inizio sulle cellule
dendritiche, è una variante del recettore del mannosio, ed è specifico per 3-4 patogeni: virus HIV,
micobatterio TCB e il elicobacter pilori (ulcera) e forse virus dell'epatite.sembra che dc-sign lega
dei carboidrati presenti su quiegli antigeni. in sintesi dc-sign è importante per la specificità con cui
lega quegli antigeni )
• i legami con i recettori del fagocita, inducono l'attivazione all'interno del fagocita di
meccanismi per l'uccisione del microrganismo, attraverso la produzione di specie contenenti
ossigeno reattivo (ROS), radicali dell'ossigeno e ossido nitrico; al contempo inducono anche la
produzione di altre citochine(TNF tumor necrosys factor, interleuchina 1 e 12) che potenziano il
processo infiammatorio soprattutto a livello dell'endotelio, dove inducono espressione di
proteine per l'arresto del leucocita ed un aumento della permeabilità del vaso.
• vengono prodotti, in seguito a legame con i recettori, anche fattori di crescita per i fibroblasti,
fattori angiogenetici e metalloproteinasi per il rimodellamento della matrice extracellulare
danneggiata.
____
• nel sito in cui un ligando lega il microrganismo, la membrana si invagina circondando il
microrganismo.
• successiva formazione di una vescicola con il microrganismo al suo interno. questa vescicola con
il microrganismo all'interno viene detta fagosoma.
• il fagosoma deve passare attraverso due eventi: maturazione del fagosoma e fusione tra
fagosoma e lisosoma.
• se non si verificano queste condizioni, specialmente la prima, non vi è possibilità di uccidere il
microrganismo.
• gran parte dei microrganismo che riescono a sopravvivere all'internalizzazione ci riescono
proprio perchè ostacolano una di queste due fasi (leishmanie, TCB).
____
5
maturazione del
fagosoma
____
processo di
internalizzazione
____
• è necessaria un acidificazione del ph all'interno del fagosoma. questo ph piu acido induce un
attivazione degli enzimi (che lavorano a ph acido: idrogenasi, prolasi collagenasi etc..); per questa
acidificazione è necessaria una pompa atp-dipendente.
• all'interno del fagosoma deve essere portato ferro: trasportatore per il ferro, e transferrina.
senza il ferro il fagosoma non può maturare.(sembra sia un componente essenziale di alcune
GTP-asi)
• rimozione dalla membrada del fagosoma della proteina TACO.
• TACO = proteina che ricopre ricca di aspartato. si trova sul versante interno della membrana
cellulare. quando si forma un fagosoma per endocitosi, taco rimane sulla membrana esterna del
fagosoma. quando taco è sulla membrana del fagosoma non vi può essere la fusione tra fagosoma e
lisosoma. RAB7 (GTP-asi) è adibita alla rimozione di taco e alla conseguente promozione della
fusione tra fagosoma e lisosoma.
• le GTP-asi ,anche della famiglia rab, possono avere funzioni che sono contrastanti fra loro stesse.
membri della stessa famiglia possono avere azioni inverse: uno stesso batterio, legandosi ad un
recettore può innescare due gtp-asi, una che promuove l'uccisione, e una che ne contrasta
l'uccisione.
• rab14 è una proteina che si trova nel citosol e deve esservi trattenuta perchè ha la tendenza di
posizionarsi sulla membrana del fagosoma, impedendone la fusione con il lisosoma. quindi
qualcosa deve trattenerla nel citosol. AS160 è la proteina deputata a controllare che rab14 non
sfugga dal citoplasma e si vada a posizionare sul fagosoma.
• alcuni batteri fosforilano, attraverso la produzione di fosfoinositobi-trifosfato, AS160, in maniera
che non possa più controllare rab14. a questo punto rab14 si mette sul fagosoma, impedendone la
fusione con il lisosoma
• a seconda della gtp-asi che si attiva può essere promossa (IRGM1, che è anche attivata dai linfociti
T) o ostacolata (inibizioneda parte del microrganismo di as160) la fusione tra fagosoma e lisosoma.
cosa accade in natura?
• quando un micobatterio viene fagocitato, all'interno del macrofaco può crescere, perchè blocca i
processi di lisi. il macrofago deve essere potenziato dai linfociti nei suoi meccanismi citotossici=
produzione di radicali dell'ossigeno (piu potente battericida conosciuto, per produrre i radicali
dell'ossigeno hanno bisogno dell'enzima NADPH OSSIDASI), produzione di radicali dell'azoto
(indotto dall'ossido nitrico sintasi utilizzando ossigeno molecolare e l'azoto della citrullina o
dell'arginina), enzimi che funzionano in ambiente acido, presenza di defensine (peptidi
antibatteriche, presenti anche su cellule epiteliali).
• l'ossidasi fagocitica è localizzata sulla membrana del lisosoma, ed è un enzima la cui attivazione
dipende dal ph; il fenomeno di citotossicità è caratterizzato da due fasi, che coincidono con la
maturazione del fagosoma e la fusione di questo con il lisosoma. queste due fasi sono dette
perossidasi dipendente o indipendete.
• questi meccanismi possono essere categorizzati per efficienza: il più importante è la produzione
di radicali dell'ossigeno perchè, a causa dell'essenzialità della nadph ossidasi, un'eventuale
mutazione di questa può portare a gravi situazioni di immunodeficienza.
• ogni punto di questa fase può essere ostacolato da microrganismi, che impediscono così che possa
avvenire il processo di degradazione.
____
• il golgi ed il r.e. attraverso una serie di sensori riescono a sostituire lka parte di membrana che è
stata usata per creare il fagosoma.
• nel citosol abbiamo dei sensori per il calcio; vi sono delle vescicole derivanti sia dal golgi (NCS1
sensore neuronale del calcio) che dai lisosomi (sinaptotagmina). queste vescicole presentano
recettori per il calcio che sono NCS1 e sinaptotagmina.
• dopo la formazione del fagosoma la permeabilità di membrana si modificav e avviene l'ingresso di
ioni calcio.
• queste vescicole presentano recettori per il calcio sulle loro pareti e sono NCS1 e sinaptotagmina
• questi sensori attivati dal calcio si mobilizzano e si portano sulla membrana, in maniera che ogni
apparato membranoso (dei due apparati considerati) andrà a donare una porzione di membrana
per ricostituire la membrana cellulare.
• questo meccanismo è stato dimostrato nel novembre 2010
____
6
Immunologia - Cellula Dendritica e Linfociti
cellule
emopoietiche
____
teorie di
differenziazione di
una cellula
staminale
____
cellula dendritica
____
PROF DIELI
April 22, 2012
• tutte derivano da un unico precursore che ha sede nel midollo osso. da questa derivano cellule
linfoidi, mieloidi (granulociti e monociti/macrofagi), cellule dendritiche, eritroidi megacariocitari
(globuli rossi, e piastrine e elementi anucleati ).
____
• ipotesi a: una cellula staminale non differenzia direttamente in una cellula matura, ma si orienta
verso un precursore, linfoide o mieloide.
• ipotesi b: non vi è bisogno di precursori intermedi, ma una staminale a seconda dello stimolon
che riceve nel midollo può diffderenziare in qualsiasi cellula senza passare attraverso precursori
• ipotesi c: la cellula staminale è programmata. questo programma prevede che essa possa
differenziarsi solo verso una sede: diventare megacariocita. SE non riuscisse ad attuare questo
programma, opterebbe per un programma alternativo che la porterebbe ad una differenziazione
linfoide o mieloide.
• teoria differienziativa natural immunology: la staminale si differenzia in un precursore
mieloide comune per cellule linfoidi e mieloidi, ed un precursore comune che differenzi in
senso eritrocitico e megacariocitico.
• fino ai 44-45 anni il pool di staminali rimane costante. perche ogni volta che una cellula staminale
differenzia fa nascere una cellula differenziata ed un'altra cellula staminale.
• teoria dell'omeostaticità: nelle cellule staminali il concorso di due eventi opposti contribuisce al
mantenimento del numero di staminali standard; avviene una divisione asimmetrica che da origine
ad una cellula differenziata ed una staminale che ristabilisce il pool.
____
• nel 1979 vengono trovate da Steiman delle cellule non identificabili ne con i monociti ne con i
granulociti. fino agli anni 80 le sue ricerce non vengono riconosciute dall'opinione medica
pubblica.
• queste sono le cellule dendritiche.
• utilizzò cellule dendritiche per curarsi dal tumore al pancreas, questo gli permise di vivere quasi
4 anni rispetto ai tre mesi di vita che questo tumore garantisce.
• sono cellule chiamate così per il loro criterio morfologico(dendriti: estroflessioni, interdigitazioni
del citoplasma). queste cellule sono di derivazione mieloide, ma sono posizionate nella periferia
dell'organismo.
• la periferia del nostro organismo è la cute le mucose.
• le cellule di langerhans sono delle cellule dendritiche
• cosa fanno le cellule di langerhans? presentano antigeni ai linfociti T, respondabili della risposta
immune specifica.
• mentre la cellula dendritica si trova in periferia, il linfocita T si trova nel linfonodo, nella
regione paracorticale di questo. se la cellula dendritica vuole presentare un antigene ad un
linfocita devono incontrarsi da qualche parte. si è ipotizzato che la cellula dendritica, riconosciuto
l'antigene, migrando raggiunge la zona paracorticale del linfonodo.
• la cellula migra e si va a posizionare nella zona paracorticale del linfonodo. questa migrazione
avviene per chemiotassi, cioè è mediata da una o piu chemiochine.
• dato che la chemiotassi avviene contro gradiente, il fatto che la cellula si posizioni alla fine nella
parte corticale ci dice che la chemiochina è posizionata nella parte paracorticale del linfonodo.
• dato che anche il linfocita vergine, appena creato viene attratto grazie a chemiochine nella parte
paracorticale, è evidente che la chemiochina è la stessa sia per la cellula dendritica che per la
chemiochina.
• quindi la cellula dendritica esprime lo stesso recettore per una citochina espresso da un linfocita
T.
____
1
maturazione e
migrazione
____
• la cellula dendritica in periferia riconosce un antigene, lo lega attraverso recettori per profili
molecolari, e attraverso il vaso linfatico afferente raggiunge la regione paracorticale del
linfonodo, andrà a riconscere ed attivare il linfocita presentandogli l'antigene.
• in seguito ad attivazione dall'antigene, la cellula dendritica acquisisce mobilità. però ha anche
una perdita di capacità funzionali:
• durante la migrazione, nel linfonodo perde la capacità di riconoscere un antigene, per acquisire la
proprietà di riuscire ad attivare il linfocita t nella maniera piu appropriata possibile.
• quindi durante questa migrazione si ha un vcambiamento di molecole di membrana: questo
meccanismo prende il nome di maturazione della cellula dendritica.
• cellula dendritica immatura: posizionata in periferia;
• cellulla dendritica matura: ha già legato l'antigene e si trova nella regione paracorticale in attesa
del linfonodo.
• in una cellula perfettamente matura, il processo di maturazione appena accennato è riferibile a
cambiamenti di aspetti funzionali, che acquisiscono capacità diverse, già insite nella cellula
maturata.
• questa maturazione in cosa consiste? e da cosa è innescata?
• la funzione è innescata da una interazione di un antigene con un recettore per profili molecolari
(TLR, recettore per il mannosio, DC-sign, recettori spazzino, ect...)
• l'interazione ligando recettore innesca nella cellula dendritica il processo detto maturazione,
composto da varie fasi e particolarità:
• una volta che ha internalizzato il microrganismo inizia ad attivare il citoscheletro per
acquisire motilità, per andare verso il linfonodo (la cellula è guidata per chemiotassi);
• la cellula dendritica quindi, per essere guidata nella giusta direzione ha bisogno di un recettore
per le chemiochine. questo recettore viene sintetizzato ed esposto solo quando avviene il legame
con l'antigene (altrimenti la cellula sarebbe soggetta alle chemiochine senza aver legato nulla, e
inizierebbe in vano la migrazione). il recettore detto è chiamato ccr7, e lega due chemiochine che
sono CCL9 e CCL21
• un altro aspetto della maturazione è che una volta che è stato iniziato il processo di fagocitosi ed
è iniziata la migrazione, la cellula dendritica non ha più motivo di mantenere proteine con
funzione di recettori per profili molecolari, che non vengono più esposte od espresse. MA al
contempo ha necessità di esprimerne altre per l'interazione con il linfocita t
• la capacità di stimolare un linfocita t dipende dall'incrementata espressione di molecole fondamentali di
membrana, queste molecole sono dette MHC2 complesso maggiore di istocompatibilità di classe2
• le mhc1 sono espresse ubiquitariamente su tutte le cellule linfoidi, le mhc2 sono espresse nelle
cellule con funzione di presentare l'antigene a linfocita t
• le cellule dendritiche espongono poche mhc1, e molte mhc2
• ciò che il linfocita riconosce non è l'interno organismo, ma una piccola parte di esso di natura
proteica, e per conoscerlo ha bisogno che il microrganismo sia associato ad un mhc2 sulla parete
della cellula dendritica.
• quando parliamo di riconoscimento antigenico di linfocita t parliamo di questa proprietà del
linfocita stesso
• il riconoscimento e l'internalizzazione di un antigene nella cellula dendritica è seguito da un
processamento dell'antigene: digerirlo, estrapolarne proteine, da queste generare piccoli frammenti
peptidici, e legarli al mhc2 ed esprimere il complesso sulla membrana.
• il linfocita t alla fine riconosce un piccolo pezzettino di pochi amminoacidi legati al mhc2 esposti
sulla membrana (condizione necessaria ma non sufficiente all'attivazione del linfocita t).
• la cellula dendritica deve esprimere oltre mhc2 sulla membrana anche delle molecole con
funzioni costimolatorie (CD 40, CD80 e CD86) che devono legare anche esse il linfocita T,
inducendo un secondo stimolo al riconoscimento.
• per completare il processo di maturazione la cellula dendritica deve acquisira la prorietà di
produzione di citochine. queste citochine determineranno, a seconda della loro natura prodotta,
il tipo e/o anche l'entità della risposta inducendo una "maturazione" del linfocita T verso una
determinata strada di risposta immuntiaria :il linfocita matura nel timo, in seguito a presentazione
dell'antigene da parte della cellula dendritica tramite MHC2, imparando a riconscere un antigene
in altre cellule dell'organismo solo sotto forma di PEPTIDE ASSOCIATO ALL' MHC1: mai sei il
peptide è dissociato, o l'MHC1 non presenta peptidi all'interno
____
2
cellule stromali,
migrazione e
attivazione del
linfocita t
____
• per migrare il linfocita t ha innanzi tutto necessità di legarsi, attraverso ad una l-selectina che
lega un oligosaccaride esposto dalle cellule delle venule dell'endotelio alto; questo processo
avviene affinchè possa attraversarlo con lo stesso procedimento con cui i fagociti migrano tra due
cellule endoteliali nella loro migrazione.
• il linfocita t vergine che è partito dal timo ed è arrivato alla paracorticale è mantenuto in vita
dalle cellule stromali del linfonodo grazie alla loro produzione di INTERLEUCHINA 7
• le cellule stromali quindi assumono un ruolo attivo, diverso da quello che per tempo si è
ipotizzato; infatti la produzione di chemiochine ed interleuchine è essenziale per l'attrazione di
linfociti e cellule dendritiche, e per la sopravvivenza del linfocita in quella sede.
• le cellule stromali sono essenziali per il mantenimento della memoria immunologica
• affinchè un linfocita t si leghi ad una cellula dendritica in maniera appropriata devono avvenire
una serie di interazioni, riassumibili in due generali interazioni:
• interazione tra mhc2 e il corrispettivo recettore dei linfociti t (segnale necessario ma non
sufficiente)
• interazione costimolatorio (o secondo segnale) tra CD80 e CD86 della cellula dendritica con
il recettore CD28 espresso dal linfocita T; questo è il segnale stimolatorio più importante.
• l'interazione di cd86 con cd28, in seguito all'attivazione del linfocita che si trovava vergine nel
linfonodo, ha la funzione di stabilizzare il dna messaggero del linfocita T per l'interleuchina 2 e
per il recettore della stessa interleuchina: cioè si evita che venga degradato, ed il segnale di questi
rna messaggeri divengono stabili nel tempo, per un tempo sufficientemente lungo affinchè il
linfocita prolifichi. quindi il linfocita dopo il legame sintetizza, grazie all'allungata emivita del
mRNA, sia la citochina stessa che il recettore per la citochina.
• il linfocita t inizia a produrre interleuchina 2, che gli serve per proliferare.
• come ogni chitochina, l'interlueuchina 2 deve legare sul linfocita un proprio recettore:
interazione autocrina e paracrina
• se l'interazione avviene in maniera corretta il linfocita prolifera, si differenzia, ed è in grado di
provvedere all'eliminazione del microrganismo.
• se l'intereazione non avviene in maniera corretta, coinvolgendo solo il primo segnale (MHC2 e
recettore) può venire indotta l'apoptosi del linfocita T, o soprattutto l'ANERGIA, cioè il
linfocita T non sarà MAI PIU IN GRADO DI RISPONDERE A STIMOLI.
• se l'interazione non avviene in maniera corretta, coinvoltendo solo il secondo segnale
(interazioni costimolatorie) può venire indotto l'arresto del ciclo cellulare del linfocita T
• la conseguenza funzionale tra queste due cellule è assolutamente differente se avviente
interazione tra segnali stimolatori e costimolatori e se avvengono interazioni solo con segnali
stimolatori
• tutti i fenomeni di immunologia non sono mai o soltato utili o soltanto dannosi. gli anticorpi igE causano
allergie, e sono responsabili dei simoli delle allergie. allo stesso tempo queste igE ci proteggono da infezioni da
particolari microrganismi, . tutti i fenomeni immunologici, come quelli biologici in generale, hanno sempre
un lato positivo e uno negativo: di un solo elemento bisogna considerare le due faccie della medaglia.
• i segnali costimolatori sono molteplici: Interazione di icosl della cellula dendritica con icos del
linfocita T; PD-l1 con PD1 del linfocita; in oltre sia pdl-2 e b7h3 della cellula dendritica sono altri
tipi di recettori per interazioni costimolatorie.
• sul linfocita t vi sono circa 2 milioni di molecole recettoriali.
• affinchè sia possibile trasdurre, all'interno del linfocita almeno un milione di recettori deve
essere legato all'antigene specifico per poter trasdurre un segnale sufficiente. quindi sulla cellula
dendritica devono essere presentare almeno un milione di complesso mhc2 affinchè si possa
indurre la risposta. la cellula denritica in realtà presenta solo 200 complessi. come può attivare
un milione di recettori del linfocita t?
• meccanismo a ruota dentata: lega 200 recettori dal linfocita T, inizia a ruotare su se stessa a mo'
di ruota dentata staccando alcuni recettori posteriori e lengandone altri anteriori.
• il legame tra complesso mhc2 e i recettori del linfocita t ha una affinità molto debole, quindi una
Ka molto elevata, questo favorisce un distacco facilitato.
____
3
complesso
maggiore di
istocompatibilità
____
• nel cromosoma sei nell'uomo vi sono i geni che codificano per il complesso maggiore di
istocompatibilità.
• esistono geni per molecola di istocompatibilità solo di classe prima e di classe seconda. le
molecole per il mhc3 che si trovano nello stesso cromosoma non hanno un ruolo approssimabile a
quello dei mhc1 e 2: i geni mhc3 codificano per diversi elementi che fanno parte del complemento
(21-idrossilasi ad esempio, che non è neanche coinvolto nella risposta immunitaria) sono quindi
chiamati mhc di classe 3 impropriamente.
• esistono 3 geni per mhc1 e 3 per mhc2. quindi ogni gene codifica per una proteina.
• se ogni cromosoma codifica 3 molecole per complesso, dato che abbiamo due cromosomi avremo
6 molecole per ogni tipo di complesso.
• le molecole mhc nell'uomo prendono il nome di HLA Human Leucotice Antigen.
• le tre molecole che compongono l'HLA classe seconda saranno HLA-DP HLA-DQ e HLA-DR
(hla-dr1 dal cromosoma di mamma e hla-dr4 dal cromosoma di papà).
• le tre molecole che compongono l'HLA di classe prima saranno HLA-A, HLA-B e HLA-C.
• ogni HLA di classe prima è composta da due catene: alfa e beta
• la catena alfa è divisa in 3 domini: 1, 2 e 3.il dominio 3 è il più vicino alla membrana, e prende
rapporti con essa, i domini alfa 1 e 2, che sono più lotani dalla membrana, si organizzano a formare
una piccola tasca, all'interno della quale si lega l'oligopolipeptide antigenico da presentare al
linfocita.
• la catena beta è identica in tutte le mhc di classe 1, ed è costituita dalla beta-2-microglobulina. il locus per
questa proteina si trova su un altro cromosoma.
• gli HLA di classe seconda presenta qualche differenza: è sempre composta da due catene: alfa e
beta; sia le catene alfa che beta presentano due domini.
• la tasca è formata sia da un dominio alfa che da un dominio beta; il locus per la sintesi della
catena beta del complesso di classe seconda si trova sul sesto cromosoma;
• il dominio alfa 2 e beta 2 sono i più vicini alla membrana e prendono rapporti con essa; i domini
alfa1 e beta 1 concorrono alla formazione della tasca di legame.
• la differenza sostanziale che si presenta nella tasca è che nella classe seconda il peptide è
parzialmente esposto fuori dalla tasca, tra l'altro il peptide per la mhc di classe seconda è più lungo
di quello di classe prima: un peptide che lega una molecola di classe prima è lungo generalmente
da 7 a 9 amminoacidi; comunque non più lungo di 9 amminoacidi perchè la tasta è chiusa alle
estremità.
• ma non tutti e sette hanno funzione di riconoscimento antigenico, alcuni amminoacidi sono
necessari per fare i legami: sono due amminoacidi posti in posizione chiave e prendono il nome di
residui di ancoraggio o residui ancora.
• tutti gli altri amminoacidi sono irrilevanti, possono essere sostituiti.
• classe due lega peptidi piu lunghi, in media 15-20 amminoacidi, e dato che la tasca è bucata
possono esserci residui di 30 amminoacidi. anche qui non tutti i peptidi sono essenziali, vi sono i
soliti 3-4 amminoacidi di ancoraggio.
• le molecole di classe prima sono esposte su tutte le cellule nucleate dell'organismo
• le molecole di classe seconda sono espresse massimalmente nelle cellule dendritiche, linfociti B e
cellule epiteliali del timo (quindi tutte le cellule con funzione di presentazione dell'antigene);
• le molecole di classe prima non sono essenziali solo nell'ativazione del linfocita, ma anche
nella parte finale della risposta.
• ipotizziamo che il virus influenzale abbia infettato un individuo, e che un linfocita sia stato
attivato contro questo antigene.
• il linfocita deve recarsi nel luogo d'infezione, deve riconoscere la cellula epiteliale infettata, e
deve uccidere la cellula. nella discriminazione tra cellula infetta e cellula sana è essenziale mhc di
classe 1. le cellule infettate, se nucleate, espongono mhc1 con il peptide antigenico, facendosi
riconoscere dal linfocita.
• il linfocita matura nel timo, in seguito a presentazione dell'antigene da parte della cellula
dendritica tramite peptide associato a MHC2, imparando a riconscere un antigene solo sotto forma
di PEPTIDE ASSOCIATO ALL' MHC1: mai sei il peptide è dissociato, o l'MHC1 non presenta peptidi
all'interno.
____
4
polimorfismo di
MHC
____
• l'ultima delle caratteristiche dei mhc è il polimorfismo: presenza in una popolazione di numeriose
varianti alleliche di uno stesso gene.
• la molecola più polimorfica è la molecola HLA B, della quale esistono 559 varianti alleliche
molecole che differiscono tra loro per la sequenza amminoacidica).
• esempio: io esprimo 6 mhc1: 3 ereditate dal padre e 3 ereditate dalla madre. per quanto riguarda
le molecole b esprimerò delle molecole che chiamoerò per convezione b1 quella di orginie paterna
e b2 quella di origine materna. quanti esprimeranno la stessa molecola che esprimo io?
• non considerando legami di parentela (dato che la trasmissione di queste molecole è autosomica)?
• queste molecole sono essenziali nei trapianti di organo, in primis trapianto di midollo. se non vi è
assoluta compatibilità il risultato sarebbe il rigetto dell'organo.
• si chiama di istocompatibilità perchè è il piu importante dei sistemi che determina la
compatibilità istologica, compatibilità nei trapianti.
• la possibilità di riscontrare due individui non correlati con compatibilità istologiche è di 1 su un
milione.
• la presenza di varianti alleliche è particolarmente spiccata per le molecole di classe prima.
• per la classe seconda, la molecola più polimorefica è HLA DR, in particolare la sua catena beta. le
catene alfa presentano una variabilità molto minore rispetto alle beta.
• le differenze della variabilità sono identificabili soprattutto in una piccola porzione della
molecola: nella tasca. la regione dove è localizzata la grande maggioranza della differenza tra le
HLA di classe 1 è la tasca, in entrambe le catene alfa.
• dato che nella hla classe seconda la tasca è formata da due catene, vi sono altre differenze: la
variabilità riguarda solo la catena beta. quindi, una variabilità ancora più selettiva.
• il fatto che la tasca di due molecole abbia differenze sostanziali, fa si che queste molecole non
possono legare lo stesso peptide: alcune molecole avranno una maggiore specificità per qualcosa,
altri per qualcos'altro ATTRAVERSO PEPTIDI DI ANCORAGGIO SPECIFICI PER GLI MHC DI UN
PARTICOLARE INDIVIDUO: questo accade a causa della regolazione genetica della risposta
immune.
• avendo 6 mhc1 e 6 mhc2, dato che un individuo può essere omozite o eterozigote, per quanto
riguarda le molecole di istocompatibilità l'omozigosi implica il fatto che molecole codificate da
geni che si trovano sullo stesso locus di cromosomi omologhi siano uguali; l'eterozigosi per queste
molecole implica la differenza dei geni nei cromosomi omologhi; quindi avrò un tipo di hla b1 e un
tipo hla b2.
• per quanto riguarda la risposta immunitaria, chi è in vantaggio? sicuramente l'eterozigote:
infatti l'eterozigosi da vantaggio selettivo per quanto riguarda le molecole hla. infatti si sostiene
che nel corso del'evoluzione tutti coloro che avevano omozigosi per certe hla non sono riusciti a
sopravvivere a particolari tipi di infezioni. si racconta di un intera popolazione delle odierne
antille olandesi che sarebbe morta a causa dell'omozigosi di alcune hla, che non sarebbero state in
grado di resistere all'agente eziologico della malaria.
• la possibilità di legame dell'eterozigote è maggiore rispetto a quella dell'omozigote.
• buco del repertorio: nel repertorio delle molecole di istocompatibilità possono esserci dei buchi,
cioè possono esserci peptidi che non possono essere legati neanche in eterozigosi. questo
fenomeno è molto raramente osservabile.
____
5
sintesi di MHC di
classe prima e
processamento
dell'antigene nella
cellula dendritica
____
• il processamento di determinati organismi produrrà dei peptidi che si possono legare ai processi
di istocompatibilità APPARTENENTI SOLTANTO a quel determinato individuo, data la grande
varietà allelica data dal polimorfismo. se in seguito a processamento del virus influenzale il
complesso mhc del mio corpo lega un peptide particolare; a parità di virus, il processamento che
subirà lo stesso virus in un altra persona produrrà un peptide diverso che sarà in grado di essere
legato dal mch della persona stessa.
• la molecola di classe prima viene sintetizzata nel reticolo
• prima tappa: sintesi della catena alfa, e legame di questa alla calnexina (una chaperonina
accompagnatrice). che se la tiene legata nel reticolo endoplasmico fino alla sintesi della beta,
2-microglobulina; che costituisce la catena beta nelle molecole di classe prima.ricordiamo che le
catene alfa sono polimorfiche nei complessi di classe 1, mentre le catene beta sono rappresentate
dalla beta-2-microglobulina. nel momento in cui viene sintetizzata questa beta 2-microglobulina si
etra nella seconda tappa
• seconda tappa: la catena alfa si dissocia dalla calnexina, e (la catena alfa) e si lega alla beta due
microgrobulina formando la molecola di classe1; nel reticolo alcune molecole, in particolare la
tapasina, porta la molecola di classe prima a contatto con strutture della membrana del reticolo
chiamate tap: trasportatore di peptidi.
• i peptidi che possono presentare le molecole di classe prima sono adibite alla presentazione di
peptidi generati da qualcosa che ha sede intracellulare (organismo fagocitato, o in generale
intracellulare come tipicamente i virus; la cellula tumorale in oltre assume caratteristiche
diverse dalla cellula normale che la possono anche rendere antigenica).
• i peptidi antigenici vengono generati nel citosol ad opera di una struttura multimolecolare
chiamato proteasoma.
• le proteine penetrano nel proteasoma, vengono digerite e vengono generati peptidi antigenici.
• il trasportatore di peptidi TAP, prende i peptidi e vengono trasportato all'interno del reticolo
endoplasmico.
• uno o due di questi peptidi legeranno la tasca della molecola di classe prima.
• questa si stacca da tutte le altre proteine (sia tapasina che tap) e attravesco una vescicola si
posiziona sulla membrana cellulare.
• l'esposizione di questo complesso interagisce con i recettori di un linfocita T CD8 citotossico, che
induce l'uccisione della cellula bersaglio.
• l'uccisione della cellula deve rispettare delle caratteristiche ben precise affinchè parassiti non
escano ed invadano l'organismo.
____
6
sintesi di MHC di
classe seconda
____
• mentre classe 1: processamento e presentazione di peptidi generati in sede intracellulare, classe
2: processamento e presentazione di peptidi generati in sede extracellulari
• nel R.E si sintetizzano sia la catena alfa sia la catena beta insieme.
• può accadere che dei peptidi self si possano già legare alla molecola di classe seconda: per
impedire questo interviene un meccanismo molecolare "Ii" catena invariante.
• la catena invariante impedisce che eventuali peptidi self si vadano a legare alla tasca della
molecola di classe 2. è un meccanismo di tutela.
• la mhc2 con la catena invariante, attraverso una vescicola va nel citosol e si fonde con un
endosoma.
• dentro l'endosoma si trovano degli enzimi, delle proteasi in particolare. man manco che il
l'endosoma matura, e acidifica il suo ph, le proteasi digeriscono la catena invariante.
• la catena invariante è idrolizzata tutta meno che la porzione che è all'interno della tasca. questo
frammento che rimane a proteggere la tasca è chiamato CLIP. (piccola porzione di Ii, che rimane
legata alla tasca di mhc2).
• al contrario di mhc di classe1, le molecole di classe seconda presenteranno molecole che si
trovano in genere in sede extracellulare.
• molecola esogena viene internalizzata, e la vescicola processa i peptidi e li prepara con il legame
con mhc2, e si fonde con la vescicola che contiene mhc2. ma mhc2 ha hancora la clip.
• una molecola chiamata HLA-DM prende clip, e lo toglie dalla tasca, libera la tasca, e permette ad
un peptide antigenico batterico di legarsi alla tasca.
• ora il complesso con il peptide nella tasca si sposta sulla membrana, e sarà pronto ad interagire
con il recettore di alcuni linfociti T, in particolare i linfociti T CD4 Helper: questi non hanno
funzioni effettrici immediate, ma aiutano i macrofagi (e i linfociti b) e tutte le altre cellule
dell'organismo attraverso la produzione di citochine. grazie a questa produzione può collaboare
con tutte le altre cellule dell'organismo in svariate maniere.
• la vera cellula effettrice però non è il linfocita Helper.
• mhc1 attivano linfociti citotossici, mhc2 attivano linfociti helper: quindi questi due sistemi
attivano diversi tipi di risposta immunitaria.
• ogni complesso attiva la risposta migliore possibile di un determinato organismo, a se conda se
intra o extracellulare.
____
7
recettori dei
linfociti B
____
• i linfociti b utilizzano come recettore di membrana degli anticorpi (immunoglobuline).
• l'anticorpo stesso è anche la molecola che secernono una volta attivati per eliminare un
microrganismo.
• è composto da due catene, una alfa e una beta. ogni catena è composto da due domini: C(vicina
alla membrana) e V(quella più lontana) c=costante, V=variabile.
• vi è anche una porzione intramembranaria, una transmembranaria e una intracitoplasmatica (che
serve per la trasduzione del segnale)
• la porzione intracitoplasmatica è molto corta rispetto a quella esterna alla cellula. dato che è
corta avrà difficoltà nelle attivazioni di secondi messaggeri.
• il fatto che la porzione intracitoplasmatica sia talmente corta che non possa essere trasdotto il
segnale, fa si che debbano cooperare altre molecoe. le molecole che si integrano con questo
recettore sono sei molecole chiamate molecole del complesso CD3: formata da 6 catene (epsilon,
delta - gamma, epsilon - e due catene ZETA)
• le catene zeta sono le piu importanti per la trasmissione di segnale
• cd3 è una molecola che utilizziamo per identificare tutti i linfociti t. se vogliamo sapere quanti
linfociti ci sono in un tessuto sfruttiamo l'espressione di questa molecola. soltanto i linfociti t
esprimono sulla membrana questa molecola cd3.
• le catene di cd3 hanno sequenze nelle regioni intracitoplasmatiche, dette sequenze ITAM, che
identificano dei segnali di attivaizone (IMMUNORECETTOREN RICCO DI TIROSINA ASSOCIATO
AlLLA MEMBRANA)
• vi possono essere anche delle sequenze ITIM che trasducono segnali inibitori.
• le sequenze itam sono presenti in tutte e sei le molecole di CD3; le catene zeta, che sono le
molecole con coda intracitoplasmatica più lunga presentano tre sequenze itam per ogni catena.
• nell'ambito della porzione variabile del recettore in cui la variabilità è particolarmente sostenuta:
è così sostenuta che vengono definite regioni ipervariabili, che sono in tutto tre nelle catene alfa,
e tre regioni ipervariabili nella catena beta.
• queste tre regioni prendono il nome di regioni CDR, e vengono indicate con CDR1 2 e 3. CDR
significa regione che determina la complementarietà.
• queste regioni formano il sito del recettore che lega il complesso peptide-mhc.
• a formare il sito quindi concorrono una piccola parte delle catene beta e una piccola parte delle
catene alfa.
• la CDR3, che è la regione più variabile di tutte, è la porzione del recettore che prende più
intimamente contatto con il complesso peptide-mhc, corrisponde quindi realmente al sito di
contatto con il ligando
• sia le catene alfa che le catene beta contribuiscono a formare i complessi CDR1, 2 e 3 .
• sappiamo che esistono 10^18 recettori alfa-beta. sappiamo che il genoma contiene 10^4 geni per i
recettori. come può un numero così piccolo di geni codificare per tutti questi recettori?
____
8
ricombinazione
somatica
____
• grazie ad un fenomeno detto ricombinazione somatica (Susumo Tonegawa, premio nobel,
attualmente il rettore del MIT)
• Susumo ci ha spiegato come viene generata questa diversità di recettori, con un esperimento
molto semplice che fece negli anni 70 in svizzera, che era l'unico paese dove fosse consentito fare
esami sul dna.
• un gene C e un gene V si trovano molto distanti l'uno dall'altro in una cellula qualsiasi; in un
linfocita i geni C e V sono giustapposti: nella maturazione di una cellula, di un linfocita, due geni
che si trovano molto distanti tra loro, nel momento in uci la cellula staminale decide di maturare,
due geni si posizionano uno accanto all'altro: questo fenomeno si chiama ricombinazione somatica
o riarrangiamento.
• mentre la porzione varbiabile della catena alfa è sintetizzata da due geni V e J, la porzione della
catena variabile beta è sintetizzata da 3 geni V, J e D.
• in una cellula staminale midollare la differenziazione verso la serie linfocitaria T, riguardo la
ricombinazione genica, accade la ricombinazione somatica in manieara del tutto casuale. in un
singolo linfocita T, casualmente, un gene V e un gene J(joining) si giustappongono grazie a degli
enzimi detti ricombinasi (rag1 e rag2), formando la ricombinazione V-J. tutto ciò che c'è tra il vj
riarrangianto ed il gene costante viene eliminato per splicing, e il gene VJ viene unito al gene C per
la porzione costante: questo porta alla sintesi di una catena alfa.
• dato che nella catene beta vi sono 3 geni, sono necessari due riarrangiamenti.
• il primo riarrangiamento riguarda J e D, e il segmento J-D viene giustapposto a V, con
conseguente formazione di V-D-J. quindi verràm spliceato tutt ciò che si trova tra la porzione VDJ e
la porzine variabile, e da questo nasceranno delle catene beta
• una volta che sono sintetizzate le catene alfa e beta, possono essere esposte sulla membrana per
formare un recettore maturo.
• in questo modo possiamo avere un numero di ricombinazioni possibili pari a 1352 combinazioni
beta e 4275 combinazioni alfa. tutti i possibili recettori combinati possono avere circa 5000000
combinazioni.
• mancano ancora 10^13 combinazioni. come possono arrivare a tanti?
• i fenomeni di giustapposizione non sono mai precisi, anzi sono talmente sbagliati che molto
spesso c'è la necessità per fare appaiare due estremi di aggiugere qualche nucleotide o di tagliarne
qualcuno: fenomi di n-addiction o n-delection. la diversità creata viene denominata diversità
giunzionale, perchè si verifica tra le giunzioni di VJ e VDJ.
• la diversità giunzionale genera il grosso della variabilità dei recettori.
____
9
maturazione dei
linfociti T
____
• una cellula staminale si orienta verso una linea di differenziazione grazie alla presenza, nel
midollo osseo, di fattori di crescita, la gran parte dei quali sono prodotti in loco dalle cellule
stromali del midollo osseo.
• interleuchina 7 : coinvolta nella maturazione, e nel mantenimento della vtalità dei linfociti t
nella paracorticale del linfonodo. questa è la citochina che al livello del midollo osseo più di tutte
determina la differenziazione di una cellula staminale a linfocita (T, helper e forse b).
l'interleuchina è prodotta dalle celule stromali del midollo osseo.
• perchè non siamo sicuri che intervenga anche nella maturazione dei linfociti b?
• si genera un topo knok-out per quella molecola o quel recettore, cioè un topo che può far tutto
tranne produrre una molecola selezionata. e così possiamo studiare come si omporta un organismo
in assenza di alcune molecole. quindi esistono topi knok-out per l'interleuchina 7 o per il suo
recettore. questi topi non ha linfociti T, B e natural killer. è un topo immunodeficiente. da questo
studio deduciamo che l'interleuchina è essenziale per la maturazione dei linfociti.
• una malattia può rendere un uomo "knok-out" per certe molecole, e può indurre delle
immunodeficienze a causa di errori nella sintesi dell'interleuchina 7.
• nell'uomo che deficita di interleuchina 7 non vi sono linfociti fuorichè linfociti B.
• per il linfocita t questa citochina è importante; mentre tutte le cellule maturano nel midollo, nel
linfocita t la maggior parte della maturazione del linfocita t matura nel TIMO (linfocita T(imo)).
• linfocita t fuoriesce immaturo dal midollo osseo. non è considerabile linfocita t ancora, finchè non
completa la fase maturativa nel timo, dove acquisirà funzioni e caratteristiche molecolari di
riconoscimento dell'antigene. queste caratteristiche di differenziazione nel timo passano
attraverso due fasi:selezione positiva e selezione negativa, che si realizzano in diverse sedi del
timo.
• il linfocita t per maturare attraverserà tutte le parti del timo, interagendo con molte cellule
(residenti o meno) secondo tappe ben precise.
• una cellula che il linfocita t immaturo incontrerà è la cellula epiteliale della corticale del timo,
con la caratteristica di esprimere molecole MHC1 E ANCHE MOLECOLE DI CLASSE SECONDA.
• se arriviamo alla giunzione corticomidollare il linfocita interagisce con delle cellule dendritiche,
che non sono cellule epiteliali, sono di origine mieloide, e quindi non residenti, che esprimono
MHC1 e 2.
• successivamente il linfocita incontra cellule epiteliali della midollare del timo. anche queste
cellule esprimono sia molecole di classe prima, come normalmente atteso, ma anche molecole di
classe 2.
• cellule epiteliali della corticale, della midollare e dendritiche svolgono un ruolo fondamentale
nella maturazione del linfocita t.
• la cellula che perviene nel timo non è assolutamente destinata a diventare necessariamente un
linfocita è chiamata precursore timico precoce, che può diventare linfocita natural killer (si è
scoperto recentemente che può diventare linfocita b), monocita, una cellula dendritica (può
orientarsi sia in senso linfoide che mieloide) ecc..
• questa cellula inizia a maturare e la identifichiamo con la sigla DN che significa cellula doppio
negativo; doppio negativo significa che non esprime due molecole di membrana: CD4 e CD8.
• l'assenza di queste molecole essenziali per l'identificazione di un linfocita è indice di
generalizzata mancanza di tutte le caratteristiche di membrana che sono associate ai linfociti.
• questa cellula doppionegativa è caratterizzata da un elevata proliferazione proteica
intracellulare, in quanto "blasto". questa elevata proliferazione può portare ad errori nella
duplicazione e indurre apoptosi. il 95% di tutti i precursiori che arrivano nel timo dal midollo
muoiono per apoptosi per "negligenza del timo". c'è una sola possibilità che il linfocita t non
muoia, e possa maturare:che abbia la possibilità di interagire con le cellule epitali della corticale.
• un doppio positovo esprime entrambe le proteine, un singolo positivo ne esprime una
soltanto.
• esistono diverse fasi maturative: DN1, DN2a, DN2b ecc... in una fase chiamata stadio DN3 la
cellula smette di essere pluripotente, quindi il vero e proprio orientamento avviene nel timo
quando la cellula ha già iniziato a differenziare
• il primo segnale nello stadio dn3 che fa capire che sta differenziando per linfocita è che si ha un
riarrangiamento nel gene per la catena beta del recettore mhc.
• la cellula, a questo punto, ha una sotto- scelta di differenziazione: se il riarrangiamento prodotto
è un riarrangiamento produttivo, si riarrangerà anche il gene per la catena alfa e ne conseguirà la
sintesi di recettori alfa-beta; se il riarrangiamento di beta non è produttivo, è possibile operare dei
riarrangiamenti per esprimere dei recettori gamma-delta (invece che formati da alfa-beta).
____
10
selettività positiva
____
selezione negativa
____
• a questo punto allo stadio doppio negativo segue direttamente uno stadio doppio positivo dopo
itnerazione con le epiteliali della corticale: nella corticale questa cellula in maturazione interagisce
con cellule epiteliali della corticale che esprimono sulla membrana molecole di istocompatibilità di
classe 1 e 2. questi complessi espongono dei peptidi-self (o timici) che pervengono al timo tramite
sangue o linfa (che derivano dal sangue, dalla linfa etc).
• questa interazione salva il linfocita t dalla morte programmata. l'interazione tra un dato
linfocita maturativo con i complessi mhc1 o 2 che esprimono peptidi self è assolutamente aleatoria.
poichè il risultato finale di queste interazioni producono la "salvezza" della cellula, queste
prendono il nome di selezione positiva.
• questo è un processo di educazione chimica: il linfocita impara che da maturo dovrà riconoscere
l'antigene in forma di peptide legato a mhc 1 o 2 (restrizione genetica a livello dell'antigene); il
linfocita deve imparare a stinguere self e non self.
• il risultato della selezione positiva darà che per la semplice intearzione con cellule epiteliali della
corticale che espongo peptidi-self da mhc1 e 2 renderà il linfocita t capace di riconoscere peptidi
non-self. .come fanno poche centinaia di recettori mhc self a educare al riconoscimento di 1*10^18
non self?
• come fa un self a educare il riconoscimento di un non-self?
____
• la cellula che ha subito la selezione positiva, a livello della giunzione corticomidollare, adesso
inizia ad interagire con le cellule dendritiche. i linfociti t che interagiscono ad alta affinità con le
cellule dendritiche muoiono per apoptosi. questa è detta selezione negativa.
• la conseguenza della selezione negativa è l'eliminazione di linfociti che presentano recettori ad
alta affinità per cellule self, quali le cellule dendritiche. questo meccanismo contribuisce alla
tolleranza delle nostre strutture. viene chiamato tolleranza immunologica: eliminazione di
linfociti t ad alta affinità per le strutture self.
• i linfociti a bassa e media affinità sopravvivono e diventano maturi.
• dopo l'interazione con le cellule dendritiche il linfocita diventa o solo cd4 positivo o solo cd8
positivo.
• un linfocita è doppio positivo solo a livello della corticale.
• la doppiapositività è indotta da un programma della cellula, che produce oltre i riarrangiamenti dei geni per
le catene beta-alfa, causa la sintesi dei recettori CD di membrana.
• come fa il timo ad esprimere antigeni self, inclusi antigeni self tessuto-specifici, propri di alcuni
tessuti specializzati?
• come facciamo a diventare tolleranti a questi antigeni?
• un gene espresso dalle epiteliali della midollare del timo permette l'espressione nel timo di
peptidi tessuto-specifici.
• il gene si chiama AIRE: gene regolatore di processi autoimmunitari, è un gene espresso dalle
cellule epiteliali della midollare.
• AIRE codifica per un fattore di trascrizione che permette la trascrizione di geni codificanti per
peptidi tessuto specifici.
• (domanda della prova in itinere: dove è espresso aire? sulle cellule epiteliali della midollare).
• dal punto di vista anatomico aquisiamo che la selezione negativa prosegue anche nella midollare,
dove il linfociti t con recettori ad elevata specificità per peptidi tessuto-specifici, espressi nelle
epiteliali della midollare che eprimono aire, vengono eliminati.
• mutazioni di aire costituiscono conseguenze di immunodeficienza generalizzata: la malattia è
autosomica recessiva, il gene per aire si trova sul cromosoma 21. questa malattia interessa
molteplici ghiandole endocrine: APS.
• AIRE NON è ESPRESSO COSTITUTIVAMENTE: AIRE VIENE ESPRESSO IN SEGUITO A INTERAZIONI
DELLE CELLULE EPITELIALI DELLA MIDOLLARE CON UN LINFOCITA CHIAMATO LINFOCITA TIMICO
INDUTTORE, CHE SAPPIAMO ESSERE UN LINFOCITA NATURAL KILLER, attraverso il segnale che è
dato da l'interazione tra RANKL e il legando di RANKL . questa interazione fa si che si esprima AIRE.
• man mano che la cellula epiteliale della midollare esprime aire, aumenta l'espressione di antigeni
tessuto ristretti, cioè antigeni non ubiquitari, la cui espressione è ristretta ad alcune cellule di
alcuni tessuti.
____
11
modalità di
induzione della
selezione
____
• un meccanismo legato all'affinità di legame tra il complesso peptide mhc ed il recettore del
linfocita: non sappiamo con certezza sia vero. parliamo di ipotesi.
• sta di fatto che chi interagisce si salva, chi non interagisce muore.
• solo il 5% ha la possibilità di interagire con peptidi mhc-self.
• anche nella selezione positiva il risultato della selettività è data dall'affinità di legame. se è
estremamente bassa o estremamente alta viene eliminato il linfocita nascente.
• l'affinità di legame deve essere intermedia, affinchè il linfocita sia selezionato correttamente.
• il modello oggi più accettato è il modello di affinità di legame per spiegare i fenomeni di selezione
sia positiva che negativa. un'affinità intermedia induce il linfocita a proseguire nella sua
maturazione.
• immaginamo che la selezione positiva e negaticva siano due eventi che avvengano in successione:
non c'è nessuna prova che sia vero, queste selezioni potrebbero avvenire comtemporaneamente.
• selezione positiva:primo aspetto: abbiamo detto che dobbiamo selezionare 10^18 recettori. quindi
dovremmo avere 10^18 peptidi self nelle cellule del timo, nel caso in cui il rapporto fosse 1:1. ma
non è così. come avviene quindi la selezione positiva? è un metodo stocastico, che un singolo
complesso mhc può selezionare più di 100 recettori differenti. questo può essere utile a spiegare un
altro fenomeno: il sorcio pacchione.
• secondo aspetto: il ruolo del peptide self non si esaurisce solo nel timo, è utile anche in periferia.
lo stesso peptide che ha indotto la maturazione nel timo si trova in periferia, nel linfonodo, e funge
da co-stimolatore dei linfociti.
• terzo aspetto: il topo pacchione di 5kg. in periferia abbiamo 10^18 recettori. questi
dovrebberoessere in grado di riconoscere tutti i potenziali peptidi non self che penetrano nel
nostro organismo.
• il problema che nasce è che il numero di potenziali peptidi di origine microbica può essere di gran
lunga maggiore a 10^18. quindi abbiamo un numero di recettori specifici inferiore ai peptidi
antigenici.
• il topo pacchione ha un linfocita per ogni peptide batterico. per questo pesa 5kg invece che 20gr.
avessimo un numero di linfociti tali nella condizione che ogni linfocita possa riconoscere un solo
peptide antigenico peseremmo centinaia di chili.
• nell'uomo un linfocita non riconosce un solo peptide, ma molti: CROSS-REATTIVITA', questa
cross-reattività naturalmente può portare a degli errori: degli antigeni self potrebbero non essere
riconosciuti. il rigetto di alcuni trapianti avviene a causa anche della cross-reattività.
• quarto aspetto: per il processamento di peptidi per il complesso mhc 1,bisogna usare un
proteosoma. il proteosoma delle cellule epiteliali della corticale è particolare, ed è presente solo in
queste cellule; questo proteosoma così specifico prende il nome di timo-proteosoma, che è molto
più complesso del proteosoma delle cellule dendritiche.
• per il complesso mhc2 il peptide viene processato da un solo ed unico enzima che si trova in un
endosoma di una cellula epiteliale della corditale: si chiama catepsina-L. nelle cellule dendritiche
invece c'erano molte proteasi, e molte proteine. il fatto che intervenga solo un enzima comporta
che i peptidi antigenici siano un numero ristretto rispetto ai peptidi antigenici che potrebbe
processare un a cellula dendritica.
• N.B.: aspetto 4 possibile domande della prova.
____
12
il risultato finale
della selezione
timica
____
• le molecole di classe prima presentano peptidi di piccola dimensione a linfociti cd8 o citotossici.
l'espressione di cd8 ha qualcosa in relazione con il timo.
• il precursore che viene nella corticale è all'inizio doppio negativo, che non esprime ne cd4 ne cd8.
• dopo aver superato la fase dn4 diventa doppio positivo nella zona corticale del timo
• dopo di che il linfocita diventerà singolo positivo. la funzione di riconoscimento di queste cellule
viene acquisita nel timo ad opera della selezione timica.
• cd4 e cd8 sono popolazioni rispettivamente di linfociti helper (aiutano i macrofaci i linfociti b, i
linfociti cd8), e i linfociti cd8 hanno una funzione effettrice diretta: uccidere una cellula bersaglio,
natural killer.
• in realtà cd4 e cd8 non identificano una funzione: cd4 e cd8 servono ad altre cose.
• cd4 lega la porzione costante di mhc2, mentre cd8 lega le porzioni costanti di mhc1.
• da cio possiamo dedurre che sia i linfocti cd4 che cd8 però riconscono antigeni di natura
proteica.
• la capacità di poter riconoscere un antigene associato ad un certo mhc è chiamata restrizione
genetica del riconoscimento dell'antigene: i cd4 sono ristretti per classe 2, i cd8 sono ristretti per
classe1.
• tutti gli antigeni sono di natura proteica? se per caso in periferia ognuno di noi avesse dei linfociti
t che non esprimono ne cd4 ne cd8?
• tutti gli antigeni di natura microbica sono proteici? pensiamo a batteri la cui maggior parte del
corpo batterico è composta da lipidi. quindi non tutti gli antigeni sono di natura proteica. nei
confronti di antigeni di natura lipidica o glicolipidica non siamo in grado di rispondere?
• in periferia riscontriamo linfociti t doppio negativi (non esprimono ne cd4 ne cd8),
evidentemente dato che questo linfocita non è in grado di riconoscere peptidi associati ne a mhc1
ne a mhc 2, riconoscerà qualcos'altro.
• dal timo avremo anche diverse popolazioni di linfociti doppionegativi: queste popolazioni sono 5
che emergono dalla selezione positiva e negativa, che poi, una volta maturati vanno nei linfonodi
della milza.
• più del 50% dei linfociti t sono linfociti cd4 helper. questo è importante dal punto di vista pratico.
• i linfociti cd8 rappresentano circa il 30% della popolazione di linfociti t.
• una percentuale minore di linfociti t sono doppio negativi, che non esprimono ne cd4 ne cd8. una
di queste popolazioni si caratterizza per il fatto che esprime un recettore che non è quello
alfa-beta, ma è un recettore gamma-delta. il recettore espresso prende quindi il nome di recettore
gamma-delta, conferendo ai linfociti il nome di linfociti gamma-delta (meno del 5% della
popolazione di linfociti t).
• altre due popolazioni di linfociti t sono doppio negative ma esprimono un recettore alfa-beta;
• una di queste due popolazioni svolge delle funzioni simili a quelle dei recettori natural killer e a
quelle dei linfociti t. dato che questa popolazione ha caratteristiche simili alle due popolazioni
questa popolazione prende il nome di Natural Killer T (NKT).
• le tre popolazioni doppionegative, dato che mancano di cd4 e cd8 non possono quindi riconoscere
antigeni di natura proteica.
____
13
linfociti alfa-beta
doppionegativi
____
processamento dei
glicolipidi per i
linfociti a-b DN
____
• sia quelli classici sia i natural killer t riconoscono glicolipidi: antigeni con una componente
glicidica e una coda lipidica.
• non li riconoscono da soli, ma quando sono associati ad una molecola molto simile alle molecole
mhc1. anche questa molecola, chiamata cd1 è un dimero alfa beta: la catena alfa è formata da 3
domini, e la catena beta da un solo dominio di beta 2 microglobulina. la tasca è formata dalle due
catene alfa. questa tasca è molto più profonda rispetto a quella della mhc1 perchè deve
alloggiarvi la coda lipidica.
• la profondità della tasca è ciò che differenzia sostanzialmente queste molecole.
• la tasca di CD1 LEGA SOLO LA PORZIONE LIPIDICA. IL GLICIDE RIMANTE ALL'ESTERNO DELLA
TASCA. un esempio di una molecola, la prima sintetizzata, riconosciuta dai NKT è la alfa
galattosilcerammide.
• questa molecola esiste solo nelle spugne di mare. ci si è chiesti perhè madre natura ci avesse
fornito protezione contro le spugne di mare. 0_0 allora perchè abbiamo questo recettore dato che
la molecola non è presenta altrove in natura?
• una parte della molecola antigenica, il lipide, si inserisce nella tasca. il recettore alfa-beta
riconosce soltanto il glidice.
• la molecola simile alla alfa galattosilcerammide è la beta galattosilcerammide, molto
abbondante nel snc. verosimilmente il fenomeno per cui viene riconosciuta l'alfa
galattosilcerammide è un fenomeno di cross-reattività. in realtà il vero ligando è la beta
galattosilcerammide.
• la alfa galattosilcerammide è stata sintetizzata, forse per sbaglio, in un laboratiorio di una fabrica
di birra asiatica (Kirin). quando ha scoperto che a che serviva questa molecola ha iniziato la
produzione su scala industriale perchè questa molecola stimoli i recettori cd1 durante tumori,
rendendoli più reattivi a cellule tumorali
• mentre molecole di hla hanno molte varianti alleliche, cd1 presenta solo 4 varianti alleliche
:CD1a CD1b CD1c e CD1d. queste variazioni alleliche riguardano piccole variazioni a livello dei
domin alfa1 e 2. inlfuenza in pratica il tipo di glicolipide che si può legare.
• i linfociti alfa-beta classici riconoscono glicolipidi associati a molecole cd1 a, b, c. i NTK
riconoscono glicolipidi associati a CD1d.
• come avviene il processamento dei glicolipidi?
____
• cd1 è espresso prevalentemente dalle cellule dendritiche. l'espressione di cd1 non è costitutiva.
• processamento che avviene in due fasi:
• prima parte: quello che accade fisiologicamente è che cd1 viene sintetizzata a livello
endoplasmico, legando un lipide endogeno. legato questo glicolipide va sulla membrana.
• il complesso glicolipide-cd1 è altamente instabile, cioè tendono a dissociarsi rapidamente: la
molecola è così instabile che il complesso si divide. cd1 viene riciclata attraverso AP2 e AP3,
dentro degli endosomi, e viene quindi condotta in un lisosoma. può capitare che non tutto il
glicolipide si sia dissociato, e cd1 arrivi al lisosoma con una porzione di glicolipide endogeno
ancora legato.
• seconda parte: all'interno del lisosoma una molecola chiamata saposina (nelle mhc questa
funzione è data da HLACM) toglie il glicolipide endogeno, ed inserisce nella tasca un
glicolipide esogeno, proveniente da un microrganismo.
• cd1 va di nuovo esposto sulla membrana in attesa di un legame con un linfocita t a-b DN.
• NKT dopo il legame produce citochine e uccide.
____
14
linfociti
gamma-delta
____
• molti batteri usano la via del desossixilulosio fosfato (ciclo di romer) che porta alla sintesi di
colesterolo e sostanze simili, isopentanil pirofosfato come sotanza finale.
• che caratteristiche hanno questi prodotti intermetdi? sono molecole che contengono fosforo. i
linfociti gamma-delta riconoscono qiundi fosfo-antigeni.
• I LINFOTICI GAMMA DELTA NON RICONOSCONO LE PROTEINE DA SHOCK
• possiamo modulare la produzione di isopentanil pirofosfato attraverso l'uso di farmaci: le statine.
• le statine sono farmaci di recente introduzione, e sono gruppi di molecole usate nelle gravi forme
di ipercolesterolemia e grave obesità: bloccano la sintesi di colesterolo, quando la dieta non può
più agire.
• gli alti livelli di colesterolo conferiscono gravi rischi di ictus infarti etc.
• le statine bloccano il ciclo dell'acido mevalonico, attraverso l'inibizione dell'idrossimetilglutil
coenzima a reduttasi (HMGC reduttasi), e quindi la sintesi di fosfoantigeni.
• come faccio ad auentare la concentrazione di intermedi di reazione? per aumentare la sintesi di
isopentanil pirofosfato possono essere usati dei farmaci detti bifosfonati (usati nell'osteoporosi o
in casi di particolari tumori del tessuto osseo).
• l'isopentanilpirofosfato è prodotto attraverso la via dell'acido mevalonico. dato che i linfociti
gammadelta vengono attivate da fosfoantigeni, e le nostre cellule producono fosfoantigeni, può
crearsi una risposta autoimmunitaria. ma ciò non avviene. perchè?
• il linfocita gamma-delta tollera il self ma non il nonself. come fa a discriminare
l'isopentanilpirofosfato self da quello non self?
• immaginiamo un macrofago infettato da un microrganismo intracellulare. cosa accade?
• questa cellula produce fisiologicamente fosfoantigeni. se la cellula viene infettata produce
molti fosfoantigeni in più, perchè deve produrre i suoi fosfoantigeni, ma anche quelli del
microrganismo infettante.
• a differenza del ciclo dell'acido mevalonico, processo utilizzato fisiologicamente nelle cellule, nel
ciclo di romer si produce un altro fosfoantigene molto attivo biologicamente:
3-formilbutilpirofosfato
• il linfocita gamma-delta discrimina una cellula infettata da una normale a causa della
quantità e della quantità di fosfoantigeni sintetizzati e quindi presentati, che deve
raggiungere una soglia tale da attivare il linfocita gamma-delta. il segnale principale è quindi
l'entità di della segnalazione.
• come può una cellula aumentare i suoi fosfoantigeni? durante infezione da HIV la via del acido
mevalonico viene incrementata notevolmente. la quantità di fosfoantigeni cellulari sarà quindi
aumentata, e potranno attivare i linfociti gamma-delta.
• anche nella proliferazione tumorale. una cellula tumorale presenta una grande incrementazione
del ciclo dell'acido mevalonico.
• che funzioni hanno i linfociti gamma-delta? producono citochine e hanno attività
citotossiche proprio come NKT
____
15
linfocita helper generalità
____
• 1984: vengono scoperti due tipi di helper: T helper 1 e 2.
• distinguiamo due tipi di risposta immuntiratia: umoral, dominata dagli anticorpi, e
cellulomediata, dominata dalla presenza di cellule, in particolar modo da macrofagi.
• l'osservazione era che quando si sviluppa una risposta anticorpale non si sviluppa mai una
risposta cellulo mediata e viceversa.
• dato che entrambe prevedono la presenza di un cd4, com'è possibile che possa mediare entrambe
le risposte? e perche una non fa creare l'altra?
• la scoperta dei linfociti t helper 1 e 2.
• t helper 1 producono interferone gamma, e i TH2 producono altri tipi di citochine, cioè IL4, IL5,
IL10, IL13. queste 4 citochine sono prodotte selettivamente solo da th2. i th1 producono interferone
gamma, che non è prodotto da th2. queste due popolazione sono distinguibili solo dalle citochine
che producono.
• il gamma interferone è il piu potente attivatore dei macrofagi, e ne potenzia tutte le attività, in
particolare l'ultima delle funzioni del macrofago: l'attività citotossica.
• IL4: promuove la differenziazione e l'attivazione dei linfociti b (che producono anticorpi)
• IL5: fattore di differenziazione che agisce nell'emopoiesi nel midollo osseo, induce una cellula
staminale a differenziarsi in un eosinofilo
• IL13: è una citochina che determina la produzione di un tipo di anticorpo particolare,( IgE) che in
primavera può creare problemi di salute, come salute, tosse lacrimazione: allergia.
• i th2 mediano in generale una risposta anticorpale, in dettaglio una risposta di tipo allergico.
• questo tipo di risposta è importante contro infezioni da parassiti, degli elminti. il dazio va
comunque pagato, perchè questa risposta estremamente importante purtroppo in certi individui è
responsabile di patologie.
• la risposta igE mediata è sempre la stessa, che alcune volte può risultare dannosa.
• il fatto che queste due popolazioni producano citochine differenti in maniera esclusiva ci spiega
perchè medino delle risposte differenti.
• perchè non agiscono insieme? una disattiva l'altra, cioè lo sviluppo di una potrebbe causare
l'inibizione dell'altra. questo meccanismo di inibizione può dipendere da linfociti che producono
inibitori: alcune citochine potrebbero inibire altri linfociti
• IL10: non attiva eosinofili, non rilascia anticorpi MA inibisce i linfociti TH1. li inibisce talmente
bene tanto che vinene utilizzata nel trattamento di malattie causate da linfociti th1.
• i linfociti th1 invece devono produrre interleuchine che inibiscono a loro volta i th2. l'interferone
gamma, da un lato potenzia l'attività dei macrofagi, dall'altro inibisce lo sviluppo di linfociti
t-helper 2.
• la produzione di citochine diverse ci spiega perchè mediano rispost immunitarie diverse e come
mai queste due popolazioni si inibiscano a vicenda.
• 2012: si è scoperto che le popolazioni di linfociti sono distinguibili, oltre che per la
produzione di citochine diverse, anche per l'espressione di particolari recettori:
• i linfociti th1 esprimo classicamente ccr5 e cxcr3 che riconscono chemiochine infiammatorie
prodotte dai macrofagi.
• i th2 esprimo un recettore ccr3 che lega una chemiochina detta eotassina, prodotta dai
mastociti. si chiama eotassina perchè richiama si eosinofili. il recettore per l'eotassina è espresso
solo dagli eosinofili e dai th2.
• i linfociti th17 esprime un recettore detto ccr6, che lega una chemiochina detta ccl20, produtta
costitutivamente dalle cellule dei plessi corioidei. questo dimostra che i th17 sono coinvolti
nella sclerosi multipla. gli unici linfociti t-helper che riescono ad attraversare per chemiotassi la
barriera ematoencefalica sono proprio i th17 che vengono attratti da ccl20 che si lega a ccr6. li il
th17 interagisce con cellule di tipo macrofagico, le cellule della glia, che se stimolate richiamano i
neutrofili.i neutrofili iniziano il processo infiammatorio. il processo infiammatorio indotto
produce demielinizzazione.
____
16
linfociti helper particolarità
____
• 2006: viene scoperto TH17: produce una sola citochina, IL17, dalla quale prende il nome.
• viene scoperto in un modello sperimentale di malattia, e successivamente viene scoperta la
funzione di questo TH17. mediano una risposta che prevede un intervento della popolazione di
globuli bianchi che sono i granulociti polimorfonucleati neutrofili. questi sono importanti nella
risposta nei confronti di batteri extracellulari (funghi, stafilococchi, streptococchi etc)
• per un batterio intracellulare è ottimale la risposta th1, per un parassita, un elmite è utile la
risposta th2, e per un batterio extracellulare è ottimale th17. esistono queste varianti perchè
l'organismo è in grado di fornire la migliore risposta possibile contro una infezione. ricordiamo
che una risposta inibisce l'altra.
• le citochine influenzano l'indirizzazione di un linfocita vergine verso una polarizzazione th1 o th2
o th17. quali citochine? chi le produce?
• le citochine sono fondamentali per polarizzare un linfocita cd4 naive in un th:
• se deve diventare th1 occorre una citochina chiamata interleuchina 12. questa citochina, come
anche le altre, ha un tempo di azione ristretto, perchè si deve svolgere in una finestra temporale
molto piccola: lecitochine hanno la capacità di determinare la differenziazione a condizione che
intervengano entro le 4-6 ore dalla stimolazione del linfocita t da parte del complesso
mhc2-peptide processato.
• se deve diventare th2 occorre l'interleuchina 4;
• se sono presenti interlueuchina 6 e TGF-Beta (trasforming growth factor, che è un fattore di
crescita fibroblastico) si sviluppera un th17. sono coinvolte altre citochine, ma basta elencare
queste due.
• chi produce queste citochine?
• IL12, TGF-Beta e IL6 proverranno dalle cellule dendritiche;
• anche i linfociti t producono IL4, non vanno nei linfonodi, e non hanno ruolo differenziativo nei
confronti di th2. per quanto riguarda IL4 che fa evolvere i th2, è prodotta vi sono due ipotesi:
• la prima è che IL4 che provenga dallo stesso linfocita t, che permette la sua polarizzazione a
linfocita th2;
• la seconda ipotesi sviluppata dopo il 2009 prevede l'intervento di molte cellule, anche del
basofilo, e si presenta molto complessa:
• cosa accade quando un parassita infetta la mucosa, o un allergene penetra attraverso le vie
respiratorie?
• accade che l'allergene va a stimolare le cellule epiteliali, che producono alcune citochine, 3 in
particolare: IL25, IL33, TSLP (linfopoietina timica stromale, è una citochina prodotta anche dalle
cellule stromali del timo). la cellula epiteliale quindi svolge, oltre che la funzione di barriera,
l'indirizzazione di una risposta immunitaria verso una via piuttosto che un'altra.
• queste tre citochine svolgono tante funzioni, ma ce ne interessano due: inibiscono nella cellula
dendritica la produzione di IL12; nel momento in cui la dendritica processa e lega l'antigene a
mhc2, e esprime ccr7, dirigendosi alla paracorticale del linfonodo. arriva al linfonodo senza
produrre IL12, e riuscirà a far differenziare un linfocita t in tutti i suoi sottogruppi MENO CHE NEL
TH1.
• QUESTE TRE CITOCHINE FANNO ESPRIMERE AL BASOFILO INTERLEUCHINA4, CCR7 E MHC2.
____
17
linfociti helper particolarità
____
popolazioni di
t-helper new entry
____
• Quando viene indotto a produrre ccr7 il basofilo si dirige per chemiotassi nel linfonodo. e la
produzione di IL4 fa polarizzare la risposta verso th2. ecco perchè un allergene o un parassita
inducono risposta th2.
• si è scoperto recentemente che il basofilo, in oltre, ha una funzione piu diretta: non solo produce
IL4, ma quando è stimolato dalle citochine delle cellule epiteliali epsrime MHC-2; processa e
presenta quindi l'antigene ai linfociti, senza bisogno della cellula dendritica. il basofilo stesso più
attivare e fornire segnali costimolatori al linfocita t naive, produrre IL4 e far si che si differenzi in
th2. il basofilo quindi può avere una funzione che prescinde dalla presenza di una cellula
dendritica.
• la cellula dendritica può produrre diversi tipi di citochine (IL12 o 6, ad esempio). come fa la cellula
dendritica a capire quale IL deve esprimere?
• grazie ai recettori per profili molecolari Toll-like: questi sono presenti in 9-10 varietà; sappiamo
che il legame di una molecola ad un recettore tlr fa cambiare la porzione intracellulare del
recettore, che induce innesco di segnali che provocano tantissime azioni, tra cui, la produzione di
determinate citochine.
• alcuni recettori funzionano in coppia (come tlr2), i legami a certi recettori inducono certi tipi di
risposta, a seconda del tlr legato si può avere una risposta piuttosto che un altra, quindi
produzione di una citochina piuttosto che un altra. è quindi il microrganismo infestante che decide
come deve essere eliminato.
• addirittura lo stesso microrganismo può presentarsi in forme diverse, vedi i funghi dimorfi: le ife
e i lieviti, che vengono eliminati con due tipi di risposte completamente diversi. nel caso dei lieviti
ci serve gamma-interferone, quindi il macrofago e il linfocita th1. per eliminare un ifa (muffe) ci
serve IL17, ergo ci serve il neutrofilo e th17. quindi parliamo di un microrganismo che ha bisogno
di due tipi di risposta per essere eliminato. quando le cellule dendritiche vengono infettate da
lieviti producono IL12; quando viene infettata con ifa la c. dendritica produce una interleuchina
(consideriamo laIL 6) e TGF-beta. perche le cellule dedritiche producono diverse risposte? perchè
ife e lieviti legano recettori toll-like diversi.
• 2012: oggi sappiamo che esistono almeno 6 linfociti t helper
____
• th9 e th22
• th9 producono IL9, e th22 producono IL22. quindi come il th17 prendono il nome dall'IL prodotta.
• funzione di th9: non ben definita, ma dal punto di vista funzionale sono piu o meno simili ai
linfociti th2. quindi mediano risposte di tipo allergico. ad esempio alcune forme di asma bronchiale
si ritiene che siano dipendenti piu da una risposta th9 che da una risposta th2.
• funzione di th22: IL22 ripristina l'integrita degli epiteli e ne mantiene l'omeostasi. stimola anche
le cellule epiteliali a produrre peptidi antibatterici, come le defensine.
• queste cellule sono state descritte come resposabili di una malattia, ma poi si è scoperto che
ripristinano l'epitelio. per tanti anni si è sostenuto che th22 siano responsabili della psoriasi. (è la
faccia negativa dei th22, come i th17 causano sclerosi multipla, come i th2 inducono reazioni
allergiche indesiderate)
____
18
la produzione di
igE
____
linfociti cd8
citotossici
____
• il ruolo di ige e degli eosinofili agiscono in ambito allergico. cosa succede quando un linfocita b
produce antigeni igE? cosa fanno ige?
• ige si vanno a legare nei tessuti a delle cellule con recettori ad altissima affinità per questi
anticorpi: i mastociti (equivalenti dei tessuti dei macrofagi del sangue).
• l'antigene è legato dall'anticorpo e l'anticorpo si lega a l mastocita. nel momento in cui
l'anticorpo si lega al mastocita: il mastocita produce delle sostanza
• Istamina, e altri mediatori (eparina, leucotrieni che derivano dal metabolismo dell'acido
arachidonico). l'istamina e altri mediatori determinano la contrazione della muscolatura liscia.
come può esserci utile?
• in caso di TENIA, che è un parassita, che può raggiungere i 12 metri. qualcuno dice che i granuli
degli eosinofili possono uccidere 14 metri di individuo. come viene in realtà la tenia?
• viene espulso.attraverso la contrazione della muscolatura liscia, e movimenti peristaltici la tenia
viene espulsa. questi mediatori aumentono la contrattilità della muscolatura liscia intestinale.
questo spasmo che è utile nell'intestino a eliminare la tenia, nel bronco chiude il calibro del bronco
stesso, causando fame d'aria e asma. quindi questa contrazione è utile in un caso, ma comporta
evidenti conseguenze un pò spiacevoli.
• la cronicizzazione delle allergie è causato dagli eosinofili, che causano quei fenomeni, nel caso di
asma, che si chiamano asma cronico-ostruttiva.
• questo è un problema che si pone quando la risposta si protrae per troppo tempo ed è mediata da
IgE, può qiundi causare problemi ai tessuti a prescindere anche dopo la fine della risposta.
• familiarità: la componente genetica prevede la partecipazione di geni che contribuiscono
minimamente alla patogenesi della malattia. la familiarità deriva dal decorso di più geni.
____
• classe molto rappresentata nel sangue epriferico e negli organi linfoidi, costituiscono il 30-35% di
tutta la popolazione linfocitica. hanno una azione diretta, perchè possono riconoscre un bersaglio
e ucciderlo.
• tramite il suo recettore il linfocita cd8 può riconoscere il complesso peptide-mhc1, e provvede
alla uccisione della cellula che lo presenta.
• l'attività citotossica è importante per le cellule infettate da virus o tumorali: mhc1 infatti
presenta generalmente peptidi processati nel citosol, derivanti da organismi intracellulari
obbligati.
• il modo in cui viene uccisa una cellula da in linfocita t è importante.
____
19
meccanismo
principale di
uccisione di tutti i
citotossici
____
• due modalità con cui una cellula può morire:
• la cellula può morire e la membrana può rimanere intatta (apoptosi), oppure la membrana può
perdere integrità e il suo contenuto uscire fuori (necrosi). il secondo caso è un caso deleterio,
perhcè questo meccanismo favorisce la diffusione e quindi l'infezione.
• è importante che la cellula muoia per apoptosi, ed è importane anche che muoia l'organismo
all'interno della cellula.
• esistono due vie principali di apoptosi: intrinseca ed estrinseca
• apoptosi intrinseca avviene attraverso recettori, domini di morte
• apoptosi estrinseca, avviene attraverso il mitocondrio
• le due vie, almeno nelle prime fasi sono mediate da enzimi detti caspasi (rispettivamente caspasi
8 e 9).
• i meccanismi dell'apoptosi sono diversi:
• uno consiste nell'interazione tra recettore e ligando (Fasl e Fas).il principale meccanismo prevede
il rilascio di molecole da parte dei granuli.
• nel momento in cui un linfocita citotossico interagisce con la cellula bersaglio, i granuli del
linfocita si contentrano nel punto di contatto tra il punto di contatto tra cellula e linfocita (detta
erroneamente sinapsi).
• i granuli svuotano all'esterno il contenuto.
• il contenuto consiste in una serie di molecole, due delle quali sono essenziali : perforina e
granizime.
• la perforina fa uno pseudoporo, polimerizzando sulla membrana della cellula bersaglio, e
formando una specie di imbuto grazie al quale i granzimi entrano nella cellula bersaglio. questi
attivano nella cellula bersaglio le caspasi che inducono l'apoptosi.
• nei granuli è contenuta anche un'altra molecola: granulisina, questa molecola non induce
apoptosi nella cellula bersaglio, ma è un potentissimo antimicrobico, in grado di eliminare virus,
batteri, micobatteri, parassiti.
• a questo punto abbiamo ottenuto l'uccisione del microrganismo intracellulare e della cellula per
apoptosi.
• il meccanismo di esocitosi di granuli è il più importante, seppur non l'unico, dei meccanismi di
uccisione, perchè permette non solo l'uccisione della cellula, ma anche del microrganismo
infestante.
• LA DIFFERENZA TRA UN CD8 E UN NK è CHE IL CD8 DEVE ESSERE STIMOLATO DA UN ANTIGENE
PER DIFFERENZIARSI, DIVIDERSI E ACQUISIRE FUNZIONE CITOTOSSICA: caratteristica
dell'immunità acquisita, caratterizzada da un tempo di latenza, ed una risposta adeguata.
• i granuli del citoplasma si colorano in rosso e sono visibili nel microscopio confocale, si
presentano ampiamente distribuiti nel citoplasma. nel momento in cui un linfocita citotossico lega
una cellula bersaglio, i granuli si accumulano nella "sinapsi". nella microscopia confocale, la cellula
bersaglio in vivo si colora in verde, un colore indice di vitalità, ma dopo l'azione delle capsasi
notiamo che la cellula perde la colorazione particolare della vitalità. il processo di rilascio dei
granuli e dell'uccisione della cellula dura circa 15 minuti.
• il linfocita citotossico muore una volta eseguito il suo compito. muore utilizzando un meccanismo
apoptodico che coinvolge il legame di fas e fasl. una volta uccisa la cellula bersaglio non ci serve
più un linfocita effettore citotossico, basta tenere le cellule della memoria. questi meccanismi
fanno parte dello spegnimento della risposta immunitaria.
• in tutti i tumori avviene un meccanismo di inibizione del fattore citotossico dei linfociti: la cellula bersaglio
NON ESPRIME PIU' MHC1. il linfocita sa riconoscere solo il complesso peptide-mhc1.
____
20
altri meccanismi di
uccisione
____
licenza di uccidere,
a.lanzavecchia nature, 06/1988
____
meccanismo di
attivazione di cd8
da parte di cd4
____
• legame tra fas e fasl, è un meccanismo apoptotico. che differenza c'è tra l'apoptosi indotta da
perforine e quella indotta da legame fas-fasl?
• nel secondo caso vi è attivazione di caspasi, ma non vi è rilascio di granulisina, che non induce
l'uccisione di eventuali microrganismi infestanti. quindi è un meccanismo utile per le cellule
tumorali, che non presentano parassiti interni, ma non per le cellule che presentano
microrganismi all'interno.
• recettore per il TNF, Tumor Necrosis Factor. in realtà non si tratta di necrosi ma di apoptosi.
questo recettore è prodotto dai linfociti citotossici, esposto sulla membrana. questo lega un
recettore che è rappresentato da una molecola esposta sulla membrana di una cellula tumorale ,
inducendone la morte per apoptosi dopo l'attivazione di caspasi 8.
• recettore per trail e ligando trail, inducono apoptosi tramite atticazione di caspasi 8. sembra
che l'uccisione di cellule tumorali del sangue o della linea mieloide sia in gran parte mediata da
trail e dal suo recettore.
• un altro sistema prevede che il ligando tweek leghi lo stesso recettore di trail, che induce
apoptosi.
• tutti i meccanismi non agiscono singolarmente, ma possono agire coordinatamente.
____
• un articolo di commento a 3 articoli comparsi sullo stesso numero di nature. questo articolo
sconvolse il modo di immaginare il modo di attivazione del linfocita t citotossico nella corticale del
linfonodo.
• fino ad allora si pensaca che nella corticale del linfonodo una c. dendritica interagisce
contemporaneamente con un linfocita cd8 e uno cd4 specifici per un certo antigene, attivando
entrambi.
• a questo punto il linfocita cd4 avrebbe prodotto una citochina (IL2), fattore di proliferazione di
CD8, che non era in grado di produrre IL2.
• questo fenomeno è detto cooperazione T-T, ed è un esempio della funzione di aiuto dei linfocidi
cd4 helper.
• Lanzavecchia si basò su un'osservazione logica: quante probabilità vi sono che 3 cellule
interagiscano contemporaneamente e nello stesso punto preciso di un linfonodo? è estremamente
improbabile.
• la interazione e l'aiuto da parte di cd4 a cd8 non avviene direttamente tra i due linfociti, ma è
mediato dalla cellula dendritica, perchè nel frattempo si è scoperto che il cd8 è in grado di
produrre IL2, e ne produce tanta quanta gliene serve per attivarsi.
____
• l'interazione per l'attivazione di cd4 servono un segnale costimolatorio, dato da interazione di
cd80-86 con il recettore della dendritica, e un segnale principale, che è il legame con il complesso
mhc2.
• una delle altre interazioni importanti convolge cd40 e il suo ligando. questa interazione non è
utile per il linfocita t, ma è utile per la cellula dendritica, che potenzia massivamente il suo
livello di attivazione. questa attivazione massiva fa si che vengano prodotte molte più citochine, e
l'espressione di membrana viene aumentata.
• questa cellula dendritica potenziata, a questo punto, può direttamente attivare un linfocita cd8:
non vi è NESSUNA INTERAZIONE TRA LINFOCITI CD4 E CD8.
• la cellula dendritica non produce IL2, è prodotta direttametnte dal linfocita cd8. anche le
citochine prodotte dalla cellula dendritica servono a stimolare il cd8.
• quindi la cosiddetta interazione TT non è proprio una interazione tra due linfociti t. la licenza di
uccidere consiste nel fatto che è la cellula dendritica, che viene autorizzata dal CD4 a conferire
potere di uccidere al CD8.
• la cellula dendritica può anche essere attivata massimalmente SENZA INTERAZIONE CON CD4.
• conosciamo questo meccanismo a causa di una malattia: ipogammaglobulinemia con iper-IgM:
soggetti affetti da questa patologia non producono altre immunoglobuline oltre IgM, e sono
deficitari per i ligandi di cd40. mancando la possibiltà di instaurare un legame tra cd4 e la cellula
dendritica dendritica non doveva essere possibile attivare il linfocita cd8: ma questa attivazione
si verifica comunque. come?
• alcune microrganismi possono attivare la cellula dendritica in maniera massimale, quando
interagiscono con essa mediante specifici recettori di membrana TLR.
• questi microrganismi, che legano certe combinazioni di TLR, possono indurre iperattivazione
della cellula dendritica, del tutto simile all'attivazione data da un cd4.
____
21
linfocita natural
killer
____
• parecchi microganismi, e anche le cellule tumorali in maniera costante, sviluppano strategie per
sfuggire alla risposta immunitaria, in particolar modo per sfuggire alla risposta citotossica che è la
migliore risposta per eliminarla.
• il piu comune dei meccanismi che utilizzano sia i virus che altri organismi adottano è quello di
bloccare l'espressione di mhc di classe 1, e dato che un linfocita cd8 riconosce solo mhc1 il linfocita
non può essere riconosciuta. in questi casi interviene un alternativa del sistema immunitario.
• nella condizione in cui il linfocita citotossico non può piu riconoscere la cellula bersaglio
interviene la popolazione di linfociti natural killer.
• come fa un linfocita natural killer a riconoscere una cellula infettata da un virus?
• i recettori natural killer non hanno recettori specifici per l'antigene, non hanno i tcr (differenza
con i linfociti t) e neanche un immunoglobulina di membrana, non vengono selezionati
clonalmente non subiscono selezione positiva o negativa.
• dopo la maturazione nel midollo osseo queste cellule migrano in periferia con capacità citotossica
gia acquisita, senza bisogno di selezione. se appena usciti dal midollo trovano cellule infettate sono
subito in grado di ucciderle.
• non hanno neanche recettori per profili molecolari clonalmente distribuiti. come fanno allora a
discriminare il self dal non-self?
____
22
ipotesi del missing
self
____
• la scoperta di come un linfotica nk uccide un bersaglio è stata una scoperta causale e si deve ad un
signore svedese chiamato Cares Kerre. lui era un giovane dottorando, ed era all'ultimo anno di
dottorato di ricerca, ed aveva iniziato a lavorare con i mezzi disponibili intorno i primi anni 80 sui
linfociti natural killer. un sabato mattina del 81 andava a lavoro. era sua consietudine comprare il
giornale e leggerlo mentre andava in giro per le strade di stoccolma. mentre camminava sotto la
pioggia lesse del ritrovamento di un sottomarino alleato, risalente alla 2 guerra mondiale. come
hanno fatto a capire che il sottomarino era alleato e non tedesco? avrà pensato che mancando
simboli tedeschi o qualcosa che lo identificasse come tedesco avevano capito che era alleato.
impose questo ragionamento anche per i linfociti.
• giunto in laboratorio fece un analisi su testi per capire quali cellule fossero uccise e quali fossero
risparmiate. notò che ciò che differenziava queste due cellule era l'espressione di mhc: quelle che
non lo esprimevano erano uccise dai nk, quelle che resistevano esprimevano mhc.
• ipotizzo che la condizione affinchè un lnk possa uccidere una cellula sia la mancanza di mhc1.
• se è vero che un lnk per uccidere un bersaglio deve o non deve piu vedere su questa la molecola di
classe prima allora vuol dire che tutte le cellule che mancano dell'espressione della molecola di
classe prima, sia infettate sia non infeettate, debbano essere uccise. quindi se questa ipotesi fosse
stata vera non dovremmo avere globuli rossi (non esprimono mhc1, non sono nucleati come le
piastrine).
• come mai non è così?
• due fratelli ricercatori di genova, lorenzo e alessandro moretta, scoprono sui linfoci natural
killer due gruppi di recettori. un gruppo di recettori si chiama kar (killer activating receptor) e
l'altro gruppo di recettori espressi dai natural killer sono chiamati kir (killer inibiting
receptors).
• l'unica condizione affinchè un linfocita possa uccire le cellule bersaglio è che il recettore
attivatorio leghi qualcosa.
• un linfocita può uccidere solo se kir non è legato e kar lega qualcosa.
• kir lega mhc1.
• affinchè si determini la citotossicita dei natural killer è che la cellula non esprima piu la molecola
di classe 1. questa è una condizione necessaria ma non sufficiente. l'altra condizione è che kar leghi
sulla cellula bersaglio un ligando composto da un gruppo di molecole indicate genericamente come
molecole da stress, che vengono tipicamente espresse nel momento in cui si verificano due
condizioni: o una trasformazione neoplastica o una infezione.
• in laboratorio per indurre l'espressione di proteine da stress (shock proteins) si usa lo stress
termico. bisogna portare una cellula ad una temperatura di 42-46 gradi e quella cellula diventa
stressata.
• in vivo, le condizioni di stress sono le infezioni e le trasformazioni neoplastiche.
• le cellule come il globulo rosso vengono risparmiate perche è vero che manca mhc1, ma la cosa
essenziale è che non vengono espresse molecole da stress, in modo che non possa avenire il legame
con car per attivare la citotossicità.
• nel momento in cui abbiamo la presenza di molecole da stress e di molecole di classe prima non avremo
attività citotossica.
• quando entrambi i segnali sono presenti, sia quello inibitorio sia quello attivatorio prevale il
segnale inibitorio.
• la condizione essenziale affinchè inizi la citotossicità è che manchi il segnale inibitorio e sia
presente il segnale attivatorio.
• questo ci spiega come fa un linfocita natural killer a distinguere tra una cellula self e una cellula
non self, e come fa a rispasrmiare una cellula self che non esprime molecole di classe prima.
• l'ipotesi di cares kerre era corretta ma non completamento. l'ipotesi del missing self non era
basata su dati sperimentali, era una semplice intuizione.in onore di cares kerre il meccanismo con
cui un linfocita acquisisce citotossicità è ancora denominato meccanismo dell'ipotesi del missing
self.
• un'ipotesi piu moderna integra quella di kerre dicendo che se prevalgono segnali inibitori
prevale la non citotossicità, se prevalgono segnali attivatori agisce la citotossicità.
• il linfocita natural killer, che si trova sempre nei tessuti periferici, migra attivato da chemiochine
prodotte dalla cellula infettata
____
23
recettori attivatori
____
recettori inibitori
____
trapianto di
midollo osseo
____
• il piu importante dei recettori kar è NKG2D. questo ha due tipi di ligandi che sono chiamati MICa
e MICb e ULBP.
• MICa e MICb sono due proteine da stress tipicamente espresse a densità molto bassa dalle cellule
epiteliali dell'intestino, la cui espressione aumenta in caso di trasformazione neoplastica. quinsi
sono espresse dalle cellule tumorali. questi due tipi di proteine non appartengono alle shock
proteins, ma usano lo stesso promotore, e quindi vengono espresse in condizioni di stressi.
• ULBP sono un gruppo di 4 proteine espresse da cellule di tumori emopoietici, ma non da cellule
normali. l'espressione di queste proteine è anche indotta da un virus chiamato citomegalovirus.
una cellula infettata da questo virus viene indotta ad esprimere le proteine ULBP (ul16 binding
protein; UL16 è una proteina di citomegalovirus che induce l'espressione di ulbp).
____
• i ligandi della cellula bersaglio compatibili con i recettori KIR inibiscono la citotossicità.
• i recettori inibitori legano mhc1. in realtà non ne legano una singola, tranne poche eccezioni.
legano una serie di mhc1. alcuni sembrano avere una specificità un pò piu particolare.
• esempio: questo recettore kir lega due molecoledi classe 1 che chiamiamo a3 e a1. se una cellula
bersaglio, invece di esprimere recettori a3 e a1 esprimesse a8 e a9, cosa succede?
• se il complesso mhc1 espresso sulla cellula stressata è diverso da quello che riconosce il linfocita,
il linfocita esprime citotossicità?
• si, il linfocita esprime citotossicità perchè la cellula è stressata, e kar si può legare ai suoi ligandi,
ma non può avvenire il legame di kir, che non è idoneo al legame con a8 e a9.
• se io non volessi la citotossicità la cellula bersaglio dovrebbe esprimere a3 e a1.
• se voglio inibire la citotssicità, la cellula bersaglio deve esprimere molecole mhc1 compatibili con
i recettori kir. se vengono espresse molecole diverse non compatibili con kir non possono essere
riconosciute, e kir non può legare e non può inibire la citotossicità.
____
• si esegue in casi in cui vi sia una patologia di natura neoplastica delle cellule della serie mieloide.
come si fa?
• si preleva midollo da un donatore e si traspone nel ricevente.normalmente al ricevente, durante il
trapianto non si somministrano mai cellule staminali pure, ma si aggiunge qualcosa alle cellule
staminali. si aggiungono linfociti t maturi del donatore.quello che il ricevente riceve in realtà sono
cellule staminali che vanno a ripopolare il modollo e il sangue del ricevente, e anche linfociti t
maturi del donatore. perchè?
• per un fenomeno che si chiama grafts versus leuchemia (reazione contro le cellule leucemiche).
• si deve però distruggere il midollo del ricevente: sia le cellule tumorali che sane. il midollo deve
essere ripopolato dalle cellule staminali del donatore. è probabile però che con l'uso di farmaci la
pulitura del midollo non sia del tutto efficacie, e che residuino ancora nel midollo delle cellule
leucemiche. il linfocita t maturo del donatore, portato sul ricevente le riconosce come non self e le
uccide.
• il problema però è che i linfociti t maturi del donatore da un lato aiutano l'eliminazione delle
cellule leucemiche del ricevente, dall'altro lato causano una malattia che si chiama grafts versus
host (reazione verso l'ospite). il grafts versus host ha una incidenza del 30% dei pazienti che
subiscono trapianto di midollo osseo con HLA identici; quindi anche in presenza di una totale
identità è elevata la posibiltà che insorgano grafts versus host. (per attenuare eventuali sintomi da
grafts versus host sono utilizzati immunosoppressori e corticosteroidi).
• perchè vi sono questi grafts versus host? perchè oltre HLA esistono molti complessi di
istocompatibilità minori, e sono questi i responsabili di grafts versus host.
• le staminali del donatore devono avere due caratteristiche fondamentali:
• devono essere totalmente compatibili dal punto di vista dei mhc: il donatore ideale è un
fratello gemello. secondo le leggi di mendel la percentuale di compatibilità tra due fratelli non
gemelli è il 25%.
• nel caso in cui non via compatibilità tra i fratelli vi sono i registri di donatori di midollo, per avere
una probabilità di trovare un soggetto compatibile nei registri dei donatori.
• se non si trova un soggetto compatibile vi è sempre la possibilità dell'autotrapianto: si prende il
midollo dello stesso paziente, si cerca di isolare le staminali e vengono trapiantate nello stesso
paziente. però le probabilità di successo dell'autotrapianto sono molto basse: 20-25% di probabilità
di successo.
• fino al 2002 se non funzionava neanche questo metodo non vi erano altri modi di ripristinare la
popolazione delle staminali di un soggetto.
____
24
trapianto di
midollo osseo in
funzione di
linfociti natural
killer
____
separazione
immunomagnetica
____
• nel 2002 fu pubblicato su Science dal gruppo di ricerca di Andrea Velardi un articolo che
trattava del trapianto di midollo osseo in funzione dei linfociti natural killer.
• negli anni precedenti, in cui non era possibile trovare un donatore di midollo per pazienti con
leucemia, nell'ambito familiare, e non c'era possibilità di autotrapianto o trapianto da
"non-correlato", essi tentarono trapianto da genitori o il padre o la madre.
• il padre o la madre rispetto al figlio sono uguali solo al 50% per quanto riguarda mhc. su 12
molecole 6 sono completamente differenti. ci si sarebbe dovuti immaginare grafts versus host a
mai finire, dato che già al massimo della compatibilità si ha un 30% di insorgenza; rigetto, recidiva
ecc..
• da un analisi retrospettiva su 34 pazienti, in tutti quei casi in cui donatore e rivecente non
solo differivano per i gruppi di istocompatibilità, ma pure per i kir, quindi avevano un
doppio livello di incompatibilità, mostravano 0% di percentuale di rigetto e 0% di percentuale di
grafts versus host. recidiva a 5 anni probabilità 0%.
• ci si aspetta che si verifichi tra un donatore e un ricevente totalmente identici, ma questo si
verifica tra un donatore un ricevente compatibili per metà delle molecole di istocompatibilità e
non compatibili per metà dei recettori kir: quindi un doppio livello di non compatibilità determina
l'ideale del trapianto di midollo.
• oggi per un trapianto di midollo si cercano soggetti compatibili per metà delle molecole di
istocompatibilità e per i kir.
• dal punto di vista pratico, i linfociti natural killer iniziarono ad acqusire importanza nei trapianti.
• perche in presenza di doppia incompatibilità non abbiamo rigetto, grafts versus host e recidiva
dopo 5 anni? qui entrano in gioco i recettori kir e i recettori kar.
• il loro ruolo gira soprattutto intorno al fatto che il legame di un recettore kir con una
molecola diversa da quella che è istruito a legare su una cellula bersaglio equivale a non
legare nulla.
• per poter uccidere, un natural killer deve avere 2 condizioni: deve trovare sulla cellula bersaglio
delle molecole da stress espresse sulla superficie, e deve mancare l'espressione mhc1, o deve
esserci un mhc1 non riconoscibile da kir.
• nel caso della donazione dai genitori abbiamo diversità dei kir, e quindi sicuramente diversità di
mhc1.
• quando trapiantiamo staminali di donatore nel ricevente, che era stato trattato con farmaci per
eliminare tutto quanto, le cellule del donatore popolano il midollo del ricevente e comincia a
differenziare, dando origine a tutte le cellule, compresi i natural killer.
• i natural killer sono quindi di provenienza del donatore.
• perchè non abbiamo recidiva? i linfociti che trovano nel donatore delle cellule leucemiche che i
farmaci non sono riusciti ad eliminare, e che possono causare recidiva, riconoscono la cellula come
una cellula stressata, inducendo il legame di kar. PERO non può legarsi kir, perchè la cellula
leucemica non esprime più mhc1; ed ammesso che lo esprima, esprimerà un mhc1 differente
da quello riconoscibile da kir del donatore, e viene quindi uccisa.
• perchè non si verifica grafts versus host? questo trapianto viene effettuato con cellule staminali
pure, senza linfociti t del donatore. questi linfociti, essendo già maturi, avrebbero riconosciuto
come non-self delle cellule sane dell'ospite.
• dato che i linfociti t che nascono dalle staminali trapiantate maturano nel timo, lì
imparano a riconoscere come self l'organismo ospite tramite i metodi già studiati.. l'mhc1
espresso dalle cellule sane dell'ospite è pur sempre diverso da quello riconoscibile da kir, quindi si
esclude un legame che induca inibizione della citotossicità. la citotossicità però non può essere
indotta perchè le cellule sane, sia dell'ospite che del donatore non presentano le molecole da
stress alle quali si possono legare i kar.
• il trapianto tra individui hla apoidentici e kir incompatibili è la seconda scelta per tutti i tipi di
leucemie (meno che per la mieloide cronica, che è curata con cura molecolare)
____
• come faccio a prendere solo le cellule staminali dal midollo e a scartare tutte le altre?
• le cellule staminali esprimono un recettore chiamato cd34, e devo sfruttare un anticorpo
monoclonale che leghi cd34.
• quindi faccio legare l'anticorpo alle cellule staminali. con la porzione variabile l'anticorpo si lega
a cd34. se nella porzione fissa lego una micro pallina di ferro, ed uso un magnete, posso separare le
cellule staminali.
____
25
citotossicità dei
natural killer
____
popolazioni nk e
linfociti natural
killer "non-killer"
____
aspetti
dell'immunità
innata dei linfociti
natural killer
____
• legame tra fas e fasl, è un meccanismo apoptotico. che differenza c'è tra l'apoptosi indotta da
perforine e quella indotta da legame fas-fasl?
• nel secondo caso vi è attivazione di caspasi, ma non vi è rilascio di granulisina, che non induce
l'uccisione di eventuali microrganismi infestanti. quindi è un meccanismo utile per le cellule
tumorali, che non presentano parassiti interni, ma non per le cellule che presentano
microrganismi all'interno.
• recettore per il TNF, Tumor Necrosis Factor. in realtà non si tratta di necrosi ma di apoptosi.
questo recettore è prodotto dai linfociti citotossici, esposto sulla membrana. questo lega un
recettore che è rappresentato da una molecola esposta sulla membrana di una cellula tumorale ,
inducendone la morte per apoptosi dopo l'attivazione di caspasi 8.
• recettore per trail e ligando trail, inducono apoptosi tramite atticazione di caspasi 8. sembra
che l'uccisione di cellule tumorali del sangue o della linea mieloide sia in gran parte mediata da
trail e dal suo recettore.
• un altro sistema prevede che il ligando tweek leghi lo stesso recettore di trail, che induce
apoptosi.
• tutti i meccanismi non agiscono singolarmente, ma possono agire coordinatamente.
____
• abbiamo gia incontrato linfociti natural killer che non inducono morte cellulare, non inducono
citotossicità, ma hanno altre funzioni.
• queste cellule sono le LTI - linfociti timici induttori.
• queste cellule nel timo interagiscono con le cellule epiteliali della midollare tramite rank e rankl,
e inducono su queste l'espressione di AIRE (vedi sopra).
• un'altra popolazione di natural killer che non uccidono sono dei linfonciti che producono una
interleuchina: interleuchina 22, sono infatti detti linfociti natural killer 22, nk22.
• questa popolazione non è citotossica, e produce il-22, come i linfociti th22, e intervengono nel
mantenimento dell'omeostasi degli epiteli.
• questa popolazoine di linfociti natural killer ha diverse caratteristiche che la distinguono dai
natural killer citotossici:
• intanto questa popolazione non produce costitutivamente il-22. la produzione di il-22 è mediata
dalla produzione di il-23 da parte delle cellule dendritiche. quindi l'infezione di una cellula
dendritica la stimola a produrre il-23, e il-23 stimola il linfocita nk22 a produrre il-22.
• il-22 agisce a livello delle cellule epiteliali mantenendone l'integrità, e induicendo la produzione
di defensine etc.
• l'altra sostanziale differenza è che la maturazione dei nk classici e dei nk22 necessita di fattori di
crescita differenti. la differenziazione di linfociti nk classici nel midollo ha bisogno di il-15,
mentre quella dei nk22 ha bisogno di il-7.
• qiundi in tutto conosciamo 3 popolazioni di nk: classiche, nkLTi e nk22.
____
• date le loro caratteristiche, i linfociti natural killer sono popolazioni linfocitiche che potrebbero
essere assimilabili alla immunità innata, quindi mancherebbero della specificità e della memoria
immunologica.
• è stato recentemente dimostrato che a una prima infezione con un virus in un animale da
esperimenti c'è una risposta nk, che si instaura dopo alcuni giorni, e con una certa lentezza
conduce all'eliminazione della popolazione virale.
• se infettiamo di nuovo l'animale con lo stesso virus, la risposta nk è molto piu veloce: poche ore.
• sono cellule che possono avere comportamento simile alle cellule dell'immunità innata, ma
possono anche dare risposte riconducibili a popolazioni cellulari dotate di memoria immunologica.
• in oltre, i linfociti natural killer uccidono con gli stessi meccanismi che usano cd8.
• usano quindi anche il metodo TNF/recettore di TNF: ciò implica il fatto che anche essi producano
TNF.
• un'altra caratteristica di tutte le popolazoini di linfociti natural killer è la produzione di TNF, una
citochina citotossica antitumorale.
____
26
Linfociti B
____
Maturazione
linfociti B antigene
indipendente
____
• sono una classe di linfociti dotati di recettori clonalmente distribuiti, come i linfociti t.
• i linfociti b presentano il recettore BCR. questo recettore è stato scoperto nel 1984, e non è altro
che un anticorpo.
• quindi il linfocita b utilizza un antiocorpo di membrana per riconoscere antigeni; e in oltre la
cellula b è in grado di produrre e rilasciare in circolo anticorpi in formas solubile.
• il linfocita b non è una cellula terminale: in realtà non è un produttore di anticorpi: una volta
stimolato dal giusto antigene, il linfocita b si espande e da origine a cellule con capacità effettrici di
produrre anticorpi.
• questa cellula è diversa su tutti gli aspetti dal linfocita b, e viene chiamata plasmacellula. la
plasmacellula è la vera fonte di anticorpi.
____
• origina da un precursore che si orienta a linfocita b grazie a citochine IL7, Il15. a differenza dei
linfociti t, i linfociti b completano il loro processo maturativo nel midollo stesso.
• anche se in realtà possono essere distinte due fasi maturative: una antigene dipendente, una
antigene indipendente.
• il primo elemento che possiamo orientativamente ipotizzare che diventerà un linfocita b è il
pro-b-linfocita, dove pro sta per progenitore.
• questa cellula progenitrice non ha nessuna caratteristica di membrana che ci indicherà che
diventerà un linfocita b; possiamo dedurre che è un progenitore dei linfociti b perchè vi è stato un
riarrangiamento V-J delle catene pesanti. questo riarrangiamento può avvenire soltanto in un
lifocita b.
• la tappa successiva è una cellula chiamata pre-b, dove pre sta per precursore. in un pre-b oltre al
riarrangiamento v-j, si è avuto il secondo riarrangiamento v-d-j. quindi l'intera porzione variabile
è disponibile, per cui si forma un trascritto primario, lo splicing, e viene sintetizzata la cantena
pesante mu (la prima catena sintetizzata in un linfocita b).
• Una catena pesante, non associata ad una catena leggera non può andare sulla membrana, e per
questo rimane sulla membrana. per analizare un linfocita b nel midollo basta analizzare la catena
pesante in sede intracitoplasmatica. questo metodo di analisi è essenziale per fini diagnostici.
• durante la maturazione, in maniera simile a cosa accade al linfocita t nel timo, che dopo il
riarrangiamento di beta è stato produttivo, prima di riarrangiare alfa viene usata una catena
pre-t-alfa, che è una catena alfa sostitutiva: il primo recettore formato nel timo è formato dalla
beta vera, e da una catena alfa surrogato, temporanea.
• altrettanto avviene nel linfocita b: nello stato pre-b il linfocita ha solo la catena pesante, e non
può fare un recettore senza la catena leggera, ma riesce a formare un recettore usando la catena
pesante mu, e una catena sostitutiva, creando un recettore detto pre-BCR, composto da una catena
pesante mu, e una leggere sostitutiva (non è ne kappa ne lambda), indicata con la sigla slc
(surrogate light chain, una catena costante senza variabilità).
• contemporaneamente all'espressione di pre-BCR, il linfocita b esprime un altro dimero associato
al recettore chiamato IgAlfa e IgBeta. questo dimero ha la funzione di CD3 nel linfocita t, che è
intimamente associato al recettore di membrana è la struttura che permette la trasduzione di
segnale, che ancora il pre.bcr, essendo immaturo non è in grado di trasdurre.
• (N.b. situazione simile a quella del linfocita t, basta ricordarne una per ricordarle entrambe).
• la tappa successiva è il riarrangiamento delle catene leggere o kappa o lambda, con la formazione
di un bcr composto da una catena pesante mu, e una catena leggera kappa o lambda. a questo
punto il linfocita b è ancora immaturo, è detto appunto linfocita b-immaturo.
• l'ultima tappa della maturazione del linfocita b consiste nell'esposizione di due Ig di membrana:
una IgM e una IgD che hanno la stessa specificità antigenica.
• queste tappe avvengono nel midollo osseo ed è detta maturazione antigene-indipendente
____
27
Maturazione
linfociti B antigene
dipendente
____
meccanismo di
cooperazione tra
linfocita b e
linfocita t
____
• antigene dipendente: il linfocita b non è una cellula terminale. una volta stimolata da un antigene
specifico in un organo linfoide, il l.b si attiva, prolifera espandendosi clonalmente diventanto un
blasto b, cellula molto ricca di citoplasma; alla fine della divisione diventa una plasmacellula, cioè
una cellula deputata alla produzione di anticorpi.
• possiamo definire questo un processo di maturazione? è piu corrtto definirlo differenziazione
• la maturazione del midollo osseo è assolutamente antigene indipendente? il linfocita b non fa
selezione positiva come il linfocita t, ma opera una selezione negativa nel midollo, che è uno dei
meccanismi di induzione di tolleranza nei linfociti b. e siccome avviene nel midollo osseo questa
tolleranza verrà chiamata tolleranza centrale. con quali meccanismi?
• per quanto riguarda l'acquisizione di tolleranza, questo concetto vale solo per i linfociti b:
• i due meccanismi utilizzati per rendere tollerante un linfocita b nei confronti di antigeni self
sono: l'utilizzo dell'apoptosi (nello stadio di b immaturo, se la cellula riconsce un self come
antigene viene liminato per apoptosi);
• e un meccanismo associabile ai meccanismi di variabilità: se lega un antigene self, il b immaturo
può cambiare specificità attraverso un processo di editing del recettore (secondo
riarrangiamento dei geni di una catena leggera).
• cosa può accadere dopo l'editing del recettore? il b immaturo con il suo recettore di membrana
cambia la catena del bcr perchè quella che ha attualmente è specifica per il self.
• la specificità può cambiare diventando specifico per il non self; oppure può verificarsi una
seconda specificità per il self, se accade il linfocita va in apoptosi.
• come decide il linfocita b se apoptotizzare o andare in editing? a seconda della solubilità e della
concentrazione dell'antigene: se l'antigene è solubile va in contro ad apoptosi, se è di membrana va
in contro ad editing; se l'antigene è presente in quantità elevata va in apoptosi, se è in bassa
concentrazione va in editing.
• cd19 e cd20 sono espressi su tutti i linfociti b a tutte le fasi maturative.
• N.B. cd10 identifica soltanto lo stadio di linfocita pre-b. la forma piu comune di leucemiariguarda
una cellula che esprime cd10. ancora una volta c'è una analogia con una situaizone simile nel timo:
esiste una molecola nel timo, espressa soltanto nello stadio del timocita corticale, detta cd1.
• cd10 è stata scoperta in pazienti leucemici, e si scopri successivamente essere un antigene di
pre-b. la presenza di cd10 è la prognosi che da la diagnosi piu sicura possibile.
____
• non esistene antigene che da solo sia in grado di attivare un linfocita b naive, senza la mediazione
di un linfocita t.
• riconoscimento linfocita b e t
• un linfocita b, quando lega un antigene, si comporta come una cellula dendritica: esprime mhc2,
molecole costimolatorie, esprime ccr7, migrando verso la paracorticale in cerca di
• un linfocita t. una molecola costimolatoria essenziale è CD40 per l'interazione con il linfocita t
helper,che esprime il ligando per CD40.
• quale tipo di linfocita t coopera con il linfocita b?
• il linfocita t helper follicolare TFH, scoperto nel 2004. si chiama helper perche aiuta, e si
chiama follicolare perchè è localizzato in un follicolo linfatico, o centro germinativo; ed è, ad oggi,
il linfocita adibito alla cooperazine con il linfocita b, e alla determinazione del tipo di
immunoglobulina che verrà prodotta dal tipo di linfocita b.
____
28
Anticorpi recettori
BCR
____
• il linfocita b utilizza come molecola di membrana un anticorpo: un anticorpo (o
immunoglobulina) è formato, nella sua struttura piu semplice, da due tipi di catene, due a peso
molecolare elevato (catene pesanti) e due a peso molecolare minore (catene leggere). queste catene
hanno una porzione variabile ed una porzione costante.
• la parte costante è la parte vicina alla membrana, e la parte variabile è quella che protrude
all'esterno e contatta l'antigene. le zone che hanno una variabilità molto spiccata sono dette
regioni ipervariabili.
• entrambe le catene hanno regioni costanti e variabili o ipervariabili.
• noi distinguiamo diversi tipi di catene pesanti e leggere che permettono di distinguere le Ig in
classi (o isotipi). gli isotipi o classi delle catene pesantii differiscono per la regione costante: ad
esempio per le classi di immunoglobuline che esprimono una catena costante di tipo mu,
identifano un anticorpo chiamato IgM. una IgE hanno la regione costante cihamata epsilon, IgA ha
una regione costante chiamata alfa, IgG ha gamma e IgD ha delta. queste 5 classi di anticorpi sono
quindi identificate dalla regione costante della catena pesante.
• per le catene leggere possiamo avere solo due isotipi ele catene sono chiamate kappa e lambda.
• un anticorpo nella sua struttura di base è costituito da due catene pesanti e due leggere legate da
ponti S-S. la variabilità e la capacità di legare un antigene è legata alla varaibilità della porzione
variabile.
• nel nostro corpo abbiamo 1*10^13 tipi di immunoglobuline. come fanno 34.000 geni a codificare
per tutta questa specificità?
• avviene un fenomeno detto riarrangiamento, o ricombinazione, che avviene casualmente in ogni
cellula durante la differenziazione nel midollo o nel timo.
• il linfocita b matura definitivamente nel midollo, ed è in quella sede che avviene il
riarrangiamento, che coinvolge geni delle catene pesanti e geni delle catene leggere.
• le catene pesanti contengono 3 pacchetti di geni che contribuiscono alla regione variabile: V, D, e
J.
• le catene leggere contengono 2 gruppi di geni, V e J, che contribuiscono a formare la porzione
varibile.
• le catene pesanti sono organizzate quindi come le catene beta del recettore, mentre le catene
leggere sono organizzate come le catene alfa del recettore.
• per la catena leggera può avvenire un riarrangiamento V-J con conseguente formazione del
trascritto primario, e grazie allo splicing, il riarrangiamento V-J si avvicina alla porzione del gene
codificante per la regione costante C, per formare alla fine il trascritto VJC.
• per la catena pesante, dato che alla porzione varaibile contribuiscono 3 porzioni, avremo 2
riarrangiamenti: un segmento D e uno J, per riarrangiarsi in D-J. il secondo riarrangiamento
provoca la formazione del trascritto V-D-J e successivamente lo splicing avvicina il trascritto V-D-J
alla porzione codificante la regione costante C, con formazione del trascritto VDJC.
____
29
variabilità bcr
____
elettroforesi delle
proteine
plasmatiche
____
• grazie ai fenomeni di ricombinazione casuale dei geni delle catene pesanti e leggere, e la loro
associazione casuale si arriva a consentire una variabilità di circa 2.16*10^6: mancano ancora circa
1*10^7.
• il grosso della variabiltà è generata dai fenomeni di imprecisione, o gli errori al momento
della ricombinazione, che comportano aggiunta o delezione di nucleotidi.
• altri due meccanismi che contribuiscono alla variabilità esculivi dei linfociti b sono importanti.
• la classe di anticorpo che noi produciamo durante il primo incontro con un antigene è la classe
IgM. a successive risposte allo stesso antigene si usano anticorpi IgG.
• nella risposta primaria produciamo IgM, e nelle risposte secondarie (successive allo stesso
microrganismo) si produce IgG. vengono prodotte in concentrazione diversa: la quantità di
anticorpo rispetta la teoria dell'espansione clonale: non abbiamo piu una sola cellula specifica, ma
abbiamo molte cellule specializzate. e in oltre, nel secondo contatto gli IgG vengono prodotti molto
piu velocemente.
• durante i vaccini mettiamo l'individuo in grado di indurre subito una risposta secondaria ad una
infezione.
• IgM presenta 10 siti di legame per gli antigeni. perchè allora le cellule della memoria durante la
seconda risposta produciamo IgG, con 2 siti di legame? perchè i le IgG hanno una maggiore affinità
di legame per un antigene. affinità maggiore significa costante di dissociazione molto alta. le IgG
hanno affinità maggiore perchè nel momento in cui vengono sintetizzate queste immunoglobuline
a partre dall'antigene presentato da IgM si verifica una ipermutazione somatica: vi sono una serie
di mutazioni nelle regioni ipervariabili dell'anticorpo. sono dette ipermutazioni perchè
intervengono con una frequenza maggiore di quella stimata da un possibile calcolo.
• le porzioni ipervariabili sono composte da circa 30 amminoacidi. se confrontiamo le porzioni
ipervariabili di uina IgG e una IgM per uno stesso antigene possiamo trovare 5 o 6 amminoacigi
variati, che sono tantissimi . l'ipermutazione somatica, che contribuisce a generare diversità
anticorpale, si verifica durante la maturazione da linfocita b maturo a plasmacellula.
____
• quando una proteina viene sottoposta ad un campo elettrico, questa migra in base alla carica e
alla massa:
• la velocita di migrazione dipende da unità di carica su densita di massa.
• questo accade quando il plasma di un individuo viene sottoposto ad un campo elettrico. viene
segnato un tracciato, in cui si evidenziano varie bande, rappresentanti le proteine.
• la banda piu alta corrisponde alle albumine, proteine prodotte dal fegato.
• le altre bande vengono a caratterizzare le alfa, beta e gamma globuline.
• gli anticorpi sono glicoproteine del siero, e quindi fanno parte delle proteine che migreranno in
corrispondenza di certe bande quando sottoposte ad un campo elettrico.
• la maggior parte degli anticorpi migrano in corrispondenza del grafico delle gamma bglobuline.
• questi sono gli anticorpi IgG e IgA.
• IgM migrano in presenza delle beta globuline.
• lo studio elettroforetico è un importante per lo studio delle immunoglobuline. se in un referto
elettroforetico manca la banda gamma possiamo immaginare che nel paziente sono assenti le
gamma globuline, e vi è una immunodeficienza.
• se le gamma globuline hanno un picco alto nel grafico deduciamo che vi sono molti anticorpi: o
una infezione o un tumore delle cellule deputate alla secrezione di anticorpi.
• la forma della linea gamma ci può far distinguere se si tratta di tumori o infezioni.
____
30
isotipi degli
anticorpi
____
struttura di IgG
____
• il 90% delle proteine migranti tra le gamma globuline sono anticorpi.
• esistono 5 classi di anticorpi e la differenza dipende dal tipo di catena pesante che
l'anticorpo utilizza: catena gamma: IgG; catena Mu: IgM; Catena delta: IgD ecc..
• la differenza a cui noi ci riferiamo riguarda la catene pesanti.
• ogni anticorpo è composto nella struttura base da due catene pesanti e da due catene leggere,
lambra e cappa, i cui geni codificanti si trovano su cromosomi diversi.
• le catene leggere rappresentano un isotipo: 5 isotipo di catene pesanti e due isotipi di catene
leggere.
• quando parliamo di isotipo ci riferiamo solo a quelli delle catene pesanti, non riferendoci a quelle
leggere che possono essere cappa o lambda.
• in un anticorpo le due catene leggere devono essere identiche: non può avere una catena
leggera cappa e una lambda.
• questo è un fenomeno gia visto durante la maturazione dei Linfociti b : avviene l'esclusione allelica:
l'esclusione di un gene è data dalla presenza dell'altro.
• nell'anticorpo possiano distinguere una struttura base: ci riferiamo ad una IgG.
• IgG è formata da due catene pesanti e due catene leggere; ha 2 siti combinatoriali dell'antigene,
creato dalle porzioni variabili delle catene leggere e pesanti. ogni igg può legare 2 molecole
antigeniche. questo IgG che lega 2 antigeni con due catene pesanti e due leggere è detta
MONOMERO.
• IgM che può legare 10 molecole antigeniche è detto PENTAMERO: dieci catene pesanti e dieci
leggere, dieci siti di legame per la molecola antigenica.
• le IgA possono essere monomeriche o dimeriche.
____
• esistono 3 domini nella catena pesante, 1 dominio costante nella leggera;
• 1 regione variabile nella catena pesante e 1 nella catena leggera.
• la variabilità è la discriminante per la formazione del sito di legame.
• la porzione costante delle catene pesanti è la parte dell'anticorpo che media tutte o quasi tutte le
porzioni effettrici dell'anticorpo.
• questa porzione prende il nome di FC: frammento cristallizzabile: se noi digeriamo con la papaina
un anticorpo, questo viene ridotto in 3 parti: due di queste parti contengono le porzioni variabili
delle catene pesanti e leggere, denominate FAB: FRAMMENTI DELL'ANTICORPO CHE LEGA L'ANTIGENE;
l'altra parte formata solo dalle porzioni costanti delle catene pesanti prendono il nome di fc.
• la parte fc media tutte le funzioni effettrici dell'anticorpo tranne una: la netralizzazione di tossine
o di microrganismi; tutta la capacità protettiva dell'anticorpo è mediata da fc, che agisce in seguito
al legame.
• l'altra caratteristica dell'anticorpo è che tra il frammento fc e le porzioni variabili vi è una
porzione "cerniera", che permette l'adattamento attraverso la capacità delle porzioni variabili di
modificarsi, conferendo flessibiltà alle porzioni variabili dell'anticorpo che possono allargarsi o
restringersi: se gli antigeni sono molto numerosi possono trovarsi molto vicini, quando sono pochi
possono trovarsi ad una distanza maggiore.
• nell'ambito delle porzioni variabili delle catene pesanti e leggere, esistono regioni in cui la
variabilità è molto spiccata, dette regioni ipervariabili CDR regioni che determinano la
complementarietà: porzioni della parte variabile che contribuiscono alla formazione del sito di
legame per l'antigene.
• vi sono 3 regioni iperviariabili nelle catene pesanti e 3 in quelle leggere; queste 6 regioni
ipervariabili formano la tasca, il sito in cui si lega l'antigene.
____
31
Risposta
immunitaria
primaria e
secondaria
____
concentrazione
sierica ed emivita
____
sottoclassi
____
• la vaccinazione con tossoide tetanico è una classica vaccinazione obbligatoria. questo soggetto
inizia a produrre anticorpi.
• la cinetica di produzione di anticorpi ha una componente qualitativa e una quantitativa.
• quando un individuo viene vaccinato o viene per la prima volta a contatto con l'antigene in
seguito ad infezione, vi è una produzione di anticorpi IgM, e la caratteristica di questa prima
risposta anticorpare è la presenza di un periodo di latenza di 5gg, e la quantità prodotta è piuttosto
bassa.
• successivamente in questo soggetto la produzione di igm si riduce e si ha una lieve e transitoria
produzione di igg.
• quanto il soggetto in seguito a prima infezione o vaccinazione, viene a contatto nuovamente con
l'antigene si ha una risposta anticorpale secondaria: latenza piu breve, e si ha una produzione di
igg molto piu intensa ed elevata.
• questo è un principio sfruttabile in diagnostica: una donna in gravidanza vuole sapere perchè il
feto correrebbe rischi se sia stata infettata o meno dal citomegalovirus o dal virus della rosolia;
oppure si è venuti a contatto con sangue infetto vi sono probabilità elevatissime di contagio. come
facciamo a capire queste cose? non possiamo cercare il virus, ma sfruttiamo questo principio. come
facciamo a capire se un individuo ha una indezione in atto o ha avuto infezioni passate? se
troviamo igm assenti e igg presenti possiamo dedurre che è una infezione secondaria, risposta
secondaria a seguito di una infezione pregressa. se le igm sono piu delle igg è si tratta di una
infezione in atto.
• latenza classe e quantità di anticorpo ci fanno capire se si ha una risposta immunitaria primaria o
secondaria.
• una risposta secondaria è sempre frutto di una memoria immunologica indotta da
infezione o vaccianazione.
____
• le albumine presenti nel siero sono presenti nell'ordine di grammo per decilitro.
• le gamma globuline IgG sono le piu presenti nel siero, mediamente entro un grammo per
decilitro.
• la seconda classe di antocorpo piu abbondante del siero sono le IgA, presenti ANCHE MA NON
SOLO nelle secrezioni.
• le terze sono le IgM.
• le IgE hano una concentrazione sierica molto bassa, e possono essere dosate solo con tecniche
sensibili e sofisticate, e non possono essere evidenziate con tecniche usate comunemente con le
tecniche come l'elettroforesi.
• l'emivita di un anticorpo è la quantità di tempo che serve affinchè la concentrazione si
dimezzi.
• l'emivita di un igg è 20gg. sapere l'emivita di un anticorpo è utile per sapere ogni quanto tempo si
devono somministrare le immunoglobuline ad un soggetto immunodeficiente.
• l'emivita delle ige è di 2 giorni. le ige stanno nel siero per pochissimo tempo, e questo ci dice che
la loro concentrazione è cosi bassa perchè scompaiono rapidamente dal siero perchè preferiscono
andare altrove, ed in effetti le ige hanno la citofilia, cioè tendono ad abbandonare il circolo e a
depositarsi nei tessuti.
____
• igg1 igg2 igg3 igg4 differiscono per la catena pesante gamma, per la concentrazione e per
proprietà biologiche.
• le igg3 hanno una emivita molto bassa, non è come quella tipica di 21 giorni, ma è di 7 giorni.
• le iga presentano due sottoclassi: iga1 e iga2.
____
32
meccanismi
effettori
dell'anticorpo
____
• ad eccezione per la neutralizzazione, la capacità di legare un antigene ed impedirne la sua azione
effettrice, l'anticorpo usa diversi sistemi per mediare la distruzione del patogeno: attivazione del
complemento, fagocitosi, ADCC
• opsonizzazione e fagocitosi: opsonizzazione: ricoprimento di un organismo legandosi con le
regioni variabili agli antigeni di membrana di un batterio.
• le funzioni effettrici dell'anticorpo, ad eccezione della neutralizzazione, dipendo dalla porzione
FC.
• quando un anticorpo ha opsonizzato, ha legato un batterio, l'anticorpo può servirsi di un fagocita.
• fagociti: macrofagi, monociti, neutrofili. queste cellule esprimono recettori per il frammento fc
delle immunoglobuline, soprattutto IgG. a questo punto si mette in atto il meccanismo di
fagocitosi.
• un altro tipo di recettore per fc delle igg può essere espresso su alcuni linfociti, i linfociti natural
killer: in questo caso nel momento in cui un anticorpo si lega ad una cellula infettata con la sua
porzione variabile, il linfocita natural killer può uccidere, non può fagocitare. il linfocita attiva
quindi i suoi meccanismi di citotossicità: esocitosi di granuli, e utilizzo di domini di morte fas, trail,
tnf twet. questo è un altro metodo di attivazione del natural killer a prescindere dai recettori kir e
kar.
• la citotossicità innescato da un anticorpo legato ad un recettore natural killer è indicata come
ADCC: citotossicità cellulo mediata anticorpo dipendente. in queste situazoini l'anticorpo fa da
ponte tra un batterio ed un fagocita, oppure tra una cellula infetta ed un linfocita.
• per quanto riguarda i parassiti come gli elminti gli anticorpi interesati sono le IgE, le citochine
che determinano la produzione di ige sono le il13 prodotte da particolari linfociti già trattati, che
producono anche IL5; l'IL5 è un fattore di differenziazione midollare di eosinofili
• le ige legano con la porzione variabile un antigene di un parassita; e con la porzione costante le
ige legano un recettore espresso sugli eosinofili. l'anticorpo fa sempre da ponte, questa volta ra un
parassita ed un eosinofilo.
• l'eosinofilo, che contiene elementi basici quali ECP e delle proteine basiche riposte nei granuli
degli eosinofili, dopo stimolazione da parte di IgE inizia a rilasciare i granuli all'esterno,
rilasciando elementi come la proteina cationica o la proteina basica maggiore. queste proteine
hanno attività citotossica.
• un sistema di proteine presenti nel sangue in forma inattiva è deto sistema del complemento: così
detto per l'attività complementare a quella dell'anticorpo.
• l'anticorpo legato all'antigene ha comunque la capacità di dare inizio ad eventi che attivano le
proteine del complemento. il complemento ha la caratteristicha che dopo l'attivazione della prima
proteina si innesca una cascata di attivazioni, con risultato finale la lisi di una cellula, di un
batterio, di un globulo rosso, insomma la citotossicità.
• non tutti gli anticorpi sono in grado di attivare il complemento, solo le Igg ele igm, e l'attivazione
coinvolge sempre la sua parte costante fc.
• la neutralizzazione consiste nell'impedire ad una molecola di legarsi ad una cellula: un anticorpo
può legarsi ad un virus, impedendone la diffusione perchè occupa i suoi siti di legame con le
cellule; le tossine, fattori di patogenicità di batteri, che possono legare dei recettori cellulari
causando delle patologie, vengono invece legate dagli anticorpi, neutralizzando la tossina.
____
33
sistema del
complemento
____
• sistema di proteine che si trovano nel plasma in fase inattiva. la caratteristica di questo sistema è
l'attivazione a cascata a partire dall'attivazione del primo componente.
• distinguiamo tre modalità di attivazione:
• via classica di attivazione del complemento: formazione di un complesso "anticorpo IgG/IgM antigene", il complesso può attivare il primo componente del complemento detto C1.
• C1 può attivare il secondo elemento del complemento detto C4.
• C4 attivato attiva il successivo elemento del complemento detto C2.
• C2 attiva il componente centrale dell'attivazione del complemento che è C3.
• questa sequenza che prevede l'ordine C1, C4 C2 è esclusiva della via classica di attivazione. dopo
l'attivazione di C3 vengono attivati gli elementi C5 C6 C7 C8 C9 (sequenza terminale o complesso
diattacco della membrana) che formano dei buchi nella membrana delle cellule come le perforine e
che hanno come risultato finale la lisi della cellula.
• via alternativa di attivazione del complemento: innescata da batteri o da virus
• via lectinica di attivazione del complemento: prevede l'intervento di una lectina che lega il
mannosio MBL (mannos binding lectin), quindi questa via è innescata da organismi ricchi di mannosio.
• sia la via lectinica che alternativa attivano direttamente C3, bypassando C1, C4, C2. ecco
perchè C3 è l'elemento cruciale dell'attivazione del complemento.
• la lisi della cellula infettata potrebbe sembrare poco conveniente, in quanto si potrebbe provocare
una diffusione dell'infezione se virale; ma dalle infezioni non si guarisce con gli anticorpi, ma solo
grazie all'azione dei linfociti citotossici.
• l'attivazione dei componenti del complemento, di natura proteica, implica l'aquisizione di
proprietà enzimatiche di questi elementi, che possono andare a scindere il componente successivo
in due parti. ad esempio C1 divide C4 in C4a e C4b; C3 viene diviso in C3b, piu grande, ed una piu
piccola detta C3a. C3b e C4b rimangono sulla membrana, mentre C3a, e altri frammenti come C5a e
anche C4a vanno "in fase fluida", cioè diffonde nel plasma, per andarsi a legare al mastocita, o al
basofilo. questo legame stimola queste cellule che liberano istamina, eparina, e molecole con
funzioni vasodilatatrici, e altre funzioni infiammatorie.
• la componente a è formata da C4a C5a e C3a. queste proteine sono dette anafilotossine, cioè
sono proteine con proprietà proinfiammatoria.
• la componente b permette l'attivazione dei componenti terminali e la lisi; i fagociti, tra il loro
pool di recettori di membrana, hanno anche recettori per C3b e C4b; cosa succede? C3b può legare
il suo recettore sul macrofago, facilitando la fagocitosi. esiste anche un recettore per C4b, che non
sembra molto importante. secondo gli immunologi C3b è la migliore opsonina presente.
• la fase finale d'azione del complemento è data sia dall'inserzione della sequenza di attacco
nuovamente nella membrana dell'attivatore creando un canale vero e proprio inducendo lisi, sia
dalla facilitazione della fagocitosi mediante i frammenti della componente b.
• le vie di attivazione del complemento diverse dalla via classica sono utili in caso di penuria di IgG,
in modo da garantire la difesa del complemento anche in assenza di anticorpi.
____
34
mediazione dei
recettori per fc
____
• i recettori fc sono presenti e compatibili con diversi anticorpi.
• esistono 3 tipi per il frammento fc delle IgG detto fc-gamma-r= recettore per il frammento c
delle igg (gamma)
• di fc-gamma-r esistono tre tipologie: fc-gamma-r 1, 2 e 3.
• questi differiscono sia per l'affinità di legame per l'fc delle igg (l'affinità di legame è elevata nel
recettore di tipo 1 media nel recettore di tipo 2 e bassa nel tipo 3); sia per la cellula che li esprime.
• il recetore 1 e il 2 sono espressi dai fagociti, il recettore di tipo 3 (detto anche cd16) è espresso
dai linfociti nk.
• i recettori differiscono per affinità, distribuzione e FUNZIONE: il recettore cd16 media ADCC, gli altri
due mediano fagocitosi.
• oggi molti tumori vengono trattati con anticorpi monoclonali. il meccanismo con cui questo
anticorpo è utile per la sua mediazione di adcc nei confronti dei natural killer contro il tumore.
• del recettore cd16 vi sono molte varianti nella popolazione, alcune con una affinità ancora piu
bassa: questi pazienti con recettori ad affinità bassissima sono quei pazienti che rispondo peggio ai
tumori, perchè la adcc non avviene a pieno.
• il recettore fc per le IgA è indicatop fc-alfa-r: recettore per il frammento c delle IgA. questo
recettore è presente SOLO NELL'UOMO, e in nessun altro animale da laboratorio. è espresso dai
monociti macrofagi.
• le IgA sono presenti oltre che nel siero anche nelle secrezioni, nel lume intestinale, nell'albero
bronchiale e nello stomaco: per questo avrebbero bisogno di recettori espressi su cellule epiteliali,
quindi in teoria il recettore fc-alfa-r dovrebbe essere espresso su cellule epiteliali. cosa che non
può avvenire.
• il recettore poli-ig può legare piu immunoglobuline, tra le quali le IgA. questo è espresso dalle
cellule epiteliali.
• esistono quindi due rettori per le fc delle IgA: poli-ig e fc-alfa-r.
• esistono due recettori per le fc delle IgE: fc-epsilon-r di tipo 1 e di tipo 2. analogamente per il
recettore fc delle IgG differiscono tra loro per l'affinità: il recettore di tipo 1 ha elevata afinità, il
recettore 2 ha affinità minore.
• il recettore di tipo 1 per le IgE è espresso anche sui mastociti, basofili, eosinofili.
• il recettore a bassa affinità, non espresso in mastociti, basofili, eosinofili, è espresso da i linfociti
b; si ipotizza possa intervenire in un meccanismo di feedback negativo.
• quando il recettore fc di un macrofago lega un antigene si verifica la fagocitosi: questo avviene
quando un recettore lega 2 IgG, potenziando la fagocitosi attraverso un fenomeno di cross linking
(recettore per antigene bivalente - o multivalente - recettore che deve legare due igg giustapposte, che induce
una trasduzione di segnale piu intensa che innesca la fagocitosi attraverso le stesse reazioni causate da
legami di molecole con i recettori toll-like).
• sui fagociti, i macrofagi in particolare, esprimono fc per le IgM, che non sembra avere un ruolo
importante, in quanto le IgM hanno come via preferenziale di contrasto dell'antigene l'attivazione
del complemento.
____
35
immunità
mucosale
____
• rispsta immunitaria che si organizza a livello del muco.
• iga viene secreta da un linfocita b attivato da un antigene specifico, che si differenzia dalla vera
cellula secretrice perchè diventa una plasmacellula.
• le iga prodotte devono esitare nelle secrezioni. affinchè queste o dal sangue o dalla mucosa
vadano alla mucosa devono attraversare un epitelio.
• il trasporto attraverso le cellule epiteliali è un trasporto attivo, ed è mediato da un recettore: il
recettore poli-ig, espresso dalla cellula epiteliale, ed è in grado di legare le iga. il recettore poli-ig
opera una transcitosi.
• dopo aver legato, il complesso recettore poli-ig/iga viene internalizzato. a noi interessa che solo
iga vada nelle secrezioni senza recettore.
• all'interno di un endosoma avviene un distacco in maniera IMPERFETTA, una parte di recettore
rimane legata all'iga: questo è un errore operato durante il taglio dell'enzima.
• ciò che va a raggiungere le secrezioni è una iga con un pezzo di recettore. questo pezzo di
recettore viene chiamato frammento secretorio o secretore. la differenza strutturale tra una iga
sierica e una secretoria è proprio il frammento secretorio.
• mai errore fu così utile all'organismo: immaginiamo che stiamo parlando della mucosa gastrica.
se iga, di natura proteica, finisse nel lume dello stomaco, in un pH cosi acido verrebbe degradata.
ma il frammento secretorio impedisce la degradazione di iga sia da enzimi proteolitici che da
ambienti acidi. il frammento secretorio permette a iga di mantenersi stabile in ambienti ostili, e
gioca quindi un importantissimo ruolo protettivo.
• le mucose rappresentano una importante via di ingresso per microrganismo, il fatto che le iga
siano così resistenti è essenziale.
• l'essenzialità delle iga viene sottolineata dal fatto che viene effettuata una vaccinazione anti
polio: utilizzando il vaccino di salk seil virus è inattivato, vaccino di sabin se il virus è ucciso. il
vaccino di sabin è per via orale. una vaccinazione per via orale induce una risposta a livello di
mucose del tratto gastrointestinale. l'infezione della polio avviene attraverso le mucose all'inizio,
per questo è piu sicuro, in quanto il virus trova subito una barriera.
•c
____
36
immunità
mucosale
____
• vaccinazione di gregge: l'ingestione di alimenti contaminati dal vaccino.
• in un soggetto affetto da deficit selettivo di iga (immunodeficit piu comune) non vi sono sintomi.
come mai? il recettore poli-ig può legare altre immuno globuline e portarle alle mucose, che
possono sostituire la funzione di iga. le igg transicitosizzate non hanno il frammento secretorio,
ma comunque non vengono degradate.
• il recettore fc-r-n, dove n sta per neonatale, scoperto sulle cellule del sinciziotrofoblasto, è
coinvolto nle passaggio delle IgG dal sangue materno al sangue fetale: così è spiegato il fatto che il
fato alla nascita ha un corredo di igg identico a quello di un adulto, le IgG infatti non sono le sue,
ma sono della madre.
• questo recettore lega IgG, il complesso viene internalizzato in una vescicola, viene trancitosizzato
e rilasciato nel sangue del feto.
• il neonato inizia a produrre IgG dopo qualche mese di vita perchè per la produzione di IgG ha
bisogno di antigeni, che non può incontrare durante la gravidanza: antigeni presenti in aria, come
batteri, o durante lo svezzamento antigeni che possono trovarsi nei vegetali.
• fc-r-n presente nell'intestino del neonato serve a far si che le IgG dal latte materno ingerito
possano passare in circolo.
• il recettore fc-r-n è presente anche nell'adulto, ed ha la funzione di riciclo di IgG: la IgG può
legare un antigene, essere internalizzata, slegata dall'antigene e riutilizzata nell'organsimo.
• N.B. domanda prova in itinere = le igg attraversano la placenta. le igm no. perchè? perchè le igg
sono piu piccole!!!!!! il recettore della placenta opera sempre un trasporto attivo, e questo recettore è
specifico per molecole igg. questa particolarità vale anche per il recettore fc-r-n dell'adulto e quello
dell'intestino del neonato.
• al momento della nascita, il neonato ha la stessa concentrazione di IgG che ha un adulto, e le igg
sono le stesse della madre. nelle settimane a seguire la concentrazione di IgG della madre
diminuisce, a causa della durata dell'emivita. a questo punto il neonato ha gia iniziato la
produzione di sue IgG, e all'età di un anno ha ne ha una quantità che inizia ad avvicinarsi a quella
di un adulto.
• una diagnosi pediatrica di immunodeficit di anticorpi può essere effettuata dopo almeno 4-6 mesi,
quando declina la concentrazione di Ig materne, e il neonato avrebbe dovuto gia iniziare a
produrre le sue.
• un immunodeficit di linfociti t dopo quanto si può diagnosticare? può essere diagnosticato subito.
• ERGO il tempo di comparsa dei sintomi è essenziale per poter discernere un'immunodeficit di
linfociti t da uno di anticorpi.
• nel neonato la sintesi di iga è molto lenta, e il pool di IgA raggiunge un numero standard ad un'età
di 3 anni. N.B. il deficit selettivo di iga può essere diagnosticato solo dopo il 3 anno di età.
____
37
note
____
cooperazione tra
linfociti B e T
____
• neutrofili alti: infezione da gram+
• pus: neutrofili morti durante il tentativo di fagocitosi, antibiotici consigliati.
• i linfociti th17 non sono inibiti dalle citochine prodotte da altri linfociti th.
• presentazione crociata: un peptide che dovrebbe andare su mhc1 va anche su mhc2. (cross
presentation)
• una cellula dendritica può incapsulare un corpo apoptotico (che rappresenta un fattore esogeno)
il quale può contenere proteine virali (che generalmente sono endogeni). quindi proteine virali che
sono solitamente presentate di mhc1 vengono presentati su mhc2.
• linfociti t-Helper: distinguibili in base alla citochina prodotta principlamente, e per una funzione
pratica di mediazione di risposte diverse.
• è possiblie differenziare queste popolazioni grazie ai recettoriper chemiochine particolari che
permettono la migrazione di queste cellule in distretti particolari: th1 th2 th17 e th22.
• th17 sono chiamati così perchè producono il17, mediano processi immunitari protettivi per
batteri extracellulari e per alcune specie di funghi.
• repubblica ha pubblicato una sintesi di un lavoro che sarà pubblicato su nature: il lavoro consiste
nella scoperta che i linfociti th17 non producono solo il17. questo lavoro uscira a maggio. i th17
possono anche produrre interferone gamma o il10. quindi possono essere differenziate in
popolazione th17 altamente infiammatorie (che producono interferone) e non altamente
infiammatorie che producono il17 e 10. la differenziazione tra queste due sottopopolazioni dipende
dalla citochina presente nel microambiente in cui il linfocita viene educato alla maturazione.
affinchè avvenga la maturazione, il1 agisce in particolar modo nella polarizzazione di un linfocita
in una di queste due sottopopolazioni. l'unico aspetto confermato in questo lavoro, messo in
dubbio in passato, è che il 6 e 23 sono essenziali per la differenziazione di il17; e il 17 non è
essenziale per la differenziazione a il17.
• non c'è molecola biologicamente attiva che non causi effetti collaterali. tra le caratteristiche che
un vaccino deve avere è che abbia pochi effetti collaterali. questi non sono importanti a fronte di
effetti collaterali gravi. il rischio dei vaccini è proprio questo: pochi casi di effetti collaterali gravi
contro un vasto numero di esiti positivi di vaccini.
• alcuni vaccini possono essere correlati all'autismo: non c'è vaccino che possa essere
somministrato senza un adiuvante. in italia il coadiuvante usato è stato lo squalene (implicato in
genesi di problemi neurologici, in soldati a cui è stato testato lo squalene come coadiuvanti a loro
insaputa). nel resto del mondo il coadiuvante è il lumen.
____
• si attua in una parte del linfonodo detta follicolo, o centro germinativo.
• generalmente questi linfociti si trovano in due compartimenti anatomici diversi (t paracorticale,
b corticale del follicolo) per poter interagire l'una con l'altra le due cellule devono muoversi
cercando di avvicinarsi.
• nel momento in cui un b lega un antigene grazie ad una sua Ig di membrana, inizia a esprimere
mhc2, molecole costimolatorie (cd80, cd86, CD40), e soprattutto CCR7.
• da quando esprime ccr7 il linfocita b iniza a migrare verso la paracorticale, e una volta arrivato a
confine tra la corticale e la paracorticale i linfociti b e t iniziano a interagire. come?
• il complesso peptide mhc espresso da linfocita b interagisce con il recettore del linfo t. CD80-CD86
interagisce con CD28, e CD40 con ligando di CD40: cosi viene attivato il linfocita b.
• questa attivazione porta vantaggi a entrambe le cellule: per effetto di interazione tra molecole di
membrana e ligandi, viene attivato il linfocita t, e viene indotta la proliferazione del linfocita b
(grazie soprattutto a cd40), che può differenziare in plasmacellula (con vita media molto breve, 1 o
2 settimane, dopo muoiono per apoptosi).
• se la risposta anticorpase fosse dovuta solo a questo meccanismo, la probabilità di successo della
memoria e di anticorpi sostenuti nel tempo sarebbe vana.
• alcuni linfociti b che hanno iniziato a proliferare, invece che diventare plasmacellule a breve vita,
iniziano a esprimere sulla membrana cxcr5, un recettore per una chemiochina, cioè quando il
linfocita b, tramite questo recettore, legherà la chemiochina specifica, migrerà in risposta a questa
chemiochina.
• cxcr5 è il mediatore per la chemiochina cxcr13, prodotta dalle cellule stromali dei follicoli (centri
germinativi).
• quando viene espressio cxcr5 il linfocita b andrà nel follicolo
• perche alcuni linfociti b scelgono questa altra strada?
____
38
Interazioni nel
follicolo e Switch
isotipico
____
• La migrazione di questa cellula nel follicolo in una regione detta zona scura del follicolo,
dipende solo dalla trascrizione di un fattore di repressione specifico, BCL6, che indirizza la cellula
verso questa strada differenziativa, evitando che il linfocita si differenzi in plasmacellula a breve
vita.
• i linfociti b che vanno nel follicolo sono altamente proliferativi, sono quindi piu grandi, con piu
citoplasma (per cui possono chiamrsi blasti), e dato he sono nei centri germinativi possiamo
chiamarli centroblasti.
• quando una cellula prolifera molto possono accadere mutazioni, se queste si verificano con una
frequenza maggiore di quella attesa vengono dette ipermutazioni.
• a questo punto la cellula smette di proliferare dopo le ipermutazione, dopo va nella zona chiara
del follicolo, dove prende il nome di centrocita.
• il centrocita interagisce con il linfocita t del follicolo, e con delle cellule dendritiche, che
trovandosi nel follicolo, vengono chiamate cellule dendritiche follicolari.
• a questo punto le interazioni intercorrono quindi tra centrocita, linfocita t follicolare, e cellula
dendritica follicare
• la c. dendritica follicolare, a parte la morfologia non ha nulla in comune con le cellule dendritiche: in primis
l'origine, che dovrebbe essere di origine mieloide, quando invece è connettivale, è un fibroblasto; la
dendritica presenta dei recettori per profili molecolari e può processare l'antigene, la dendritica follicolare
non può processare e non presenta recettori per profili molecolari.
• nonostante ciò riesce ad esprimere l'antigene sulla membrana complessato con un anticorpo di
membrana: sotto forma di immunocomplesso.
• perchè è importante che il centrocita interagisca con la dendritica follicolare?
• nel passaggio da centroblasto a centrocita abbiamo selezionato linfociti b che esprimono Ig di membrana
con gradi di affinità diversi, sia molto bassi sia medi sia alti, e tra cui alcuni anche con affinità verso il self.
• non possiamo permetterci questo, e quindi selezionamo ulteriormente i linfociti b che hanno una
maggiore affinità recettoriale con l'antigene. il contatto con l'antigene lo favorisce la dendritica
follicolare, tramite il recettore del linfocita b con l'immuno complesso di membrana della
dendritica follecolare. per effetto di questa interazione, le cellule che riescono ad interagire
fortemente con l'antigene, ed hanno alta affinità, possono differenziare in plasmacellule; gli altri
linfociti b, con poca affinità o affinità self vengono a morire per apoptosi.
• il passaggio da una risposta primaria ad una risposta secondaria, oltre che migliorato da un
migrioramento dell'affinità è accompagnato anche dallo switch isotipico (commutazione di
classe): non vengono prodotte igm come in una risposta primaria, ma vengono prodotte igg: il
centrocita cambia il gene per la porzione costante, sostituengo il gene c-mu con c-gamma (o c-alfa,
c-epsilon etc..). da cosa dipende questo evento?
• lo switch isotipico E' ASSOLUTAMENTE A SE STANTE A DAL FENOMENO DELL'IPERMUTAZIONE. a
determinare lo switch è sia un linfocita t-helper follicolare che fornisce le citochine adeguate allo
switch isotipico; sia l'interazione tra cd40 e il suo lingando. nel caso della mancanza di questa
interazione per variazioni di questi recettori si ha una situazione patologica chiamata
Ipo-gamma-globulinemia con iper-IgM.
• dopo la commutazione di classe, a questo punto il linfocita b fa l'ultima mitosi, una mitosi
asimmetrica, con generazione di un linfocita b della memoria, che ritorna nella corticale, ed una
plasmacellula a lunga vita, con durata di almeno sei mesi.
• questa plasmacellula lascia il centro germinativo, per raggiungere il midollo osseo.
•c
____
39
plasmacellule
____
progressione dei
linfociti B
____
• come può una plasmacellula, che è una cellula terminale e non può fare mitosi, a sopravvivere sei
mesi?
• perche va nel midollo? si tratta di una migrazione orientata da chemiotassi, mediata da
chemiochine prodotte dalle cellule stromali del midollo osseo, i cui recettori sono esposti sulla
plasmacellula (cxcr4 lega la citochina cxcr12).
• la produzione di questa chemiochina, e il suo legame con un recettore specifico, spega perchè la
plasmacellula migrazione nel midollo.
• nel midollo, la plasmacellula si trova in alcune nicchie, a stretto contatto con le cellule stromali
grazie a legami stretti tra e-selectina e glicolipidi di membrana della plasmacellula, e tra proteine
di adeisione icam e integrine della membrana della plasmacellula
• la sopravvivenza della plasmacellula nel midollo è data dalla produzione, da parte delle stromali
del midollo di Il6, una citochia che determina la sopravvivenza della plasmacellula; e dalla
produzione di APRIL, un fattore prodotto dagli eosinofili e dai megacariociti.
• Il6 e APRIL favoriscono la sopravvivenza della cellula.
• possiamo distinguere 3 tipi di stromali del midollo:
• il primo tipo produce cxcr12, chemiochina che richiama la plasmacellula, e la mantiene salda nel
midollo;
• il secondo tipo produce IL7, che richiama e tiene legati dei linfociti t della memoria;
• il terzo tipo non produce nessuna delle due precedenti citochine, quindi non richiama i linfociti al
midollo, e la sua funzione è ancora sconosciuta.
____
• i linfociti si dividono in B1 e B2.
• i linfociti B2 sono i linfociti di cui abbiamo fin ora parlato.
• i B1 producono soltanto autoaticorpi, non producono anticorpi contro non self.
• il repertorio di questo pool di linfociti b è un repertorio molto particolare, e hanno delle
caratteristiche:
• non maturano nel midollo osseo, ma nell'organo emopoietico che precede il midollo osseo: il
fegato fetale (infatti compaiono precedentemente alla maturazione del idollo osseo);
• producono prevalantemente IgM, poche IgG3: anticorpi con bassa affinità;
• esprimono una molecola CD5, che è solitamente espressa dai linfociti T;
• fine, la loro localizzazione anatomia è molto particolare: nella zona marginale della milza, che
rappresenta la prima barriera nei confronti di tutti mi microrganismi che sono in circolo, e ha la
funzione di drenare il circolo da questi.
• gli autoanticorpi prodotti sono autoanticorpi fisiologici, riscontrabili in ciascun individuo, che
NON sono causa di malattie immunitarie, ma servono all'eleminazione di cellule vecchie o
danneggiate o che vanno in necrosi: legano infatti autoantigeni che, in caso di danneggiamento
cellulare si diffonderebbero nel circolo.
• legando questi autoanticorpi, i linfociti B1 provvedono all'eliminazione delle cellule danneggiate.
____
40
Immunologia - Memoria immunologica
Basi cellulari della
memoria
immunologica
____
Decadimento della
memoria
____
PROF DIELI
May 7, 2012
• la memoria immunologica è una proprietà tipica ed esclusiva dei linfo t e b, cioe cellule con
recettori clonalmente distribuiti.
• la memoria immunologica è una proprietà come la specificità antigenica, la "rapidità" della
risposta secondaria rispetto alla prima, e l'entità della risposta secondaria rispetto alla primaria.
• la memoria non implica solo aspetti quantitativi, quindi anche di tempo, di prodotto, di numero
di cellule espanse, ed esiste anche una differenza qualitativa: l'anticorpo della risposta primaria
non è lo stesso della risposta secondaria (igm-igg o ige).
• la memoria è definita come un cambiamento nella frequenza e nelle proprietà (quantita e qualità)
di linfociti antigene specifici, che persiste anche quando l'antigene viene eliminato.
• persistono in teoria per l'intera durata di vita di un individuo. sappiamo che non è così, ma
dovrebbe esserlo.
• le due proprietà funzionali della memoria sono mediate da due popolazioni cellulari differenti:
• immediata risposta protettiva: plasmacellule e linfo t
• risposta secondaria: cellule b della memoria, linfociti t centrali della memoria.
• le cellule della memoria sonodivisibili in due popolazioni: cellule della memoria centrale e
cellule della memoria effettrici
• la celula che media l'eliminazione di un microrganismo attraverso gli anticorpi è detta
plasmacellula.
• nel momento in cui il centrocita si differenzia e fa la sua ultima mitosi, si genera una cellula della
memoria, che va nelle aree b del linfonodo : linfocita b della memoria centrale.
• dal centocita origina quindi il linfo b della memoria centrale e una linfo b della memoria
effettrice: la plasmacellula.
• linfo t della memoria centrale: mantenimento della risposta secondaria, localizzato nelle aree t
dei linfonodi
• linfo t della memoria effettrice: migra immediatamente nei tessuti periferici e media
l'eliminazione dell'antigene
____
• quando dura la memoria immunologica? dopo quanti anni si dimezza?
• ci sono tempi stimati assolutamente differenti per quanto riguarda la memoria mediata dai B e i
T.
• in teoria la memoria anticorpale (B) in base a calcoli teorici, dovrebbe avere un tempo di
dimezzamento di 92 anni
• la memoria dei T durerebbe molto meno:tempo di dimezzamento= 8-15 anni per i T.
• cosa avviene in una risposta immunitaria ?
• nel momento in cui un antigene penetra in un individuo abbiamo una prima fase:
• espansione clonale: linfo specifico (t o b) è stimolato da uno specifico antigine, e si espande, si
moltiplica, dando origine ad un numero superiore di cellule. la fase di espansione dipende
dall'espansione di un linfo t a partire da un antigene specifico: la proliferazione ad opera di IL2 ha
luogo solo se un linfocita t è stato correttamente attivato da cellule apc.
• dopo l'espansione clonale segue una fase detta
• contrazione: se nella fase di espansione la cellula proliferava, nella fase di contrazione il numero
di cellule espanso diminuiscem per dei meccanismi di spegnimento della risposta immunitaria: in
quanto IL2 (che era il fattore di proliferazione per i t in maturazione), dopo l'induzione della
citotossicità, uccide i linfociti t per contatto.
• fase stazionaria: il numero di linfo si è ridotto, ma è sempre molto piu elevato rispetto a quello
di partenza (questo ci spiega come nella risposta secondaria avremo un numero di linfociti specifici
molto piu elevato che daranno una risposta piu intensa e molto piu rapida), e rimane ad uno stato
costante. la fase di mantenimento delle cellule della memoria a livelli costanti e piu elevati è data
da due citochine : IL7 e IL15, che sono prodotte dalle cellule stromali, in particolare quelle della
paracorticale del linfonodo.
• durante una risposta secondaria, la replicazione di un patogeno, quale un virus ad esempio, è
repressa dalla presenza di molte cellule specializzate, questo è un esempio di [..]
____
1
Due sottofamiglie
di cellule T della
memoria
____
mantemimento
della memoria
____
• una dendritica che interagisce con delle cellule naive nella paracorticale del linfonodo induce
l'espansione di queste cellule, che modificano il loro atteggiamento: diventano cellule in
espansione, che producono solo solo il loro fattore di crescita, e che hanno un pattern di crescita
specifico:queste cellule escono dal linfonodo e poi ritornano al linfonodo.
• questa popolazione di linfociti che non produce citochine e non ha proprietà effettrici è la
popolazione del linfocita t della memoria centrale.
• quando questa cellula viene nuovamente stimolata da un antigene, essa non solo prolifera,
ma da origine a cellule della memoria effettrice, che nel caso del cd4 sono i
th1,th2,th17,th9,th22; che possono andare in tessuti periferici ed operare la loro attività.
• il linfo b della memoria rimane anche esso nel linfonodo, al contrario della plasmacellula, che va
in periferia.
• il t della memoria centrale migra di linfonodo in linfonodo, in quanto esprime ccr7 e e-selectine,
riuscendo a dare origine, se è necessario, volta per volta, a cellule della memoria effettrici.
• i t della memoria effettrice mediano la risposta immediata della memoria, e presentano diversi
recettori per citochine diverse.
• queste cellule della memoria effettrici sono stabili o si possono modificare?
• per quanto riguarda le cellule t della memoria effettrice dei cd8 abbiamo due popolazioni: due
tipi per la memoria effettrice (una con funzione di produzione di citochine, senza citotossicità, e
una con funzione citotossica) e un tipo per la memoria centrale (responsabili della riposta
secondaria, senza funzioni effettrici, si trovano in prossimità della paracorticale del linfonodo, e se
stimolate nuovamente da un antigene possono produrre cellule effettrici della memoria).
• qual'è la differenza tra le cellule della memoria dei linfociti b e t?
• la differenzanella generazione di cellule della memoria effettrice tra b e t è nell'induzione della
memoria
• il centrocita produce una cellula della memoria e una plasmacellula.
• nei linfociti t il modello è lineare: la cellula naive da luogo ad una cellula della memoria centrale,
e da questa successivamente origina una cellula della memoria effettrice.
• nell'uomo tutti i dati puntano al modello lineare anche se sono ipotizzati 3 modelli di induzione
della memoria dei linfo t.
____
• l'induzione della memoria è antigene specifica, è legata all'antigene specifico ed ad il2, e il
mantenimento avviene alla fine della contrazione.
• la memoria immunologica è molto piu transitoria rispetto ai dati sperimentali.
• vi sono due modalita di mantenimento della memoria: il meccanismo antigene specifico,
tramite esposizione, per vie naturali tramite infezioni, anche inapparenti, o per vie artificiali
tramite i richiami, ad uno specifico antigene; e il meccanismo policlonale.
• quest'ultimo permette di mantenere la memoria per molte specificità antigeniche, ed è
differente nei linfociti b e nei linfociti t.
• Il7 e IL15 sono essenziali per il mantenimento della memoria. queste due citochine, molto
lentamente, fanno fare una o due mitosi in un anno, e differenziare 1 o 2 volte all'anno una cellula
della memoria centrale in una cellula della memoria effettrice.questo induce un mantenimento del
pool ad un livello costante, e una differenziazione, che garantisce al contempo anche una minima
soglia di protezione.
• il meccanismo non è omeostatico, ma sempre policlonale.
• cosa induce i b a fare 1-2 mitosi e a differenziare a plasmacellule? intervengono due meccanismi:
- il primo meccanismo, che è anche principale, dei quali sfrutta il fatto che la maggior parte
dei b della memoria centrale esprimono TLR: quando degli antigeni che presentano profili
molecolari (presentati da una grande varietà di microrganismi) stimolano i recettori TLR
fanno si che la cellula centrale della memoria si moltiplichi, e differenzi in cellula effettrice.
- il secondo meccanismo è detto Bystander:cooperazione da parte di un linfocita t spettatore. il
concetto di spettatore implica il fatto che non sia uno t specifico, a prescindere dalla
specificità antigenica, un t potrebbe riconoscere un antigene "anti-b", e possono interagire
tramite cd40-cd156 con i b della memoria, promuovendo la mitosi e la differenziazione.
• questa cooperazione mediata da cd40-cd40l assolutamente non specifica può far produrre al linfo
b anche degli anticorpi non correlati con l'antigene stimolante, inducendo una risposta non
correlata.
• quindi la memoria puo essere mantenuta in due modi, che non si escludono a vicenda: una
modalità antigene antigene specifica (mantiente efficacemente la memoria nei confronti di
specifici antigeni) e una policlonale (che può mantenere memoria nei confronti di tutte le
specificità antigeniche seppur ad un livello piu basso rispetto a quella indotta dalla modalità
antigenespecifica)
____
2
PROF DIELI
May 19, 2012
Immunologia - Vaccini
Definizione
____
calendario delle
vaccinazioni
____
composizione di
un vaccino
____
effetti collaterali
____
• un vaccino è una microrganismo ucciso o inattivato che deve garantire la protezione dallo
specifico antigene, deve essere una molecola sicura in quanto non induca la malattia stessa, e la
protezione che induce deve perdurare.
• In oltre deve indurre anticorpi neutralizzanti, cellule t effettrici, deve essere biologicamente
stabile, economica, e facilmente somministrabile (evitare intradermico o intramuscolo: l'uso di
aghi, usati per vaccinare piu bambini in africa è stata la causa della diffusione dell'aids, in quanto
l'ago fungeva da veicolo per la trasmissione dell'infezione).
• la somministrazione preferita è la somministrazione orale: bene tramite frutta - l'uso di vegetali
ricombinanti, con il vaccino al loro interno, quali banane e tabacco, è una delle vie di
somministrazione piu facili.
• secondo L'OMS un vaccino, per essere tale deve riuscire ad indurre questa protezione almeno sul
30% dei soggetti vaccinati.
• (bcg "bacillo di c.e g" ., usato nei confronti della tbc, non induce alcuna protezione, ma è meglio di
niente.)
____
• obbligatoria epatite b (HBV)
• in caso la madre sia HBV positiva, il nascituro dovrà essere vaccinato alla nascita con richiami al
2, 4/5 e 11/13 mese con doppia azione con vaccino e Ig anti HBV, per bloccare il virus.
• difterite tetano e pertosse (sistema trivalente) sono le uniche vaccinazioni obbligatorie.
____
• può esssere costituito da un batterio ucciso (vaccini in cui un intero microrganismo fornisce
protezione: il caso del tifo, causato da un agente eziologico chiamato salmonella); o da un batterio
attenuato attraverso una serie di passaggi in coltura (il bacillo bcg per la tbc, è il vaccino piu
utilizzato al mondo e il meno efficace: è utilizzato un micobatterio bovino inattivato non virulento
per l'uomo); può essere dato da un tossoide (in cui una tossina è modificata perdendo potere
patogeno ma mantenendo la capacità immunogenica, esempio tossoide tetanico); oppure delle
molecole di membrana, come nel caso delle molecole utilizzate per la vaccinazione contro il virus
dell'influenza: vengono utilizzate emoagglitinina e neuroamminidasi, oppure HBSg (antigene
superficiale dell'epatite b) per quanto riguarda l'epatite b; possono essere utilizzati virus uccisi o
inattivati (virus della polio: sabin - virus inattivato, somministrato per via orale, salk - virus
ucciso, somministrato intramuscolo).
• la vaccinazione nei confronti di nemophilus e pneumococco riguarda tutti i batteri i cui fattori
patogenici sono costituiti da oligosaccaridi. bisogna creare Ig contro gli oligosaccaridi, ma
sappiamo chequesti antigeni non creano memoria immunologica.
• possiamo renderlo immunogeno? si, coniugando l'oligposaccaride ad un carrier.
• il carrieri è una molecola proteica, viene internalizzata dal linfo b, vengono processati e legati
frammenti a mhc2 e presentati al Th. il Th può attivare il linfo b, che differenzierà verso lo switch
isotipico e potrà produrre anticorpi.
• i virus generati con dna ricombinanti e i vaccini creati con carrier virali sono ancora di ambito
sperimentale.
• si possono utilizzare virus come carrier: qual'è il virus tipico che posso utilizzare come carrier?
il virus vaccinico: il virus che è stato utilizzato per debellare il vaiolo.
• fu utilizzato il virus bovino (per questo detto vaccino) fatale per i bovini ed innoquo per l'uomo.
• si può utilizzare il virus vaccinico con funzione di carrier di una proteina verso cui si vuole
indirizzare la risposta immunitaria.
____
• l'incidenza della malattia può diminuire a prescindere dall'introduzione del vaccino (vedi tbc: la
scoperta dell'isomiazide iniziò a ridurre l'incidenza prima dell'introduzione del vaccino)
• Ve ne sono di tre tipologie diverse:
• A- Effetti collaterali singoli
• B- Effetti collaterali che interessano più gruppi di soggetti
• C- Altri ancora.
____
1
malattie per cui
non esistono
vaccini
____
• malaria - mortalità annua: 1.124.000; nuovi casi annui 500.000
• schistosomiasi • infestazione da vermi
• tubercolosi
• diarrea - mortalità annua: 2.000.000; nuovi casi annui: 4.000.000
• malattie respiratorie - mortalità annua: 3.947.000; nuovi casi annui: 362.000.000
• hiv - mortalità annua: 2.866.000; nuovi casi annui: 2.000.000
• morbillo - mortalità annua: 7.45.000; nuovi casi annu:i 44.000.000
• perche non ci sono vaccini per queste malattie?
• perche non c'è ritorno economico, perche il mercato è rappresentato da popolazioni povere, da
governi poveri e corrotti che non possono o non sono interessati all'acquisto di vaccini.
• quello che sborsa piu soldi per la ricerca è Bill Gates
• sarebbero necessari solo 70 miliardi di dollari per il controllo totale della tbc.
• un giorno di guerra in Iraq del governo americano costa 450 milioni di dollari: 5 mesi di guerra in
meno terrebbero sotto controllo la TBC.
• 500.000.000$ in un anno spesi dalle popolazioni per cosmetici e profumi.
• Il caso del Papilloma virus: questo virus si trasmette per via sessuale e nei casi di promiscuità;
• un maggior numero di partners sessuali corrisponde a una maggiore possibilità di contrarre il
• virus. Gli ostacoli incontrati riguardo l’introduzione di un vaccino per il Papilloma sono stati in
• sintesi due: la mancanza di studi clinici validi e l’atteggiamento bigotto delle istituzioni
• ecclesiastiche.
____
2
Immunologia - Immunocomplessi
Caratteristiche
Fisico-Chimiche
____
Caratteristiche
biologiche
____
In sintesi
____
Malattie da
immunocomplessi
____
PROF DIELI
May 20, 2012
• la caratteristica degli immunocomplessi è la tendenza a precipitare.
• Infatti essi perdono solubilità e precipitano.
• Se un immunocomplesso si forma all’ interno di un vaso dove precipiterà ?
• Precipiterà sull’ endotelio a meno che non si realizzi una condizione che conduca all’aumento
della permeabilità vascolare, per cui, trovando spazio, l’immunocomplesso può precipitare, ma
depositarsi nei tessuti .
• Possiamo avere degli immunocomplessi in eccesso di anticorpi, quindi immunocomplessi in cui la
quantità di anticorpi è decisamente superiore alla quantità di antigene ancora presente. E anche
questi complessi hanno la caratteristica fisico chimica di perdere solubilità e tendono a precipitare
nei tessuti.
____
• Tutti e tre i tipi di immunocomplessi in eccesso di antigene, alle equivalenza e in eccesso di
anticorpi, hanno la capacità di attivare per via classica il sistema del complemento.
• Quando viene attivato il sistema del complemento accadono due fenomeni:
- Uno a livello dell’attivazione di C3 e di C5 ,in cui si formano due piccole molecole che
abbiamo chiamato C3A e C5A, definite anafilotossine. Queste ultime hanno la capacità di legarsi
ai recettori sui mastociti e nel sangue circolante sui basofili, inducendone la degranulazione .
(Come sappiamo, oltre a queste, si formano due molecole più grosse che si chiamano C3B e
C5B ,le quali finiscono sull’attivatore che può essere la membrana di un batterio o un
complesso antigene anticorpo o altro. Le cellule che posseggono recettori per C3 B e C5B sono
i macrofagi, i granulociti polimorfo- nucleati neutrofili , i globuli rossi e le piastrine.)
- Uno a livello della molecola del complemento attivata che rimane sull’ immunocomplesso e
può permettere il legame di questo con un’altra cellula, che esprime il recettore per C3B o per
C4B o per C5B.
____
• l’ immunocomplesso si può legare ai globuli rossi , alle piatrine ,ai neutrofili e ai monociti ,cioè a
tutte quelle cellule del sangue che hanno recettori per C3B C4B C5B.
• L’attivazione del complemento da un lato con la produzione di anafilotossine stimola la de
granulazione dei basofili, dall’altro media il legame dell’ immunocomplesso con una cellula
qualunque del sangue circolante e questo ha importanza fondamentale nel meccanismo
patogenetico delle malattie da immunocomplessi o da ipersensibilità di terzo tipo.
____
• le malattie da immunocomplessi si dividono in:
- Sistemiche,facendo riferimento al modello sperimentale delle malattie da siero
- Localizzate, facendo riferimento al modello sperimentale della malattia di ARTHUS.
____
1
Malattia da siero
____
• Cos'è una malattia da siero?
• E’ un modello impropriamente definito sperimentale ma in realtà non lo è.
• Esempio: Sappiamo che la vaccinazione antitetanica non conferisce memoria immunologica per
tutta la vita, tanto che, se qualcuno si procura un taglio con materiale infetto si fa una profilassi
somministrando IgG. Oggi le IgG usate sono PURIFICATE, cioè si somministra sangue privo di tutte le altre
proteine.
• In passato cosa si faceva? Si ottenevano immunoglobuline immunizzando un animale con un
antigene , quindi si prendeva il tossoide tetanico, si somministrava ad un animale da esperimento e
si raccoglieva il siero di questo animale che conteneva immunoglobuline contro la tossina tetanica
e infine si somministrava questo all’ uomo . L’animale da esperimento era il cavallo che permetteva
di ottenere una grande quantità di siero antitenatico.
• Il siero antitetanico da cavallo non conteneva solo le immunoglobuline contro il tossoide tetanico,
ma anche tutte le proteine del cavallo che nell’ uomo avevano funzione non self; quindi quando
l’albumina del cavallo, che è la molecola più cospicuamente rappresentata nel siero, penetrava
nell’individuo questi produceva anticorpi diretti contro l’ albumina del cavallo.
• L’albumina è una proteina solubile non di membrana. Quando si formano gli anticorpi contro l’
albumina del cavallo, questi si legano all’albumina e formano degli immunocomplessi.
• Quindi una bassa percentuale di soggetti 10-15%, a cui veniva somministrato il siero antitetanico
di cavallo,a distanza di alcuni mesi, sviluppava una malattia caratterizzata da febbre , vasculite,
infiammazione delle articolazioni o artrite, infiammazione del glomerulo renale o glomerulo
nefrite, ed endocardite cioè l’ infiammazione dell’ endocardio.
• Questa patologia dipendeva dalla formazione di immunocomplessi e dal danno causato da questi.
• Oggi la profilassi con siero di cavallo non si fa più ma c’ è una malattia, riconducibile alla malattia
sopra indicata,che è il reumatismo articolare acuto o malattia reumatica che non è l’ artrite
reumatoide.
• Ad esempio spesso si sente dire “Ho il titolo alto” riferito agli anticorpi diretti verso lo
streptococco beta emolitico di gruppo A. E’ bene precisare che ognuno di noi è stato a contatto con
questo batterio che ha causato una faringite o una faringotonsillite. Però bisogna analizzare cosa
succede nel 10% dei soggetti affetti da streptococco betemolitico di gruppo A dopo che si sono fatti
la faringite o la faringotonsillite!
• Dopo 4\ 6 mesi che l’infezione è guarita, sviluppano vasculite, artrite, glomerulo nefrite, e
febbre…Cioè gli stessi sintomi che aveva il soggetto che riceveva siero antitetanico di cavallo .
Quindi risultano affetti da una malattia riconducibile, come meccanismo patogenetico, alla
malattia da siero .
____
2
Cause della
malattia da siero
____
• Dipende dalla deposizione negli organi, a cui noi indirettamente abbiamo fatto riferimento, di
immunocomplessi ed il particolare:
- Nella vasculite gli immunocomplessi si depositano lungo la parete dei vasi.
- Nella glomerulo nefrite gli immunocomplessi si depositano a livello del glomerulo renale.
- Nell’ artrite gli immunocomplessi si depositano a livello delle articolazioni.
- Nell’endocardite gli immunocomplessi si depositano sull’endocardio. A volte la malattia può
interessare, oltre che l’endocardio, anche il pericardio e il miocardio ,quindi in realtà può
essere una pancardite cioè un’ infiammazione che coinvolge tutti e tre gli strati del cuore.
• E degli immunocomplessi ,quali sono quelli che si possono depositare a livello di queste regioni?
Tipicamente quelli all’ equivalenza ed eventualmente quelli in eccesso di anticorpi,mentre quelli in
eccesso di antigene non possono precipitare perché sono solubili quindi rimangono sempre in
circolo. Gli immunocomplessi che si depositano, lo fanno perché perdono solubilità e precipitano.
Ma, affinchè gli immunocomplessi precipitino, è necessario che la permeabilità vascolare aumenti
tanto da permettere a questi complessi di trovare la possibilità negli spazi aperti a livello del
glomerulo, in modo che precipitino ma non solo fuoriescano dal vaso e si depositino nel tessuto.
• Affinchè avvenga tutto ciò occorrono 2 condizioni:
- La presenza di qualcosa che aumenti la permeabilità vascolare
- Il fatto che gli immunocomplessi ad equivalenza, dove trovano il vaso permeabilizzato,
possano precipitare e depositarsi nell’ interstizio.
• E questo sperimentalmente noi lo sappiamo, se ad esempio prendiamo un coniglio e gli
somministrate per via endovenosa una quantità anche elevatissima di immunocomplessi ad
equivalenza, non accade nulla se non una leggera infiammazione alla parete dei vasi.
• Se però gli permeabilizzate i vasi e gli inoculate una dose minima di immunocomplessi ad
equivalenza, il coniglio fa un danno a livello di rene, delle articolazioni . Questo è l’evidenza che la
permeabilizzazione del vaso è fondamentale affinchè gli immunocomplessi ad equivalenza possano
precipitare e causare una malattia .
• COME SI REALIZZA L’ AUMENTO DELLA PERMEABILITÀ VASCOLARE?
• Si realizza grazie al fatto che i primi complessi che si formano, quelli che sono solubili in eccesso
di antigene , attivano il complemento, e ripetiamo che a seguito dell’ attivazione del complemento
si liberano anafilotossine, indicateC3A C5A, che si legano ai ricettori sui basofili, e inducono la de
granulazione del basofilo.
• (Nel caso in cui somministriamo le IgG pure, non si ha una malattia da immunocomplessi. )
• Parleremo perché solo un 10 15 % di persone che sono infettate da streptococco, sviluppano la
malattia
• e arriveremo anche a capire come in certi distretti c’ è una malattia e in altri no.
____
3
Cause della
malattia da siero
____
Gromerulo Nefrite
____
Artrite
____
• COSA FANNO LE ANAFILOTOSSINE?
• Vanno a stimolare i basofili alla degranulazione quindi, al rilascio di istamina che sappiamo
essere causa dell’aumento della permeabilità vascolare.
• Abbiamo anche detto che ci sono cellule nel sangue che hanno i recettori per C3B , tra cui alcune
veramente importanti per l’aumento della permeabilità vascolare .
• Queste cellule sono le piastrine, che al seguito del legame di C3B e dell’ immunocomplesso al
recettore che esprimono, de granulano e nei loro granuli è contenuta una molecola che si chiama
serotonina che causa un aumento della permeabilià vascolare .
• Quindi riassumendo l’ aumento della permeabilità vascolare si realizza grazie alla degranulazione
di 2 cellule:
- i basofili con la produzione di istamina
- e le piastrine con il rilascio di serotonina.
• Entrambi questi fattori dipendono dall’ attivazione della via classica del complemento.
• CHE COSA SONO IN GRADO DI CAUSARE I COMPLESSI IN ECCESSO DI ANTIGENE?
• Si dice nella patogenesi di queste malattie , che i complessi in eccesso di antigene aprono le porte
dove si intende che sono degli immunocomplessi che, a seguito dell’ attivazione del complemento,
causano un aumento della permeabilità vascolare.
• I complessi in eccesso di antigene non sono in grado di fare altro .
• Cosa causa poi la malattia?
• Come già sappiamo non i complessi in eccesso di antigene che si depositano nei tessuti, perché
questi sono solubili, non possono precipitare.
• Precipitano, invece, i complessi che si vanno formando successivamente detti alle equivalenze,
che precipitano lungo la parete del vaso e là dove trovano il vaso permeabile, precipitano nel
tessuto.
• Nel tessuto attivano il complemento ,poi rilasciano i mediatori , stimolano i mastociti e in questo
caso, soprattutto a seguito della liberazione di citochine dai mastociti, richiamano i neutrofili.
• Il problema a carico del danno nei tessuti è causato dal neutrofilo, perché questo va nei tessuti
per fagocitare un immunocomplesso .
• La fagocitosi è mediata dall’ attivazione del complemento.
• Il neutrofilo inoltre produce citochine, rilascia enzimi lisosomiali e causa un processo
infiammatorio a carico dei tessuti.
____
• A livello del gromerulo un danno a carico della membrana glomerulare, comporta perdita della
capacità di filtrazione selettiva del glomerulo.
• Quindi un processo infiammatorio a carico del glomerulo, che si chiama glomerulo nefrite,
implica come primo segno che la membrana glomerulare non può filtrare più in maniera selettiva,
il che significa che attraverso la membrana passa di tutto e nelle urine noi troviamo quello che
normalmente non dovremmo trovare.
• Come pensate che sia il colore delle urine di un soggetto affetto da glomerulo nefrite?
• Sicuramente rosso .
• Perché ci sono globuli rossi infatti non passano solo proteine, ma passano pure cellule.
- Ematuria significa presenza di globuli rossi nelle urine
- Proteinuria significa presenza di proteine in grande quantità nelle urine, proteine anche di
peso molecolare elevatissimo.
• Immaginate che nelle urine di questi pazienti si trovano anche le IgM che hanno un peso
molecolare di 900000 circa, quando normalmente il glomerulo tollera un peso molecolare di 60-65.
____
• Un’ infiammazione a carico delle articolazioni comporta ad esempio che un soggetto che ha
un’artrite abbia un ginocchio o un gomito più gonfio perché si ha un edema perché c’è
vasopermeabilizzazione, rosso perché c’è vasodilatazione, dolorante e con la funzionalità lesa.
• Inoltre può accadere, a parte il dolore e la funzionalità lesa, che la sinovia può andare incontro, ad
esempio durante la riparazione, a fibrosi.
• Si possono formare inoltre adesioni , aderenze stabili tra i capi dell’ articolazione, tra i capi ossei ,
fino ad arrivare nelle forme più gravi, e questo è tipico in alcune malattie autoimmunitarie, alla
saldatura dei capi ossei.
____
4
Endocardite
____
Vasculite
____
• Per endocardite si intende uno stato infiammatorio dell’ endocardio che riveste atri e
ventricoli e valvole cardiache:
• I tessuti di queste ultime sono quelle maggiormente interessati dalla patologia.
• Un’ endocardite che interessa una valvola può causare ad esempio una stenosi valvolare, in cui
accade che la valvola si chiude.
• Si assiste all’ ispessimento del lembo valvolare e alla riduzione del lume della valvola .
• Questo si chiama stenosi ad esempio stenosi mitralica, aortica, bicuspidale.
• Se il processo infiammatorio continua e si ha un processo di fibrosi che interessa per esempio i
muscoli papillari, questa valvola rimane pervia, cioè aperta e questa si chiama insufficienza
valvolare.
• Quindi un’ endocardite può evolvere prima in fenomeni di stenosi valvolare nella fase iniziale ma
successivamente in insufficienza delle valvole.
____
• A livello della parete dei vasi abbiamo un processo vasculitico e qui un problema grosso può
essere l’ insorgere della formazione di un trombo, quindi un processo di embolia a livello dei
vasi.
• Analizziamo ora due questioni:
- Perché solo alcuni tessuti sono interessati e non tutti
- Perché solo il 10 -15% dei soggetti sviluppano una malattia dopo faringite da streptococco
• Parliamo della malattia del reumatismo articolare acuto... Cos’è il titolo? E cosa ci indica questo
parametro?
• Il titolo indica la quantità di anticorpi diretti verso un determinato antigene e quello in questione
è la streptolisina, che è un antigene dello streptococco beta emolitico di gruppo A. Infatti il titolo
viene comunemente chiamato “ TITOLO ANTI-STREPTOLISINA “ .
• Sappiamo anche che, se questo titolo supera un certo valore,( tipicamente 240 = Valore di
riferimento) il soggetto deve fare profilassi con antibiotici, con penicillina.
• Cosa è la penicillina? È un antibiotico. Però gli antibiotici non agiscono sugli anticorpi. La
penicillina va ad agire sul batterio (antibiotico-antibatterico), quindi va a ridurre la quantità di
antigene presente. Perché il titolo deve essere mantenuto al di sotto di 240? L’unica maniera per
mantenerlo al di sotto di tale cifra è con la profilassi antibiotica, perché se il titolo supera 240 o
aumenta ancora di più, il rischio di sviluppare reumatismo articolare acuto è elevatissimo.
• E’ cronica o acuta? Si presenta con quale frequenza?
• Il rischio di sviluppare una malattia da immunocomplessi è legato alla quantità di antigene che è
presente.
• Quando un antigene viene somministrato ad un individuo, và in circolo e viene eliminato secondo
3 fasi:
- La prima fase di eliminazione è molto lenta e dipende dalla distribuzione dell’antigene dallo
spazio intravascolare agli spazi extravascolari. [Quindi l’antigene è una proteina che diffonde
negli spazi extravascolari o può diffondere negli spazi intravascolari e quindi la sua
concentrazione minima in circolo si riduce leggermente]
- Poi abbiamo una seconda fase di eliminazione molto più rapida che dipende da fagocitosi
non immune, cioè il fatto che i fagociti, i monociti e i neutrofili presenti in circolo per
macropinocitosi e per micropinocitosi fagocitano e internalizzano una proteina. Soltanto una
piccola parte di antigene viene eliminata a seguito della risposta immunitaria .
• Quando cominciano a formarsi gli anticorpi, antigene ce n’è molto poco, e solo questa piccola
parte di antigene viene eliminata in seguito alla formazione di immunocomplessi.
• Quindi l’eliminazione dipende fondamentalmente da meccanismi che non sono immunologici:
DIFFUSIONE E FAGOCITOSI NON IMMUNE.
____
5
Vasculite
____
• Se un individuo elimina l’antigene non come citato sopra ma in maniera differente, la velocità e la capacità
di eliminare un antigene può influire sulla formazione di immunocomplessi? E se influisce, in che modo? Se
consideriamo un soggetto normale in cui iniziano a formarsi gli anticorpi e c’è ancora una certa quantità di
antigene… se la curva di eliminazione dell’antigene fosse più veloce cosa potrebbe accadere? Immaginiamo un
soggetto che, o perché diffonde rapidamente o perché fagocita rapidamente, nel momento in cui iniziano a
formarsi gli anticorpi ha già eliminato tutti gli antigeni cosa succede?
• Risposta: Non si formano immunocomplessi, o se si formano immunocomplessi sono quelli in
eccesso di antigene. Nel momento in cui comincia ad aumentare la produzione di anticorpi non c’è
più antigene. Qualunque sia la condizione, o che sia un soggetto che elimina velocemente o
lentamente, i primi complessi che si formano per definizione sono complessi sempre in eccesso di
antigene.
• [ESEMPIO: Se si ha un individuo con 10 molecole di antigene invece di 1000, mel momento in cui si
forma il 1° anticorpo, si avranno 10 molecole di antigene e 1 di anticorpo, poi ne avrà 9 di antegene
e 2 di anticorpo, 8 di antigene e 3 di anticorpo… Ma i primi complessi sono sempre in eccesso di
antigene! Il problema poi può essere che l’antigene può essere eliminato velocemente e non si
arriva a formare i complessi successivi, o che l’antigene viene eliminato molto lentamente e si ha
tutto il tempo di formare complessi in eccesso di antigene, complessi in equivalenza e complessi in
eccesso di anticorpi; ma se l’antigene viene eliminato molto rapidamente, non c’è possibilità di
formare complessi in equivalenza.]
• Quindi la velocitànell'eliminazione dell’immunocomplesso è uno dei fattori determinanti nel
causare o meno la malattia.
• Se si elimina velocemente un antigene non si fa la malattia da immunocomplessi, se si elimina
lentamente si ha un rischio maggiore di sviluppare una malattia da immunocomplessi.
• Esiste una malattia che stabilisce il vero meccanismo per cui un individuo svilupperà o meno una
malattia da immunocomplessi. E’ una malattia che insorge in alcuni soggetti a seguito
dell’assunzione di un farmaco anti-ipertensivo, l’IDRALAZINA, che viene utilizzato nella terapia
dell’ipertensione arteriosa. A seguito della somministrazione di questo farmaco, alcuni soggetti
sviluppano una malattia da immunocomplessi, altri (la gran parte) no.
• Perche? L’idralazina viene eliminata come tutti i farmaci per coniugazione a livello del fegato, la
gran parte dei farmaci vengono eliminati con questa metodica. L’idralazina a livello del fegato
viene acetilata e eliminata con le urine. Ci sono 2 gruppi di soggetti che differiscono in base alla
velocità con cui acetilano l’idralazina. Il primo gruppo viene chiamato degli “Acetilatori Rapidi”
l’altro gruppo degli “Acetilatori Lenti”. Nei soggetti che acetilano lentamente accade che
l’idralazina rimane in circolo per un periodo di tempo molto più lungo e in forma biologicamente
attiva, mentre negli acetilatori rapidi viene coniugata rapidamente a livello del fegato e viene
eliminata molto rapidamente quindi l’emivita è molto breve.
• Andrà a fare una malattia da immunocomplessi il gruppo degli acetilatori lenti e quindi questa
malattia detta Lupus da Idralazina, perché è una variante di una malattia che si chiama Lupus
Eritematoso Sistemico causata però dall’idralazina, non è autoimmunitaria; si chiama Lupus perché
i sintomi clinici sono esattamente gli stessi di quelli che si verificano nel Lupus. Alla sospensione di
Idralazina la malattia non si ripresenta più.
• LA MALATTIA CHIAMATA LUPUS DA IDRALAZINA SUPPORTA MOLTISSIMO IL CONCETTO CHE IL
RISCHIO DI SVILUPPARE UNA MALATTIA DA IMMUNOCOMPLESSI E’ LEGATO, PROBABILMENTE
ANCHE AD ALTRI MECCANISMI, MA SOPRATTUTTO ALLA CAPACITA’ DI UN INDIVIDUO DI
ELIMINARE PIU’ O MENO RAPIDAMENTE DAL CIRCOLO UN DETERMINATO ANTIGENE.
• Altre possibilità possono essere: affinità anticorpo-antigene, cross-reattività tra l’antigene contro
cui l’anticorpo è rivolto e antigeni self, etc...
____
6
Approfondimenti
____
• COME MAI LA DEPOSIZIONE DEGLI IMMUNOCOMPLESSI SI VERIFICA SOLTANTO IN ALCUNI ORGANI
E NON IN TUTTI?
• Ci aspetteremmo che gli immunocomplessi precipitino nel distretto in cui la vaso-permeabilità è
elevatissima perché le caratteristiche dell’endotelio sono particolari: è un endotelio fenestrato,
molto aperto, molto prono al passaggio di immunocomplessi dal vaso all’esterno (il fegato ad es.),
eppure non c’è una malattia da immunocomplessi che interessa il fegato, o la milza. Questi due
organi non vengono mai interessati perché vi risiedono dei macrofagi, le cellule di Kupffer,
ricchissime di macrofagi che anche nel momento in cui gli immunocomplessi fuoriescono dal vaso,
li fagocitano e li rimuovono rapidamente.
• IN QUESTI DISTRETTI C’È QUALCOSA CHE FAVORISCE LA DEPOSIZIONE DEGLI IMMUNOCOMPLESSI?
• Per prima cosa ci sono meno macrofagi, quindi una volta che precipitano non c’è nessuno che li
rimuove, poi un’altra cosa è che il flusso del sangue a livello di questi distretti è molto lento, quindi
probabilmente (non lo sappiamo) la velocità di flusso in questi distretti è lenta e quindi ciò
favorisce la deposizione di un immunocomplesso, laddove la permeabilizzazione è aumentata.
• Nota bene: Stiamo parlando di un esempio di malattia autoimmunitarie, malattie da
immunocomplessi, malattie da siero che sono reazioni di ipersensibilità ritardata, e sono malattie
sistemiche; abbiamo 5 organi o distretti interessati nella malattia da siero, nel reumatismo
articolare acuto: Vasi, Cuore (può interessare l’Endocardio, il Miocardio ,il Pericardio)
Articolazioni, Glomerulo-Renale. Alcuni sostengono sia interessato un altro distretto, la cute.
____
7
PROF DIELI
May 21, 2012
Immunologia - Ipersensibilità
Generalità
____
Classificazione di
Gelle Coombs
____
• Con questa espressione indichiamo una serie di condizioni in cui la risposta immunitaria non
provvede all’eliminazione di un microrganismo, non è utile nell’attivare una risposta protettiva nei
confronti dell’individuo, ma anzi il risultato di tale risposta esita in un danno a carico dei tessuti,
quindi in una malattia.
• Affronteremo d’ora in poi proprio lo studio di queste malattie che sono causate da una risposta
immunitaria e parleremo dei loro meccanismi patogenetici.
• Il primo gruppo di queste patologie che andremo a studiare prende nel complesso il nome di
malattie o reazioni di ipersensibilità. Il prototipo più comune di tali patologie è l’asma bronchiale o
più in genere tutto quel gruppo di malattie chiamate comunemente allergie. In realtà il termine
più corretto è proprio ipersensibilità.
• Un individuo che sviluppa una di queste patologie viene chiamato individuo ipersensibile (ad
esempio è un individuo suscettibile ad ammalarsi di asma bronchiale, rinite, rinocongiuntivite...)
• La denominazione di “reazioni di ipersensibilità” è dovuta al fatto che per molto tempo si è
ritenuto che una risposta immunitaria il cui risultato era dannoso per l’individuo, dovesse essere
una risposta quantitativamente esagerata e qualitativamente differente dalla tipica risposta
immunitaria, che viceversa è protettiva.
• Si è sempre sostenuto che se la risposta immunitaria si mantiene entro un certo limite, il risultato
è positivo per l’organismo perché essa sarà una risposta protettiva. Se viceversa questa risposta
diventa esagerata, allora il risultato sarà una malattia. Ecco perché si parla di individuo
ipersensibile, cioè dotato di un’alterata sensibilità.
• Oggi sappiamo che le risposte immunitarie che generano una malattia non hanno assolutamente
nulla di diverso né nella qualità né nella quantità rispetto una risposta immunitaria protettiva
mediata dallo stesso linfocita o dallo stesso anticorpo.
• Esempio: sappiamo che una riposta Th2-mediata e IgE-mediata è utile nella protezione contro i
parassiti, gli elminti. Lo stesso tipo di riposta immunitaria che ci è utile contro gli elminti, in alcuni
casi è responsabile dell’asma bronchiale. Ma tra la risposta protettiva e quella allergica non c’è
nessuna differenza nella qualità, nella quantità, nel modo in cui si instaura, nel modo in cui si
mantiene. L’unica differenza sta nel risultato finale della risposta: eliminazione di un parassita nel
primo caso, danno a carico dei tessuti nel secondo caso.
• IPERSENSIBILITÀ: risposta immunitaria il cui risultato finale è una malattia, un danno a carico dei
tessuti.
• Questa risposta a carico dei tessuti può essere innescata da un antigene self (allora parleremo di
malattie autoimmunitarie) oppure da antigeni non self (tra queste rientrano proprio le reazioni di
ipersensibilità).
____
• Esistono diverse classificazioni delle reazioni di ipersensibilità. Quella che tutt’oggi continuiamo
ad utilizzare è la prima classificazione e risale a due ricercatori, Gell e Coombs, da cui prende il
nome. Questa classificazione fa riferimento ai meccanismi patogenetici delle reazioni di
ipersensibilità e permette così di distinguere quattro tipi di ipersensibilità, chiamati:
ipersensibilità di tipo I, di tipo II, di tipo III e di tipo IV.
- Le reazioni di ipersensibilità di tipo I, II e III sono accomunate dal fatto di essere mediate da
anticorpi. Pertanto esse sono chiamate reazioni di ipersensibilità antiticorpo-mediate.
• Le reazioni di IV tipo, invece, sono mediate da linfociti T CD4 e CD8 e pertanto sono anche dette
reazioni di ipersensibilità cellulo-mediate.
- I primi tre tipi di ipersensibilità sono anche detti reazioni di ipersensibilità immediate
mentre il IV tipo prende il nome di reazione di ipersensibilità ritardata. In questo caso
utilizziamo come criterio non il meccanismo patogenetico, ma il tempo entro cui compare una
determinata malattia o sintomo, a partire dal momento in cui penetra l’antigene responsabile.
Per cui le reazioni cosiddette immediate sono caratterizzate dal fatto che i sintomi della
malattia compaiono entro pochi minuti, al massimo 20-30 minuti, dalla penetrazione di un
allergene in un individuo. Reazione ritardata significa invece che la malattia o i sintomi si
manifestano dopo giorni, tipicamente dopo 48 o 72 ore dalla penetrazione o somministrazione
dell’antigene nell’individuo.
____
1
Diverse
classificazioni di
ipersensibilità
____
Reazioni di
Ipersensibilità di I
tipo (IgE mediate)
____
Caratteristiche
degli allergeni
____
• IPERSENSIBILITÀ DI I TIPO: reazioni IgE-mediate (esempio, asma bronchiale)
• IPERSENSIBILITÀ DI II TIPO: reazioni citotossiche o citolitiche, in cui gli anticorpi della classe
IgG (più raramente della classe IgM) si legano ad antigeni presenti sulla membrana cellulare e
provvedono all’uccisione della cellula bersaglio con meccanismi come ADCC, opsonizzazione
seguita da fagocitosi ed attivazione del complemento. Esempi di malattie causate con questo
meccanismo: REAZIONI trasfusionali e incompatibilità materno-fetale nell’ambito del sistema Rh.
• IPERSENSIBILITÀ DI III TIPO: reazioni mediate da IgG; questa volta però gli antigeni contro cui
gli anticorpi sono diretti sono solubili, tipicamente si tratta di antigeni di natura proteica. In
questo caso il meccanismo è legato alla formazione di immunocomplessi (complessi formati da
antigeni e anticorpi).
• IPERSENSIBILITÀ DI IV TIPO: reazioni cellulo-mediate; in questo caso il meccanismo
patogenetico deriva dall’attivazione di un linfocita CD4, molto spesso di tipo Th1, o di un linfocita
CD8 o citotossico.
____
• Queste reazioni possono dare luogo a malattie sistemiche (cioè che interessano l’intero organismo,
ossia lo shock anafilattico) oppure localizzate (se interessano un distretto anatomico o un organo,
come una rinocongiuntivite o una rinite ).
• In base a che cosa una malattia provocata da un allergene può essere sistemica o localizzata?
Dipende dal sito di ingresso per l’antigene.
• Se l’antigene penetra per via sistemica (ad esempio, per via endovenosa), allora la reazione di
ipersensibilità di I tipo sarà sistemica e avremo una patologia gravissima rapidamente mortale, lo
shock anafilattico o collasso cardiocircolatorio acuto.
• Se l’allergene penetra per altre vie, avremo malattie che interessano un determinato distretto,
per esempio:
- se l’allergene viene inalato, i distretti interessati saranno le vie respiratorie (pensiamo ai
pollini, che talvolta possono provocare manifestazioni anche a livello cutaneo). È il caso
dell’asma o della rinite allergica;
- se penetra a livello della congiuntiva, congiuntivite;
- se penetra per via orale (è il caso di allergeni presenti in diverse categorie di cibi) avremo
una sintomatologia a carico del tratto gastrointestinale.
• Gli antigeni coinvolti nelle reazioni IgE mediate sono detti allergeni.
____
• Devono essere molecole di natura proteica, a basso peso molecolare, altamente solubili, molto stabili e
ciascun allergene deve contenere epitopi in grado di attivare un linfocita CD4. Altra caratteristica è che
gli allergeni anche penetrando in bassa dose possono indurre una reazione di ipersensibilità.
• Ma la caratteristica fondamentale è che devono essere molecole enzimaticamente attive.
• Ricordiamo cosa succede durante l’attivazione dei linfociti Th2: un allergene viene inalato, esita
nelle mucose e riesce a superare la barriera epiteliale proprio grazie la sua attività enzimatica;
dopo aver superato tale barriera verrà riconosciuto e processato dalle cellule dendritiche del
derma. Per superare le cellule epiteliali agisce a livello della b-catenina, rompendo le giunzioni tra
le cellule adiacenti, e penetra passando tra una cellule a l’altra. Inoltre, a livello delle cellule
epiteliali, è importante che l’allergene stimoli le cellule epiteliali a produrre citochine.
____
2
Forme di asma
bronchiale
____
Azione di un
allergene
enzimaticamente
attivo
____
• Non tutte le forme di ASMA BRONCHIALE sono riconducibili a una reazione di ipersensibilità di I
tipo.
• C’è una quota di asma indotta da allergeni e il meccanismo patogenetico è proprio la produzione di IgE
(quindi è una ipersensibilità di I tipo). Ci sono anche delle forme di asma però che non sono indotte da
allergeni e non sono riconducibili nel loro meccanismo patogenetico alla produzione di IgE e a una risposta di
tipo Th2.
• In questo caso, nell’eziologia dell’asma sono coinvolti altri fattori:
- fumo di sigarette, può causare un’infiammazione cronica a livello delle vie respiratorie e
verosimilmente è coinvolto nella patogenesi di diverse forme di asma;
- esercizio fisico, alcune forme di asma insorgono dopo un’attività sportiva;
- aria fredda, ci sono soggetti che hanno una particolare reattività della mucosa e della
muscolatura delle vie respiratorie, per cui a seguito di inalazione di aria fredda sviluppano
crisi asmatiche;
- aspirina;
- ozono;
- asma intrinseca, è una piccola quota di casi di asma di cui non si conosce l’eziologia (ossia
agente causale) e la patogenesi (ossia il meccanismo con cui l’agente causale determina un
danno ai tessuti);
- infiammazioni, sembra che ci sia una correlazione tra l’infezione da parte del virus
respiratorio sinciziale in età pediatrica e il successivo sviluppo di asma bronchiale in età adulta.
Questa è l’unica correlazione statisticamente significativa e attendibile tra infezioni ed asma
bronchiale.
____
• Abbiamo già detto che un allergene enzimaticamente attivo agisce a livello delle b-catenina,
rompe le giunzioni tra cellule adiacenti e passa tra una cellule e un’altra. Ma l’allergene svolge
un’altra funzione importantissima: stimola attivamente la cellule epiteliali a produrre
citochine: IL-25, IL-33 e TSLP (Linfopoietina Timica Stromale).
- IL-25 stimola i linfociti Th2 a produrre le loro citochine tipiche (soprattutto IL-4, IL-5, IL-13)
- IL-33 attiva i mastociti
- TSLP svolge una serie di azione tra cui attivazione di mastociti, reclutamento di eosinofili
ma soprattutto blocca la produzione di IL-12 da parte della cellula dendritica che così non può
attivare una risposta di tipo Th1.
• La funzione più importante svolta da queste citochine è l’attivazione dei basofili. I basofili
così attivati esprimono CCR7, molecole MHC di classe II, possono processare peptidi antigenici e
soprattutto producono IL-4. Il basofilo quindi migra nella paracorticale del linfonodo (proprio in
virtù dell’espressione di CCR7) e lì fornisce l’IL-4 necessaria a far differenziare i linfociti Th2.
Inoltre, il basofilo non ha più bisogno della cellula dendritica perchè può fungere esso stesso da
cellula che presenta l’antigene ai linfociti T.
• I linfociti Th2 producono IL-4 che attiva i linfociti B.
• Ma queste citochine possono attivare sia i mastociti che i basofili. Un basofilo attivato esprime
CCR7, esprime MHC di II classe, può processare peptidi antigenici e produrre IL-4. Questo basofilo
migra nella paracorticale del linfonodo, fornisce IL-4 che è utile per far differenziare i linfociti Th2,
ma esso stesso può fungere da cellula che presenta l’antigene ai linfociti T, senza bisogno della
cellula dendritica, e producendo IL-4 può favorire la differenziazione di Th2. Questi sono gli stessi
meccanismi visti nella risposta di tipo protettivo, anche se la stiamo riassumendo in riferimento
alle malattie.
• I linfociti Th2 producono:
- IL-4 che oltre a favorire il differenziamento dei Th2 attiva i linfociti B.
- IL-5 è un fattore di differenziazione midollare degli eosinofili
- IL-13 che è un fattore di switch per le IgE,ovvero favorisce la produzione di IgE.
____
3
Switch isotipico
per le IgE
____
Fase di
sensibilizzazione
____
• Per le IgE non si aveva idea di come avvenisse lo switch isotipico, tanto che fino alla pubblicazione
di un articolo sulla rivista Nature nell’aprile 2012 si sapeva che lo switch non potesse avvenire da
IgM a IgE,ma da IgM a IgG o ad IgA. Si pensava infatti che lo switch isotipico per le IgE avvenisse
dopo che già si era verificato un primo switch da IgM ad IgG1. Dopo questo switch, si poteva
verificare un secondo switch da IgG1 a IgE.
• Invece il mese scorso è stato dimostrato che lo switch isotipico, analogamente a tutte le
altre classi di Ig, avviene direttamente da IgM a IgE e avviene anche questo nel follicolo.
Questo chiaramente dipende dalla cooperazione con i linfociti Th2 e dalla produzione di IL-13 come
fattore di switch principale.
• Ricordiamo anche che c’è un’altra popolazione di linfociti Th,coinvolta nella potogenesi delle
malattie IgE-mediate che sono i Th9. Quindi i linfociti Th2 e i Th9, con una serie di effetti mediati
dalle citochine che producono, sono le due popolazioni oggi ritenute responsabili delle reazioni di
ipersensibilità ritardata, dell’asma bronchiale (in particolare IgE-mediata). Anche qui,grazie alla
produzione di citochine che fondamentalmente hanno questa serie di effetti, anche IL-9 può
intervenire nello switch verso le IgE, ma soprattutto è molto importante nei meccanismi di
attivazione e reclutamento dei mastociti.
• Quindi abbiamo l’allergene che penetra e con quei meccanismi, in parte attivi in parte legati alla
sua attività enzimatica, stimola i linfociti Th2 che a sua volta cooperano con i linfociti B nella
sintesi di IgE.
• L’altro protagonista è il mastocita, il cui equivalente nel sangue è il basofilo. Ci sono due tipi di
mastociti:
- Mucosali, sono localizzati nel contesto delle mucose. Essi presentano nel citoplasma dei
granuli ricchi di enzimi (proteasi in particolare). Essi non giocano alcun ruolo nella patogenesi
delle malattie allergiche e nell’asma bronchiale in particolare.
- Connettivali, si trovano nel connettivo, a contatto con le cellule connettivali. Essi hanno dei
granuli che non contengono enzimi ma contengono istamina. L’istamina in questi granuli è
intimamente legata ad un’altra molecola, l’eparina. Quest'ultima dà la tipica colorazione dei
mastociti e conferisce metacromasia. La metacromasia è il fenomeno per cui alcuni elementi
cellulari (in questo caso i granuli dei mastociti) assumono un colore diverso da quello dei
coloranti con cui sono trattati. Se non ci fosse l’eparina non sarebbero metacromatici. I
mastociti connettivali svolgono un ruolo fondamentale nella patogenesi di queste malattie.
____
• Tutto quello di cui abbiamo parlato fino ad ora prende il nome di fase di sensibilizzazione, ovvero
l’individuo risulta sensibilizzato ad un allergene. Questa fase di sensibilizzazione consiste in:
- penetrazione di un allergene
- produzione di IgE
- legame delle IgE ai mastociti tissutali.
• Questo è ciò che si verifica in seguito ad un primo contatto tra un allergene o un antigene e un
individuo. Infatti in questo caso non si sviluppa una malattia, ma si dice che in seguito al primo
contatto l’individuo viene sensibilizzato, la malattia sviluppa dopo. Infatti l’allergene che ha
indotto la risposta, poi viene eliminato. Infatti durante la risposta primaria vengono prodotte IgM,
ma alla fine della risposta primaria vengono prodotte IgG oppure come in questo caso IgE. Le IgE
possono stare adese alla membrana dei mastociti anche settimane (2/3 settimane fino a 6
settimane, secondo alcuni).
• N.B.: L’allergene per fenomeni di cross-reattività può penetrare in modo inapparente in un individuo e per
le allergie esistono numerosi casi di cross-reattività. Tanto è vero che molto spesso quando un soggetto è
allergico ad un determinato alimento, spesso è allergico anche ad un farmaco, ovvero ad un gruppo di
molecole. Quindi la possibilità che un allergene, anche in forma inapparente, senza causare patologie, possa
penetrare nell’organismo, è praticamente minima.
• Al primo contatto non degranula il mastocita, ma l’allergene viene eliminato come una normale
proteina. Il primo modo con cui una proteina viene eliminata è per diffusione negli spazi
extravascolari, poi per fagocitosi non immune.
____
4
Secondo contatto
____
• Se invece un individuo è stato immunizzato con un antigene e riceve per la seconda volta lo stesso
antigene si avrà una maggiore produzione di anticorpi ( una risposta secondaria). In questo caso
vengono prodotte infatti le IgE.
• Ecco infatti che nella risposta secondaria avrò due fenomeni:
- La risposta di memoria IgE con la produzione di una maggiore quantità di IgE specifiche per
quel determinato allergene.
- L’allergene si va a legare alle IgE che sono già legate sul mastocita. Il mastocita degranula.
• Per degranulare un mastocita, come per qualunque attività di un anticorpo, l’allergene si lega a
due molecole di anticorpi IgE presenti sulla membrana del mastocita e devono essere tra loro
molto vicini. Quindi si deve verificare il fenomeno del Cross-Linking. Quindi in una risposta
secondaria si avrà la presenza delle IgE che sono legate e quelle che sono di nuova produzione. In
questo modo il mastocita svuota il contenuto dei suoi granuli che contengono eparina ed istamina.
• L’eparina in questo tipo di reazione non gioca nessun ruolo, invece l'istamina causa:
- vasodilatazione e aumento della permeabilità vascolare, che provocano la fuoriuscita di
acqua e quindi edema che, a livello di un bronco, spinge la sottomucosa verso l’interno e il
lume del bronco si restringe.
- contrazione della muscolatura liscia bronchiale (broncospasmo), in questo modo il lume
del bronco si restringe;
- ipersecrezione di muco da parte delle cellule ciliate: il muco via via si accumula
all’interno dei bronchi e contribuisce a restringere ancora il lume bronchiale.
• Quindi l’asma non è altro che una restrizione del calibro dei bronchi, dovuta a questi tre
meccanismi. In un soggetto con asma bronchiale, la somministrazione di antistaminici non aiuta,
deve essere somministrato il broncodilatatore in caso di attacchi acuti (dispnea). L’antistaminico
sarà inefficace, perché istamina è una molecola con un’emivita brevissima, di circa 9 millisecondi, e
viene inattivata dall’istaminasi e da altri mediatori. Questo ci dice che:
- Istamina e i mediatori pre-formati intervengono nelle prime fasi dell’asma bronchiale e
comunque non sono i principali mediatori di danno a carico dei bronchi. I mediatori principali
responsabili del danno a carico dei tessuti sono quelli che nell’arco di alcuni minuti il mastocita
sintetizza ex novo. Quindi da un lato il mastocita, attivato e stimolato dalle IgE che si sono
legate all’allergene, degranula immediatamente (quindi cross-linking e degranulazione);
dall'altro lato, i mediatori principali dei danni ai bronchi non sono quelli secreti nella prima
degranulazione, ma vengono sintetizzati e rilasciati dopo pochi minuti/ore.
- Dei meccanismi patogenetici che causano la broncostrizione, il più importante è la
contrazione della muscolatura liscia. Basta interrompere la contrazione e il calibro del bronco
ritorna normale.
• Se non ci fosse aumento della permeabilità vascolare noi non avremmo mai l’edema.
____
5
Riassunto
induzione di asma
bronchiale da IgE
____
• Il meccanismo che conduce alla sintesi di IgE è l’attivazione di una risposta Th2 mediata che
prende inizio dalla produzione di citochine che vengono prodotte con meccanismo attivo dalle
cellule epiteliali della mucosa bronchiale. Quindi, queste cellule, a seguito di stimolazione di
allergeni che legano recettori a profili molecolari, producono citochine che attivano i basofili da un
lato, e dall’altro inibiscono le cellule dendritiche e inducono nei linfonodi una risposta Th2
mediata, ma non soltanto la Th2 mediata perché in gioco entra adesso il Th9. La combinazione di
questi due linfociti conduce alla produzione di una serie di citochine che inducono la sintesi di IgE,
lo switch isotipico di IgE, la differenziazione di eosinofili nel midollo osseo, soprattutto i mastociti
attivano IL-9, e poi si ha anche la produzione di una serie di chemiochine (sempre soprattutto da
parte dei mastociti) che richiamano in situ anche gli eosinofili.
• Il meccanismo di danno ai tessuti è il concorso di 3 fenomeni che sono causati dai mastociti in una
prima fase e dagli eosinofili in una seconda fase:
- 1) contrazione muscolatura liscia;
- 2)edema;
- 3) ipersecrezione di muco.
• Mentre i mediatori responsabili di queste fenomeni sono:
- 1) in una primissima fase e per un brevissimo tempo, l’istamina;
- 2) entro minuti od ore, l’attivazione della sintesi di nuovi mediatori da parte del mastocita;
mediatori che prendono origine dall’acido arachidonico che normalmente si trova ancorato
nel versante interno della membrana e per effetto dell’enzima lipossigenasi o Lox.
• L’acido arachidonico dà luogo alla formazione di composti biologicamente e farmacologicamente
attivi, questi composti sono:
- a. leucotrieni B4;
- b. leucotrieni C4;
- c. PAF : altro mediatore lipidico che si forma nel mastocita e che ha anch’esso caratteristiche
biologiche simili ai leucotrieni.
• La differenza sostanziale tra i mediatori di neosintesi e l’istamina è l’EMIVITA, secondi o
millisecondi nell’istamina e 10-20 ore in media per i mediatori lipidici.
• Che ruolo hanno nell’asma bronchiale gli eosinofili? Cosa rilasciano?
• Degranulando rilasciano gli enzimi contenuti nei granuli, che causano un danno cronico a livello
della mucosa! Per cui gli eosinofili sono i responsabili dei fenomeni di cronicizzazione!
• I TEST che utilizziamo per mettere in evidenza la sensibilizzazione di un individuo nei confronti di un
allergene sono, dapprima il PRICK TEST, e successivamente i test che si basano sul DOSAGGIO DI IgE
SPECIFICHE (è utilizzato il sistema ELISA in particolare è usato l’ELISA SANDWICH nel quale un Ab
viene legato ad un supporto di plastica, poi va l’allergene e infine il siero del pz che contiene le IgE,
per cui l’allergene viene a trovarsi a mo’ di prosciutto tra due fette di un panino!). Questo è un test
molto diffuso in laboratorio, anche gli ormoni si dosano in questa maniera.
• La scoperta degli Ab monoclonali ha dato luogo al loro utilizzo in qualsiasi settore della medicina.
Questo va dall’utilizzo in vivo in Ab monoclonali (anche l’asma bronchiale ne è un esempio), all’uso
di questi come componenti di test diagnostici! Le industrie farmaceutiche vendono proprio il kit
diagnostico, cioè tutto quello che serve per dosare, per esempio, le IgE.
• I farmaci di uso più comune sono:
- 1) CORTICOSTEROIDEI, che costano poco e hanno poche controindicazioni;
- 2) MONTELUCAS , uno dei farmaci inibitori dei recettori dei leucotrieni;
- 3) OMALIZUMAB, che è il più efficace tra tutti, ma anche il più costoso e per questo si utilizza
solo quando il Montelucas non va bene.
____
6
Prick Test
____
Note
____
• Nel momento in cui eseguiamo un Prick Test, somministriamo ad un soggetto che sospettiamo allergico
ad un determinato allergene, proprio quel determinato allergene per via intradermica o ancora meglio
ne depositiamo una piccola goccia sulla cute e poi esponiamo il derma graffiandolo con una lancetta per
fare in modo che l’allergene, in piccola quantità, venga a contatto con i mastociti del derma.
Sapremo se quel soggetto è realmente sensibilizzato osservando la formazione di un ponfo
eritematoso ed edematoso, e lo osserviamo subito perché quanto detto è il risultato di una
sensibilità immediata. In questo caso il risultato di una reazione, così come in vivo il sintomo
clinico, si manifesta dopo pochi minuti.
• Cosa può accadere in questo tipo di test?
• Può accadere che dopo pochi minuti, il soggetto avrà il ponfo sulla superficie dell’avambraccio,
ponfo che è indice dell’avvenuta sensibilizzazione del soggetto nei confronti di quell’allergene.
• A questo punto il ponfo si ridurrà dopo un’ora, un’ora e mezza circa ma, può accadere che dopo
4-9 ore ricompaia spontaneamente.
• Cos’è accaduto?
• E’ una risposta successiva detta TARDIVA (perché si realizza in un lasso di tempo di qualche ora)
• Da cosa dipendono queste reazioni tardive così frequenti da osservare? E da cosa sono mediate?
• La reazione tardiva ci indica il reclutamento di eosinofili nella sede in cui abbiamo somministrato
l’allergene, mediato dall’esotossina rilasciata dai mastociti, e gli eosinofili, una volta reclutati nel
sito di deposizione dell’allergene, rilasciano mediatori e causano nuovamente una reazione
edematosa ed eritematosa.
• Gli eosinofili, oltre ad essere responsabili dei fenomeni di cronicizzazione nelle malattie
allergiche, sono quindi anche responsabili delle reazioni tardive che si verificano
nell’ipersensibilità immediata.
____
• La sintesi di IgE non è immediata, ma come in una risposta primaria la sintesi di un anticorpo ha
una fase di latenza. Nel momento in cui vengono prodotte le IgE l’antigene viene eliminato.
• Il mastocita rimane sempre nei tessuti a prescindere che ci siano o meno le IgE. Ci sono infatti
fattori di crescita e di attivazione per i mastociti. Tuttavia il basofilo può andare nei tessuti e
differenziarsi in mastocita, ma nel momento in cui vengono prodotte le IgE, queste vanno a legarsi
a tutte le cellule che esprimono recettori ad alta affinità e queste cellule sono soltanto tre: i
mastociti tissutali,i basofili e gli eosinofili circolanti. Ma a noi in questo momento interessa il
tessuto. Infatti se l’antigene penetra per via sistemica, ci interessa ciò che avviene nel basofilo
circolante. Ma in questo momento ci occupiamo dei mastociti tissutali dell’albero bronchiale, in
quanto stiamo analizzando un antigene che accede attraverso le vie respiratorie.
____
7
Reazioni di
Ipersensibilità di II
tipo
____
• Una reazione di ipersensibilità è una risposta immunitaria dannosa che provoca alterazioni
tissutali e può causare gravi patologie. Deriva dall'interazione di un antigene (endogeno o esogeno)
con anticorpi umorali o da reazioni immunitarie cellulo-mediate.
• Nello specifico, le reazioni di Ipersensibilità di Secondo Tipo, sono reazioni Anticorpo-Mediate di
tipo citotossico veicolate da anticorpi IgG o IgM, i quali interagiscono con antigeni presenti sulla
superficie di membrana di specifiche cellule, rendendole suscettibili di fagocitosi, in un tempo di
risposta molto rapido di circa 30 minuti.
• sono reazioni mediate da Ab della classe IgG o IgM, sono Ab diretti contro Ag presenti sulla
membrana delle cellule. Questi Ag possono essere di due tipi:
- 1) Molecole coinvolte nella funzione della cellula (per esempio dei recettori);
- 2) Molecole che servono a interazioni cell-cell o cell endoteliale (come le glicoproteine delle
piastrine).
• Quindi o semplici molecole di membrana o molecole di tipo recettoriale.
• Gli Ab della classe IgG o IgM hanno una serie di meccanismi di azione che conducono ad un unico
esito.
• Se un Ab lega un Ag presente su una cellula cosa immaginiamo che accada?
• Intanto opsonizza, cioè lega la cellula.
• A questo cosa può seguire?
• Quale meccanismo porta ad eliminazione della cellula bersaglio sulla quale si è legata un Ab?
- 1) Fagocitosi mediante legame al recettore Fc γ R1 (con più alta affinità) o eventualmente il
2, essi mediano la fagocitosi da parte di neutrofili o di macrofagi;
- 2) ADCC mediata da recettore CD16 o di III tipo a bassa affinità e NK come cellula effettrice;
- 3) Attivazione della via classica del sistema del complemento, che conduce alla lisi cellulare a
seguito dell’attivazione dei componenti della via comune terminale.
• Questi meccanismi che abbiamo visto essere sinora estremamente utili affinché un Ab possa
provvedere all’eliminazione di un microrganismo, adesso essi stessi, in questo tipo di reazione,
causano una malattia!
• Per cui, facciamo riferimento a due gruppi di malattie legate alla produzione e lo sviluppo di Ab
contro questi gruppi di Ag di cui abbiamo pocanzi parlato: o dei recettori di membrana, per es. i
recettori per ormoni, o dei recettori presenti su cellule ematiche. Cominciamo da queste ultime.
____
8
Effetti patologici di
reazioni di
ipersensibilità di II
tipo: Anticorpi
contro antigeni
strutturali del
sistema AB0 -Rh
____
• Le malattie scaturite da questo tipo di reazioni, dipendono, come già osservato, dall’interazione
degli anticorpi (IgG e IgM) con antigeni strutturali ( come antigeni del sistema AB0 o del sistema
Rh) presenti sulle membrane di cellule precise quali i globuli rossi, le piastrine, i leucociti, cui
consegue, a seconda del tipo di cellula bersaglio interessata, una diversa patologia:
- - ANEMIA EMOLITICA: nel caso in cui l’interazione avviene tra anticorpo e antigene
presente sulla membrana di un globulo rosso;
- - PIASTRINOPENIA: se l’interazione interessa recettori di superficie delle piastrine;
- - LEUCOCITOPENIA: l’interazione riguarda i leucociti, i quali riducono di numero
manifestando maggiore suscettibilità da parte dell’organismo a sviluppare infezioni.
• Ma, nonostante il comune meccanismo patogenetico (interazione: anticorpo- antigene
strutturale), i meccanismi effettivi attraverso cui si provvede alla distruzione della cellula
bersaglio sono differenti e da ciò consegue che anche i sintomi e l’entità della malattia scaturita
saranno differenti.
• Prendiamo in riferimento, nel caso delle Anemie, due diverse forme di incompatibilità:
- - INCOMPATIBILITA’ TRASFUSIONALE: In questo caso la mancata compatibilità riguarda gli
antigeni del sistema AB0 presenti sulla membrana del globulo rosso i quali vengono
riconosciuti come “estranei” e legati dagli anticorpi che provvedono ad attivare il sistema del
complemento per “distruggerli” provocando un emolisi in circolo. In questa particolare caso
si verifica shock e emoglobinuria (concentrazioni anormalmente elevate di emoglobina nelle
urine, in seguito a lisi degli eritrociti).
- - INCOMPATIBILITA’ MATERNO-FETALE PER FATTORE RH: Si verifica in caso di seconda
gravidanza in condizioni di feto Rh+ e madre Rh-. Il fattore Rh è un antigene geneticamente
determinato. Se una donna Rh negativa (Rh-) alla prima gravidanza partorisce un bambino Rh
positivo (Rh+) è probabile che i globuli rossi del feto, che possiedono l'antigene Rh, entrino nel
circolo sanguigno materno. Di conseguenza il corpo della madre reagisce producendo
anticorpi contro l'antigene estraneo(Rh), i quali anticorpi rimarranno presenti nel suo sangue,
per un eventuale secondo contatto. In caso di una seconda gravidanza, infatti, gli anticorpi
prodotti(detti anticorpi anti Rh attaccheranno i globuli rossi fetali distruggendoli. Gli anticorpi
anti-Rh vengono anche definiti “anticorpi incompleti” perché non sono in grado di fissare il
complemento in vivo, pertanto l’emolisi è mediata dalla fagocitosi ad opera dei macrofagi
nella milza. In questo particolare caso si verifica Ittero (colorazione giallastra di cute, e
mucose in generale).
• E’ possibile prevenire l’insorgenza di questa patologia (anche nota come eritroblastosi fetale)
iniettando alla madre(Rh-), entro 72 ore dal primo parto, anticorpi specifici, come il Rhogam, che riconosce
e blocca l'antigene Rh, dei globuli rossi, che dal feto passa alla madre, il quale andrebbe a scatenare
una potente reazione immunitaria che porterebbe il feto a morte. Questo processo deve essere ripetuto
con ogni gravidanza successiva alla prima esposizione della madre all' antigene Rh.
• Domanda: E’ POSSIBILE UNA MALATTIA DA INCOMPATIBILITA’ MATERNO-FETALE ALLA PRIMA
GRAVIDANZA?
• Si, se la madre ha precedentemente subìto una trasfusione con sangue incompatibile o è andata incontro ad
aborto incompatibile, cioè se è già entrata in contatto con l’antigene Rh.
• In questi casi si ricorre al test di Coombs (test dell’antiglobulina), utilizzato per rilevare la presenza
di anticorpi fissati alla superficie dei globuli rossi, oppure liberi nel siero, cioè di qualsiasi molecola
che possa reagire con particelle poste sulla superficie dei globuli rossi.
• Nel caso specifico si utilizza per verificare la presenza di anticorpi anti-Rh nella madre oppure,
nell’uomo, per diagnosticare un’anemia emolitica autoimmune.
• Esistono due modalità di svolgimento del test:
- - MODALITA’ DIRETTA: usata per visualizzare anticorpi “incompleti” attaccati ad antigeni dei
globuli rossi;
- - MODALITA’ INDIRETTA: consente di visualizzare anticorpi incompleti presenti nel siero.
____
9
Effetti patologici di
reazioni di
ipersensibilità di II
tipo: Anticorpi
contro antigeni
strutturali
recettori per
ormoni neurotrasmettitori
____
• Le reazioni Di Ipersensibilità di II tipo possono anche provocare malattie in cui l’azione degli
anticorpi è sempre diretta contro antigeni di membrana, che in questo caso fungono da recettori, e
in particolare recettori per ormoni o recettori per neurotrasmettitori. Tra queste ricordiamo:
- - MALATTIA DI GRAVES ( DI FLAJANI o DI BASEDOW o DI PARRY o GOZZO TOSSICO DIFFUSO): è
una condizione di ipertiroidismo, cioè di aumentata funzionalità della ghiandola tiroidea, la
quale viene iperstimolata a produrre quantità massive di ormoni, in assenza di una risposta al
feedback di autoregolazione che coinvolge ipotalamo ed ipofisi. In questo particolare caso
l’azione degli anticorpi è diretta contro il recettore TSH della tiroide, presente sui tireociti
(cellule follicolari tiroide). In condizioni di salute l’ipofisi produce TSH (ormone
tireostimolante) che stimola la produzione di ormoni tiroidei da parte del tireocita, i quali
ormoni, con meccanismo a feedback negativo, inibiscono, a loro volta, la produzione di TSH
ipofisario; questo processo garantisce l’omeostasi di ormoni sia ipofisari sia tiroidei. Ma in
condizioni di patologia, i soggetti affetti, producono anticorpi diretti contro il recettore del
TSH che si vanno a posizionare esattamente sullo stesso sito di legame dell’ormone e ne
mimano l’azione, cioè di fatto questo anticorpo si comporta funzionalmente come se fosse TSH, perciò
avverrà la stimolazione continua e progressiva delle cellule tiroidee a produrre una quantità sempre
maggiore di ormoni, ma non viene svolta l’azione di feedback negativo sull’ipofisi, (perché il
TSH è inibito ma l’anticorpo, che funge da TSH, continuerà a stimolare la ghiandola tiroidea).
Di contro avremo: bassi livelli di TSH = elevati quantità di ormoni tiroidei = ipertiroidismo.
L'effetto piu rilevante è a carico del sistema cardiocircolatorio. La terapia di tale patologia è
una terapia principalmente immunosoppressiva (inibisce la risposta immunitaria contro
antigeni non-self) , che raramente vede la somministrazione di anticorpi monoclonali per le
malattie autoimmunitarie.
- - MIASTENIA GRAVIS : è una malattia dovuta ad una riduzione della trasmissione nervosa a
livello neuromuscolare, in assenza quindi di stimolo dal nervo al muscolo, causata da anticorpi
che bloccano i recettori colinergici (dell’acetilcolina) postsinaptici della giunzione neuromuscolare,
inibendo l'effetto stimolante del neurotrasmettitore acetilcolina. in questo caso gli anticorpi
anti-recettori si legano in un sito diverso rispetto a quello dell’acetilcolina stessa, a differenza
della precedente patologia. In condizioni di normalità la trasmissione è mediata dal rilascio
del neurotrasmettitore acetilcolina, il quale lega un recettore, presente a livello della
giunzione neuromuscolare, composto da 5 catene proteiche che formano una sorta di canale il
quale permette il passaggio di ioni ( Ca++) , responsabili della contrazione muscolare. In caso
di patologia, la diminuzione del numero di recettori funzionanti, cui consegue una diminuita
contrazione muscolare, causa una diffusa debolezza muscolare che spesso sfocia in una
paralisi progressiva.
• Domanda: POSSIAMO IPOTIZZARE CHE, IN QUESTO CASO, SI INSTAURI UNA COMPETIZIONE TRA
RECETTORE E ACETILCOLINA?
• E’ possibile parlare di competizione nel momento in cui anticorpo e acetilcolina leghino lo stesso sito, quindi
“competano” nel legarsi ad esso. Ma, poiché essi si associano a due siti differenti, il meccanismo di inibizione
a livello della giunzione neuromuscolare non è un meccanismo di competizione. Una volta che l’anticorpo
anti-Ach (acetilcolina) lega il suo recettore, l’intero complesso formatosi, viene internalizzato in un endosoma
e successivamente digerito con una tale velocità che la sintesi di nuovi recettori non è in grado di sopperire
alla velocita di degradazione. Ciò comporta una progressiva diminuzione dei recettori di membrana , per cui
l’acetilcolina non può legarsi non perché l’anticorpo compete nel legame, ma perché non trova nessun
recettore cui legarsi , dal momento che questi vengono internalizzati e distrutti in forma di complesso.
• Nel primo caso abbiamo ,quindi, osservato che l’anticorpo “mima” la funzione dell’ormone,
legandosi allo stesso sito, nel recettore.
• Nel secondo caso invece l’anticorpo lega un sito diverso dal neurotrasmettitore(acetilcolina)
quindi il meccanismo prevede che il complesso anticorpo-recettore venga internalizzato e distrutto
impendendo quindi all’Ach di legarsi poiché letteralmente non trova alcun recettore cui legarsi!
Entrambi i meccanismi inducono un simile effetto: morte della cellula bersaglio su cui si trova il
recettore o inibizione della funzione della cellula su cui si trova il recettore.
• NOTA BENE: Una donna affetta da malattia di Graves o Miastenia Gravis, che va incontro a gravidanza è in
grado di trasmettere la patologia al feto poiché tramite placenta è possibile il passaggio di anticorpi (igG o
IgM) rispettivamente o contro il recettore del TSH o contro il recettore dell’acetilcolina, facendo si che il
nascituro manifesti la malattia. Ma La differenza tra la patologia del nascituro e della madre risiede nel fatto
che nel figlio, scomparse le IgG materne, la malattia termina, e noi sappiamo bene che la concentrazione di
IgG trasmesse dalla madre diminuisce sensibilmente intorno al sesto mese di vita, momento in cui il neonato
inizia la produzione di proprie IgG. Comunque sia, in caso di patologia conclamata viene effettuata una
plasmaferesi (tecnica di separazione del plasma sanguigno dagli altri elementi del sangue mediante
centrifugazione)al feto e dunque successiva rimozione delle IgG materne in modo tale che la malattia cessi.
____
10
Reazioni di
Ipersensibilità di
III tipo
____
• Si tratta sempre di reazioni, in questo caso mediate da immunocomplessi, innescate
dall’interazione tra un anticorpo e un antigene di natura solubile, che attivano il sistema del
complemento. Però i meccanismi patogenetici e immunologici che causeranno il danno ai tessuti
saranno sostanzialmente diversi per la presenza di un antigene solubile e non cellulare.
• Vi sono tre tipi di complessi antigene anticorpo a seconda delle diverse proporzioni instaurate tra i
due elementi:
- - immunocomplessi con eccesso di antigene; (solubili)
- - immunocomplessi all' equivalenza tra antigene e anticorpo; (insolubili)
- - immunocomplessi con eccesso di anticorpi. (insolubili)
• Questi tre tipi di immunocomplessi hanno proprietà biologiche anche differenti e rispecchiano
quello che progressivamente accade, in maniera del tutto fisiologica, in caso di una risposta
immunitaria normale. In sostanza costituiscono tre diverse fasi di un unico processo (la risposta
immunitaria)
• Nello specifico, quando somministriamo una dose antigenica ad un individuo o ad una cavia da
esperimento, nelle fasi iniziali, in cui la risposta anticorpale non è ancora iniziata, la quantità di
antigene supera di gran lunga quella degli anticorpi. Quindi, nella fase iniziale della risposta
immunitaria prevalgono immunocomplessi in eccesso di antigene. Progressivamente, però, la
quantità di anticorpi prodotti tende ad eguagliare quella degli antigeni che, intanto, vengono
inglobati negli immunocomplessi. In questa fase intermedia, le quantità di antigeni e anticorpi
sono uguali e legate in forma di immunocomplessi definiti all’equivalenza. La caratteristica
fondamentale di questi immunocomplessi risiede nella totalità dei legami che anticorpi e antigeni
instaurano tra di loro. Questo, infatti, fa si che tali immunocomplessi perdano di solubilità dal
momento che non possono legarsi a molecole d’acqua poiché già impegnati in altri legami. In sintesi
se gli unici legami possibili avvengono tra anticorpi e antigeni e non con molecole d’acqua è chiaro che i
complessi formati manchino di solubilità e tendano a precipitare rapidamente, nell’endotelio di un eventuale
vaso sanguigno o nel connettivo e nei tessuti, nel caso in cui il vaso in cui si forma è fortemente
permeabilizzato. In corrispondenza delle fasi finali di una risposta immunitaria, ci troveremo in una
condizione in cui l’antigene è stato quasi completamente eliminato, ma nel contempo la produzione
anticorpale è incrementata formando, quindi, degli immunocomplessi in eccesso di anticorpo. Tali
immunocomplessi possiedono proprietà chimico-fisiche simili ai complessi precedenti (all’equivalenza),
poiché anche in questo caso presentano scarsa solubilità e tendenza a precipitare.
____
11
Effetti patologici di
reazioni di
ipersensibilità di
III tipo
____
• Ci sono due forme di malattie da ipersensibilità di III tipo:
• 1) La forma sistemica: la malattia da siero (che non esiste più), reumatismo articolare acuto, lupus
eritematoso sistemico e, in parte, l'artrite reumatoide.
• 2) La forma localizzata: sperimentalmente prendiamo in considerazione il fenomeno di Arthus.
• Il fenomeno di Arthus è una reazione localizzata che si verifica in una sede in cui viene inoculato
ripetutamente un antigene. Un individuo, avendo avuto molteplici inoculi di un antigene, ha
sviluppato una notevole quantità di anticorpi (è un individuo immune o addirittura iperimmune).
• In questo caso si somministra all'animale da esperimento localmente (ad esempio per via
intramuscolare) una proteina. Poi la risomministriamo nuovamente (anche fino a 8
somministrazioni della proteina).
• La prima inoculazione ha dato luogo a una risposta primaria, la seconda a una risposta
secondaria, mentre le successiva hanno amplificato ancora di più l'entità della risposta. Questo è
un soggetto che ha una grossa quantità di anticorpi IgG diretti contro quella determinata proteina.
• All'ennesima somministrazione locale, nel sito della somministrazione si formano
immunocomplessi in eccesso di anticorpi. Questi complessi non hanno solubilità e precipitano
nell'endotelio del vaso e qui attivano il sistema del complemento per via classica con rilascio di
mediatori: ma in questo caso il processo infiammatorio è talmente intenso che, oltre ad avere la
degranulazione dei basofili con rilascio di istamina e la degranulazione delle piastrine con rilascio
di serotonina, abbiamo anche un importante adesione delle piastrine all'endotelio vascolare. Si
forma,in questo modo,un trombo che occludo il vaso. Il tessuto a valle del vaso va incontro ad
ischemia e in seguito a necrosi: la zona di necrosi, a volte, può staccarsi dal tessuto e cadere
(Escara).
• Arthus lo mise in evidenza sperimentalmente inoculando una proteina di cavallo in un coniglio,
che formò la zona di necrosi dopo la quarta-quinta somministrazione con escara conseguente.
• In patologia umana è difficile osservare il fenomeno di Arthus.
• Lo possiamo osservare inoculando ripetutamente per via intramuscolare farmaci.Mentre le
patologie da immunocomplessi di tipo sistemico sono riconducibili ai primi due tipi di
immunocomplessi, immunocomplessi in eccesso di antigene, che determinano un aumento della
permeabilità vascolare e immunocomplessi all'equivalenza che precipitano dove c'è permeabilità
determinando il processo infiammatorio, il fenomeno di Arhtus è dovuto all'azione degli
immunocomplessi in eccesso di anticorpi.
• Il lupus eritematoso sistemico è mediato da anticorpi diretti non solo, ma anche contro il DNA.
Nei pazienti con questa patologia,il DNA è solubile.
• In questo caso anche gli istoni, l'RNA, varie proteine nucleari, cellulari possono fungere da
autoantigeni.
• Le malattie da immunocomplessi sono dovute ad anticorpi diretti contro antigeni solubili.
____
12
Reazioni di
Ipersensibilità di
IV tipo (ritardata)
____
Varianti delle
reazioni di
Ipersensibilità di
IV tipo (ritardata)
____
• Le reazioni da ipersensibilità di IV tipo non sono mediate da anticorpi bensì da linfociti T CD4 e
CD8 (se in un alcune reazioni si ha anche la formazione di anticorpi, questi non hanno un'azione
patogenetica, rappresentano solo un epifenomeno) e viene anche detta "ipersensibilità
cellulo-mediata"
• Mentre le prime tre ipersensibilità erano immediate: i sintomi si evidenziano dopo pochi minuti
dalla seconda esposizione all'antigene, questo tipo di ipersensibilità invece è ritardata: i segni si
manifestano di solito dopo 2-3 giorni dalla successiva somministrazione dell'antigene.Non
confondiamo questa ipersensibilità con le reazioni tardive, che si verificano nelle risposte
allergiche o IgE mediate. Sono situazioni diverse sia dal punto di vista clinico, che dal punto di
vista patogenetico. Le reazioni tardive delle risposte allergiche dipendono dagli eosinofili e
comunque si manifestano dopo qualche ora (e non dopo qualche giorno) dall'esposizione
all'allergene.
• La memoria immunologica è trasferibile.
• Trapiantando linfociti T della memoria centrale dal linfonodo di un topo (immunizzato nei
confronti di un antigene) in un altro topo, che deve essere geneticamente identico (perché
altrimenti rigetta le cellule), quest'ultimo acquisisce passivamente memoria nei confronti di quel
determinato antigene anche se non l'ha mai visto.
• Questa metodica ovviamente non può essere applicata all'uomo perché si dovrebbe trovare un
secondo individuo ricevente geneticamente identico al primo.
• Questo sistema ha permesso sperimentalmente di definire alcuni aspetti fondamentali
dell'immunologia, ad esempio il fatto che una malattia può essere mediata da un anticorpo e non
da un linfocita T (lupus eritematoso).
• Anche nell'uomo è possibile trasferire malattie con anticorpi: una madre affetta da morbo di
Graves o miastenia gravis può trasferire attraverso la placenta anticorpi al feto che nasce con la
malattia.
• Quindi il trasferimento di cellule o sieri è stato utile per caratterizzare cellule che mediano la
memoria, popolazioni linfocitarie e meccanismi effettori di certe malattie; ma si parla pur sempre
di modelli sperimentali.
____
• Esistono tre varianti di reazioni di ipersensibilità ritardata:
- Le reazioni di ipersensibilità ritardata vera e propria;
- Le reazioni di ipersensibilità da contatto, note come dermatiti da contatto, che si verificano
in seguito al contatto con apteni;
- Le reazioni di ipersensibilità di tipo granulomatoso.
• Tutte queste reazioni sono sempre mediate da linfociti CD4.
• Può cambiare la morfologia e il tipo di reazione che dipende sia dall'agente eziologico che ha
causato la reazione sia dal distretto anatomico in cui essa si verifica.
- La prima reazione che prendiamo in considerazione è il test alla tubercolina.
- Per il secondo tipo di reazioni,prendiamo in considerazione le dermatiti da contatto.
- Per il terzo tipo di reazioni prendiamo in considerazione il micobatterio della tubercolosi
come agente che causa la reazione (granuloma).
____
13
Ipersensibilità di
IV tipo: Variante 1
- Ipersensibilità
ritardata propria
-Test di reazione
alla tubercolina
____
• La classica forma di ipersensibilità ritardata si ha quando una molecola lipoproteica o proteica
viene somministrata, per via intradermica, per la seconda volta.
• Il tipico esempio usato come prototipo è la REAZIONE ALLA TUBERCOLINA.
• Che cos’è la reazione alla tubercolina? E perché si eseguiva?
• Consiste nella somministrazione intradermica ( o sottocutanea ma l’intradermica è la migliore) , sulla
superficie volare dell’avambraccio di un individuo , della tubercolina.
• La tubercolina veniva usata una volta ed era l'estratto del brodo di coltura del micobatterio della
tubercolosi ( conteneva sicuramente proteine,lipidi ed altri componenti del micobatterio).
• Oggi si utilizza solo la componente proteica purificata e più precisamente il prodotto prende il
nome di derivato proteico purificato (PPD) e la reazione adesso prende il nome di reazione al PPD.
• Tuttavia rimangono sconosciute le componenti del ppd. Una decina di proteine sono state
identificate, ma si pensa che il ppd ne contenga almeno un centinaio; quindi è un illustre
sconosciuto, tuttavia viene ampiamente utilizzato in diagnostica in vivo.
• Somministrazione ppd ad un soggetto -> dopo 28-72 h (essendo una reazione di ipersensibilità
“ritardata”) -> Possiamo avere due possibilità:
- Avambraccio dell’individuo non mostra alcun cambiamento ( TEST AL PPD NEGATIVO);
- Avambraccio dell’individuo mostra un ponfo eritematoso in durativo (e non morbido come
nelle reazioni igE mediate il quale conteneva edema, liquido) contenente cellule, e in
particolare 90-95% macrofagi e 10-5% linfociti T. Questa volta il processo infiammatorio non è
più caratterizzato da una risposta con formazione di edema- vasodilatazione ma mediata da
macrofagi, infatti si chiama cellulo-mediata. Se il soggetto dopo 48-72 h sviluppa una reazione
di questo tipo TEST AL PPD POSITIVO. In realtà non basta che formi il ponfo eritematoso in
durativo per definire il test al ppd positivo, infatti viene misurato il diametro il quale deve
superare i 2-5 mm per poter considerarlo tale.
• Perché in un soggetto il test al ppd è negativo e in un altro positivo?
- Il primo (test ppd negativo) non aveva mai incontrato l’antigene.
- Il secondo (test ppd positivo) invece è stato precedentemente sensibilizzato all’antigene, ovvero dal
contatto con il micobatterio della tubercolosi -> infezione!
• Prendiamo in considerazione il secondo caso ( test ppd positivo): il soggetto che è stato
precedentemente infettato dal micobatterio della tubercolosi ha sviluppato cellule T della memoria
nei confronti di vari antigeni proteici del micobatterio (questi linfociti T della memoria centrale si
trovano nella paracorticale del linfonodo). Una volta somministrato il ppd , le cellule denditriche
legano, processano e presentano l’antigene di micobatterio, vanno nel linfonodo, attivano linfociti
T che differenzia in cellula della memoria effettrice, che migra nel tessuto, produce citochine una
volta che riconosce l’antigene specifico ( risposta che tipicamente è mediata dai linfociti Th 1 che
producono INF-gamma , TNF); quindi reclutamento e attivazione dei macrofagi ( fagocitosi), questo
è il motivo per il quale questo tessuto è ricco di monociti oltre che di linfociti cd4 Th1 .
____
14
Ipersensibilità di
IV tipo: Variante 1
- Ipersensibilità
ritardata propria Test di reazione
alla tubercolina
____
• Oggi non c’è nessun vaccino utilizzabile nei confronti del micobatterio della tubercolosi se non il
BCG che non funziona. Il BCG è micobatterio patogeno per i bovini che nell’arco di 12 anni di
passaggi in coltura è stato inattivato. Recentemente è stato sequenziato l’intero genoma del
micobatterio della tubercolosi e del bcg per cercare di capire cosa ha determinato l’inattivazione
nel bcg rispetto al micobatterio patogeno e si è scoperto che ha causato la delezione di molti geni
tra cui un plaster che si chiama RD1 che comprende un centinaio di geni.
• Allora si è pensato di utilizzare due di queste proteine che non sono presenti nel bcg ma sono
presenti nel micobatterio patogeno e con adiuvanti opportuni vedere se protegge; queste proteine
sono eccezionali nell’immunogenicità, cioè inducono un’importantissima risposta immunitaria Th1
molto più forte di quella indotta dal bcg nei confronti del micobatterio ma non proteggono! Quindi
immunogenicità e protezione non sempre vanno di pari passo. Ad oggi non c’è nulla di meglio del
bcg per quanto questo sia inefficace.
• Un soggetto può aver avuto la tubercolosi da bambino ( infezione) quindi essere positivo al test,
e rifacendo il test trovarlo negativo??
• SI se :
- È immunocompromesso, per esempio ha l’aids;
- Ha fatto radioterapia;
- Ha assunto farmaci immunosoppressivi;
- Ha assunto farmaci corticosteroidei.
• Tutte queste opzioni realizzano una condizione di immunosoppressione.
• Il test è dunque negativo non perché non si ha mai avuto l’infezione ma anche per fenomeni di
immunosoppressioni.
• Esiste un virus che causa una condizione transitoria di immunosoppressione come il virus del
morbillo ( paramixovirus) tale da rendere il test negativo.
• Infatti la principale utilizzazione di questo test oltre che da screening dell’infezione tubercolare,
serve a valutare se un individuo ha una risposta T linfocitaria normale oppure compromessa.
• Un soggetto può non essere stato mai infettato da micobatterio della tubercolosi e avere test
positivo??
• SI: se ha subito vaccinazione con BCG, il vaccino (effettuato con il micobatterio attenuato) induce
una risposta T linfocitaria ma non protegge e non si sa il perché.
• Esistono solo 2 condizioni per cui il test è positivo:
- Infezione da micobatterio della tubercolosi;
- Vaccinazione con BCG.
• Fino a qualche anno in Italia la vaccinazione con BCG veniva effettuata in due categorie a rischio:
personale sanitario e parasanitario e militari. Oggi è stata completamente abbandonata.
• Tuttavia nei paesi dove la vaccinazione viene fatta routinariamente (Estremo Oriente, Russia , Ex
Unione Sovietica, Africa), di fatto è impossibile distinguere se un test è positivo e se è avvenuta
infezione da micobatterio o per la vaccinazione con bcg; qualcuno sostiene che sia dipendente
dall’entità del diametro del ponfo: se è molto grande, in genere, indica un’infezione recente da
micobatterio piuttosto cha una vaccinazione.
• Quindi la distinzione è improbabile a meno che nel test non utilizziamo proteine che sono
presenti nel micobatterio ma che non sono presenti nel bcg; ma questo ad oggi non viene fatto nel
test in vivo .Questo potrebbe permettere la distinzione.
• Il 95% delle persone infettate non sviluppano la tubercolosi (infettati ma sani). Solo il 5% sviluppa
la malattia . Questo è dovuto alla risposta naturale dell’ospite, di cui però è sconosciuto il
meccanismo.
____
15
Ipersensibilità di
IV tipo: Variante 2
- Ipersensibilità da
contatto Dermatiti da
contatto
____
• Il secondo tipo di reazione di ipersensibilità ritardata è una reazione che prende il nome di
ipersensibilità da contatto, o più comunemente dermatite da contatto.
• Come indica il nome stesso, la reazione si verifica in seguito al contatto di sostanze chimiche
con la cute.
• Le sostanze chimiche che danno luogo ad una ipersensibilità da contatto hanno delle
caratteristiche fisico-chimiche molto particolari, tanto che non li possiamo considerare degli
immunogeni veri e propri poiché rientrano in quella categoria di antigeni chiamati apteni
(molecole con basso peso molecolare e non sono in grado da solo di indurre una risposta
immunitaria).
• Un tipico aptene che è molto coinvolto nelle reazione di ipersensibilità da contatto è il Nichel,
praticamente ubiquitario non ci sono gioielli o oggetti in metallo che non ne contengano, ed in
questo caso la risposta immunitaria si attiva al seguito del contatto dell’aptene con la cute.
• Come fa il nichel o un qualunque aptene a indurre una risposta immunitaria?
• Un aptene (sia esso il nichel o il dinitroclorobenzene) deve essere legato necessariamente
ad un carrier che trova sulla cute stessa, il carrier è dunque una proteina endogena che
conferisce immunogenicità all’aptene.
• In questo caso l’aptene che si lega a proteine della cute viene captato da cellule dendritiche (per
eccellenza l’epidermide è ricca di cellule dendritiche in particolare cellule di Langerhans), e
comportandosi da tipiche APC, captato il complesso carrier-aptene, lo portano nella paracorticale
del linfonodo dove attivano un linfocita T e dopo differenziazione in linfocita T effettore e si va
a localizzare nella cute.
• Qui però il processo si arricchisce di un altro protagonista, i cheratinociti che svolgono un ruolo
estremamente attivo nella patogenesi delle dermatiti da contatto (è stato già visto come i cheratinociti
partecipano attivamente alla patogenesi nelle allergie e nell’attivazione di una risposta Th2).
• In questo caso i cheratinociti producono una miriade di citochine, come TNF-alfa o IL-1 con
un importante attività pro-infiammatoria. E producono anche chemiochine che reclutano i
neutrofili e macrofagi.
• Qui dunque il danno è provocato in parte dai linfociti T attivati dall’aptene, in parte dal
ruolo attivo svolto dai cheratinociti.
• In queste reazioni intervengono un tipo particolare di linfociti Th: oltre a Th1, ci si potrebbe
aspettare che intervengano i th22 impiegati nel mantenimento dell’omeostasi delle mucose ma non
ci sono evidenze di una partecipazione di questa popolazione, invece vi è la certezza della
partecipazione dei linfociti th17 e dei CD8 in queste reazioni.
• Oltre alle cellule di Langerhans per la presentazione degli apteni intervengono altri due citotipi,
simili alle cellule dendritiche, presenti nel derma e che si differenziano per il fatto che una
popolazione esprime langherina mentre l’altra non la esprime.
• La langherina è una molecola di membrana molto importante per i fenomeni di posizionamento e
di legame a livello del derma e l’espressione o meno di questa molecola è il segnale distintivo che
permette di distinguere le popolazioni
• Ricapitolando abbiamo tre differenti popolazioni di cellule dendritiche nel derma: le cellule di
Langerhans (specializzati nell’attivazione di th17), cellule che esprimono langherina(specializzati
nell’attivazione di th1 e CD8) e cellule che non esprimono langherina (non si sa in cosa siano
specializzate). Popolazioni diverse di DC attivano popolazioni diverse di linfociti perché producono
citochine diverse.
• A livello cutaneo che cosa si manifesta in un paziente affetto da dermatite da contatto?
• Si possono avere di vescicole doloranti oppure ad esempio in una dermatite da contatto da talco
dei guanti si hanno delle lesioni tipiche che nel complesso costituiscono l’eczema, ciò può portare a
lichenificazione della cute, cioè la cute diventa durissima, tende a spaccarsi e si è soggetti a
maggiori infiltrazioni di microrganismi e dunque una maggiore suscettibilità ad infezioni.
____
16
Ipersensibilità di
IV tipo: Variante 2
- Ipersensibilità da
contatto - Diabete
mellito
insulino-dipendente
____
• Un altro tipo di reazione di ipersensibilità ritardata sui generis prevede l’intervento di
linfociti CD4, CD8 e di anticorpi, tuttavia il danno di un tessuto non è svolto dagli anticorpi
né dai CD4 ma dalla citotossicità dei CD8.
• La malattia in questione si chiama diabete mellito insulino-dipendente.
• E’ una malattia autoimmunitaria in cui il sistema immunitario di un individuo riconosce non più
come self le cellule beta del pancreas e le distrugge.
• Si tratta di soggetti che vanno incontro progressivamente ad un depauperamento delle cellule
beta pancreatiche che producono insulina.
• La causa (eziologia) della malattia è autoimmunitaria, la patogenesi è procurata in questo caso
come in altri (ad esempio le anemie emolitiche) da una qualunque reazione di ipersensibilità di
secondo tipo o di terzo tipo (come il lupus eritematoso sistemico).
• Tutte queste malattie sono contemporaneamente autoimmunitarie causate da reazioni di
ipersensibilità.
• Non si sa da cosa sia innescato il diabete mellito né perché solo le cellule beta non vengono riconosciute
come self a differenza di tutte le altre cellule pancreatiche.
• Il meccanismo di citotossicità è mediato dall’intervento di FAS e ligando di FAS.
____
17
Ipersensibilità di
IV tipo: Variante 3
- Ipersensibilità
granulomatosa Infezione
Mycobacterium
tuberculosis
____
• L’”ultima” reazione di ipersensibilità ritardata è quella definita granulomatosa, ossia che dà vita
a lesioni granulomatose.
• Il granuloma è la struttura istologica che identifica e dà il nome a questa reazione.
• Per questo tipo di reazione si può fare riferimento all’infezione del micobatterio della
tubercolosi.
• L’infezione avviene per inalazione da un soggetto che ha la tubercolosi, infatti questo
espettorando (tosse, starnuto) o anche semplicemente respirando (o cantando), libera il
micobatterio che si localizza nell’alveolo.
• Cosa succede a chi viene infettato dal micobatterio?
• Ogni 100 soggetti che vengono infettati, solo 5 sviluppano la malattia, gli altri 95 controllano
l’infezione e non vanno mai incontro alla malattia.
• Quel 5% che sviluppa malattia e la manifesta nell’arco di 1-2 mesi con un rischio che comunque
permane elevato entro i due anni dalla prima infezione tubercolare, sono soggetti che sono
tipicamente immunocompromessi.
• Come la controlla l’infezione il restante 95% dei soggetti?
• Attivando una risposta immunitaria protettiva, ma come sia fatta questa risposta
immunitaria protettiva non è ancora noto.
• E’ noto, tuttavia, che c’è un segnale che indica che è in atto una risposta immunitaria
protettiva, ed è la formazione di un granuloma nel polmone.
• Il problema è che l’infezione viene controllata MA l’individuo nel corso della sua vita non diventa
mai sterile infatti il micobatterio rimane quiescente all’interno del granuloma.
• Un soggetto che presenta un’infezione latente da micobatterio della tubercolosi ha nel corso della
vita un rischio del 10% di manifestare la malattia, ma questo rischio aumenta di 800 volte se
l’individuo va incontro ad una condizione di immunodeficienza ad esempio se viene infettato
da HIV.
• Nel mondo 2 miliardi di persone hanno un’infezione latente da micobatterio e dunque che hanno
un rischi del 10% di riattivare il micobatterio (200 milioni).
• Il granuloma non si può asportare perchè si correrebbe il rischio di liberare il micobatterio così
come avviene con alcuni farmaci biologici, come anticorpi monoclonali anti-TNF (MAB anti-TNF)
utili per curare altre malattie quali l’artrite reumatoide. Ciò accade poiché il TNF ha un ruolo importante
nella composizione del granuloma e nella sua curabilità nel tempo, attaccando esso si scompagina il
granuloma e così il micobatterio viene liberato.
• Questo è stato scoperto in seguito al fatto che molti pazienti affetti da artrite reumatoide curati
con anticorpo monoclonale sviluppavano la TBC.
• Adesso infatti prima di intraprendere questo tipo di terapia bisogna fare il test di Mantoux.
• Uno dei problemi legati alla terapia con MAB anti-TNF, soprattutto con quelli di topo, è la
possibilità di andare incontro ad una reazione di ipersensibilità di III tipo e questo è uno dei
motivi per cui gli anticorpi monoclonali in uso in terapia umana vengono geneticamente
modificati: la porzione variabile, che lega l'antigene, rimane di topo, mentre si tolgono tutte le
porzioni costanti dell'anticorpo monoclonale e si sostituiscono con la regione costante di un gene
umano.
• Questo riduce moltissimo il rischio di reazioni da immunocomplessi.
• NOTA BENE: Il granuloma, anche se finisce in -oma, non è un processo neoplastico, quanto una reazione
infiammatoria cellulo-mediata.
• Il granuloma non è normalmente evidenziabile con una radiografia al torace, ha una grandezza di
qualche micron e dunque non comporta difficoltà nella respirazione e normalmente si forma nella
porzione apicale del polmone, che è più aerata (e dove si va a posizionare per tropismo il micobatterio
della tubercolosi).
• Il granuloma è molto importante per contenere l'infezione di Mycobacterium tubercolosis,
che una volta fagocitato dai macrofagi presenti nell'alveolo polmonare, mette in atto una serie di
strategie per cui sfugge all'uccisione intracellulare, tra queste c'è quella di impedire la
rimozione di TACO dalla membrana del fagosoma, impedendo dunque la fusione del fagosoma con
il lisosoma.
• Questi meccanismi fanno sì che non solo il micobatterio non venga ucciso una volta
fagocitato, ma anzi trova tutte le condizioni ideali per replicarsi.
• Nel momento in cui si forma il granuloma la crescita del micobatterio viene ridotta in
maniera consistente però il soggetto rimane infettato in modo latente. Il micobatterio si
adatta alle nuove condizioni e rimane dormiente anche per decine di anni.
____
18
Ipersensibilità di
IV tipo: Variante 3
- Ipersensibilità
granulomatosa Risposta
immunitaria
contro
Mycobacterium
tuberculosis
____
• Nel momento in cui il macrofago alveolare fagocita il micobatterio, il macrofago sarà infettato dal
micobatterio, in quanto questa è la prima cellula che trova nel suo percorso.
• Così com'è, il macrofago ha pochissime possibilità di eliminare il micobatterio.
• Infettato il macrofago, il micobatterio comincia a replicarsi e stimola il macrofago a produrre
citochine; contemporaneamente il microrganismo verrà anche legato dal DC-sign delle cellule
dendritiche, viene internalizzato, digerito e presentato ai linfociti T nel linfonodo, portando
all'attivazione dei linfociti T CD4 e in particolar modo Th1. Questi linfociti T si localizzeranno
nel polmone, laddove si trovano i macrofagi infettati dal micobatterio.
• La formazione del granuloma dipende necessariamente dalla partecipazione dei linfociti T CD4.
• Questo ci spiega un aspetto clinico della tubercolosi, ovvero che i soggetti affetti da HIV, avendo pochissimi
linfociti T CD4, sviluppano la malattia; e inoltre dato che i linfociti Th1, come tutti i linfociti T helper
non sono dotati di proprietà effettrici dirette, non fanno citotossicità ma producono citochine,
tipicamente TNF e IFN-gamma .
• L'IFN-gamma potenzia l'attività dei macrofagi ed in particolare la loro citotossicità ed inoltre
fa anche produrre al macrofago chemiochine e citochine; tra le citochine viene prodotta TNF.
• Le citochine dei linfociti Th1 e dei macrofagi richiamano, nel sito dove si trova il micobatterio,
macrofagi, che si organizzano a formare questa struttura , che altro non è che un accumulo di
macrofagi focalizzati in un determinato punto del polmone, che noi chiamiamo
GRANULOMA.
• Così la replicazione del micobatterio si interrompe e in gran misura viene anche ucciso; una
certa carica di micobatterio rimane dormiente e non più in grado di replicarsi.
• Il micobatterio “dormiente” non può essere attaccato dal sistema immunitario in alcun modo.
• Il micobatterio si adatta abbastanza bene all'ambiente che trova all'interno del macrofago
(particolari condizioni di pH e di ipossia) e infatti, se confrontassimo i geni del micobatterio che
vengono trascritti durante la fase di replicazione attiva e durante la fase di latenza, è come se
stessimo parlando di due batteri completamente differenti.
• Alla periferia del granuloma si forma una zona fibrotica dovuta al fatto che i macrofagi
producono due citochine che si chiamano TGF-beta (transforming growth factor) e PDGF (platelet
derived growth factor) che sono fattori di crescita dei fibroblasti.
• Nella parte centrale del granuloma si forma invece una forma di necrosi che somiglia moltissimo
al formaggio fuso e per questo motivo si chiama necrosi caseosa (da caseum, “formaggio” in
latino).
• Questa zona di necrosi è provocata dall'azione di TNF: questo causa un'ischemia perché
aumenta l'espressione delle molecole di adesione delle piastrine, fa aderire le piastrine e fa
trombizzare il vaso. La necrosi caseosa è quindi una necrosi ischemica causata da TNF
• Nel granuloma sono anche presenti altri due tipi di cellule, molto più grandi dei macrofagi,
che sono caratteristiche del granuloma:
- cellule epitelioidi, macrofagi che si pongono a mutuo contatto formando delle vere e
proprie palizzate; prendono questo nome perché somigliano alle cellule epiteliali, per il fatto
di essere tra di loro mutuo contatto
- cellule giganti plurinucleate (cellule di Langhans), formate dalla fusione di macrofagi.
• Questi due tipi di cellule non hanno più attività fagocitaria e microbicida, ma possono solo
secernere citochine e enzimi.
____
19
Ipersensibilità di
IV tipo: Variante 3
- Ipersensibilità
granulomatosa Risposta
immunitaria
contro
Mycobacterium
tuberculosis
____
• Grazie all'azione della vitamina D al processo di fibrosi può seguire la deposizione di sali di calcio
e quindi la calcificazione: in questo caso il granuloma è evidenziabile con la radiografia. Si dice
che il micobatterio latente rimane “murato vivo” all'interno del granuloma.
• Sia la fibrosi che la calcificazione non sono fenomeni stabili ma fenomeni dinamici, e sono dovuti
alla produzione di citochine da parte dei macrofagi (TGF-beta e PDGF).
• Il macrofago non attivato inoltre, se non attivato dai linfociti T CD4, non è in grado di mantenere
dormiente il micobatterio.
• Nella zona che sta ad interfaccia tra la necrosi caseosa e l'infiltrato cellulare ci sono dei macrofagi
detti macrofagi schiumosi (foamy macrophages), che contengono dei corpi lipidici (LB, lipidic
bodies). In alcuni casi i fagosomi con all'interno il micobatterio possono anche localizzarsi
all'interno dei corpi lipidici.
• L'infezione si può controllare con combinazioni di farmaci (isoniazide, rifampicina,
cloramfenicolo), somministrati per circa 6 mesi, ma il soggetto non guarisce. Ci sono dei casi
in cui la tubercolosi è causata da ceppi di micobatteri farmaco-resistenti provenienti soprattutto
dalla Cina (come il ceppo Beijing, dal nome della città, Pechino). I farmaci antitubercolari finora
conosciuti (non solo quelli approvati, ma anche quelli sperimentali) non hanno alcun effetto.
Chiunque si infetti con questo ceppo di micobatteri è “spacciato”.
• Nel momento in cui un soggetto si co-infetta con HIV o viene trattato con anticorpi anti-TNF, la
parete del granuloma viene scompaginata.
• All'interno del granuloma avviene che le cellule plurinucleate di Langhans e le cellule
epitelioidi rilasciano una quantità tale di enzimi che danneggiano e degradano l'intero
parenchima; in questo modo i micobatteri vanno liberi al di fuori del macrofago e questa zona di
parenchima polmonare che viene “scavata” prende il nome di caverna tubercolare; questa cavità si
forma soprattutto quando più granulomi che vanno incontro a questa degradazione si fondono tra
di loro, tanto che a volte la caverna può occupare anche una parte importante di parenchima
polmonare.
• La caverna contiene micobatteri e questa si può aprire:
- in un vaso (sanguigno o linfatico): in questo caso il contenuto della caverna va in circolo, il
micobatterio si dissemina e questo è il modo in cui la tubercolosi va ad interessare vari organi,
determinando meningite tubercolare, pericardite tubercolare, ascite tubercolare, tubercolosi
renale ecc.
- in un bronco: il micobatterio può dunque, tramite i colpi di tosse, uscire all'esterno tramite
espettorato. Questa è infatti la modalità con cui si trasmette la malattia.
____
20
Immunologia - Trapianti, Aloreattività
tipi di trapianto
____
PROF DIELI
May 21, 2012
• trapianto è una parola che comprende diverse entita cliniche secondo i rapporti tra donatore e
ricevente.
• ne distinguiamo almeno 4 tipi:
• isotrapianto: due individui della stessa specie geneticamente identici (gemelli) - trapianto ideale,
perche le propbabnilità di rigetto sono praticamente nulle
• autotrapianto: il donatore e il ricevente coincidono, anche qui il caso di rigetto è molto ridotto,
ed esiste riguardo soltanto un tessuto, piuttosto che un organo: il midollo osseo.
• allotrapianto: la forma piu comune di trapianto di organi solidi, in cui il donatore e il ricevente
appartengono alla stessa specie ma non sono geneticamente correlati (solitamente il donatore è un
cadavere)
• xenotrapiantpo: la speranza ed il futuro dei trapianti, data la scarsità di organi disponibili di
fronte alla grande richiesta. riguarda donatori di specie diverse: LA SCIMMIA è la specie piu affine
all'uomo. uno xenotrapianto è+ stato effettuato diversi anni fa, un cuore di babuino o di maiale è
stato trapiantato in un uomo, ma è stato rigettato dopo poco tempo. poltre al problema del rigetto
vi è anche la possibilità di infezione dell'uomo con batteri o virus propri dell'animale e per i quali
l'uomo non ha difese.
• la compatibilitàm donatore ricevente è data da diversi sitemi, alcuni li conosciamo già.
• il piu importante sistema è il sistema AB0 (quando abbiamo parlato dell'ipersensibilità di II tipo
abbiamo detto che nessuna donazione puo avvenire senza prima la compatibilità del sistema AB0).
• rarissime volte si può fare un trapianto controgruppo : procedura estremamente rischiosa solo
per condizioni estreme.
• dopo aver selezionato un possibile donatore o ricevente, il secondo livello di compatibilità è dato
dal sistema di HLA: donatore e ricevente, in modo auspicabile, devono essere compatibili per HLA1
e HLA2. quindi bisogna scegliere il donatore con maggior grado di compatibilità con il ricevente.
• in fine, un aspetto molto importante per il trapianto di midollo osseo, esiste un terzo livello di
compatibilità per il quale non c'è un test per conoscerlo, sistemi minori di istocompatibilità (HA
antigeni del complesso minore di istocompatibilità e HY antigeni di istocompatibilità codificati dal
cromosoma y(assenti in individui di sesso femminile: se una donna viene a contatto con cellule
maschili, il suo corpo può riconoscere HY come estraneo, e far partire una reazione contro questo.
i grafts versus host possono essere dati da incompatibilità tra donatore maschio e ricevente
femmina)).
• qualunque forma di incompatibilità causa il rigetto del trapianto mediato dalla risposta
immunitaria.
• il ruolo della risposta immunitaria fu acclarato con esperimenti sui topi intorno gli anni 50: il
rigetto di un trapianto è mediato da linfociti t e non da anticorpi:
- è stata trapiantata della cute da un topo donatore a un ricevente non geneticamente
correlati;
- dopo un po' di tempo il topo ricevente rigetta la cute trapiantata.
- da questo topo che ha rigettato prendiamo del siero e lo iniettiamo in un altro topo
- quando a questo topo che ha ricevuto il siero inoculato viene trapiantato un pezzo di cute
dal topo donatore iniziale il rigetto viene effettuato molto piu velocemente, in molto meno
tempo. tipo di reazione che ci saremmo aspettati da una risposta immunitaria secondaria.
• lo sappiamo anche dall'evidenza clinica che la compatibilià a livello di HLA è cruciale per il
trapianto.
• la percentuale di rigetto di un rene in base a livello di compatibilità tra donatore e ricevente diminuisce al
diminuire della compatibilità HLA (campione di 1000 pazienti immunosoppressi)
• la percentuale di incidenza di grafts versus host in base a livello di compatibilità tra donatore e ricevente del
50% in donatore ricevente HLA identici: a causa dei sistemi di istocompatibilità minori.
• il ricevente può aver trapiantato un organo con bassa compatibilità HLA (MM6) a seconda delle
aspettative di attesa dell'organo richiesto: se c'è poca probabilità che un organo arrivi viene
trapiantato il primo che si presenta, che deve avere compatibilità AB0 e può avere un grado
basso di compatibilità HLA .non è possibile infatti selezionare a priori un donatore. il rigetto, in
questi individui, è evitato dalla continua somministrazione, vita natural durante, di farmaci
immunosoppressori.
• in soggetti immunodepressi aumenta l'incidenza di trasformazioni neoplastiche varie, tra cui la priu
frequente è il linfoma post trapianto.
____
1
modalità di rigetto
____
• tre forme di rigetto di un organo, facendo riferimento al criterio temporale.
• oltre a differire per un criterio temporale differiscono per il meccanismo patogenetico che hanno
alla base, che sono totalmente diversi
• rigetto iperacuto, rigetto acuto e cronico.
• rigetto iperacuti: nell'arco di minuti/ore dopo il trapianto - un rene rigettato nel momento in
cui il chirurgo abboccò i vasi: l'organo diverò bianco e si ruppe, come fosse esploso a causa di una
trombosi massiva, che è la condizione essenziale di questo tipo di rigetto, e richiede l'intervento
delle piastrine, cellule che non sono coinvolte negli altri tipi di rigetto. il rigetto iperacuto si
verifica subito dopo l'unione dei vasi. il meccanismo molecolare fa si cheche inesca questo
rigetto dipende dalla presenza nel ricevente da anticorpi gia formati contro antigeni del
donatore, attraverso varie modalità:
- per aver ricevuto un trapianto precedente da un individuo qualunque, con un antigene in
comune con il donatore attuale. Per evitare che il ricevente ideale abbia già anticorpi contro il
donatore, specialmente se non è il primo trapianto che subisce, si fa il test del cross match per
evidenziare la presenza di anticorpi contro cellule del donatore. se il cross test è positivo, nonostante
tutte le compatibilità, il trapianto è da evitare
- per aver ricevuto trasfusioni di sangue in precedenza dallo stesso donatore, o da un donatore
precedente affine al donatore attuale
- per incompatibilità AB0
• quindi notiamo che nel rigetto si verifica sia l'alloreattività sia una risposta di ipersensibilità (II
tipo)
• rigetto acuto: da poche settimane a mesi dopo l'intervento - l'organo ha la possibilità di
ricominciare a funzionare, ma poi viene rigettato dopo del tempo.
- è mediato da linfociti cd4 e cd8: reazione di ipersensibilità di IV tipo
• rigetto cronico: può avvenire anche dopo molti anni.
- è mediato sia da linfociti cd4 che cd8 e da anticorpi: dipende quindi da ll'intervento di
reazioni di ipersensibilità di II tipo e IV tipo.
• gli anticorpi sulla cellula attivano il complemento per via classica, che grazie alla formazione
delle anafilotossine C3a e C5a avvia un processo infiammatorio attivanto basofili etc, e si può
avviare anche cellulare.
____
2
alloreattività
____
• abilità al riconoscimento e alla reazione allogenica delle cellule
• [...]
• esiste l'alloreattività diretta e indiretta
• l'alloreattività indiretta è una risposta immunitaria che nulla ha di diverso con l'attivazione di
un linfocita t, e consiste nel fatto che la cellula dendritica del ricevente riconosce come non self
antigeni del donatore, e fa scatenare una risposta immunitaria in seguito a processamento e
presentazione du MHC2.
• nell'alloreattività diretta, la dendritica del donatore presenta al linfocita del ricevente un
peptide antigenico del donatore stesso.
• l linfocita del ricevente ha però subito una selezione genetica nel riconoscimento dell'antigene in cui un
peptide non self veniva riconosciuto solo su mhc2 del ricevente stesso.
• l'alloreattività presenta molte anomalie: il paradosso dell'alloreattività di un linfocita t
• in un individuo naive gli antigeni di un linfocita t sono specifici per antigeni non-self
nell'ordine 1/100000; mentre hanno una specificità per mhc non self nell'ordine di
100-1000/1000000: quindi il primo paradoso consiste nel fatto che alcuni linfociti t hanno subito
una selezione per complessi mhc con i quali non sono mai venuti a contatto.
• un secondo paradosso consiste nel fatto che le queste cellule che riconscono MHC non self hanno
caratteristiche fenotipiche proprie delle cellule della memoria.
• l'alloreattività diretta è la causa di circa il 90% dei fenomeni alloreattivi.
• alloreattività diretta e indiretta si dividono i compiti: l'alloreattivita diretta è la prima forma
di alloreattivitò che compare, ed è quella che media il rigetto acuto. nel tempo questa forma di
alloreattività tende a scomparire, e molto tempo dopo compare l'alloreattività indiretta, che è
responsabile del rigetto cronico.
• esempi di alloreattività:
• variante diretta
• trapianto di rene - il rene del donatore ha dei vasi sia sanguigni che linfatici - nei vasi linfatici
possono esserci cellule dendritiche del donatore - nel momento che i vasi vengono abboccati le
dendritiche possono andare in un linfonodo e presentare ad un linfocita t del ricevente
• oppure, per la variante indiretta
• dopo il rabbocco dei vasi si verifica che cellule dendritiche del ricevente vadano nel rene del
donatore e internalizzino peptidi del donatore, che saranno presentati su MHC self.
• LE MOLECOLE DI ISTOCOMPATIBILITA' NON SELF, ESPOSTE SU CELLULE NON SELF TRAPIANTATE,
CHE VENGONO PRESENTATE A CELLULE DENDRITICHE SELF SE E SOLO SE CONTENGONO PEPTIDI
SELF.
• il linfocita t self che subisce selezione per particolari peptidi self esposti su mhc self; e può
riconoscere altri peptidi self su mhc non self per fenomeni di cross-reattività: quindi è un fenomeno
fisiologico.
• l'allorattività è il prezzo che paghiamo per avere dei linfociti cross-reattivi.
____
3
alloreattività
____
• la cross reattività avviene non perche vi siano delle sequenze amminoacidiche simili tra i due
peptidi, e tra le mhc self e non self; un aspetto rilevante nella modalità di riconoscimento
recettore-ligando è che questo ricevimento avviene in uno spazio tridimensionale.
• immaginiamo la tasca del recettore del linfocita t con dentro un complesso peptide mhc.
• gli amminoacidi che mediano il legame tra peptide antigenico e tcr sono solo 2: la specificità di un
linfocita t nel riconoscimento di un peptide non self è limitato a 2 amminoacidi. e un solo
amminoacido è riconosciuto, e media il legame, tra un complesso mhc sia self che non self, con il
tcr.
• è importante che in questo caso, che nelle posizioni di legame, vi siano 3 amminoacidi con
caratteristiche fisico-chimiche simili a quelle per cui è selezionato il tcr.
• che uno dei tre l'amminoacidi che venga a mettersi in una delle 3 nella sedi di legame appartenga
al peptide o all'mhc, non ha importanza: se un amminoacido con determinate caratteristiche è
sulla sua regione di legame sul recettore tcr , il linfocita t viene ativato.
• la crossreattività non è quindi riferita alla sequenza di un peptide, ma alle caratteristiche fisiche e
chimiche degli amminoacidi sia del peptide che del mhc: infatti la stessa tasca del tcr può
modellarsi affinchè gli amminoacidi con determinate caratteristiche entrino nei punti ben precisi
delle sedi di legame. questo fenomeno è detto flessibilità della tasca di legame, che insieme alla
cross reattività permette l'aumentata incidenza di fenomeni di alloreattività: reazione immunitaria
contro alloantigeni.
• la specificità naturale di queste cellule non è per l'alloantigene, ma per qualcosa per cui sono
state correttamente selezionate dal timo.
• perche hanno una così grande incidenza di popolazione? perche sono cellule già hanno già
ricevuto la presentazione di un antigene, e contro questo si sono espanse; il fenomeno di
cross-reattività fa si che siano specifiche anche per alloantigeni.
____
4