Classe 1E
SCIENZE NATURALI
PROGRAMMA EFFETTIVAMENTE SVOLTO
A.S.2015/16
TRIMESTRE:
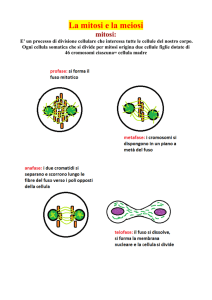
LA DIVISIONE CELLULARE: il ciclo cellulare ed i fattori che lo controllano. I cromosomi e la
loro struttura. La mitosi e la citodieresi; differenze tra la mitosi delle cellule animali e vegetali.
LA GENETICA: il concetto di gene; l'opera di Mendel: principio della segregazione dei caratteri e
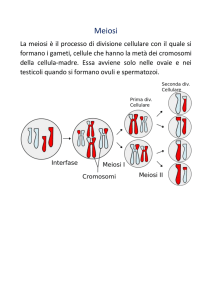
dell'ereditarietà indipendente. La meiosi ed il ciclo vitale. Organismi e cellule aploidi e diploidi; la
meiosi e le sue fasi; la meiosi nella specie umana: lo spermatozoo e la cellula uovo. L'ipotesi di
Sutton. Le mutazioni. Le anomalie cromosomiche: la non disgiunzione (la sindrome di Down,
Turner, Klinefelter). Le traslocazioni, le inversioni e le delezioni.
GENI e CROMOSOMI: la revisione mendeliana; alleli multipli (gruppi sanguigni e fattore Rh; le
trasfusioni di sangue; la malattia materno fetale). La dominanza incompleta; l'eredità poligenica; la
pleiotropia; i geni e l'ambiente. La determinazione cromosomica del sesso; gli esperimenti su
Drosophyla; i caratteri legati al sesso: colore degli occhi in Drosophyla, emofilia, daltonismo e
distrofia muscolare di Duchenne nell'uomo.
PENTAMESTRE.
IL DNA: la comprensione del suo ruolo; gli esperimenti di Griffith e quelli sui batteriofagi. Il
modello di Watson-Crick; la replicazione (meccanica ed energetica).
IL CODICE GENETICO: geni e proteine; la sintesi proteica (trascrizione e traduzione) Gli RNA
(ribosomico, messaggero, di trasporto). La comprensione del codice. le mutazioni geniche. Il gene
eucariote (esoni, introni, splicing)
CHIMICA GENERALE
IL LEGAME CHIMICO: l'energia di legame; il legame covalente puro e polare; il legame ionico;
il legame dativo; valenza e numero di ossidazione. La teoria del legame di valenza; legami sigma e
pi greco; il legame metallico. Le forze intermolecolari: le forze di Van der Waals (dipolo-dipolo,
dipolo-dipolo indotto, dipolo indotto-dipolo indotto); il legame idrogeno; il legame ione-dipolo.
LA NOMENCLATURA CHIMICA: regole per l’attribuzione del n° di ossidazione, i composti
binari con l’ossigeno (ossidi basici e acidi), i composti binari con l’idrogeno (idruri metallici,
covalenti, idracidi, Sali binari); gli idrossidi, gli acidi ossigenati, i Sali ternari, di ammonio, i Sali
acidi.
LE REAZIONI CHIMICHE: cos'è una reazione chimica; i coefficienti stechiometrici e
stechiometria della reazione. Esercizi di stechiometria. Principali tipi di reazioni chimiche. Le
reazioni redox ed il loro bilanciamento.
LE SOLUZIONI: generalità sulle soluzioni. Soluzioni gassose; soluzioni liquide Solubilità e
soluzioni sature. La concentrazione delle soluzioni: concentrazione percentuale in massa e in
volume, molarità, molalità