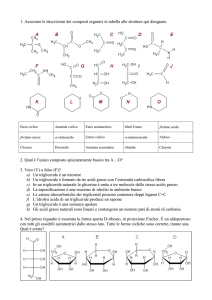
Idrolisi di Esteri -Criteri generali
Idrolisi di esteri
Esistono molte poche esterasi che possono essere utilizzate per
l’idrolisi di esteri. Tra queste particolarmente importanti sono la PLE
(pig liver esterase) HLE (horse liver esterase) e la ACE (acetilcoline
esterase) estratta dall’anguilla elettrica. Possono essere anche
utilizzare le cellule microbiche, ma questo limita la variazione delle
condizioni di reazione. Ampi screening per individuare nuove esterasi
e per esprimerle in microorganismi ospiti sono in corso
Fortunatamente per queste reazioni possono essere utilizzare anche
anche le
proteasi.
proteasi. Le più utilizzate sono la α-chimotripsina e la subtilisina.
subtilisina.
Vengono anche utilizzate, anche se in modo minore, la tripsina,
tripsina,
pepsina,
pepsina, papaina e la penicillina acilasi
In generale vengono idrolizzati gli esteri che mimano la configurazione
configurazione
di un amminoacido L
Substrato tipo per esterasi e proteasi
Idrolisi di esteri
Idrolisi di Esteri –Regole generali
Idrolisi di esteri
9 Per entrambi i tipi di esteri lo stereocentro deve essere collegato
collegato
il più possibile vicino al centro reattivo per assicurare un
riconoscimento chirale massimo.
9 I gruppi R1 e R2 possono essere gruppi arilici o alchilici o sistemi
ciclici, ma la loro differenziazione sterica deve essere
massimizzata.
9 Non devono essere presenti gruppi carichi o polari (COOH, CONH2,
NH2) che sono fortemente idratati in ambiente acquoso. Per cui
devono essere opportunamente protetti.
9 Per i substrati di tipo I la funzione alcolica R3 deve essere la più
piccola possibile (Me, Et).
Et). Questo vale anche per quelli di tipo II
(acetati o propionati).
propionati).
9 In tutti i casi deve essere presente un protone legato allo
stereocentro.
Pig liver esterase (PLE)
Idrolisi di esteri
PLE è l’esterasi
l’esterasi più versatile. E’ un enzima complesso ed è formato da
almeno cinque isoiso-enzimi, che sono associati come trimeri di tre
singole proteine. Per il loro uso come biocatalizzatori possono
comunque considerarsi come una singola proteina perché tutte
mostrano reattività simili.
IL ruolo biologico della PLE è quello di idrolizzare i vari esteri
esteri
presenti nella dieta del maiale, e questo spiega l’eccezionale
tolleranza ai substrati.
Per gli scopi pratici può essere utilizzato anche l’estratto crudo,
crudo, non
necessariamente l’enzima isolato.
Le altre esterasi di fegato (pollo, criceto, cavallo, coniglio) si sono
rivelate meno efficaci.
Idrolisi in condizioni blande con PLE
Idrolisi di esteri (PLE)
Le condizioni blande consentono di idrolizzare composti labili o
altamente funzionalizzati che non resisterebbero alle condizioni
idrolitiche acide o basiche
Idrolisi regio e stereoselettive con PLE
Idrolisi di esteri (PLE)
Solo monomono-acido trans
Asimmetrizzazioni di diesteri
Idrolisi di esteri (PLE)
Centro prostereogenico in α
L’aumentato
ingombro sterico del
gruppo R forza il
substrato ad entrare
nel sito attivo
dell’enzima con la
funzione entiotopica.
entiotopica.
Si ottiene opposta
selettività
Asimmetrizzazione di esteri glutarici 3-sostituiti
Idrolisi di esteri (PLE)
Centro prostereogenico in β
Asimmetrizzazione di diesteri meso aciclici
Idrolisi di esteri (PLE)
(esteri dell’acido succinico e glutarico)
glutarico)
La presenza di una funzione ossidrilica porta ad ottenere
stereoselezioni più elevate
Asimmetrizzazione di diesteri meso ciclici
Idrolisi di esteri (PLE)
Influenza della dimensione del ciclo sulla stereoselezione e selezione
selezione
della funzione da idrolizzare.
L’estere dietilico del cicloesano viene idrolizzato lentamente e con
basse stereoselezioni: importanza dell’alcol utilizzato
Idrolisi di esteri (PLE)
Composti utilizzati per le
sintesi di composti bioattivi.
bioattivi.
I derivati eso sono substrati
migliori degli endo
La sostituzione del residuo
organico influenza
sensibilmente la
stereoselezione. Anche
l’alcol utilizzato ha
notevole importanza
Asimmetrizzazione di diesteri meso ciclici
Idrolisi di esteri (PLE)
(CiclopentanoloCiclopentanolo-monoestere,
monoestere, building block per la sintesi di prostaglandine)
prostaglandine)
Forte influenza della
natura dell’estere
utilizzato. eeMAX=86%
L’acetilcolina
L’acetilcolina esterasi (ACE)
ACE) è più
selettiva e ha stereoselezione
opposta al PLE.
Con l’ACE si osserva anche una
forte influenza delle dimensioni del
ciclo con inversione di selettività
per cicli più grandi.
Selettività simili sono state
ottenute anche con delle lipasi
(Candida antarctica e porcine
pancreas lipase)
Asimmetrizzazione di diesteri meso ciclici azotati
Il
-diacetato (ee=92%) è
cis
Il ciscis-diacetato
cisdicarbossilato
cis
cis-dicarbossilato (ee=75%),
(ee=75%), le
le
Idrolisi di esteri (PLE)
un substrato migliore del
del
stereoselezioni
stereoselezioni sono
sono opposte
opposte
Risoluzione cinetica di diesteri aciclici
Idrolisi di esteri (PLE)
Sono compatibili anche composti organometallici
Risoluzione cinetica di diesteri ciclici
Idrolisi di esteri (PLE)
N-acetilamino ciclopentano carbossilato:
carbossilato:
sintesi di analoghi
carbociclici di nucleosidi
ad attività antianti-virale
sintesi di prodotti naturali
Risoluzione cinetica di diacetati ciclici
Idrolisi di esteri (PLE)
Forte influenza delle dimensioni del ciclo con inversione di selettività
selettività per
cicli più grandi
K1>k3
k4>k3
Utilizzo di esterasi microbiche
Idrolisi di esteri
Sono stati anche utilizzate cellule intere di batteri e funghi
alternativamente agli enzimi isolati.
Bacillus subtilis,
subtilis, Brevibacterium ammoniagenes,
ammoniagenes, Bacillus coagulans,
coagulans, Pichia
miso,
miso, Rhizopus nigricans
Le condizioni di reazione sono più complesse ma in alcuni casi le
le
stereoselezioni sono migliori
La protezione della funzione carbossilica terminale come estere terzterz-butilico
ne previene l’idrolisi
Resting cells di Baker’s
Baker’s yeast
Idrolisi di esteri
Per evitare problemi derivanti dal metabolismo degli organismi nelle
nelle
fermentazioni sono state utilizzare resting cells di Baker’s
s
yeast
Baker’
Un esempio interessante riguarda la risoluzione dell’acetato del
pantolattone,
pantolattone, un precursore dell’acido pantenoico,
pantenoico, costituente di
una vitamina del gruppo B
Risoluzione del 11-alchinalchin-3-il acetato con
resting cells di Baker’s
Baker’s yeast
Idrolisi di esteri
Ulitizzo sintetico di 11-alchinalchin-3-oli
Sintesi di derivati di acidi aril propionici
Idrolisi di esteri
Idrolisi di esteri
L’importanza dei derivati degli acidi arilpropionici come
antiinfiammatori e prodotti agrochimici ha portato ad effettuare
un intenso programma di screening che ha permesso di isolare una
nuove esterasi dal Bacillus Sibtilis, la carbossil esterasi NP.
Idrolisi di esteri
Sintesi di derivati di acidi aril propionici
La presenza di un ossigeno legato allo stereocentro porta ad
un’inversione della selettività di idrolisi
(questo non viene messo in evidenza con l’assegnazione della
configurazione assoluta degli stereocentri,
stereocentri, l’ossigeno ha priorità
maggiore rispetto al carbonio)
Idrolisi di esteri
Utilizzo di proteasi come esterasi:
esterasi: α-chimotripsina
L’utilizzo di proteasi per l’idrolisi di esteri non naturali è stata
applicata con successo già dal 1976 utilizzando principalmente la
la
papaina e l’ α-chimotripsina.
himotripsina. Perché il processo sia altamente
selettivo è necessaria la contemporanea presenza di un sostituente
sostituente
polare e uno idrofobico sullo stereocentro in α alla funzione
esterea (analogamente a quanto avviene negli amminoacidi).
Idrolisi di esteri
Idrolisi regioselettive:
regioselettive: α-chimotripsina vs papaina
La papaina è una delle poche proteasi utilizzate in sintesi organica
di origine vegetale (la papaia). Altre proteasi vengono isolate dai
fichi (ficina
).
(ficina)) e dall’ananas (bromelaina
(bromelaina).
Idrolisi di esteri
Idrolisi regioselettive:
regioselettive: subtilisina
è chirale?
La selettività è completa, nella miscela di reazione non si è
osservata la presenza di altri regioisomeri
Idrolisi di esteri
Idrolisi chemo e stereoselettive: penicillina acilasi
La penicillina acilasi è altamente selettiva
nell’idrolisi di un gruppo fenilaceto del
substrato naturale, la penicillina G.
Per cui gioca un ruolo importante nella chimica
selettiva di gruppi protettori (idrolisi selettiva
acetati
della rimozione
di fenilacetati vs
Idrolisi di esteri
Idrolisi chemo e stereoselettive: penicillina acilasi
Idrolisi stereoselettive: Aspergillus oryzae proteasi
Una proteasi derivante dall’Aspergillus oryzae, utilizzato
principalmente per la lavorazione del formaggio, ha mostrato
elevate reattività e selettività nella risoluzione di substrati
particolarmente ingombrati, carbossilati α,α,α-trisostituiti,
trisostituiti,
sustrati per i quali le altre proteasi non mostrano particolari
reattività
reattività e selettività
selettività
CF3
Ph
MeO
Acido di Mosher:
Mosher: agente derivatizzante chirale
OH
O
Chiral Derivating Agents (CDAs)
CDAs)
CF3
H
(±)
L3
L2
+
XH
Ph
MeO
O
O
H
Cl
L3
L2
X
CF3
H
+
OMe
Ph
X=O, NH
Analisi dei prodotti via NMR:
CF3
Ph
MeO
OH
O
-OMe 1H NMR; -CF3
19F
NMR
L2
X
L3
O
CF3
OMe
Ph
Risoluzione dinamica con proteasi da Streptomyces griseus
Sintesi del Ketorolac,
Ketorolac, un agente antianti-infiammatorio
A pH = 9 il substrato racemizza
mentre non racemizza l’acido
corrispondente. Perché?
O
O
O
OEt
H
OEt
OEt
N
N
N
O
O
O
Ottimizzazione della selettività
Per ottimizzare reazioni enzimatiche che procedono con selettività
selettività non
particolarmente elevate (E=3(E=3-20) possiamo agire sulle tre componenti
principali:
(bio)catalizzatore
bio)catalizzatore
substrato
mezzo di reazione
La possibilità di scegliere un biocatalizzatore migliore è strettamente
legata alla loro disponibilità. Per esempio vi sono poche esterasi
mentra la scelta di lipasi è molto più vasta.
Eventualmente si può modificare l’enzima, per esempio mediante
directed evolution.
evolution.
Ottimizzazione della selettività
Modificazione del substrato
E’ la cosa più agevole, specie per un chimico organico.
Si può agire principalmente sulla struttura
tridimensionale del substrato e secondariamente sugli
effetti elettronici.
Questo può essere fatto agevolmente utilizzando
differenti gruppi protettori che modificano
temporaneamente la natura del substrato e poi possono
essere rimossi
Ottimizzazione della idrolisi catalizzata da PLE
modificazione del substrato
Ottimizzazione della selettività
Si sintetizzano una serie di ammidi che influenzano fortemente il
il
livello di stereoselezione e l’induzione del processo
Ottimizzazione del processo
Ottimizzazione della selettività
modificazione del substrato
Si può anche modificare la struttura del substrato rendendolo
temporaneamente più rigido e ricco di elettroni Π
Riduzione con RaneyRaney-Nickel
Reazioni di desolforizzazione mediate da Raney Nickel
Raney Nickel
(Vedere anche riduzione doppi legami)
Quale è il prodotto atteso dalla reazione dei prodotti
seguenti e Raney Nickel?
Ottimizzazione della selettività
Medium Engineering – Variazione del mezzo di reazione
CoCo-solventi:
solventi: MeOH, t-BuOH,
BuOH, acetone, diossano,
diossano, MeCN,
MeCN, DMF, DMSO
Aggiunte coco-solvente:
solvente: 1010-50%
9
9
9
9
9
Aumento della selettività
Riduzione delle velocità di reazione
Disattivazione dell’enzima ad elevate concentrazioni di coco-solvente
Meccanismo di azione del coco-solvente non chiarito
Difficili previsione del risultati (trial & error)
Studi effettuati principalmente su PLE
Ottimizzazione della idrolisi catalizzata da PLE
Ottimizzazione della selettività
modificazione del mezzo di reazione uso di coco-solvente
Ottimizzazione della selettività
Medium Engineering – Variazione del mezzo di reazione
Effetto del pH
Le reazioni catalizzate da idrolasi vengono condotte
generalmente in soluzioni acquose e a valori di pH
ottimale per l’enzima.
Variazioni di pH possono portare a variazioni
conformazionali dell’enzima, E’ la cosa più agevole,
specie per un chimico organico.
Si può agire principalmente sulla struttura
tridimensionale del substrato e, in maniera minore, sugli
effetti elettronici
Medium Engineering – Variazione del mezzo di reazione
Effetto della temperatura
Generalmente si crede che gli enzimi, analogamente agli altri
catalizzatori esibiscono selettività più elevate a basse
temperature. Questa risulta vero solamente nel caso delle idrolasi
e delle deidrogenasi.
deidrogenasi.
Solo recentemente è stato proposta una spiegazione razionale
dell’effetto della temperatura sulla stereoselezione e si basa sulla
sulla
‘Temperatura di Racemizzazione’.
.
Racemizzazione’
La Temperatura di Racemizzazione (Trac) è la temperatura alla
quale una reazione enzimatica procede senza alcuna
stereoselezione, il che equivale a dire che l’energia di attivazione
attivazione
dei due processi che portano a stereoselezioni opposte è uguale.
La Temperatura di Racemizzazione (Trac) è la temperatura alla
quale una reazione enzimatica procede senza alcuna
stereoselezione, il che equivale a dire che l’energia di attivazione
attivazione
dei due processi che portano a stereoselezioni opposte è uguale.
La variazione di ∆∆G
∆∆G‡ con la temperatura può dipendere solo dal fattore per
cui:
A temperature inferiori a Trac, il contributo entropico è basso e la
selettività
selettività dipende principalmente dalla ∆∆H
∆∆H‡. Per cui aumentando la
temperatura la selettività
selettività (∆∆G
∆∆G‡) diminuisce.
A temperature maggiori di Trac la reazione è controllata principalmente dal
fattore entropico (∆∆S
porterà ad un
∆∆S‡) e un aumento di temperatura porterà
aumento di stereoselezione.
Passando da temperature inferiori a temperature maggiori della Trac si
potrà
potrà osservare un’
un’inversione della stereoselezione del processo. Questo
avviene nel caso di una deidrogenasi di un organismo termofilo
(Thermoanaerobium brockii)
Modelli di Enzimi
Per evitare un approccio trial & error, sono stati sviluppati dei
dei
modelli astratti che possono aiutare il ricercatore nella scelta e
ottimizzazione del substrato.
Molecular Modelling:
Modelling:
Sistemi di calcolo di molecular modelling possono aiutare nella
comprensione dei fattori che determinano la stereoselezione del
processo.
La struttura ai raggi X di un enzima fornisce un’
un’accurata
descrizione della struttura dell’
dell’enzima anche se in condizioni
statiche. Però, poiché
poiché il riconoscimento chirale emerge nella
formazione del complesso substratosubstrato-enzima, un processo dinamico,il
tentativo di predire la stereoselezone sulla base dei dati ottenuti
da strutture ai raggi x è azzardato.
Sono note le strutture di solo alcuni dei biocatalizzatori quali αchimotripsina,
chimotripsina, la subtilisina e alcune lipasi.
Nota la struttura tridimesionale di un enzima, si può cercare di
predirre la selettività
selettività e il decorso stereochimico mediante:
Costruzione del complesso substratosubstrato-enzima negli stati di transizione
diastereoisomerici attraverso conti di dinamica molecolare. Il ∆∆G
∆∆G‡
viene determinati via calcoli force field fornendo risultati
semiquantitativi della attesa selettività
selettività.
Se non si hanno informazione sullo stato di transizione, si può cercare
la migliore interazione del substrato nel sito attivo. Questo si fa
simulando il sistema dopo riscaldamento e raffreddando lentamente.
lentamente.
Si determinano così
così i due minimi di energia per i due complessi
diastereoisomerici.
diastereoisomerici.
Se è nota la sequenza degli ammino acidi si può stimare attraverso
calcoli la struttura tridimensionale in analogia con altri enzimi
enzimi con che
hanno un elevato numero di sequenze omologhe (almeno 60%)
Modelli del Substrato
Si costruiscono quando non si hanno informazioni sull’
sull’enzima
Modello del Substrato per la PLE
Modelli del Sito Attivo
Si fanno delle mappature con differenti substrati. Più
Più substrati si
utilizzano più
ù
affidabile
diventa
il
modello
pi
Modello del Sito Attivo per la PLE (ottenuto con più di 100 substrati)
H = siti idrofobici,
idrofobici, P= siti polari
Il gruppo estereo si deve posizionare nelle vicinanze della serina
Lipasi
Lipasi
Le lipasi sono enzimi che idrolizzano trigliceridi nei corrispondenti
acidi grassi e glicerolo.
glicerolo.
Giocano un importante ruolo nelle biotecnologie poiché
poiché vengono
utilizzati in processi alimentari e per la preparazione di intermedi
intermedi
chirali. Più
Più del 35% delle biobio-trasformazioni vengono effettuate con
lipasi e per questo le lipasi sono gli enzimi più
più studiati.
Sono state clonate più
più di 30 lipasi e sono state risolte le strutture di
12 lipasi.
Il meccanismo con cui idrolizzano funzioni esteree è differente da
quello delle esterasi
Differente interazione fisico chimica con il substrato: l’enzima non mostra
attività finché il substrato è sciolto nel solvente in forma monomerica.
monomerica.
Lipasi e Esterasi:
Esterasi: cinetiche
Lipasi
Differente interazione fisico chimica con il substrato: l’enzima non mostra
attività finché il substrato è sciolto nel solvente in forma monomerica.
monomerica.
Quando la concentrazione aumenta tanto da formare una seconda fase
fase
(lipofilica),
lipofilica), si ottiene un brusco innalzamento della reattività.
Attivazione all’interfaccia:
origina dal fatto che il
sistema diventa attivo solo
quanto la concentrazione
del substrato raggiunge la
CMC (concentrazione
micellare critica)
Attivazione all’interfaccia: la spiegazione a livello molecolare del
fenomeno è stato visto derivare da un riarrangiamento
dell’enzima: l’enzima in fase acquosa è inattivo poiché una sua
parte copre il sito attivo [Enz
].
[Enz].
a contatto con la fasefase-bifasica un piccolo peptide in α-elica si
allontana e scopre il sito attivo e la lipasi si riarrangia nella forma
attiva [Enz
[Enz]]‡.
Per cui idrolisi catalizzare da lipasi devono essere condotte in
mezzi bifasici.
bifasici.
Il substrato può essere usato come tale o dissolto in solventi
organici immiscibili con l’H2O (esano, etere etilico, toluene).
Fenomeni di trasferimento di massa (per esempio agitazione)
influenzano notevolmente la reattività del sistema (rese in
prodotto)
Per determinare l’attività di una lipasi si utilizzano triacilgliceroli
quali la trioleina e tributilina mentre per le esterasi si utilizza il
p-nitroacetato
O CO R
O CO R
O CO R
NO2
O
H2C
O
OH
OH
OH
lipasi
+ 3 R-COOH
O
esterasi
H2C
OH
+ HO
NO2
CoCo-solventi miscibili con l’acqua attivano le esterasi mentre cocosolventi immiscibili attivano le lipasi
Le lipasi sono sono state maggiormente utilizzate in risoluzioni
piuttosto che con composti meso, e con derivati di alcoli chirali,
chirali,
vista la natura dei substrati naturali
In generali le stereoselezioni sono più elevate quando lo
stereocentro è vicino alla funzione carbossilica e in presenza di
di un
protone, (analogamente alle esterasi)
esterasi)
Criteri generali
Per substrati di tipo III la catena R3 deve essere
sufficientemente lunga (3,4 atomi di C) per conferire
sufficiente lipofilicità al substrato. D’altro canto
catene troppo lunghe portano a substrati con punto di
ebollizionetroppo alto e alla formazione di schiume e
emulsioni. n-Butanoati sono normalmente gli esteri
prescelti
Usualmente vengono idrolizzati preferibilmente
substrati con configurazione R allo stereocentro
alcolico. Molte proteasi (α-chimistripsina,
chimistripsina,
subtilisina)
subtilisina) mostrano stereoselezioni opposte.
Nelle strutture risolte ai raggi x si è osservato
che la disposizione della triade catalitica è
invertita nelle due classi di idrolasi. Questa
potrebbe essere l’
l’origine dell’
dell’opposta
stereoselezione.
Criteri generali
Per substrati di tipo IV il residuo R3 dell’alcol deve
essere preferenzialmente una catena alifatica lunga
(n-butanolo).
butanolo). Per questi substrati si è osservata una
preferenza nell’idrolisi di esteri S.
Funghi e batteri producono un elevato numero di lipasi. Poiché sono
sono
enzimi extracellulari possono venire prodotti in elevate quantità
quantità su
larga scala.
Spesso vengono prodotti due isoenzimi (A e B), che sono strettamente
strettamente
correlati. Solitamente mostrano la stesso senso di stereoselezione,
stereoselezione, ma
in alcuni casi si notano diversi valori di stereoselezione.
Estratti di lipasi usualmente contengono entrambe le forme. La loro
attività dipende dal quantitativo di enzima presente nella preparazione
preparazione
e anche dal fornitore.
Requisiti Sterici per le Lipasi
Le lipasi più utilizzate possono essere classificate sulla base delle
caratteristiche del substrato naturale
Lipasi di Pancreas Suino (PPL)
E’ la lipasi più economica e quindi più utilizzata. L’estratto crudo
contiene una serie di altre idrolasi oltre alla PPL (la forma
parzialmente purificata è commerciale ad un prezzo molto più alto).
alto).
L’estratto commerciale che contiene ca 5% di PPL viene chiamato
pancreatina o steapsina. Contiene anche altre idrolasi (αchimotripsina,
chimotripsina, colesterol esterase,
esterase, carbossipeptidasi B, fosfolipasi)
fosfolipasi)
per cui la reattività
reattività osservata può originare dalle diverse specie.
PPL è particolarmente attiva nell’
nell’idrolisi di esteri primari mentre αchimotripsina e colesterol esterase sia con esteri di alcoli primari che
secondari.
Idrolisi regioselettive con PPL
Uno dei problemi principali nella chimica dei carboidrati riguarda
riguarda la
deprotezione selettiva di alcoli secondari
Idrolisi regioselettive possono essere ottenute insieme a risoluzioni cinetiche
PPL e α-chimotripsina
mostrano stereoselezioni
opposte
Idrolisi asimmetrica di derivati meso con PPL
Risultati complementare con l’idrolisi catalizzata da PLE
Ee maggiori con modificazioni del substrato –
sintesi di prostaglandine carbacicliche – trattamento della trombosi
Idrolisi asimmetrica di gliceroli con PPL
1,31,3-propandioli achirali come substrato (fattori stereostereo-elettronici)
Migliori risultati con sistemi bifasici
Risoluzione di acetati biciclici
Reattività delle diverse idrolasi contenute nel PPL
L’elevata selettività è dovuta ad una nuova idrolasi isolata dal estratto di PPL
Idrolisi stereoselettiva di lattoni con PPL
Influenza del sostituente sulla selettività
Il lattone e idrossi acido si separano agevolmente a pH basico.
Acidificando si recupera il secondo enantiomero come lattone
Risoluzione dinamica di ossazoloni con PPL
Risoluzione di N-acil ammino acidi
Risoluzione di epossialcoli con PPL
Complementare all’epossidazione di Sharpless
Addizioni elettrofile
Interazione di un elettrofilo con il sistema Π
Reazione dell’intermedio elettrofilo con un nucleofilo
Elementi chiave:
E-N è un reagente polare
E+ è un elettrofilo
N- è un nucleofilo
Reazioni del cicloesene con reagenti polari
Addizioni di acidi alogenidrici HX (X= Cl, Br,
Br, I)
Processo analogo alla SN1
Quale è il prodotto atteso nella seguente reazione?
Addizioni di acqua in ambiente acido
(con base coniugata non nucleofila)
nucleofila)
Una bassa concentrazione di un
nucleofilo debole minimizza la
formazione del prodotto di
sostituzione
Catalizzatore
Reazione di equilibrio
H
H
H
+ H2O
H2SO4
H
H
OH
Modificando le condizioni possiamo spostare l’equilibrio a
destra o a sinistra
Principio della reversibilità microscopica
Proporre un meccanismo ragionevole per la seguente
trasformazione
Addizione di Cloro e Bromo
L’interazione del sistema Π con la molecola di bromo crea un
dipolo poiché c’è repulsione tra gli elettroni che circondano i
nuclei di bromo ed il sistema Π
Addizione di Fluoro e Iodio
F2 molto reattivo, rompe anche legami CC-H e CC-C
I2 molto poco reattivo, l’equilibrio è spostato a
sinistra (legame CC-I è debole)
Reazione stereospecifica
Reazione stereoselettiva
Si ottengono i due enantiomeri 1:1
Si ottiene un racemo
Esercizio
Assumendo che un alchene lineare reagisca come
il cicloesene,
cicloesene, quale sarà il prodotto di reazione
tra il cis-2-butene e Cl2?
E tra il trans-2-butene e Cl2?
Addizione di X2 in acqua
Sintesi di Aloidrine
Proporre un meccanismo che renda conto della
formazione dell’altro enantiomero, (1S,2S)-trans-2bromocicloesanolo.
Poiché lo iodio non addiziona ad un alchene per produrre un addotto stabile, può essere usato
in un’addizione in cui è presente un nucleofilo diverso dallo ioduro. Questa caratteristica
viene utilizzata nel processo di iodolattonizzazione, illustrato nell’equazione seguente
Proporre un meccanismo per quetsa trasformazione: Quale è la stereochimica attesa del
prodotto? E’ il prodotto chirale? E’ racemo?
Reazione di addizione ad alcheni aciclici
Con che meccanismo si forma il (2S,3S)-2,32,3-dibromobutano?
Epossidazione stereospecifica di olefine con peracidi
Magnesio monoperosso ftalato
Epossidazione stereoselettiva
Con peracidi chirali: stereoselezioni molto basse (ee
(ee < 10%)
Epossidazione alcoli allilici
La presenza dell’ossidrile influenza la stereoselezione del processo
processo
Epossidazione alcoli allilici
Epossidazione alcoli allilici
Reagente di Sharpless
Meccanismo proposto
Epossidazione degli alcoli allilici – Reagente di Sharpless
Reagente catalitico
Ti(IV)/(+)Ti(IV)/(+)-DET/t
DET/t-BuOOH,
BuOOH, setacci molecolari
Epossidazione degli alcoli allilici – Reagente di Sharpless
Doppia stereoselezione
Epossidazione di Sharpless - Risoluzione cinetica
Epossidazione di alcoli allilici racemi con il reagente di Shapless
(Ti(IV)idroperossido)
(Ti(IV)-DETDET-terz-Butil idroperossido)
s= relative rate
Candida sp. Lipasi
Sono disponibili diverse lipasi da lieviti tipo Candida.
I più utilizzati sono quelli di Candida lipolitica,
lipolitica, C. antartica e C. rugosa.
Lipasi di Candida rugosa
Sono principalmente attivi con esteri di alcoli secondari ciclici
ciclici
+ veloce
Modello del Substrato per Lipasi di C. Rugosa
L’estratto di CRL occasionalmente manifesta scarsa selettività con
con esteri
α-sostituiti. Questo è attribuibile alla presenza di due forme isomeriche
dell’enzima che operano con differenti selettività anche se hanno
hanno la
stessa enantiopreferenza
Forma A più selettiva e stabile
Modificazioni non covalenti di Lipasi di C. Rugosa
(trattamento con i-PrOH)
PrOH)
Il semplice trattamento con i-PrOH acquoso (50%) porta ad una lipasi
modificata che mostra un considerevole aumento di attività e
stereoselezione
Lipasi di Candida antartica
Questi enzimi sono stati trovati in Antartico nel
effettuato per ottenere lipasi che operassero in
usare in formulazioni per la detergenza
corso di uno screening
screening
condizioni estreme
estreme da
I due isoenzimi sono abbastanza diversi:
isoenzima A: Ca2+ dipendente, termostabile,
termostabile, molto stabile con trigliceridi
in modo non specifico, non molto utile per sistemi non naturali.
isoenzima B: non è Ca2+ dipendente, meno termostabile,
termostabile, attivo con un
largo numero di substrati non naturali.
Entranbi sono stati clonati e sovraespressi in Aspergillus oryzae e sono
disponibili in larghe quantità
Tipici substrati per lipasi di Candida antartica
Ottimizzazione della selettività con lipasi
Possono essere utilizzate tutte le tecniche viste per le esterasi:
esterasi:
variazioni di temperatura, pH e variazione dei parametri cinetici delle
reazioni (riciclo del prodotto, risoluzione sequenziale). Sono inoltre
disponibili un elevato numero di lipasi. Il mezzo di reazione può
può inoltre
essere modificato passando preferibilmente a sistemi bifasici piuttosto
che a sistemi omogenei.
Modificazione del substrato
Per incrementare la stereoselezione del processo si possono utilizzare
utilizzare
anche composti che abbiano stereocentri sia alla funzione acida e alcolica.
Poiché l’enzima è sensibile a tutta la struttura del reagente questa
questa
semplice modifica può incrementare sensibilmente la selettività.
Si generano dei diastereoisomeri
Il sistema selezione la miglior coppia alcol/acido (coppia match).
match).
Inibizione enantioselettiva di lipasi
Basi chirali (ammine o ammino alcoli) possono giocare un ruolo di inibitore
incrementando notevolmente la selettività.
Si tratta di una
inibizione non
competitiva, causata
dalla coordinazione
dell’ammina a un
diverso sito della
lipasi che non
idrolizza più uno die
die esteri
enantiomerici.
enantiomerici.
Inibizione enantioselettiva di lipasi (Pseudomonas
(Pseudomonas sp. Lipasi)
L’utilizzo dei due enantiomeri porta ad effetti confrontabili