Titolo
Fase
Obiettivo primario
Obiettivi secondari
Criteri di inclusione
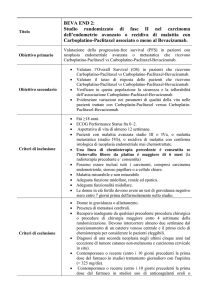
PAOLA-1 : Platino, Avastin and OLAparib in 1° linea
Studio randomizzato di fase 3, in doppio cieco, per valutare olaparib
vs placebo come terapia di mantenimento in associazione a
bevacizumab, in pazienti affette da carcinoma sieroso ad alto grado o
endometrioide dell’ovaio, della tuba o del peritoneo, avanzato, stadio
FIGO IIIB-IV, che abbiano ricevuto chemioterapia di prima linea
con carboplatino-paclitaxel più bevacizumab.
Studio di fase 3, randomizzato, in doppio cieco, multicentrico
Sopravivenza libera di malattia (PFS1) fra olaparib e placebo
1.
Determinare :
•
Tempo alla progressione secondo RECIST o Cancer Antigen-125
(CA-125) o decesso
•
Tempo dalla randomizzazione alla prima terapia successiva o
decesso (TFST)
•
Tempo dalla randomizzazione alla seconda progressione (PFS2)
•
Tempo dalla randomizzazione alla seconda terapia successiva o
decesso (TSST)
•
Sopravvivenza globale (OS)
2.
Valutare la sicurezza e tollerabilità di olaparib in mantenimento
versus placebo.
3.
Confrontare la qualità di vita (HRQoL),i “patient reported
outcomes” (PROs), e la preferenza dalla paziente di olaparib in
mantenimento versus placebo.
4.
Valutare l’impatto del trattamento e la malattia sull'impiego di
risorse.
I-1.
Sesso femminile con età ≥18 anni.
I-2.
Consenso informato scritto.
I-3.
Recente diagnosi di:
I-3-1 Carcinoma dell’ovaio, della tuba e/o del peritoneo,
I-3-2 con istologia :
alto grado sieroso (vedi appendice 2) o
alto grado endometrioide (vedi appendice 2) o
altro carcinoma ovarico epiteliale non mucinoso in una
paziente con mutazione germinale BRCA 1 o 2 mutazione
deleteria.
I-3-3 Stadio avanzato: FIGO IIIB, IIICo IV della classificazione FIGO
1988 (vedi appendice 12)
I-4.
Chemioterapia a base di platino e taxani completata prima della
randomizzazione:
a. Almeno 6 e non più di 9 cicli di terapia a base di platino e
taxani. Se la paziente ha sospeso la terapia con platino
per una tossicità non ematologica, almeno 4 cicli di
terapia con platino prima della randomizzazione
b. Sono permesse: terapia a base di platino endovenosa o
intraperitoneale, terapia neoadiuvante, chirurgia di
intervallo.
I-5.
I-6.
I-7.
I-8.
I-9.
Almeno tre cicli di terapia con bevacizumab in combinazione con
gli ultimi 3 cicli di chemioterapia a base di platino. In caso di
chirurgia di intervallo, almeno 2 cicli con bevacizumab in
combinazione con gli ultimi 3 cicli di chemioterapia a base di
platino. Dose di bevacizumab 15mg/kg ogni 3 settimane per fino
a 15 mesi
Senza evidenza di malattia o in risposta completa o risposta
parziale dopo la prima linea. Senza evidenza di progressione di
malattia durante la terapia di prima linea e prima della
randomizzazione.
Randomizzazione almeno 3 e non più di 9 settimane dopo
l’ultima dose di chemioterapia e recupero al grado ≤ 1 (secondo
CTCAE v4) di tutte le maggiori tossicità dalla precedente
chemioterapia (eccetto: alopecia e neuropatia periferica).
Normale funzionalità d'organo:
a. Emoglobina ≥ 10.0 g/dL.
b. Valore assoluto Neutrofili (ANC) ≥ 1.5 x 109/L.
c. Piastrine ≥ 100 x 109/L.
d. Bilirubina Totale ≤ 1.5 x il limite alto del range di
normalità (ULN).
e. Transaminasi AST/ALT ≤ 2.5 x ULN, eccetto nel caso di
metastasi epatiche ove il valore deve essere ≤ 5 x ULN.
f. Creatinina ≤ 1.25 x ULN e clearance della creatinina
> 50 mL/min.
g. Non in trattamento con anticoagulanti che abbia un
International Normalized Ratio (INR) ≤1.5 e un tempo di
protrombina attivata (aPTT) ≤1.5 x ULN.
Il trattamento con anticoagulanti orali o parenterali è
consentito se l'INR e l'aPTT sono nei limiti terapeutici
(secondo gli standard internazionali accettati) ed il
paziente, al momento della randomizzazione, sia in
trattamento con una dose stabile di anticoagulanti da
almeno 2 settimane.
h. Dipstick delle urine < 2+ per le proteine. In caso di
disptick ≥2+, la proteinuria nelle 24 ore deve essere <1 g.
i. Pressione arteriosa nella norma (sistolica ≤ 140 mmHg
e/o diastolica BP ≤ 90 mmHg) o adeguatamente
controllata con il trattamento.
Eastern Cooperative Oncology Group (ECOG) performance status
0-1 (see appendix 3)
I-10.
I-11.
Criteri di esclusione
E-1.
E-2.
E-3.
E-4.
E-5.
E-6.
E-7.
E-8.
Campione tissutale in paraffina (Formalin fixed, paraffin
embedded, FFPE) del tumore primitivo per il test di BRCA a livello
centralizzato il cui risultato sarà disponibile per la stratificazione
al momento della randomizzazione.
Evidenza di assenza di gravidanza in corso o possibile o
menopausa (naturale o indotta) prima della prima di dose di
trattamento (vedi appendice 4).
Tumore non epiteliale (i.e. tumore germinale) con origine da
ovaio, tuba o peritoneo
Tumore ovarico a basso potenziale di malignità (borderline) o
tumore mucinoso.
tumore endometriale sincrono a meno che tutti i seguenti criteri
non siano rispettati:
a. stadio < II,
b. età < 60 anni al momento della diagnosi di carcinoma
endometriale stadio IA o IB grado 1 o 2, o stadio IA
grado3; ovvero età ≥ 60 anni al momento della diagnosi di
carcinoma endometriale I A grado 1 o 2.
Pazienti con tumore endometriale sieroso, a cellule chiare o
carcinosarcoma non sono eleggibili.
Precedenti neoplasie negli ultimi 5 anni eccetto: tumori cutanei
"non-melanoma", cancro della cervice in situ e carcinoma duttale
della mammella in situ, adeguatamente trattati. Pazienti con
anamnesi di neoplasia localizzata precedente ai 5 anni dall'inizio
del trattamento possono essere eleggibili se hanno completato la
terapia adiuvante prima della randomizzazione e sono libere da
malattia.
Pazienti con storia di tumore mammario triplo-negativo possono
essere eleggibili qualora abbiano completato il loro trattamento
definitivo più di 3 anni prima e siano liberi da neoplasia prima
dell'inizio del trattamento in studio.
Pazienti con anamnesi positiva per sindrome mielodisplastica o
leucemia mieloide acuta
Pazienti che hanno avuto in almeno un ciclo un ritardo di
trattamento > 2 settimana a causa di tossicità ematologica
prolungata.
Radioterapia nelle 6 settimane precedenti l'inizio del
trattamento.
Chirurgia maggiore nelle 4 settimane prima dell'inizio del
trattamento. La paziente deve aver recuperato completamente
E-9.
E-10.
E-11.
E-12.
E-13.
E-14.
E-15.
E-16.
E-17.
E-18.
E-19.
E-20.
da ogni effetto della chirurgia maggiore per essere eleggibile.
Precedente trapianto di midollo allogenico
Precedente trattamento con inibitori PARP, incluso olaparib.
Somministrazione concomitante di chemioterapia, ogni altro
agente antitumorale o radioterapia durante il periodo dello
studio. Sono consentiti la terapia ormonale sostitutiva e gli
steroidi a scopo antiemetico.
Utilizzo concomitante o recente (entro 10 giorni precedenti alla
randomizzazione) di aspirina a dosi maggiori di 325 mg/die
Utilizzo simultaneo di potenti inibitori del citocromo CYP3A4
come: ketoconazolo, itraconazolo, ritonavir, indinavir, saquinavir,
telithromicina, claritromicina and nelfinavir.
Storia di crisi ipertensive (CTCAE G4) o di encefalopatia
ipertensiva.
Presenza di almeno una malattia cardiovascolare clinicamente
significativa (i.e. attiva) incluso:
a. Infarto del miocardio o angina instabile nei 6 mesi
precedenti alla randomizzazione
b. New York Heart Association (NYHA) ≥ G2 scompenso
cardiaco congestizio, (vedi appendice 5).
c. Aritmia scarsamente controllata dai farmaci (i pazienti
con fibrillazione atriale controllata sono eleggibili),
d. Malattia vascolare periferica ≥ G3 (i.e. sintomatiche e che
interferisce con le normali attività quotidiane (ADL).
Precedente accidente cerebro-vascolare, attacco ischemico
transitorio (TIA) o emorragia subaracnoidea entro i 6 mesi
precedenti alla randomizzazione.
Storia o evidenza di disordini emorragici nei 6 mesi precedenti la
randomizzazione.
Evidenza di diatesi emorragica o coagulopatia significativa (in
assenza di coagulazione).
Storia o sospetto clinico di metastasi cerebrali o compressione
midollare La CT/RMN dell'encefalo è obbligatoria (entro le 4
settimane prima della randomizzazione) in caso di metastasi
cerebrali sospette. Una RMN della colonna vertebrale è
obbligatoria nelle 4 settimane precedenti alla randomizzazione in
caso di sospetta compressione midollare.
Storia o evidenza alla visita neurologica di malattia a a carico del
sistema nervoso centrale non adeguatamente controllata con la
terapia medica standard (i.e. epilessia non controllata).
E-21. Trauma significativo nelle 4 settimane precedenti il trattamento.
E-22. Ferite non rimarginate, ulcere attive, o fratture ossee. Pazienti
con ferite in guarigione per seconda intenzione in assenza di
deiscenza della fascia o infezione possono essere arruolabili ma
necessitano di controllo trisettimanale della ferita.
E-23. Storia di fistola addominale o perforazione gastrointestinale o
sanguinamento gastrointestinale attivo legati al trattamento con
agenti anti VEGF entro i 6 mesi precedenti all'entrata nello
studio.
E-24. Occlusione intestinale, inclusa la subocclusione, legata alla
patologia di base clinicamente significativa .
E-25. Aria libera in addome non spiegabile con una recente paracentesi
o procedura chirurgica.
E-26. Evidenza di qualsiasi altra malattia, disfunzione metabolica,
sintomo o segno e qualsiasi altro valore di laboratorio generante
il sospetto di una controindicazione all'uso di un agente
sperimentale o che ponga il paziente ad alto rischio di
complicanze legate al trattamento.
E-27. Gravidanza o allattamento.
E-28. Partecipazione ad altro studio clinico durante il periodo di
trattamento chemioterapico immediatamente precedente alla
randomizzazione .
E-29. Incapacità della paziente di assumere farmaci per via orale o
condizione che possa interferire con il loro assorbimento.
E-30. Nota ipersensibilità a olaparib o uno degli eccipienti.
N. pz da arruolare
Per informazioni
Compromissione immunitaria, positività ai virus epatitici B o C;
infezione da virus HIV
612
30 pz MITO arruolate al 18/01/2017
Sandro Pignata [email protected]
Francesco Perrone [email protected]
Titolo
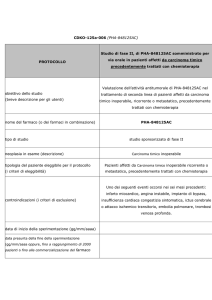
MITO 16b – MANGO OV2b – ENGOT OV17
Platinum-Sensitive “Second-Line Protocol”
(Fase III)
A multicenter phase III randomized study with second line
chemotherapy plus or minus bevacizumab in patients with platinum
sensitive epithelial ovarian cancer recurrence after a
bevacizumab/chemotherapy first line
Fase
Obiettivo primario
Obiettivi secondari
Studio randomizzato (1:1) di fase 3, prospettico, in aperto, multicentrico,
internazionale
Valutare se l’aggiunta di bevacizumab alla chemioterapia, nel trattamento
delle pazienti con tumore ovarico avanzato precedentemente trattate con
terapia a base di platino e platino-sensibili, possa prolungare la
sopravvivenza libera da progressione (Progression Free Survival,
PFS), valutata dai singoli investigatori, delle pazienti, rispetto alla sola
chemioterapia.
Sopravvivenza globale
PFS valutata centralmente
Tasso di risposte
Sicurezza del trattamento
Valutazione del ruolo prognostico e predittivo di biomarcatori
molecolare e fattori clinici
Descrizione della prevalenza dell’uso delle terapie antidiabetiche orali
ed antitrombotiche fra le pazienti arruolate nello studio
Criteri di inclusione
Pazienti di sesso femminile con età ≥18 anni.
Diagnosi istologica di carcinoma epiteliale dell’ovaio oppure delle
tube di Falloppio o carcinoma primitivo del peritoneo, inclusi i
tumori Mulleriani misti.
Ricaduta o progressione di malattia almeno 6 mesi dopo l’ultimo
ciclo di chemioterapia contenente platino e bevacizumab
FIGO stadio IIIB & C o IV
Performance Status 0–2 secondo ECOG.
Aspettativa di vita di almeno 12 settimane.
Consenso informato firmato ottenuto prima dell’inizio di qualsiasi
procedura studio specifica e del trattamento quale conferma della
volontà della paziente di partecipare allo studio e della
consapevolezza da parte della paziente di dover rispettare le
procedure previste dal protocollo.
Disponibilità di campioni di tessuto tumorale per analisi
molecolari.
Criteri di esclusione
Relativi alla diagnosi oncologica
Tumori ovarici a basso potenziale di malignità (i.e. tumori borderline)
Storia o evidenza di metastasi cerebrali o di compressione midollare.
Storia o evidenza di carcinoma endometriale primitivo sincrono a
meno che tutti i seguenti criteri per il carcinoma endometriale siano
rispettati:
o stadio ≤Ia
o invasione miometrale solo superficiale
o nessuna invasione linfovascolare
o assenza di forme scarsamente differenziate (grado 3 oppure
carcinoma sieroso papillare o a cellule chiare).
Altre patologie neoplastiche negli ultimi 5 anni, ad eccezione del
carcinoma in situ della cervice o del carcinoma cutaneo spinocellulare
o basocellulare in stadio iniziale, purché adeguatamente trattati.
Altri relativi al trattamento
Qualsiasi precedente trattamento radioterapico della pelvi o
dell’addome.
Chirurgia (inclusa biopsia incisionale) nelle 4 settimane precedenti la
prima dose di bevacizumab o programmata (in questo caso la
paziente può essere arruolata ma la somministrazione di
bevacizumab dovrà essere omessa al primo ciclo).
Attuale o recente (nei 10 giorni precedenti la prima dose di farmaco
nello studio) uso di dose orale piena o parenterale di agenti
anticoagulanti o trombolitici utilizzati a scopo terapeutico (ad
eccezione della dose prevista per il mantenimento della pervietà del
catetere venoso centrale, nel qual caso il rapporto internazionale di
normalizzazione [INR] deve essere mantenuto al di sotto di 1.5). La
profilassi postoperatoria con eparina a basso peso molecolare
somministrata per via sottocutanea è consentita.
Attuale o recente trattamento con un altro farmaco in fase di studio (
entro 30 giorni dalla prima dose dei farmaci in studio) .
Relativi al laboratorio
Inadeguata funzione midollare: Neutrofili: <1.5 x 109/l, o piastrine
<100 x 109/l o emoglobina <9 g/dl. I pazienti possono essere trasfusi
per mantenere i valori di emoglobina ≥9 g/dl.
Parametri di coagulazione inadeguati:
o Tempo di tromboplastina parziale attivata (APTT)>1.5xULN
oppure
o INR >1.5
Inadeguata funzione epatica, definita come:
o Bilirubina sierica (totale) >1.5 x limite superiore del valore
normale (ULN) per l’istituzione
o AST/SGOT o ALT/SGPT >2.5 x ULN.
Inadeguata funzione renale, definita come creatinina sierica >2.0
mg/dl o >177 mol/l
Proteinuria >1g nella raccolta delle urine delle 24-ore (da eseguire
solo fra i pazienti che hanno presentato un valore ≥3+ per proteinuria
allo stick sulle urine).
Relativi al paziente
Gravidanza o allattamento.
Storia o evidenza di disordini trombotici o emorragici; inclusi gli
accidenti cerebrovascolari (CVA)/ictus o attacco ischemico
transitorio (TIA) o emorragia subaracnoidea nei 6 mesi precedenti al
primo trattamento previsto dallo studio).
Ipertensione non controllata (valore sistolico sostenuto >150 mm Hg
e/o diastolico >100 mm Hg nonostante la terapia antipertensiva)
oppure malattia cardiovascolare clinicamente significativa (i.e.
attiva), comprendente:
o infarto del miocardio o angina instabile nei 6 mesi precedenti
lo studio o il primo trattamento previsto dallo studio
o insufficienza cardiaca congestizia (CHF) di classe II o
superiore secondo la classificazione della New York Heart
Association (NYHA).
o aritmia cardiaca grave che ne richieda il trattamento (con
l’eccezione della fibrillazione atriale o della tachicardia
sopraventricolare parossistica)
o malattia vascolare periferica di grado ≥3 (i.e. sintomatica, che
interferisce con le attività quotidiane e che richiede uno
specifico trattamento).
Storia di fistole addominali, perforazione gastrointestinale o ascesso
intra-addominale nei 6 mesi precedenti l’inizio del trattamento
previsto dello studio.
Ferite che non si rimarginano, ulcere o fratture ossee. I pazienti con
ferite con tessuto di granulazione che guariscono per seconda
intenzione con nessuna evidenza di deiscenza fasciale o infezione
sono eleggibili ma richiedono controlli trisettimanali della ferita.
Evidenza di qualsiasi altra condizione medica (quali ad esempio
malattie psichiatriche, ulcera peptica, etc), riscontri agli esami
strumentali o di laboratorio di qualsiasi elemento che possa interferire
col trattamento programmato o che influenzi la compliance del
paziente o che lo ponga a rischio alto di sviluppare complicanze
legate al trattamento.
400
406 pz arruolate al Novembre 2016
N. pz da arruolare
Per informazioni
Sandro Pignata [email protected]
Nicoletta Colombo [email protected]
Titolo
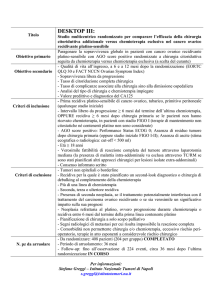
BGOG CX-1/ENGOT CX-1: Studio randomizzato
in doppio cieco di fase II con carboplatino (AUC5) e
paclitaxel (175 mg/mq) ogni 3 settimane con o senza
Nintedanib (BIBF 1120) concomitante e in
mantenimento nel carcinoma della cervice avanzato
o recidivato.
Fase
Studio randomizzato in doppio cieco di fase II con carboplatino (AUC5)
e paclitaxel (175 mg/mq) ogni 3 settimane con o senza Nintedanib (BIBF
1120) concomitante e in mantenimento nel carcinoma della cervice
avanzato o recidivato.
Scopo dello studio è verificare se l'aggiunta di Nintedanib alla
chemioterapia (carboplatino-taxolo) migliora la progression free survival
rispetto alla stessa chemioterapia più placebo in pazienti con malattia
avanzata o recidivata.
1. Valutare la sicurezza e la tossicità della combinazione.
2. Valutare il tasso di risposta secondo i criteri RECIST 1.1 e la
sopravvivenza globale.
3. Valutare l'effetto del trattamento sulla qualità di vita misurata
con i questionari EORTC-QOL-Cx24 e QLQ-C30.
1. Età maggiore di 18 anni.
2. Carcinoma della cervice uterina avanzato (stadio FIGO IVB) o
recidivato, squamoso, adenocarcinoma, o adenosquamoso.
3. Nessuna precedente chemioterapia per recidiva di malattia.
Una precedente chemioterapia concomitante alla
radioterapia è consentita se la recidiva si è verificata oltre
sei mesi dall'ultima somministrazione.
Le pazienti trattate con chemioterapia neoadiuvante sono
eleggibili se la recidiva si è verificata oltre i sei mesi
dall'ultima somministrazione.
Le pazienti trattate con chemioterapia neoadiuvante prima
della
chirurgia
seguita
da
radio-chemioterapia
concomitante sono eleggibili se la recidiva si è verificata
oltre i sei mesi dall'ultima somministrazione di
chemioterapia.
Le pazienti trattate con chemioterapia neoadiuvante prima
della chirurgia e successivamente trattate con radioterapia
adiuvante sono eleggibili se la recidiva si è verificata oltre i
sei mesi dall'ultima somministrazione di chemioterapia.
4. Aspettativa di vita superiore a 3 mesi.
5. PS secondo ECOG 0 o 1.
6. Almeno una lesione misurabile secondo i criteri Recist 1.1.
7. Consenso informato firmato e datato prima dell’inclusione nello
studio.
Obiettivo primario
Obiettivi secondari
Criteri di inclusione
Criteri di esclusione
1. Precedente chemioterapia per malattia recidivata.
2. Precedente terapia con Nintedanib o altri inibitori di VEGFR.
3. Ipersensibilità ai farmaci o i loro ingredienti (soia, arachidi).
4. Metastasi cerebrali o meningee.
5. Recidive centrali con evidenza TC o RMN di infiltrazione dei
grossi vasi.
6. Neoplasia infiltrante la mucosa della vescica o dell'intestino o
con fistole entero-urinarie o entero-enteriche.
7. Trattamento con altri farmaci sperimentali nelle 4 settimane
precedenti la randomizzazione.
8. Evidenza radiografica dei tumori cavitari o necrotici.
9. Trattamento anticoagulante terapeutico con farmaci che
richiedono monitoraggio dell’INR (ad eccezione eparina a basse
dosi e/o soluzione eparinata per il mantenimento di un catetere
endovenosa permanente) o anti-aggregante (ad eccezione di
terapia a basse dosi con acido acetilsalicilico < 325 mg al giorno).
10. Ferite nelle 4 settimane precedenti all'inizio del trattamento,
non completamente guarite.
11. Storia di eventi emorragici o tromboembolici clinicamente
significativi nei precedenti sei mesi.
12. Difetti ereditari della coagulazione o dell'emostasi.
13. Malattie cardiovascolari significative (ad es. ipertensione non
controllata, angina instabile, infarto del miocardio negli ultimi 12
mesi prima dell’inizio del trattamento in studio, scompenso
cardiaco > NYHA II, aritmia cardiaca grave, versamento
pericardiaco).
14. Accidenti vascolari cerebrali, TIA, o emorragie sub-aracnoidee
negli ultimi sei mesi.
15. Alterazioni significative della funzione renale, epatica o
midollare.
16. Altri tumori maligni negli ultimi 3 anni.
17. Malattie infettive significative che richiedono terapia
antimicrobica.
18. Epatite B o C attiva o cronica, documentata infezione HIV (in
Italia è obbligatorio un test di screening per l’HIV per tutte le
pazienti che non hanno fatto il test negli ultimi 3 mesi prima
dell’inizio del trattamento in studio).
19. Disordini gastrointestinali che possono interferire con
l'assunzione orale del farmaco.
20. Malattie gravi o concomitanti quali neurologiche, psichiatriche,
infettive o ulcere attive (gastrointestinale o cutanea) o esami di
laboratorio che, nel giudizio dello sperimentatore, possano
aumentare il rischio alla partecipazione allo studio.
21. Donne in età fertile che sono sessualmente attive e non
disposte a utilizzare un metodo di contraccezione accettabile (ad
es. impianti iniettabili, contraccettivi orali, dispositivi intrauterini,
partner vasectomizzato, astinenza sessuale) durante lo studio e
per almeno 3 mesi dopo la fine della terapia dello studio.
22 Gravidanza o allattamento. Se applicabile, le pazienti devono
avere un test di gravidanza negativo (test ß HCG di urina o siero)
prima di iniziare il trattamento in studio.
23. Fattori quali psicologici, familiari, sociologici, o geografici che
possano interferire con la compliance della paziente al protocollo e
al follow-up.
24. Abuso attivo di alcool o droghe.
N. pz da arruolare
Per informazioni
120
Sandro Pignata [email protected]
Nicoletta Colombo [email protected]