Chimica Inorganica Biologica
Composti di coordinazione
Nomenclatura
Si nomina prima il catione e poi l’anione
Si nominano i leganti in ordine alfabetico
I nomi dei leganti anionici terminano in -o
I leganti neutri mantengono il nome della molecola neutra
I nomi dei leganti cationici terminano in –ium/-io
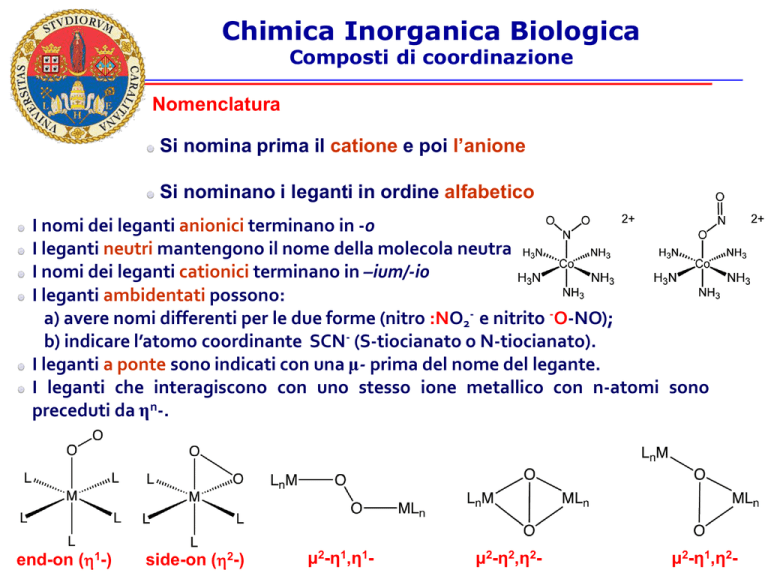
I leganti ambidentati possono:
a) avere nomi differenti per le due forme (nitro :NO2- e nitrito -O-NO);
b) indicare l’atomo coordinante SCN- (S-tiocianato o N-tiocianato).
I leganti a ponte sono indicati con una μ- prima del nome del legante.
I leganti che interagiscono con uno stesso ione metallico con n-atomi sono
preceduti da ηn-.
end-on (h1-)
side-on (h2-)
μ2-η1,η1-
μ2-η2,η2-
μ2-η1,η2-
Chimica Inorganica Biologica
Composti di coordinazione
Nomenclatura
Si scrive e si nomina prima il catione e poi l’anione
Si nominano i leganti in ordine alfabetico
Si indica quante unità sono presenti di ogni legante (2,3,4,5,6) tramite:
- I prefissi di, tri, tetra, penta, esa per:
a) I leganti monoatomici
b) I leganti poliatomici con nomi corti
c) I leganti neutri aventi nomi speciali
- I prefissi bis, tris, tetrakis, pentakis, hexakis per:
a) Tutti i leganti che hanno un prefisso del tipo precedente (di, tri,…)
b) I leganti neutri comuni;
c) I leganti ionici con nomi particolarmente lunghi.
Se l’anione è un complesso, si aggiunge il suffisso -ato al nome del metallo.
Per alcuni metalli come Cu, Fe, Au e Ag si usa la radice latina del nome:
cuprato, ferrato, aurato, argenato
Si indica lo stox del metallo centrale sotto forma di numero romano fra parentesi
K3[Au(CN)4]
Potassio Tetracianoaurato(I)
K[Co(C2O4)2(NH3)2]
Potassio Diamminodiossalocobaltato(III)
[Cr(en)2F2]NO3
Bis(etilenediammina)difluorocromo(III) nitrato
K2[PtCl6]
Potassio esacloroplatinato(IV)
Chimica Inorganica Biologica
Composti di coordinazione
Nomenclatura
[Co(NH3)5(OH2)]Br3
ammoniaca x 5
acqua x 1
cobalto (III)
bromuro
[Co(NH3)5Br]Br2
Pentaamminobromocobalto(III) bromuro
ammoniaca x 5
bromuro x 1
cobalto (III)
bromuro
[Co(NH3)5Br](SO4)
Pentaamminobromocobalto(III) solfato
ammoniaca x 5
bromuro x 1
cobalto (III)
solfato
[Co(NH3)5(SO4)]Br
Pentaamminosolfatocobalto(III) bromuro
ammoniaca x 5
solfato x 1
cobalto (III)
bromuro
Acquapentaamminocobalto(III) bromuro
Chimica Inorganica Biologica
Composti di coordinazione
Nomenclatura
[Co(NH3)3(NO2)3]
Triamminonitrocobalto(III)
[CoCl2(NH3)4]Cl
Tetraamminodiclorocobalto(III) cloruro
[Pt(NH3)4(NO2)Cl]SO4
Tetraamminocloronitroplatino(IV) solfato
NH4[Cr(NH3)2(NCS)4]
ammonio diamminotetratiocianatocromato(III)
K3[Al(C2O4)3]
potassio triossalatoalluminato(III)
[Co(en)2Cl2]2SO4
diclorobis(etilendiammina)cobalto(III) solfato
Ca2[Fe(CN)6]
calcio esacianoferrato(II)
[Fe(H2O)6]SO4
esaacquoferro(II) solfato
μ-ammino-μ-idrossobis(tetraaaminocobalto)(IV)
Chimica Inorganica Biologica
Composti di coordinazione
Geometrie di coordinazione
• Numero di coordinazione
• Dimensione dell’atomo o ione centrale
• Topologia del legante
• Interazioni steriche tra i leganti
• Interazioni elettroniche tra l’atomo o ione centrale e i leganti
Chimica Inorganica Biologica
Composti di coordinazione
Geometrie di coordinazione
Formalismo grafico
Numero di coordinazione: 2
Chimica Inorganica Biologica
Composti di coordinazione
Geometrie di coordinazione
Numero di coordinazione: 4
Chimica Inorganica Biologica
Composti di coordinazione
Geometrie di coordinazione
Numero di coordinazione: 4
Isomeria geometrica
Isomeria chirale
Meso-stilbendiammino platino (II)
Iso-stilbendiammino platino (II)
Chimica Inorganica Biologica
Composti di coordinazione
Geometrie di coordinazione
Numero di coordinazione: 5
tbp
D3h
Bipiramide trigonale
sp
C4v
Piramide a base quadrata
flussionalità
Chimica Inorganica Biologica
Composti di coordinazione
Geometrie di coordinazione
Numero di coordinazione: 5
Pseudorotazione di Berry
Fe(CO)5
PF5
Chimica Inorganica Biologica
Composti di coordinazione
Geometrie di coordinazione
Numero di coordinazione: variazione senza cambio di stox
Esempio: anidrasi carbonica
CO2
10%
20%
70%
plasma
emoglobina
acqua
Alcuni complessi con lo stesso metallo possono
interconvertirsi in stati con numero di coordinazione
differenti come nel caso dello Zn2+ nella reazione
d'idratazione CO2 + H2O ⇆ H+ + HCO3-, catalizzata
dall'anidrasi carbonica.
La direzione in cui la reazione ha luogo dipende dalla
concentrazione di CO2: se questa è bassa (come nei polmoni)
l’acido viene dissociato e viene liberata anidride carbonica;
se questa è elevata, la CO2 si lega all’acqua e forma carbonati
che vengono trasportati nei polmoni dal sangue. L’enzima è
presente nei mammiferi, piante, alghe e batteri come pure nel
processo di calcificazione dei coralli nella produzione dello
ione bicarbonato dai polipi del corallo.
CO2 + 2 H2O
H3O+ + HCO3-
Chimica Inorganica Biologica
Composti di coordinazione
Geometrie di coordinazione
D3h
Oh
W(CO)6
W(CH3)6
Geometria prismatica trigonale
Geometria ottaedrica
Numero di coordinazione: 6
Chimica Inorganica Biologica
Composti di coordinazione
Geometrie di coordinazione
Numero di coordinazione: 6
ottaedro
trans
cis
mer
fac
Chimica Inorganica Biologica
Composti di coordinazione
Geometrie di coordinazione
Numero di coordinazione: 6
Isomeria Geometrica
viola
verde
Chimica Inorganica Biologica
Composti di coordinazione
Geometrie di coordinazione
Numero di coordinazione: 6
ISOMERI OTTICI
Isomeria Ottica
Chimica Inorganica Biologica
Composti di coordinazione
Alfred Werner
Premio Nobel 1913
Sophus Mads Jørgensen
Chimica Inorganica Biologica
Composti di coordinazione
CoCl3·6NH3
CoCl3·5NH3
CoCl3·4NH3
CoCl3·4NH3
giallo
porpora
verde
violetto
complesso
complesso
complesso
complesso
luteo
purpureo
praseo
violeo
CoCl3·6NH3 + Ag+(eccesso) →
3 AgCl(s)
[Co(NH3)6]Cl3
CoCl3·5NH3 + Ag+(eccesso) →
2 AgCl(s)
[Co(NH3)5Cl]Cl2
CoCl3·4NH3 + Ag+(eccesso) →
1 AgCl(s)
[Co(NH3)4Cl2]Cl
CoCl3·4NH3 + Ag+(eccesso) →
1 AgCl(s)
[Co(NH3)4Cl2]Cl
Chimica Inorganica Biologica
Composti di coordinazione
Chimica Inorganica Biologica
Composti di coordinazione
Isomeri e Struttura: Numero Coordinazione 6
Chimica Inorganica Biologica
Composti di coordinazione
Isomeri e Struttura: Numero Coordinazione 4
[PtX2Y2]2-
[PdX2Y2]2-
2 isomeri
2 isomeri
[MA2B2]
1 isomero
Chimica Inorganica Biologica
Composti di coordinazione
Il Legame
Teoria del Legame di
Valenza (VB)
Teoria del Campo
Cristallino (CFT)
Teoria del Campo
dei Leganti (LFT)
L. Pauling
1930
H. Bethe
1929
J.H. Van Velck 1935
Teoria degli Orbitali Molecolari (MO)
Chimica Inorganica Biologica
Composti di coordinazione
Teoria del Campo Cristallino
Legante →
Legame →
Metallo →
carica negativa puntiforme
interazione puramente elettrostatica
orbitali d
L’ approccio del modello CFT è basato sulla simmetria
in maniera analoga al modello MO
Chimica Inorganica Biologica
Composti di coordinazione
Simmetria Ottaedrica










