GLI STATI DI AGGREGAZIONE
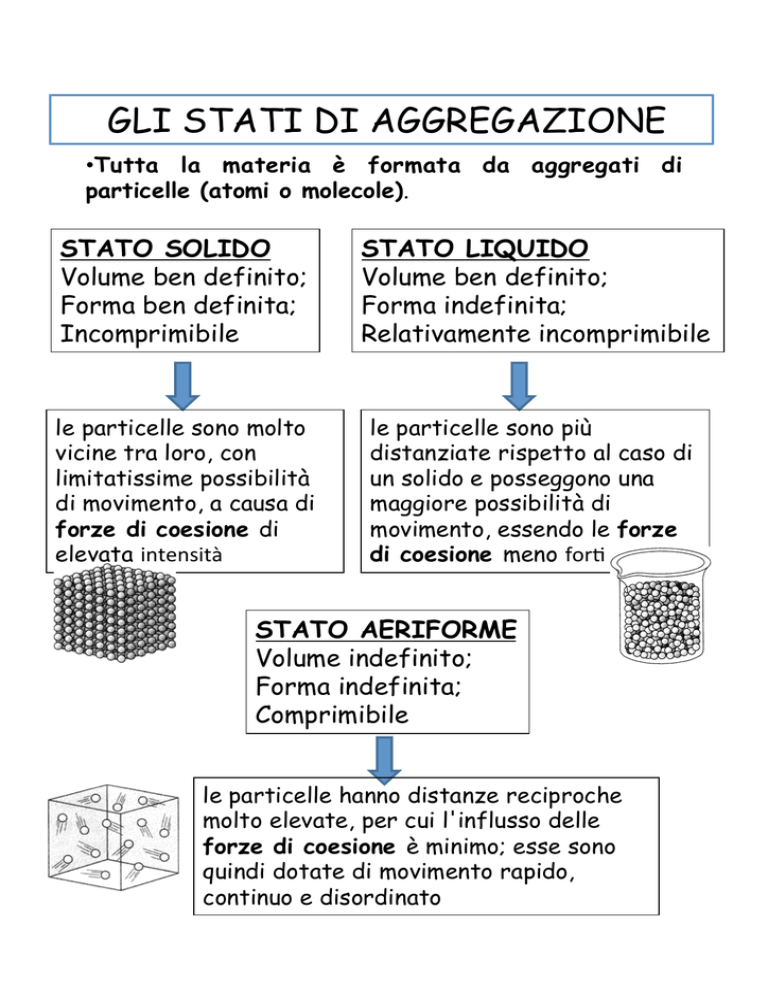
• Tutta la materia è formata da aggregati di
particelle (atomi o molecole).
STATO SOLIDO
Volume ben definito;
Forma ben definita;
Incomprimibile
STATO LIQUIDO
Volume ben definito;
Forma indefinita;
Relativamente incomprimibile
le particelle sono molto
vicine tra loro, con
limitatissime possibilità
di movimento, a causa di
forze di coesione di
elevata intensità
le particelle sono più
distanziate rispetto al caso di
un solido e posseggono una
maggiore possibilità di
movimento, essendo le forze
di coesione meno for* STATO AERIFORME
Volume indefinito;
Forma indefinita;
Comprimibile
le particelle hanno distanze reciproche
molto elevate, per cui l'influsso delle
forze di coesione è minimo; esse sono
quindi dotate di movimento rapido,
continuo e disordinato
TEORIA ATOMICA DELLA MATERIA
1. Tutta la materia è formata da piccolissime particelle
chiamate atomi.
_____________________________________________
2. In natura esistono circa 100 tipi diversi di atomi che
rappresentano altrettanti elementi chimici.
_____________________________________________
3. Gli atomi di uno stesso tipo sono identici tra loro e dotati
delle stesse proprietà.
_____________________________________________
4. Due o più atomi possono legarsi tra loro, secondo precise
leggi , a formare particelle più grandi chiamate molecole.
_____________________________________________
5. Ogni sostanza è formata da un grandissimo numero di
molecole, tutte identiche e legate tra loro da forza di
coesione.
_____________________________________________
6. Ciascuna molecola ha in sé tutte le proprietà tipiche della
sostanza di cui fa parte.
_____________________________________________
7.
Le sostanze possono essere semplici o composte; sono
semplici quando formate da atomi o da molecole
contenenti un solo tipo di atomo (es. il ferro –Fe- o la
molecola di ossigeno O2); si dicono composte quando sono
formate da molecole costituite da atomi diversi (es. acqua
H2O)
LA MATERIA E GLI ATOMI
Si definisce materia tutto ciò che ci circonda, occupa spazio e ha quindi un
volume e una massa.
Anche noi stessi, così come tutti gli esseri viventi, siamo costituiti di
materia, in quanto occupiamo uno spazio e abbiamo una massa.
Fin dall’antichità gli scienziati si sono domandati di che cosa fosse formata
la materia. Già 2400 anni fa un filosofo greco, Democrito, immaginò che la
materia, fosse costituita da particelle piccolissime, invisibili, che chiamò
atomi (RICORDA! atomo = dal greco ἄτοµος - àtomos –, indivisibile, unione di
ἄ - a –[alfa privativo] + τόµος - tómos - [tagliare]). Negli ultimi anni
dell’Ottocento la scienza dimostrò che l’intuizione di Democrito era
sostanzialmente giusta: la materia è formata da particelle piccolissime, gli
atomi, ma gli atomi non sono “indivisibili” perché essi stessi sono formati da
particelle ancora più piccole (come vedremo meglio nel prossimo paragrafo).
Oggi la scienza sa che in natura esistono circa 100 tipi di atomi differenti,
ciascuno con specifiche caratteristiche e contraddistinto da un nome e un
simbolo (esempio: atomo di ferro, Fe, atomo di idrogeno, H, di ossigeno (O)
ecc…). Due o più atomi, uguali o diversi, si possono legare tra di loro,
secondo leggi precise, a formare particelle più grandi dette molecole.
Più precisamente se atomi di uno stesso tipo si uniscono si formano sostanze
semplici o elementi. Ad esempio la mina di una matita è formata tutta da
atomi di carbonio, la sbarra di ferro da atomi di ferro, l’ossigeno presente
nell’aria, è formato dall’insieme di molecole a loro volta formate da due
atomi di ossigeno). Se invece si uniscono due o più atomi diversi le molecole
che si formano prendono il nome di sostanze composte o composti. Ad
esempio l’acqua è una sostanza composta: una molecola di acqua è formata
da una atomo si ossigeno e due atomi di idrogeno (H2O).
LA STRUTTURA DELL’ATOMO Abbiamo visto che tutte le sostanze presenti in natura sono formate dalla
combinazione dei circa 100 elementi chimici presenti in natura, ciascuno
composto da atomi dello stesso tipo; ma come sono fatti gli atomi e che
differenza c’è fra gli atomi di due elementi diversi fra loro?
Oggi sappiamo con certezza che gli atomi sono a loro volta formati da
particelle più piccole (elettroni, protoni e neutroni) e che queste particelle
sono formate probabilmente da componenti ancora più piccoli (i cosiddetti
quark).
Più precisamente un atomo è costituito da
una parte interna, il nucleo, formato a sua
volta da protoni, particelle dotate di una
carica positiva (+) e da neutroni, particelle
che non hanno carica elettrica. Attorno al
nucleo, su orbite precise, si muovono gli
elettroni , particelle caratterizzate da
carica elettrica negativa (-) uguale ed
opposta a quella dei protoni. Complessivamente un atomo è neutro.
I protoni ed i neutroni hanno massa simile tra loro e duemila volte maggiore
rispetto a quella degli elettroni: la massa di un atomo è quindi concentrata
tutta nel nucleo ed aumenta all’aumentare del numero di protoni e neutroni
che lo costituiscono.
Si definisce numero di massa (indicato con la lettera A) la somma del numero
di protoni e di neutroni presenti in un nucleo.
Si definisce numero atomico (indicato con la lettera Z) il numero di protoni
presenti in un nucleo: Esso è uguale al numero di elettroni che orbitano
intorno al nucleo.
Le proprietà chimiche di un elemento dipendono dal suo numero atomico.
IL NOME DEGLI ATOMI In un atomo in condizioni normali il numero degli ele5roni è sempre uguale a quello dei protoni: a un certo numero di cariche posi*ve corrisponde un ugual numero di cariche nega*ve. L'atomo, dunque, risulta neutro, né posi*vo né nega*vo. Pur essendo tuB forma* dalle stesse par*celle, gli atomi non sono tuB uguali tra loro: alcuni sono più piccoli, altri più grandi. La piccolezza o la grandezza di un atomo dipende dal numero di protoni del suo nucleo. Ques* atomi hanno un diverso numero atomico, termine che indica quan* protoni sono presen* nel nucleo: il primo ha numero atomico 1 perché ha un solo protone e l ul*mo ha numero atomico 92 perché ha 92 protoni. Il numero atomico perme5e di dis*nguere un atomo da un altro: questo consente anche di dare un nome a ciascuno di essi. L'atomo più piccolo, quello con un solo protone, è l'idrogeno; il più grande in natura si chiama uranio e ha 92 protoni. L'atomo che possiede 7 protoni è quello dell'azoto, una sostanza presente nell'aria; l'atomo con numero atomico 8, cioè con 8 protoni, è l'ossigeno, il gas che ci perme5e di respirare, mentre l’atomi con numero atomico 6 è il carbonio. Imparerai il nome di mol* altri atomi: carbonio, rame, ferro, oro, argento, sodio, cloro... Essi si definiscono elemen4 chimici. Ogni elemento chimico, per brevità, è indicato con un simbolo, che deriva dal nome dell'atomo. Ogni simbolo è formato dalla prima o dalle prime due le5ere del nome dell'atomo, per non creare confusione tra atomi i cui nomi hanno la stessa iniziale. Per esempio il simbolo del carbonio è C (si legge ci), quello del calcio è Ca (si legge ci-­‐a) e quello del cloro è Cl (si legge ci-­‐elle). Ci sono poi alcuni elemen* il cui simbolo è molto diverso da quello del loro nome. La tavola periodica degli elemen4 è lo schema col quale vengono ordina* gli atomi sulla base del loro numero atomico. Ideata dal chimico russo Mendeleev nel 1869, inizialmente contava numerosi spazi vuo*, previs* per gli elemen* che sarebbero sta* scoper* in futuro, taluni nella seconda metà del 1900. h5p://www.dayah.com/periodic/ MOLECOLE E LE FORMULE CHIMICHE Gli atomi hanno la capacità di unirsi tra loro formando le molecole. Ma che cos'è una molecola? E la più piccola par*cella di una sostanza che ne conserva tu5e le proprietà. Un esempio di molecola è la molecola dell'acqua. Se potessimo spezzare questa par*cella, i suoi frammen* non sarebbero più acqua ma altre sostanze. La molecola dell'acqua è infaB cos*tuita da tre atomi: due atomi di idrogeno (H) e uno di ossigeno (0) lega* tra loro. Così accade per tu5e le sostanze. La molecola dell'ammoniaca, cioè la più piccola quan*tà di materia che ha le cara5eris*che di questa sostanza, per esempio, è formata da un atomo di azoto (N) e tre di idrogeno (H) tra loro uni*; la molecola dell'ossigeno, il gas che respiriamo, è formata da due atomi di ossigeno (0) lega* tra loro. Per indicare le molecole si usano segni convenzionali, cioè delle FORMULE CHIMICHE. Si scrivono i simboli degli atomi che le cos*tuiscono e in basso a destra di ogni simbolo si indica un numero, che corrisponde al numero di atomi di quell'elemento presen* nella molecola stessa: H2O per l’acqua, C6H1206 il glucosio,… Gli elemen4 sono sostanze la cui molecola è cos*tuita da atomi tuB uguali tra loro. L'ossigeno che respiriamo, per esempio, è un elemento, perché la sua molecola è formata da due atomi di ossigeno. Anche il rame è un elemento, perché è cos*tuito da molecole formate ognuna da un atomo di rame. I compos4 sono sostanze la cui molecola è cos*tuita da atomi tra loro diversi. Il sale da cucina (o cloruro di sodio), in cui sono presen* atomi di cloro e atomi di sodio, è appunto un composto, e così l acqua e tante altre.