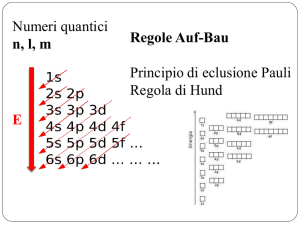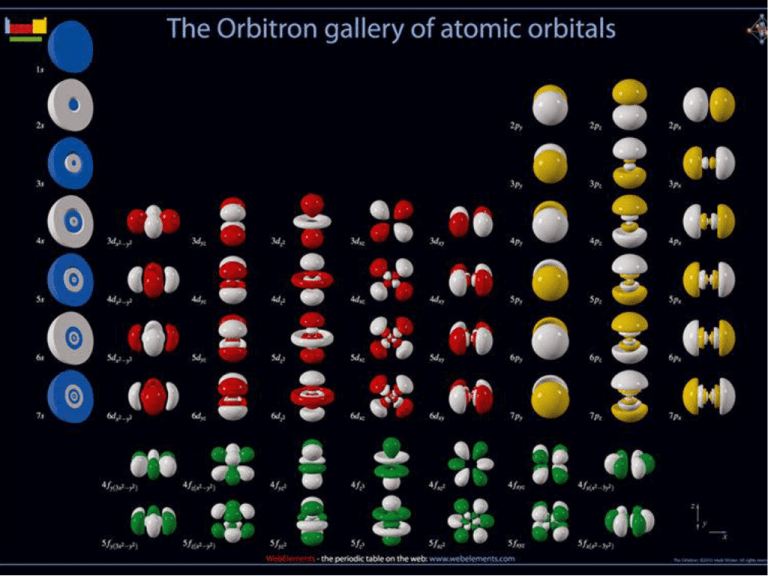
Numeri quantici
n, l, m
Regole Auf-Bau
Principio di eclusione Pauli
Regola di Hund
E
Periodicità Chimica
Chimica generale ed Inorganica: Chimica Generale
Volume atomico (Meyer)
FIGURA 10-1 Una illustrazione della legge periodica - la variazione del volume atomico con il numero atomico
Quando gli elementi sono
disposti in ordine crescente di
massa atomica, alcune proprietà
ricorrono con periodicità
Oltre il volume altre proprietà
ricorrono periodicamente, durezza
comprimibilità punti di ebollizione
Periodicità Chimica
Chimica generale ed Inorganica: Chimica Generale
proprietà periodiche: colore, densità, reattività
Sc
Ga
Ge
Tc gas nobili
Periodicità Chimica
Chimica generale ed Inorganica: Chimica Generale
La tavola periodica è costituita da 18 gruppi
Periodicità Chimica
Chimica generale ed Inorganica: Chimica Generale
metalli non metalli e metalloidi
Periodicità Chimica
Chimica generale ed Inorganica: Chimica Generale
un inciso:
atomi, ioni
raggi covalenti metallici e ionici
Periodicità Chimica
periodicità
nei raggi
atomici
FIGURA 10-4 Raggi atomici
In un atomo maggiore è il
numero di livelli elettronici e
maggiore è la sua dimensione.
Nel gruppo il raggio atomico
aumenta dall’alto al basso
pm=10-12m
Chimica generale ed Inorganica: Chimica Generale
Raggi Ionici
Periodicità Chimica
Chimica generale ed Inorganica: Chimica Generale
andamenti periodici dei raggi
FIGURA 10-8 Un confronto tra alcuni raggi atomici e ionici
Periodicità Chimica
Chimica generale ed Inorganica: Chimica Generale
Energia di ionizzazione
Periodicità Chimica
Chimica generale ed Inorganica: Chimica Generale
Energie di ionizzazione nel primo periodo
Periodicità Chimica
Chimica generale ed Inorganica: Chimica Generale
Affinità elettronica
FIGURA 10-9 Energie di prima ionizazione in funzione del numero atomico
EA è una misura della variazione di energia che si verfica quando un atomo gassoso acquista elettroni:
F(g) + e- F-(g) EA= -328kJ/mol si ha emissione di energia e il processo si dice esotermico
Trasformandosi in F- l’atomo di fluoro passa da 1s22s22p5 + e- a 1s22s22p6 ossia la
configurazione elettronica del Neon.
Periodicità Chimica
Chimica generale ed Inorganica: Chimica Generale
andamenti periodici
FIGURA 10-11 Proprietà atomiche e tabella periodica – Un riassunto
Periodicità Chimica
elemento
Chimica generale ed Inorganica: Chimica Generale
Z
uma
molecola
p.f. /K
p.e. /K
17
35,45
Cl2
172
239
Br
35
79,90
Br2
266
332
I
53
126,90
I2
387
458
FIGURA
Cl 10-12 I tre elementi alogeni
andamenti periodici e non ...
molecola
p.f /°C
molecola
p.f. /°C
CCl4
-22,9
HCl
-114,2
CBr4
90,1
HBr
-86,8
CI4
171
HJ
-50,8
Periodicità Chimica
Proprietà Fisiche periodiche
Punti di fusione, ebollizione
Proprietà riducenti
Proprietà ossidanti
Proprietà acide
Chimica generale ed Inorganica: Chimica Generale
Quale ha una maggiore concentrazione di saccarosio tra una soluzione al 46% in peso con densità 1.21 g/ml e
una 1.50 M (saccarosio C12H22O11).
10 g di Al reagiscono con 10 g di O2 per formare Al2O3. Calcolare: le moli di ossido formate; quale elemento è
in eccesso e di quante moli.
Calcolare quanti grammi di ossido di bario si possono dissolvere in 600 ml di acido cloridrico al 40 % in peso
con densità pari a 1.12 g/ml.
Bilanciare la seguente reazione:
idrossido di ferro(III) + acido solforico --> solfato di ferro(III)
e calcolare i grammi di solfato di ferro(III) che si formano mettendo a reagire 530 mg di idrossido con
1.2 mL di una soluzione di acido solforico 4 M.
Che volume in ml di HCl(aq) 2.35 M occorre per sciogliere un pezzo di carbonato di calcio (marmo) del peso di
1.75 g.? CaCO3(s) + 2HCl(aq) CaCl2(aq) + H2O(l) + CO2(g)
Determinare la densità, espressa in g/ml, di una soluzione acquosa di acido cloridrico al 37 % in peso e
molarità 10.5 moli/l.
Bilanciare la seguente reazione redox, utilizzando il metodo ionico elettronico:
KMnO4 + H2C2O4 + HCl CO2 + MnCl2 + KCl + H2O
Quanti grammi di permanganato di potassio si consumano per ottenere 1.20 L di anidride carbonica
misurati a 25°C ed 1.00 atm?
Periodicità Chimica
Chimica generale ed Inorganica: Chimica Generale