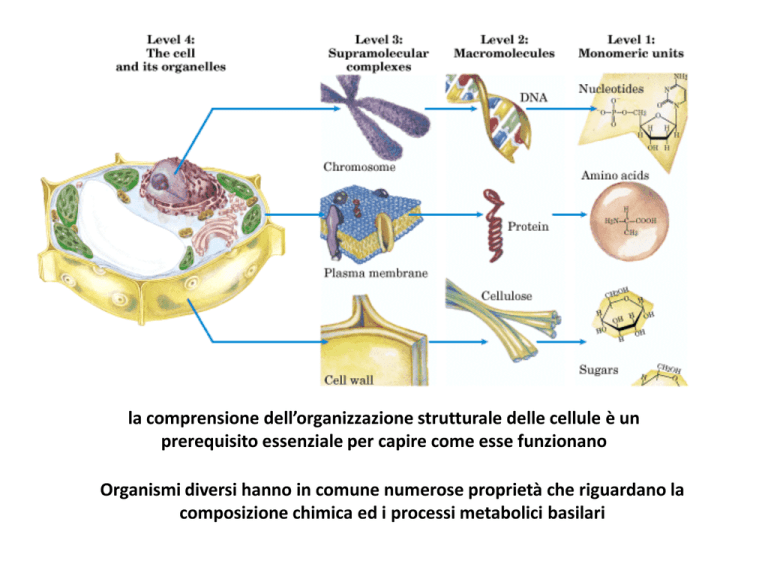
la comprensione dell’organizzazione strutturale delle cellule è un
prerequisito essenziale per capire come esse funzionano
Organismi diversi hanno in comune numerose proprietà che riguardano la
composizione chimica ed i processi metabolici basilari
Elemento: sostanza che non può
essere scissa in sostanza
più semplice mediante
reazione ordinaria
l’atomo è la più piccola porzione
di un elemento che mantiene
tutte le proprietà chimiche di quell’elemento
Numero atomico:
n° dei protoni
Gli elettroni si muovono
in regioni dello spazio
dette ORBITALI
Elementi ordinati secondo il numero atomico crescente
Gli ISOTOPI hanno un numero diverso di neutroni
Ogni orbitale può contenere due elettroni
L’energia di un elettrone dipende dall’orbitale che esso
occupa: in generale hanno maggiore energia gli elettroni
distanti dal nucleo rispetto a quelli posti più vicino al
nucleo.
Gli elettroni con maggiore energia sono detti
elettroni di valenza
e sono quelli importanti nella formazione
dei legami chimici
Il comportamento chimico di un elemento è determinato
dal numero degli elettroni di valenza
SPONCH
Il secondo livello energetico
contiene 4 orbitali quindi……
C
L’elettronegatività è la forza attrattiva che il nucleo di
un atomo esercita sugli elettroni
O>N>C>H
3.5 3.0
2.5 2.1
Legame covalente si forma per condivisione di elettroni
polare
apolare
Legame covalente apolare o non polare
Legame covalente apolare o non polare
Legame covalente polare
Forza di legame: si misura con la quantità di energia necessaria per romperlo
Legame a idrogeno si forma tra un atomo con parziale
carica negativa ed un atomo di idrogeno con parziale
carica positiva
Legame ionico si forma per trasferimento di elettroni
ioni positivi: cationi
ioni negativi: anioni
Idratazione di un composto ionico
IDROFILE
Interazioni idrofobiche: molecole apolari tendono ad interagire
con altre molecole apolari. Per esempio una catena idrocarburica
in acqua tende ad aggregarsi con altre molecole idrocarburiche.
Le molecole idrocarburiche sono idrofobe e le loro interazioni
sono dette idrofobiche.
IDROFOBE
Interazioni di van der Waals: interazioni elettroniche tra gli atomi
molecole organiche
gruppi funzionali biologicamente importanti
apolare
molecole organiche
gruppi funzionali biologicamente importanti
Il gruppo ossidrile è polare ed attrae molecole di acqua
carbonilico
C
O
OH
carbossilico
C
O
amminico
H
N
H
molecole organiche
SPONCH
gruppi funzionali biologicamente importanti
I gruppi funzionali hanno tendenza a reagire tra loro formando legami covalenti
che possono unire tra loro molecole diverse o possono unire gruppi funzionali
diversi all’interno della stessa molecola
legame estere: reazione di condensazione tra un acido e un alcool
H3PO4 = acido fosforico
ione fosfato o Pi
acido fosforico + alcool = estere del fosfato
fosfato + fosfato = fosfoanidride
Le proprietà chimiche dell’acqua e la loro influenza sul comportamento
delle molecole biologiche
reticolo di legami a idrogeno
CONDENSAZIONE
IDROLISI