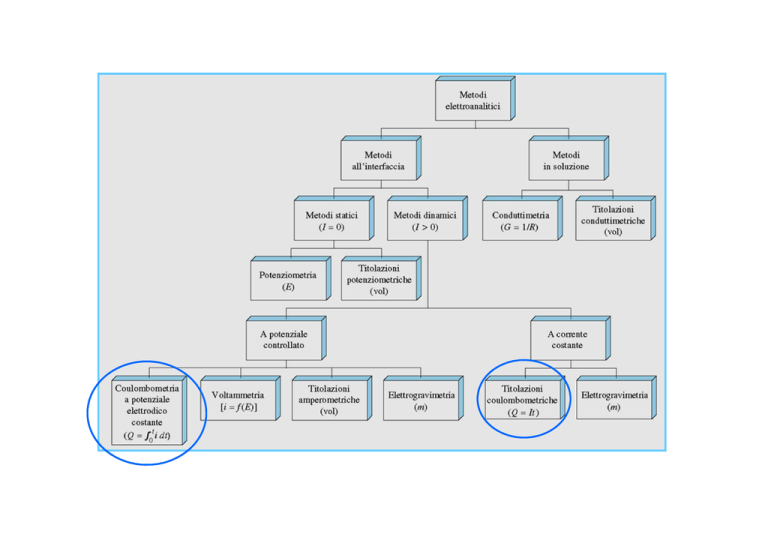
Coulombometria ed elettrogravimetria
Nei
metodi
noti
come
coulombometria
(o
coulometria)
ed
elettrogravimetria la determinazione di un analita avviene sfruttando,
rispettivamente, la carica elettrica necessaria per la sua completa
ossidazione o riduzione o la massa che si deposita su uno dei due elettrodi
di una cella elettrochimica in seguito proprio a tale processo.
Rispetto ai metodi potenziometrici in
questo caso una corrente deve
necessariamente circolare attraverso
la cella elettrochimica, dunque vanno
considerati due aspetti fondamentali:
1) la caduta ohmica
2) la polarizzazione
I
Cella elettrolitica
0
f.e.m.
Cella galvanica
Eapp
Tipicamente la cella elettrochimica opera in condizioni di elettrolisi, in modo
che le reazioni redox agli elettrodi siano opposte a quelle spontanee:
Edestra = -0.471 V
Esinistra = 0.263 V
Ecella = -0.734 V
nessuna reazione
Si noti che -0.734 V rappresenta la f.e.m. della cella senza giunzione liquida
così com’è disegnata, applicando la convenzione IUPAC.
Se non vi fosse alcuna sovratensione, si potrebbe scrivere la relazione:
Eappl = Ecella – IR
da cui: I = (Ecella – Eappl)/R
dove Ecella è la differenza fra il potenziale dell’elettrodo di destra e quello
dell’elettrodo di sinistra.
In realtà è possibile che siano presenti diversi tipi di sovratensione, in
particolare le sovratensioni di concentrazione e di trasferimento di carica
(o cinetica), pertanto la relazione più generale è:
Eappl = Ecella+ (rc + rk ) – (lc + lk) - IR
dove: r = right, l = left, c = pol. di conc. e k = pol. di trasf. di carica.
Qualunque altro contributo, se presente, alla sovratensione complessiva
degli elettrodi destro e sinistro della cella andrebbe introdotto nel
termine in parentesi corrispondente, al secondo membro dell’equazione.
Nel caso della cella elettrochimica mostrata in precedenza:
Ag|AgCl, Cl- (0.200 M), Cd2+ (0.00500 M)|Cd
si osserva la validità della relazione
fino ad un
Eappl = Ecella – IR
potenziale applicato di circa -0.800
V, infatti risulta:
I-0.800
V
= [- 0.734 – (-0.800)]/15 =
= 0.0044 A = 4.4 mA
Per potenziali applicati superiori (in
valore assoluto), necessari per
ottenere intensità di corrente
maggiori, si registra una crescente
sovratensione (ad esempio -0.23 V
per una corrente di 7 mA).
Modalità operative di un’elettrolisi analitica
A prescindere dal metodo a cui è destinata, coulombometria o
elettrogravimetria, un’elettrolisi analitica può essere condotta in varie
modalità.
Le principali sono:
1) potenziale applicato alla cella costante;
2) corrente costante;
3) potenziale dell’elettrodo di lavoro costante.
Elettrolisi a potenziale di cella costante
Il metodo 1 viene tipicamente applicato per la riduzione di cationi in
condizioni in cui la riduzione di H+ ad H2 è difficile.
Un caso tipico è la determinazione del Cu2+.
Si consideri la seguente cella elettrochimica:
Pt|Cu2+ (0.0220 M), H+ (1 M)|Pt
nel caso specifico occorre considerare anche l’O2 disciolto in soluzione e la
sua coppia redox con l’H2O. Di fatto l’obiettivo dell’elettrolisi è far avvenire
la reazione:
Cu2+ + H2O Cu(s) + ½ O2 + 2 H+
Applicando una differenza di potenziale di -2.5 V fra l’elettrodo di destra e
quello di sinistra, sul primo si verifica la deposizione di Cu metallico mentre
sull’altro l’acqua si ossida liberando O2 gassoso.
Sperimentalmente si osserva che
l’intensità di corrente non è
costante, nonostante si mantenga il
potenziale di cella costante nel
tempo:
La diminuzione della corrente si deve alla
sempre maggiore difficoltà di trasporto di
ioni Cu2+ verso l’elettrodo che funge da
catodo, legata alla progressiva scomparsa
di tali ioni dalla soluzione.
Poiché I diminuisce, -IR diventa meno
negativo, dunque gli altri termini del
secondo membro dell’equazione:
Eappl = Er – El + (rc + rk ) – (lc + lk) - IR
devono modificarsi, assumendo valori più
negativi, affinché sia sempre Eappl = -2.5 V.
Nel caso specifico, la sovratensione di
trasferimento di carica per la formazione
di O2 (lk) compensa leggermente,
procedendo verso valori meno negativi.
Il potenziale del catodo, Ec = Er + rc, compensa in modo prioritario, diminuendo
in modo marcato.
La diminuzione del potenziale del
catodo può innescare altri processi
di riduzione, se sono presenti altre
specie riducibili:
se fossero presenti Pb2+ e/o Cd2+
nella cella, comincerebbero a ridursi
al catodo quando ancora è in corso la
deposizione
di
Cu,
rendendo
impossibile la determinazione di
questo, sia per via coulombometrica
che elettrogravimetrica.
2H+ H2
Cd2+ Cd
Pb2+ Pb
In assenza di altri cationi riducibili,
la riduzione di H+ ha inizio prima del
completamento della deposizione di
Cu2+. Poiché l’H2 si libera come gas,
almeno la determinazione elettrogravimetrica del Cu2+ non ne è
inficiata.
La scarica di H2 attenua la polarizzazione catodica (depolarizza il catodo),
impedendo l’eventuale scarica di cationi con potenziali redox ancora più bassi.
Elettrolisi a corrente costante
La scarica di un catione come Cu2+ può avvenire a corrente costante, purché
si aumenti (in valore assoluto) il potenziale di cella durante l’elettrolisi, in
modo da compensare la polarizzazione catodica.
Di fatto, quando la concentrazione di
Cu2+ scende a valori molto bassi, la
polarizzazione catodica si innesca
comunque:
La riduzione di H+ ad H2 diventa dunque via via preponderante e la carica
spesa nell’elettrolisi non è più correlabile alla quantità di Cu2+ presente.
Elettrolisi a potenziale dell’elettrodo di lavoro controllato (potenziostatica)
Rappresenta l’approccio migliore per la determinazione coulombometrica o
elettrogravimetrica di un analita, in quanto permette di impedire a reazioni
redox interferenti di verificarsi insieme a quella di interesse sull’elettrodo
prescelto per essa, definito elettrodo di lavoro.
Per
tale
approccio
è
indispensabile utilizzare una
cella a tre elettrodi:
1) Elettrodo di lavoro
2) Controelettrodo
3) Elettrodo di riferimento
e
due
circuiti,
quello
dell’elettrolisi vera e propria e
quello del riferimento.
Nelle varianti attuali dei sistemi
per elettrolisi a potenziale
controllato,
totalmente
automatizzate,
l’operatore
imposta da software il potenziale
dell’elettrodo di lavoro rispetto al
riferimento e anche se (e come)
esso dovrà variare nel tempo
dell’elettrolisi.
Quando il potenziale comincia a
discostarsi dal valore desiderato,
il computer, che riceve il segnale
dal voltmetro digitale, invia un
comando al sistema di controllo
della d.p.p. fra elettrodo di lavoro
e controelettrodo, in modo da
variarla fino a quando il potenziale
del primo torni al valore atteso
(meccanismo di feedback).
Nel caso dell’elettrolisi potenziostatica si può modulare il potenziale di
cella iniziale in modo che la corrente iniziale sia elevata (il che velocizza il
processo).
Man mano il potenziale di cella viene diminuito per evitare eccessi di
polarizzazione catodica.
Il processo si ritiene completo quando l’intensità di corrente diventa
trascurabile:
Deposizione potenziostatica del Cu da Cu2+
Elavoro = -0.26 V contro SCE
Selettività di un’elettrolisi potenziostatica
L’Equazione di Nerst prevede che un abbassamento di 10 volte della
concentrazione di un catione Mn+ implichi una diminuzione del potenziale
della coppia Mn+/M di 0.059/n V (a 25°C).
Considerando di partire da [Mn+] = 0.1 M e di ritenere la deposizione
completa quando [Mn+] = 10-6 M, la variazione sarà pari a :
0.059 × 5 = 0.295 V
per cationi monovalenti;
0.059/2 × 5 = 0.147 V per cationi bivalenti;
0.059/3 × 5 = 0.098 V per cationi trivalenti
In definitiva è possibile determinare in modo selettivo, per elettrolisi
potenziostatica, cationi, aventi la stessa concentrazione, i cui potenziali
nerstiani differiscano dei valori indicati.
Metodi coulombometrici
Nei metodi coulombometrici la quantità di carica Q che circola nel
circuito viene calcolata a partire dall’intensità di corrente I e
successivamente utilizzata per risalire alle moli di analita, nA, coinvolte
nel processo redox (ad esempio moli di metallo depositate dal catione
presente in soluzione):
Q=I×t
(nei metodi a corrente costante o amperostatici)
t
Q = I(t)dt (nei metodi a potenziale controllato)
0
Per la Legge di Faraday risulta:
nA = Q/nF
dove F = 96485 C/eq, la costante di Faraday
Tale relazione vale rigorosamente soltanto se l’efficienza di corrente del
processo è del 100%, ossia se tutta la carica elettrica circolante viene
spesa per la reazione redox che coinvolge l’analita.
Coulombometria a potenziale controllato
In questo caso la carica viene ottenuta per
integrazione della curva corrente/tempo:
Di fatto non è necessario che il prodotto
della reazione redox si depositi all’elettrodo
di lavoro (ad esempio la riduzione Fe3+
Fe2+ o l’ossidazione H3AsO3 H3AsO4)
La strumentazione per coulombometria potenziostatica consta di:
1) una cella a tre elettrodi
2) un potenziostato
3) un integratore della corrente, necessario per la misura della
carica
Esempi di celle a tre elettrodi per coulombometria potenziostatica
In entrambi i casi anche il controelettrodo è separato dalla soluzione
mediante un ponte salino; ciò evita che i prodotti generati dall’elettrolisi
sull’elettrodo di lavoro interferiscano con la reazione redox relativa al
controelettrodo.
Potenziostati
Il potenziostato comprende un partitore di tensione, un dispositivo di feedback (retro-azione), deputato al controllo del potenziale dell’elettrodo di
lavoro rispetto all’elettrodo di riferimento, ed il dispositivo per la misura
dell’intensità di corrente che circola nella cella elettrolitica.
Lo schema generale per un’elettrolisi che implica una riduzione all’elettrodo di
lavoro è il seguente:
partitore di tensione
opzionale
terra
dispositivo di
feed-back
Agitatore
magnetico
terra
partitore di tensione
opzionale
terra
dispositivo di
feed-back
Agitatore
magnetico
terra
nodo
circuitale
I2
Eapp
P
anodo
Circuito equivalente
Ic
I1
catodo
Il meccanismo di feed-back si basa su
un
amplificatore
operazionale,
schematicamente disegnato come un
triangolo nel circuito equivalente:
nodo
circuitale
I2
Eapp
P
anodo
Ic
I1
catodo
Per il circuito associato al potenziostato valgono le seguenti relazioni e
considerazioni:
in base alla Prima Legge di Kirchoff risulterà: Ic = I2 + I1;
poiché l’amplificatore ha un’elevata resistenza di ingresso I2 ≈ 0; ciò
implica che:
1) la differenza di potenziale fra il punto P e l’ingresso negativo
dell’amplificatore (detto terminale invertente) sia uguale al potenziale
dell’elettrodo di riferimento, Eref;
2) Ic ≈ I1
Fasi della misura coulombometrica
Il partitore di tensione applica una
tensione
E1
all’ingresso
positivo
dell’amplificatore
(detto
anche
terminale non invertente);
nodo
circuitale
I2
Eapp
l’amplificatore eroga in uscita un
potenziale Eapp che viene applicato
all’anodo, mentre il catodo è posto al
potenziale della Terra: ha inizio
l’elettrolisi e circola una corrente di
cella Ic;
P
anodo
Ic
I1
catodo
l’amplificatore opera in modo che E2 ≈ E1; in base alle considerazioni
fatte in precedenza si possono scrivere le relazioni:
E1 ≈ E2 = Eref + I1
Ru = Eref + Ic
Ru
in quanto la differenza di potenziale fra il punto P e il catodo è pari alla
caduta ohmica fra di loro, ossia I1 Ru
Il termine Ic × Ru è, di fatto, il potenziale del catodo, Ecat, rispetto alla
Terra, quindi si può scrivere la relazione:
E1 ≈ E2 = Eref + Ic × Ru = Eref + Ecat
Nel corso della misura potenziostatica Ecat dev’essere costante e la tensione
in uscita dall’amplificatore, Eapp, varia nel tempo proprio per assicurare
questa condizione.
Ad esempio, se il prodotto Ic × Ru aumenta, perché la resistenza Ru o la
corrente Ic sono aumentate nel tempo (Ic può aumentare anche se
diminuisce Rc, ad esempio), l’amplificatore diminuisce Eapp in modo che Ic
diminuisca.
Il contrario accade, naturalmente, quando il prodotto Ic × Ru diminuisce.
La variazione di Eapp avverrà fin tanto che non si saranno ripristinate le
condizioni chiave del meccanismo di feedback, ossia I2 = 0 e, quindi, E2 =
Eref.
Integratori analogici o digitali dell’intensità di corrente
Negli
integratori
(coulometri)
analogici
l’intensità di corrente di cella (ii) diventa prima
un potenziale, passando su una resistenza nota
R i.
Integ.
Tale potenziale viene inviato ad un circuito di
integrazione (Integ.), anch’esso basato su un
amplificatore operazionale: l’integrale della
corrente nel tempo (ossia la carica) è
proporzionale al potenziale in uscita (o).
Negli integratori digitali l’intensità di corrente
di cella (o la tensione in cui è stata
preventivamente trasformata) viene prima
convertita in dato digitale da un convertitore
analogico/digitale (A/D) e poi inviata ad un
computer, che effettuerà l’integrazione:
A/D
Applicazioni generali della coulombometria potenziostatica
Analisi di ioni inorganici (oltre 55 applicazioni riportate), tipicamente per
riduzione a metallo (amalgama) su elettrodi di mercurio;
Analisi di ioni/molecole neutre organiche riducibili su mercurio, ad
esempio:
2 Cl3C-COO- + 2H+ + 2 e-
2 Cl2H-COO- + Cl2
OH
O 2N
OH
NO2
+ 18 H+ + 18 eNO2
H2 N
NH2
+ 6 H2O
NH2
Analisi di ioni/molecole neutre organiche (ammine, fenoli) ossidabili su Pt
o elettrodi di grafite
Coulombometria a corrente controllata: titolazioni coulombometriche
In una titolazione coulombometrica si determina il numero di moli della
specie da titolare a partire dalla carica circolante in una cella elettrolitica
operante a corrente costante (entro al massimo lo 0.1 %).
La reazione redox all’elettrodo di lavoro può coinvolgere:
1) unicamente la specie da titolare (titolazione diretta)
2) in parte la specie da titolare, in parte una specie aggiunta, il cui prodotto
di reazione redox funge, da un certo punto della titolazione in poi, da
titolante (titolazione parzialmente indiretta)
3) unicamente una specie diversa, che fungerà sin dall’inizio da titolante,
mentre la specie da titolare non sarà interessata dal processo redox
(titolazione indiretta)
In tutti i casi citati si deve fare in modo che l’efficienza di corrente del
processo si mantenga sempre al 100% ossia che la carica circolante non
venga mai spesa in un processo che non coinvolga, direttamente o
indirettamente, la specie da titolare ma che venga tuttavia innescato da
fenomeni di polarizzazione.
Esempi di titolazione coulombometrica non diretta
Titolazione coulombometrica ossidativa del Fe2+
La reazione iniziale in questo caso è:
Fe2+
Fe3+ + e-
ma all’aumentare del potenziale applicato all’elettrodo di lavoro, per effetto
della polarizzazione di concentrazione a carico del Fe2+, subentra la
reazione di ossidazione dell’H2O a O2:
2 H2O
O2 + 4H+ + 4e-
La carica spesa in questa fase non è più correlata unicamente al Fe2+
presente, dunque si genera un errore nella determinazione.
La contromisura consiste nell’aggiungere inizialmente un eccesso di sale di
Ce3+ alla soluzione di Fe2+ da titolare.
Prima che possa innescarsi l’ossidazione dell’H2O avverrà quella del Ce3+:
Ce3+
Ce4+ + e-
Il Ce4+ prodotto reagirà con stechiometria 1:1 con il Fe2+ residuo presente:
Ce4+ + Fe2+
Ce3+ + Fe3+
in pratica la carica spesa per ossidare il Ce3+ sarà la stessa necessaria per
completare l’ossidazione del Fe2+, dunque non si commette alcun errore nel
ricavare il numero di moli di quest’ultimo da essa.
Titolazione coulombometrica indiretta del ClIn questo caso si sfrutta l’ossidazione elettrochimica dell’Ag ad Ag+, che poi
reagisce con stechiometria 1:1 con il Cl- facendolo precipitare come AgCl.
Di fatto il Cl- non è coinvolto in alcuna reazione redox, eppure la carica
misurata è correlabile al numero delle sue moli.
Apparato strumentale
galvanostato
La misura ha inizio quando l’interruttore passa in posizione 1, facendo così
circolare corrente nella cella e partire contemporaneamente il timer.
Passando alla posizione 2 il timer si ferma ma la corrente circola comunque,
passando per la resistenza R1, che simula quella della cella elettrochimica. Ciò
consente di mantenere stabile la corrente erogata dal galvanostato in vista di
una successiva misura.
L’elettrodo di lavoro è tipicamente in
platino (il mercurio crea solo il
contatto elettrico al suo interno) e
ha una superficie elevata.
Anche
in
questo
caso
il
controelettrodo è isolato dal resto
della soluzione mediante un setto
poroso (vetro sinterizzato) per
evitare interferenze.
Nel caso delle titolazioni coulombometriche il punto finale non è
determinato automaticamente, va individuato con l’ausilio di indicatori o per
via potenziometrica o fotometrica.
Titolazioni coulombometriche di neutralizzazione
E’ possibile generare elettroliticamente
ioni OH- o H+ da impiegare per
titolazioni
di
neutralizzazione,
sfruttando la riduzione o l’ossidazione
dell’H2O, rispettivamente:
Nella cella rappresentata viene stabilito
un flusso di elettrolita dall’alto, che
rimane attivo brevemente anche dopo
aver interrotto l’elettrolisi, in modo che
i titolanti possano essere introdotti nel
recipiente di titolazione.
Nel caso specifico la lana di vetro impedisce che le specie prodotte ai due
elettrodi possano mescolarsi.
In alternativa, nel caso di titolazioni di acidi forti/deboli (generazione di OH-),
all’anodo, realizzato in Ag, si fa avvenire una reazione del tipo:
Ag(s) + Br- (o Cl-)
AgBr (AgCl)
aggiungendo Br- o Cl- all’elettrolita.
Titolazioni coulombometriche di precipitazione/formazione di complessi
Nel caso delle titolazioni coulombometriche di precipitazione si genera, a
seconda dei casi, un catione o anione per titolare uno ione di carica opposta
mediante formazione di un sale poco solubile.
Le titolazioni coulombometriche con formazione di complessi implicano, invece,
il rilascio del legante EDTA (H4Y), nella forma HY3-:
HgNH3Y2- + NH4+ + 2e-
Hg(l) + 2 NH3 + HY3- (1)
impiegando un catodo di Hg e una soluzione ammoniacale del complesso
HgNH3Y2-.
Applicazioni principali dei due tipi di titolazione
(1)
Titolazioni coulombometriche di ossidoriduzione
L’elettrolisi a corrente costante può consentire anche di generare specie
chimiche in grado di titolare l’analita di interesse mediante reazione redox:
Con tale approccio si possono generare al momento utile specie che non
sarebbero sufficientemente stabili da poter essere conservate in soluzione, ad
esempio l’Ag2+ o il CuCl32-.
Confronto fra titolazioni coulombometriche e volumetriche
Entrambe le tipologie di titolazione richiedono una valutazione esterna del
punto finale;
in entrambi i casi le reazioni coinvolte devono essere rapide, complete e
prive di reazioni collaterali;
si può stabilire un’analogia concettuale fra galvanostato/timer
(interruttore) di un sistema coulombometrico e soluzione di titolante/buretta
(rubinetto) per un apparato volumetrico; in effetti l’interruttore viene chiuso
per tempi più brevi, in più fasi, in prossimità del punto equivalente, così come si
opera con il rubinetto di una buretta;
le titolazioni coulombometriche evitano le problematiche connesse alla
preparazione di soluzioni standard e consentono di disporre al momento di
specie titolanti instabili sul lungo periodo;
consentono, impiegando correnti basse, di “dosare” piccole quantità di
titolante che non sarebbero erogabili con un dispositivo volumetrico;
tipologie diverse di titolazione possono essere effettuate con lo stesso
apparato strumentale.
le titolazioni coulombometriche sono soggette ad alcune cause di errore:
1) fluttuazioni di corrente;
2) scostamenti dal 100% di efficienza di corrente;
3) errore nella misura dell’intensità di corrente;
4) errore nella misura del tempo di elettrolisi;
5) errore nell’apprezzamento del punto finale
Di fatto, essendo le intensità di corrente stabili entro almeno lo 0.2% relativo,
le efficienze di corrente non inferiori al 99.5% e le misure di intensità di
corrente e di tempo accurate e precise, il fattore chiave nell’errore finale è
l’apprezzamento del punto finale.
Questo rende le titolazioni coulombometriche
volumetriche in termini di accuratezza e precisione.
paragonabili
a
quelle