Il sistema periodico degli elementi
Gli
elementi
mostrano
una
variazione
progressiva
delle
proprietà chimiche; dopo un
definito numero di elementi, le
medesime proprietà si ripetono con
deboli variazioni (Mendeleev)
Dati gli elementi:
Li
Be
B
C
N
O
F
Na
Mg
Al
Si
P
S
Cl
Risultano simili le proprietà delle coppie: Li-Na, Be-Mg, B-Al, C-Si, N-P,
F-Cl.
Se quindi gli elementi che vengono dopo il fluoro vengono scritti sotto
quelli della serie precedente, gli elementi che vengono a trovarsi
allineati nella medesima colonna presentano una grande analogia di
proprietà.
Gli elementi che si trovano nella medesima colonna sono detti
appartenere allo stesso gruppo; alle linee orizzontali si dà invece il
nome di periodi:
gruppo
Li
Be
B
C
N
O
F
Na
Mg
Al
Si
P
S
Cl
periodo
Le proprietà chimiche e fisiche degli elementi sono
una funzione periodica del loro peso atomico.
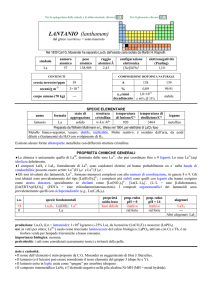
PROPRIETÀ
Peso atomico
Densità del metallo
Colore del metallo
Formula dell’ossido
Densità dell’ossido
Formula del cloruro
Densità del cloruro
Prevista da
Mendeleev
72
5.5
Grigio scuro
GeO2
4.7
GeCl4
1.9
Osservata
sperimentalmente
72.6
5.4
Grigio
GeO2
4.7
GeCl4
1.89
Elemento
H
He
Li
Be
B
C
N
O
F
Ne
Na
Peso
atomico
Z
Elemento
1.01
4.00
6.94
9.01
10.81
12.01
14.01
16.00
19.00
20.18
22.99
1
2
3
4
5
6
7
8
9
10
11
Mg
Al
Si
P
S
Cl
K
Ar
Ca
Sc
Ti
Peso
atomico
Z
24.31
26.98
28.09
30.97
32.06
35.45
39.10
39.95
40.08
44.96
47.90
12
13
14
15
16
17
19
18
20
21
22
3600
3000
Tf °C
2400
1800
1200
600
0
-600
H He Li Be B C N O F Ne NaMg Al Si P S Cl K Ar Ca Sc Ti -Ar K
elementi ordinati secondo il peso atomico
4
valenza
3
2
1
0
H He Li Be B C N O F Ne NaMg Al Si P S Cl K Ar Ca Sc Ti -Ar K
elementi ordinati secondo il peso atomico
Inversioni:
- Ar e K
- I e Te
- Co e Ni
- Th e Pa
In tutti questi casi l’inversione porta a ordinare gli elementi secondo
il numero atomico Z, che Mendeleev ai suoi tempi non poteva
conoscere. Nella tavola periodica moderna basata sui risultati di
Mendeleev, il numero d’ordine che l’elemento occupa nel sistema
periodico è il numero atomico: pertanto gli elementi sono ordinati in
base al numero atomico.
proprietà chimiche ÍÎ proprietà degli elettroni nell’atomo
Periodi:
- un piccolo periodo costituito da due elementi (H e He), chiamato
I periodo;
- due periodi di 8 elementi, includendo i gas nobili (il primo va dal
litio al fluoro, il secondo dal sodio al cloro), chiamati II e III
periodo;
- un periodo di 18 elementi (sempre includendo i gas nobili),
chiamato IV periodo. Gli elementi ferro, cobalto e nichel sono
stati inseriti in un gruppo a parte (il cosiddetto VIII gruppo);
- un periodo costituito da 18 elementi (dal rubidio allo xenon),
chiamato V periodo;
- un periodo che inizia con il cesio (VI periodo), prosegue con il
bario e poi con il lantanio. Dopo il lantanio si hanno 14 elementi
(dal cerio al lutezio), detti lantanidi che per le loro caratteristiche
(in particolare per la struttura elettronica) devono essere inseriti
nella stessa casella del lantanio.
Gruppi:
nella tavola a lunghi periodi gli elementi sono disposti in
18 colonne verticali, numerate da 1 a 18, secondo la
normativa IUPAC del 1986.
In precedenza le colonne erano suddivise in modo da
costituire 7 gruppi A (da IA a VIIA), 7 gruppi B (da IB a
VIIB), 1 gruppo VIII (comprendente 3 colonne) e 1 gruppo
0 (i gas nobili).
IL SISTEMA PERIODICO DEGLI ELEMENTI (FORMA COMPATTA)
Periodo
I
II
III
IV
V
VI
Gruppo
I
A
B
1H
1.008
3 Li
6.941
11 Na
22.990
19 K
39.102
29 Cu
63.546
37 Rb
85.468
47 Ag
107.868
VI
55 Cs
132.905
79 Au
196.966
87 Fr
(223)
(Lantanidi)
VII
(Attinidi)
VII
Gruppo II
A
B
4 Be
9.012
12 Mg
24.305
20 Ca
40.08
30 Zn
65.37
38 Sr
87.62
48 Cd
112.40
56 Ba
137.34
80 Hg
200.59
Gruppo
A
III
B
Gruppo
A
5B
10.81
13 Al
26.981
21 Sc
44.956
IV
B
6C
12.011
14 Si
28.086
22 Ti
47.90
31 Ga
69.72
39 Y
88.906
32 Ge
72.59
49 In
81 Tl
204.37
V
B
82 Pb
207.2
83 Bi
208.981
VII
B
34 Se
78.96
Gruppo 0
2 He
4.003
10 Ne
20.179
18 Ar
39.948
35 Br
79.904
52 Te
127.60
36 Kr
83.80
44 Ru 45 Rh 46 Pd
101.07 102.905 106.4
54 Xe
131.30
53 I
126.904
75 Re
186.2
84 Po
(210)
VIII
26 Fe 27 Co 28 Ni
55.847 58.933 58.71
43 Tc
(99)
74 W
183.85
Gruppo
9F
18.998
17 Cl
35.453
25 Mn
54.938
42 Mo
95.54
51 Sb
Gruppo
A
8O
15.999
16 S
32.06
33 As
74.922
121.75
73 Ta
180.948
72 Hf
178.49
VI
B
24 Cr
51.996
41 Nb
92.906
50 Sn
69.72
Gruppo
A
7N
14.007
15 P
30.974
23 V
50.941
40 Zr
91.22
114.82
57 La
138.905
Gruppo
A
76 Os 77 Ir 78 Pt
190.2 192.22 195.09
85 At
(210)
86 Rn
(222)
58 Ce 59 Pr
60 Nd 61 Pm 62 Sm 63 Eu 64 Gd
65 Tb
66 Dy
67 Ho
68 Er 69 Tm
70 Yb 71 Lu
140.12 140.908 144.24
(145)
150.4 151.96 157.25 158.925 162.50 164.930 167.26 168.934 173.04 174.97
90 Th 91 Pa
92 U 93 Np
94 Pu 95 Am 96 Cm 97 Bk
98 Cf 99 Es
100 Fm 101 Md 102 No 103 Lr
232.038 (231) 238.029 (237)
(244)
(243)
(247)
(247)
(251)
(254)
(253)
(256)
(255)
(257)
Il numero indicato tra parentesi per gli elementi fortemente radioattivi o non rinvenibili in natura rappresenta il numero di massa dell'isotopo con
periodo di semitrasformazione più lungo
IL SISTEMA PERIODICO DEGLI ELEMENTI (FORMA LUNGA)
Gruppi
1
2
3
4
5
6
7
Periodi
IA
II A
III A
IV A
VA
VI A
VII A
I
1
2
H
He
II
III
IV
V
VI
VII
Lantanidi
Attinidi
8
9
10
VIII
11
12
13
14
15
16
17
18
IB
II B
III B
IV B
VB
VI B
VII B
0 (VIIIB)
3
4
5
6
7
8
9
10
Li
Be
B
C
N
O
F
Ne
11
12
13
14
15
16
17
18
Na
Mg
Al
Si
P
S
Cl
Ar
19
20
21
22
23
24
25
26 27 28
29
30
31
32
33
34
35
36
K
Ca
Sc
Ti
V
Cr
Mn
Fe Co Ni
Cu
Zn
Ga
Ge
As
Se
Br
Kr
37
38
39
40
41
42
43
44 45 46
47
48
49
50
51
52
53
54
Rb
Sr
Y
Zr
Nb
Mo
Tc
Ru Rh Pd
Ag
Cd
In
Zn
Sb
Te
I
Xe
55
56
57
72
73
74
75
76 77 78
79
80
81
82
83
84
85
86
Cs
Ba
La
Hf
Ta
W
Re
Os Ir Pt
Au
Hg
Tl
Pb
Bi
Po
At
Rn
87
88
89
Fr
Ra
Ac
58
59
60
61
62
63
64
65
66
67
68
69
70
71
Ce
Pr
Nd
Pm
Sm
Eu
Gd
Tb
Dy
Ho
Er
Tm
Yb
Lu
90
91
92
93
94
95
96
97
98
99
100
101
102
103
Th
Pa
U
Np
Pu
Am
Cm
Bk
Cf
Es
Fm
Md
No
Lr
Osservazioni:
• in generale il numero che definisce i periodi è uguale a quello dello strato più
esterno occupato dagli elettroni nello stato fondamentale:
• alcuni gruppi della tavola periodica assumono dei nomi particolari:
- gli elementi del gruppo IA si dicono metalli alcalini
- gli elementi del gruppo IIA si dicono metalli alcalino-terrosi
- gli elementi del gruppo VIIB si dicono alogeni
- gli elementi del gruppo 0 (anche chiamato VIIIB) si dicono gas nobili
• gli elementi del sistema periodico possono essere anche suddivisi in 4 blocchi,
in accordo con il riempimento degli orbitali più esterni
blocco s
blocco f
blocco d
blocco p
• gli elementi di transizione
appartengono al blocco d