Q
U
Per la spiegazione delle schede e le abbreviazioni, cliccare Q
QU
UIII
Q
U
QU
UIII
Per il glossario, cliccare Q
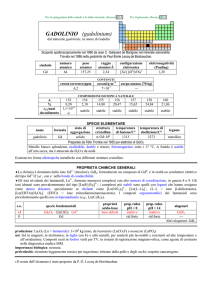
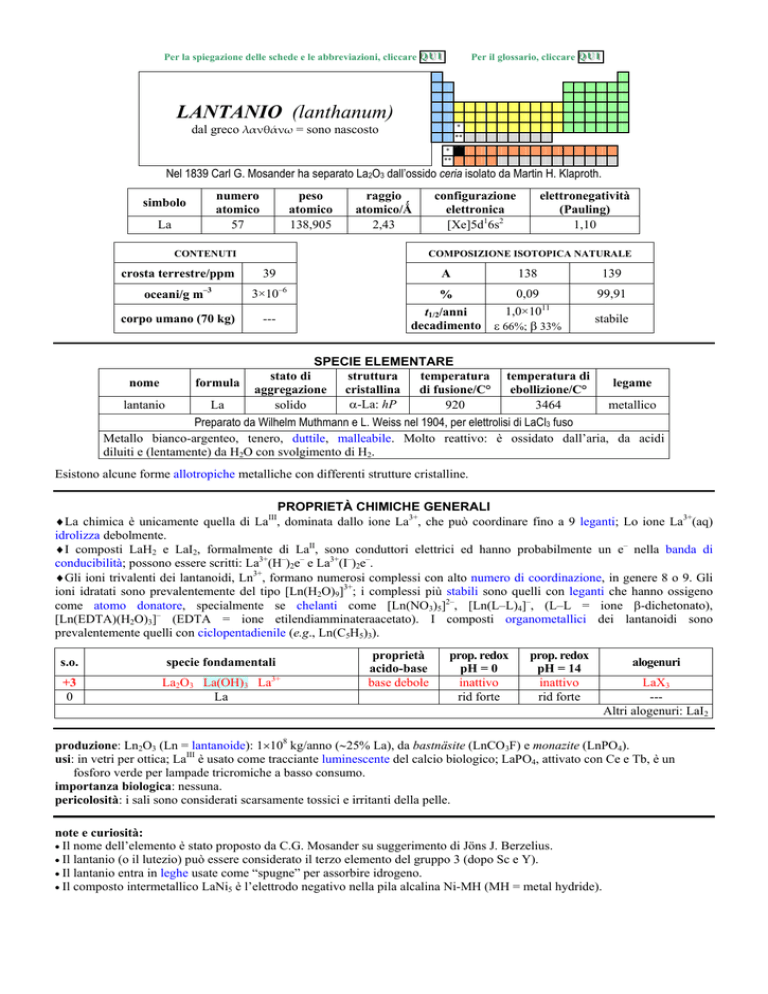
LANTANIO (lanthanum)
dal greco ������� = sono nascosto
*
**
*
**
Nel 1839 Carl G. Mosander ha separato La2O3 dallossido ceria isolato da Martin H. Klaproth.
numero
atomico
57
simbolo
La
peso
atomico
138,905
CONTENUTI
crosta terrestre/ppm
oceani/g m
3
corpo umano (70 kg)
raggio
atomico/�
2,43
configurazione
elettronica
[Xe]5d16s2
elettronegatività
(Pauling)
1,10
COMPOSIZIONE ISOTOPICA NATURALE
39
3×10
6
---
A
138
139
%
0,09
1,0×1011
��66%; � 33%
99,91
t1/2/anni
decadimento
stabile
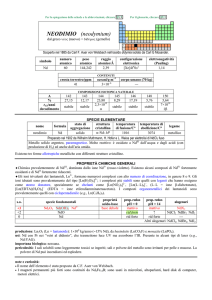
SPECIE ELEMENTARE
stato di
struttura
temperatura
aggregazione cristallina di fusione/C°
�-La: hP
solido
920
temperatura di
legame
ebollizione/C°
lantanio
La
3464
metallico
Preparato da Wilhelm Muthmann e L. Weiss nel 1904, per elettrolisi di LaCl3 fuso
Metallo bianco-argenteo, tenero, duttile, malleabile. Molto reattivo: è ossidato dallaria, da acidi
diluiti e (lentamente) da H2O con svolgimento di H2.
nome
formula
Esistono alcune forme allotropiche metalliche con differenti strutture cristalline.
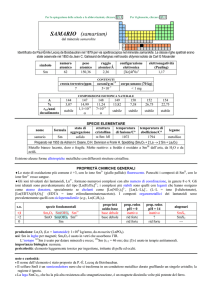
PROPRIETÀ CHIMICHE GENERALI
�La chimica è unicamente quella di LaIII, dominata dallo ione La3+, che può coordinare fino a 9 leganti; Lo ione La3+(aq)
idrolizza debolmente.
�I composti LaH2 e LaI2, formalmente di LaII, sono conduttori elettrici ed hanno probabilmente un e nella banda di
conducibilità; possono essere scritti: La3+(H)2e e La3+(I)2e.
�Gli ioni trivalenti dei lantanoidi, Ln3+, formano numerosi complessi con alto numero di coordinazione, in genere 8 o 9. Gli
ioni idratati sono prevalentemente del tipo [Ln(H2O)9]3+; i complessi più stabili sono quelli con leganti che hanno ossigeno
come atomo donatore, specialmente se chelanti come [Ln(NO3)5]2, [Ln(LL)4], (LL = ione �-dichetonato),
[Ln(EDTA)(H2O)3] (EDTA = ione etilendiamminateraacetato). I composti organometallici dei lantanoidi sono
prevalentemente quelli con ciclopentadienile (e.g., Ln(C5H5)3).
s.o.
+3
0
specie fondamentali
La2O3 La(OH)3 La
La
3+
proprietà
acido-base
base debole
prop. redox
pH = 0
inattivo
rid forte
prop. redox
pH = 14
inattivo
rid forte
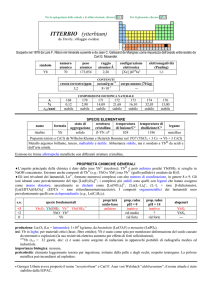
alogenuri
LaX3
--Altri alogenuri: LaI2
produzione: Ln2O3 (Ln = lantanoide): 1�108 kg/anno (�25% La), da bastnäsite (LnCO3F) e monazite (LnPO4).
usi: in vetri per ottica; LaIII è usato come tracciante luminescente del calcio biologico; LaPO4, attivato con Ce e Tb, è un
fosforo verde per lampade tricromiche a basso consumo.
importanza biologica: nessuna.
pericolosità: i sali sono considerati scarsamente tossici e irritanti della pelle.
note e curiosità:
� Il nome dellelemento è stato proposto da C.G. Mosander su suggerimento di Jöns J. Berzelius.
� Il lantanio (o il lutezio) può essere considerato il terzo elemento del gruppo 3 (dopo Sc e Y).
� Il lantanio entra in leghe usate come spugne per assorbire idrogeno.
� Il composto intermetallico LaNi5 è lelettrodo negativo nella pila alcalina Ni-MH (MH = metal hydride).