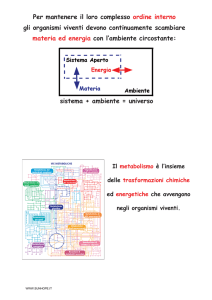
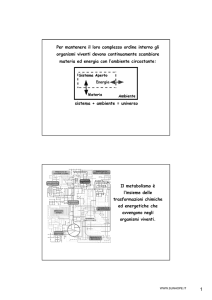
scaricato da www.sunhope.it
Seconda Università di Napoli
III° Anno I° Semestre A.A. 2011/2012 Sbobinatura Fisiopatologia Migliaccio
Gruppo di studio “La Sbobba”
A cura di dodo
1) Fisiopatologia dell’Ipofisi Pag. 2
2) Ipofisi Ipotalamo Pag. 9
3) Ipotalamo Pag. 20
4) Mineralcorticoidi Aldosterone e Gonadi Pag. 29
5) Effetti degli Estrogeni e Progesterone sulla Ghiandola Mam., Ovaio e Testicolo Pag. 41
6) Ermafroditismo Tiroide Pag. 51
7) Ipo e Iper Tiroidismo, Paratiroidi e Regolazione Calcio-Fosforo Pag. 61
scaricato da www.sunhope.it
1
scaricato da www.sunhope.it
1.1 Ipofisi (Giovedì 6 Ottobre 2011)
Fisiopatologia dell’Ipofisi
L’ipofisi è una ghiandola la cui funzione fondamentale è quella di
controllare le altre ghiandole. In realtà l’ipofisi più che una ghiandola,
nel senso di organo specifico, ha una specie di interfaccia tra i centri
corticali che modulano le funzioni emotive, emozionali etc… e le
funzioni vegetative quindi regolano le funzioni specifiche degli organi
e degli apparati che sono a valle mediante la liberazione di fattori
specifici.
L’ipofisi, si presenta di forma irregolare di piccola castagna, ed è ben
sistemata nella sella turcica dello sfenoide dove presenta una parte
anteriore e una posteriore dove distinguiamo un ipofisi anteriore e una
posteriore che sono sostanzialmente diverse. Inoltre presenta una
relazione con il Chiasma Ottico, parte importante poiché i disturbi
dell’ipofisi si traducono poi in disturbi della vista. Inoltre esiste una
differenziazione funzionale tra l’ipofisi anteriore e posteriore, dove la
parte anteriore è la parte più propriamente endocrina mentre quella
posteriore definiamo generalmente neuroendocrina.
Per quanto riguarda la divisione funzionale vi sono delle afferenze che
vanno dall’ipotalamo, nel caso dell’ipofisi anteriore si fermano alle
cellule dove riversano vari tipi di fattori di rilascio di origine ipotalamica
nel sistema vascolare piuttosto complesso, che è a monte dell’arteria
ipofisiaria dove presenta una raccolta attraverso le vene portali che
raccolgono, dopodichè c’è una secrezione di ormoni che vengono
raccolti dalla vena ipofisaria che li mette in circolazione.
La parte posteriore non presenta un’attività ormono-sintetica vera e
propria, in effetti è un distributore dove arrivano direttamente le
terminazioni dei neuroni che originano dall’ipotalamo, dove rilasciano
neuro ormoni all’interno del ipofisi posteriore, quindi non esiste un
attività follicolare autonoma.
Questi ormoni sono di origine peptidica, con
funzione sulle
membrane in quanto non attraversano le membrane delle cellule e in
questo differiscono dagli ormoni steroidei che sono liposolubili dove
presentano recettori intracellulari che cambiano posizione molto
scaricato da www.sunhope.it
2
scaricato da www.sunhope.it
spesso infatti si è notato che questi recettori si spostano dal nucleare
al citoplasmatico, attivano dei segnali di traduzione regolando la
trascrizione a monte di geni specifici.
Come si è visto la differenza funzionale tra ipofisi anteriore e quella
posteriore è notevole nel senso che, l’ipofisi anteriore rilascia ben
sette ormoni Somatotropina (SH o GH), Prolattina (PRL), Tireotropina
(TSH), Ormone follicolo stimolante (FSH), Ormone luteinizzante (LH),
Corticotropina (ACTH), Melanotropo (MSH) mentre l’ipofisi posteriore
non produce di per sé ma si limita a distribuire quello che le viene
portato dal ipotalamo e poi produce solo due ormoni Vasopressina
(ADH) e Ossitocina (Vasopressina e ossitocina sono 2 nonapeptidi
che differiscono per 2 soli aa), dove quest'ultimo nella donna è
importante durante i parto, mentre nell’uomo ha una funzione non
molto chiara. Mentre la Vasopressina è un ormone impegnato nei
processi regolatori idrosalinici a livello dei tubuli contorti distali e dei
collettori del rene, stimolando il riassorbimento dell’acqua dal filtrato
glomerulare.
Ma come funziona la concentrazione grazie alla vasopressina?
L’acqua deve essere necessariamente riassorbita e questo lo fa
grazie al passaggio in un condotto semipermeabile cioè da dentro
esce fuori dal condotto e quindi non viene presa con le urine e questo
avviene soprattutto al vertice delle piramidi renali cioè la cosiddetta
Midollare dove avviene soprattutto lo scambio tra sodio (Na) e acqua.
Ricordando le strutture in sequenza: Tubulo prossimale dove gran
parte dell’acqua viene riassorbita, poi abbiamo l’ansa di Henle dove
viene riassorbito il sodio, tubulo distale sotto il controllo
dell’aldosterione che ulteriormente controlla il riassorbimento
dell’acqua e del sodio, poi il filtrato passa nei tubuli collettori dove
perde nuovamente acqua sotto l’azione del ADH.
La concentrazione dell’urina e del filtrato glomerulale è determinato
soprattutto da fattori anatomici e fattori elettrochimici.
Per quanto riguarda i fattori che controllano il riassorbimento
dell’acqua c’è da sapere che l’acqua viene filtrata (180ml/die) insieme
ai soluti al livello del glomerulo renale, il glomerulo fa passare tutto
tranne le proteine fino a 10,000 dalton, oltre questo stato vi è una
patologia in atto, ed ecco che entra in gioco ADH ormone
scaricato da www.sunhope.it
3
scaricato da www.sunhope.it
fondamentale per il riassorbimento al livello del tubulo convoluto
distale ma soprattutto nei tubuli collettori.
Ma come funziona ADH?
Come tutti gli ormoni attraverso un recettore (V1 induce la contrazione
della muscolatura liscia dei vasi e stimola la glicogenolisi epatica,
inibisce la lipolisi e la sintesi delle prostaglandine, V2 situate sulle
cellule dei tubuli contorto distale e collettore del rene, V3 localizzato
nell’ipofisi e contribuisce ad aumentare la secrezione di ACTH), in
questo caso recettori chiamati V2 presenti sulla membrana
vasolaterale del neurone distale e dei collettori, legati ad una proteina
C di tipo attivatorio che attiva l’adenilato ciclasi AMP dipendente la cui
funzione è di aumentare l’aspersione e la funzione di proteine che si
chiamano acquaporine.
Il riassorbimento dell’acqua, al contrario del riassorbimento dei sali
che funziona attraverso un meccanismo elettrochimico cioè attraverso
pompe di membrana ATP dipendenti, il trasporto dell’acqua
paradossalmente richiede un meccanismo un po’ più complicato e
cioè, l’acqua si avvale di proteine dette acquaporine che sono
espresse sulla membrana e si presenta piene si anse formando un
canale consentendo il passaggio dell’acqua. Di acquaporine si
conoscono tanti tipi ma di importante da ricordare sono la 2 che è
presente su versante luminare del neurone del tubulo collettore, la 3
presente sul versante vascolare che permette all’acqua di essere
riassorbita sul segmento distale e la 6 sul dotto collettore. Quindi
riassumendo il 90% dell’acqua viene riassorbita nel tubulo distale del
della branca discendente della ansa di Henle, solo il 10% nel tubulo
collettore e solo questo 10% è sotto il controllo dell’ormone
antidiuretico (ADH) ed è importante perché, a volte, anche quei 15/20
litri di acqua ritenuta, permette di avere una pressione ottimale.
Quando tutto questo sistema viene a mancare, si parla di Diabete
(derivato dal greco διαβαίνω dia-bàino, "passare attraverso”) in
questo caso, variante detto Insipido dove non viene riassorbita l’acqua
con una concentrazione osmolare intorno a 300 (ottimale 1400)
mentre quello Mellito detto anche Dolce in quanto è presente lo
zucchero nella diuresi sempre per motivi osmotici.
Il Diabete Insipido vene descritto, in fisiopatologia, in due grandi classi
scaricato da www.sunhope.it
4
scaricato da www.sunhope.it
quello Nefrogenico (più comune, il problema si colloca sul sistema
nefronico) e quello Neurogeno (meno comune e la patologia è
causata per una mancanza del ormone ADH che non viene prodotto
dal ipofisi posteriore).
Quello Neurogeno può essere di natura: Autosomica dominante
(colpisce i cromosomi non sessuali e viene trasmesso da genitore a
figlio), Idiopatico, Traumatico (se coinvolta la scatola cranica o per un
incidente o una neoplasia come il Craniofaringioma tumore
istologicamente benigno), Sindromi Tossiche come quella di Simmons
per lo più tropicale ma rara oggi, oppure sindrome di Sheehan Ipossia
acuta post-partum distocico (parto non fisiologico da parte della
gestante), Aneurismica, Trombosica, malattie da granulomatosi,
infezioni del sistema nervoso come encefalite virale, meningite latente
(quasi sempre malattie reversibili).
Quali segni si mostrano in una persona con il diabete insipido?
Ad esempio come in una forte Poliuria (escrezione di un'eccessiva
quantità di urine in assenza di un contemporaneo aumento
dell'assunzione di liquidi) con una bassissima concentrazione, o una
ipercalcemia, oppure ostruzione da infezioni delle vie urinarie, o
anche da Sali di litio che si trovano in alcuni farmaci che si
somministrano durante alcune Psicosi o in alcuni anestetici che
agiscono sul sistema nervoso centrale, nell’anemia falciforme, ed
alcune volte anche nella gravidanza.
Nella valutazione del diabete Insipido Primario e quello Nefrogenico la
prima differenza che risalta all’occhio è che in soggetti che non
riescono a sintetizzare ADH la concentrazione plasmatica non sale,
invece nel soggetto con diabete insipido fino ad un certo punto si ha
un andamento tipo il Primario ma ad un certo punto sale
repentinamente la concentrazione del ADH questo test è definito di
“Assetamento” Si tratta di non far bere il soggetto per un periodo
variabile a seconda della tolleranza individuale, non inferiore
comunque alle 12 ore, a meno che non si manifestino segni o sintomi
di disidratazione (come accade spesso nel diabete insipido vero). Il
soggetto affetto da polidipsia primaria (potomania “bere”) opererà in
risposta alla privazione di liquidi in una drastica riduzione del volume
urinario, con conseguente aumento del peso specifico dell’urina
scaricato da www.sunhope.it
5
scaricato da www.sunhope.it
emessa. Al contrario il soggetto affetto da vero diabete insipido,
essendo incapace di secernere l’antidiuretina, non riuscirà a
concentrare le urine, che continueranno ad essere prodotte con
abbondanza e a basso peso specifico. La prova dell’assetamento è
utile per la diagnosi differenziale e risolutiva del quesito nella
maggioranza dei casi.
Ma c’è anche un'altra faccia della medaglia perché gli ormoni,
principio di carattere generale, cioè se prodotti troppo o troppo poco
abbiamo il diabete, ma se invece c’è molta produzione di ADH avremo
SIADH (inappropriata secrezione di ADH) in un soggetto con questo
tipo di sindrome si osserverà una forte ritenzione di liquidi e gonfiore
generale ed una pressione elevata, urine molto concentrate e sodio
urinario molto basso perché ne secerne poca, si accompagna anche a
debolezza fisica, si accompagna ad un atteggiamento di mal
sopportazione o insofferenza verso qualcosa o situazione
(sfasteriato), possono subentrare anche segni psicomotori come
convulsioni causato da un alterazione notevole della concentrazione
di ioni, con risultato finale di coma.
Per quanto riguarda le cause, quasi sempre non c’è un problema di
recettori o un problema alla periferia ma c’è un problema di tipo
secretorio ed è legato stranamente alle malattie polmonari come
tumori che possono portare un eccessiva produzione di ADH, ma
anche al pancreas, alcuni linfomi, malattie neurologiche o vari farmaci.
Per quanto riguarda l’Ipofisi Anteriore è la ghiandola che controlla la
funzione di tutte le altre ghiandole, funzioni dirette dell’ipofisi, non
mediata da altre ghiandole sono la produzione di somatotropina o
ormone della crescita GH e l’ormone della Prolattina PRL (dette
somatomammotropine) che agiscono direttamente sugli organi
bersaglio.
L’attività dell’ipofisi anteriore è controllata mediante un interfaccia tra
le funzioni superiori come funzioni cognitive, emozionali controllate
dalla corteccia e la funzioni vegetative che sono controllate dal rilascio
di ormoni e neuromediatori. Quindi esiste la mediazione tra la
componente endocrina cioè il laboratorio che produce questi fattori
(ipofisi anteriore) e la corteccia che è costituita dai nuclei della base
soprattutto dall’ipotalamo, il quale presenta una serie di connessioni
scaricato da www.sunhope.it
6
scaricato da www.sunhope.it
con la corteccia limbica, i centri visivi. Il meccanismo con cui
l’ipotalamo regola la funzione dell’ipofisi è sostanzialmente sempre la
stessa e cioè con fattori di rilascio o con fattori inibitori ma quasi
sempre con fattori di rilascio perché l’inibizione non avviene attraverso
l’ipotalamo, tranne in alcuni casi specifici, ma avviene mediante un
azione retrograda attraverso il cosiddetto Feedback Negativo il quale
è sinonimo di ipofisi anteriore che è un meccanismo di regolazione
fondamentale, c’è un solo caso di feedback positivo che riguarda gli
estrogeni che durante l’ovulazione quindi vi è una secrezione di
estrogeni che stimola anche la produzione di ormoni ipofisari.
Gli ormoni dell’ipofisi anteriore sono sette e li possiamo suddividere in
base alla zona in cui vengono prodotti: come ACTH, MSH, Endorfine,
ormoni glicoproteici quali TSH, LH e FSH, Somatotropina quali
Prolattina e GH prodotti da una zona detta Oppio Corticale da dove ne
derivano anche gli oppiacei endogeni le cosiddette endorfine da un
frammento intermedio dall’ACTH la PROOPIOMELANOCORTINA
(POMC). La POMC è un peptide di 240 aminoacidi che ha la
potenzialità, all'interno della sua molecola, di generare varie altre
molecole di grande significato biologico e neurobiologico in virtù di
eventi che seguono alla sintesi proteica e sono rappresentati da
clivaggi proteolitici in sedi strategiche della molecola della POMC.
All'interno della POMC questi peptidi sono separati l'uno dall'altro da
due o più aminoacidi basici che servono come sedi di riconoscimento
per il clivaggio proteolitico che avviene all'interno dell'apparato
golgiano. La POMC può essere considerata composta da tre Domini
principali da dove poi mediante clivaggio si avrà ACTH α-MSH (che
presenta la stessa funzione del MSH) e CLIP e poi la β-Lipotropina
(LPH) che deriva da morfine endogene quali β-Endorfina e la βEncefalina (mediatori negativi del dolore, cioè ci fanno sopportare il
dolore).
La secrezione avviene dal CRF (corticotropin releasing factor) dove il
nucleo paraventricolare contiene dei neuroni che liberano CRF questi
vengono riversati nel sistema cortico-ipofisario che stimola la
produzione di ormoni ACTH da parte del lobo anteriore dove produce
anche un azione di produzione sulla vasopressina da parte del lobo
posteriore. A questo punto si produce ACTH che presenta dei
scaricato da www.sunhope.it
7
scaricato da www.sunhope.it
recettori sulle cellule della ghiandola surrenalica, qui viene prodotto
l’ormone Cortisolo che inibisce la secrezione ulteriore di ACTH
mediante feedback negativo. C’è da dire che il momento in cui vene
stimolata ACTH ci sono anche altri effetti quali la produzione di
Adrenalina e Noradrenalina e Catecolamine dalla corteccia.
Oltre al feedback negativo vi è un altro fattore importante che regola
la secrezione da parte dall’ipotalamo dei fattori di rilascio, di
conseguenza dell’ipofisi, da parte degli ormoni somatotropi è
l’oscillazione durante la giornata della secrezione di questi ormoni nel
arco delle 12/24 che è influenzato anche dal ritmo sonno/veglia e dal
ritmo luce/buio.
Lo stimolo più importante che regola la secrezione dell’ACTH è lo
Stress dove lo distinguiamo in due tipi: uno di carattere Emozionale
(che agisce insieme all’azione di catecolamine) e l’altro è di natura
Biochimica, cioè se si ha un infiammazione o un trauma di natura
fisica che porta ad una sofferenza cellulare induce una liberazione di
CRH che agisce sull’ipofisi che libera ACTH che a sua volta agirà
sulla corticale del surrene con liberazione di cortisolo inibendo la
secrezione di CRH.
Inoltre ACTH modula la secrezione di glucocorticoidi (importanti per
l’equilibrio energetico) regolata dall’ippocampo che controlla la
secrezione di ormoni da parte dell’ipofisi e poi dalla secrezione del
sistema nervoso autonomo.
L’ipotalamo contiene una serie di cellule specializzate che sono
coinvolte in molte funzioni ipotalamiche ad esempio il ciclo circadiano,
nucleo sopra chiasmatico questo provvede all’attività sulle cellule
della pressione arteriosa o della temperatura, ma sono presenti altri
nuclei che esplicano funzioni neuroendocrine che intervengono
direttamente sul sistema nervoso autonomo.
scaricato da www.sunhope.it
8
scaricato da www.sunhope.it
Migliaccio 1.2 (Giovedì 13 Ottobre 2011)
Ipofisi
Ipotalamo
Come già detto l’ipofisi rappresenta una vera e propria interfaccia tra i
centri corticali (parte cognitiva del cervello) e le funzioni vegetative
vere e proprie, quindi rappresenta una specie di strumento che
consente il controllo da parte delle funzioni superiori, delle funzioni
vegetative necessarie per le normali attività dell’uomo.
Come concetti generali bisogna ricordare che l’ipotalamo rappresenta
l’interfaccia nervosa l’ipofisi l’interfaccia endocrina cioè quello che
trasforma l’impulso nervoso in segnale chimico che viene inviato agli
organi effettori delle ghiandole endocrine che secernano degli ormoni
specifici che controlleranno e determineranno le funzioni vitali.
Alcuni concetti generali che regolano l’attività dell’ipofisi, uno dei
concetti menzionati era il ritmo circadiano dovuto dal fatto che alcuni
dei neuroni che provengono dall’area retinica (coni e bastoncelli) e
prima di andare all’aria genicolata che è quella che determina
rappresentazione dell’impulso visivo, quindi la razionalizzazione della
percezione visiva, quindi si intrattiene al livello dell’ipotalamo dove
intrattiene relazioni sinaptiche con altri neuroni che sono quelli che poi
andranno verso i nuclei sopraottico regolando le funzioni vegetative.
Quindi il ritmo circadiano influenzato dalla luce e dal trascorrere del
tempo in quanto l’attività di molte ghiandole presenta un ritmo ciclico
ad esempio è quello dei glicocorticoidi ad esempio per determinare la
concentrazione ad esempio di cortisolo, in un individuo, il prelievo si
effettua verso le 8 della mattina per avere la massima concentrazione,
invece per avere il Nadir per determinare la concentrazione più bassa
poco prima delle 24.
Poi abbiamo il concetto di feedback negativo cioè che ad ogni
variazione di un parametro che deve essere ritenuto stabile
corrisponde ad una controreazione mediata dai nuclei ipotalamici che
cerca di ripristinare le condizioni preesistente, l’esempio più comune è
la variazione della temperatura corporea infatti tutte le volte che si
supera il valore pre-settato del setpoint ipotalamico vengono messi in
funzione dei meccanismi di termodispersione come la sudorazione,
scaricato da www.sunhope.it
9
scaricato da www.sunhope.it
aumento della frequenza respiratoria in modo da ripristinare la
temperatura precedente, mentre al contrario se vi è una condizione di
ipotermia
oltre
a
mettere
in
funzione
meccanismi
di
termoconservazione si mettono in funzione anche meccanismi di
termoaccessori come il brivido o l’orripilazione (erezione dei peli) ma
soprattutto vengono anche introdotte delle funzioni cognitive come
coprirsi o accendere il fuoco e anche qui vene introdotto il concetto di
feedback negativo quindi ad ogni variazione dove lo stimolo è
negativo corrisponde una controreazione che cerca di ripristinare le
condizioni preesistenti, sempre se queste condizioni preesistenti siano
fisiologiche. Ad esempio l’asse ipofisi surrene si ha uno stimolo, in
genere uno stimolo stressogeno, cioè uno stimolo che mette in
difficoltà le funzioni vitali questo agisce sull’ipotalamo che libera CRF
all’ipofisi che a sua vola rilascia ACTH, corteccia surrenale,
glicocorticoidi, in più l’ipotalamo attiva la midollare del surrene che
secernerà adrenalina. A sua volta subentra un meccanismo di
feedback negativo dove sono presenti dei recettori per i glicocorticoidi
che sono presenti in quantità maggiore nel sistema nervoso che
nell’ipofisi per cui, il cortisolo, prodotto dalla corticale del surrene,
riduce, legandosi a dei recettori specifici presenti al livello
ippocampale, la secrezione di CRH di conseguenza si riduce la
concentrazione di ACTH quindi si ha la regolazione negativa.
Come detto i glicocorticoidi non funziona solo sull’attività endocrina
propriamente detta (secrezione di ACTH, cortisolo) ma funziona
anche sulla midollare del surrene causando il rilascio di catecolamine
che finiscono con sinergizzare con l’azione dei glicocorticoidi, in altre
parole i glicocorticoidi procurano la riserva di combustibile biologico
con gli zuccheri mentre l’adrenalina e noradrenalina ridistribuiscono la
vascolarizzazione dirottando il flusso ematico ai distretti muscolari,
vene aumentata la disponibilità di glicogeno e i glicocorticoidi
inibiscono alcuni processi non essenziali in quel momento come ad
esempio come la funzione riproduttiva delle cellule o le reazioni
infiammatorie. Naturalmente se persiste una condizione di stress la
presenza stessa dei meccanismi che dovrebbero proteggere, quindi
controregolare gli eventi stressogeni finisce per diventare deleterio
perché un eccesso di glicocorticoidi porterà ad una depressione della
scaricato da www.sunhope.it
10
scaricato da www.sunhope.it
risposta immunitaria, una condizione di iperglicemia costante o tutta
una serie di effetti riguardando i glicocorticoidi (rimando a spiegazione
dei glicocorticoidi).
Un altro esempio di feedback negativo è quello di controllo neuronale
dove la concentrazione più alta dei recettori per i glicocorticoidi si
trova proprio a livello dell’ippocampo. Questi glicocorticoidi hanno un
effetto sulle stesse cellule dell’ippocampo perché a livelli normali
mantengono una normale funzionalità di quest’organo, ma a livelli più
alti possono indurre addirittura fenomeni irreversibili secondari alla
morte programmata delle cellule che viene indotta da insulti ischemici
ipossici che sono conseguenti all’azione stessa delle cellule morte.
Un altro concetto fondamentale è che la memoria neuronale, che è
presente proprio al livello dell’ipotalamo che ne confronta con dei
segnali che vengono dalla corteccia sensoriale limbica e la corteccia
motoria limbica. La corteccia sensoriale limbica possiede l’intera
rappresentazione di tutti gli organi ed apparati che sono presenti e
attraverso all’alterazione funzionali che possono coinvolgere
determinati distretti può intervenire con reazioni sia di tipo somatico
(ripristinando la pressione, la motilità intestinale, la frequenza
respiratoria) sia a sua volta interagendo con i centri chimici l’ipofisi
con la liberazione di fattori ormonali (glicocorticoidi) che vanno a
regolare le funzioni metaboliche.
La stessa cosa si può dire, grosso modo, parlando degli ormoni
glicoproteici la quale caratteristica fondamentale di questi ormoni è la
presenza di una catena comune che è la α e di una catena
differenziata β che differisce le due grandi classi che compongono
questa famiglia di ormoni che sono l’Ormone tireo stimolante TSH e le
gonadotropine (hCG) GH e FSH tutte quante differiscono
esclusivamente per la struttura della catena β. Anche in questo caso
abbiamo un controllo a feedback negativo dove avremo che
l’ipotalamo rilascia il fattore specifico che è il TRH il quale va all’ipofisi
anteriore che secerne TSH che porta all’attivazione della tiroide e vi
rilascia T3 e T4, a sua volta i T3 e T4 esercitano un azione di
regolazione negativa. Qui si introduce un nuovo concetto e cioè il
concetto di inibizione a Loop Lungo e a Loop Breve dell’attività, in
quanto il feedback negativo può seguire due modalità: il loop lungo è
scaricato da www.sunhope.it
11
scaricato da www.sunhope.it
l’inibizione che si svolge direttamente a livello dell’ipotalamo cioè
presente soprattutto per i glicocorticoidi e le hCG perché la maggior
parte dei recettori dei glicocorticoidi, dell’estradiolo e degli androgeni
sono presenti nel sistema nervoso. Per il loop breve invece è
soprattutto al livello degli ormoni tiroidei cioè significa che l’inibizione
avviene direttamente a parità di secrezione di ormone stimolante da
parte dell’ipotalamo, in effetti gli ormoni secreti dalla ghiandola
bersaglio non riducono la secrezione del fattore di rilascio ipotalamico
ma la sensibilità dell’ipofisi all’azione di questi ormoni. Quindi nella
patologia difficilmente si incontreranno casi di ipotiroidismo terziario
cioè dovuto dal difetto dell’ipotalamo (riduzione del TRH con
conseguente riduzione di TSH), mentre spesso si possono trovare
casi di alterazioni del sistema nervoso si può trovare ipogonadismo,
quindi la maggior parte delle patologie legate ad un'alterata funzione
della tiroide sono o primarie o secondarie mentre per l’asse ipotalamo
hCG ci possono essere fenomeni più complessi.
Nel caso delle hCG si osserva un tipico esempio di loop lungo dove si
osserva feedback negativo. L’ipotalamo secerne un fattore di rilascio
GRH che agisce sull’ipofisi il quale secerne ben due ormoni che
regolano le gonadi, quali LH ed FSH. Da vecchi studi che si sono
rivelati non proprio veritieri, in quanto, noi sappiamo che le gonadi
presentano due funzioni una gametogenetica riproduttiva e una
funzione endocrina, quindi da un vecchio concetto sappiamo che FSH
servisse essenzialmente per la funzione gametogenetica cioè
servisse a determinare la maturazione e lo scoppio dell’ovocita e la
maturazione degli spermatozoi, mentre LH la funzione endocrina. Ma
in realtà non è proprio così, infatti, da studi recenti si è visto che tutti e
due funzionano per tutte e due le cose, ad esempio LH nel caso
dell’ovaio è importantissimo per la sintesi del testosterone però se non
è presente FSH non viene attivata la Aromatasi fondamentale enzima
che trasforma il testosterone in estradiolo, quindi si possono
immaginare le conseguenze della donna con evidenti tratti di
ipertricosi facciale, quindi sono importanti entrambi questi ormoni per
la sintesi degli ormoni nella donna. Nell’uomo questa differenziazione
è più marcata in quanto FSH serve soprattutto per la maturazione per
gli spermatozoi però svolge anche un’azione molto importante e cioè
scaricato da www.sunhope.it
12
scaricato da www.sunhope.it
di indurre la produzione di una proteina ABP che serve per aumentare
la concentrazione di testosterone al livello dei testicoli in modo da
eutrofizzare (nutrice) il tessuto testicolare.
Un altro concetto fondamentale è come avviene la secrezione delle
hCG che avviene prevalentemente in maniera “pulsatile” dove si
hanno dei picchi di secrezioni dei hCG più o meno ad intervalli fissi
20/40 minuti in realtà si arriva anche a 2 ore e si presentano piuttosto
stabili, ma quello che fa variare la concentrazione di ormoni sessuali
non è tanto il picco della concentrazione di hCG ma la frequenza cioè
quando deve esserci un picco di secrezione di ormoni steroidei
sessuali (testosterone o estrogeni) c’è un aumento della frequenza di
questi eventi secretori da parte dell’ipofisi e questo è dovuto al fatto
che si modula differentemente l’inibizione dell’ipofisi da parte degli
ormoni bersaglio, cioè ad esempio durante l’infanzia e l’adolescenza i
livelli di ormoni sessuali (testosterone o estradiolo) è molto basso però
c’è già un'attività di secrezione da parte dell’ipotalamo quindi sono
presenti eventi pulsatili, ma in maniera molto più rari, ma si ha una
riduzione della sensibilità dell’inibizione da parte del testosterone da
parte delle hCG, in altre parole a parità degli eventi secretori l’ipofisi
produce molto ormone gonadotropo e quindi aumenta i livelli di
ormone periferico quale testosterone ed estrogeno. Praticamente
quello che succede a parità di un’attività secretoria relativamente
costante si ha soprattutto una riduzione dell’inibizione dell’ipofisi che
produce più hCG e diventa molto meno sensibile all’inibizione da
parte degli ormoni sessuali per cui anche se il livello di ormoni
sessuali è relativamente alto l’ipofisi continua a secernere hCG. Gli
effetti sono sul testicolo, sulle ovaie stimolando la produzione di
estrogeni e indirettamente di progesterone, nell’uomo mantiene la
secrezione di testosterone.
Per quanto riguarda la secrezione degli estrogeni e del progesterone
da parte delle gonadotropine, come abbiamo detto il concetto
fondamentale è che è presente un feedback negativo cioè tutti gli
ormoni ipofisari sono regolati negativamente dall’eccesso di ormoni
prodotti delle ghiandole bersaglio, c’è una sola eccezione che
riguarda l’asse ipotalamo ipofisi ovaio, questo è dovuto soprattutto da
una particolarità modalità di secrezione di questi ormoni che si ha
scaricato da www.sunhope.it
13
scaricato da www.sunhope.it
nella donna che differisce soprattutto dalla secrezione che abbiamo
nell’uomo. Nell’uomo non ci sono oscillazioni “drammatiche” una volta
raggiunta l’età adulta la concentrazione di testosterone, nella donna
invece dopo il Menarca cioè dopo che si sono maturati i primi follicoli
e quindi si ha il normale ciclo ovulatorio che dura circa 28/30 giorni e
durante questo ciclo si ha una concentrazione ciclica delle
concentrazioni di estrogeni, progesterone e delle corrispondenti
gonadotropine. Questo è dovuto al fatto che a differenza di tutti gli altri
ormoni che solo in questo caso di feedback positivo cioè: 1 si ha la
maturazione dei caratteri sessuali e inizia la secrezione di hCG si
osserverà il primo segno delle maturazioni dei caratteri sessuali
caratterizzata da un aumento della secrezione di hCG da parte del
ipofisi, questo succede nel primo ciclo mestruale e poi in tutti quelli
successivi subito dopo l’emorragia mestruale cioè subito dopo che è
stato eliminato quello che resta del follicolo si osserva un piccolo
aumento di LH e FSH il quale incomincia a portare all’aumento della
sintesi di estradiolo, estradiolo che inizia a sparire perché si ha uno
strano gioco di rimozione ed inibizioni da parte dell’ipofisi per cui
l’estradiolo non inibisce completamente l’attività dell’ipofisi, all’inizio
cresce la concentrazione di estradiolo e si osserva una piccolissima
riduzione dell’attività del FSH e LH, ma ciò nonostante la secrezione
di estradiolo continua a salire e si osserva un punto in cui si ha un
doppio picco di estradiolo c’è anche un picco di LH e FSH questo è
essenziale per lo scoppio del follicolo. Se non si ha questo quasi
simultaneo (differenza di ora), non si potrà avere lo scoppio del
follicolo, in quanto estradiolo e hCG sono essenziali per far crescere
la pressione all’interno del follicolo e quindi allo scoppio del follicolo
stesso e alla fuoriuscita dell’ovulo. Successivamente l’estradiolo risale
ma soprattutto risale il progesterone perchè viene prodotto dal corpo
luteo pur essendo relativamente bassa la secrezione di LH e FSH.
Un ormone più tipicamente ipofisario, perché, mentre tutti questi
ormoni, hCG, TSH, corticopropine sono tipicamente prodotte
dall’ipofisi e non mediate da altre ghiandole, l’ipotalamo secerne sia il
fattore di rilascio del GH sia una sua controparte, un regolatore
negativo quale la Somatostatina (prodotta anche dalle cellule δ del
pancreas, e dalle cellule D antrali dello stomaco, prodotta in una
scaricato da www.sunhope.it
14
scaricato da www.sunhope.it
forma inattiva precedentemente, poi viene trasformata da enzimi
proteolitici formando due frammenti 28 e 14 che hanno un azione di
inibizione) la quale agisce sull’ipofisi che secerne GH il quale presente
due modalità di azione detta bifasica cioè ha un azione diretta
attraverso dei recettori di membrana (proteine G) che attivano
l’adenilato ciclasi e quindi con un meccanismo ciclico AMP dipendente
inducono effetti sul tessuto adiposo sulla mobilizzazione dei grassi,
però il grosso dell’effetto del GH è mediato dal IGF (che presenta una
notevole somiglianza con l’insulina) che agisce attraverso la
membrana. Questo effetto indiretto agisce soprattutto sul tessuto
muscolare, soprattutto sul tessuto muscolare liscio, sugli organi e
sull’osso (detta reazione di solfatazione perché faceva incorporare il
condroitin solfato radioattivo nelle ossa e perciò si chiamava fattore di
solfatazione si pensava che avesse a che fare con lo zolfo ma in
realtà si usava lo zolfo 35 come marcatore).
Il GHRH stimolano ipofisi a produrre GH e i fattori che inducono la
secrezione di GHRH e di GH come conseguenza sono soprattutto
l’ipoglicemia che è un forte stimolante della sintesi di GH, bassi livelli
di acidi grassi, il sonno negli stadi 3 e 4, l’ormone antidiuretico, gli
estrogeni anche se l’estrogeno in eccesso può portare ad una
“saldature” precoce dell’epifisi e poi ad un accorciamento della statura
e gli aminoacidi liberi soprattutto quelli basici come Arginina. Invece
l’inibizione della produzione di GH è data soprattutto dalla
iperglicemia, l’obesità quindi la liberazione di acidi grassi e la
somatostatina.
Il vero bersaglio dove viene indotta la sintesi di IGF che a sua volta
porta alla crescita cellulare e alla sintesi di condroitin solfato.
Il GH agisce soprattutto sulle epifisi durante la fase dell’infanzia
quando ancora le cartilagini sono particolarmente sensibili all’azione
dell’ormone. Le cellule staminali cartilaginee presentano dei recettori
elevati recettori per IGF che stimola la sintesi di RNA inducendo
l’espansione clonale trasformando i condrociti in via di maturazione
che maturano nella parte distale determinando l’allungamento
dell’osso. Quindi si ha un picco di crescita massimo durante l’infanzia,
scende durante la pubertà e poi si appiattisce.
Per quanto riguarda il meccanismo di funzionamento dell’IGF è
scaricato da www.sunhope.it
15
scaricato da www.sunhope.it
uguale a quello dell’insulina, la cosa importante è che sfrutta varie vie
di trascrizione una di queste è la MAP-chinasi che come effetto finale
si ha una produzione di una notevole quantità di cicline a livello di vari
organi.
Un discorso simile è quello per quanto riguarda la Prolattina dove
abbiamo una secrezione regolata da una serie di fattori, come la
secrezione che è stimolata da vai fattori ipotalamici come il riflesso
della suzione e dagli estrogeni ed è inibito potentemente soprattutto
dalla dopamina.
L’azione
fondamentale
della
prolattina,
non
pensando
all’accrescimento del parenchima mammario che è legato soprattutto
ad estrogeni e progesterone dove gli estrogeni fanno allungare i dotti
ed il progesterone determina la proliferazione degli acini (ormoni
molto importanti per il determinismo degli ormoni della mammella) è
legata moltissimo alla secrezione tonica delle ghiandole mammarie,
infatti iperprolattinemia nell'uomo porta a ginecomastia, ma serve
soprattutto per la produzione del colostro e successivamente del latte.
La secrezione è legata soprattutto al TRH o all’ossitocina dopo la
nascita, a vari fattori ipotalamici, è inibita dalla dopamina ma
soprattutto fortemente stimolata dal riflesso della suzione.
Le conseguenze del iperprolattinemia nelle donne può portare alla
amenorrea, infatti è quella condizione che si verifica subito dopo il
parto con la sospensione del ciclo mestruale, Galattorrea o eccessiva
o ingiustificata produzione di latte al di fuori della necessità. Nell’uomo
ipogonadismo, riduzione della libido, oligo-azospermia, ginecomastia.
Nel momento in cui si hanno dei danni dell’ipofisi si parla di
Ipopituitarismo suddivisibile in due grandi classi: Pan-Ipopituitarismo
monotropo quando prende tutta l’ipofisi, Monotropo quando colpisce
una singola parte dell’ipofisi quindi a seconda della causa si può
avere che vengono coinvolti diversi tipi cellulari e quindi la secrezione
di molti ormoni stimolatori oppure di un singolo gruppo il che è un po’
più difficile.
Pan-Ipopituitarismo può essere determinato da due malattie esotiche
Sindrome di Sheehan (necrosi post partum dovuta da parto
particolarmente difficile che determinavano una situazione di
sofferenza per la madre e si osservava un ischemia molto grave
scaricato da www.sunhope.it
16
scaricato da www.sunhope.it
dell’ipofisi che portava ad insufficienza di tutta l’ipofisi, in alcuni casi la
situazione si riprendeva molto lentamente, ma in altri casi questa
sofferenza si protraeva molto a lungo) e sindrome di Simmons (si
tratta di microadenomi non produttiva cioè, in genere i microadenomi
ipofisari fanno funzionare di più l’ipofisi e non di meno ma in questo
caso si degenera in una forma di fibrosi), Trombosi (che rievocano
Simmons) e Neoplasie.
Ipopituitarismo monotropo da alcune forme di Addison cioè da
insufficienza della corticale del surrene legata ad un deficit delle
cellule che producono la melanocortina (MSH), Ipotiroidismo
secondario, Ipogonadismo e Ipogonadotropo piuttosto frequente nei
maschi.
Quella che può interessare di più, nel caso di ipofunzione dell’ipofisi, è
proprio l’ipofunzione da GH dove si osservano cause primarie come
Aplasia e Ipoplasia piuttosto rara, alcuni difetti genetici che portano
ad una secrezione alterata di un GH alterato, più frequenti sono
tumori intrasellari e distruzioni non neoplastica (infezioni, trauma).
Cause secondarie come Idiopatico, postinfettivo ad esempio legato ad
eventi come encefaliti, tumori ipotalamici, deficit psicosociali. Poi si
può avere anche una forma di resistenza periferica come il nanismo.
Tutto questo si traduce in un deficit della crescita lineare del soggetto,
che possono essere gli ormoni che sono coinvolti nella crescita. Il
deficit da GH è quello responsabile del cosiddetto nanismo ipofisario
che si presenta con un fisico piuttosto armonico, mentre l’eccesso di
GH porta al gigantismo, una possibile diversità del nanismo sono i
nani tiroidei che si presenta non molto armonico, perché l’eccesso di
ormoni tiroidei non fa crescere moltissimo, mentre il deficit fa ridurre
molto la crescita lineare, riduce anche le caratteristiche psichiche in
cui c’è il cretinismo, quindi molto spesso un soggetto che ha una
carenza così violenta di ormoni tiroidei oltre ad essere un nano
presenta segni di cretinismo.
Un altro ormone che può interferire con la crescita sono i
glicocorticoidi che interessano la crescita riducendo la crescita lineare
dell’osso, ritardano la maturazione scheletrica, un soggetto iper
trattato con cortisolo può presentare un effetto di riduzione della
statura. Poi abbiamo androgeni ed estrogeni, androgeno stimola la
scaricato da www.sunhope.it
17
scaricato da www.sunhope.it
maturazione dell’osso e un allungamento scheletrico, gli estrogeni in
qualche modo consente una crescita prolungata per cui si presentano
più alti della media però sia androgeni che estrogeni da soli in
eccesso provocano una diminuzione dell’altezza perchè inducono una
precoce maturazione dell’osso, come nei casi di pubertà precoce, si
maschile che femminile ma soprattutto maschile, sono più bassi
proprio perché si ha una saldatura precoce delle epifisi.
La cosa interessante che si è osservato negli ultimi anni è che c’è una
forma di nanismo psicosociale (es. orfani rumeni) che è su base
organica cioè in questi soggetti che vivono in condizioni
particolarmente gravose si è osservato che questi bambini non
secernevano concentrazioni normali di GH, ma se i bambini venivano
nutriti in maniera normale e sopratutto si ripristinavano delle
condizioni minime di serenità, si osservava recupero del profilo
secretorio del GH.
L’eccesso di GH porta a Gigantismo dove si osserva una mancata
saldatura delle ossa o Acromegalia si ha la saldatura ossea ma l’osso
cresce in modo concentrico, ma questo non si osserva solo sul
tessuto osseo ma anche su organi e tessuto muscolare infatti si
osserva un ingrossamento generale di tutti gli organi e dei tessuti e si
hanno si cosiddetti “Gross feature” lineamenti grossolani cioè si
presentano con mascelle grosse, zigomi molto grandi, le mani e i piedi
sono invece di essere lunghe sono larghe e soprattutto l’eccesso di
GH e di IGF porta a disturbi metabolici con presenza di diabete di tipo
2 (insulino indipendente).
Tutte queste alterazioni sono dovute essenzialmente da micro o
macro adenomi ipofisari.
Per quanto riguarda gli organi bersaglio, tra i più interessanti è la
corteccia surrenale, la loro funzione è riassunta nella loro azione
soprattutto quando mancano o funzionano troppo.
La corteccia surrenale in modo particolare è un organo
particolarmente complesso in quanto come se fosse ben tre ghiandole
separate, perché è divisa in tre zone, una zona Esterna che si chiama
glomerulosa o glomerulare (ricordate glomerulosa e pensate al
glomerulo perché è quella che produce Aldosterone ormone che
agisce soprattutto sul rene), una zona Fascicolata o intermedia e zona
scaricato da www.sunhope.it
18
scaricato da www.sunhope.it
Reticolare interna, che essenzialmente producono essenzialmente
cortisolo (glicocorticoidi) e gli ormoni sessuali soprattutto maschili.
Tutto quello che al livello della glomerulare o glomerulosa non si ha
sintesi di glicocorticoidi e di androgeni surrenalici perché manca un
enzima fondamentale che è la 17-α-idrossilasi il quale è controllato
trascrizionalmente dall’ ACTH cioè controlla direttamente la
trascrizione di questo enzima. Questo enzima è responsabile della
fase primordiale che porta da pregnonolone a 17-idrossipregnonolone o progesterone a 17-idrossi-progesterone. Se non si
parte da quel 17 non si può avere ne cortisolo ne testosterone etc…
Mentre invece nella glomerulare è presente un altro enzima la 18idrossilasi che alla fine trasforma il corticosterone in aldosterone e
quindi ci determina il tropismo di questi ormoni.
Quindi la 17-α-idrossilasi conferisce la specificità 18-idrossilasi è
necessaria per la conversione in aldosterone, tipica della zona
glomerulare. Altro concetto è che tutti questi ormoni (cortisolo e
corticosterone etc…) posseggono sia capacità mineral-attive che
glicoattive è solo una questione di rapporto, il cortisolo è cento volte
più glicoattivo dell’aldosterone, aldosterione è cento volte più minerlattivo del cortisolo. Quindi intercambiabilità dei pathway (via
metabolica), specificità della zona glomerulare e presenza di sintesi
multistep per la produzione di questi ormoni.
scaricato da www.sunhope.it
19
scaricato da www.sunhope.it
Migliaccio 1.3 (Mercoledì 19 Ottobre 2011)
Ipotalamo
Gli ormoni sono molto importanti soprattutto quando non ci sono o ce
ne sono troppi perché possono dare notevole fastidio.
Per quanto riguarda i recettori steroidei c’è da dire che sono differenti
dai recettori peptidici perché gli ormoni sterioidei passano attraverso
la membrana e possono andare ovunque, passano la membrana,
attraversano i microtubuli e poi arrivano nel nucleo, molti studiosi
affermano che i recettori siano essenzialmente nucleati in quanto
presentano una regione che interagisce con l’ormone che è altamente
specifica in quanto conferirà la specificità a alcun recettore chiamata
“Hormon binding” in corrispondenza del carbossi terminale regione
che mostra un elevato grado di differenziazione e funzione dello
specifico recettore, poi presentano una regione “DNA binding” cioè
che lega il DNA caratterizzata da Zinc finger che sono dei legami
coordinati di cisterna che legano uno zinco, questi due legami sono
importanti perché si infilano nel elica del DNA e regolano i fattori di
trascrizione di geni specifici. Poi è presente un'altra regione
“interactive with other” che lega altri fattori di trascrizione quali gli
enancer, coattivatori, corepressori che servono a regolare la funzione
specifica degli ormoni che legano gli ormoni stessi.
Fino a qualche anno fa si pensava che questi recettori svolgessero
tutte le funzioni di trascrizione, ma oggi si sa che la questione è più
complicata, perché, oltre ai recettori per gli ormoni, ci sono altri fattori
che regolano la trascrizione attraverso meccanismi specifici. Una delle
funzioni specifiche, ad esempio i recettori per i glicocorticoidi, viene
attivato soprattutto in condizioni di stress soprattutto in presenza di
cortisolo. Il cortisolo si lega ai recettori dei glicocorticoidi, si dissocia
da un complesso multiproteico costituito dalle “heat shock protein”
dette anche proteine di protezione, in quanto, in condizioni di stress si
dissociano dal recettore dei glicocorticoidi, il quale recettore si associa
con un altro recettore dimerizzandosi, in un secondo momento
entrano nel nucleo e interagiscono con il DNA, regolando la
trascrizione dei geni specifici.
scaricato da www.sunhope.it
20
scaricato da www.sunhope.it
Per quanto riguarda i geni dei glicocorticoidi, sicuramente sono quelli
che sono coinvolti nella apoptosi (si chiamano glicocorticoidi perché
regolano il metabolismo glicidico) ma sopratutto una delle reazioni
fondamentali è che regolano negativamente la proliferazione di molte
linee cellulari e viene usato in farmacologia per uso antinfiammatorio
in quanto sono i più potenti antinfiammatori che esistono, inoltre
stabilizzano la membrana dei lisosomi, bloccano la fosfolipasi-a,
quindi si può trovare molto spesso in presenza di eccessi di
glicocorticoidi di natura iatrogena (effetti collaterali o complicanze
dovute a trattamenti medici) perché si danno come farmaci
antinfiammatori o immunosoppressori. Questo eccesso di
glicocorticoidi porta quindi ad una soppressione dove sfruttano vari
tipo di sistemi: uno è quello metabolico cioè riducendo la sintesi
proteica che comporta una riduzione della funzionalità cellulare, l’altro
sistema è quello di attivare direttamente la apoptosi attraverso la via
mitocondriale tramite la via della caspasi-9 e inducono la liberazione
di fattori pro-apoptotici, tra i fattori abbiamo BAX che si lega al
mitocondrio che libera Citocromo-C che attiva la caspasi e a questo
punto si ha una doppia azione: una al livello delle proteine quindi la
cellula va incontro a rigonfiamento, l’altra si ha il danno al DNA
mediato dalle endonucleasi.
La secrezione dei glicocorticoidi è data da fattori di stress che
inducono la liberazione di CRH che stimola la secrezione di ACTH da
parte dell’ipofisi la quale stimola la corticale del surrene che attraverso
ACTH regola specificamente la secrezione di androgeni surrenalici,
sia soprattutto del cortisolo che è più importante dei glicocorticoidi che
è detto il cosiddetto ormone guida e cioè la cui concentrazione regola
negativamente attraverso il feedback sia con loop breve che con loop
lungo la secrezione di CRH e ACTH in altre parole quando i livelli si
incominciano ad alzare viene bloccata la secrezione di ACTH e viene
impedita un ulteriore secrezione di cortisolo perché la secrezione di
cortisolo agisce su molti organi bersaglio (fegato, grasso, muscoli,
linfociti, etc…).
La funzione dei glicocorticoidi è quello di mantenere alto i livelli di
glucosio, anche a digiuno, sorge spontaneo pensare al Glucagone ma
la sua azione è più rapida e violenta rispetto i glicocorticoidi che
scaricato da www.sunhope.it
21
scaricato da www.sunhope.it
mantengono un livello tonico della glicemia relativamente alto. I livelli
di glucosio i glicocorticoidi non lo fanno attivando la demolizione del
glicogeno (glicolisi) ma lo fanno stimolando la gliconeogenesi a spese
di grassi ma soprattutto degli aminoacidi, convertendo questo
composti di natura glicidica fanno in modo che il livello di glucosio
venga mantenuto piuttosto alto, funzione più caratterizzata. Per fare
questo devono indurre la mobilitazione degli aminoacidi all’interno di
tessuti non epatici quindi inducendo la proteolisi (breakdown) delle
proteine, inibisce l’uptake cioè il rifornimento del tessuto adiposo in
quanto la sua funzione è di mantenere la glicemia alta e non di
indirizzare le sostanze nei tessuti di deposito, stimola la lipolisi nel
tessuto adiposo fatto molto strano infatti se osserviamo soggetti che
assumono molto cortisone si nota che presentano zone
maggiormente “tonde” come si osserva nella Sindrome di Cushing
dove c’è una distribuzione particolare dell’adipe cioè effettivamente al
livello del tessuto adiposo avviene una lipolisi perché questi grassi
vengono utilizzali a livello muscolare e il glicerolo viene riconvertito a
glucosio però siccome il livello di glicemia medio è alto questo viene
riutilizzato a livello di alcuni particolari distretti, situazione non molto
diversa dal diabete di tipo 2 (chiamato anche diabete mellito non
insulino-dipendente) quindi l’effetto è un effetto post assorbitivo.
Quindi riassumendo il glucosio venendo essenzialmente dal fegato
ma avviene anche il riciclo la riutilizzazione di basi che derivano da
altri tessuti come tessuto adiposo l’idrolisi dei triacilgriceroli che porta
a glicerolo che poi viene convertito a glucosio e acidi grassi che
servono come riserva di energia a livello di tutti i tessuti, così come al
livello del muscolo il breakdown delle proteine porta alla liberazione di
aminoacidi che a livello del fegato vengono riconvertiti a glucosio, il
glicogeno anch’esso viene utilizzato ma in misura minore. Tutto
questo il fegato altro non fa che raccogliere questi composti e
trasformarli in glucosio che poi verrà immesso nella circolazione e
questo è il motivo per cui i glicocorticoidi mantengono elevato un
livello tonico piuttosto elevato di glucosio. L’effetto più diretto, con la
somministrazione dei glicocorticoidi è l’innalzamento della glicemia,
quindi evitare di somministrare glicocorticoidi ad un diabetico.
Non sono solo gli effetti sul metabolismo glicidico, in effetti una delle
scaricato da www.sunhope.it
22
scaricato da www.sunhope.it
cause che molto spesso, con un eccesso di livelli di glicocorticoidi,
come la Sindrome di Cushing che è caratterizzata da una iper
funzione delle ghiandole surrenaliche non é così comune, mentre
invece si può trovare più spesso una disfunzione da
Ipercorticosurrenalismo di tipo iatrogena dovuta da una
somministrazione di glicocorticoidi.
I glicocorticoidi vengono usati soprattutto per altri effetti tipici come
l’effetto del controllo della maturazione del Surfattante, sostanza che
consente di tenere elevata la tensione superficiale degli alveoli
polmonari, se non avessimo il surfattante, durante l’espirazione gli
alveoli collasserebbero, gli alveoli si chiuderebbero, ed il polmone si
epatizerebbe. Invece, grazie alla presenza del surfattante si ha la
normale respirazione. Il surfattante matura durante la 30/32 esima
settimana, una volta se si nasceva verso l’ottavo mese si rischiava di
andare incontro ad una affezione grave chiamata malattia delle
membrane ialine caratterizzata dall’assenza di surfattante e
collabimento di alcuni alveoli ed il neonato andava in asfissia, oggi si
somministra surfattante sintetico ed il neonato sopravvive. Tutta
questa premessa per arrivare a dire che il surfattante è controllato dai
glicocorticoidi (cortisolo). Topi “knock-out” per il gene CRH muoiono
subito dopo la nascita per deficiente funzione polmonare, questo è
dovuto perché non sintetizzano più glicocorticoidi. Non è il solo effetto
dei glicocorticoidi ma possono avere anche effetti indesiderati ad
esempio se si prende un cortisonico di sintesi come Urbason,
troveremo che nel bugiardino ci sono effetti collaterali sul sistema
osseo proprio perché, i glicocorticoidi hanno un azione sul sistema
osseo e soprattutto induce l’osteoporosi, questo perché per una serie
di effetti e cioè: in primis compromettono l’assorbimento del calcio al
livello del sistema gastrointestinale, poi determinano altre alterazioni
ormonali che concorrono all’aumento della produzione di
paratormone, ritardano la riparazione delle ferite legato a diversi fattori
come l’immobilizzazione delle cellule che dovrebbero convergere sul
sito di riparazione della ferita, quindi fibroblasti e cellule di origine
mesenchimale e in parte per il blocco della sintesi proteica come il
collagene.
Un altro effetto è sulle cellule, come ad esempio nelle avvertenze
scaricato da www.sunhope.it
23
scaricato da www.sunhope.it
delle pomate composta da corticosterioidi si trova scritto che non
bisogna mai usare questo tipo di pomata se si sospetta ci sia un
infezione di tipo suppurativa, o se il soggetto ha la tubercolosi oppure
se ci sono delle lesioni particolarmente estese questo perché i
glicocorticoidi inducono paralisi delle cellule della linea bianca del
sangue come i linfociti dove su questi inducono apoptosi e inibizione
della secrezione di citochine come ad esempio la IL-2 non vene
prodotta da parte dei linfociti T per cui i linfociti B non sono più ingordo
di produrre adeguatamente immunoglobuline. Al livello di monociti,
precursori dei macrofagi, si ha apoptosi e inibizione della secrezione
di citochine monocitarie. Anche a livello dei granulociti si ha una
apoptosi massiccia, soprattutto di quelli maturi e una inibizione della
chemiotassi.
Quindi
un
aumentata
concentrazione
di
glicocorticosteroidi influenza molto stadi tipo antinfiammatorio e
immunosoppressori.
Tornando all’osso sono vari i motivi che determinano l’osteoporosi da
corticosteroidi perché innanzitutto determinano il bloccano della
sintesi proteica quindi blocco della matrice che successivamente verrà
ossificata dopo di che determinano l’apoptosi delle cellule
mesenchimali quali fibroblasti precursori degli osteoblasti. Poi
abbiamo effetti di concorrenza ormonale come una riduzione di livelli
di estrogeni, una riduzione del testosterone e degli androgeni
surrenalici. Al livello dello apparato gastrointestinale determinano una
riduzione dell’assorbimento del calcio e quindi un aumento
dell’escrezione urinaria di calcio, quindi basso livello di calcio stimola
la sintesi di PTH il quale stimola l’attività di osteoclasti e quindi di
riassorbimento. In poche parole un aumentato riassorbimento,
riduzione dei progenitori ossei, riduzione dell’ossificazione, riduzione
del calcio si ha Osteoporosi.
In effetti l’osso è in un equilibrio dinamico tra rigenerazione e
riassorbimento, tutto quello che fanno i glicocorticosteroidi è spostare
l’equilibro verso più il riassorbimento inibendo la rigenerazione che è
soprattutto bloccata per effetto dei glicocorticoidi mentre il
riassorbimento è soprattutto stimolato dal iperparatiroidismo
secondario alla carenza di calcio e alla ridotta funzionalità di
androgeni ed estrogeni che normalmente proteggono l’osso.
scaricato da www.sunhope.it
24
scaricato da www.sunhope.it
Quando questo equilibro si spezza si può avere una condizione di
ipersecrezione o una situazione di iposecrezione.
Nell’ipersecrezione si parla di malattia o di sindrome (differenza tra
sindrome e malattia è che la sindrome è un complesso di
segni/alterazioni di cui non è possibile sempre ricostruire un percorso
causale. Nella malattia si ha invece una concatenazione di eventi
casualmente connessi che portano all’alterazione funzionale) di
Cushing sarà caratterizzata da un eccesso di glicocorticoidi ma non
ha un origine caratterizzata, in effetti è presente nella maggior parte
dei casi un tumore della corticale del surrene, invece malattia di
Cushing è diventato sinonimo di Cushing secondario dove si ha un
adenoma ipofisario che produce più ACTH che stimola la corticale
producendo l’aumento di glicocorticoidi, infatti è causata da un
eccesso di CRH, ACTH, tumori surrenalici o tumori ectopici secernenti
ACTH, 80% delle malattie sono legate a problemi ipofisari.
Nell’iposecrezione è
presente
un deficit della funzione
corticosurrenale che può essere anche in questo caso primario o
secondario però per avere dei sintomi apprezzabili bisogna avere una
riduzione dell’attività della corticale del surrene nel 90%.
La malattia di Addison (ipofunzione) che è piuttosto rara, dove la
distinguiamo in sindrome (primaria) o malattia (secondaria). Nella
primaria, come ad esempio una volta la Tubercolosi si pensava che
sia una malattia polmonare, ma in genere è una malattia che comincia
dai reni e poi passava al surrene dove andava ad intaccare le ossa,
parliamo di tubercolosi molto complicata che nel mondo occidentale
se ne vedono pochi. Un'altra sindrome è quella di Waterhouse–
Friderichsen che si presenta come una setticemia acuta provocata da
un infezione da meningococco che causa una coagulazione
intravasale disseminata che posta alla necrosi della corticale del
surrene. Invece molto più diffuse sono le sindromi autoimmuni.
Fino a 50 anni fa la causa più comune era la tubercolosi, mentre
invece è attualmente di origine autoimmuni, come la sindrome
polighiandolare autoimmune che è associata la disfunzione di altre
ghiandole come l’ipotiroidismo primitivo. Poi abbiamo un'altra
sindrome che forse è più comune che è la sindrome di Schmidt in cui
è presente un’associazione con altre malattie endocrine autoimmuni
scaricato da www.sunhope.it
25
scaricato da www.sunhope.it
tipo il diabete di tipo 1, tireopatie autoimmuni come quella di
Hashimoto, celiachia e altre affezioni non endocrine.
Quando mancano i glicocorticoidi ci troveremo su di un soggetto che
mostra ipoglicemia, ipotensione, astenia ma a volte anche segni
neuronali come il vomito, tremore, letargia, depressione. I
glicocorticoidi sono essenziali soprattutto per il mantenimento della
glicemia, in oltre soprattutto nelle forme primarie vi è sempre
un’associazione con la disfunzione della parte glomerulare con deficit
di aldosterone e quindi mostra una perdita di sodio determinando
ipotensione questo è utile da sapere perché nella malattia primaria di
Addison uno dei segni caratteristici è una iposecrezione
contemporanea sia del cortisolo che di mineralcorticoidi in quanto è
difficile avere una sola carenza dei due ormoni, invece i livelli di ACTH
saranno moto elevati perché i livelli bassi di glicocorticoidi fa salire
ACTH. Mentre nella forma secondaria i livelli ACTH, che controlla solo
gli ormoni surrenalici, cortisolo, si osservano: bassi livelli di cortisolo,
bassi livelli di ACTH e mineralcorticoidi quasi nella normalità. Nella
maggior parte dei casi si avranno dei casi secondari.
Un segno di Addison lo possiamo vedere sulla mano dove il palmo
della mano è chiaro e il dorso scuro proprio perché c’è un eccesso di
ACTH e di melanocortina e quindi di MSH detto anche morbo
bronzino, da non confondere con diabete bronzino che è la malattia di
Cushing che è l’opposto. Un'altra caratteristica nel paziente con
Addison è che si pigmentano i segni dermatoglifi (segni situati sui
polpastrelli delle dita che formano le impronte digitali) di nero cioè si
raccoglie la melanina.
Una patologia invece molto diffusa è un eccesso di glicocorticoidi che
sono stati somministrati per natura iatrogena, oppure da un
incremento da ormoni circolanti di origine esogena, tumori
corticosurrenalici ipersecernenti, iperplasia surrenale bilaterale (per lo
più da malattie trasmesse), aumentate secrezione di ACTH (80%),
adenoma ipofisario (65%). Un'altra cosa che può capitare è la
produzione di ACTH ectopico cioè da tessuto che non produce
normalmente ATCH, molti tumori come ad esempio i tumori
polmonari. Solo del 20% dei casi sono ACTH indipendenti e posso
essere legati o all’adenoma surrenalico o al carcinoma surrenalico,
scaricato da www.sunhope.it
26
scaricato da www.sunhope.it
iperplasia nodulare delle surrenali.
Il soggetto ipercorticosurrenalico (sindrome di Cushing) appare con
una distribuzione del grasso, per via di una cura di ipercortisonica,
ovunque, un aspetto sferico con grasso localizzato sulla pancia,
presenta strie rubre, faccia a luna piena, esagerato catabolismo
proteico, assottigliamento della cute e degli annessi, tendenza a
formare ecchimosi e rallentata riparazione delle ferite, diabete mellito
insulino resistente e ipertensione arteriosa. Questi casi sono dovuti,
come ad esempio il più complicato è la distribuzione del grasso
perché ci si aspetta un accentuata lipolisi quindi il soggetto ce lo
aspettiamo magro, questo è dovuto al fatto che: vi è una lipolisi al
livello dei depositi però l’elevata glicemia fa in modo che ci sia un
turnover nelle zone di grasso intenso. Le strie rubre, soprattutto
sull’addome basso che somigliano molto alle smagliature con la
differenza che la smagliatura (stria distanze) si presenta biancastra,
come avviene durante il parto, nel caso della malattia di Cushing le
strie rubre sono dovute al fatto che la debolezza del connettivo fa in
modo che ci siano delle micro emorragie e con la scarsa riparazione
dei tessuti fa in modo che ci sia una riduzione della riparazione e
quindi appaiono rosse. La faccia a forma di luna sempre per la
ridistribuzione del grasso in modo tipica, ma pure si può avere una
distribuzione sul gibbo o gobbo di bufalo e la bolla di Bichat (tessuto
adiposo contenuto tra il muscolo massetere ed il muscolo
buccinatore). Inoltre, come detto, anche un esagerato metabolismo
proteico che si riflette sul assottigliamento della cute ed annessi
cutanei. Anche tendenza a formare ecchimosi (ad esempio con un
semplice test si può valutare questa malattia, si mette una piccola
striscetta di scotch sulla pelle e poi tirarlo velocemente, si nota un
eccesso di capillari rotti quindi la zona diventerà viola). Ipertensione
arteriosa è dovuta in parte al fatto che ci può essere una
concomitante secrezione di aldosterone. Come detto la causa più
frequente è rappresentata da una iperfunzione della ipofisi come ad
esempio in presenta di un adenoma ipofisario.
Riassumendo in caso di carenza ipoglicemia, astenia, mentre i segni
da eccesso sono molto più complicati, infatti come abbiamo visto, si
ha una ridistribuzione del grasso, sono presenti la strie rubre dovuta
scaricato da www.sunhope.it
27
scaricato da www.sunhope.it
da scarsa sintesi di proteine, la paralisi delle cellule che rispondono ai
fenomeni infiammatori e autoimmuni (immunità normale repressa).
scaricato da www.sunhope.it
28
scaricato da www.sunhope.it
Migliaccio 1.4 (Giovedì 27 Ottobre 2011)
Mineralcorticoidi Aldosterone e Gonadi
Chiariamo dall’inizio che i mineralcorticoidi sono regolati dalla Renina
Angiotensina Aldosterone e non regolati dal asse Ipotalamo Ipofisario,
quindi dalla ACTH!!!
Mineralcorticoidi sono ormoni molto importanti per il controllo per il
riassorbimento minerale, soprattutto di Sodio (Na) il cui assorbimento
viene controllato dall’aldosterone che è al termine di una catena di
controllo che comincia con la renina che promuove il riassorbimento
del sodio.
I fattori che controllano la secrezione di aldosterone sono alti livelli di
Potassio (K) che stimolano la secrezione di renina e di conseguenza
di aldosterone, il sistema Renina Angiotensina che è l’asse portante
che regola la secrezione dell’ormone, bassi livelli di Sodio nel sangue
e come ultima conseguenza nell’ultrafiltrato (nel glomerulo dov'è
presente la pre-urina) come conseguenza.
L’ACTH in questa funzione sostanzialmente fa poco e niente, non che
faccia poco e niente sul riassorbimento in generale del sodio perché
come menzionato ci sono dei composti intermedi nella via di sintesi
del cortisolo che hanno un’attività “mimetica” e quindi anche ACTH
alla fine finisce con il riassorbimento di sodio, però in genere ACTH
non ha un ruolo diretto nel controllo nella secrezione di aldosterone.
L’aldosterone il quale svolge la sua funzione più importate nel
riassorbimento del sodio al livello della parte distale del neurone cioè
nell’ultima parte dell’ansa di Henle (dove sono presenti anche altri
fattori) tutto questo è alla base del sistema Renina Angiotensina che
inizia a livello renale.
Tutto questo comincia dalla stimolazione da un fattore che, secreto
dal rene e precisamente dalle cellule iuxtaglomerulari del rene che
secernano Renina che agisce sull’angiotensinogeno (grossa proteina
sintetizzata dal fegato e poi presente nel sangue) la quale renina
agisce con azione di proteolisi sull’angiotensinogeno estraendo dei
peptici attivi che corrispondo all’Angiotensina I la quale viene
convertita in Angiotensina II (potentissimo vasocostrittore) ma che
scaricato da www.sunhope.it
29
scaricato da www.sunhope.it
soprattutto agisce al livello delle cellule della glomerulare del surrene
esattamente su dei recettori con attività tirosin-chinasica, una volta
attivato stimolano la secrezione e la conversione dei precursori del
aldosterone che viene secreto determinando un aumento di
riassorbimento di sodio, ricordiamo che il sodio serve da guida per il
riassorbimento dei fluidi grazie alla sua capacità osmotica, con
conseguente espansione della massa plasmatica. In altre parole un
aumento potenziale della pressione arteriosa. L’aldosterone
sostanzialmente è un ormone che serve a mantenere la pressione
adeguata, soprattutto controllando il riassorbimento del sodio che è il
risultato finale.
Il realtà all’origine il sistema di regolazione della secrezione di renina
e quindi di aldosterone è soprattutto di natura elettrochimica. Il
sistema che produce la renina risiede dell’apparato iuxtaglomerulare
che è formato da due tipi di cellule: Cellule della Macula Densa e le
Cellule Iuxtaglomerulari. Le iuxtaglomerulari sono cellule che si
trovano in corrispondenza delle arteriole afferenti al glomerulo, quindi
guardano il sangue. Mentre le cellule della macula densa sono
funzionalmente distanti perché si trovano in un frammento di un
segmento distale del nefrone al livello del convoluto distale o meglio,
nel estremo distale della branca ascendete dell’ansa di Henle, quindi
guardano verso l’ultrafiltrato (preurina). Sostanzialmente sono molto
distanti però per un gioco anatomico si trovano molto vicine, per cui
interagiscono non solo funzionalmente ma proprio materialmente.
Quando la pressione scende ci sono vari stimoli che attivano la
secrezione di renina come ad esempio si ha un attivazione del
sistema nervoso simpatico e contestualmente l’attivazione dei
cosiddetti barocettori intrarenali che risiedono nell’apparato
iuxtaglomerulare. Poi c’è un effetto molto importante che è alla base
dell’attivazione di renina, le cellule della macula densa che è
sensibile, non tanto di natura fisica o meccanica come le cellule
iuxtaglomerulari, soprattutto a segnali di natura elettrochimica in
poche parole alla concentrazione di soluti come il Cloruro di sodio
(NaCl) e in modo particolare al sodio. Ma le cellule che secernano
attivamente la renina sono le cellule dell’apparato iuxtaglomerulare.
Quindi abbiamo due tipi di stimoli: stimoli meccanici che fa scendere
scaricato da www.sunhope.it
30
scaricato da www.sunhope.it
la pressione stimolando le cellule iuxtaglomerulari e
la
concentrazione che scende al livello del ultrafiltrato che induce la
secrezione della renina sempre dall’apparato iuxtaglomerulare ma
mediante la mediazione della cellule della macula densa le quali sono
sensibili a stimoli soprattutto di tipo elettrochimico, mediante la
percezione di soluti di sodio e cloro al livello dell’utrafiltrato del fluido
tubulare. La riduzione della concentrazione e quindi anche di urina
influisce la secrezione della renina e questo lo fa mediante la velocità
di filtrazione con cui l’urina passa, infatti nella branca ascendente
dell’ansa di Henle vi è una velocità costante se si ha un rallentamento
si avrà una maggiore concentrazione di sodio che viene riassorbito
per cui quando alla fine della branca ascendete dell’ansa di Henle la
concentrazione è più bassa ed è questo lo stimolo più lontano. Quindi
bassa velocità di filtrazione causa over riassorbimento del sodio nella
branca ascendente, bassa concentrazione di sodio nel tubulo distale
induce il rilascio di renina da parte delle cellule dell’apparato
iuxtaglomerulare, quindi sono le cellule della macula densa che
comunicano con le cellule dell’apparato iuxtaglomerulare inducendo la
liberazione di renina che agisce sull’angiotensinogeno che viene
convertito in angiotensina I questa a sua volta convertita in
angiotensina II che oltre ad essere un vasocostrittore induce il rilascio
di aldosterone che stimola il riassorbimento del sodio. Di
conseguenza si ripristina il livello di sodio e di liquido e la pressione
che eventualmente era scesa per effetto della iposodemia viene
ripristinata ai livelli normali.
Gli organi che partecipano a questo sistema sono il Fegato che
secerne l’angiotensinogeno, il Rene che secerne la renina che altro
non è un banale enzima proteolitico che scinde una serinoproteasi
cioè scinde l’angiotensinogeno in componenti attivi (angiotensina I e II
mediante ACE).
Il meccanismo dell'aldosterone, come tutti gli steroidi, ha un’azione
essenzialmente rivolta al controllo della trascrizione cioè controllare
l’espressione di proteine specifiche coinvolte nella sua funzione. Nel
caso specifico sono stati identificati un meccanismo RAS dipendente
controllato che insiste sulla pompa del sodio al livello del polo
vascolare, inoltre, invece esistono una serie di proteine come la
scaricato da www.sunhope.it
31
scaricato da www.sunhope.it
permeasi (proteine di trasporto) che facilitano il trasporto contro
gradiente del sodio all’interno della cellula, l’azione dell’aldosterone
consiste essenzialmente nello stimolare l’espressone di questa
proteina e nell’attivare il meccanismo di pompa favorendo il
riassorbimento del sodio nei tubuli distali e parte nei tubuli collettori.
Quando questo sistema non funziona ecco che avremo l’ipertensione
che coinvolge anche la renina e il sistema che la controlla, ma
badiamo bene non sempre l’ipertensione si ha per un alterazione di
questo asse anzi non sono quasi mai primarie infatti le ipertensioni
endocrine sono molto rare, quello che avviene è che questo sistema è
stimolato e “insultato” da una serie di condizioni che possono portare
ad un’ipersecrezione di aldosterone e ad un riassorbimento anomalo
del sodio.
Le patologie, come sempre nelle ghiandole, c’è un’Ipersecrezione e
un’Iposecrezione. Ipersecrezione comprende due importanti
condizioni che sono iperaldosteronismo primario come la sindrome di
Conn che è un ipersecrezione primaria della corticale del surrene
dovuta limitata all’aria glomerulare e legata a microadenomi o grandi
adenomi e quanto determina un eccesso di aldosterone, e un
iperaldosteronismo secondario dovute da alterazioni sistema reninaangiotensina dovuta da arteriosclerosi delle arterie renali, dovuto da
cirrosi epatica, scompenso cardiaco, sindrome nefrosica, stenosi
arteria renale, insufficienze di vario genere, determinando ritenzione
di sodio e ipertensione, in questo caso la secrezione dell’aldosterone
è conseguente per l’eccessiva secrezione di renina. Ad esempio un
cirrotico o uno scompensato, uno con sindrome nefrosica può avere
un’aumentata secrezione di renina tale da determinare a valle una
secrezione di aldosterone questo è dovuto da una sindrome del Terzo
spazio dove avviene un sequestro di liquidi, nel cirrotico si forma
l’iponchia (diminuzione pressione oncotica del sangue), in dei distretti
per cui su ha una percezione di ridotto volume del plasma e quindi
una iperconcentrazione di soluti che induce la liberazione di renina,
infatti nei cirrotici si usa terapia con spironolattone (aldactone) proprio
perché si cerca di ridurre la possibilità di riassorbimento di sodio che
non fa aumentare la pressione ma va ad aumentare i liquidi
sequestrai nei punti in cui è presente.
scaricato da www.sunhope.it
32
scaricato da www.sunhope.it
Per quanto riguarda i sintomi possiamo avere ipertensione saltuaria
data da “pulse secretive” dell’aldosterone, ipocalemia, cefalea,
astenia, nocturia (si ci alza molto spesso la notte per urinare). Sulle
analisi di laboratorio sarà presente ipocalemia, livelli di renina non
sono significativamente alterati o bassi, livelli di potassio sono alti
nelle urine e l’aldosterone è quello che sostanzialmente sarà alterato
tutte condizioni che sono sensibili allo spironolattone.
Il motivo sostanziale per cui studiamo l’aldosterone è il rapporto intimo
che esiste tra pressione arteriosa renina e aldosterone anche se le
alterazioni endocrine sono rare in realtà è sempre alla base
un’alterazione del sistema renina angiotensina aldosterone che mi
porta alterazioni della pressione arteriosa.
La relazione che può esistere tra renina aldosterone pressione
arteriosa, possiamo avere quattro condizioni: bassa renina, basso
aldosterone, alta renina, alto aldosterone. In una condizione dove
avremo poca renina e poco aldosterone non ripresenta pressione alta
ma è presente una condizione di ipotensione permanente e queste
condizioni si possono avere in genere per lesioni dei parenchimi renali
che portano alle alterazioni del parenchima secernente della renina
oppure causata da farmaci. Un’altra condizione che si può osservare
è un’alta renina e basso aldosterone è conseguente proprio per i
bassi livelli di aldosterone detto anche ipoaldosteronismo primario
dove si osserverà una pressione bassa ma non sempre
vertiginosamente bassa perché essendoci una forte produzione di
angiotensina II, forte vasocostrittore, si osserverà un livello di
pressione alta non dovuta dall’espansione della massa plasmatica ma
piuttosto per le resistenze periferiche, però vi è una pressione bassa
apprezzabile. Nel caso di alto aldosterone e bassa renina, si osserva
la renina bassa perché è alto l’aldosterone per la sindrome di Conn
caratterizzata in genere da bassa renina e alto aldosterone o in
genere per un deficit di sintesi di mineralcorticoidi, difetto
dell’organogenesi, disturbi congeniti degli enzimi che presiedono alla
sintesi dell’aldosterone, lo pseudo iperaldosteronismo, iper secrezione
di cortisolo in alcune condizioni, tumori surrenalici.
In sintesi l’elemento che più regola positivamente la pressione e
l’espansione della massa plasmatica è l’aldosterone.
scaricato da www.sunhope.it
33
scaricato da www.sunhope.it
Altre condizioni che ci possono essere, come ad esempio
l’ipertensione a bassa renina, intossicazione di liquirizia.
Poi abbiamo la condizione di alta renina e alto aldosterone dove si
osserva una condizione piuttosto strana in quando se si osservano
entrambi questi due fatto alti pur essendo la renina a guidare le
variazioni perché come sappiamo se vi è alta renina si osserva alto
aldosterone che fa riassorbire e l’alta pressione dovrebbe inibire la
neo secrezione di renina ma questo non succede perché vi sono
alcune condizioni estremamente spiacevoli che possono portare ad
una ipertensione molto evidente come l’ipertensione maligna detta
anche sindrome di Laragh (Laraf) sindrome dovuta da una
nefroangiosclerosi dove si ha un irrigidimento delle arterie dovuta da
un non corretto funzionamento dei barocettori simpatici
iuxtaglomerulai, inoltre visto che è presente questo gioco di
rallentamento dei flussi si ha un aumento di un riassorbimento di
sodio anche in presenza di un’ipertensione sistemica cioè in poche
parole c’è una pressione periferica però sistemica, mentre invece al
livello del rene laddove dovrebbe esistere il livello di percezione della
pressione e concentrazione di sodio non c’è questa stessa condizione
cioè gli organi sensori non rispondono, questa sindrome Laragh
raggiunge una pressione di 280/300 con conseguente, aterosclerosi,
aneurismi, edema, danno celebrale fino morte del soggetto.
Altre condizioni che si possono avere sono renina e aldosterone alto
ma senza ipertensione che sono tutte quelle condizioni riconducibili a
terzo spazio, cirrosi, sindrome nefrosica, scompenso cardiaco.
Come menzionato per quanto riguarda l’intossicazione da liquirizia
che è dovuta dal fatto che i recettori dei mineralcorticoidi è un
recettore che ha molta affinità con l’aldosterone ma anche con altri
corticosurrenalici come il cortisolo però al livello delle cellule renali
esiste un enzima 11-β.idrossi-steroido-deidrogenasi che elimina il
cortisolo e lo trasforma in cortisone il quale non ha affinità con i
recettori dei mineralcorticoidi, la liquirizia altro non fa che inibire
questo enzima per cui si hanno quantità notevoli di cortisolo al livello
delle cellule renali che si legano al recettore dei mineralcorticoidi ed
emulano l’azione del aldosterone. E’ inutile dire che nel
ipercortisonemia questi è uno dei motivi per cui anche quando il
scaricato da www.sunhope.it
34
scaricato da www.sunhope.it
cortisolo è alto ci può essere ipertensione e ritenzione di sodio, uno
dei motivi è proprio che il cortisolo presenta una discreta affinità
anche per i recettori dei mineralcorticoidi per cui se l’eccesso è tale da
accedere alla capacità catalitica della 11-β-idrossi-steroidodeidrogenasi si ha comunque questo segno.
Le Gonadi sono fortemente differenziate in funzione del sesso,
testicoli per il sesso maschie e ovaie per il sesso femminile.
In tutte e due le gonadi coesistono due funzioni: la funzione
gametogenetica cioè la produzione di cellule apolidi destinata
all’accoppiamento e alla riproduzione, e una funzione endocrina dove
vengono prodotti degli ormoni che dovrebbero assicurare un corretto
funzionamento della gonade, ma in realtà, ci sono altre funzioni. Ad
esempio l’estradiolo, in natura non esistono malattie caratterizzate
dalla assenza del recettore dell’estradiolo (recettore degli estrogeni è
stato scoperto proprio alla Federico secondo più di 30 anni e tutt’oggi
si continua a studiare), infatti anni fa fu fatto uno studio condotto su
Topi “knock-out” per il recettore dell’estradiolo si è osservato che non
presentavano l’utero ma vivevano, quindi l’assenza del recettore per
l’estradiolo è compatibile per la vita quindi alla base esistono altri
motivi magari di tipo genetico.
L’Estradiolo è sempre stato ritenuto necessario per garantire la
sopravvivenza e lo sviluppo del feto in utero, quindi ha sicuramente
una funzione importante non solo per la differenziazione dei caratteri
sessuali ma proprio come fattore di crescita ed è un fattore di crescita
a tutti gli effetti.
Il Progesterone invece è utile soprattutto importante per la gravidanza.
Il Testosterone è importante sopratutto per la differenziazione, in
quanto è un fattore di crescita ma agisce in un ambito più limitato
soprattutto determina la differenziazione ma fa anche cose strane
come far muovere i fibroblasti. Il sistema nervoso esprime molti
recettori per il testosterone ad esempio ci sono cellule chiamate
feocromocitoma o Pc12 che esprimono recettori per gli androgeni ma
non per gli estrogeni, ad esempio, si è notato che ci sono più maschi
artistici che femmine artistiche, questo perché, forse, l’ormone riesce
a modificare lo sviluppo, probabilmente favorendo alcune funzioni dei
neuroni. Ad esempio il cervello maschio predilige le funzioni
scaricato da www.sunhope.it
35
scaricato da www.sunhope.it
associative ad altro tipo di funzione e questo potrebbe essere uno dei
motivi questo tipo di degenerazioni psichiche.
Oltre agli ormoni sessuali ci sono gli ormoni peptidici che sono
l’inibina e ormone antimulleriano che fa regredire i dotti di Muller ed è
un ormone che serve soprattutto alla differenziazione maschile perché
inibendo i dotti di Muller si sviluppano i dotti di Wolff e quindi si
differenzia in senso maschile il fenotipo.
Per quanto riguarda la sintesi è la stessa di quella degli steroidi
surrenalici la cosa importante che si arriva sempre per il solito
percorso
colesterolo,
progesterone,
17-idrossi-progesterione,
androstenedione importante nei vari dosaggi ormonali, si arriva ai
composti finali che il più importante è il testosterone e l’incrocio da cui
parte successivamente l’estradiolo che subisce il processo di
aromatizzazione oppure può essere ridotto a diidrotestosterone che
ha un affinità per i recettori androgeni 10 volte di più del testosterone,
vedremo che è molto importante per le sindromi di femminilizzazione
testicolari, mentre la romatasi che è presente nel ovaio trasforma il
testosterone in estradiolo determinando la sintesi di estrogeni grazie
alla 5-α-reduttasi.
Quest’attività è molto più sviluppata nel testicolo e nell’ovaio che nella
corticale del surrene.
Per quanto riguarda al regolazione è sempre riconducibile all’asse
ipotalamo ipofisario in quanto esiste una secrezione di gonadotropine
che inizia nell’infanzia che stimola la produzione di GRH che stimola
la produzione delle gonadotropine ipofisarie, l’ipofisi stimola la gonade
che produce testosterone nel maschio ed estradiolo nella femmina. Il
Feedback è negativo a loop breve a loop lungo però con una
differenza l’estradiolo unico caso può in una circostanza e cioè nel
picco ovulatorio svolgere un ruolo di feedback positivo sulla
secrezione di FSH e LH per il resto il feedback è sempre negativo. Alti
ormoni che sono presenti ad esempio le inibine che hanno un’azione
di inibizione soprattutto espressa a livello del ipofisi infatti quando
viene prodotta inibina al livello delle gonadi va ad inibire la sensibilità
dell’ipofisi al GRH.
L’ovaio è un organo doppio relativamente piccolo che contiene uno
stroma di natura connettivale all’interno della quale è presente il
scaricato da www.sunhope.it
36
scaricato da www.sunhope.it
parenchima secernente, attivo, che è rappresentato sostanzialmente
dai follicoli ovarici, quali follicoli sono presenti in quantità
numerosissima, ma al contrario degli spermatozoi che si riproducono
continuamente, la donna nasce con un patrimonio di circa due milioni
di ovocita contenuti nei follicoli primari che dal momento della nascita
in poi questo patrimonio si ridurranno progressivamente fino ad
arrivare alla menopausa dove saranno pochi e dove i follicoli non
svolgeranno più una funzione di ovulazione ma avranno una funzione
ormonosintetica.
Lo stroma e i follicoli ovarici a loro volta sono formati da due strati di
cellule quali le cellule della granulosa interne e le cellule della teca più
esterne che producono testosterone e estrogeno sotto effetto delle
gonadotropine che agiscono sia per promuovere il progresso
dell’ovulazione, quindi sviluppare l’ovulo ma anche vengono secreti
nel sangue e servono per lo sviluppo di diversi tessuti, alcuni
direttamente connessi con le funzioni dell’ovaio (tube di falloppio,
utero, vagina, mammelle, ipotalamo, ipofisi, vasi, reni, ossa, cervello,
sistema nervoso).
Lo sviluppo dell’ovaio e quindi del follicolo ovarico cioè la parte
secernete è un processo che dura tutta la vita con una maturazione e
una differenziazione molto complessa.
I follicoli si presentano primordiali e follicoli primari, follicolo
primordiale è costituito dal ovogonio che è separato da un singolo
strato di cellule della granulosa attraverso la membrana basale, il
follicolo primario è differente perché comincia a comparire la zona
pellucida e l’epitelio che circonda l’ovocita sono circondati da uno
strato di cellule. Questa condizione dura per tutta l’infanzia fino alla
adolescenza fino al menarca perché c’è una secrezione tonica di
fattori di rilascio ipotalamici che comincia già dalla nascita, anzi alla
nascita si osserva un fenomeno strano dove si osservano molti
ormoni sessuali che sono serviti allo sviluppo del feto e che
mantengono molto bassi i livelli gonadotropine e di fattori ipotalamici,
dopodichè i fattori ipotalamici salgono le gonadotropine non tanto
perché sono molto sensibili all’azione inibitoria di quelle
concentrazioni se bene bassissime di ormoni sessuali che sono
presenti nel bambino o bambina fino allo sviluppo dei caratteri
scaricato da www.sunhope.it
37
scaricato da www.sunhope.it
sessuali. Con la pubertà invece incomincia ad esserci un fenomeno
che sostanzialmente comporta una disinibizione dell’ipofisi all’azione
degli ormoni bersaglio per cui l’ipofisi comincia a secernere con eventi
secretori pulsatili sempre più frequenti (ogni 20,30, 40 minuti) per cui
si ha una iperstimolazione della gonade che promuove una selezione
di alcuni follicoli presenti, oggi ancora ignoto il perché questa
selezione, però si è notato che questa selezione avviene su quei
follicoli più grandi, a quanto punto l’ormone aumenta di
concentrazione e comincia a determinare lo sviluppo dove il follicolo
primari si trasforma in follicolo secondario dove la differenza più
importante è che compaiono le cellule della teca. La prima parte è
dominata essenzialmente dal FSH (anche molto importante perché
c’è una sindrome molto diffusa nelle donne che si chiama Sindrome di
Stein-Leventhal o ovaio policistico che è dovuto proprio da un deficit
selettivo di FSH che non determina la trasformazione del testosterone
in estradiolo e quindi porta ad una mancata ovulazione) e la seconda
dal LH perché LH nelle cellule della teca determina la sintesi del
testosterone che è fondamentale per determinare la maturazione, lo
sviluppo finale del follicolo perché il testosterone viene trasformato al
livello delle cellule della granulosa in estradiolo determinando un
aumento di estradiolo necessario per la maturazione terminale del
follicolo, per cui alcuni di questi follicoli diventano terziari caratterizzati
da un doppio strato della teca e dalla cavità antrale alla fine uno sono
di questi diventa follicolo Graffiano fino ad “esplodere”, e quando
“esplode” per la prima volta si ha il Menarca (intorno ai 12 anni) e da
questo momento in poi per una quartina di anni ogni mese con una
frequenza costante avremo questi aventi dove un follicolo che matura
ed “esplode” liberando l’ovocita al mese durante l’ovulazione.
Sul ruolo degli estrogeni e la loro funzione, c’è da dire hanno recettori
un po’ ovunque nella cellula e la sua funzione più nota è quella della
trascrizione di varie proteine che svolgono un azione diretta su vari
geni coinvolti nella proliferazione. Oltre a controllare la trascrizione il
recettore degli estrogeni attivano lievi trascrizioni non genomica ad
esempio una è la via di SRC che va a finire su ERK (insulina)
portando un abbassamento di livelli di P27 che è uno degli inibitori del
ciclo cellulare, contemporaneamente attiva Pi3 chinasi che attraverso
scaricato da www.sunhope.it
38
scaricato da www.sunhope.it
AKT stimola l’attività della ciclina D1, probabilmente gli effetti
proliferativi sono mediati da vie non genomiche importante perché ad
esempio ormonodipendenti.
Una serie di effetti di questi ormoni su varie cellule che non sono
cellule dell’apparato riproduttivo ma che probabilmente servono a altre
funzioni che comunque vengono regolate dagli estrogeni. Innanzitutto
gli estrogeni controllano la crescita cellulare, probabilmente
controllano anche la corretta crescita e il corretto sviluppo del feto
durante una parte della gravidanza, a livello dell’osso gli estrogeni
controllano la rigenerazione ossea effetto che risalta durante la
menopausa per effetto della osteoporosi in quanto i livelli di estrogeni
sono molto bassi/assenti. Anche sul sistema vascolare, prima della
menopausa, le donne sono molto protette verso ad esempio l’infarto
(rapporto uomo donna 5:1), ma dopo la menopausa gli accidenti
vascolari sono molto più frequenti anche se non colpiscono le
coronarie ed il cuore ma più incidenti vascolari celebrali come ictus
TIA (attacco transitorio ischemico) etc…
Tutto questo perché gli estrogeni funzionano essenzialmente sul
sistema vascolare sulle cellule endoteliali perché attivano p85 una
subunità di Pi3k e come conseguenza p85 porta un’attività della NOsintetasi potentissimo vasodilatatore. Inoltre fa una serie di cose
benefiche, riduce l’aggregazione piastrinica, riduce l’adesione dei
neutrofili
cioè
fenomeni
infiammatori
che
caratterizzano
l’arterosclerosi, aumenta il profilo lipidico aumentando HDL e ridurre
LDL. Sul sistema nervoso centrale è molto importante sulla
sopravvivenza dei neuroni e sulla microglia al punto che si sta
pensando nell’ alzheimer di aggiungere piccole dosi di estrogeni
perché pare che agisce mediante quelle vie non trascrizionali che ha
un effetto sui neuroni ippocampali e della corteccia e tutto sembra
legato ad una rapida salita del calcio e che porta liberazione di calcio
nel mitocondrio e inibizione di BCR2 che servirebbe ad eliminare
un’azione anti apoptotica e di neuro protezione e inoltre agirebbe su
alcuni mediatori trascrizionali tipo CREB controllando la produzione di
neurofisine e altre molecole che sono importanti per la conservazione
della memoria.
Il concetto è questo che se si deve fare la terapia sostitutiva va
scaricato da www.sunhope.it
39
scaricato da www.sunhope.it
integrata subito dopo la menopausa e non dopo anni, infatti si nota
che gli effetti degenerativi non solo non si riducono ma addirittura
aumentano la proliferazione delle cellule infiammatorie e si
manifestano difetti ancora maggiori.
Stesso discorso vale per il sistema nervoso centrale dove vediamo
che gli estrogeni hanno un’azione protettiva ma essenziale che
vengano somministrate a piccole dosi subito dopo la loro caduta nella
menopausa e non successivamente perché se no si hanno effetti che
sono contrari per la proliferazione di cellule di natura mesenchimale
che possono danneggiare il cervello.
Gli estrogeni e del progesterone sulla mammella. Uno si aspetta che
normalmente la mammella sia sotto il controllo della prolattina ma non
è così, la prolattina serve sostanzialmente a stimolare la produzione
del latte, colostro, in realtà quello che fa progredire la crescita della
mammella sono soprattutto estrogeni e progesterone. L’estradiolo,
possibilmente in presenza del progesterone, fa sviluppare soprattutto
le ramificazioni cioè promuove lo sviluppo dei dotti mammari. Il
progesterone svolge un azione diversa in quanto riesce a far fare un
solo un ciclo cellulare, il resto dei vari cicli cellulari è affidato
all'estrogeno che promuove la crescita, il progesterone la crescita
degli acini della mammella. Poi interviene la prolattina dove, mediante
la caduta dei livelli di estrogeni e progesterone, realizza la montata
latte.
Gli estrogeni sono molto importanti nella progressione dei tumori
ormono dipendenti della mammella che sono controllati
dall’estrogeno.
scaricato da www.sunhope.it
40
scaricato da www.sunhope.it
Migliaccio 1.5 (Lunedì 7 Novembre 2011)
Effetti degli Estrogeni e Progesterone sulla Ghiandola Mammaria, Ovaio e
Testicolo
Esistono due compartimentazione per quanto riguarda gli estrogeni e i
progestinici che agiscono su due settori anatomico/istologico
differenziati e poi c’è la funzione differenziativi della prolattina che
entra in funzione soltanto quando si ha la caduta di estrogeni e
progestinici.
Per quanto riguarda gli ormoni legati ai tumori ormoni dipendenti
come ad esempio il caso degli estrogeni sulla mammella, che
essendo un fattore della crescita, ma come tutti gli altri ormoni, hanno
essenzialmente una funzione regolatrice cioè gli ormoni fanno tante
cose che fanno anche altri fattori come nel caso degli estrogeni,
progestinici, androgeni, fanno proliferare le cellule, quindi ci chiediamo
qual è la funzione che distingue la funzione di uno ormone che stimola
la proliferazione espressa da questi fattori, è proprio quello di impedire
questi fattori agiscono quando non devono agire cioè l’importanza di
un ormone non è tanto quello di fare una determinata cosa condivisa
da molti altri fattori ma di impedire che quegli altri la facciano quando
la deve fare lui, in altre parole l’estrogeno da una parte stimola la
crescita quando la deve stimolare ma impedisce che altri fattori di
crescita subentrino.
Quindi, nel caso degli estrogeni pur essendo un fattore di regolazione
si trasforma in un fattore che promuove la crescita cellulare, ma il
concetto è proprio questo cioè che gli estrogeni, come i progestinici,
sono soprattutto fattori di progressione e non fattori trasformanti cioè
noi non avremo la trasformazione per effetto degli estrogeni della
mammella in tessuto neoplastico. Oppure si hanno dubbi
sull’alterazione sul equilibrio ormonale che possono avere
direttamente un ruolo di trasformazione si ha per esempio per il
carcinoma della prostata che è probabile che gli stessi estrogeni o che
la caduta degli androgeni possa avere un ruolo nello sviluppo di una
patogenesi, ma nel caso del estrogeno sono fattori di progressione
cioè promuovono lo sviluppo del tumore che è stato determinato da
altri fattori trasformanti di natura genotossica. La presenza di un
scaricato da www.sunhope.it
41
scaricato da www.sunhope.it
effetto di controllo da parte dell'estrogeno, anche se in questo caso
solo di proliferazione, può essere utilizzato per la terapia. Ad esempio
il Tamoxifene (norvadex) è il farmaco neoplastico di gran lunga
venduto che esista in quanto è un farmaco molto efficace e che serve
a contrastare la crescita di tumori ormono-dipendenti che ha una
azione antagonista sul recettore dell’estradiolo, ma altri farmaci come
il Faslodex, più moderni del Tamoxifene, e che sono degli inibitori
specifici che competono con l’ormone per il recettore e inibiscono la
crescita rallentando la crescita impedendo all’ormone che è un fattore
promuovente sulla crescita cellulare abbia azione e in questo modo si
riesce a contrastare abbastanza bene l’insorgenza di un principio di
proliferazione tumorale (ma rimuovere un tumore primario è sempre
meglio).
Ma quando decidere che questo tumore è ormono-dipendente?
Andare a verificare se è presente o meno il recettore per l’estrogeno.
Ma la cosa non è così semplice! Oltre a vedere se o meno presente
quel tipo di recettore, mediante degli anticorpi specifici o se è
presente il recettore deve funzionare, perché ci può essere ma non
funzionante. Tutto questo lo possiamo sapere se è presente una
proteina la cui espressione è regolata dall’ormone e vedere se è
indotta o non indotta. La proteina più interessante è sicuramente
rappresentata dal recettore del progesterone in quanto il recettore del
progesterone è indotto dal recettore dell'estradiolo che induce anche
la crescita di tessuto. Quindi bisogna osservare se è presente sia il
recettore per l’estradiolo e del progesterone, se sono presenti
entrambi i due recettori e sono funzionanti, evidentemente il tumore
c’è e può essere considerato tumore ormono-dipendente. La terapia
molto spesso prevede la rimozione, quando è possibile, affiancare
antagonisti ormonali con il Tamoxifene. Questo tipo di terapia
funziona abbastanza bene, infatti l’incidenza del tumore della
mammella, tra le malattie neoplastiche, è il primo killer tra le donne
perché colpisce tra 1,5 al 2% della popolazione femminile, ma il più
del 20% si complica, purtroppo essendo un tumore molto aggressivo
può dare metastasi ai polmoni, spesso alle ossa.
Un'altra possibilità è che è presente il recettore del estradiolo ma è
assente quello del progesterone, questo ci fa pensare che il recettore
scaricato da www.sunhope.it
42
scaricato da www.sunhope.it
è presente ma non funziona bene non agendo con il DNA e non
attivando la trascrizione quindi ci aspettiamo che non attivi neanche la
proliferazione, di conseguenza terapia con antagonisti (Tamoxifene,
Faslodex) non ha una buona risposta, però il fatto che ci sia il
recettore del estradiolo è ancora un indice di differenziazione quindi i
recettori tumori positivi sono in genere considerati meno aggressivi di
quelli recettori negativi.
Poi si può avere la condizione che sono assenti entrambi i recettori ed
è quindi un tumore ormone indipendente in questi casi la terapia
ormonale non può dare grossi risultati passando a terapie alternative.
Infine abbiamo un caso strano, c’è il recettore per il progesterone ma
non c’è quello del estradiolo, qui ci fa pensare che il recettore è
presente ma non è riconoscibile dall’anticorpo, questo è un segno
importante perchè fa vedere che c’è un frammento o qualcosa di
molto simile paragonabile al recettore che viene attivato anche in
assenza di ormone quindi esiste un’attività costruttivamente attiva sui
geni ormone regolati che porta alla proliferazione di questo tessuto.
I recettori steroidei non agiscono solo attraverso un meccanismo
trascrizionale, quindi lo schema classico, dove c’è il recettore del
estradiolo che induce proteine tra cui il recettore del progesterone e
solo quando induce la trascrizione è in grado di stimolare la
proliferazione cellulare, non funziona perché gran parte degli effetti
proliferativi degli estrogeni sono mediati da pathway non genomici,
non solo è evidente un interazione funzionale tra recettore degli
estrogeni e i recettori della famiglia del EGF-HER2/ErbB2-neu (HER2neu significa recettore 2 per il fattore di crescita epidermico umano,
ErbB2 famiglia dei recettori epidermici dei ), oggi ogni qual volta ci si
trova davanti un tumore della mammella viene richiesto il dosaggio,
oltre che dei recettori, anche dell’oncogene neu perché neu riesce a
stimolare una pathway proliferativa cellulare. Quindi si è visto che
esiste un integrazione tra funzioni genomiche e meccanismi genomici
non dipendenti dal estradiolo portando alla fine proliferazione
cellulare.
Un altro elemento molto importante il gene BRCA 1 e 2 che sono degli
oncosoppressori dei regolatori che intervengono al livello della
decisione della mitosi, mutazioni inattivanti dei geni BRCA 1 e 2
scaricato da www.sunhope.it
43
scaricato da www.sunhope.it
predispongono a tumori molto aggressivi ereditari della mammella.
Caso molto più interessante è il tumore della prostata, in quanto
ancora da capire come mai il recettore che fino ad un certo momento
funzionava bene poi di non funziona più determinando la
trasformazione.
Gli estrogeni oltre ad avere tutte quelle funzioni sul sistema vascolare,
nervoso, osseo etc…, alla fine fa una cosa molto importante e cioè di
determinare l’ovulazione che è necessaria per la riproduzione.
Abbiamo visto che fino ad una certa età i livelli di estrogeni sono livelli
molto bassi, dopodichè siccome vene rimossa l’inibizione da parte
dell’ipofisi l’ovaio diventa molto più sensibile e l’ipofisi diventa molto
più sensibile all’ipotalamo, si ha la salita della produzione degli
estrogeni e poi di progesterone che porta alla maturazione del follicolo
e alla comparsa del ciclo che ha una sua cronicità caratteristica e che
il cui elemento determinante è caratterizzato dall’ovulazione che
avviene dopo 15 giorni dalla maturazione del primo follicolo.
Nell’ovulazione l’elemento determinate è l’ipofisi, dove in tutta l’età
infantile i livelli di estrogeni sono molto bassi dopodichè ad un certo
punto per effetto della disinibizione dell’asse ipotalamo ipofisario si
comincia ad osservare un lieve aumento di LH e FSH a cui segue un
aumento dell’estradiolo aumenta e fa deprimere la sintesi di FSH però
nonostante questo per un effetto stranissimo è che nonostante ci sia
un incremento dei livelli di estradiolo anziché avere una riduzione di
FSH ed LH, per effetto del feedback negativo, si osserva un effetto di
feedback positivo, è l’unico caso in cui questo avviene. Questo
feedback positivo è fondamentale perché si abbia l’ovulazione, ripeto
questo è l’unico caso di feedback positivo dimostrato determinato solo
da una quantità elevata di estrogeni (superiore a 200 pg/ml) ma è
importante perché solo in questo caso si ha quel aumento della
pressione interna al follicolo necessaria per l’espulsione del ovulo.
A questo punto, visto che è successo per la prima volta (menarca)
questo evento si ripeterà con una cronicità sua caratteristica per tutta
la vita fertile della donna, questo evento è chiamato Ciclo Mestruale
che rappresenta l’evento di questo ciclo e caratterizzato
dall’ovulazione dove è presente anche il corpo luteo il quel e produce
una quantità enorme di progesterone.
scaricato da www.sunhope.it
44
scaricato da www.sunhope.it
Il progesterone non ha un azione proliferativa intensa come quella del
estradiolo però ha il compito di eutrofizzare (nutrire) soprattutto
l’edomentrio, perché a questo livello si hanno una serie di
modificazioni di tipo fenotipiche a carico dell’apparato genitale
femminile che si può valutare attraverso l’esplorazione vaginale con la
produzione di muco e soprattutto lo spessore dell’endometrio. Nella
prima fase si ha una fase prevalentemente dominata dagli estrogeni
che è una fase proliferativa caratterizzato da un aumento della
cellularità e lo sviluppo di alcuni annessi come le arterie, le ghiandole
che producono muco e questa fase dura fino all’ovulazione. Una volta
che si è avuta l’ovulazione subentra l’azione del progesterone che
porta ad un effetto differenziativo con produzione di nutrienti, sintesi di
glicogeno e soprattutto ispessimento dell’endomentro, tutti elementi
che dovrebbero consentire l’annidamento dell’ovocita qualora fosse
fecondato che ha un tempo di 15 giorni, se non viene fecondato in
questo tempo il corpo luteo va in atresia, livelli di progesterone
scendono, anche l’endomentro si squama andando in emorragia con il
flusso mestruale dove si noteranno dei brandelli epiteliali,
caratterizzando la mestruazione per tutto il periodo fertile della donna.
Se invece si annida il follicolo fecondato si ha lo sviluppo del feto con
il sincizio trofoblasto e citotrofoblato incominciando a produrre gli
ormoni necessari per sostenere la gravidanza e non la placenta la
quale produce la gonadotropina che è necessaria per la stimolazione.
La maggior parte delle sostanze vengono prodotte dal feto che è in
stato di crescita che si auto sostiene che autoproduce formando il
deidroepiandrosterone solfato (DHEAS che vene misurato nei maschi
per l’attività ormonosintetica) viene soprattutto prodotto dalla
surrenale fetale che viene trasformato in estradiolo estrone oppure il
suo derivato idrossilato in estriolo che è un estrogeno molto
rappresentato in questa fase. Quindi le ghiandole surrenali del feto
sono la maggior fonte di produzione per gli ormoni steroidi soprattutto
estrogeno, dopo la regressione del corpo luteo promuovono la
crescita del feto e degli annessi e poi successivamente lo sviluppo
delle mammelle, la lattazione in tandem con la prolattina e la
dilatazione dei genitali esterni richiesti per il parto.
Il progesterone è il più importante per la stabilizzazione e il
scaricato da www.sunhope.it
45
scaricato da www.sunhope.it
sostentamento del feto durante la vita uterina e stimola ad esempio
glicogeno per il nutrimento del feto.
Quando non funziona il progesterone si chiamano ipofunzioni
ovariche e l’evento caratteristico quando non funziona è la
sospensione del ciclo mestruale fenomeno noto come Amenorrea. Le
amenorree vengono distinte in Primarie e Secondarie. Primaria vuol
dire che non c’è mai stato il menarca dovute da un mancato sviluppo
o uno sviluppo ritardato delle gonadi dove si può avere Sindrome di
Turner, ipopituitarismo, ipogonadismo monotropo, pubertà ritardata,
carenze nutrizionali gravi, lesioni organiche. Secondario se ci sono
state almeno due mestruazioni, anche non regolari, che vengono poi
interrotte e possono essere distinte in fisologiche come gravidanza,
allattamento e menopausa, patologiche deficit della funzione ovarica,
iperprolattinemia, anoressia nervosa come diete molto rigide, malattie
sistemiche come leucemie malattie autoimmuni la chemioterapia,
stress molto intenso e sindrome dell’ovaio policistico.
La sindrome dell’ovaio policistico o di Stein-Leventhal è una sindrome
diffusissima, per molti anni non si era capita a che cosa fosse dovuta
questa particolare condizione e alla fine si è venuti a capo che alla
base di tutto c’è uno sbilanciamento della secrezione di LH e FSH
infatti in alcuni soggetti si produce molto più LH che FSH porta una
stimolazione delle cellule della teca una iperattività di sintesi di
testosterone da cui tutti segni correlati che talvolta di notano in
persone afflitte da ovaio policistico come una lieve peluria, qualche
brufolo dovuto da un ipersecrezione di sebo, quindi segni di
virilizzazione leggera. Ma il problema non è tanto per i caratteri esterni
ma perché vi è un iperandrogenismo che porta da una parte ad un
fenomeno di aromatizzazione d’altra parte la mancata produzione di
FSH riduce l’attività dell’aromatasi quindi gli androgeni sono molti però
gli estrogeni sono pochi quindi un mancata concentrazione di
estradiolo (inferiore a 200pg/ml in quanto necessari per determinare il
doppio feedback positivo che porta allo scoppio dell’ovaio) può
portare a dei cicli inefficaci in cui l’ovaio non esplode e quindi questo
follicolo si ingrandisce sempre di più proprio per una mancata
esplosione e si osservano dei follicoli enormi. Mentre per l’androgeno
si accumula ma se il soggetto è afflitto da obesità si osserva un
scaricato da www.sunhope.it
46
scaricato da www.sunhope.it
accentuata aromatizzazione extraghiandolare che porta un eccesso
non di estradiolo ma di estrone che va ad inibire la secrezione in
senso negativo di LH e FSH per cui si perpetua questo ciclo
all’infinito. Riassumendo c’è uno sbilanciamento tra FSH e LH, LH
produce molto testosterone che viene aromatizzato in estrogeni ed
estrone che determina una inibizione della produzione di FSH che non
fa produrre aromatasi quindi non si hanno produzione di estrogeni non
fanno scoppiare il follicolo quindi avrà un ovaio enorme pieno di
follicoli molto grossi.
Per quanto riguarda la gonade maschile è costituito soprattutto dal
testicolo e come tutte le gonadi ha una doppia funzione una endocrina
che è sostenuta dalle cellule di Leyding che è il parenchima endocrino
del testicolo e da una funzione gametogenetica rappresentata
appunto dagli spermatozoi che sono il frutto della spermatogenesi.
Se si osserva una sezione istologica si può notare una struttura
canalicolare in cui si notano dei “peli” che non sono nient’altro che le
code degli spermatozoi che si muovono all’interno dei canali
seminiferi. Tutto intorno si trovano le cellule di Sertoli separata da una
membrana basale dove sono presenti le cellule di Leyding che
producono il testosterone, che viene prodotto quasi esclusivamente in
risposta al LH secreto dall’ipofisi.
Ogni giorno ne vengono prodotti circa, se non vengono utilizzati, 250
milioni e la loro produzione parte dalla cellula staminale che sono gli
spermatogoni (cellule diploidi) che vanno incontro a due meiosi
quando sono allo stato di spermatociti dopodichè si trasformano in
spermatidi che man mano salgono dallo strato basale al lume, fino ad
arrivare spermatozoi, cellula gamentica definitiva che sarà eliminata
verso l’esterno dei tubuli seminiferi. Una cosa molto importante, a
differenza della donna dove il patrimonio dei gamenti è limitato, invece
gli spermatozoi fino alla pubertà ci sono solo spermatogoni che si
cominciano a riprodurre sotto l’effetto del testosterone con la pubertà
e cominciano immediatamente a riprodursi, indifferentemente se
vengono utilizzati o no, e a differenziarsi. Quindi nel testicolo
immaturo troviamo prevalentemente spermatogoni che sono cellule
staminali con corredo cromosomico diploide che si riproducono fino
alla meiosi soltanto quanto arriva il testosterone vengono trasformate
scaricato da www.sunhope.it
47
scaricato da www.sunhope.it
in spermatociti e questo loro passaggio è caratterizzato dal fatto che
entrano nella prima divisione meiotica che dura alcuni giorni (16) e per
effetto di questo fenomeno avremo una riduzione del numero di
cromosomi che trasforma queste cellule a cellula aploidi che poi si
trasformeranno successivamente in spermatidi che è la
spermatogenesi vera e propria, durante la quale acquistano il flagello,
che conferiscono un elevata mobilità, grazie alla dineia una proteina
che fa muovere il flagello, che è fondamentale per la fertilità, infatti la
maggior parte delle impotenze maschili da una a-dinamia dei
spermatozoi. Inoltre sulla testa dello spermatozoo sono presenti degli
enzimi detti acrosoma necessari per lisare la membrana dell’ovocita.
Gli enzimi acrosomiali derivano dall’apparato del golgi.
Alla fine della maturazione avremo degli spermatozoi che si libera
dell’eccesso di citoplasma che può essere secreto nei tubuli
seminifesi, fenomeno detto spermiazione.
La cosa importante è che gli spermatociti vengano reclutati solo
quando si hanno livelli adeguati di testosterone che ha una funzione
molto importante per quanto riguarda la proliferazione e la
differenziazione. In assenza di testosterone anche in soggetti
genotipicamente maschi possono avere un fenotipo femminile o
fortemente femminilizzati, infatti la patologia da testosterone è una
patologia del fenotipo maschile, anche se hanno molta importanza i
tumori ormono-dipendenti tipo quelli della prostata.
L’importanza delle cellule inerziali è basata sulla produzione
dell’ormone in quanto fondamentale sia per la produzione degli
spermatociti che per la differenziazione del sesso fenotipico.
La secrezione del testosterone avviene con il solito sistema
l’ipotalamo che secerne GRH che fa liberare FSH e LH dal ipofisi che
raggiungono il testicolo dove stimolano la produzione di testosterone
attraverso le cellule di Leyding e le cellule di Sertoli producono
l’inibina, caratteristica maschile della gonade maschile. Abbiamo visto
che nel caso dell’ovaio c’è una cooperazione stretta tra LH che
produce i precursori e FSH l’estradiolo, invece nel testicolo FSH e LH
in qualche modo non agiscono in tandem come nell’ovaio, ma
cooperano in qualche modo, ma l’asse di regolazione e diverso. Il
testosterone è quasi esclusivamente regolato dalla secrezione di LH
scaricato da www.sunhope.it
48
scaricato da www.sunhope.it
che agisce solo sulle cellule di Leyding, il testosterone inibisce con
feedback negativo ipotalamo ed ipofisi. Al contrario FSH agisce sulle
cellule di Sertoli che le fa riprodurre, fa attivare le funzioni
metaboliche, e queste producono l’inibina che inibisce esclusivamente
FSH. Una cosa importante è che FSH controlla una proteina ABP che
è molto concentrata nei tubuli seminiferi delle cellule del Sertoli la cui
funzione è riconsentire una concentrazione molto elevata di
testosterone all’interno del testicolo.
Gli effetti fondamentali del testosterone sono evidenti in quanto sono
legati alla differenziazione del fenotipo, aumenta la concentrazione nel
corso degli anni dove avrà una salita intorno ai 13/14 anni dove si
osserveranno lo sviluppo dei caratteri sessuali esterni a una
particolare morfologia dei peli pubici e anche ad uno sviluppo lineare
del soggetto.
Il testosterone è appunto un ormone differenziativo agisce su quasi
tutti gli organi, agisce sulla cute con la produzione di sebo, conferisce
una struttura ai peli della testa al livello recettoriale che regola la
caduta dei capelli, stimola la crescita della barba, determina
l’allungamento del pene, la pigmentazione dello scroto, l’allungamento
dell’uretra, lo sviluppo della prostata molto importante perché questo
ci conduce ai tumori della prostata ormono-dipendenti. Nei genitali
interni conferisce crescita dell’epididimo, dei deferenti, delle vescicole
seminali. Sul sistema nervoso presiede sullo sviluppo del fenotipo
psichico maschile (libido maschile), la laringe con un tono più basso
dovuto ad un allargamento della laringe, incremento degli eritrociti
infatti sono molti di più rispetto alle donne, incremento della massa
muscolare e distribuzione aneroide (forma a mela) dell’adipe.
Importante gli effetti metabolici in quanto il testosterone determina un
incremento della sintesi di VLDL, LDL e una riduzione HDL,
naturalmente controlla la produzione degli spermatozoi determinando
una produzione delle cellule del Sertoli.
Quando abbiamo un mancato funzionamento del testosterone
abbiamo una ipofunzione e una iperfunzione. Nell’ipofunzione se
avviene nella vita fetale si ha lo pseudo ermafroditismo. Nella
adolescenza
nell’adulto
possiamo
avere
ipogonadismo
ipergonadotropo e ipogonadismo ipogonadotropo.
scaricato da www.sunhope.it
49
scaricato da www.sunhope.it
Nella forma ipergonadotropo abbiamola sindrome di Klineferlter (XXY)
il testicolo diventa duro non risponde con scarsa funzione testicolare.
La sindrome di Reifenstein deficit del recettore presente nel testicolo.
L’anorchia mancanza del testicolo. Insufficienza secondaria ad
esempio per effetto di malattie infettive o di altre circostanze
traumatiche, anorchia congenita, aplasia germinale,
Mentre nella forma ipogonadotropo abbiamo Enuncoidismo, deficit di
LH o FSH, panipopituitarismo, criptorchidismo quando il testicolo
viene ritenuto in addome e quindi con scarso funzionamento in quanto
il testicolo teme il caldo rallentando molto la funzione gametogenetica
che quella endocrina e il varicocele presenza di varici nel plesso
testicolare che possono interferire ma che colpisce soprattutto gli
adulti. Orchite autoimmune cioè fenomeni infettivi che possono
portare malattie autoimmuni in quanto la vaginale del testicolo
rappresenta una di quelle zone escluse dal sistema immune. Farmaci,
radiazioni effetti iatrogeni.
Effetti ipogonadotropi sono dovute essenzialmente da difetti genetici o
da gonadotropine però si può avere una deficienza sistemica come
AIDS, emocromatosi cioè accumuli di metalli, aplasia delle cellule
germinali, obesità o mal nutrizione.
I disturbi della differenziazione sessuale sono un fenomeno molto
legati soprattutto legato all’androgeno per quanto riguarda la
differenziazione maschile ma bisogna tener conto che vi sono altri tipi
di differenziazione sessuale come sesso cromosomico (maschio
femmina) sesso gonatico (testicolo, ovaio), sesso fenotipico, uno
dipendente dall’altro, ma talvolta questa catena si interrompe legato al
fatto che in mancanza di un segnale positivo a prescindere da quello
che c’è scritto nei cromosomi diventeremo tutti di sesso femminile
cioè la nostra evoluzione naturale va verso il fenotipo femminile. In
soggetto che hanno il cromosoma Y, che a differenza del X che è un
cromosoma enorme, ha una regione che serve a differenziare il sesso
e produce una serie di sostanze come l’antigene WAY che consentirà
la differenziazione della gonade in senso maschile che consentirà la
produzione di testosterone se è presente il testosterone avremo la
differenziazione dei caratteri sessuali in senso maschile.
scaricato da www.sunhope.it
50
scaricato da www.sunhope.it
Migliaccio 1.6 (Mercoledì 9 Novembre 2011)
Ermafroditismo
Tiroide
Come abbiamo detto esistono quattro livelli di differenziazione
sessuale, uno genetico, uno gonadico, uno fenotipico e uno
psicologico.
Come detto esiste una tendenza verso il fenotipo femminile cioè in
mancanza di un segnale positivo che modifichi lo stato delle cose
infatti sia le gonadi che l’aspetto (fenotipo) evolve verso un aspetto
femminile. Infatti un fenotipo 44 XX porta progressivamente ad una
differenziazione che non è molto veloce da dove parte dalla corticale
del mesonefro primitivo il quale si divide in due una zona midollare
che darà origine allo stroma e una corticale che darà i follicoli ovarici
e in un giro di settimane darà la differenziazione del fenotipo sia
interno che esterno in senso femminile, se invece è presente un
cromosoma XY dove Y è presente una regione autosomale dove
risiedono una serie di geni che modificano il fenotipo in una maniera
non semplice. Anche qui si parte da una zone mesonefrica che si
divide in due sezioni, una che darà origine all’epitelio seminifero e una
allo stroma. La prima cosa che si osserva è l’espressione di un
antigene che si chiama HY che è un componente del complesso
maggiore di istocompatibilità il quale è il responsabile del misterioso
rigetto nel trapianto di cute maschile nella donna proprio perché si ha
un espressione di rigetto non self che HY quindi lo si può considerare
più come un marker, ma in realtà il concetto HY è molto vago perché
esiste anche un altro antigene HY che si presenta solubile ed oggi
viene identificato come MIF cioè il fattore antimulleriano che inibisce
lo sviluppo dei dotti di Muller. Comunque sia una volta manifestato
questo antigene osserveremo che le cellule staminali si differenziano
in cellule di pre-sertoli e poi successivamente in cellule di sertoli,
mentre in corrispondenza dell’interstizio cominciano a nascere altre
cellule di origine epiteliale che diventeranno le cellule di Leyding. Le
cellule di sertoli produrranno il fattore antimulleriano che va ad inibire
la progressione dei dotti di Muller, invece la cosa più importante sono
le cellule di Leyding infatti sono proprio queste cellule a differenziare il
scaricato da www.sunhope.it
51
scaricato da www.sunhope.it
feto da sesso femminile a sesso maschile mediante la produzione di
testosterone che per azione della 5-α-reduttasi si trasforma in
diidrotestosterone e determina la mascolinizzazione del seno
urogenitale e quindi della prostata e delle vescicole seminifere, dei
genitali esterni e conduce alla differenziazione maschile. Questo tipo
di processo dura anche 120 giorni all’incirca 4 mesi quando appunto
si effettua l’ecografia e si è sicuri che il sesso sia differenziato verso il
senso femminile o maschile. La differenziazione è lenta e si completa
intorno a i 4 mesi con la completa morfogenesi dei genitali esterni,
invece già dopo un mese se si ha una differenziazione, nel caso
maschile, i tubuli seminiferi e dopo un poco le cellule di Leyding. Al
livello interno i dotti mulleriano nella donna daranno origine alle tube
Falloppio nel maschio regrediscono formando il legamento rotondo,
intorno ai 40 si incornicia ad avere la differenziazione dei genitali
esterni e di conseguenza interni.
Ritornando all’antigene HY insolubile non è nient’altro che un antigene
di istocompatibilità quindi non ha un ruolo efficace nella
trasformazione, mentre HY solubile altro non è che MIF che
porterebbe semplicemente solo alla regressione dei mulleriani.
Ciò che determina la trasformazione, nel caso della differenziazione
maschile, è un complesso poligenico detto SRY dove il gene più
importante di questa regione si chiama ZFY uno zinc finger, altro non
è che un regolatore della trascrizione che induce l’espressione di
proteine coinvolte nel differenziamento o nella migrazione delle cellule
che porterà alla morfogenesi maschile infatti le cellule di Leyding
porteranno testosterone dove indurrà la formazione dei dotti di Wolf
quindi dei dotti seminiferi, vaso deferente, vescicole seminali ed
epididimo. Dall’altra parte una volta che il testosterone si riduce a
DHT (diidrotestosterone) porta allo sviluppo del pene e dello scroto e
quindi alla differenziazione dei genitali esterni.
Uno dei disturbi più famosi è sicuramente la sindrome di Turner
caratterizzata dall’assenza di uno dei due cromosomi X praticamente
il cariotipo di queste persone è 45X0 dove un soggetto X0 si
presenterà un fenotipo femminile. Questa sindrome può originare da
una disfunzione a vari livelli, ad esempio può avvenire una
disfunzione allo spermatocita primario dove si avranno dei
scaricato da www.sunhope.it
52
scaricato da www.sunhope.it
spermatociti secondari e poi spermatozoi apolidi con un cariotipo
22XY e un cariotipo X0. Se lo spermatozoo 22XY trova la sua X, che
proviene dalla madre, avremo un cariotipo 47XXY noto come
sindrome di Klinefelter. Mentre se si trova lo spermatozoo senza
l’eterocromosoma può solo trovare la X da parte dell’ovocita materno
dove avremo in 45X0.
La sindrome di Turner è appunto un cariotipo difettivo e una serie di
conseguenze dove mancherà il corpo di Barr, mostrerà una serie di
caratteristiche fenotipiche come bassa statura, collo a forma di
pipistrello, torace a scudo, gomito valgo e alcune volte anche
patologie cardiache. Tutto questo è dovuto a disturbi una serie di
astrazioni del cromosoma X. Nel caso di una donna con questa
sindrome, a livello del ovaio, sembra incredibile, ci possono essere
delle astrazioni meno gravi che possono permettere la riproduzione.
Per quanto riguarda le patologie da 47XXY in questo caso avremo un
soggetto di fenotipo maschile, perché Y funziona sempre, è una
patologia non rarissima e si nota uno sviluppo dello sviluppo
testicolare cioè lo sviluppo non va oltre gli spermatociti con canali
seminiferi ipotrofici e quello che accade sono anomalie dello sviluppo
testicolare, degenerazione dei tubuli seminiferi, scomparsa
dell’epitelio germinale. Si presenta anche un effetto di
ipoandrogenismo che è considerata come prima causa di
ipogonadismo ipergonadotropo dove osserviamo segni come: la
ginecomastia dove si hanno livelli molto alti di aromatizzazione di
testosterone con formazione di estradiolo che può determinare la
comparsa della ginecomastia, ancora, la azoospermia dove i testicolo
sono piccoli duri e ipotrofici, il testosterone si riduce ma l’estradiolo è
presente ma non ci dovrebbe essere, non è presente inibina, sono
molto elevati i livelli di FSH e LH (considerato il paradigma del
ipogonadismo ipergonadotropo), è alta anche la SHBG “Sex Binding
Hormone Globulin” Globulina leganti gli steroidi sessuali precisamente
testosterone e estradiolo. Spesso si associa ad una intolleranza al
glucosio. Chi è affetto da ginecomastia si presenta con una
distribuzione ginoide dell’adipe cioè vita stretta e fianchi larghi,
presentano una statura più alta del normale, un fenotipo piuttosto
aggressivo.
scaricato da www.sunhope.it
53
scaricato da www.sunhope.it
Per quanto riguarda i disturbi del sesso gonadico, come abbiamo visto
se è presente la Y si va verso la differenziazione maschile se non è
presente si va verso la differenziazione femminile, questi disturbi sono
dovuti ad una gonade non ben differenziata e questo è causato da un
mescolamento tra geni X e Y. Questa sindrome ne è caratteristico gli
ermafroditi veri dove la caratteristica fondamentale è che coesiste sia
tessuto gonatico maschile che femminile, può esistere sotto forma del
ovotestis cioè una gonade indifferenziata in cui coesistono sia tessuto
germinativo maschile che ovarico o talvolta ci può essere da una
parte l’ovaio dall’altro il testicolo in genere ritenuto in addome.
I disturbi del sesso fenotipico sono i pseudo-ermafroditismi e sono
soggetti che hanno un sesso cromosomico definito, una gonade
definita però il fenotipo non corrisponde al genotipo o alla gonade e
questo può succedere perché nella differenziazione sessuale quello
che gioca tutto è soprattutto il testosterone, infatti in un soggetto
cariotipo femminile con un testosterone molto alto si ha uno pseudoermafrodita maschile, per il contrario maschile deve succedere che
bisogna avere qualche disturbo dell’ormonogenesi e non tanto al
livello genetico, in quanto abbiamo visto che il sesso è definito da per
effetto dei geni della gonade presenti sul cromosoma Y, infatti un
soggetto presenta i caratteri sessuali maschili ma appare come una
donna anche di bello aspetto.
Lo pseudo-ermafrodita femminile si può avere per un deficit di due
enzimi la 21-idrossilasi e 11-β-idrossilasi la conseguenza di questi
deficit ormonali è che la corticale del surrene che porta ad una
produzione eccessiva di androgeni durante la vita fetale andando a
interferire con i genitali esterni.
Alla fine dell’organogenesi per il cortisolo c’è bisogno dell’azione
essenziale della 21-idrossilasi e subito prima viene la 11-β-idrossilasi
che trasforma i precursori al destino opposto. Immaginiamo che il
gene che codifica la 21-idrossilasi si blocca e quindi non lo codifica
più, in questo caso non si ha più cortisolo, di conseguenza ACTH
stimola la corticale del surrene non riesce a produrre cortisolo però
produce tutti i precursori dove vengono captati dagli androgeni che
finiscono per mascolinizzare il fenotipo. Come segni caratteristici non
si ha più la sintesi di mineralcorticoidi, ne di cortisolo ma molti
scaricato da www.sunhope.it
54
scaricato da www.sunhope.it
androgeni, quindi si ha ipovolemia, ipotensione, netto pseudoermafroditismo femminile, nel caso del maschio si può avere una
precocità dei caratteri sessuali.
Nel caso del deficit del 11-β-idrossilasi si ha una forma di pseudoermafroditismo con ipertensione però presenta tutti i caratteri dello
pseudo-ermafroditismo come virilizzazione, ambiguità genitale etc…
L’ipertensione è data dal questo blocco dove tutto il deossicortisolo
viene deviato verso la produzione di androstenedione che poi si
trasformerà in testosterone (virilizzazione del fenotipo) ma anche
deviato verso la produzione di deossicorticosterone (DOC) dove
presenta una altissima attività mineral attiva e quindi una potentissima
ritenzione di sodio facendo salire la pressione.
Invece se si ha un deficit della 21-idrossilasi la situazione appare più
semplice in quanto non si forma il DOC e neanche l’aldosterone
quindi non si ha un effetto mineral attivo ma perdita di sodio e perdita
di Sali in generale, quindi ipotensione e tutti i precursori a partire dal
idrossiprogesterone vengono deviato verso l’androstenedione e
successivamente verso il testosterone con effetto della virilizzazione
del fenotipo.
Quindi per avere un ermafroditismo femminile ci deve essere molto
testosterone e quindi ci deve essere un blocco basso della sintesi
degli steroidi al livello della corticale del surrene tale che i precursori
vengono tutti deviati verso la produzione di androgeni.
Al contrario nello pseudo-ermafroditismo maschile, pur avendo il
cariotipo XY e testicolo non produce testosterone, evidentemente ci
deve essere una mutazione nei primi enzimi coinvolti nella
steroidogenesi questi enzimi sono la 17-α-idrossilasi la 3-βidrossisteroido-deidrogenasi o addirittura la desmolasi che trasforma il
colesterolo in precursori primari.
Nel caso che si tratti una donna si può avere amenorrea primaria, ma
soprattutto nel maschio si può avere pseudo-ermafroditismo maschile
e ipertensione.
Nel caso della 3-β-idrossisteroido-deidrogenasi nella donna si può
avere una modica virilizzazione e iogenitalismo maschile.
Mentre nella 20/22 desmolasi si ha blocco totale della sintesi
dell’ormonogenesi con surrenalismo grave, se prende sia testicoli che
scaricato da www.sunhope.it
55
scaricato da www.sunhope.it
surrene è incompatibile con la vita, ma se prende solo al livello
testicolare si ha solo uno pseudo-ermafroditismo maschile.
Una della cause più frequenti del disturbo della differenziazione
maschile (pseudo-ermafroditismo maschile) è la resistenza periferica,
cioè si ha presenza di testosterone ma manca il recettore degli
androgeni e questa mancanza può essere totale detta sindrome di
Morris o incompleta detta sindrome di Lanfestain.
La Tiroide è costituita da due lobi tenuti insieme da un minuscolo
istmo che fa sede nel collo, in condizioni normali non dovrebbe essere
palpabile ma nel caso di ipertrofia è palpabile se facciamo deglutire il
paziente, pesa circa 12g e la sua struttura istologica si presenta
formato da un tessuto follicolare dove notiamo delle cavità circondato
dall’epitelio secretivo, il quale epitelio cambia profondamente aspetto
in base all’attività infatti se non presenta attività si presenta quasi
pavimentoso se mostra attività diventa cilindrico ma soprattutto se
appare disteso, filiforme in quanto è pieno di una sostanza detta
Colloide che è di natura glicoproteica rappresentata quasi
esclusivamente dalla tireoglobulina proteina essenziale per la sintesi
degli ormoni tiroidei che non avviene in fase libera ma mediante un
processo che è la iodinazione che avviene su molecole di tirosina che
sono comprese ancora nella struttura primaria della molecola della
tireoglobulina, in seguito vene digerita, proteolizzata e vene liberata
sotto forma di triiodotironina e la tetraiodotironina (T3 e T4).
La differenziazione avviene verso VIII/X settimana si ha la sintesi sia
di TRH che TSH, alla X settimana inizia la sintesi di tireoglobulina che
aumenterà fino alla fine, alla XII settimana si ha fine della morfogenesi
ma la cosa fondamentale è in grado di sintetizzare autonomamente
l’ormone perché la fase più importante e cioè la trasformazione di una
tiroxina in uno ormone tiroideo è la iodinazione cioè una
incorporazione di iodio che trasforma la tirosina in 3-monoiodotirosina
(MIT) e 3,5-diiodotirosina (DIT). Un residuo di MIT e uno di DIT per
condensazione formeranno all'interno del lume follicolare 3,5,3'triiodotironina (T3) mentre due residui di DIT daranno origine ad una
molecola di tiroxina (T4) ormone tipico della tiroide. Quindi dalla XII
scaricato da www.sunhope.it
56
scaricato da www.sunhope.it
settimana avremo sintesi degli ormoni tiroidei, ma i livelli restano bassi
fino alla XX settimana e poi aumentano. Alla nascita risulta una buona
quantità di ormoni tiroidei che gli serviranno per una serie di cose.
Noi ci aspetteremo che la tiroide sia sempre davanti al faringe invece
non è spesso in queste zone ma si può collocare in zone
particolarmente pericolose come ad esempio nella zona retro glottidea
cioè alla fine della lingua che occlude con grosse difficoltà nella
deglutizione oppure alla base della lingua oppure in posizione
sottolinguale talvolta anche nella zone endotracheale oppure si può
sviluppare nella regione retrosternale.
Per quanto riguarda gli ormoni tiroidei, i più importanti sono T3 e T4,
meglio note come tetraiodiotironina che deriva dalla sintesi di due
diiodotirosine e triiodotironina teoricamente deriverebbe dalla sintesi
di una monoiodiotirosina con una diiodotirosina, tutto questo avviene
al livello della tireoglobulina, ma in realtà viene prodotta tutta come
tetraiodotironina e la triiodotironina essendo molto più attiva della
tetraiodotironina avviene per deiodinazione che viene operata da
enzimi che si chiamano deiodinasi e che possono portare sia alla
formazione di triiodotironina che di R-triiodotironina (R=revers) che è
un composto che viene fuori nei dosaggi radioimmunometrici ma che
non è assolutamente attiva. Quindi normalmente la T4 viene
convertita a prodotto T3 dalla 5-deiodinasi, può essere convertita a RT3 dalla 5-deiodinasi. Questo enzima è moto importante perché è
quello responsabile dall’inattivazione dell’ormone perché la T3 può
essere convertita definitivamente in T2 che è inattiva ed è il
meccanismo con cui viene spento il meccanismo periferico di questi
ormoni.
La cosa più importante che si deve sapere della tiroide è che senza
non si vive, tant’è che nei soggetti costretti alla chirurgia ad esempio
per carcinomi, si deve fare una terapia sostitutiva “Eutirox”.
La funzione della tiroide è una funzione di equilibri di vari metabolismi,
inoltre ha una funzione di regolazione sulla sensibilità degli ormoni
della midollare del surrene perché regola direttamente il recettore βadrenergico.
scaricato da www.sunhope.it
57
scaricato da www.sunhope.it
La sintesi di questi ormoni parte da un enorme proteina (660kDa)
quale la tireoglobulina, lo iodio viene collocato sulle tirosine dove
formano legami covalenti all’interno di questa grossa macromolecola,
poi viene captata dai lisosomi e fatta a pezzi e vengono liberati questi
aminoacidi con lo iodio dopodichè si hanno i T3 e T4
Caratteristica fondamentale di questi ormoni è la presenza dello iodio
sulla tirosina, lo iodio può essere solo introdotto dall’esterno visto che
non abbiamo fonti endogene di iodio, vene introdotto all’incirca di una
dose di 0.5mg al giorno. Quasi tutto lo iodio che riusciamo a
immagazzinare, circa 8mg, va a finire nella tiroide che lo utilizza per
produrre gli ormoni tiroidei dove poi vanno ai tessuti dove vengono poi
in parte catabolizzati e dispersi, alla fine quasi tutto quello che
introduciamo lo ritroviamo nelle feci 488mcg e 488mcg nelle urine.
Lo iodio è fondamentale per l’ormonogenesi e anche qui vene
regolata dal asse ipotalamo ipofisi dove ipotalamo rilascia il fattore
TRH che va ad agire sul TSH che stimola la tiroide che a questo
livello il TSH essendo un recettore di membrana legato ad una Gprotein, attiva adenilato ciclasi e il secondo mediatore cAMP
producendo due effetti fondamentali: al livello del sistema
trascrizionale attiva il ciclo di Krebs e un intensa attività cellulare,
induce la sintesi della tireoglobulina e tutti gli enzimi coinvolti
nell’ossidazione dello iodio nella sintesi degli ormoni tiroidei. A questo
punto la tiroide riproduce gli ormoni tiroidei e soprattutto
tetraiodotironina la quale va in circolo viene in gran parte deiodinata e
trasformata in T3 che è il regolatore della secrezione che agisce con
un meccanismo a loop breve perché inibisce la sensibilità della ipofisi
alla secrezione dell’ipotalamo riducendo il rilascio di TSH.
L’ipotiroidismo di diagnostica non tanto per i valori di T4 in quanto può
avere picchi dovuti alla distruzione di tipo infiammatorio del tessuto e
quindi liberazione anomala di questo ormone, ma lo si può vedere
perché l’ipotiroidismo è caratterizzato da alti livelli di TSH in quanto il
ci mette un po’ di tempo per essere regolato, quindi se i valori rimando
alti nel tempo vuol dire che il soggetto è ipotiroideo.
L’altro fattore limitante è rappresentato dallo iodio dove essere
sottoposto ad una serie di processi, dove prima di tutto deve essere
scaricato da www.sunhope.it
58
scaricato da www.sunhope.it
ossidato (I- a I+) poi sotto azione del TSH, viene incorporato dalla
tirosina dove può esser incorporato in una singola posizione o una
doppia posizione. Dopo che è avvenuta l’incorporazione si formano le
iodiotirosine, dove sulla tirosina presenta un ossidrile OH all’estremità,
grazie alla presenza del OH si lega ad altre tirosine formando le
Tirodine. Tutto questo avviene nel follicolo all’interno della colloide la
quale viene captata mediante un processo di pinocitosi dalla cellula
follicolare tiroidea, proteolizata attraverso enzimi lisosomiali e secreta
al polo vascolare della stessa cellula tiroidea e quindi messa in
circolo.
La regolazione dello ioduro può avvenire in vari sistemi: diminuendo la
risposta della tiroide al TSH, inibisce la sua ossidazione con un effetto
di Wolff Chaikoff (effetto paradosso), riduce dell'uptake dello iodio
stesso da parte delle cellule tiroidee, e inibisce, ad alte
concentrazioni, la secrezione degli ormoni tiroidei. Quindi lo iodio ha
una regolazione sull’attività tiroidea perché all’inizio stimola l’attività,
quando poi la concentrazione di iodio circolante aumenta abbiamo
l’effetto paradosso in cui si ha un inibizione sia dell'uptake dello iodio
stesso sia della sintesi degli ormoni tiroidei. A questo punto gli ormoni
tiroidei possono agire, vanno in circolo e trovano dei recettori sugli
organi bersaglio, qui entrano all’interno delle cellule e non agiscono a
livello delle membrane, in quanto appartengono alle superfamigle
degli ormoni steroidei e non alla famiglia dei dipeptidi normali anche
se presenta la stessa struttura, una regione che lega il DNA, una
regione ginocchio, una regione cerniera e una regione che lega
l’ormone con il dominio carbossi terminale. Questo recettore è
presente in vari punti, nel citoplasma, moltissimo nei nuclei, e un poco
nei mitocondri dove vanno ad aumentare l’attività della pompa del
sodio, al livello della membrana, aumentando il consumo di ATP.
Gli ormoni tiroidei svolgono una quantità notevole di cose: stimolano
la termogenesi, infatti in soggetti esposti all’azione degli ormoni
tiroidei presentano una temperatura basale più alta; sul metabolismo
proteico svolge un azione tanto positiva quanto negativa, per i
carboidrati in un certo aspetto aumenta l'uptake del glucosio ma ne
aumenta l’utilizzazione; stimola il metabolismo dei lipidi, infatti si sa
scaricato da www.sunhope.it
59
scaricato da www.sunhope.it
che l’eccesso di ormoni tiroidei fa dimagrire; stimola il consumo ed il
metabolismo delle vitamine; ha un azione sul sistema nervoso
simpatico e cosa importante promuovono il differenziamento del
sistema nervoso centrale, stimolano la crescita dell’assone, stimolano
la sintesi degli RNA necessari per la produzione della trasmissione
dell’impulso, sul sistema nervoso simpatico fanno una cosa molto
importante perché aumentano la sensibilità alle catecolamine ad
esempio se una persona ipertiroidea va dal medico perché presenta
sintomi tipo palpitazioni, diarrea, un respiro molto frequente, questo
non è dovuto all’azione degli ormoni tiroidei direttamente a carico del
polmone, del cuore o dell’intestino ma semplicemente ha la risaltata
sensibilità degli effetti delle catecolamine mediate dal recettore βadrenergico. Quindi sul cuore ha un azione cronotropa e inotropa
positiva aumenta la forza di contrazione e la frequenza cardiaca,
aumenta la frequenza respiratoria, aumenta la peristalsi intestinale, ci
possono essere alterazioni del tono muscolare; aumenta l’escrezione
di calcio e di fosforo; riduce la sintesi di colicalciferolo; stimola il
riassorbimento osseo.
scaricato da www.sunhope.it
60
scaricato da www.sunhope.it
Migliaccio 1.7 (Lunedì 14 Novembre 2011)
Ipo e Iper Tiroidismo
Paratiroidi e Regolazione Calcio-Fosforo
Ricordiamo che gli ormoni tiroidei sono dei dipeptidi iodinati noti come
tiroxina o tetraiodotironina T4 e triiodiotironona T3 che è molto più
attiva della T4, la quale può essere sintetizzate sia come tale perché
vengono sintetizzate per la fusione di due iodiotironina poi viene
deiodinata dalle deiodinasi la quale è importante per inibire la
secrezione di TSH da parte dell’ipofisi quindi responsabile della retro
regolazione però sempre per un processo di deionizzazione.
La funzione degli ormoni tiroidei, come abbiamo gia detto, sono molto
importanti per stimolare una serie di attività come ad esempio svolge
una serie di regolazioni toniche sull’attività di molti enzimi coinvolti nel
metabolismo come agire sulla pompa sodio/potassio per mantenere il
gradiente del ATP, metabolismo dei grassi e dei glucidici etc…
Ha una funzione di coordinamento e cioè hanno la stessa funzione
degli ormoni steroidei, questi due ormoni entrano nella cellula e si
legano ad un recettore, che a differenza di quelli steriodei, risiede
stabilmente nel nucleo ed è legato permanentemente sul DNA e
quando si lega avvia la trascrizione di geni specifici.
Nel mitocondrio è coinvolto in una serie di funzioni che riguarda il
controllo degli enzimi ossidativi come la succinato deidrogenasi, la
glicerolo fosfato deidrogenasi, acido grasso sintetasi, enzima malico
incrementando la sintesi di NADPH, inoltre attiva la funzione
glutammato aspartato transaminasi.
L’importanza degli ormoni tiroidei la notiamo quando sono deficitarii
oppure quando ce ne è troppo e si parla di ipertiroidismo e
tireotossicosi, dove per tireotossicosi si intende che la concentrazione
degli ormoni tiroidei livelli tali da determinare effetti tossici ed è
indipendente dall’attività della tiroide. Invece si parla di ipertiroidismo
quando si ha una iperattività della ghiandola dove ne fa caratteristico il
basso livello di TSH.
Quando si hanno effetti tossici tiroidei, come gia menzionato, alcuni
sono specifici di malattie che possono determinare tireotossicosi o
scaricato da www.sunhope.it
61
scaricato da www.sunhope.it
ipertireodismo. Altri sono tipici di qualsiasi altra produzione di eccesso
di ormoni tiroidei.
In genere un paziente che si lamenta di essere nervoso agitato, non
riesce a dormire e non riesce a concentrarsi, presentano palpitazioni o
cardiopalmo che si manifesta molto spesso è talmente forte il polso
che si può arrivare a forme che si chiama dissociazione dei nodi di
conduzione fino alla fibrillazione atriale. Il soggetto ha fame e non
ingrassa, molta sete, perdita di peso. Un'altra caratteristica è talvolta
un tremore che viene collegato con questo stato di ipereccitabilità
accompagnato con sintomi di nervosismo.
Poi ci sono dei segni che sono caratteristici della malattia che può
avere determinato questa situazione di tireotossicosi ad esempio la
malattia di Flaiani-Basedow-Graves, che sostanzialmente è una
malattia autoimmune che è caratterizzata dal esoftalmo o proptosi che
si presenta come una protrusione del bulbo oculare oltre la rima
palpebrale, l'acropachia cioè pelle ispessita, si nota anche il classico
gozzo.
Le cause di tiretossicosi può essere associata ad ipertiroidismo o non
associata cioè la tireotossicosi è un alto livello di ormoni tiroidei che
può essere associata ad una esagerata funzione della tiroide o può
essere non associata.
Associata a ipertiroidismo aumentata secrezione di TSH è molto rara
che ci sia un ipertiroidismo di secondo grado legato all’ipofisi, ma più
comune è sicuramente l’adenoma tossico o di Plummer, il gozzo
tossico multi nodulare legato ad una patogenesi globale.
Poi abbiamo forme che non sono associate a ipertiroidismo ma c’è
tireotossicosi in quanto è una colpa esterna (tipo farmaci) ad esempio
una volta si prescrivevano ormoni tiroidei per dimagrire causando
tireotossicosi dovuta da un eccesso di farmaci, oppure produzione
ectopica (presenza di tumori metastatici) come ormoni come TSH ma
soprattutto T4, oppure la rottura della tiroide con conseguenza
liberazione di colloide e ormoni tiroidei che possono provocare una
situazione transiente di tireotossicosi.
Come abbiamo detto la malattia di Flaiani-Basedow-Graves è
caratterizzata da una malattia autoimmune dove vengono prodotti
scaricato da www.sunhope.it
62
scaricato da www.sunhope.it
degli anticorpi diretti contro il recettore del TSH presente nella tiroide.
Questa immunità è di tipo 6 o 5 a seconda dei casi, detti anche gli
anticorpi stimolanti dove si legano ad un recettore, in questo caso
ormonale, e questo stimola la produzione di T3 e T4, ma è difficile
governare questa situazione a livello di feedback, se non con farmaci
mirati che inibiscono la produzione di ormoni tireoidei, in quanto
l’anticorpo anti recettore TSH si legano al recettore del TSH e
stimolano l’attività, si ha produzione di T3 e T4 che va ad inibire in
maniera radicale il TSH, infatti questi pazienti il TSH non ce l'hanno
proprio, ma l’anticorpo continua a produrre enormi quantità di ormoni
tiroidei. C’è da dire che la malattia non si manifesta ma si ha solo un
aumento dei T3 e T4 e scende di conseguenza il TSH.
La diagnosi di ipertireodismo e ipertireotossicosi la si fa quando il
paziente in presenza di sintomi cardiaci il paziente incomincia a
lamentare di insonnia con livelli molto bassi di TSH.
L’adenoma tossico di Plummer, anche qui vi è una situazione simile
con un TSH molto basso perché c’è una produzione molto elevata di
T3 e T4 ma in questo caso non ci sono gli anticorpi ma il recettore fa
tutto da solo perché il più delle volte contiene delle mutazioni ed
essendo un recettore di transmembrana è un recettore che è in uno
stato di attività permanente di cAMP stimolando si la produzione di
cellule sia la produzione di rilascio di ormoni tiroidei.
Per quanto riguarda la diagnosi diretta della tiroide, ancora oggi si usa
la Scintigrafia che consiste nella somministrazione di un isotopo
marcato (iodio 131) che viene fatto bere al paziente e dopo un poco, e
siccome lo iodio viene captato contro gradiente dalla tiroide, e da
come l’ha captato o dove non lo ha captato si ha un idea di quello che
ci può essere alla base di una disfunzione tiroidea. Ad esempio con
questa tecnica si può diagnosticare il cosiddetto Nodulo Caldo che in
genere sono tumori benigni dove appunto mediante scintigrafia mette
in evidenza solo una metà della tiroide. Ma con questa tecnica si può
anche avere una patologia detta Nodulo Freddo dove quasi tutta la
tiroide è evidente ma nella zona dove non è evidente si nota il punto
in cui non capta lo iodio, risalendo dunque alla diagnosi.
scaricato da www.sunhope.it
63
scaricato da www.sunhope.it
Ritornando agli anticorpi una domanda da porsi è il perché si
producono questi anticorpi, probabilmente alla base c’è un
meccanismo infiammatorio dove penetrano delle cellule infiammatorie
e soprattutto quelle dell’immunità aspecifica ma poi successivamente
cellule dendritiche, macrofagi dove vanno a produrre delle citochine
che favoriscono l’interazione tra le cellule e i recettori delle cellule
tiroidee. L’interazione esalta notevolmente la liberazione di
interleuchine (13 e 6) che attivano e stimolano i linfociti B alla
produzione di anticorpi che si legano al recettore del TSH inducendo
sia proliferazione cellulare sia sintesi di ormoni tiroidei.
Per quanto riguarda la presenza di oftalmopatia è da attribuire,
probabilmente, ad una cross reazione dove anche in questo caso c’è
probabilmente reazione degli stessi anticorpi che stimolano il recettore
dl TSH o anticorpi simili, che cross reagiscono con antigeni che
vengono riconosciuti al livello del grasso retrorbitario o sulla superficie
dei muscolo retrorbitari. La produzione di questi anticorpi determina
da una parte una serie di fenomeni locali, d'altra parte richiama
attraverso stimolazione di citochine l’infiltrazione di cellule
dell’infiammazione come cellule dendritiche ma soprattutto linfociti T e
macrofagi che producono a loro volta delle citochine che stimola FGF
stimolando la riproduzione dei fibroblasi, la produzione di collagene e
glicosaminoglicani i quali essendo fortemente idrofili si imbibiscono di
acqua si gonfia il grasso retrorbitale o le cellule muscolari retrorbitali e
spinge l’occhio fuori. L’estrusione del globo oculare è tale che tal volta
non si riesce neanche a chiudere gli occhi dove porta a secchezza
congiuntivale e si arriva anche a fenomeni di cheratidi con formazioni
di ulcere sulla cornea che possono causale danni irreversibili. Pazienti
affetti da questi disagi vengono trattati con cortisone per ridurre la
reazione. Un altro segno di questa imbibizione è dato dal morbo di
Graves detto Mixedema il quale da una serie di quei segni strani dove
lo possiamo trovare sia nel ipertiroidismo che nell’ipotiroidismo ed è
ancora una volta legato ad una imbibizione del tessuto sottocutaneo
di acqua da parte dei glicosamminoglicani che porta alla tipica pelle a
“buccia d’arancia”.
Nel caso di ipotiroidismo, che ovviamente si presenta con un
insufficiente produzione di ormoni tiroidei, una differenza
scaricato da www.sunhope.it
64
scaricato da www.sunhope.it
fondamentale è che il destino del ipotiroidismo è completamente
diverso a seconda che esordisca in età infantile o nell’adulto.
Nell’infanzia è fondamentale perché sviluppa il cretinismo (con
aspetto di faccia da “cretino” e una grossa lingua macroglossia), infatti
una delle funzioni che svolgono gli ormoni tiroidei è quella di
promuovere la sintesi degli RNA al livello del tessuto nervoso, in
quanto fondamentale per il differenziamento e per la propagazione
degli impulsi nervosi, quindi ritarda lo sviluppo delle sinapsi, questo è
uno dei motivi che in un soggetto con ipotiroidismo c’è un mancato
sviluppo del sistema nervoso ma soprattutto delle funzioni cognitive
per cui si ha una riduzione delle funzioni cognitive. Un altro motivo era
che i bambini fossero mal nutriti.
Nell’adulto vi capiterà spessissimo di osservare signore di età
superiore ai 40 anni che cominciano ad ingrassare ad avere segni
come mixedema, sonnolenza, apatia, mani un po’ giallastre, non
mangiano però prendono peso, bradicardia e bradipnea,
rallentamento della peristalsi con stipsi, ipotensione, mixedema tibiale
(gambe che si gonfiano).
Come cause da attribuire all’ipotiroidismo, anche in questo caso
secondario è raro ed è legato in genere ad eventi catastrofici
dell’ipofisi, più delle volte ipotiroidismo è legato ad eventi primari o
tireoprivo (mancanza della tiroide o non si è sviluppata bene o è stata
esportata via per effetto di un tumore) oppure presenta resistenza al
TSH. Sempre nel caso primario e più comuni, distinguiamo
l’ipotiroidismo gozzigeno cioè il gozzo, dove è caratterizzato da un
iperattività cellulare e quindi anche produzione di colloide, quindi in un
soggetto con ipotiroidismo non presenta ormoni tiroidei però presenta
il gozzo che è causato da una elevata concentrazione di TSH detta
anche tiroidite di Hashimoto con deficit di Iodio, patologia che colpiva
soprattutto persone che vivevano in montagna o zone particolarmente
povere, ma è una malattia che è stata debellata tra gli anni 60/70.
Come menzionato il deficit del recettore del TSH è caratterizzato da
mutazioni e la sua funzione è molto simile agli altri recettori steroidei
dove la sua funzione è caratterizzata appunto con l’arrivo dell’ormone
si lega al recettore determinando una serie di modificazioni dopodichè
si attacca al DNA polimerasi insieme ai coattivatori e porta avanti
scaricato da www.sunhope.it
65
scaricato da www.sunhope.it
l’espressione e la sintesi di RNA e di geni specifici. Invece per quanto
riguarda i recettori per gli ormoni tiroidei è un po’ complicata perché
purtroppo il recettore è permanentemente localizzato sul DNA detto
TR che è associato TRAP insieme al co-repressore (CO) e TRE
(thyroid-hormone responsive element) (TRAP-CO-TRE dove insieme
reprimono la trascrizione di mRNA perché legati al CO). TRAP
sembrerebbe che non lega direttamente T3 e T4 ma agisce soltanto
come eterodimero in associazione con il recettore TR. Quanto arriva
T3 o T4 si possono avere due possibilità o l’omodimero viene scalzato
e il co-repressore va via formando un nuovo eterodimento detto TRETRAP attivando la trascrizione. Se è presente una mutazione
possiamo avere che i complessi non si riescono a liberare nel
momento in cui arriva l’ormone e la trascrizione non parte, questo è
quello che succede nella resistenza periferica agli ormoni tiroidei cioè
quanto è presente una reazione inattivante del recettore tiroidei.
Il caso più comune di tiroidite e ipotiroidismo è sicuramente da
ricondurre alla tiroidite di Hashimoto che è di carattere autoimmune,
diffusissima, molto più diffusa tra le donne che tra gli uomini ed è
caratterizzata da un infiltrazione linfomonicitaria della tiroide, che
invece di produrre anticorpi che stimolano il recettore del TSH come
avviene nel morbo di Graves distruggono la tiroide dove, in
precedenza si osserva un piccolo picco ipertiroideo e tireotossicosi.
Per la diagnosi si useranno appunto la misurazione di questi anticorpi
dove si osserverà un aumento di 10/20 volte superiori alla norma
contro la TPO perossidasi o la tireoglobulina. Si sviluppa in donna dai
30/50 anni, è a-sintomatica per molto tempo ma si ha gia un
infiltrazione massiccia ma il soggetto è perfettamente normale, dopo
altro tempo (alcuni mesi) si osserva un aumentata risposta al TSH con
T3 o T4 ancora bassi con un aumento del TSH, soltanto
successivamente compaiono i sintomi che corrispondono solo con un
aumento del TSH superando i valori normale, dopodichè avremo
l’ipotireoidismo clinico fino al mixedema che è un segno conclusivo di
questa malattia.
Per quanto riguarda la distruzione della colloide si sa che inizialmente
vene considerata segregata e non è a contatto con il torrente
scaricato da www.sunhope.it
66
scaricato da www.sunhope.it
circolatorio per cui mantiene uno stato di isolamento, uno dei motivi
che potrebbero innescare la tireoidite di Hashimoto è che qualche
fenomeno di infiammazione possano portare alla liberazione di piccole
parti di tireoglobulina in circolazione quindi si ha la produzione di
anticorpi contro la tireoglobulina che è soprattutto captata da
macrofagi che produce le citochine INF-γ che porta all’attivazione di
CD4+ (linf.T) e quindi porta ad una distruzione di tipo cellulo-mediata
che è in parte mediata da macrofagi e in parte dalle NK che
distruggono le cellule.
Oppure si è ipotizzato che in presenza di particolari citochine come IL2 e INF-γ potremmo avere l’espressione di CD95 cioè di fas quindi
l’interazione diretta con i linfociti tireotossici che distruggerebbero con
meccanismo fas-fas ligando queste cellule, in sintesi vanno in
apoptosi.
Esiste un farmaco che si chiama amiodarone che viene usato molto
nei cardiopatici, ed è uno di quei farmaci che inattiva la 5-deiodinasi e
porta ad una produzione notevole di T4 senza portare alla produzione
di T3 inotre porta alla formazione di R-T3 che è una forma inattiva
dell’ormone tiroideo di conseguenza si avrà una produzione di ormone
inattivo che è causa di un ipotiroidismo.
Infine per quanto riguarda il gozzo è una dilatazione del parenchima
tiroideo che si manifesta come un rigonfiamento al livello del collo. Si
distinguono due forme, una forma diffusa e una nodulare che è legata
essenzialmente a situazioni iperplastici.
Per quanto riguarda le paratiroidi c’è da dire che sono connesse con
un aspetto più importante dell’omeostasi che è la regolazione del
calcio e del fosforo.
L’equilibrio del calcio e del fosforo è importantissimo perché senza di
essi e soprattutto di fosforo non sarebbe possibile la vita.
Il calcio è importantissimo per una serie di funzioni che riguardano i
sistemi e gli organi e le funzioni intracellulari con la traduzione del
segnale, mentre extracellulari sono ad esempio la metallizzazione
dell’osso dove si formano Sali di fosfato di calcio senza il quale l’osso
sarebbe flessibile come la gomma, importantissimo per la
coagulazione, per l’eccitabilità dell’attività neuromuscolare.
scaricato da www.sunhope.it
67
scaricato da www.sunhope.it
Per quanto riguarda le funzioni intracellulari essenzialmente connesse
con vari tipi di segnali come attivazione neuronale, contrazione
muscolare compresa quella del muscolo cardiaco, controllo della
secrezione degli ormoni infatti è un secondo messaggero per ormoni
e fattori di crescita, è importante per la regolazione e trascrizione, e
altre attività.
La sua concentrazione è compresa tra gli 8.5 e 10.5 ml/dl, dove una
metà è ionizzato mentre l’altra metà è legata a proteine dove quando
si valutano questi parametri bisognerà fare qualche correzione. Poi vi
è una certa quota in forma di sotto sali insolubili nel plasma.
A differenza del fosforo il calcio è uno ione prevalentemente
extracellulare fuori dalle cellule vi è una concentrazione di 2.5 mM di
cui la metà libero che è necessario per la mineralizzazione delle ossa
per l’eccitabilità delle membrane e la coagulazione. All’interno è
presente una quota nettamente minore cioè 100 nM e serve invece
per l’attivazione neuronale, per la traduzione dei segnali e altro.
Mentre il fosfato è presente in una concentrazione nettamente
maggiore dove i livelli vanno da 4,5 a 5,5 mg/dl rispetto al calcio in
quanto svolge la quota maggiore di funzioni rispetto al calcio. Infatti è
il componente maggiore dei fosfati, ma poi serve per una quantità
enorme di fenomeni come: legami ad alta energia per la fosforilazione
di proteine, funzioni strutturali etc…
E’ presente più o meno alla stessa concentrazione dentro e fuori la
cellula perché è il Puffer (accumulo) tampone nella fase disperdente
cellulare.
I livelli di calcio va corretto per la concentrazione di proteine, che si fa
con un algoritmo che serve a vedere la concentrazione di calcio
corretto in quanto l’albumina è sempre di più di 2g/dl inoltre perché
quando si effettuano le analisi normali si hanno le concentrazioni di
calcio libero ed è quella a cui bisogna attenersi se si vede che il calcio
incomincia a scendere al disotto dei 7 è un segno di allarme in quanto
sicuramente c’è qualche patologia in atto.
Le regolazioni di calcio e di fosforo avviene grazie: all’osso e al dente
per il calcio che è sotto forma di fosfato quindi il calcio che è presente
nel sangue è in equilibrio permanente con questa riserve enorme che
è rappresentata dall'osso. Naturalmente il calcio è eliminato attraverso
scaricato da www.sunhope.it
68
scaricato da www.sunhope.it
il rene e introdotto normalmente attraverso l’intestino.
La regolazione avviene attraverso 3 ormoni (Patatormone PTH,
Vitamina D e Calcitonina) dove il più importante di tutti è secreto dalle
paratiroidi PTH (organo pari, collocato in netta vicinanza alla tiroide),
la Vitamina D che serve soprattutto all’assorbimento e fissazione del
calcio e la Calcitonina che ha una funzione molto più ambigua infatti
svolgerebbe una funzione di antagonista con il paratormone è inoltre
un marker tumorali (delle cellule C tiroidee) di alcuni carcinomi tiroidei.
Il paratormone o PTH agisce soprattutto su organi quali ossa,
intestino e reni, si presenta come un ormone di 84 aminoacidi il quale
precursore inattivo viene tagliato in due frammenti uno attivo amminoterminale e un frammento inattivo carbossi-terminale. La sua
secrezione è direttamente regolata dai livelli di calcio 16 dove viene
regolato da un sensore intracellulare che riflette la concentrazione di
calcio sierico (in circolo) e in questo modo alti livelli di calcio
sopprimono il paratormone, bassi livelli di calcio inducono la
secrezione di paratormone che agisce sul rene ossa e intestino.
Sul rene svolge la funzione di aumentare l’escrezione urinaria del
cAMP, aumenta il riassorbimento del calcio soprattutto al livello del
tubulo distale, riduce il riassorbimento tubulare del fosfato (si deve
stare attenti se in una situazione di ipocalcemia e ipofosfatemia il
paratormone per ritenere il calcio fa perdere fosfato andando incontro
a ipofosfatemia molto gravi), inoltre aumenta l’attività del 1-αidrossilasi che trasforma il calcitriolo in calcitriolo attivo cioè in
vitamina D che è importante per controllare il riassorbimento di calcio
a livello dell’intestino.
All’intestino aumenta, indirettamente promuovendo l’attivazione della
vitamina D, il riassorbimento e il trasporto intestinale del calcio.
A livello delle ossa abbiamo recettori del paratormone che sono
presenti più sugli osteoblasti che su osteoclasti, in quanto gli
osteoblasti liberano delle citochine che fanno attivare gli osteoclasti.
C’è da fare un osservazione che di paratormone abbiamo ben tre
forme: uno secreto delle paratiroidi detto PTH che agisce su tutti i vari
bersagli come rene osso e intestino, poi abbiamo una proteina detta
PTH-related protein (PTHrP) la cui funzione è molto discussa in
quanto viene prodotta dai tumori soprattutto quelli che producono
scaricato da www.sunhope.it
69
scaricato da www.sunhope.it
metastasi osteolitiche, presenta dei recettori sui osteoclasti necessari
per promuovere l’osteolisi durante le metastasi osteolitiche, l’altra
forma PTHR1 sembra che promuove, da studi effettuati in laboratorio,
la genesi dei denti perché fa regredire l’osso mandibolare
consentendo la gemma dentaria di emergere inoltre sarebbe molto
importante in alcuni tumori perché è secreta e guida la transizione
epitelio mesenchimale che è quel fenomeno che nei tumori maligni
caratterizza la trasformazione del fenotipo fisso a fenotipo
metastatico.
Il paratormone agisce con due recettori per attivare la protein-chinasiC.
Le conseguenze del ipoparatiroidismo che in genere è l’ipocalcemia
(esiste anche una ipocalcemia dovuta ad altri fattori che in questo
caso è associato ad iperparatiroidismo) con il segno di Chvostek e di
Trousseau contrattura muscolare dovuta da ipolcemia, molto importati
sugli effetti cardiaci.
Esiste un vero ipoparatiroidismo dovuto a carenza di secrezioni di
ormone paratiroidei e uno pseudoipoparatiroidismo (PHP) dove gli
ormoni paratiroidei possono non funzionare perché non vengono
prodotti ma anche perché non c’è cAMP o manca l'adenilato ciclasi o
perché non funziona la proteina-G legata al recettore.
scaricato da www.sunhope.it
70