LICEO G. M. COLOMBINI
MATERIA: SCIENZE NATURALI
CLASSI: TERZE LICEO SCIENZE UMANE
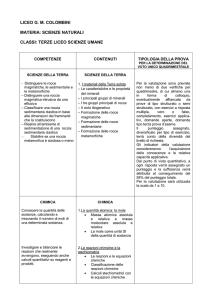
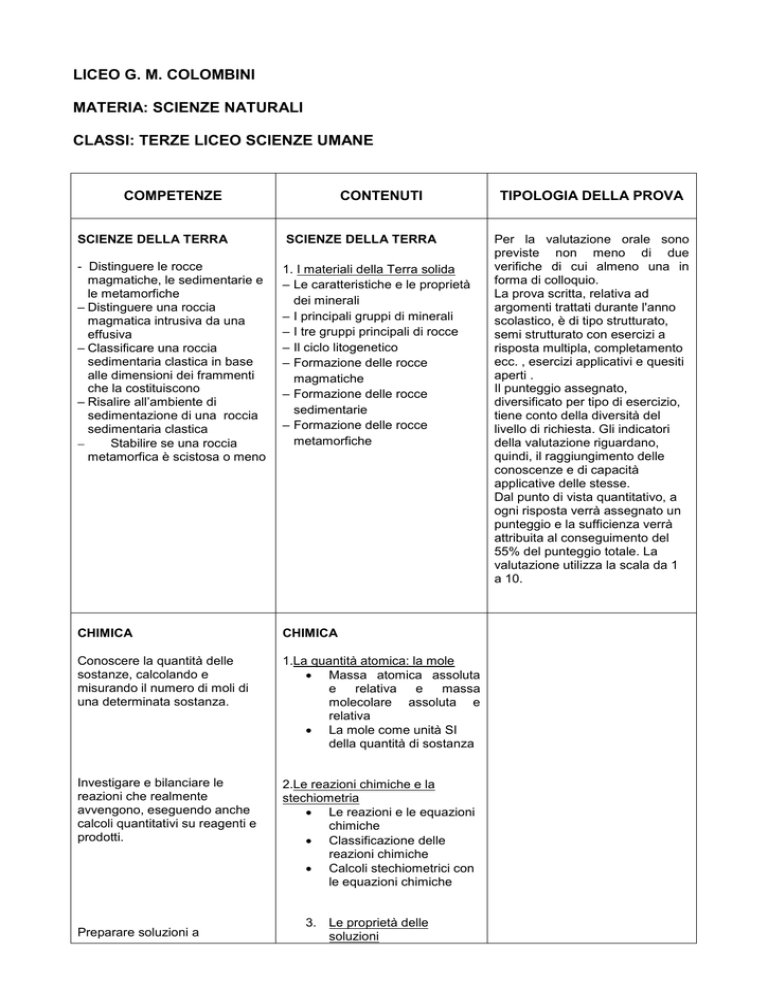
COMPETENZE
CONTENUTI
SCIENZE DELLA TERRA
SCIENZE DELLA TERRA
- Distinguere le rocce
magmatiche, le sedimentarie e
le metamorfiche
– Distinguere una roccia
magmatica intrusiva da una
effusiva
– Classificare una roccia
sedimentaria clastica in base
alle dimensioni dei frammenti
che la costituiscono
– Risalire all’ambiente di
sedimentazione di una roccia
sedimentaria clastica
Stabilire se una roccia
metamorfica è scistosa o meno
1. I materiali della Terra solida
– Le caratteristiche e le proprietà
dei minerali
– I principali gruppi di minerali
– I tre gruppi principali di rocce
– Il ciclo litogenetico
– Formazione delle rocce
magmatiche
– Formazione delle rocce
sedimentarie
– Formazione delle rocce
metamorfiche
CHIMICA
CHIMICA
Conoscere la quantità delle
sostanze, calcolando e
misurando il numero di moli di
una determinata sostanza.
1.La quantità atomica: la mole
Massa atomica assoluta
e relativa e massa
molecolare assoluta e
relativa
La mole come unità SI
della quantità di sostanza
Investigare e bilanciare le
reazioni che realmente
avvengono, eseguendo anche
calcoli quantitativi su reagenti e
prodotti.
2.Le reazioni chimiche e la
stechiometria
Le reazioni e le equazioni
chimiche
Classificazione delle
reazioni chimiche
Calcoli stechiometrici con
le equazioni chimiche
Preparare soluzioni a
3. Le proprietà delle
soluzioni
TIPOLOGIA DELLA PROVA
Per la valutazione orale sono
previste non meno di due
verifiche di cui almeno una in
forma di colloquio.
La prova scritta, relativa ad
argomenti trattati durante l'anno
scolastico, è di tipo strutturato,
semi strutturato con esercizi a
risposta multipla, completamento
ecc. , esercizi applicativi e quesiti
aperti .
Il punteggio assegnato,
diversificato per tipo di esercizio,
tiene conto della diversità del
livello di richiesta. Gli indicatori
della valutazione riguardano,
quindi, il raggiungimento delle
conoscenze e di capacità
applicative delle stesse.
Dal punto di vista quantitativo, a
ogni risposta verrà assegnato un
punteggio e la sufficienza verrà
attribuita al conseguimento del
55% del punteggio totale. La
valutazione utilizza la scala da 1
a 10.
concentrazione nota e spiegare
la solubilità nei solventi col
modello cinetico-molecolare.
Spiegare le proprietà delle tre
particelle che compongono
l’atomo
Determinare il numero di massa
e il numero atomico di un
elemento chimico e calcolare il
numero di neutroni presenti nel
nucleo conoscendo il suo
numero di massa e il suo numero
atomico.
Spiegare la struttura elettronica a
livelli di energia dell’atomo.
Riempire i vari orbitali di un
elemento in relazione al suo
numero atomico.
Individuare il comportamento
chimico di un elemento
Identificare gli elementi della
tavola periodica mediante il
numero atomico e stabilire la
massa atomica degli isotopi
componenti
Spiegare la relazione fra struttura
elettronica e posizione degli
elementi sulla tavola periodica
Descrivere le principali proprietà
periodiche che
confermano la struttura a strati
dell’atomo
Descrivere le principali proprietà
di metalli, semimetalli e non
metalli
Saper descrivere i tipi di legame
presenti in un composto chimico
Utilizzare le formule dei composti
inorganici per classificarli
secondo le regole della
nomenclatura sistematica e
tradizionale.
Saper assegnare la formula
esatta a una specie chimica in
Solubilità e temperatura
Concentrazioni di una
soluzione
4.Le particelle dell’atomo e i
modelli atomici
Le particelle subatomiche
(richiami)
L’identità chimica di un
atomo
Il modello atomico di Bohr
Il concetto di orbitale
5.La struttura dell’atomo
Le configurazioni
elettroniche
6.Il sistema periodico
La scoperta della legge
periodica
Periodicità di alcune
proprietà chimiche e
fisiche degli elementi
Metalli, semimetalli, non
metalli
7. I legami chimici
Origine e natura del
legame chimico
La regola dell’ottetto
La notazione di Lewis
Legame covalente
Legame ionico
Legame metallico
Interazioni tra molecole
8.Classificazione e nomenclatura
dei composti
Numero di ossidazione
Classificazione dei
composti inorganici
Nomenclatura tradizionale
e I.U.P.A.C
base alla sua denominazione
Saper attribuire l'esatta
denominazione secondo le
diverse nomenclature a una
specie chimica in base alla sua
formula
Saper scrivere le reazioni di
formazione dei composti
appartenenti alle diverse classi.
9.
Saper collegare le reazioni
esotermiche ed endotermiche ai
relativi grafici.
10.
Spiegare l’azione dei diversi
parametri che influenzano la
velocità di reazione
(temperatura, concentrazione,
pressione, superficie di contatto,
presenza dei catalizzatori).
Spiegare le proprietà dei sistemi
chimici all’equilibrio e risolvere
problemi riguardanti la costante
di equilibrio.
Spiegare le proprietà di acidi e
basi, mediante le teorie di
Arrhenius e di Brønsted-Lowry e
risolvere problemi quantitativi
riguardanti queste sostanze.
Calcolare il pH di soluzioni acide
e basiche (solo con acidi forti e
basi forti)
Identificare le reazioni di ossidoriduzione, bilanciarle col metodo
del numero di ossidazione.
Reazioni di preparazione
dei principali composti
inorganici
L’energia si trasferisce
Scambi di energia nelle
reazioni chimiche
La velocità di reazione
La velocità di reazione
La teoria delle collisioni e
del complesso attivato
I fattori che influenzano la
velocità delle reazioni
chimiche
11. L’equilibrio chimico
Le reazioni reversibili
Legge dell’equilibrio
chimico o legge
dell’azione di massa
Il Principio di Le Châtelier
12. Acidi e basi si scambiano
protoni
Proprietà chimiche degli
acidi e delle basi
Acido e base secondo le
teorie di Arrhenius e di
Bronsted - Lowry
Reazione acido – base
Il prodotto ionico
dell’acqua
La forza degli acidi e delle
basi
Il pH: significato e
importanza
13.
Le reazioni di ossidoriduzione
Ossidazione e riduzione
Bilanciamento delle
reazioni di ossido
riduzioni.