Capitolo primo
CENNI DI FISICA DEI METALLI
Intorno al nucleo che contiene praticamente tutta la massa dell’atomo esistono altre particelle: gli elettroni, di massa trascurabile rispetto a quella dei protoni o dei neutroni
(m = 9,1 x 10-28 grammi), dotati di carica elettrica d’ugual
entità, ma di segno opposto a quella dei protoni (e = - 1,60
x 10-19 coulomb).
10 3
FERMIONI
Seconda
generazione
BOSONI
terza
generazione
Bosone di Higgs
10 2
Z
W
10 1
Quark bottom
Quark charm
10 0
Particella tau
Quark strano
10 -1
Muone
Quark giù
10 -2
Quark su
10 -3
Elettrone
10 -4
FOTONI PRIVI DI MASSA
10 -10
10 -11
Nucleo
Atomo
Prima
generazione
Quark top
Massa (GeV)
L’ATOMO
La fisica moderna ha dimostrato che non è possibile farsi un’idea esatta di come sia realmente l’atomo, immaginato
dai filosofi dell’antica Grecia come la più piccola ed indivisibile particella della materia. Tuttavia, per spiegare molti
fenomeni fisici o chimici legati al comportamento della materia, è riconosciuta l’utilità di modelli più o meno semplificati, a condizione che si considerino come rappresentazioni
molto approssimate della realtà.
Così, se chiederete ad un fisico di descrivervi l’atomo, si
dilungherà soprattutto nella descrizione dei nuclei, cioè
dell’insieme di tutte le particelle che ne costituiscono la
massa. Scoprirete così che oltre ai protoni, ciascuno caratterizzato da una massa (m = 1,67 x 10-24 grammi) e da una
carica elettrica di segno convenzionalmente positivo (e = +
1,60 x 10-19 coulomb), esistono i neutroni, di circa ugual
massa, ma privi di carica. Protoni e neutroni sono a loro
volta costituiti da particelle più piccole: i quark e i gluoni
(figura 1.01). Ed ancora scoprirete che nel nucleo esistono
tante altre particelle, alcune molto più piccole dei protoni e
neutroni, il cui contributo alla massa totale dell’atomo è trascurabile, ma la cui esistenza e proprietà sono fondamentali
per comprendere l’intima essenza della materia (figura
1.02). Queste particelle subnucleari spesso sono state scoperte teoricamente, prima che sperimentalmente, attraverso
il puro calcolo matematico. Dunque, ciò che ad un primo
esame sembrava indivisibile vi apparirà sempre più frazionato, indefinito e difficile da comprendere.
Neutrino
muonico
Neutrino
elettronico
Fotone
Neutrino
Tau
Gluone
10 -12
Protone
I Fermioni si suddividono in Quark e Leptoni. Questi ultimi includono l’elettrone,
il muone, la particella tau e i tre tipi di neutrini
Figura 1.02. Particelle subatomiche. Fermioni e Bosoni.
Orbitali
Neutrone
Protone
Quark su
Gluone
Elettrone
Quark su
Quark giù
Figura 1.01. Rappresentazione moderna dell’atomo con le particelle fondamentali.
Tutte le particelle nucleari sono ammassate in uno spazio ridottissimo dove la densità della materia raggiunge valori da capogiro. Ricordate che la densità (d) è la quantità di
massa (m) dell’unità di volume (V), cioè:
d=
m
.
V
Nel nucleo dell’atomo di ferro, che contiene trenta neutroni
e ventisei protoni, e il cui volume è approssimativamente
4,19 x 10-33 mm3, la densità è di circa 100 000 tonnellate per
mm3. Tradotto in scala macroscopica ciò significa che se il
nucleo dell’atomo di ferro fosse grande quanto una palla da
tennis, peserebbe alcuni miliardi di tonnellate.
Gli elettroni interessano relativamente poco al fisico nucleare e per saperne di più dovremo rivolgerci al chimico
teorico. Con sorpresa constateremo come il chimico consideri il nucleo dell’atomo di secondaria importanza, tenendone conto soltanto perché contiene un certo numero di protoni. Infatti, il numero di protoni caratterizza la specie o
l’elemento chimico.
Il chimico teorico è fondamentalmente interessato agli
elettroni, che ci descrive minuziosamente, con tale pignoleria e tanto entusiasmo, da lasciarci sgomenti.
Così apprendiamo che gli elettroni, oltre alle proprietà
che loro derivano dalla natura corpuscolare, perché dotati di
massa, hanno anche proprietà ondulatorie, simili a quelle
dell’energia elettromagnetica, cioè come quelle della luce.
Perciò il loro moto intorno al nucleo non può essere descritto dalla meccanica classica, ma dalla meccanica quantistica,
che ragiona in termini probabilistici. Per questa ragione non
sapremo mai con esattezza dove un elettrone si trovi rispetto al nucleo e quale traiettoria stia percorrendo in un dato
istante, ma potremo affermare che la probabilità di trovarlo
nell’intorno del nucleo è definibile in termini matematici.
La funzione matematica che descrive questa probabilità si
definisce orbitale. Intuitivamente l’orbitale rappresenta la
parte di spazio (volume), talvolta di forma assai complicata,
entro la quale si può trovare, con una certa probabilità,
-1-
l’elettrone dell’atomo esaminato. In altri termini l’elettrone
potrà esser vicino o lontano dal nucleo e muoversi da un
punto all’altro secondo traiettorie disparate (figura 1.03). Se
immaginiamo di poter riprendere continuamente la sua posizione su una lastra fotografica, otterremmo la rappresentazione dell’orbitale, che sembrerà una nuvola di forma anche
complessa, sfumata all’infinito. Per questo si parla di nuvola elettronica che avvolge il nucleo dell’atomo.
quantico è ben rappresentato in figura 1.05. Si desume che
l’atomo, rappresentato con tutti gli orbitali disponibili, assume una forma quasi sferica di cui è possibile calcolare il
diametro medio. Tale modello è puramente ideale, ma utile
per definire le dimensioni dell’atomo.
Figura 1.05. Atomo con gli orbitali che completano il secondo
livello quantico.
Figura 1.03. Rappresentazione del moto caotico degli elettroni
intorno all’atomo, secondo la meccanica quantistica.
L’orbitale assume un volume definito, quando si fissa un
valore della probabilità. Per esempio la certezza di trovare
l’elettrone intorno al nucleo in un certo istante (probabilità
al 100%) si ha, quando è infinito il volume che l’elettrone
può occupare, ma se si riduce il valore della probabilità al
95%, si ottiene un volume di dimensioni di circa 10-27 mm3,
che in prima approssimazione si può considerare il volume
dell’atomo.
Z
X
Y
Orbitale s
Orbitale pz
Orbitale p x
Orbitale py
Orbitale d x2y2
Orbitale d z2
Orbitale d xz
Orbitale d xy
Orbitale dyz
Tutto questo è molto bello, ma serve soprattutto al chimico per spiegare come gli atomi si leghino fra loro per
formare le molecole, di cui è possibile definire le proprietà
attraverso lo studio dei tipi di legame tra gli atomi. Infatti, i
legami dipendono proprio dagli elettroni, da come sono disposti intorno al nucleo (configurazione elettronica
dell’atomo) e dalle interazioni reciproche e con i nuclei di
due o più atomi. È un modello troppo complicato per il metallurgico che generalmente ragiona in scala macroscopica,
ovvero studia come grandissime quantità di atomi si leghino
fra loro, soprattutto nei due stati fondamentali della materia:
il liquido ed il solido.
Perciò chiediamo ad un insigne metallurgista come rappresenti gli atomi nei metalli, che sono appunto il tipo di
materia che ci accingiamo a studiare.
«Sfere elastiche», è la risposta.
C’è da rimanerci male!
«Sfere elastiche con massa pari alla somma della massa dei
protoni e neutroni presenti nel nucleo e diametro pari al diametro medio degli orbitali più esterni».
«Ma come! non servono a nulla tutte le nozioni di cui i fisici
ed i chimici ci hanno riempito la testa?»
«La conoscenza più approfondita è sempre utile, ed è indispensabile ai chimici ed ai fisici per descrivere le proprietà
più recondite della materia. Ma a noi metallurgisti interessa
poco conoscere come l’atomo sia fatto o come due o pochi
più atomi possano legarsi per dare molecole; a noi interessa
soprattutto come gli atomi, in grande quantità, si dispongano nello spazio ed interagiscano fra loro, perché proprio
dalla loro disposizione spaziale ed interazione reciproca dipendono le caratteristiche dei metalli».
Figura 1.04. Orbitali atomici fino al terzo livello quantico.
I vari orbitali assumono le forme illustrate in figura 1.04 e il
loro insieme, fino al completamento del secondo livello
-2-
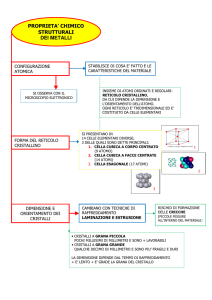
LO STATO METALLICO
Il termine metallico è correntemente usato con due significati diversi:
• quello chimico, che indica le proprietà di un certo elemento, per esempio la capacità di combinarsi con
l’ossigeno per dare un ossido. Ci si riferisce perciò a
proprietà che competono ai singoli atomi e che dipendono dalla loro configurazione elettronica (vedi il sistema
periodico degli elementi);
• quello metallurgico, usato per caratterizzare certi materiali, cioè per descriverne alcune proprietà fisiche, dipendenti dall’aggregazione degli atomi: per esempio la
lucentezza, la conduttività elettrica, la duttilità, che sono
proprietà non attribuibili ad un singolo atomo.
Nei metalli l’aggregazione avviene fra atomi e non fra
molecole, attraverso un legame debole che coinvolge ogni
atomo dell’aggregato; perciò i legami tra i singoli atomi non
sono mai direzionali, come nel caso delle ceramiche, ma
delocalizzati, indipendentemente dallo stato fisico del metallo (gassoso, liquido o solido - figura 1.06).
Allo stato liquido gli atomi sono in stretto contatto fra
loro, con forze interatomiche già cospicue, ma tali da lasciar
loro un’ampia possibilità di movimento, soprattutto vibrazionale e rotazionale. Possiamo rappresentare il modello
atomico d’un metallo allo stato liquido con biglie che riempiano completamente un cassetto sottoposto a forti vibrazioni. In tale situazione le biglie (atomi) vibrano, ruotano e
si urtano energicamente, ma traslano lentamente, sebbene
non siano vincolate, perché lo spazio libero fra loro è minimo.
Nei metalli allo stato solido gli atomi, pur vibrando e
ruotando, secondo la temperatura, sono saldamente vincolati in posizioni spaziali ben definite, costantemente ripetute
nello spazio, e non possono traslare se non assai lentamente.
In altri termini gli atomi dei metalli costituiscono un reticolo cristallino (figura 1.07).
Piano atomico
Nodo
z
GAS
y
Filare
x
LIQUIDO
Reticolo cristallino
SOLIDO
Figura 1.07. Esempio di reticolo cristallino rappresentato dal
reticolato di rette le cui intersezioni (nodi) rappresentano la posizione del baricentro dei singoli atomi o ioni.
Figura 1.06. Rappresentazione schematica dei tre stati della materia.
Allo stato solido, che ci interessa maggiormente, il legame fra gli atomi avviene tramite gli elettroni di valenza di
ciascun atomo, cioè degli elettroni degli orbitali più esterni,
che sono messi in compartecipazione con quelli di tutti gli
altri atomi dell’intero aggregato. Dunque ogni atomo è legato debolmente al vicino, ma assai saldamente nell’intera
struttura, perché soggetto ad un elevatissimo numero di legami, seppur deboli.
Questo modello spiega con buona approssimazione molte
caratteristiche dei metalli allo stato solido, come la conduttività elettrica, resa possibile dalla delocalizzazione degli
elettroni di legame, o la duttilità, dovuta allo scorrimento di
blocchi di atomi, lungo particolari piani, reso possibile dai
deboli legami reciproci, senza che avvenga la rottura del
legame metallico complessivo.
Allo stato gassoso i metalli sono costituiti da singoli atomi relativamente distanti fra loro, cioè liberi di traslare
rapidamente, ruotare e vibrare energicamente (energia cinetica), con scarse interazioni reciproche, fatti salvi gli urti
elastici ed anelastici.
L’energia cinetica aumenta con la temperatura del gas,
mentre il numero e la forza degli urti aumentano con la
pressione e la temperatura del gas a volume costante.
CRISTALLI METALLICI
Nei corpi solidi, che la chimica definisce cristalli, gli
atomi, gli ioni o le molecole (particelle) sono disposti nello
spazio con grande regolarità geometrica o periodicità tridimensionale, tale da costituire un reticolo spaziale: essi sono
disposti su piani tra loro paralleli (piani atomici) e
s’allineano secondo rette, giacenti sui piani e parallele fra
loro (filari).
Tutto l’edificio cristallino macroscopico, che può assumere
ogni forma (figura 1.08), può esser ottenuto per aggregazione di celle elementari (minor gruppo di atomi, che mantiene costante la simmetria del reticolo cristallino), che sono i
mattoncini dell’edificio cristallino (figura 1.09).
Spesso il reticolo cristallino è rappresentato da un reticolato
di rette che s’intersecano in punti (nodi), che rappresentano
le posizioni del baricentro dei singoli atomi.
Tutti i metalli allo stato solido sono corpi cristallini,
cioè formati da cristalli la cui simmetria, desumibile dalla
cella elementare, è di quattro tipi fondamentali: esagonale
compatta, esagonale semplice, cubica corpo centrato e cubica facce centrate (figura 1.09).
-3-
Esagonale compatto
Cubico corpo centrato (ccc)
Esagonale normale
Energia negativa 0 Energia positiva
Figura 1.08. Esempio d’un cristallo macroscopico ottenuto per
aggregazione di molte celle elementari con simmetria cubica.
nuclei positivi ed elettroni negativi) e le forze repulsive (per
esempio alla repulsione tra cariche elettriche dello stesso
segno, ovvero cariche dei nuclei dei singoli atomi).
È interessante constatare che la forza attrattiva tra due masse è proporzionale al loro prodotto ed inversamente proporzionale al quadrato della distanza tra i baricentri delle masse
stesse (legge di Newton).
Analogamente due cariche elettriche puntiformi di segno
opposto s’attirano o di ugual segno si respingono con forza
proporzionale al prodotto delle cariche ed inversamente
proporzionale al quadrato della distanza tra le cariche stesse
(legge di Coulomb).
Ed ancora, l’interazione tra due magneti s’interpreta, in analogia alle forze gravitazionali ed elettriche, come azione del
campo magnetico generato da un magnete ed agente
sull’altro.
Forse questo significa che la massa, l’elettricità e il magnetismo sono espressioni di un’unica realtà fisica
dell’universo in cui materia, energia, spazio e tempo sono
un’unica cosa? Le più recenti teorie fisiche ne dimostrano
l’attendibilità. Non solo, hanno anche unificato le forze deboli con le forze elettromagnetiche, salvo quella gravitazionale e l’interazione “forte”, che ancora sfuggono ad una teoria d’unificazione globale.
A distanza relativamente grande prevalgono le forze attrattive; a piccola distanza quelle repulsive. Perciò esisterà una
posizione d’equilibrio in cui l’energia del sistema sarà minima (figura 1.11).
Cubico facce centrate (cfc)
Figura 1.09. Celle elementari che rappresentano le principali
simmetrie dei reticoli cristallini dei metalli.
Nei cristalli metallici gli atomi sono a stretto contatto fra
loro e tendono ad assumere una configurazione di massima
costipazione (figura 1.10).
Distanza d’equilibrio
Forza attrattiva
Energia di legame
Forza repulsiva
Distanza tra gli atomi
Figura 1.11. Distanza d’equilibrio tra due atomi adiacenti in un
reticolo cristallino.
Figura 1.10 A. Disposizione degli atomi in un reticolo cubico
corpo centrato (ccc).
Figura 1.10 B. Disposizione degli atomi in un reticolo cubico facce centrate (cfc).
La distanza fra i nuclei è definita dall’equilibrio tra le
forze attrattive (per esempio al legame degli elettroni di valenza, all’attrazione elettrica tra cariche di segno opposto –
TRASFORMAZIONI ALLOTROPICHE
Il lavoro necessario per distruggere un reticolo cristallino cioè per allontanare gli atomi a distanza infinita, corrisponde all’energia del reticolo. Oltre che dal tipo di atomo,
essa dipende soprattutto dalla distanza interatomica ed in
modo trascurabile dalla simmetria del reticolo cristallino.
Pertanto, se le distanze tra atomo ed atomo non variano apprezzabilmente, il cristallo potrà assumere facilmente diverse simmetrie reticolari. Ciò si verifica effettivamente in
molti metalli, che assumono un reticolo cristallino di diversa simmetria in funzione della temperatura. Questo fenomeno si definisce polimorfismo e le diverse forme cristalline
si dicono allotropiche.
Il ferro possiede due forme allotropiche (figure 1.10A e
10b): la cubica corpo centrato (ccc), stabile a bassa temperatura (fino a 911 °C - Fe α e Fe β) o ad alta temperatura
(tra 1392 °C e la temperatura di fusione, 1536 °C - ferro δ)
-4-
e la cubica facce centrate (cfc), stabile nell’intervallo tra
911 e 1392 °C (ferro γ).
Tale proprietà, unita alla grande differenza di solubilità
del carbonio nei due reticoli cristallini α e γ, conferisce agli
acciai molte caratteristiche ottenibili con i trattamenti termici.
CARATTERISTICHE MECCANICHE DEI CRISTALLI
Supponiamo di disporre d’una provetta di ferro purissimo, costituita da un unico cristallo, e di sottoporla, in una
normale prova di trazione, ad una forza applicata alle due
estremità. Essa si allunga proporzionalmente alla forza applicata. Se la forza non supera un valore critico, la barretta
ritornerà esattamente alla geometria iniziale al cessare della
sollecitazione (si definisce sollecitazione il rapporto tra la
forza applicata e la superficie sulla quale essa agisce). In
questo caso la forza di trazione allontana gli atomi nel reticolo cristallino, spostandoli dalla posizione d’equilibrio,
alla quale essi tendono al cessare della sollecitazione. Il cristallo si comporta elasticamente (figura 1.12).
Figura 1.13. La deformazione plastica di un monocristallo è accompagnata da scorrimenti secondo piani preferenziali e cambiamenti d’orientazione del reticolo cristallino.
F
Se si sollecita un cristallo metallico oltre il limite elastico,
esso si deforma in modo permanente (deformazione plastica), allungandosi molto più di quanto non indichi il calcolo
teorico. Il meccanismo della deformazione plastica è diverso da quello della deformazione elastica. Infatti, avviene per
slittamento di blocchi di atomi lungo i piani più rigidi del
cristallo, ovvero quelli con maggior densità atomica (figura
1.13), mentre il meccanismo della deformazione elastica
avviene per allontanamento degli atomi dalla loro posizione
nodale.
Piano cristallografico 011
Z
Piano cristallografico 001
Z
Figura 1.12. Rappresentazione schematica del comportamento
elastico dei cristalli metallici.
Tutti i metalli si comportano elasticamente entro certi
limiti di sollecitazione applicata. Essi sono tanto meno elastici (o più rigidi) quanto meno si allungano a parità di dimensioni della provetta e della sollecitazione applicata. Tale caratteristica è misurata dal modulo elastico, che rappresenta la pendenza della retta nel grafico allungamento / sollecitazione, ottenibile nelle normali prove di trazione. Il
modulo elastico è una caratteristica costante di ogni metallo, funzione della sola temperatura, perché dipende soltanto
dall’energia del reticolo cristallino, che sappiamo non variare significativamente anche quando il reticolo subisce trasformazioni allotropiche.
Se si calcola la forza necessaria per allontanare gli atomi
nel cristallo ccc del ferro, cioè si calcola la sommatoria delle energie di ogni singolo legame, divise per lo spostamento
degli atomi, e si paragona a quella misurata sperimentalmente su provette monocristallo di ferro purissimo, si trova
un perfetto accordo.
Il valore della sollecitazione massima entro cui il comportamento dei cristalli è elastico, si definisce limite elastico, che varia secondo lo stato metallurgico del solido cristallino (ricotto, normalizzato o temprato).
X
Y
X
Y
Cella elementare ccc
Cella elementare ccc
L
L
√2 L
Figura 1.14. Proiezioni dei piani cristallografici 001 e 011 del
reticolo ccc, utili per il calcolo della densità atomica.
Nel reticolo cristallino ccc i piani con maggior densità atomica sono quelli ortogonali alle facce del cubo e paralleli
alla diagonale di ogni faccia (piani cristallografici 110, 101
e 011), e sono i più rigidi perché contengono un maggior
numero di legami.
Osservando la figura 1.14 si può facilmente calcolare la
densità atomica dei piani 011, 101 e 110, uguale a 1,41 atomi/L2, dove L è il lato della cella ccc. Quella dei piani che
contengono le facce del cubo (001, 010 e 100) è uguale a 1
atomo/L2. Infatti, la proiezione ortogonale del piano 011
-5-
contiene 4/4 +1 = 2 atomi in un’area di 1,41 L2, mentre la
proiezione ortogonale del piano 001 contiene 4/4 = 1 atomo
in un’area L2.
Ripetendo tale operazione per ogni altro piano del reticolo
ccc, si troverà una densità sempre inferiore a quella dei piani 110, 101 e 011.
σ
τ
atomi in posizioni adiacenti nel reticolo cristallino. Le dislocazioni assumono forme e definizioni diverse, secondo la
loro disposizione geometrica. Per esempio si dicono dislocazioni a «T» quelle dove mancano atomi lungo più filari
adiacenti su un unico piano; dislocazioni ad «elica», dove
mancano atomi lungo più filari in posizioni nodali che collegate fra loro darebbero luogo ad una spirale; dislocazioni
a «forbice», quelle dove mancano atomi lungo almeno due
piani obliqui; dislocazioni «complesse», quelle dove mancano atomi lungo linee o superfici di forma non definibile.
F
α
σ
F τ’
τ
σ’
σ
F
τ
σ
τ
Figura 1.15. Componenti di trazione (σ) e taglio (τ) della forza
(F), che genera la deformazione plastica permanente del cristallo,
quando l’intensità sollecita il metallo oltre il suo limite elastico.
Lo slittamento dei blocchi di atomi, che genera la deformazione plastica, disassa la forza di trazione F e crea un
momento, che fa ruotare il cristallo. Ciò lo rende più resistente ad un’ulteriore deformazione.
La forza F di trazione del cristallo rappresentata in figura
1.15, può esser scomposta nelle due componenti σ, che tende ad allontanare i piani a 45° rispetto alle facce del cubo
(componente di trazione), e τ, che tende a farli slittare
(componente di taglio).
La deformazione plastica avviene quando gli atomi, sotto
l’azione della componente σ s’allontanano quanto basta per
superare le linea tratteggiata e non essere più incastrati gli
uni negli altri. Ciò è possibile solo quando σ raggiunge un
valore di soglia, che dipende dall’intensità della forza madre F. Prima che il valore di soglia sia raggiunto, la deformazione del cristallo sarà solo elastica.
La deformazione plastica genera una rotazione α che fa diminuire la componente σ (figura 1.16) e predispone il cristallo a reggere una forza di trazione F maggiore prima di
cedere ad un ulteriore slittamento.
Ricalcolando le forze necessarie per fare avvenire lo
slittamento di un pacchetto di atomi nel cristallo perfetto, si
trovano valori teorici di circa 100÷1000 volte superiori a
quelli sperimentali. Dunque i cristalli perfetti non sono un
modello fisico che possa spiegare con sufficiente approssimazione le proprietà meccaniche dei metalli.
DISLOCAZIONI
Per spiegare l’incongruenza tra i risultati teorici e sperimentali nella deformazione plastica dei cristalli, i metallurgisti ipotizzarono l’esistenza di alcuni difetti, che definirono dislocazioni, cioè la mancanza d’un certo numero di
Figura 1.16. La rotazione α del cristallo durante la deformazione
plastica predispone il cristallo a reggere ad una sollecitazione
maggiore prima di cedere ulteriormente per diminuzione della
componente σ.
Centro della dislocazione
Figura 1.17. Esempio di dislocazione a T. Nel reticolo cristallino, qui rappresentato in sezione retta, mancano un
certo numero di atomi lungo un filare.
In figura 1.17 è rappresentata schematicamente una dislocazione a T. Lungo la dislocazione gli atomi sono più
distanti rispetto alle posizioni d’equilibrio. I filari adiacenti
alla dislocazione sono deformati per un certo numero di
piani atomici, fin dove gli atomi ritornano alla corretta distanza reticolare in cui l’energia dell’atomo è minima. Al
centro della dislocazione esiste una buca d’energia potenziale, non occupata da alcun atomo. In tale situazione gli
atomi nei pressi della dislocazione, per compiere uno slittamento d’un passo reticolare devono superare un gradino
d’energia (energia d’attivazione) molto più basso di quello
-6-
Energia d’attivazione
Energia potenziale
Reticolo cristallino perfetto
degli atomi lontani dalla dislocazione o nel cristallo perfetto
(figure 1.18 A e B).
zione del cristallo sono sufficientemente in accordo con
quelli sperimentali.
Con l’avvento del microscopio elettronico a trasmissione (TEM) si sono potute realmente vedere le dislocazioni,
dimostrando definitivamente la correttezza della teoria che
ne postulava l’esistenza.
Quando gli atomi adiacenti cadono nella dislocazione
sotto l’azione di una sollecitazione, lasciano libera la loro
posizione. Relativamente parlando, è come se la dislocazione traslasse nel cristallo in direzione opposta allo slittamento degli atomi. Si parla dunque di movimento delle dislocazioni. Quando molte dislocazioni raggiungono l’estremità
del cristallo esso apparirà deformato anche macroscopicamente (figura 1.13).
La fisica moderna ha dimostrato che le dislocazioni si
formano sotto l’azione delle sollecitazioni, sia esterne che
interne. Le sollecitazioni esterne dipendono dalle condizioni
d’esercizio o di prova del nostro oggetto; quelle interne, generate da forze che agiscono in campo elastico e definite
tensioni interne, sono la conseguenza della storia termica
e/o meccanica del pezzo. La figura 1.19 illustra il meccanismo di formazione e propagazione d’una dislocazione a T.
Forza di taglio
Figura 1.18 A. Distribuzione dell’energia potenziale in un reticolo cristallino perfetto.
Centro della dislocazione
A
Dislocazione
B
Energia potenziale
Energia d’attivazione
della dislocazione
C
Figura 1.19. Meccanismo di formazione e propagazione di una
dislocazione a T.
Figura 1.18 B. Distribuzione dell’energia potenziale in un
reticolo cristallino contenente una dislocazione a T.
Affinché un atomo adiacente possa cadere nella dislocazione compiendo uno slittamento reticolare è necessaria una
sollecitazione di circa 100÷1000 volte inferiore a quella teorica per il cristallo perfetto. Accettando l’esistenza delle
dislocazioni, i valori teorici della resistenza alla deforma-
Se si applica una forza di taglio al cristallo (figura 1.19 A),
metà del piano atomico più esterno è spinto verso l’interno
(figura 1.19 B), fino a scontrarsi con il semipiano successivo, che si taglia lungo un filare, mentre il semipiano più esterno lo sostituisce (figura 1.19 C). Se la sollecitazione
persiste, la dislocazione continua a propagarsi con lo stesso
meccanismo, fino a raggiungere l’estremità opposta del cri-
-7-
AUTODIFFUSIONE
Se depositiamo per via elettrolitica uno strato di rame
radioattivo su una lamina di rame puro normale, otterremo
una provetta di rame caratterizzata da una faccia radioattiva
e l’altra no. Dopo un certo tempo, più o meno lungo secondo la temperatura e gli spessori della lamina e dello strato
depositato, si constata che tutta la provetta è divenuta uniformemente radioattiva. Ciò significa che tutti i nuclidi radioattivi si sono uniformemente distribuiti all’interno
dell’intera provetta per il fenomeno dell’autodiffusione (figura 1.20).
La velocità di diffusione degli atomi misurata sperimentalmente è molto più elevata di quella calcolata teoricamente
per un cristallo perfetto od anche in presenza di numerose
dislocazioni. Perciò è stata postulata la teoria delle vacanze
(da vacuum = vuoto), secondo la quale mancherebbero ogni
tanto alcuni atomi nelle posizioni nodali del reticolo cristallino. Gli atomi avrebbero dunque un maggior grado di libertà e possibilità di diffondere, come le 15 tessere di quel gioco con sedici caselle, di cui una vuota, che consente la traslazione di ogni tessera in una qualsiasi posizione, purché si
LEGHE
La fisica definisce sistema tutto ciò che è oggetto delle
nostre osservazioni ed è limitato da confini definiti.
Ogni parte del sistema, chimicamente e fisicamente omogenea, perfettamente distinguibile e divisa dalle altre
parti da una superficie di separazione, si definisce fase.
Si definisce lega un aggregato di atomi di due o più elementi chimici che abbia caratteristiche metalliche. Dal
punto di vista chimico le leghe possono essere soluzioni o
miscugli.
Allo stato liquido le leghe sono per lo più soluzioni, cioè
costituite da un’unica fase liquida, dove gli atomi del soluto
(elemento chimico presente in minor quantità) sono omogeneamente dispersi tra quelli del solvente (elemento chimico
presente in maggior quantità).
Allo stato solido le leghe possono esser soluzioni solide
o miscugli; nel primo caso sono costituite da un’unica fase
solida, mentre nel secondo caso da due o più fasi solide, indipendentemente dal loro stato di dispersione.
Lamina di rame appena
placcata con rame radioattivo
Se la sollecitazione che ha generato la dislocazione è
una tensione interna, si estinguerà totalmente non appena la
dislocazione si sarà propagata d’un parametro reticolare,
come nel caso di una molla precompressa, quando
un’estremità non sia più vincolata.
Questo fenomeno è sfruttato per la distensione dei metalli, sia con i trattamenti termici che con vibrazioni di risonanza applicate esternamente (VSR – Vibration Stress Relive). Durante i trattamenti termici di distensione la resistenza
allo snervamento del metallo diminuisce, con l’aumentare
della temperatura, fino al valore della tensione da scaricare.
In tale condizione avviene lo slittamento del cristallo e
l’annullamento della tensione interna. Con la tecnica VSR si
eleva la tensione locale al valore della resistenza allo snervamento.
Dal punto di vista fisico le dislocazioni sono veri e propri spazi vuoti, dove, per il fenomeno della diffusione, possono accumularsi «impurezze», che talvolta sono la causa
della fragilità degli acciai.
abbia la pazienza di progredire un passo dopo l’altro (figura
1.21).
Atomi di rame radioattivi
Atomi di rame normali
Lamina di rame placcata con
rame radioattivo e riscaldata
a 540 °C per 2 ore
stallo e con numerose altre dislocazioni (treno di dislocazioni) deforma microscopicamente il cristallo.
I metalli in cui le dislocazioni si propagano con difficoltà si deformano pure con difficoltà: sono i metalli più duri e
resistenti. Infatti la durezza misura la resistenza che un metallo oppone alla deformazione plastica.
Dunque è possibile aumentare la durezza dei metalli ostacolando il moto delle dislocazioni.
Poiché nei cristalli non esistono i semafori che regolano il
traffico delle dislocazioni, il metodo più semplice per indurire un metallo è quello di generare quante più dislocazioni
possibile, che, giungendo e muovendosi in ogni direzione, si
ostacolano
mutualmente.
Ciò
avviene
durante
l’incrudimento per deformazione plastica a freddo dei metalli. Più incrementa l’incrudimento più il metallo
s’indurisce per l’incremento del numero delle dislocazioni
ed anche per l’orientamento dei cristalli deformati. Un ulteriore tentativo di deformazione, quando è esaurita tutta la
riserva plastica del metallo, porta alla frattura duttile per
coalescenza di microvuoti, favoriti anche dall’impilamento
delle dislocazioni.
Figura 1.20. Schema del fenomeno dell’autodiffusione, verificato
sperimentalmente.
-8-
1
4
2
8
6
5
3
7
9
10
Figura 1.21. Diffusione d’un atomo facilitata dalla presenza
d’una vacanza.
Le soluzioni solide possono essere soluzioni di sostituzione o soluzioni interstiziali.
Nelle prime gli atomi di soluto possono sostituire un certo
numero di atomi di solvente nel reticolo cristallino ospite.
Ciò è possibile quando gli atomi di solvente e di soluto hanno diametro medio non troppo diverso (figura 1.22).
a
più di quanto non facciano le distorsioni reticolari dovute
agli atomi di soluto. Tuttavia non bloccano le dislocazioni,
che possono aggirare l’ostacolo tramite un percorso tortuoso e più lungo. Per questa ragione le leghe soprassature, con
molti precipitati, sono più dure e resistenti del metallo base.
In particolare lo sono se la fase precipitata è finemente dispersa nella matrice.
Con un opportuno trattamento termico (tempra di solubilizzazione), che sfrutta la variazione di solubilità con la
temperatura di alcuni elementi nelle leghe metalliche, è possibile mantenere in soluzione soprassatura alcuni elementi
di lega, anche a temperatura ambiente (figura 1.24 A).
b
A
B
C
D
Figura 1.22. Soluzioni solide di sostituzione. Gli atomi di soluto
con diametro maggiore di quelli del reticolo ospite generano una
distorsione locale del reticolo cristallino.
Nelle seconde gli atomi di soluto sono così piccoli rispetto a
quelli di solvente da potersi inserire negli spazi vuoti (interstizi) tra atomo ed atomo del reticolo cristallino (figura
1.23).
Figura 1.24. Schema del processo d’invecchiamento, di una lega
soprassatura (A), con nucleazione indurente (B e C) e separazione finale del precipitato (D).
Figura 1.23. Soluzione solida interstiziale. L’atomo di soluto genera sempre una distorsione locale del reticolo cristallino.
La presenza del soluto nel reticolo cristallino provoca
sempre una piccola distorsione locale, che ostacola il movimento delle dislocazioni, sebbene modestamente, perché
le dimensioni delle dislocazioni sono molto maggiori della
distorsione locale.
Dunque le leghe allo stato ricotto (condizioni tendenti
all’equilibrio) sono sempre più dure del metallo base puro.
INDURIMENTO PER PRECIPITAZIONE
Si definisce solubilità il numero massimo di atomi, o la
concentrazione percentuale di soluto, generalmente espressa
in parti in peso, che può sostituire gli atomi di solvente od
inserirsi negli interstizi del reticolo cristallino del solvente.
La solubilità è funzione della temperatura e nei metalli cresce sempre con l’aumentare della temperatura stessa.
In condizioni d’equilibrio, se la quantità di soluto supera
la solubilità alla temperatura del sistema, si separa (precipita) una nuova fase (figura 1.24 D), che può essere costituita
da soluto puro o da una soluzione solida ricca di soluto. Affinché avvenga la precipitazione è necessario che si formi
un primo nucleo del nuovo cristallo di dimensioni cospicue
e tali da consentire l’accrescimento. Il nuovo cristallo ha
dimensioni paragonabili ad una montagna se confrontato
con quelle delle dislocazioni. Dunque ne ostacola il moto
In questo stato le leghe sono particolarmente tenere, perché
non esiste alcun oggettivo impedimento al moto delle dislocazioni, salvo le piccole distorsioni reticolari dovute alla
presenza degli atomi di soluto. Possiamo immaginare un
effetto analogo paragonando le distorsioni reticolari a piccoli ciottoli sulla strada liscia e la dislocazione ad una grande ruota di trattore. L’impedimento è trascurabile.
Dopo un blando riscaldamento (invecchiamento), che
favorisce la diffusione degli atomi, nelle leghe soprassature
s’assiste alla nucleazione di precipitati. Un discreto numero
d’atomi di soluto si raggruppano e costituiscono un aggregato di celle elementari del nuovo cristallo, che, dopo accrescimento, dovrebbe dar luogo al vero precipitato. Finché il nucleo del nuovo cristallo non s’accresce oltre una
certa dimensione, mantiene l’allineamento dei filari nel reticolo cristallino del solvente (coerenza o semicoerenza –
figura 1.24 B e C) e genera un’enorme distorsione reticolare, che blocca attivamente il moto delle dislocazioni. Perciò
le leghe sottoposte al trattamento di tempra di solubilizzazione ed invecchiamento (bonifica), possono diventare
molto dure.
I nuclei, che mantengono la coerenza o la semicoerenza con
il cristallo ospite, si definiscono zone di Guinier-Preston,
dal nome dei due fisici che per primi le hanno studiate e descritte.
Se s’insiste nel riscaldamento, le zone di zone di Guinier-Preston degradano in precipitati incoerenti, incapaci di
bloccare le dislocazioni; perciò la durezza del metallo decresce (iperinvecchimento).
-9-
INDURIMENTO CON TEMPRA MARTENSITICA
Con altri trattamenti termici che sfruttano le trasformazioni allotropiche del metallo (tempra martensitica), in
alcune leghe è possibile generare nuove fasi, metastabili a
temperatura ambiente e caratterizzate da reticoli cristallini
tetragonali, che non possiedono piani preferenziali di scorrimento e dove ogni movimento delle dislocazioni è fortemente impedito. In queste leghe la massima durezza si manifesta allo stato di piena tempra.
Altri trattamenti termici sfruttano entrambi i fenomeni
della variazione della solubilità e della trasformazione allotropica (figura 1.25), conferendo alle diverse leghe tutte le
caratteristiche meccaniche che conosciamo.
Durezza HRC
Resilienza KV
100
200
300
400
500
600
M
Mt
Cricca
α
+ ε’
Mc
α + ε’ + Fe3C
Temperatura °C
α
+ Fe3C
Zone Guinier-Preston
α
+ Fe3C
Sorbite
Perlite
globulare
BIBLIOGRAFIA
• Bartocci e Marianeschi - I metalli e l’acciaio - Seconda
edizione Poligrafica Altarocca Editore - Terni, 1960.
• M. Rippa - Fondamenti di chimica - Italo Bovolenta Editore Srl - Ferrara, 1987
• Camilli, Valeri, Mackenzie - Chimica, Scienza della materia - Spa G.B. Paravia & C., 1980.
• L. Matteoli - Il diagramma ferro carbonio e le curve
TTT - Associazione Italiana di Metallurgia, 1972.
• B.M. Kear - I metalli avanzati - Le Scienze, n° 220, dicembre 1986, pagg. 131-139.
• Araneo - Chimica - Piccin Nuova Libraria Spa, Padova
1987
• W. Nicodemi - Metallurgia - Masson Italia Editori,
1986.
• J.N. Murrei, S. F.A. Kettle, J. M. Tedder - Valence Theory - John Willey & Sons, London 1965.
• S. Glasstone - Trattato di chimica fisica - C. Manfredi
Editore, Milano 1963.
• Cartmell & Fowles - Valency and molecular structure Butterworths, London 1961.
• Caforio, Ferilli - Physica per i licei scientifici. Vol. 3° Edizioni le Monnier, 1991.
• H.R. Quinn e M.S. Witherell – Violazioni della simmetria fondamentale della natura - Le Scienze, n° 366,
Febbraio 1999, pag. 66.
• S. Weinberg - Una fisica unificata delle particelle - Le
Scienze, n° 376, Dicembre 1999, pag. 48
α
Cementite
a veli
Figura 1.25. Evoluzione della martensite tetragonale e conseguenze sulla durezza e resilienza al riscaldamento. Mt = martensite tetragonale; Mc = martensite cubica; ε’ = nucleo di carburo,
precursore della cementite;α = matrice di ferro ccc o ferrite;
Fe3C = carburo di ferro o cementite; Sorbite = aggregato di cementite finemente dispersa nella ferrite; Perlite globulare = aggregato di cementite coagulata dispersa nella ferrite.
Per la descrizione dei fenomeni della tempra martensitica si rimanda ai capitoli terzo, quarto, quinto e ottavo.
Si rimanda alla bibliografia chi gradisse approfondire gli
argomenti accennati in questo capitolo.
- 10 -