PROGRAMMAZIONE DIDATTICA ANNUALE
ANNO SCOLASTICO 2015/2016
DOCENTE PROF.SSA
ROSANNA MADONNA
MATERIA DI INSEGNAMENTO SCIENZE INTEGRATE- CHIMICA
CLASSE PRIMA
Risultati di apprendimento in termini di Competenze
L’insegnamento di “Chimica e laboratorio” è previsto come biennale con le finalità descritte nei programmi ministeriali. In particolare, alla fine
del primo anno di corso, gli allievi dovranno:
- possedere conoscenze teoriche di base e abilità operative che permettano il relativo completamento durante il secondo anno e favoriscano il
successivo approfondimento dei contenuti della Chimica con le altre scienze biologiche e tecnologiche
- cominciare ad acquisire consapevolezza del collegamento della Chimica con le altre scienze biologiche e tecnologiche
- cominciare a rendersi conto di quanto la Chimica faccia parte della quotidianità della vita e la possa condizionare
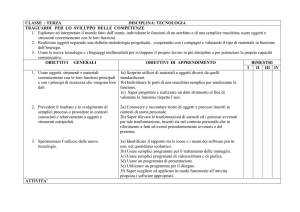
OBIETTIVI GENERALI:
possedere conoscenze di base su proprietà, composizione, struttura e trasformazioni della materia;
saper eseguire misure di grandezze con la necessaria accuratezza;
saper prelevare e manipolare prodotti chimici di uso comune osservando scrupolosamente le norme di sicurezza previste;
saper utilizzare il linguaggio chimico, servendosi di terminologia appropriata;
saper indicare le finalità di un esperimento e le precauzioni necessarie per eseguirlo;
saper registrare correttamente le osservazioni qualitative sull’andamento del fenomeno studiato e sui suoi risultati;
saper risolvere problemi stechiometrici inerenti al programma svolto.
Programmazione
MODULO N° 1: INTRODUZIONE ALLA CHIMICA
Unità didattica 1: Il metodo sperimentale e le grandezze
Obiettivi
Conoscenza
-
Saper che cos’è la chimica e che cosa studia
Conoscere le fasi che caratterizzano il metodo scientifico
Conoscere le grandezze fondamentali e derivate del S.I.
Abilità
- Riconoscere le fasi del metodo scientifico nell’attività sul campo
- Comprendere il corretto uso delle varie grandezze
- Saper realizzare in laboratorio la misurazione di alcune grandezze
- Osservare le norme di comportamento e sicurezza in laboratorio
- Saper costruire un grafico
Unità didattica 2: La materia
Obiettivi
Conoscenze
- Saper definire la materia e i suoi stati di aggregazione
- Conoscere le differenze tra i tre stati di aggregazione
- Conoscere i metodi di separazione dei componenti di una miscela
- Conoscere la simbologia utilizzata in chimica
Contenuti
-
-
-
Contenuti
-
Abilità
- Sapere descrivere il comportamento di una sostanza pura al riscaldamento e al
raffreddamento
- Saper distinguere tra proprietà e trasformazioni chimiche e fisiche
- Esprimere le differenze tra miscuglio e sostanza pura
- Esprimere le differenze tra composto ed elemento
Il metodo sperimentale
Elaborazione dei dati: stesura di una relazione e
realizzazione di un grafico
LABORATORIO:
1) norme di comportamento e sicurezza in laboratorio, simboli di pericolo
2) materiali di laboratorio
3) misure di volume
4) misure di massa
-
-
Stati fisici della materia e passaggi di stato
Sostanze pure
Miscele omogenee e miscele eterogenee
Metodi di separazione dei componenti di una
miscela eterogenea
Metodi di separazione dei componenti di una
miscela omogenea:
Trasformazioni fisiche e reazioni chimiche
Composti ed elementi, nomi e simboli degli
elementi chimici, formule chimiche
LABORATORIO:
1) separazione di un miscuglio eterogeneo:
Scansione
temporale
Settembre Ottobre
Scansione
temporale
Ottobre Novembre
-
filtrazione
2) distillazione
3) cromatografia su carta
4)fusione e solidificazione di una sostanza pura,
temperatura di fusione
Saper effettuare separazioni dei componenti di un miscuglio
Saper determinare la temperatura di fusione di una sostanza pura
Saper costruire le curve di riscaldamento e di raffreddamento di una sostanza
pura
MODULO N° 2: DALLA MATERIA AGLI ATOMI
Unità didattica 1: Le leggi ponderali
Obiettivi
Conoscenze
- Conoscere le leggi ponderali dei rapporti di combinazione
- Conoscere la legge di conservazione dell’energia
- Conoscere i punti fondamentali della teoria atomica di Dalton
- Conoscere il principio di Avogadro
Abilità
- Definire la differenza tra atomo e molecola
- Interpretare alcuni fenomeni della materia sulla base della sua natura particellare
- Saper applicare le leggi ponderali alle trasformazioni chimiche
Unità didattica 2: La mole e i calcoli stechiometrici
Obiettivi
Contenuti
-
-
Legge di conservazione della massa
Legge di conservazione dell’energia
Legge delle proporzioni definite
Teoria atomica di Dalton
LABORATORIO:
1) verifica della legge di Lavoisier
Contenuti
Conoscenze
- Conoscere il significato di formula minima e di formula molecolare
- Conoscere il significato della mole e la quantità di particelle che rappresenta
- Definire il volume molare
- Definire il reagente limitante
-
Abilità
- Saper determinare la massa molecolare
- Saper calcolare il numero di moli relative ad una certa massa di sostanza e
viceversa
- Saper determinare la formula minima e molecolare di un composto
conoscendone la composizione
-
-
-
Scansione
temporale
Massa atomica e massa molecolare
Mole, massa molare e volume molare dei gas,
legge generale dei gas
Formula e composizione di un composto
Equazioni chimiche, bilanciamento di una
reazione
Problemi stechiometrici, reagente limitante, resa
percentuale
LABORATORIO:
1) aspetti qualitativi delle reazioni chimiche
NovembreDicembre
Scansione
temporale
Gennaio
-
-
Calcolare la composizione percentuale degli elementi in un composto
Saper bilanciare una reazione chimica
Saper calcolare le quantità di sostanza che si formano o che reagiscono in una
trasformazione chimica utilizzando i rapporti fra le moli, anche in presenza di un
reagente limitante
MODULO N° 3: I FLUIDI: PARTICELLE IN MOVIMENTO
Unità didattica 1: gas, liquidi e soluzioni
Obiettivi
Contenuti
Conoscenze
- Conoscere l’equazione di stato dei gas ideali
- Conoscere le leggi di Dalton e di Graham
- Conoscere la terminologia relativa alle soluzioni
- Sapere in quali modi si può esprimere la concentrazione delle soluzioni
- Conoscere i parametri che influenzano la solubilità di un solido in un liquido
-
Abilità
- Saper esprimere la concentrazione con le varie modalità
- Saper utilizzare l’equazione di stato nel calcolo chimico
- Saper risolvere esercizi con l’uso delle concentrazioni
- Calcolare le quantità delle sostanze coinvolte in una reazione che si svolge in
soluzione
- Saper preparare soluzioni alla concentrazione desiderata
-
MODULO N° 4: L’ATOMO
Unità didattica 1: L’atomo e le particelle subatomiche
Obiettivi
Conoscenze
- Conoscere le tappe fondamentali nell’evoluzione del modello atomico
- Conoscere le caratteristiche delle particelle subatomiche, il numero atomico e il
numero di massa
- Saper cosa sono gli isotopi e cosa rappresenta la massa atomica
-
-
L’equazione di stato dei gas ideali, cenni al
comportamento dei gas reali
I liquidi e le soluzioni
Soluzioni: dissociazione, ionizzazione,
solubilità e temperatura, modi di esprimere la
concentrazione (molarità, % in peso, % in
volume)
Calcoli stechiometrici relativi alle reazioni in
soluzione acquosa
LABORATORIO:
1) preparazione di soluzioni a partire da una
sostanza solida
2) preparazione di soluzioni per diluizione
3) purificazione di una sostanza in soluzione
mediante cristallizzazione
Contenuti
-
Scoperta delle particelle subatomiche
Numero atomico e numero di massa
Isotopi e massa atomica
Evoluzione del modello atomico
Scansione
temporale
Febbraio
Scansione
temporale
Marzo
Abilità
- Comprendere il limite di validità dei modelli atomici
- Saper calcolare la massa atomica di un elemento conoscendone la composizione
isotopica
Unità didattica 2: La configurazione elettronica
Obiettivi
Contenuti
Conoscenza
- Conoscere il modello dell’atomo secondo Bohr
-
Abilità
- Comprendere l’inadeguatezza del modello atomico di Bohr
- Saper definire l’orbitale
- Sapere cosa sono i numeri quantici e descrivere le relazioni che li legano
- Rappresentare la configurazione elettronica degli elementi
- Individuare gli elettroni di valenza
- Identificare gli elementi in base alla colorazione della fiamma
-
Unità didattica 3: La tavola periodica
Obiettivi
-
Contenuti
Conoscenze
- Conoscere la struttura della tavola periodica e come questa è stata determinata
- Conoscere la relazione esistente tra configurazione elettronica esterna e proprietà
chimiche di un elemento
- Definire le proprietà periodiche più importanti
- Conoscere le differenze fra metalli e non metalli
Abilità
- Descrivere e interpretare le variazioni delle proprietà periodiche lungo i gruppi e
i periodi
- Identificare le caratteristiche degli elementi in base alla loro posizione nella
tavola periodica
La quantizzazione negli atomi
Il nuovo modello atomico (cenni del principio di
indeterminazione di Heisenberg)
I numeri quantici e le caratteristiche degli
orbitali
La configurazione elettronica degli atomi,
elettroni di valenza
LABORATORIO
Saggi alla fiamma
L’attuale tavola periodica
Periodicità di alcune proprietà fisiche e chimiche degli elementi: energia di ionizzazione, affinità elettronica, elettronegatività, raggio atomico e raggio ionico
Metalli e non metalli
Scansione
temporale
Marzo
Scansione
temporale
Aprile
MODULO N° 5: ATOMI E MOLECOLE
Unità didattica 1: I legami chimici
Obiettivi
Conoscenze
- Conoscere i vari tipi di legami chimici primari e secondari
- Conoscere le caratteristiche delle diverse sostanze
Abilità
- Sapere perché si instaurano i legami tra gli atomi
- Stabilire quanti legami un atomo è in grado di formare
- Prevedere il tipo di legame che si può instaurare tra atomi
- Correlare le proprietà delle sostanze con i legami tra gli atomi e le molecole
- Distinguere i diversi tipi di solidi in base ai legami che li costituiscono
- Saper rappresentare gli elettroni di valenza secondo la simbologia di Lewis
- Saper rappresentare le molecole con la simbologia di Lewis
- Saper ricavare la struttura di una molecola con il metodo VSEPR
Contenuti
-
Il legame chimico
Come avvengono i legami
Interazione tra atomi
Interazione tra molecole
Sostanze solide: solidi metallici, ionici,
covalenti, molecolari, amorfi
Formule di lewis e cariche formali
VSEPR e geometria molecolare
LABORATORIO:
solubilizzazione dei solidi nei liquidi
Scansione
temporale
Aprile-Maggio
Metodologia: Strategie educative, strumenti e tecniche di lavoro, attività di laboratorio, attività di progetto.
Il conseguimento degli obiettivi che il curricolo si propone poggia in larga misura sull’adozione di metodologie didattiche motivanti ed adeguate
allo sviluppo cognitivo degli allievi a cui si rivolge. È opportuno che lo sviluppo didattico della disciplina mantenga un costante riferimento
all’esperienza quotidiana e ai processi chimici naturali o industriali, onde dare senso di concretezza ed utilità a quanto l’allievo sta apprendendo.
L’apprendimento della Chimica non potrà prescindere i n o l t re dall’esecuzione di esercizi e dalla risoluzione di problemi, quali mezzi atti a
favorire una effettiva padronanza dei concetti e a stimolare l’acquisizione di strategie di pensiero sempre più complesse. Saranno curati i
collegamenti con le altre discipline dell'area scientifica, in particolare fisica e scienza della terra, evitando inutili sovrapposizioni e ripetizioni, ed
evidenziando gli aspetti interdisciplinari degli argomenti. Un ruolo centrale avrà il laboratorio che di volta in volta verrà utilizzato per
l'approfondimento e il chiarimento dei concetti teorici studiati.
Strumenti e metodologie per la valutazione delle conoscenze e delle abilità e per il giudizio di competenza.
Le verifiche saranno effettuate in itinere e a conclusione di una o più unità didattiche e saranno volte ad accertare il livello delle conoscenze, delle
competenze e delle capacità raggiunto dall'alunno nella disciplina. Per quanto riguarda le tipologie, accanto alle verifiche di tipo orale saranno
effettuate anche quesiti a risposta aperta, quesiti a risposta multipla, test, colloqui di gruppo. La valutazione terrà conto della situazione iniziale, dei
risultati delle verifiche, delle attitudini evidenziate, dell'interesse e dell'impegno dimostrati, della partecipazione al dialogo educativo, della
progressione rispetto ai livelli di partenza, delle capacità di rielaborazione dei contenuti acquisiti, del raggiungimento degli obiettivi. Si adotteranno,
in riferimento alle conoscenze, competenze e capacità, i seguenti indicatori :
-correttezza e completezza delle conoscenze;
-chiarezza e correttezza espressiva;
-capacità di collegamento, contestualizzazione, rielaborazione critica;
-capacità di comprensione di un testo;
-padronanza del linguaggio specifico della disciplina
Per l'attribuzione del valore prettamente numerico ci si atterrà alla tabella di valutazione concordata
da tutti i docenti ed allegata al POF.
Attività di supporto ed integrazione. Iniziative di recupero.
Sono rivolte agli alunni che alla fine di ogni Unità Didattica e/o ad ogni verifica intermedia non avranno raggiunto gli obiettivi prefissati. Di volta in
volta si stabilirà se il recupero dovrà avere carattere individuale o collettivo e se dovrà svolgersi in orario curricolare o extracurricolare. In ogni
caso, le attività di recupero riguarderanno singoli argomenti, di estensione limita e saranno sviluppate in modo intensivo e in tempi brevi.