DIREZIONAMENTO DEI
FARMACI AI TUMORI
Dott.ssa Rosa Pireddu
Corso di Tecnologia farmaceutica applicata
a.a. 2016-2017
Con il termine generico di cancro o tumore maligno si indica qualsiasi tipo di
tumore maligno caratterizzato non solo dalla proliferazione incontrollata e
progressiva di cellule anomale, ma anche dalla capacità di invadere i tessuti
adiacenti e di colonizzare sedi distanti dando origine alle metastasi.
Rappresenta una delle principali cause di morte in tutto il mondo.
Secondo i dati dell’OMS, il numero dei nuovi casi diagnosticati ogni anno
supera i 10 milioni, mentre nel mondo muoiono ogni anno di cancro circa 6
milioni di persone.
Gli agenti chemioterapici tradizionali hanno una elevata tossicità sistemica
Si distribuiscono in modo non specifico nel corpo colpendo sia le cellule
normali che quelle tumorali.
La dose di farmaco che raggiunge il tumore è molto limitata
COME È POSSIBILE RIDURRE
GLI EFFETTI COLLATERALI?
COME È POSSIBILE RIDURRE
GLI EFFETTI COLLATERALI?
TARGETED THERAPY
o farmaci a bersaglio molecolare
COME È POSSIBILE RIDURRE
GLI EFFETTI COLLATERALI?
TARGETED THERAPY
o farmaci a bersaglio molecolare
TARGETED DRUG DELIVERY
uso di sistemi di direzionamento sito specifico: DDS
TARGETED THERAPY
Si basa sull’uso di molecole in grado di bloccare l’azione di un recettore specifico (target)
ritenuto svolgere un ruolo critico nella crescita o nella progressione del tumore. Il bersaglio
può essere un recettore presente sulla superficie o all’ interno della cellula neoplastica.
È una terapia più efficace della terapia corrente e meno dannosa per le cellule normali.
Il farmaco può agire con 3 meccanismi d’azione:
b-1) Può legarsi al fattore di crescita
b-2) Può legarsi nel dominio intracellulare del
recettore detto tirosin-chinasi impedendo che
questo venga attivato
c) Può legarsi al dominio extracellulare del recettore
impedendo che il fattore di crescita lo attivi
TARGETED THERAPY
Piccole Molecole
Anticorpi Monoclonali
Imitanib mesylate (Gleevec ®)
Trastuzumab (Herceptin®)
Gefitinib (Iressa ®)
Cetuximab (C225, Erbitux®)
Erlotinib
Bevacizumab
Tamoxifene
Rituximab
COME È POSSIBILE RIDURRE GLI
EFFETTI COLLATERALI DEI
FARMACI GIÀ ESISTENTI?
COME È POSSIBILE RIDURRE GLI
EFFETTI COLLATERALI DEI
FARMACI GIÀ ESISTENTI?
TARGETED DRUG DELIVERY
uso di sistemi di direzionamento sito specifico: DDS
TARGETED DRUG DELIVERY
DRUG DELIVERY capacità di un farmaco di accumularsi
selettivamente e quantitativamente in un tessuto o organo
specifico indipendentemente dal sito e dal metodo di
somministrazione
La distribuzione di un farmaco può essere
modificata attraverso la sua associazione ad
un vettore o CARRIER
DRUG DELIVERY SYSTEM sistemi complessi di dimensioni
nanometriche, costituiti da almeno due componenti, il vettore
e il principio attivo.
TARGETED DRUG DELIVERY
Obiettivi e specificità dei nanosistemi per il direzionamento sito specifico:
Aumentare la concentrazione del farmaco nel tumore attraverso i
meccanismi di: (a) targeting passivo (b) targeting attivo
Diminuire la concentrazione di farmaco nei tessuti sani
Migliorare i profili farmacocinetici e farmacodinamici
Migliorare la solubilità del farmaco per consentire la somministrazione
endovenosa
Rilasciare la minor quantità di farmaco durante la circolazione
Rilasciare la maggior quantità di farmaco nel sito bersaglio
Aumentare la stabilità del farmaco proteggendolo dalla degradazione
Aumentare l’internalizzazione e il rilascio intracellulare del farmaco
Devono essere biocompatibili e biodegradabili
TARGETED DRUG DELIVERY
I SISTEMI CARRIER impiegati nel drug targeting sono diversi per composizione,
struttura e modalità di trasporto
OPSONIZZAZIONE
Jiskoot et al, 2009
OPSONIZZAZIONE E SISTEMI STEALTH®
Rivestendo la superficie dei nanovettori con dei polimeri flessibili e idrofili è
possibile proteggerli dal RES e aumentare il loro tempo di circolazione nel sangue
Il PEG (Poli-(etilenglicole)) è il polimero più utilizzato per proteggere le particelle
in quanto è idrofilo, con un’alta flessibilità della catena polimerica, non tossico,
non immunogenico, poco costoso
Forze attrattive
Forze repulsive
tra il carrier peghilato e i
componenti del sangue
LIPOSOMI STEALTH®
MICROAMBIENTE TUMORALE
La conoscenza e la comprensione del microambiente tumorale permette di
elaborare diverse strategie terapeutiche sfruttando le numerose differenze
rispetto al tessuto normale
ANGIOGENESI TUMORALE
EFFETTO EPR
pH
ANGIOGENESI TUMORALE
Piccolo tumore localizzato
Tumore che cresce e si diffonde
Angiogenesi
Vaso sanguigno
Dim tumore <2 mm3
Dim tumore >2 mm3
Molecole segnale
(VEGF etc)
LA CASCATA DEI SEGNALI NELL’ANGIOGENESI
Cellula tumorale
VEGF (o bFGF)
Fattore di crescita endoteliale vascolare
Recettori
Trasduttori
Cellula endoteliale
Proteine che
stimolano la crescita
di nuove cellule
endoteliali
Geni attivati
ATTIVAZIONE DELLE CELLULE ENDOTELIALI
MMPs secrete
che digeriscono
la matrice
circostante
Matrice
Cellule
endoteliali
migrano e si
dividono
Cellule
endoteliali
attivate
l'integrina αvβ3 espressa
interagisce con le proteine
della matrice extracellulare e
regola la migrazione delle
cellule endoteliali durante la
formazione dei vasi
ANGIOGENESI TUMORALE
TESSUTO NORMALE
TESSUTO TUMORALE
I vasi sanguigni tumorali che si formano risultano con una forma irregolare,
dilatata e tortuosa e con ampie fenestrature
Jain, Science; 307: 58-62, 2005
EFFETTO EPR
“EFFETTO DI AUMENTATA PERMEABILITÀ E RITENZIONE” (EPR) è un fenomeno
passivo scoperto da Matsumura e Maeda nel 1986 osservato in quasi tutti i tumori
umani.
I vasi sanguigni tumorali sono caratterizzati da una maggiore permeabilità
vascolare con pori endoteliali di dimensioni da 10 a 1000 nm. I nanovettori (dim.
20-200 nm), possono extravasare e accumularsi all'interno dello spazio interstiziale.
I vasi linfatici sono assenti o non funzionali nel tumore e questo contribuisce a un
inefficiente drenaggio del tessuto tumorale.
I nanovettori una volta raggiunto il tumore non vengono rimossi in modo efficiente
e si accumulano nel tumore.
EFFETTO EPR
Ampia angiogenesi e ipervascolature
La mancanza di uno strato di muscolatura liscia, periciti
Difettosa architettura vascolare: fenestrature
Nessun flusso sanguigno costante
Drenaggio linfatico inefficiente che porta a una maggiore ritenzione
nell'interstizio tumorale
Ritorno venoso lento che porta all'accumulo negli interstizi della massa
tumorale
la pressione del microcircolo nei tumori è più alta e facilita lo stravaso dei
nanovettori.
pH TUMORALE
Cellule tumorali
Produzione di acido lattico
pH dello spazio
extracellulare tumorale
(6 – 7)
blocco uptake cellulare
di basi deboli
forma indissociata
EFFETTO WARBURG
difetto nella catena respiratoria
mitocondriale che determina un
elevato tasso di glicolisi
l piruvato viene convertito in lattato
per generare il NAD +, un fattore
richiesto da diversi enzimi glicolitici.
Il lattato eliminato dalla cellula tramite
trasportatore monocarbossilato che
esporterà un protone con una molecola
lattato
Doxorubicina
STRATEGIE PER IL DIREZIONAMENTO SPECIFICO
TARGETING ATTIVO
FARMACO LIBERO
TARGETING PASSIVO
TARGETING ATTIVO
STIMOLI INTERNI/ESTERNI
TARGETING PASSIVO
Estravasione di PEG-Liposomi (dim 126 nm) dai vasi
tumorali
Nessuna estravasione di PEG-Liposomi (dim 126
nm) dai tessuti normali
Il targeting passivo consiste nel trasporto di nanovettori attraverso le ampie
fenestrature dei capillari tumorali nello spazio interstiziale tumorale e nelle cellule
tumorali per semplice diffusione passiva (grazie all’effetto EPR).
TARGETING PASSIVO
Nanovettori grandi e a lunga circolazione
(100 nm) sono mantenuti maggiormente
nel tumore, mentre le molecole più
piccole vengono facilmente diffuse
TARGETING PASSIVO
Proprietà dei nanovettori per raggiungere il tumore con meccanismo passivo:
eludere la sorveglianza immunitaria e circolare per un lungo periodo
dimensione ideale tra i 10 e 100 nm
per una efficiente extravasione dalle fenestrature dei vasi tumorali dim << 400nm
per evitare la filtrazione attraverso i reni dim > 10 nm
per evitare la cattura specifica da parte del fegato dim < 150 nm.
TARGETING PASSIVO
Limitazioni per raggiungere il tumore con meccanismo passivo:
il targeting passivo dipende dal grado di vascolarizzazione del tumore e
dall'angiogenesi
l’extravasione dei nanovettori varierà con il tipo di tumore e con la
localizzazione anatomica
l'alta pressione del fluido interstiziale nei tumori solidi impedisce un
assorbimento efficace e distribuzione omogenea dei farmaci nel tumore
(interessa di più le piccole molecole rispetto ai grandi nanovettori)
INTERAZIONE CARRIER- CELLULA
…O anche Rilascio del farmaco nello spazio extracellulare
Myocet: Liposomi di Doxorubicina
Emivita da 0,2 h a 2,5 h
cardiotox
DOXIL, Caelix: Liposomi pegylati di Doxorubicina
Emivita da 0,2 h a 55 h
cardiotox
TARGETING ATTIVO
Il modello di distribuzione del carrier è
modificato utilizzando un “homing device”
che porta il dispositivo su un sito specifico
TARGETING CELLULE TUMORALI
TARGETING ENDOTELIO TUMORALE
TARGETING ATTIVO
ENDOCITOSI RECETTORE-MEDIATA
TARGETING ALLE CELLULE TUMORALI
Con questa strategia di targeting attivo viene sfruttata l’iperespressione sulla
superficie delle cellule tumorali di particolari recettori inclini all’endocitosi
RECETTORE DELLA TRANSFERRINA
RECETTORE PER IL FOLATO
GLICOPROTEINE ESPRESSE SULLA SUPERFICIE DELLE CELLULE
RECETTORE DEL FATTORE DI CRESCITA EPIDERMICO (EGFR)
RECETTORE DELLA TRANSFERRINA
RECETTORE DELLA TRANSFERRINA
RECETTORE DEL FOLATO
RECETTORE DEL FOLATO
Es. Yoo HS et al hanno prodotto dei nano coniugati di doxorubicina-PEG-folato e
hanno dimostrato come questi coniugati hanno un maggiore effetto citotossico
sulle cellule KB rispetto alla doxorubicina libera
DOX
DOX- nano aggregati
DOX/FOL- nano aggregati
TARGETING ALL’ENDOTELIO VASCOLARE
I nanovettori targati da ligandi specifici si legano e uccidono i vasi sanguigni
angiogenici e, indirettamente, le cellule tumorali che questi nuovi vasi
supportano, soprattutto nel centro del tumore.
I vantaggi del targeting all'endotelio tumorale sono:
non è necessario lo stravaso di nanovettori per arrivare al loro bersaglio
il legame ai loro recettori è direttamente possibile dopo iniezione
endovenosa
Minore rischio potenziale di sviluppare resistenza a causa della stabilità
genetica delle cellule endoteliali rispetto alle cellule tumorali
la maggior parte dei bersagli delle cellule endoteliali sono espressi
qualunque sia il tipo di tumore, offrendo uno spettro di applicazione
più ampio
TARGETING ALL’ENDOTELIO VASCOLARE
I bersagli principali dell'endotelio tumorale includono:
I fattori di crescita endoteliale vascolare (VEGF) e i loro recettori,
VEGFR-1 e VEGFR-2:
bloccare il recettore per il VEGF-2 e diminuire il legame
dirigersi verso il VEGF per inibire il legame del ligando al
recettore VEGFR-2
Il recettore delle cellule endoteliali INTEGRINA αvβ3 :
I derivati ciclici o lineari dell’oligopeptide RGD (Arg-Gly-Asp) sono
in grado di legarsi a alle integrine αvβ3endoteliali
Le metalloproteinasi della matrice (MMPs):
Il peptide NGR (Asn-Gly-Arg) è in grado di legarsi al recettore di
superficie Aminopeptidasi N/CD13 (MMP)
TARGETING ATTIVO
TARGETING ATTIVO
Esempi di nanosistemi progettati per il direzionamento attivo utilizzati in studi pre-clinici e clinici
TARGETING ATTIVO
Esempi di nanosistemi progettati per il direzionamento attivo utilizzati in studi pre-clinici e clinici
NANOCARRIER SENSIBILI AGLI STIMOLI
STIMOLI ESTERNI
STIMOLI INTERNI
TEMPERATURA
pH
CAMPO
MAGNETICO
Potenziale
REDOX
RADIAZIONI
UV, IR
ULTRASUONI
RILASCIO DEL
FARMACO
TEMPERATURA
ENZIMI
Il microambiente tumorale differisce da quello delle cellule normali
Un ambiente extracellulare tumorale unico innesca la trasformazione dei nanovettori,
permettendo un rapido rilascio del farmaco o l'interazione con un obiettivo specifico
L'applicazione di stimoli esterni può consentire di controllare il rilascio o di dirigere i
carrier selettivamente verso le cellule.
NANOCARRIER pH-SENSIBILI
DESTABILIZZAZIONE DELLE NANOPARTICELLE
es. presenza di polimeri o lipidi ph-sensibili
acido oleico, poli-L-istidina, polisulfonamide,
poli-β-amminoesteri
SCISSIONE DI UN LEGAME PH-SENSIBILE
es. Idrazone
NANOCARRIER pH-SENSIBILI
Meccanismo di schermatura-esposizione
pH 7.4
pH 7
TAT
TAT: peptide che favorisce la
penetrazione cellulare
Poliy Sulfonamide
dissociata
Catene PEG
Poliy Sulfonamide
Sethuraman et al. TAT peptide-based micelle system for potential active targeting of anti-cancer agents to acidic solid tumors, J. Control. Release
118 (2007) 216–224
NANOCARRIER ATTIVATI DA ENZIMI
β- GLUCURONIDASI
è un enzima che si ritrova in grande quantità nelle zone necrotiche tumorali
Scinde il legame β1-4 tra 2 molecole di glucosio o tra glucosio- altra molecola
Questo coniugato è attivato dall’enzima β- glucuronidasi
NANOCARRIER ATTIVATI DA ENZIMI
PROTEASI (Metalloproteinasi della matrice)
Lin Zhu et al. Matrix Metalloprotease 2-Responsive Multifunctional Liposomal Nanocarrier for Enhanced Tumor Targeting. ACS Nano. 2012
April 24; 6(4): 3491–3498
NANOCARRIER TERMO-SENSIBILI
T. Ta, T.M. Porter, Thermosensitive liposomes for localized delivery and triggered release of chemotherapy, J. Control. Release (2013)
NANOCARRIER TERMO-SENSIBILI
LIPOSOMI TERMOSENSIBILI TRADIZIONALI
DPPC TC= 41°C
LIPOSOMI TERMOSENSIBILI CONTENENTI LYSOLIPID
DPPC +MCCP TC= 39°C
T. Ta, T.M. Porter, Thermosensitive liposomes for localized delivery and triggered release of chemotherapy, J. Control. Release (2013)
NANOCARRIER TERMO-SENSIBILI
LIPOSOMI MODIFICATI CON POLIMERI TERMOSENSIBILI
T < LCST
T > LCST
NIPAM(poli-isopropilacrilamide)
LCST bassa temp critica di soluzione
T. Ta, T.M. Porter, Thermosensitive liposomes for localized delivery and triggered release of chemotherapy, J. Control. Release (2013)
NANOCARRIER MAGNETO-SENSIBILI
NANOPARTICELLE MAGNETICHE (SPIONs) : nanoparticelle di Ossido di Ferro chiamate
maghemite (γ-Fe2O3) o magnetite(Fe3O4), con dimensioni comprese tra 4–10 nm e con
proprietà superparamagnetiche
Tumore
Arteria
Nanocarrier magneto-sensibili + farmaco
Micelle PE-PEG caricate con le SPION
NANOCARRIER MAGNETO-SENSIBILI
La magnetite (MAG-C) è stata caricata in
liposomi cationici insieme a etoposide e
dacarbazine. Si è notato che a basse
concentrazioni di MAG-C non si altera
l’efficienza di incapsulazione, ma per alte
concentrazioni (2.5 mg/ml), diminuisce
l’incorporazione dei farmaci
Accumulo nelle pareti dei vasi tumorali dei MAG-C PEG liposomi cationici
Dandamudi et al. The drug loading, cytotoxicty and tumor vascular targeting characteristics of magnetite in magnetic drug targeting, Biomaterials
28 (2007) 4673–4683.
NANOCARRIER MAGNETO-SENSIBILI
Pradhan et al. Targeted temperature sensitive magnetic liposomes for thermo-chemotherapy, Journal of Controlled Release 142 (2010), 108-121
NANOCARRIER MAGNETO-SENSIBILI
Gang et al. (2007) hanno dimostrato il direzionamento di
nanoparticelle magnetiche di poly e-caprolactone caricate con
gemcitabina in vivo su un modello xenografico di cancro al pancreas
utilizzando un magnete esterno
Alexiou et al.(2003) hanno utilizzato delle SPION contenenti
mitoxantrone e sono state direzionate verso il carcinoma a cellule
squamose VX2 nel coniglio utilizzando un magnete esterno
‘‘Ablazione termica magnetica” è un approccio alternativo indagato
da Hilger et al.(2002)in vivo in un modello animale. Questo metodo
si basa sull’accumulo nel tumore delle SPION e con l’applicazione di
un campo magnetico alternato esterno sul tumore se ne ottiene
l’eliminazione grazie al calore sviluppato dall’oscillazione delle SPION.
NANOCARRIER FOTO-SENSIBILI
MICELLE POLIMERICHE FOTO-SENSIBILI
UV/NIR
Il copolimero amfifilico è formato
dal PEG (porzione idrofila) e
dall’acido polimetacrilico (porzione
idrofobica) in cui i carbossili sono
mascherati da diversi gruppi
protettivi che vengono rimossi dopo
esposizione alla luce (switch
idrofobico)
Fomina et al. Photochemical mechanisms of light-triggered release from nanocarriers, Advanced Drug Delivery Reviews 64 (2012) 1005–1020
NANOCARRIER FOTO-SENSIBILI
LIPOSOMI FOTO-SENSIBILI
Nella forma trans le molecole di
azobenzene sono strettamente
impaccate nel doppio strato.
La luce UV determina
l’isomerizzazione trans-cis delle
molecole e la destabilizzazione della
struttura del doppio strato .
Fomina et al. Photochemical mechanisms of light-triggered release from nanocarriers, Advanced Drug Delivery Reviews 64 (2012) 1005–1020
NANOCARRIER MULTIFUNZIONALI
Il risultato della combinazione di diverse strategie (stabilità nel sangue
(PEGylation), capacità direzionante (targeting passivo o attivo) e sensibilità agli
stimoli (pH, temperatura, ultrasuoni, ecc) porta a nanovettori multifunzionali
di nuova generazione.
Hanno la capacità di “accendere” certe funzioni solo quando è necessario, ad
esempio sotto l’azione di stimoli locali caratteristici della zona patologica
(aumento della temperatura o diminuzione del pH nei tessuti tumorali).
Una volta accumulati nel tumore, il polimero protettivo o l’anticorpo presente
sulla superficie del DDS si stacca sotto l’azione locale della condizione
patologica e viene esposta la seconda funzione precedentemente nascosta
consentendo il successivo rilascio del carrier e del suo contenuto all'interno
delle cellule.
NANOCARRIER MULTIFUNZIONALI
Hillaireau et al. Nanocarriers’ entry into the cell: relevance to drug delivery, Cell. Mol. Life Sci. 66(2009), 2873–2896
NANOCARRIER MULTIFUNZIONALI
pH
pH 5.0–6.0
TAT- liposomi
TAT- liposomi con
PEG pH insensibile
TAT- liposomi con PEG
pH sensibile dopo 20 min
di incubazione a basso pH
V. Torchilin . European Journal of Pharmaceutics and Biopharmaceutics 71 (2009) 431–444
DIREZIONAMENTO DEI FARMACI
AI TUMORI EPATICI:
HCC
DIREZIONAMENTODEI FARMACI AL FEGATO
IL FEGATO
Gli epatociti rappresentano le
principali cellule del fegato (circa il
75% del parenchima epatico), hanno
forma poliedrica con sei o più facce
con le quali o delimitano lo spazio di
Disse, o entrano in contatto con gli
epatociti adiacenti delimitando i
canalicoli biliari.
IL FEGATO
Le cellule endoteliali costituiscono la
parete dei sinusoidi. La parete è
discontinua
per
la
presenza
nell'endotelio di pori e fenestrature
(100-175nm).
Queste
aperture
permettono al plasma, ma non agli
elementi figurati del sangue, di
raggiungere la membrana plasmatica
degli epatociti.
IL FEGATO
Le cellule di kupffer sono elementi
di forma stellata, con spiccata
attività fagocitaria presenti nei
sinusoidi
Il CARCINOMA EPATOCELLULARE (HCC)
È uno dei tumori maligni più comuni del fegato
È la sesta forma di tumore più comune (nel maschio) e la terza causa di
morte associata al cancro al mondo, con più di un milione di morti ogni
anno
Può derivare da diverse malattie del fegato come le infezioni da epatite B e
C, malattie epatiche metaboliche e malattie non alcoliche del fegato grasso
La trasformazione maligna degli epatociti indotta da fattori virali e i diversi
mediatori presenti nella zona cronicamente infiammata
portano
all'epatocarcinogenesi.
Più del 80% dei pazienti si presenta con una malattia avanzata o non
operabile
Il trattamento con chemioterapici sistemici comporta una elevata tossicità
sistemica e un accumulo limitato nel sito del tumore
Il CARCINOMA EPATOCELLULARE (HCC)
lo sviluppo di un efficace sistema di direzionamento specifico per il
carcinoma epatocellulare è estremamente importante
migliorare l'efficacia dei farmaci alle cellule tumorali epatiche
ridurre gli effetti collaterali tossici sistemici
CELLULA DI
EPATOMA
STRATEGIE PER IL DIREZIONAMENTO ALL’HCC
TARGETING ATTIVO
FARMACO LIBERO
TARGETING PASSIVO
TARGETING ATTIVO
STIMOLI INTERNI/ESTERNI
TARGETING PASSIVO
Il trasporto dei nanovettori per semplice diffusione passiva al fegato
sembrerebbe favorito
Ha due fonti di irrorazione sanguigna
I sinusoidi epatici presentano ampie fenestrature (100-170nm)
Molti farmaci vengono assorbiti e sottratti dalla circolazione
dalle cellule epatiche, senza alcun sistema di direzionamento
TARGETING PASSIVO
(B) Nanoparticles smaller than 3 nm in diameter could extravasate different tissues nonspecifically.
(C) Nanoparticles with large negative surface charge or larger than 150 nm in diameter could be captured by
Kupffer cells.
(D) Nanoparticles less than 200 nm in diameter could pass through sinusoidal fenestrations after intravenous
administration.
(E) Nanoparticles with negative surface charge tend to be taken up by Kupffer cells and endothelial cells.
(F) Nanoparticles with positive surface charge tend to be taken up by epatocytes.
TARGETING PASSIVO
Kupffer cells
Endothelial cells
Rune Kjeken et al.(2000).Biochemical Pharmacology
Hepatocytes
TARGETING PASSIVO
Anche se i farmaci e i nanovettori si accumulano rapidamente nel
fegato, non si accumulano nel corretto tipo cellulare intraepatico
Nelle CELLULE DI KUPFFER si accumulano la maggior parte dei farmaci e
dei nanocarrier convenzionali
l’elevato assorbimento in queste cellule porta spesso alla completa
degradazione dei farmaci
UPTAKE DA PARTE DELLE CELLULE DI KUPFFER
Carrier neutri o carichi negativamente
L’uptake da parte delle
cellule di Kupffer avviene
per diretto riconoscimento
(senza opsonizzazione)
Carrier carichi positivamente
Si ha l’opsonizzazione nel
sangue con conseguente
uptake da parte delle
cellule di Kupffer degli
aggregati
TARGETING PASSIVO_NANOCARRIER STEALTH®
Rivestire la superficie dei nanovettori con il
PEG (idrofilo)
l’opsonizzazione
l’uptake da parte delle cellule di Kupffer
il loro tempo di circolazione nel sangue
l’effettivo trasporto di farmaco al sito del
tumore (fegato) grazie all’effetto EPR
l’interazione con le cellule target e il rilascio del farmaco all’interno della cellula
TARGETING ATTIVO
Glycyrrhetinic acid receptor
Glypican-3 protein
Transferrin receptor
lysosomal associated protein transmembrane-4β
Somatostatin receptor
Cluster of
differentiation 44
Homodimeric
glycoprotein
Modificando la superficie del nanoocarrier con un “homing device” è possibile
dirigere il carrier in maniera specifica verso le cellule di epatoma
Sulla superficie di queste cellule sono iperespressi dei particolari recettori inclini
all’endocitosi
Xue Zhang et al. Drug delivery system targeting advanced hepatocellular carcinoma: Current and future Nanomedicine: Nanotechnology,
Biology and Medicine, 12, 2016, 853–869
TARGETING ATTIVO
asialoglycoprotein receptor
carbonic anhydrase IX
Glypican-3 protein
Glycyrrhetinic acid
receptor
Homodimeric
glycoprotein
Transferrin receptor
lysosomal associated
protein transmembrane-4β
Somatostatin receptor
Cluster of
differentiation 44
LIPOSOMI MODIFICATI CON Tf
Es. In uno studio di Li et al, la Doxorubicina è stata incapsulata in Tf-PEG-liposomi
e PEG-liposomi. Studi in vitro di associazione cellulare e uptake cellulare su
cellule HepG2 hanno dimostrato che l’associazione dei Tf-PEGliposomi con le
cellule HepG2 porta a una maggiore internalizzazione e rilascio di DOX rispetto ai
PEGliposomi non targati. In vivo diminuisce l’accumulo di Dox nei reni, nella milza,
nell’intestino e soprattutto nel cuore
DOX-Stealth lipo
X. Li et al. / International Journal of Pharmaceutics 373 (2009) 116–123
Tf-DOX-Stealth lipo
LIPOSOMI MODIFICATI CON Tf
In Vivo:
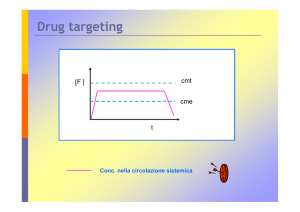
CONCENTRAZIONE PLASMATICA DELLA DOX NEL TEMPO
LIPOSOMI MODIFICATI CON Tf
In vivo:
DISTRIBUZIONE NEL CUORE E NEL TUMORE
In vivo diminuisce l’accumulo di Dox nei reni, nella milza, nell’intestino e
soprattutto nel cuore
LIPOSOMI MODIFICATI CON Tf
In vivo:
SOPPRESSIONE DELLA CRESCITA TUMORALE
RECETTORE DELLE ASIALOGLICOPROTEINE
Residui di Galattosio
Lactoferrina
GALATTOSIO-MICELLE POLIMERICHE
D.-Q. Wu et al. / Biomaterials 30 (2009) 1363–1371
GALATTOSIO-MICELLE POLIMERICHE
Gal-micella (HepG2 cells)
micella (HepG2 cells)
UPTAKE CELLULARE in vitro
D.-Q. Wu et al. / Biomaterials 30 (2009) 1363–1371
Gal-micella (3T3 cells)
GALATTOSIO-MICELLE POLIMERICHE
UPTAKE in vivo nei diversi tessuti dopo 2h dall’iniezione ev. Le micelle senza
Gal sono state usate come controllo
D.-Q. Wu et al. / Biomaterials 30 (2009) 1363–1371
LACTOFERRINA
È una glicoproteina legante il ferro che deriva dalla famiglia delle Tranferrine
è in grado di legarsi a diversi recettori presenti negli epatociti
consentendo l’internalizzazione
Recettori per la Lactoferrina LfR
Recettori per le lipoproteine a bassa densità LRP-R
Recettori per le Asialoglicoproteine ASGP-R
In modo
galattosioindipendente
LIPOSOMI MODIFICATI CON Lf
Es. In uno studio di Wei et al, Sono stati preparati PEG-liposomi e per postinserzione è stata legata covalentemente la lattoferrina al lipide DSPE-PEG2000 –
COOH. Nei liposomi è stata incapsulata come sostanza lipofila fluorescente la
Coumarin-6 e la DiR (una indotricarbocianina).
PEG-LIPO
ALBUMINA-PEG-LIPO
UPTAKE CELLULARE in vitro su HEPG2
M. Wei et al. / European Journal of Pharmaceutical Sciences 46 (2012) 131–141
LF-PEG-LIPO
LIPOSOMI MODIFICATI CON Lf
In Vivo:
CONCENTRAZIONE PLASMATICA DELLA Coumarin-6 NEL TEMPO
M. Wei et al. / European Journal of Pharmaceutical Sciences 46 (2012) 131–141
LIPOSOMI MODIFICATI CON Lf
Tumore
Biodistribuzione dei Peglipo e Lf-Peg-Lipo caricati
con DiR
M. Wei et al. / European Journal of Pharmaceutical Sciences 46 (2012) 131–141
LIPOSOMI TERMO-SENSIBILI: THERMODOX®
http://celsion.com/docs/technology_thermodox
THERMODOX®
http://celsion.com/docs/technology_thermodox
THERMODOX®
http://celsion.com/docs/technology_thermodox
LIPOSOMI DI
TRIIODOTIRONINA PER IL
TRATTAMENTO DELL’HCC
LA TRIIODOTIRONINA
è un ormone fisiologicamente prodotto dalla tiroide
attraverso l’interazione con i suoi recettori intracellulari (TRs) svolge un
importante ruolo nella crescita, sviluppo e metabolismo cellulare ma
anche nella soppressione tumorale
in particolare induce una rapida regressione dei noduli epatici e riduce
l’incidenza del carcinoma epatocellulare e delle metastasi polmonari
la somministrazione causa degli importanti effetti collaterali sia centrali
che periferici dovuti all’aumento dell’attività simpatica
LIPOSOMI DI T3
POPC-DDAB
LIPOSOMI
PEG-POPC-DDAB
LIPOSOMI
POPC=1-Palmitoyl-2-oleylphosphatydilcholine
DDAB= Dimethyldioctadecylammonium
Lf-PEG-POPC-DDAB
LIPOSOMI
LIPOSOMI PREPARAZIONE
Ltf-LIPOSOMI PREPARAZIONE
LIPOSOMI ANALISI TEM
STUDI DI UPTAKE CELLULARE
L’uptake cellulare è stato valutato mediante
Microscopio ottico confocale (FluoView, FV10i, Olympus).
Compartimento acquoso
Probe idrofilo :
5(6)-CARBOXYFLUORESCEIN
Doppio strato lipidico
Probe lipofilo :
LISS-RHODAMINE B
STUDI DI UPTAKE CELLULARE SULLE FaO
Controllo
Rho-Lipo1
CF-Lipo1
STUDI DI UPTAKE CELLULARE SULLE SKHep
Controllo
Rho-Lipo1
CF-Lipo1
Riferimenti utili
Bertrand, Nicolas et al. “Cancer Nanotechnology: The Impact of Passive and Active
Targeting in the Era of Modern Cancer Biology.” Advanced Drug Delivery Reviews 66
(2014): 2–25.
Danhier, F. “To Exploit the Tumor Microenvironment: Since the EPR Effect Fails in the
Clinic, What Is the Future of Nanomedicine?” Journal of Controlled Release 244 (2016):
108–121.
Danhier, Fabienne, Olivier Feron, and Véronique Préat. “To Exploit the Tumor
Microenvironment: Passive and Active Tumor Targeting of Nanocarriers for AntiCancer Drug Delivery.” Journal of Controlled Release 148.2 (2010): 135–146.
Malam, Yogeshkumar, Marilena Loizidou, and Alexander M. Seifalian. “Liposomes and
Nanoparticles: Nanosized Vehicles for Drug Delivery in Cancer.” Trends in
Pharmacological Sciences 30.11 (2009): 592–599.
Poelstra, Klaas, Jai Prakash, and Leonie Beljaars. “Drug Targeting to the Diseased Liver.”
Journal of controlled release : official journal of the Controlled Release Society 161.2 (2012): 188–
97.
Wang, Haolu et al. “Diagnostic Imaging and Therapeutic Application of Nanoparticles
Targeting the Liver.” J. Mater. Chem. B 3.6 (2015): 939–958.
Zhang, Xue et al. “Drug Delivery System Targeting Advanced Hepatocellular Carcinoma:
Current and Future.” Nanomedicine: Nanotechnology, Biology and Medicine 12.4 (2016): 853–
869.