Chimica Inorganica Biologica
Il diossigeno O2
Tossicità di O2
La comparsa di O2 sulla terra ha rappresentato una catastrofe
ecologica in quanto organismi anaerobici dovettero trasformarsi
in aerobici.
•
•
•
•
•
•
•
•
FeII (solubile) → FeIII (insolubile);
CuI (insolubile) → CuII (solubile);
S−II (insolubile) → SO42− (solubile);
Se−II (insolubile) → SeO32− (solubile);
MoSx (insolubile) → MoO42− (solubile);
CH4 → CO2;
H2 → H2O;
NH3 → NO3−, NO2−, NO.
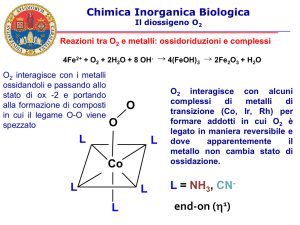
Chimica Inorganica Biologica
Il diossigeno O2
Tossicità di O2
•
•
Per sopravvivere alla reattività dell'ossigeno e dei suoi derivati
gli organismi dovettero sviluppare una moltitudine di
antiossidanti biologici ed un processo opposto alla fotosintesi,
la respirazione.
I batteri anaerobici attuali derivano dai primitivi organismi
anaerobici mentre gli attuali organismi aerobici si sono
sviluppati adattando il loro metabolismo al potere ossidante del
diossigeno.
Il diossigeno è essenziale per la vita degli organismi
aerobici, le cellule umane usano O2 come accettore finale di
elettroni nella respirazione:
O2 + 4H+ + 4e → 2H2O
Chimica Inorganica Biologica
Il diossigeno O2
Cenni storici
o
o
o
La tossicità del diossigeno fu riconosciuta da Rebecca Gerschman (1954).
Irwin Fridowich imputò invece la tossicità allo ione superossido (1968)
Attualmente il candidato principale è il radicale idrossile.
L’azione lesiva di queste specie reattive riguarda i lipidi, il DNA e le proteine.
Il DNA presente all'interno della cellula è vulnerabile all'attacco ossidativo alla
base e allo zucchero; L'ossidazione del DNA può portare a mutazioni.
Le proteine possono subire un danno ossidativo alle catene laterali
amminoacidiche in particolar modo i residui cisteinici e metioninici.
Nella cellula sono comunque presenti le difese opportune.
Chimica Inorganica Biologica
Reattività del diossigeno O2
I lipidi sono componenti essenziali delle membrane ed il danno
ossidativo osservato è dovuto ad autossidazione radicalica.
Perossidazione lipidica
Variazioni irreversibili della
catena fosfolipidica
o Lipidi
o Proteine
o DNA
Chimica Inorganica Biologica
Il diossigeno O2
L'adattamento della vita alla presenza del diossigeno ha potuto
realizzarsi, in assenza di catalizzatori, grazie alla lentezza della
velocità di reazione del diossigeno.
L’utilizzazione del diossigeno comporta la possibilità di formazione
di specie reattive quali: diossigeno singoletto, superosso, perosso
ed ossidrile.
Quest’ultimo, uno dei più potenti radicali conosciuti, è prodotto dalla
riduzione monoelettronica dell’acqua ossigenata da Fe3+ e Cu2+
Chimica Inorganica Biologica
Reattività del diossigeno O2
Sistemi di difesa dell’organismo contro i danni ossidativi
Le reazioni ossidative avvengono in compartimenti
cellulari chiusi: mitocondri e cloroplasti
Esistenza di specie molecolari capaci di catturare i derivati
tossici dell’ossigeno
Sistemi che sequestrano ioni metallici con attività redox
Fe2+ + H2O2
Fe3+ + OH- + OH.
Tocoferolo (E)
membrane
cellulari
citosol
acido
ascorbico (C)
Enzimi detossificanti
glutatione
Chimica Inorganica Biologica
Il diossigeno O2
Cellula
Chimica Inorganica Biologica
Reattività del diossigeno O2
Enzimi detossificanti
Citocromo P-450
Catalasi
Perossidasi
Superossidismutasi
Chimica Inorganica Biologica
Reattività del diossigeno O2
Citocromo P-450
Sono emoproteine il cui sito attivo è molto simile a quello della
emoglobina/mioglobina. Appartengono alla famiglia degli enzimi
mono-ossigenasi perché catalizzano l’inserzione di un atomo di
ossigeno in una grande varietà di substrati
C
C
Idrossilazione di composti alifatici
OH
OH
H
O
S
Epossidazione di alcheni
N+_ O-
N
S
O
Idrossilazione di composti aromatici
Ossidazione di ammine a N-ossidi
Ossidazione di solfuri a solfossidi
Chimica Inorganica Biologica
Reattività del diossigeno O2
Citocromo P-450
Chimica Inorganica Biologica
Reattività del diossigeno O2
Citocromo P-450
Chimica Inorganica Biologica
Reattività del diossigeno O2
Citocromo P-450
Gli enzimi citocromo P450 costituiscono una superfamiglia (CYP) che
conta più di 7700 macromolecole.
Il nome deriva dalla lunghezza d’onda del picco di assorbimento
Fegato
Corteccia Surrenale
Catalizza
reazioni
di
ossidazione
con
scarsa
selettività dei substrati
Metabolismo
di
sostanze
endogene
(acidi
grassi,
steroidi) attraverso reazioni
stereospecifiche
Sono stati difficili da caratterizzare perché
sono legati alle membrane del mitocondrio e
del reticolo endoplasmatico e sono poco
solubili in acqua.
Si è isolato quello presente nel batterio
Pseudomonas putida P-450cam
Chimica Inorganica Biologica
Reattività del diossigeno O2
Citocromo P-450
Questi enzimi consistono di una singola catena
polipeptidica (400-530 aa).
Il gruppo eme b (Fe-protoporfirina IX) è privo di
legami covalenti fra l ’ anello porfirinico e la
proteina. L’atomo è un FeIII BS legato solo ad
un atomo di S di una cisteina (RS-).
L’altra posizione assiale è probabilmente
occupata da una molecola di H2O in prossimità
di una cavità
Il potenziale redox, a pH 7 è – 330 mV.
Chimica Inorganica Biologica
Reattività del diossigeno O2
Citocromo P-450
Meccanismo
Interesse biologico/fisiologico
Interesse chimico/sintetico
Si è ipotizzato che il meccanismo avvenga
attraverso la reazione controllata di O2 e
substrato nella sfera di coordinazione
dello ione metallico (reazione templata)
Orientazione spaziale (stereospecificità)
Attivazione elettronica
Chimica Inorganica Biologica
Reattività del diossigeno O2
Citocromo P-450
Cys:
Fe
Fe
Cys
Met
donatore σ
donatore π
Campo Debole
Alto Spin
Met:
donatore σ
accettore π
Campo Forte
Basso Spin
Interazione con il substrato genera
Fe(III) pentacoordinato ad alto spin.
La variazione di spin cambia il
potenziale redox a +170 mV
L’aumento di potenziale
favorisce la riduzione (via
FADH2): si ottiene Fe(II)
pentacoordinato ad alto spin,
del tutto simile alla specie
che coordina O2 in
emoglobina
Fe(III) esacoordinato a
basso spin: potenziale
redox a -330 mV
XOOH
Se all’enzima si aggiunge un
peracido XOOH (che funge
da donatore di O) il ciclo è
cortocircuitato
(effetto
shunt); ne consegue che
l’atomo di ossigeno proviene
dal perossido -O-OH.
XOH
O2 si coordina per
dare addotto Fe(II)O2
o Fe(III)-superossido
Rimane nel ciclo catalitico la
specie estremamente reattiva
[FeIVPO]+ che ossida
il substrato RH:
[FeIVPO]++RH→FeIII(P)++ ROH
La cattura di un H+ forma un Fe(III)
idroperossido, il quale per rottura eterolitica del
legame O-O si trasforma in OH- che viene
eliminato come H2O per acquisto di un protone.
La seconda riduzione forma il
complesso perossidico
Chimica Inorganica Biologica
Reattività del diossigeno O2
Perossidasi
Classe di emoproteine che catalizza
l’ossidazione di molecole organiche da
parte di H2O2 che viene ridotta ad acqua
H2O2 + AH2
2H2O + A
Il centro metallico è un Fe(III) alto spin
coordinato ad un imidazolo di una istidina.
Nella sesta posizione coordina l’H2O2: gli aa
presenti da questo lato guidano la
coordinazione e promuovono la reazione
Mn-perossidasi
V-perossidasi
Mfree-perossidasi
Questi enzimi consentono l’eliminazione di H2O2
La riduzione completa avviene solo per 80% di O2
Chimica Inorganica Biologica
Reattività del diossigeno O2
Perossidasi
Acidi grassi
Ammine
Fenoli
Xenobiotici
Tossine
Perossidasi
R-CH2-COOH + 2H2O2
3 H2O + R-CHO + CO2
ossidazione
R-COOH
α-ossidazione controllata degli acidi
grassi durante la crescita vegetale con
formazione di anidride carbonica e di un
omologo inferiore
Tireoperossidasi
Citocromo c perossidasi (CCP)
Mieloperossidasi
Lignina perossidasi
Chimica Inorganica Biologica
Reattività del diossigeno O2
Perossidasi
L’enzima più studiato nel gruppo delle perossidasi è
HRP (Horseradish Peroxidase)
Chimica Inorganica Biologica
Reattività del diossigeno O2
Perossidasi
H2O2 coordina sul Fe(III) e
istidina distale media il
trasferimento di un H+ in
modo che entrambi gli
idrogeni siano legati
sull’ossigeno non
coordinato al ferro
Arg polarizza il legame
perossidico favorendo la
rottura eterolitica di detto
legame
Si libera una molecola
di acqua e si forma un
intermedio Fe(IV)=O
con il metallo in uno
stato di ossidazione
elevato. L’anello
porfirinco è un
radicale catione
Composto I è ridotto al Fe(III) di partenza a seguito di due trasferimenti elettronici.
Gli elettroni provengono dal substrato che si ossida
Chimica Inorganica Biologica
Reattività del diossigeno O2
Catalasi
È stata determinata la struttura della
catalasi presente nel fegato di
vitello.
H2O2 + H2O2
2H2O + O2
È una perossidasi speciale
perché il suo substrato è una
seconda molecola di H2O2.
Catalizza
la
reazione
disproprozione di H2O2
di
Il Ferro (III) alto spin è coordinato
assialmente dal gruppo fenolato
dell’aminoacido tirosina e da una
molecola di acqua che viene
spostata dall’H2O2.
Chimica Inorganica Biologica
Reattività del diossigeno O2
Fe(III)porf + H2O2
Fe(III)porf(OOH) + H+
Fe(III)porf(OOH)
Fe(IV)porf+.=O + OH-
Fe(IV)porf+.=O + H2O2
O2 + Fe(III)porf + H2O
Stesso
meccanismo
visto per le
perossidasi e si
forma
Composto I con
ferro ad alta
valenza
Usando H2O2 marcata si è stabilito che rottura legame O-O non avviene. Si tratta di una
riduzione bielettronica del composto I da parte di H 2O2, con l’ossigeno coordinato al ferro
che viene rilasciato in una molecola di acqua
Chimica Inorganica Biologica
Reattività del diossigeno O2
Perossidasi e citocromo P-450
R-H
His
+
Arg
O
O
Fe(IV)-Por+.
Fe(IV)-Por+.
S-Cys
His
Compound I
Come è possibile che la stessa specie ipervalente dia due reazioni molto diverse:
trasferimento di atomo di ossigeno nel cyt P-450
trasferimento elettronico in perossidasi e catalasi
Le cavità in cui si dispone il substrato sono diverse: nel cytP450 RH è molto vicino al ferrile. Nella
perossidasi alcuni aminoacidi bloccano di fatto l’avvicinamento del substrato al ferrile, rendendo
possibile solo il trasferimento dell’elettrone.
Come si effettua la rottura eterolitica del legame perossidico nei due sistemi enzimatici?
Nella perossidasi la polarizzazione del legame è raggiunta grazie all’azione degli aminoacidi. Nel
citocromo P-450 tali aminoacidi non ci sono perché il complesso si trova in una tasca idrofobica.
Probabilmente il legante assiale cisteina, per la sua natura basica, favorisce la rottura eterolitica.
Chimica Inorganica Biologica
Reattività del diossigeno O2
SUPEROSSIDO DISMUTASI (SOD)
Famiglia di metallo proteine che catalizza la disproporzione dello ione
superossido attraverso un meccanismo che consiste di due passaggi
consecutivi:
1)
Mn+ + O2-
2)
M(n-1)+
+ O2
M(n-1)+ + O2
-
Mn+(O22-)
2H+
Mn+ + H2O2
Nello step 1) lo ione superossido riduce lo ione metallico ossidandosi ad ossigeno molecolare
Nello step 2) lo ione superossido riossida lo ione metallico riducendosi a perossido
La reazione complessiva è:
2O2- + 2H+
SOD
O2 + H2O2
Chimica Inorganica Biologica
Reattività del diossigeno O2
Cu-Zn (SOD)
Si trova nei mitocondri delle cellule eucariote
consiste di due subunità identiche tenute
insieme da interazioni idrofobiche
il rame e lo zinco si trovano sul fondo di uno
stretto canale fatto ad imbuto. Le dimensioni di
questo canale consentono il passaggio solo a
molecole molto piccole (H2O) e a piccoli ioni
all’imboccatura del canale sulla superficie
esterna della proteina ci sono due aa lisina,
che essendo carichi positivamente, attraggono
lo ione superossido.
lungo le pareti del canale vi è un aa arginina
anch’esso positivo che ha la funzione di
convogliare l’anione superossido verso il sito
catalitico
una modifica chimica delle lisine e della
arginina comporta una forte diminuzione
dell’attività della SOD
Struttura della forma ossidata della
CuZn-SOD da eritrociti bovini
Chimica Inorganica Biologica
Reattività del diossigeno O2
Cu-Zn (SOD)
His118
His44
Cu2+ è
coordinato a
4 imidazoli istidinici
e a una molecola di
H2O. La geometria è
piramidale a base
quadrata con acqua
nella posizione
apicale
H2O
His 69
Cu
Zn
Asp 81
His 46
His 78
His 61
Zn2+ è coordinato a 3 imidazoli
istidinici e al carbossilato di un
aspartato
A ponte tra i due centri metallici
Chimica Inorganica Biologica
Reattività del diossigeno O2
Cu-Zn (SOD)
His118
H2O
His44
His 69
Cu
Zn
Asp 81
His 46
His 78
Cu2+ è il sito di interazione dello
ione superossido. Quindi il Cu2+ è
His 61
il sito su cui avviene la
disproporzione:
Cu2+ + O2Cu+ + O2-
Cu+ + O2
Cu2+(O22-)
Rimozione dello Zn2+ non altera
l’attività della SOD ma rende più
instabile la proteina che si denatura a
temperatura più bassa della SOD
nativa
Cu2+ + H2O2
Zn2+ ha ruolo strutturale
Attività della SOD è inibita in presenza di specie
anioniche piccole come CN-, F-, N3- che competono
con lo ione superossido nel sito catalitico.