Chimica Inorganica Biologica
Il diossigeno O2
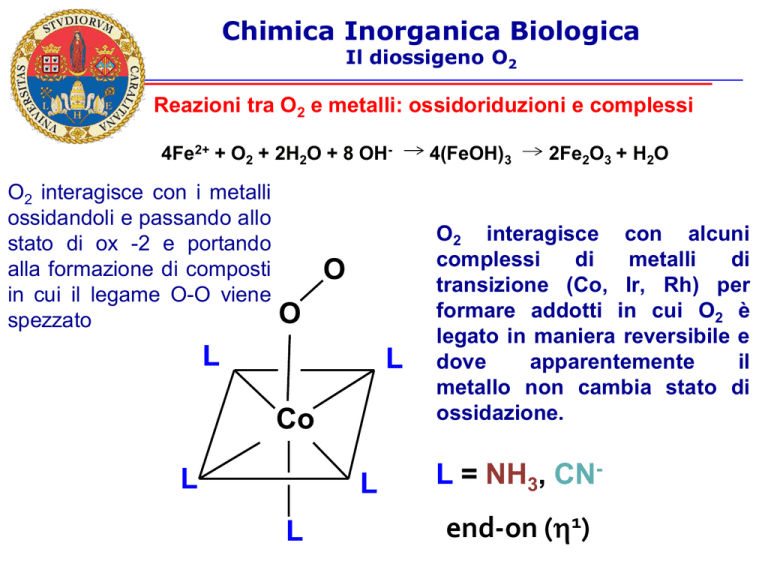
Reazioni tra O2 e metalli: ossidoriduzioni e complessi
4Fe2+ + O2 + 2H2O + 8 OH-
O2 interagisce con i metalli
ossidandoli e passando allo
stato di ox -2 e portando
alla formazione di composti
in cui il legame O-O viene
spezzato
O
O
L
L
Co
L
L
L
4(FeOH)3
2Fe2O3 + H2O
O2 interagisce con alcuni
complessi
di
metalli
di
transizione (Co, Ir, Rh) per
formare addotti in cui O2 è
legato in maniera reversibile e
dove
apparentemente
il
metallo non cambia stato di
ossidazione.
L = NH3, CN-
end-on (h1)
Chimica Inorganica Biologica
Il diossigeno O2
Gli stati di ossidazione formali di O2 possono essere identificati
dalle distanze di legame O-O nei complessi (strutture
cristalline) oppure dalla vibrazione di stiramento ν(O-O)
(spettroscopia IR/Raman) o da misure EPR
side-on (h2)
Complesso di Vaska
n+
d(O-O)
H3N
NH3
H3N NH3
H3N Co O
H N NH O Co NH3
3
3
H3N
NH3
n=4
n=5
1.47 Å
1.31 Å
Legante
O22–
O2· –
Chimica Inorganica Biologica
Il diossigeno O2
Chimica Inorganica Biologica
Il diossigeno O2
Chimica Inorganica Biologica
Il diossigeno O2
Orbitale Molecolare
donatore σ
donatore π
accettore π
Chimica Inorganica Biologica
Il diossigeno O2
La densità elettronica è trasferita
sul centro metallico dalle coppie
elettroniche libere e dal doppio
legame del diossigeno.
Gli
orbitali
nd
parzialmente
occupati del metallo possono
contribuire alla formazione del
legame con O2 attraverso retrocoordinazione.
In questi casi l’O2 agisce da σ e π
donatore/accettore.
P. L. Holland, Dalton Trans., 39, 5415-5425 (2010)
Chimica Inorganica Biologica
Il diossigeno O2
Utilizzo di O2 negli organismi viventi
Prelievo di O2 dall’aria
Trasporto negli organi
Conservazione fino all’utilizzo
Invertebrati
Molluschi
Crostacei
complessi bimetallici con
coordinazione amminoacidica :
emocianina (Cu-Hc)
emeritrina (Fe-Hr)
Vertebrati
Organismi più evoluti
complessi monometallici di
macrocicli porfirinici EME:
tetramero: emoglobina (Hb)
monomero: mioglobina (Mb)
Chimica Inorganica Biologica
Il diossigeno O2
Reattività con gruppi eme
O2 transport in blood (65%)
O2 storage in muscles (6%)
electron transfer (0.1%)
incorporation of molecular O2 (0.1%)
metabolism of H2O2 (0.1%)
terminal oxidation (0.5%)
Chimica Inorganica Biologica
Il diossigeno O2
Reattività con gruppi eme
I complessi porfirinici del FeII (ferro-eme) FeIIP, reagiscono velocemente con il
diossigeno per formare l’ossido
FeIIP + O2 ⇆ FeIIIPO2FeIIIPO2- + FeIIP ⇆ FeIIIP –O-O–PFeIII
FeIIIP –O-O–PFeIII → 2FeIVPO
FeIVPO + FeIIP → FeIIIP –O–PFeIII
P = ione porfirinato P2-
(1)
Chimica Inorganica Biologica
Il diossigeno O2
Reazione 1
Deoxy form
FeIIP + O2 ⇆ FeIIIP(O2·-)
3d6 HS
Reazione spin
permessa con 3O2
S=2
4 e- spaiati
paramagnetico
3d6 LS + 1O2
3d5 LS + 2O2·–
S=0
diamagnetico
Pauling
S=0
diamagnetico
Weiss
Chimica Inorganica Biologica
Il diossigeno O2
La reazione è limitata all’equilibrio (1) se sulla porfirina del
ferro-eme s’introducono barriere strutturali che impediscono la
riduzione bi-elettronica dell’ossigeno (Collman 1974).
In questo caso il ferro eme può assumere funzione di
trasporto.
Mioglobina ed Emoglobina
Chimica Inorganica Biologica
Il diossigeno O2
Le porfirine più semplici da un punto di vista strutturale spesso
vanno incontro alla formazione irreversibile di dimeri
ferrile
ematina
insolubile
Chimica Inorganica Biologica
Il diossigeno O2
La funzionalizzazione delle porfirine viene utilizzata per prevenire la
formazione di dimeri e quindi il blocco delle funzioni di trasporto
Chimica Inorganica Biologica
Il diossigeno O2
Chimica Inorganica Biologica
Il Trasporto del diossigeno O2
Il trasporto del O2 negli organismi viventi avviene utilizzando le
metalloproteine;
Esse sono presenti in tutti i vertebrati, molti invertebrati (artropodi e
molluschi) e in quattro phyla di invertebrati marini:
Emoglobina (Hb), contiene quattro gruppi eme;
Emeritrina (Hr), contiene due atomi di Fe;
Emocianina (Hc), contiene due atomi di Cu.
Si realizza l’equilibrio:
metalloproteina + O2 ⇆ metalloproteinaO2
Chimica Inorganica Biologica
Trasporto di O2: Pigmenti Respiratori
Deoxy
Oxy
Hb
HbO2
Forme
intensamente
colorate
HcO2
HrO2
Chimica Inorganica Biologica
Trasporto di O2: Pigmenti Respiratori
Chimica Inorganica Biologica
Immagazzinamento del diossigeno O2
Emoglobina
Emeritrina
Emocianina
Origine
Animali
superiori
Invertebrati
Artropodi,
molluschi
M:O2 legato
Fe(eme) : O2
2Fe(non eme) : O2 2Cu : O2
M in ossiproteina
Fe3+
Fe3+
Cu2+
M in deossiproteina
Fe2+
Fe2+
Cu+
Colore nella forma ossi
rosso
borgogna
blu
Colore nella forma deossi
rosso-porpora incolore
Gli stati ossidati inattivi sono detti meta
incolore
Chimica Inorganica Biologica
Immagazzinamento del diossigeno O2
Il diossigeno trasportato è ceduto ad altre metalloproteine quali la
Mioglobina (Mb) e Mioemeritrina (mioHr) nei tessuti
per essere
immagazzinato e quindi utilizzato.
Presentano strutture simili alle metalloproteine di trasporto con la
differenza che devono possedere una maggior affinità per il diossigeno.
Chimica Inorganica Biologica
Mioglobina
La struttura della Mb è stata
ottenuta da campioni di balena
Sono state determinate le strutture
delle tre forme: deossi, ossi e meta.
globina
Coordinazione:
4 N pirroli
1 N imidazolo proveniente (His)
1 posizione libera per O 2
150-160 aminoacidi
Presente nei muscoli dei vertebrati
Polipeptide PM 17000 formato da 153
amminoacidi contenuti in sette eliche e sei
segmenti non elica avvolti intorno al gruppo eme
64500 Da
Chimica Inorganica Biologica
Mioglobina ed Emoglobina
Chimica Inorganica Biologica
Deossimioglobina ed Ossimioglobina
raggio 0.92 Å
Il centro attivo è FeII pentacoordinato da
cinque atomi di N con l'atomo metallico
fuori dal piano dei quattro pirroli di 0.42 Å.
Quattro N provengono dai pirroli, il quinto N
dall’imidazolo dell’His (His prossimale).
È anche presente un residuo istidinico, His
distale, vicino alla tasca che ospita il O2.
raggio 0.75 Å
Il legame con il diossigeno avvicina il Fe
al piano N4.
O2 è legato end-on al Fe e forma un
angolo Fe-O-O di 115°.
Chimica Inorganica Biologica
Interazione fra O2 e FeII
La coordinazione con O2 comporta il trasferimento di un elettrone
dal ferro all’ossigeno per formare O2·– stabilizzato via legame-H con
un protone imidazolidinico distale
Il FeII presente nell’eme pentacoordinato è d6 AS con quattro
elettroni spaiati (S=2), nell’eme esacoordinato FeIII è d5 a BS con
un elettrone spaiato (S=1/2)
L’interazione con lo spin dell’elettrone O2– produce un sistema
diamagnetico (S=0).
Chimica Inorganica Biologica
Interazione di O2 nel sito eme
Chimica Inorganica Biologica
Interazione di O2 nel sito eme
Nella forma deossi FeII (AS) non entra nella cavità
Nell'ossi FeIII a BS si posiziona nel piano
Chimica Inorganica Biologica
Interazione di O2 nel sito eme
È presente un residuo istidinico (distale), vicino alla tasca che ospita O2
Si forma un legame ad idrogeno fra O2 coordinato e H-N dell’imidazolo
che produce una coordinazione angolata dell'O2.
Chimica Inorganica Biologica
Interazione di CO nel sito eme
Nei composti fra CO ed Hb/Mb l'angolo Fe-C-O è ancora angolato
Il rapporto K(CO)/K(O2) vale circa 200.
J. N. Harvey, J. Am. Chem. Soc. 2003, 127, 165-177
Chimica Inorganica Biologica
Emoglobina
Il diossigeno dall'aria passa ai polmoni, catturato dall’Hb presente nel
plasma sanguigno:
Polmoni(branchie)
Hb + 4 O2 Hb(O2)4
L’O2 circola attraverso tutto l’organismo e trasportato nei muscoli dove è
strappato dalla Mb
Tessuti
K Mb
[ Mb(O2 )]
[ Mb][O2 ]
K Hb
[ Hb(O2 ) 4 ]
[ Mb][O2 ]2.8
Hb(O2)4 + 4 Mb 4 Mb(O2) + Hb
Chimica Inorganica Biologica
Emoglobina
L’emoglobina (PM 64500) è un tetramero costituito da 4
subunità (α1, α2, β1, β2) ciascuna delle quali lega un
gruppo eme. Le catene sono organizzate in coppie
simmetriche αβ: l'emoglobina può essere considerata un
doppio dimero.
α1, α2, β1, β2 sono disposte simmetricamente intorno a
una cavità centrale occupata da molecole di acqua.
Le subunità sono tenute insieme da interazioni
elettrostatiche e da legami a idrogeno che rendono la
struttura quaternaria assai stabile.
a2
b2
eme
b1
Contenendo quattro gruppi eme, l'emoglobina può
legare sino a 4 molecole di O 2 .
Chimica Inorganica Biologica
Emoglobina
Hb è una proteina multisubunità della Mb ed è
costituita da due catene polipeptidiche α (141 ac) e
due β (146 ac)
In ogni catena è presente un eme legato ad un
imidazolo istidinico
Ιn Hb Fe è fuori dal piano porfirinico di 0.36-0.40 Å
nel legame con O2 si muove di ±0.12 Å.
Nel trasferimento di O2 da Hb a Mb gioca un ruolo
importante lo spostamento di Fe verso il piano
porfirinico
Lo spostamento funge da grilletto per un legame
cooperativo dell'O2 nell'Hb
Chimica Inorganica Biologica
Emoglobina: conformazioni T e R
L’emoglobina è una proteina allosterica
Minor affinità per O2
Maggior affinità per O2
Ponti salini
O2
O2
T
Gli stati conformazionali T e R sono in equilibrio
R
Chimica Inorganica Biologica
Emoglobina: conformazioni T e R
Lo stato T prevale quando le quattro subunità non sono legate ad O2
Interazioni fra le subunità costringono l’His prossimale a resistere nei
confronti del movimento verso il piano allentando il legame con O2
Legame cooperativo
Quando circa 2 molecole di O2 sono legate
ad Hb la struttura quaternaria della proteina
cambia in R facilitando il legame degli altri
due O2
Il legame con O2 porta il Fe nel piano
dell'anello porfirinico trascurando l'His
prossimale.
R
T
Chimica Inorganica Biologica
Effetti Allosterci
Il legame dell’O2 in vivo è modulato da effettori allosterici
che attraverso interazioni con la proteina cambiano
l’affinità e il grado di cooperatività.
Regolatori
H+
CO2
2,3-difosfoglicerato (2,3-DPG)
Stabilizzano la forma T e favoriscono
il rilascio di O2 coordinato
Chimica Inorganica Biologica
Effetto Bohr
Il catabolismo dei nutrienti porta alla formazione di CO2
CO2 + H2O
HCO3– + H+
Protonazione di amminoacidi
Diminuzione del pH
Formazione di ponti salini
Stabilizzazione forma T
Rilascio O2
Chimica Inorganica Biologica
Effetto Bohr
La CO2 prodotta nella respirazione forma
carbammati con i gruppi amminici N-terminali
della Hb
RNH2 + CO2 ⇆ RNHCOO- + H+
L'Hb quindi non solo trasporta O2 ma
facilita la rimozione di CO2
Chimica Inorganica Biologica
2,3-BPG
Il 2,3-bisfosfoglicerato (2,3-BPG) deriva da
un intermedio della glicolisi ed è presente
in quantità elevata nei globuli rossi.
Il 2,3-BPG interagisce mediante legami ionici
con i residui di His-143 delle catene b
Stabilizzazione forma T
Rilascio O2
A pH fisiologico,
il 2,3-BPG è
deprotonato