Chimica Inorganica Biologica
Emeritrina
La presenza biologica delle emeritrine è molto
rara ed è ristretta a quattro phyla di invertebrati:
Policheti, Sipunculidi, Priapulidi e Brachiopodi.
Proteina binucleare di ferro
meglio caratterizzata perché è
relativamente facile da
cristallizzare.
Neanthes succinea (Nereis) - Policheti
L'emeritrina è un pigmento respiratorio violetto nello stato
ossigenato e incolore nello stato deossigenato. Nella sua
forma monomerica (mioemeritrina) ha un peso molecolare
di 13.000-14.000 dalton e contiene due ioni Fe2+ senza
però alcun gruppo eme come nella emoglobina.
La sua limitata distribuzione nel regno animale
ne sancisce il fallimento evolutivo. Le funzioni
che compie negli animali marini non sono
chiare.
Si
pensa
abbia
funzioni
di
immagazzinamento di O2 ma probabilmente
partecipa ad altri processi metabolici.
Un rappresentante del Phylum Sipuncula
Chimica Inorganica Biologica
Emeritrina
Sono disponibili informazioni strutturali ad elevata risoluzione per
l’azoturo-metaemeritrina (mHrN3) e l’azoturo-metamioemeritrina mMrN3
N3– è legato al FeIII al posto di O2 in HrO2
Hr esiste abitualmente come un ottamero di subunità identiche, ma sono stati
isolati e identificati anche tetrameri, trimeri, dimeri e monomeri (mioHr).
La forma monomerica contiene due atomi di Fe circondati da 4 catene
proteiche elicoidali quasi parallele.
Sono note forme mono-, tri- e ottameriche
dell’emeritrina addette a differenti funzioni
Chimica Inorganica Biologica
Emeritrina
Le strutture determinate mostrano che la
proteina si ripiega disponendo le sue quattro
eliche quasi parallele.
Questa disposizione produce un canale
idrofobico dove si colloca il centro
binucleare di FeII e attraverso il quale penetra
la molecola di O2
Chimica Inorganica Biologica
Emeritrina e Ossiemeritrina
I due ioni FeIII con intorno ottaedrico, sono uniti da un atomo di O a ponte
e da due gruppi carbossilati CO2– a ponte, derivanti da residui
amminoacidici del glutammato e aspartato della catena proteica
Tre posizioni terminali su un atomo di
FeIII e due sull'altro sono completati
da imidazoli dell'His.
Un centro metallico ha quindi una
posizione di coordinazione vacante
che serve per legare la molecola di
O2 e formare ossiHr.
R.E. Stenkamp et al., Proc. Natl. Acad. Sci. USA, 1984, 82 713–716
Chimica Inorganica Biologica
Caratterizzazione Hr/HrO2
Tramite l'uso di O2 marcato in modo asimmetrico (18O – 16O) è
stato stabilito che in Hr O2 il diossigeno si lega
asimmetricamente:
Da tecniche spettroscopiche è stato dedotto un angolo FeFe–O2 di circa 90°, in
contrasto con la geometria a ponte -1,1-(idro)perosso. Inoltre la coordinazione di O2
avviene con un solo centro di ferro con una geometria angolata.
La prima struttura è quindi quella corretta.
L’ossigeno è legato
come idroperossido
H-O-O–
Chimica Inorganica Biologica
Caratterizzazione Hr/HrO2
Magnetismo
Hr:
HrO2:
Strutture
Hr:
HrO2:
Raman
HrO2:
2 x FeII d6 AS (paramagnetico)
2 x FeIII d5 BS accoppiati in modo antiferromagnetico
attraverso un ponte -osso.
FeII···FeII = 3.57 Å
FeIII···FeIII = 3.24 Å
ν = 844
cm–1
(perosso)
Si conoscono
ossidate:
anche
due
forme
metaHr: due nuclei di FeIII
semi-metaHr: un FeII e un FeIII
Nessuna delle due forme è capace di
legare O2
Chimica Inorganica Biologica
Emocianina Hc
Le emocianine sono grandi proteine contenenti molte subunità
Palinurus interruptus
460000 Da
L’unità simmetrica è composta di sei subunità
Chimica Inorganica Biologica
Emocianina Hc
La struttura della forma HcO2
contiene due atomi di CuII
La Hc contiene due ioni CuI
Ogni CuI è coordinato da tre
residui His
Chimica Inorganica Biologica
Strutture e Magnetismo
Magnetismo
Hc:
2 x Cu I d 10
HcO 2 :
2 x Cu II d 9 antiferromagneticamente accoppiati
con conseguente diamagnetismo.
Strutture
Hc:
HcO 2 :
Cu I ···Cu I = 4.6 Å
Cu II ···Cu II = 3.6 Å
Raman
HcO 2 :
ν = 744 cm –1 (perosso)
Chimica Inorganica Biologica
Strutture e Magnetismo
Tramite l’uso di O2 marcato in modo asimmetrico (18O–16O)
è stato stabilito che in HcO2 il diossigeno si lega
simmetricamente
(è valida solo una di queste strutture)
Chimica Inorganica Biologica
Emocianina e Ossiemocianina
In Hc, il sito di legame di O 2 consiste di
2 unità di Cu I (D 3h ), Cu I (His) 3 , quasi
coplanari, in cui la distanza Cu···Cu è
4.6 Å, senza leganti a ponte
In HcO 2 , è presente un gruppo
perossidico a ponte, Cu II (- 2 : 2 O 2 )Cu II , (coordinazione " side-on") con
una distanza Cu···Cu di 3.6 Å
2 dei 3 leganti istidinici su ogni Cu
rimangono a formare un arrangiamento
approssimativamente planare
(Cu 2 O 2 N 4 ). La coordinazione a piramide
quadrata di Cu II è completata da una
istidina assiale: le due istidine assiali
hanno una configurazione trans
BLU
Chimica Inorganica Biologica
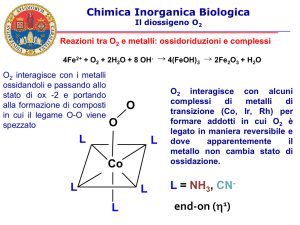
Reattività del diossigeno O2
Citocromi e respirazione
La principale reazione di O2 negli
organismi viventi è la respirazione
O2 + 4H+ + 4e– ⟶ 2H2O
La reazione avviene nell’enzima
citocromo c ossidasi dove gli elettroni
provenienti dalla catena respiratoria
sono utilizzati per la riduzione di O2
ad H2O.
La riduzione della molecola di O2 ad acqua
richiede 4 elettroni che, quando sono ceduti
uno alla volta alla molecola, attraverso
riduzioni monoelettroniche e/o bielettroniche
porterebbero alla formazione di specie
tossiche quali O2·–, O22– e HO·
Chimica Inorganica Biologica
Reattività del diossigeno O2
La respirazione
I trasportatori di elettroni sono disposti
secondo una precisa sequenza, in modo da
garantire un potenziale di riduzione crescente
ovvero una maggiore tendenza a ridursi.
Alcuni trasportatori di elettroni occupano una
posizione fissa nella membrana; altri sono
liberi di muoversi e fungono da navette tra i
trasportatori fissi.
Il flusso di elettroni attraverso la catena
respiratoria inizia quando, su un lato della
membrana a contatto con la matrice, una
molecola di NADH e l’ambiente interno
cedono due elettroni e due ioni H+ al primo
trasportatore della catena: i due elettroni
vengono poi ceduti al successivo
trasportatore, mentre i due ioni H+ vengono
“pompati” sul lato esterno della membrana.
nicotinammide
adenina
dinucleotide
Chimica Inorganica Biologica
Reattività del diossigeno O2
La respirazione
Gli e- passano attraverso i
trasportatori e alla fine
della catena, si
combinano con l’accettore
finale, l’ossigeno che si
trasforma in O2-.
L’ossigeno così ridotto
forma H2O perché si
combina con due ioni H+
ritrasportati all’interno
della matrice.
Chimica Inorganica Biologica
Reattività del diossigeno O2
La respirazione
il NADH viene ossidato liberando due
elettroni e riducendo la FMN a FMNH2 (o
FAD a FADH2 in alternativa)
Queste riduzioni coinvolgono molecole
organiche e il centro metallico Fe-S del
gruppo prostetico dell'enzima NADHcoenzima Q reduttasi, noto anche come
coenzima Q reduttasi o NADH deidrogenasi
o complesso I
flavina
adenina
dinucleotide
Chimica Inorganica Biologica
Reattività del diossigeno O2
Centri Fe-S (Fe non eme)
Chimica Inorganica Biologica
Reattività del diossigeno O2
La respirazione
Il QH2 si ossida a Q liberando due H+ e riducendo il
Fe3+ del citocromo b a Fe2+ che riossidandosi a sua
volta riduce i centri Fe-S da Fe3+ a Fe2+.
L'enzima di questa tappa è il QH2-citocromo c
reduttasi noto anche come citocromo c reduttasi o
complesso III
Durante questa tappa due protoni vengono prelevati
dalla matrice e quattro vengono liberati nel
citoplasma mitocondriale.
Cit c
Chimica Inorganica Biologica
Reattività del diossigeno O2
Complesso III
Chimica Inorganica Biologica
Reattività del diossigeno O2
La respirazione
Prima che termini la catena respiratoria
e avvenga la reazione con O2 entrano in
gioco i citocromi dei sistemi redox
altamente specializzati
Chimica Inorganica Biologica
Reattività del diossigeno O2
Citocromi
La chimica inorganica che avviene nei citocromi è legata al gruppo eme:
chimica di coordinazione
chimica di ossidoriduzione
Nei citocromi il Fe può esistere negli stati di ossidazione
+2 e +3 da cui la capacità di agire come intermedi redox
nel trasferimento elettronico:
Cloroplasti: fotosintesi
Mitocondri: respirazione
Il gruppo eme è avvolto da catene polipeptidiche
che differiscono nel numero di amminoacidi:
103 in alcune specie marine
104 in pesci e vertebrati terrestri
112 in organismi vegetali
La coordinazione del Fe è simile a quella dell’Hb
ma un atomo di S di un residuo metioninico
completa la coordinazione rendendo impossibile
ulteriori
coordinazioni
chimica
di
Chimica Inorganica Biologica
Reattività del diossigeno O2
Citocromi
Sono divisi in vari gruppi (a, b, c etc.) che si
differenziano per alcune caratteristiche del gruppo
prostetico e si distinguono per differenze di
solubilità e di spettro di assorbimento.
Il potenziale redox dipende dai leganti presenti e
può essere finemente modulato.
Il trasferimento di elettroni avviene nell’ordine:
b c a O2
Alcuni citocromi di tipo a sono in
grado di legare l’O2 per poterlo ridurre
citocromo c ossidasi (a3)
Chimica Inorganica Biologica
Reattività del diossigeno O2
Citocromi
Chimica Inorganica Biologica
Reattività del diossigeno O2
La respirazione
L’enzima citocromo c ossidasi contiene
4 centri metallici, costituiti da 2 gruppi
ferro-eme del tipo citocromo a e a3, uno
ione rame (CuB) e 2 ioni rame
raggruppati in un cluster (CuA), che
possono acquistare un totale di 4
elettroni da 4 molecole di citocromo c
Il diossigeno e i protoni necessari alla
riduzione provengono dall’esterno
L'enzima, quando è totalmente ridotto, può legare
l'ossigeno e ridurlo completamente ad acqua,
cedendogli in rapida sequenza i 4 elettroni, senza
liberare nessuno degli intermedi tossici.
I quattro elettroni necessari alla riduzione all’interno
dell’enzima provengono: uno dall’emea ed uno dalla
coppia di Cu+A, uno dal Cu+B ed uno dal Fe2+ dell’eme a3.
Chimica Inorganica Biologica
Reattività del diossigeno O2
La respirazione
Il Fe2+ del citocromo c viene
ossidato riducendo il Fe3+ del
citocromo a
Quest'ultimo riossidandosi riduce il Fe3+ del
citocromo a3.
Il Fe2+ del citocromo a3 riduce il Cu2+ legato alla
citocromo ossidasi (o citocromo c ossidasi o
complesso IV) a Cu+ che riossidandosi riduce
l'O2 a H2O consumando due H+ ogni O.
Altri due protoni vengono portati
dalla matrice al citoplasma
Il citocromo a3 e CuB sono il
cuore della catalisi
e
nell’enzima
ossidato
sono
legati a ponte da un legante,
non nella forma ridotta;
Entrambi posseggono siti di
coordinazione
vacanti
per
legare il diossigeno.
Chimica Inorganica Biologica
Reattività del diossigeno O2
La respirazione
1) (cit c) Fe2+ + (cit a) Fe3+ ⟶ (cit c) Fe3+ + (cit a) Fe2+
2) (cit a Fe2+ + (cit a3) Fe3+ ⟶ (cit a) Fe3+ + (cit a3) Fe2+
3) [(cit a3)Fe2+ CuB+] + O2 ⟶ (cit a3)Fe3+-(O2-) CuB+
4) (cit a3)Fe3+-(O2-) CuB+ ⟶ (cit a3)Fe3+-(O2-2)-CuB+2
5-6) (cit a3)Fe3+-(O2-2)-CuB+2 + e + 2H+ ⟶ (cit a3)Fe4+=O H2O-CuB+2
7) (cit a3)Fe4+=O H2O-CuB+2 + e ⟶ (cit a3)Fe3+-(OH-) (HO-)-CuB+2
(cit a3)Fe3+-(OH-) (HO-)-CuB+2 + 2H+⟶ (cit a3)Fe3+
CuB2+ + 2H2O
Chimica Inorganica Biologica
Reattività del diossigeno O2
Citocromo c ossidasi
La coppia dall’emea /Cu+A, Cu+A è detta a basso potenziale quella
dell’emea3/Cu+B alto potenziale;
La prima coppia accetta elettroni dal citocromo mentre la seconda è il
centro catalitico di riduzione;
In assenza di diossigeno i potenziali redox sono simili.