BiochimicaMatricoledispari1
Biochimica
Matricole dispari 1^
lezioneProf.Spina
p
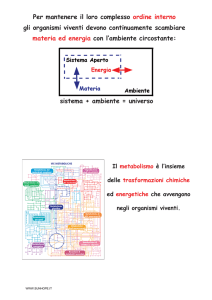
LA BIOCHIMICA
LABIOCHIMICA
15Ͳ20miliardidiannifal’universocomparvesottoformadieruzioni
l d d
f l’
f
d
inimmaginabilidiparticelesubatomichericchedienergiaecalore.
• HeHesiformarononeiprimisecondi;conilprogressivoraffreddamentoi
p
;
p g
materialisicondensavanosottol’influenzadellagravitàgenerandole
stelle.Alcunestellediventaronoenormiedesploserocomesupernove,
rilasciando l’energia
rilasciandol
energiachedeterminòlacondensazionedeinucleidegli
che determinò la condensazione dei nuclei degli
elementisempliciinelementicomplessicheinmiliardidiannigenerarono
lacomplessitàodierna.Circa4miliardidiannifasioriginòlavita,piccoli
organismi capaci di estrarre energia dai composti organici e dalla luce e
organismicapacidiestrarreenergiadaicompostiorganiciedallalucee
operaremutazioninellaformamolecolaredeicompostiorganicichenel
tempogeneraronomolecolesemprepiùcomplesse,lebiomolecole.
• Labiochimicasichiedecomelediversemigliaiadibiomolecole
interagiscanotradiloroconferendoagliesseriviventicaratteristiche
uniche.DaLeheninger:IprincipidiBiochimica.
g
p
p
•
WWW.SUNHOPE.IT
STRUTTURA E FUNZIONE
DELLE PROTEINE
Le PROTEINE sono i biopolimeri maggiormente presenti all
all’interno
interno delle
cellule, dal momento che costituiscono dal 40 al 70% del peso secco.
Svolgono funzioni biologiche di fondamentale importanza e possono essere
divise in 7 gruppi principali:
• SOSTEGNO proteine strutturali (collagene, cheratina, elastina, fibroina)
• CATALISI (enzimi)
g
, albumina,, lipoproteine,
p p
,p
proteine di membrana))
• TRASPORTO ((emoglobina,
• ORMONI proteine regolatorie (es. insulina e glucagone)
• DIFESA proteine di protezione (anticorpi, trombina)
• MOVIMENTO proteine contrattili (actina, miosina)
• RISERVA (ovoalbumina, caseina)
• ATTACCO (tossine batteriche, veleni dei serpenti)
WWW.SUNHOPE.IT
Ligando
Le proteine sono
biomolecole in grado di
comunicare tra di loro e
con altre molecole.
Le relazioni possibili sono
alla base della scelta dei
“partner” e della
costruzione dei
“pathway”.
Falso Ligando
Falso Ligando
Il profilo di superficie
determinato dalle catene
laterali degli aa. è alla
base di questa proprietà
Esempi di modalità di interazione
• ALLOSTERIA (ad es
es. nei recettori
recettori, nei canali ionici
ionici,
nella contrazione).
• MOVIMENTO (ad
( d es. il colpo
l generato
t dalla
d ll miosina
i i a
seguito dell’azione ATPasica delle 2 teste, e
dell’actina che dopo il legame con l’ATP polimerizza
consentendo alla miosina di attaccarsi)
• TRASFORMAZIONE (Gli Enzimi che trasformano il
ligando Substrato in Prodotto)
• FOSFORILAZIONI ((legame
g
covalente con il ligando
g
PO4– che
h modifica
difi lla struttura
t tt
e quindi
i di lle iinterazioni
t
i i
successive)
WWW.SUNHOPE.IT
PROTEINE
Formaefunzione
Strettacorrelazionefraformae
funzione delle proteine
funzionedelleproteine
Èlaconformazionetridimensionale
che conferisce alla proteina
checonferisceallaproteina
l'attivitàbiologicaspecifica
La caratteristica
distintiva di ogni
proteina è la
particolare sequenza
di aminoacidi
WWW.SUNHOPE.IT
Il dogma centrale della genetica
Espressione genica
Espressionegenica.
ungeneunaproteina
i
• PerIniziarecioccuperemodell’organizzazione
p
p g
strutturaledelleproteinelepiùgrandi
molecolefin’oraincontrate.
CLASSIFICHIAMOLE
LeproteinepossonoessereFibroseeGlobulari
• Le proteine di sostegno e alcune di
ll contrattili
l h
quelle
hanno una fforma
fibrosa
Sono costituite da catene polipeptidiche
allungate, disposte in fasci lungo uno stesso
asse a costituire le fibre
Sono insolubili in acqua
• Gli enzimi, gli anticorpi e le proteine di
trasporto hanno invece una forma
globulare
Le catene sono strettamente avvolte in
forma compatta, sferica o globulare, come
un gomitolo
Sono solubili in acqua
WWW.SUNHOPE.IT
La struttura delle proteine ne
determina la funzione
Le proteine costituiscono il 40-70% del peso secco di una
cellula
•
•
•
•
•
Le proteine sono singole catene, non ramificate di monomeri amino
acidici
Nell’organismo umano ne sono presenti centinaia ma solo 20
compongono
p g
le p
proteine .
Per la sintesi di una proteina devono essere presenti tutti
contemporaneamente
La sequenza
q
degli
g amino acidi di una proteina
p
è responsabile
p
della sua
struttura tridimensionale
idi
i
l ((conformazione)
f
i
)
A sua volta, la struttura di una proteina ne determina la funzione
Tutti g
gli amino acidi hanno la stessa
struttura generale ma ciascuno differisce
per il gruppo R
WWW.SUNHOPE.IT
WWW.SUNHOPE.IT
ɲ
Zwitterion
Glicina.Unicoaa.con2sostituentialCɲ identici(2H)
WWW.SUNHOPE.IT
Enantiomeri:molecolenonsovrapponibiliimmagini
speculari
WWW.SUNHOPE.IT
ConvenzionediFischerperdescrivere
molecoleconcentrichiralici,siusala
gliceraldeide per confrontare
gliceraldeideperconfrontare.
Isomeria,stereoisomeria,
enantiomeri
i
WWW.SUNHOPE.IT
Il potererotatorio èlamisuradell'attivitàottica diunasostanza,quest'ultimarappresentala
proprietàdiruotareilpianodivibrazionedella lucepolarizzata posseduta
dai composti
p
otticamenteattivi.Dalpuntodivista
p
otticorappresentauncasoparticolare
pp
p
di birifrangenza dovutaaldiverso indicedirifrazione dellecomponentidestrogiraelevogira
dellalucelinearmentepolarizzata.
LacondizionenecessariaͲ manonsufficienteͲ affinchévi
siaattivitàotticaèchelamolecolasia
i tti ità tti è h l
l l i chirale,cioèessa
hi l i è
nondeveesseresovrapponibileallasuaimmagine
speculare
Unasostanzacapacediruotareilpianodivibrazionedella
l
lucepolarizzatainsensoorario(dasinistraadestra)è
l i t i
i (d i i t
d t )è
detta destrogira,mentreunasostanzaingradodiruotare
talepianoinsensoantiorarioèdetta levogira
Ilpolarimetrodi
Il
l i
di
Laurent
AmminoͲAcido
Dopoavervalutateleproprietàotticheespazialidegliaminoacididefiniamoil
l
l
à
h
l d l
d d f
l
comportamentodiquestafamigliamolecolarechehasiaungruppoacidocheunobasico,
allevariazionidipH
WWW.SUNHOPE.IT
H
FormaIIpHintornoa
neutralità
FormaIpH<2
2
FormaIIIpH>7
EquazionediHendersonHasselbach
HAH++AͲ
[ac.debole][protone][baseconiugata]
Costdidiss.
Ka=[H+][AͲ ]
[HA]
Risolvendoper[H],considerandoillogdientrambei,membridell’eq.
Ri
l d
[H]
id
d il l di t
b i
b i d ll’
moltiplicandoliperͲ1esostituendoil–logconpHepKarispettivamente:
pH=pKa+log[A
pH
pKa + log[AͲ]
[ ]
[HA]
WWW.SUNHOPE.IT
Tamponediacidoaceticoeacetatopk:4,8;poteretamponetra3,8
e4,8,massimaapH4,8.
Latitol.diuna.puòessereconsideratasimileaquellaperl’ac.acet.,magliaa.
presentanoduegruppifunzionalidissociabili,ilcarbossilicoel’amminico.ApHacido
l’a.ènellaformaI,coll’aumentaredelpHilcarbossilesidissociainformacarbossilato
sigeneraunozwitterione(formaII),chedaràlaformaIII,adunpHmoltomaggiore,
infattiilgruppoNH3èunacidodebole.
K1=[H+][II]
[I]
[II]
pH=pK1+log
[I]
WWW.SUNHOPE.IT
WWW.SUNHOPE.IT
WWW.SUNHOPE.IT
WWW.SUNHOPE.IT
P.Champe,R.Harvey,D.R.Ferrier,LEBASI
DELLABIOCHIMICA,Zanichelli Editore
S.p.A. Copyright © 2006
P.Champe,R.Harvey,D.R.Ferrier,LEBASI
DELLABIOCHIMICA,Zanichelli Editore
S.p.A. Copyright © 2006
WWW.SUNHOPE.IT
P.Champe,R.Harvey,D.R.Ferrier,LEBASIDELLA
BIOCHIMICA,Zanichelli Editore S.p.A.
Copyright © 2006
degradazionedelle
proteine
alimentari
Usometabolico
delloscheletro
carboniosodell’aa.
P.Champe,R.Harvey,D.R.Ferrier,LEBASIDELLA
BIOCHIMICA,Zanichelli Editore S.p.A.
Copyright © 2006
WWW.SUNHOPE.IT
• Le proteine sono macromolecole costituite
d ll’ i
dall’unione
di un grande
d numero di unità
i à
elementari: gli amminoacidi (AA)
• Sebbene in natura esistano più di 300
amminoacidi, soltanto 20 sono incorporati
p
nelle proteine dei mammiferi poiché sono gli
unici codificati dal DNA
• La caratteristica strutturale comune a
tutte
u
le p
proteine è di essere dei p
polimeri
m
lineari di amminoacidi
• Ciascuna proteina ha però una propria
struttura tridimensionale che la rende
capace di svolgere specifiche funzioni
biologiche
WWW.SUNHOPE.IT
Struttura degli amminoacidi
• Ogni amminoacido (eccetto la prolina)
possiede un carbonio centrale
centrale,
chiamato carbonio D(chiralico), al
quale
l sono legati
l
ti quattro
tt diff
differenti
ti
gruppi:
• un gruppo amminico basico (-NH2)
• un gruppo carbossilico acido ((-COOH)
COOH)
• un atomo di idrogeno
g
(-H)
• una catena laterale, diversa per
ciascun amminoacido (-R)
WWW.SUNHOPE.IT
Gliaminoacidi
Anatomiadiunamminoacido.Adeccezionedellaprolinaedeisuoiderivati,tuttigli
amminoacidi che si trovano comunemente nelle proteine possiedono questo tipo di struttura.
amminoacidichesitrovanocomunementenelleproteinepossiedonoquestotipodistruttura.
• Tutti gli amminoacidi (tranne la glicina) hanno
l’
l’atomo
di carbonio
b i D legato
l
a quattro gruppii
diversi: il carbonio D ((asimmetrico)) è qquindi
un centro chiralico o otticamente attivo
• Gli amminoacidi che hanno un centro
asimmetrico nel carbonio Dpossono esistere
in due f
forme
m speculari
p
(D ed L) dette
stereoisomeri, isomeri ottici o enantiomeri
• Le p
proteine contengono
g
solo L- amminoacidi
WWW.SUNHOPE.IT
•
Gliaminoacidinaturalie,inparticolare,quellichecostituisconole
l
d
l
l
ll h
l
proteine,appartengonotuttiallaserieL.Giàdatempoperòaminoacidi
dellaserieDsonostatiriscontratiinnatura,inparticolarenei
microrganismi,inalcuniinsetti,negliinvertebratimarini,nellepiante
superiorie,ultimamente,ancheneimammiferi.Recentiricerchein
mutantiditopoprividiDͲaminoacidoossidasihannoinfatticonfermatola
p p
presenzaneitessutideimammiferidiDͲaminoacidiinquantitàsuperioria
quellestimateprecedentemente.
Gli aminoacidi della serie D possono anche formarsi in seguito alla cottura
GliaminoacididellaserieDpossonoancheformarsiinseguitoallacottura
deglialimentioatrattamentitecnologici.LacapacitàditrasformareiDͲ
aminoacidinellaformaLinveceèspecieͲspecifica:nell'uomosololeforme
D della metionina e della fenilalanina possono essere convertite nelle
Ddellametioninaedellafenilalaninapossonoessereconvertitenelle
formeLcorrispondenti.
Champe et al., Le basi della biochimica, Ed. Zanichelli
WWW.SUNHOPE.IT
Quando un amminoacido viene sciolto in
H2O diventa uno ione dipolare
(zwitterione) che può agire sia come
acido
id (donatore
(d
t
di protoni)
t i) che
h come
base (accettore di protoni)
Le sostanze che hanno questa doppia
natura si definiscono anfòtere o anfoliti.
Al pH fisiologico (valore attorno a 7,4)
tutti gli amminoacidi hanno:
• il gruppo carbossilico dissociato,
si forma lo ione negativo carbossilato
((-COO
COO-)
• il gruppo amminico protonato (-NH3+)
Champe et al., Le basi della biochimica, Ed. Zanichelli
WWW.SUNHOPE.IT
• Oltre alla parte funzionale, comune a tutti,
ogni amminoacido presenta un gruppo -R
R
proprio
• La natura del gruppo -R
R conferisce proprietà
diverse a ciascun amminoacido
• Punto isoeletrico (pI): è il valore di pH al
quale un amminoacido ha carica netta 0 cioè è
elettricamente neutro
Il pI è una caratteristica di ogni singolo
amminoacido
• Nelle proteine quasi tutti i gruppi carbossilici
e amminici degli amminoacidi sono uniti in
legami peptidici
• Le proprietà di ciascun amminoacido dipendono
dalle catene laterali (-R) che sono i gruppi
funzionali responsabili della struttura
struttura, delle
funzioni e della carica elettrica delle proteine
• Ciò che sostanzialmente determina il ruolo di
un amminoacido in una proteina è la natura
della catena laterale (-R)
( R)
WWW.SUNHOPE.IT
• Gli amminoacidi possono essere classificati in
base alle proprietà delle loro catene laterali
(-R), considerando la loro polarità o non
polarità
l
à all pH
H fisiologico
f
l
e quindi
d lla tendenza
d
ad interagire
g
con l’acqua
q
• Gli amminoacidi con catene laterali cariche
cariche,
idrofiliche, sono generalmente esposti sulla
superficie
fi i d
delle
ll proteine
i
• I residui idrofobici, non polari, si trovano in
genere all
all’interno
interno delle proteine,
proteine protetti dal
contatto con l’acqua
Amminoacidi con gruppi -R alifatici
(non polari)
• Glicina,, alanina,, valina,, leucina,, isoleucina,, metionina,,
prolina.
• Le loro catene laterali sono costituite da una catena
idrocarburica satura: sono idrofobici.
• La metionina è uno dei due amminoacidi contenenti
zolfo.
• La
L prolina
li ha
h una caratteristica
tt i ti struttura
t tt
ad
d anello,
ll
formato dalla catena laterale e dal suo gruppo
amminico,
i i
e diff
differisce
i
d
dagli
li altri
lt i amminoacidi
i
idi
perché contiene un gruppo imminico (R-NH-R’).
E’ solo moderatamente polare.
WWW.SUNHOPE.IT
Champe et al., Le basi della biochimica, Ed. Zanichelli
Amminoacidi con gruppi -R
aromatici
Fenilalanina, tirosina, triptofano
Le loro catene laterali sono aromatiche
Sono relativamente non polari (idrofobici)
Possono partecipare tutti ad interazioni
idrofobiche
f
• I gruppi -OH della tirosina ed NH del
triptofano possono formare legami a idrogeno
•
•
•
•
WWW.SUNHOPE.IT
Amminoacidi aromatici
Nonpolare
ionizzabile
Nonpolare
Amminoacidi con gruppi -R polari,
non carichi
• Serina, treonina, cisteina, asparagina, glutammina
• Sono
n p
polari m
ma in
n condizioni
n z n ffisiologiche
g
sono
n p
privi di
carica elettrica.
• I loro gruppi -R
R sono più idrofilici di quelli degli AA
non polari: contengono gruppi funzionali che formano
legami idrogeno con ll’acqua.
acqua.
• La polarità di serina e treonina è dovuta al gruppo
ossidrilico (-OH)
( OH), quella della cisteina al gruppo
sulfidrilico (-SH), quella di asparagina e glutammina ai
gruppi ammidici ((-CONH
CONH2), dove sia la porzione
carbonilica che quella amminica possono entrare in
g
gioco.
WWW.SUNHOPE.IT
Amminoacidi con gruppi -R carichi
positivamente (basici)
• Lisina
Lisina, arginina,
arginina istidina
• Sono accettori di protoni
• Le loro catene laterali, contenenti gruppi
pH fisiologico
g
sono ionizzate
amminici, a p
ed hanno carica positiva
• L
L’istidina
istidina è debolmente basica (pKa = 6
6,0)
0)
ed a pH fisiologico l’amminoacido libero è
in gran parte non ionizzato; quando si
trova incorporata in una proteina può
recare una carica positiva o essere
neutra (proprietà molto importante!)
WWW.SUNHOPE.IT
Struttura degli
g amminoacidi
Amminoacidi polari con carica
Sidispongonoall’esterno
della molecola proteica a
dellamolecolaproteicaa
contattoconilsolvente
*
H
WWW.SUNHOPE.IT
Amminoacidi con gruppi -R carichi
negativamente
i
( idi)
(acidi
• Acido aspartico, acido glutammico.
• Sono donatori di protoni.
p
• I gruppii carbossilici
b
ili i d
delle
ll lloro catene
t
laterali, al pH fisiologico, sono ionizzati ed
hanno carica negativa.
PROTEINE ACIDE E BASICHE
Le proteine nelle quali il rapporto:
(6lys +6arg )/(6asp +6glu )>1sono basiche.
Quando tale rapporto
(6lys +6arg )/(6asp +6glu )<1sono acide.
WWW.SUNHOPE.IT
Strutturadegliamminoacidi
Amminoacidi con caratteristiche particolari
WWW.SUNHOPE.IT
Champe et al., Le basi della biochimica, Ed. Zanichelli
Dal punto di vista biochimico gli
amminoacidi si possono classificare in:
• Essenziali: quegli AA che una determinata specie
non è in
n grado
gra o di ssintetizzare
nt t zzar (o li ssintetizza
nt t zza in
n
quantità non sufficienti *);
- devono essere introdotti con la dieta
- Phe, Val, Thr, Try, Ile, Met, Leu, Lys, His*, Arg*
(* sono necessarii nella
ll dieta
di t solo
l d
durante
t llo stadio
t di
giovanile di crescita)
• Non essenziali: q
quegli
g AA che una determinata
specie è in grado di sintetizzare.
WWW.SUNHOPE.IT
• Glucogenici: tutti gli AA dal cui catabolismo
otteniamo acido piruvico o un intermedio del ciclo di
Krebs e che quindi possono essere utilizzati per
riformare glucosio (Asp,
(Asp Glu
Glu, Asn,
Asn Gln,
Gln His,
His Pro,
Pro Arg,
Arg
Gly, Ala, Ser, Cys, Met, Val).
• Chetogenici: gli AA dal cui catabolismo otteniamo
acetilCoA o acetoacetilCoA, che quindi non possono
essere utilizzati per riformare glucosio (leucina e
lisina).
• Sia
Si ch
chetogenici
t
nici ch
che glucogenici:
luc
nici: dal
d l lloro
catabolismo otteniamo acido piruvico o un
intermedi del cicl
intermedio
ciclo di Krebs,
Krebs oltre
ltre che acetil C
CoA
Ao
acetoacetilCoA (Phe, Tyr, Trp, Ile, Thr).
WWW.SUNHOPE.IT