SINTESI DEI CONTENUTI
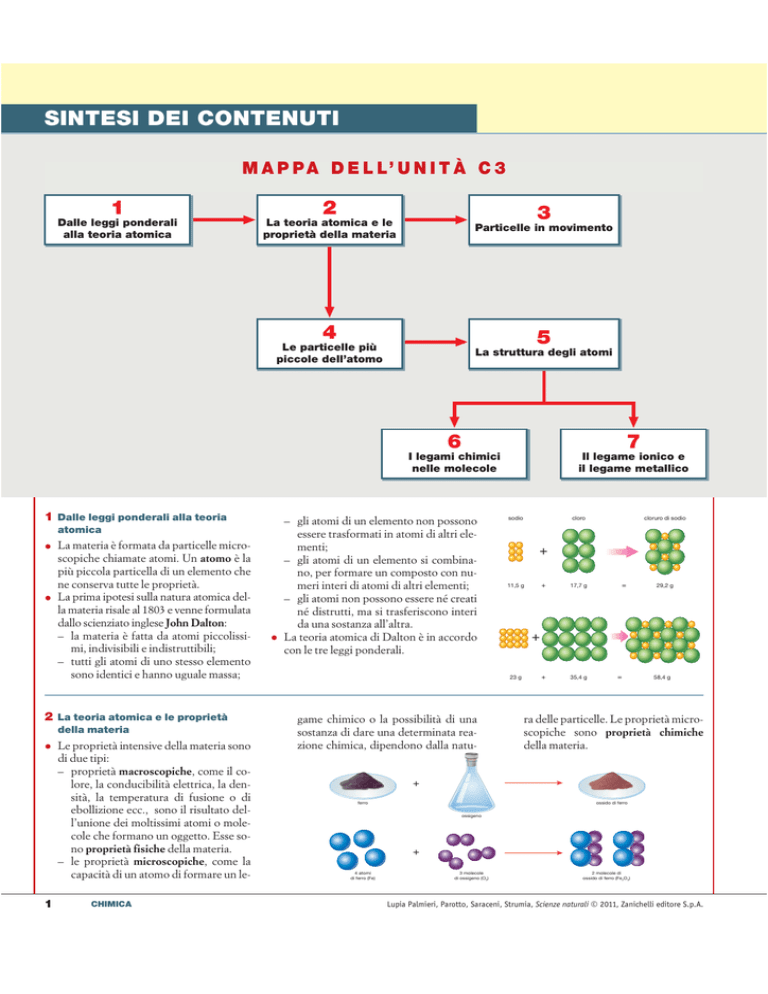
M A P P A D E L L’ U N I T À C 3
1
2
Dalle leggi ponderali
alla teoria atomica
La teoria atomica e le
proprietà della materia
3
Particelle in movimento
4
5
Le particelle più
piccole dell’atomo
1 Dalle leggi ponderali alla teoria
atomica
• La materia è formata da particelle micro-
•
scopiche chiamate atomi. Un atomo è la
più piccola particella di un elemento che
ne conserva tutte le proprietà.
La prima ipotesi sulla natura atomica della materia risale al 1803 e venne formulata
dallo scienziato inglese John Dalton:
– la materia è fatta da atomi piccolissimi, indivisibili e indistruttibili;
– tutti gli atomi di uno stesso elemento
sono identici e hanno uguale massa;
2 La teoria atomica e le proprietà
della materia
• Le proprietà intensive della materia sono
di due tipi:
– proprietà macroscopiche, come il colore, la conducibilità elettrica, la densità, la temperatura di fusione o di
ebollizione ecc., sono il risultato dell’unione dei moltissimi atomi o molecole che formano un oggetto. Esse sono proprietà fisiche della materia.
– le proprietà microscopiche, come la
capacità di un atomo di formare un le-
1
CHIMICA
•
La struttura degli atomi
6
7
I legami chimici
nelle molecole
Il legame ionico e
il legame metallico
– gli atomi di un elemento non possono
essere trasformati in atomi di altri elementi;
– gli atomi di un elemento si combinano, per formare un composto con numeri interi di atomi di altri elementi;
– gli atomi non possono essere né creati
né distrutti, ma si trasferiscono interi
da una sostanza all’altra.
La teoria atomica di Dalton è in accordo
con le tre leggi ponderali.
sodio
cloruro di sodio
ⴙ
11,5 g
ⴙ
17,7 g
ⴙ
35,4 g
ⴝ
29,2 g
ⴙ
23 g
game chimico o la possibilità di una
sostanza di dare una determinata reazione chimica, dipendono dalla natu-
cloro
ⴝ
58,4 g
ra delle particelle. Le proprietà microscopiche sono proprietà chimiche
della materia.
ⴙ
ferro
ossido di ferro
ossigeno
ⴙ
4 atomi
di ferro (Fe)
3 molecole
di ossigeno (O2)
2 molecole di
ossido di ferro (Fe2O3)
Lupia Palmieri, Parotto, Saraceni, Strumia, Scienze naturali © 2011, Zanichelli editore S.p.A.
3 Particelle in movimento
• Per spiegare importanti proprietà della
materia, come l’esistenza dei tre stati di
aggregazione e i passaggi di stato, si ricorre alla teoria cinetica. Essa afferma che:
– le particelle che formano la materia
(atomi, molecole) sono in continuo e
inarrestabile movimento;
– temperatura e calore sono manifestazioni del moto delle particelle;
•
•
•
4 Le particelle più piccole dell’atomo
• Oggi sappiamo che tutti gli atomi sono for-
mati da tre tipi di particelle subatomiche:
– l’elettrone (e), con carica elettrica negativa (⫺ 1,6 ⫻ 10⫺19 C) e massa pari
a 9,1 ⫻ 10⫺31 kg.
– il protone (p), con carica elettrica positiva, il cui valore è pari a quella degli
5 La struttura degli atomi
• A partire dalla scoperta degli elettroni, gli
•
•
•
•
spazio in cui
ruotano gli elettroni
•
•
•
•
e il legame metallico
• Alcuni elementi, come i gas nobili (gli ele-
•
•
nucleo
positivo
•
•
– il legame covalente,
– il legame ionico,
– il legame metallico.
In tutti i casi, formando un legame, gli
atomi tendono a diventare più stabili. Un
atomo raggiunge la massima stabilità
quando l’orbitale più esterno contiene 8
elettroni.
Il legame covalente si forma quando due
«strappandoli» a un altro. Si formano così
due ioni dotati di carica elettrica: un catione (⫹) e un anione (⫺).
Tra cationi e anioni si manifesta un’attrazione elettrostatica detta legame ionico.
Nei metalli, gli atomi sono uniti tramite
legami metallici dovuti all’attrazione fra i
cationi metallici e gli elettroni del livello
energetico più esterno che, negli elementi
metallici, sono liberi di muoversi.
Lupia Palmieri, Parotto, Saraceni, Strumia, Scienze naturali © 2011, Zanichelli editore S.p.A.
sima perché esse sono molto distanti tra
loro e libere le une rispetto alle altre. Il
moto è casuale e disordinato e gli urti sono molto frequenti.
Il passaggio da uno stato di aggregazione
a un altro è il risultato della variazione del
moto e della distanza delle particelle, dovuto al riscaldamento o al raffreddamento
della materia.
ⴙ
modello atomico
di Rutherford
7 Il legame ionico
menti del diciottesimo gruppo), hanno il
livello energetico più esterno completo di
8 elettroni e per questa ragione non hanno
alcuna tendenza a formare legami chimici.
In altri casi, l’interazione tra atomi di diverso tipo può portare a un trasferimento
di elettroni: un atomo acquista elettroni
elettroni, ma di segno opposto; la massa
è invece 1836 volte quella dell’elettrone;
– il neutrone (n), una particella priva di
carica elettrica, con massa praticamente uguale a quella del protone.
La presenza all’interno degli atomi di
queste particelle cariche è alla base
dell’elettrizzazione della materia.
ma resta ancora valido nel suo principio ge-
6 I legami chimici nelle molecole
•
•
• Il modello di Rutherford è stato superato
scienziati ipotizzarono che all’interno dell’atomo fosse presente una carica positiva
che bilanciasse quella negativa.
Thompson suggerì l’idea che l’atomo fosse
una sfera di carica positiva in cui gli elettroni erano distribuiti a distanza regolare, «come le uvette in un panettone».
Rutherford ideò un esperimento che lo
portò a formulare un modello con le cariche positive concentrate in un nucleo centrale, intorno al quale ruotano gli elettroni.
Gli orbitali sono le porzioni di spazio intorno al nucleo entro le quali si muovono
gli elettroni. Gli orbitali corrispondono a
livelli energetici differenti: quelli più vicini al nucleo hanno un contenuto energetico inferiore di quelli più lontani.
Gli atomi degli elementi si uniscono tra
loro con tre tipi diversi di legami chimici:
– la distanza tra le particelle dipende dallo stato di aggregazione della materia.
Nei corpi allo stato solido le particelle sono molto vicine tra loro, hanno una posizione reciproca stabilita e vibrano continuamente intorno a posizioni fisse.
Nei corpi allo stato liquido, le particelle
sono in grado di scorrere le une sulle altre.
Nella materia allo stato aeriforme la libertà di movimento delle particelle è mas-
ⴙ
nerale: la maggior parte della massa di un
atomo si trova concentrata nel suo nucleo.
Inoltre, il moderno modello atomico comprende anche i neutroni, anch’essi localizzati nel nucleo.
Il numero di protoni nel nucleo dell’atomo caratterizza un elemento e si chiama
numero atomico.
Il numero dei protoni sommato a quello
dei neutroni si chiama numero di massa.
Atomi con uguale numero atomico ma
diverso numero di massa sono chiamati
isotopi.
atomi mettono in comune una o più coppie di elettroni (fino a un massimo di tre
coppie).
O
Naⴙ
O
Clⴚ
U N I T À C3• Le particelle della materia
2












