ITIS H.HERTZ
Progetto “Monoennio”
Chimica e laboratorio
PARTE PRIMA
I ° MODULO: Struttura atomica e molecolare della materia
PESO : 70%
UNITA’ ORARIE PREVISTE : 20 h
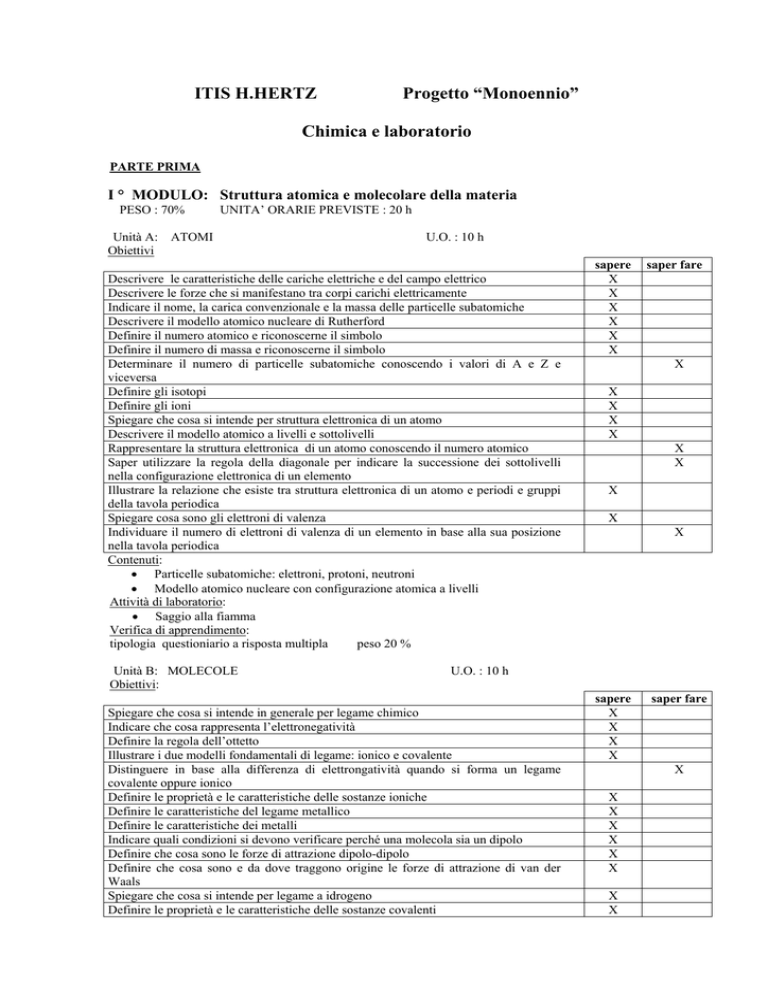
Unità A: ATOMI
Obiettivi
U.O. : 10 h
Descrivere le caratteristiche delle cariche elettriche e del campo elettrico
Descrivere le forze che si manifestano tra corpi carichi elettricamente
Indicare il nome, la carica convenzionale e la massa delle particelle subatomiche
Descrivere il modello atomico nucleare di Rutherford
Definire il numero atomico e riconoscerne il simbolo
Definire il numero di massa e riconoscerne il simbolo
Determinare il numero di particelle subatomiche conoscendo i valori di A e Z e
viceversa
Definire gli isotopi
Definire gli ioni
Spiegare che cosa si intende per struttura elettronica di un atomo
Descrivere il modello atomico a livelli e sottolivelli
Rappresentare la struttura elettronica di un atomo conoscendo il numero atomico
Saper utilizzare la regola della diagonale per indicare la successione dei sottolivelli
nella configurazione elettronica di un elemento
Illustrare la relazione che esiste tra struttura elettronica di un atomo e periodi e gruppi
della tavola periodica
Spiegare cosa sono gli elettroni di valenza
Individuare il numero di elettroni di valenza di un elemento in base alla sua posizione
nella tavola periodica
Contenuti:
• Particelle subatomiche: elettroni, protoni, neutroni
• Modello atomico nucleare con configurazione atomica a livelli
Attività di laboratorio:
• Saggio alla fiamma
Verifica di apprendimento:
tipologia questioniario a risposta multipla
peso 20 %
Unità B: MOLECOLE
Obiettivi:
sapere
X
X
X
X
X
X
saper fare
X
X
X
X
X
X
X
X
X
X
U.O. : 10 h
Spiegare che cosa si intende in generale per legame chimico
Indicare che cosa rappresenta l’elettronegatività
Definire la regola dell’ottetto
Illustrare i due modelli fondamentali di legame: ionico e covalente
Distinguere in base alla differenza di elettrongatività quando si forma un legame
covalente oppure ionico
Definire le proprietà e le caratteristiche delle sostanze ioniche
Definire le caratteristiche del legame metallico
Definire le caratteristiche dei metalli
Indicare quali condizioni si devono verificare perché una molecola sia un dipolo
Definire che cosa sono le forze di attrazione dipolo-dipolo
Definire che cosa sono e da dove traggono origine le forze di attrazione di van der
Waals
Spiegare che cosa si intende per legame a idrogeno
Definire le proprietà e le caratteristiche delle sostanze covalenti
sapere
X
X
X
X
saper fare
X
X
X
X
X
X
X
X
X
Spiegare quando due sostanze sono solubili o miscibili
Prevedere se il mescolamento di due sostanze porta ad un miscuglio omogeneo o
eterogeneo
Contenuti
• Legame ionico e sostanze ionici
• Legame covalente, legami intermolecolari e sostanze covalenti
• Legame metallico e proprietà dei metalli
Attività di laboratorio:
• Polarità, solubilità e miscibilità
• Conducibilità sostanze ioniche e covalenti
Verifica di apprendimento:
tipologia questionario a risposta multipla
peso 20 %
Verifica sommativa di fine modulo:
tipologia questionario a risposta multipla
peso 60 %
X
X
II ° MODULO Il linguaggio e i conti dei chimici
PESO : 30%
UNITA’ ORARIE PREVISTE : 10 h
Unità A: SIMBOLI E FORMULE
Obiettivi
U.O. : 4 h
Illustrare la differenza tra elementi e composti
Assegnare il nome ad un elemento di cui è noto il simbolo
Scrivere il simbolo di un elemento di cui è noto il nome
Descrivere che cosa rappresenta una formula chimica
Definire che cosa è una molecola
Descrivere che cosa rappresentano gli indici presenti in una formula
Determinare il numero di atomi di ogni elemento presenti in una formula
Indicare che cosa rappresentano i numeri che precedono una formula
Classificare le sostanze in elementi e composti in base alla formula
Classificare un elemento in base alla posizione che occupa nella tavola periodica
Definire che cosa sono gli ossidi, gli idrossidi, gli ossiacidi, gli idracidi e i sali
Distinguere in base alla formula gli ossidi basici da quelli acidi
Scrivere la reazione di formazione di un idrossido,di un ossiacido, di un sale
Contenuti:
• Elementi e composti
• Simboli e formule
• Famiglie di composti
Verifica di apprendimento:
tipologia questionario a risposta multipla
peso 10 %
Unità B: MOLE E MOLARITÀ
Obiettivi
sapere
X
saper fare
X
X
X
X
X
X
X
X
X
X
X
X
U.O. : 6 h
Definire la quantità di sostanza e la sua unità di misura (mole)
Definire che cosa si intende per peso atomico (PA) e per peso molecolare (PM)
Calcolare il peso molecolare di una sostanza in base alla sua formula
Definire che cosa si intende per volume molare e indicarne il valore in condizioni
standard
Utilizzare l’equazione generale del gas ideale
Calcolare quante moli corrispondono ad una massa assegnata di sostanza e viceversa
Calcolare quante moli corrispondono ad una volume assegnato di sostanza aeriforme e
viceversa
Indicare le caratteristiche delle soluzioni
Definire la concentrazione di una soluzione (g/L)
Definire la concentrazione di una soluzione (molarità)
Calcolare le moli di soluto contenute in un volume assegnato di soluzione di cui è nota
la concentrazione e viceversa
Calcolare la massa di soluto (o il volume di soluzione) necessaria per preparare una
soluzione a volume e molarità assegnati
Spiegare che cosa si intende per soluzione satura
Definire la solubilità di un soluto in un solvente
Contenuti:
• Mole
• Peso atomico
• Peso molecolare
• Soluzioni e concentrazioni
Attività di laboratorio:
• Preparazione di una soluzione a molarità nota
• Determinazione dell’acqua di cristallizzazione
Verifica di apprendimento:
tipologia questionario a risposta multipla; esercizi stechiometrici
peso 20 %
Verifica sommativa di fine modulo:
tipologia questionario a risposta multipla
peso 70 %
sapere
X
X
saper fare
X
X
X
X
X
X
X
X
X
X
X
X
SECONDA PARTE
I ° MODULO Reazioni chimiche
PESO : 30%
UNITA’ ORARIE PREVISTE : 10 h
Unità A: CARATTERISTICHE DELLE REAZIONI
Obiettivi
U.O. : 5 h
Spiegare che cosa è una reazione chimica
Individuare i reagenti e i prodotti in base alla descrizione di una reazione chimica
Rappresentare gli stati fisici di reagenti e prodotti usando le abbreviazioni
convenzionali
Enunciare il principio di conservazione dell’energia
Definire le reazioni esoenergeriche ed endoenergetiche
Elencare i fattori da cui dipende la velocità di reazione
Illustrare la teoria delle collisioni
Definire l’energia di attivazione e il complesso attivato
Descrivere il grafico che rappresenta il variare dell’energia nel corso di una reazione
Indicare come varia la velocità al variare della concentrazione dei reagenti e al variare
della temperatura
Definire che cosa sono i catalizzatori
Scrivere l’espressione della costante di equilibrio di una reazione di cui è nota
l’equazione
Spiegare la relazione tra Keq e la tendenza ad avvenire di una reazione
Contenuti:
• Reazioni chimiche
• Energia nelle reazioni chimiche
• Velocità delle reazioni chimiche
Attività di laboratorio:
• Fenomeni legati alle reazioni chimiche
• Velocità di reazione al variare della concentrazione e della temperatura
Verifica di apprendimento:
tipologia questionario a risposta multipla
peso 20 %
Unità B: STECHIOMETRIA DELLE REAZIONI
Obiettivi
peso 60 %
saper fare
X
X
X
X
X
X
X
X
X
X
X
X
U.O. : 5 h
Enunciare la legge di conservazione della massa
Scrivere l’espressione di una reazione chimica usando i nomi delle sostanze e
indicando l’energia in gioco
Calcolare la massa dei reagenti o dei prodotti applicando la legge di conservazione
della massa
Illustrare che cosa rappresenta un’equazione chimica
Spiegare che cosa rappresentano i coefficienti stechiometrici nelle equazioni chimiche
Descrivere che cosa significa affermare che un’equazione chimica è bilanciata
Determinare i coefficienti stechiometrici necessari per bilanciare un’equazione chimica
Calcolare la massa (volume, moli) di sostanza che reagisce (o che si forma) in una
trasformazione chimica di cui è nota l’equazione bilanciata
Contenuti:
• Stechiometria reazioni chimiche
Attività di laboratorio:
• Verifica della legge di Lavoisier
• Determinazione volume H2 prodotto in una reazione chimica
• Precipitazione quantitativa PbSO4
Verifica di apprendimento:
tipologia questionario a risposta multipla, bilanciamento reazioni, calcoli stechiometrici
Verifica sommativa di fine modulo:
tipologia questionario a risposta multipla
sapere
X
sapere
X
saper fare
X
X
X
X
X
X
X
peso 20 %
I I° MODULO Alcuni tipi di reazioni
PESO : 70%
UNITA’ ORARIE PREVISTE : 20 h
Unità A: EQUILIBRI ACIDO BASE
Obiettivi
U.O. : 10 h
Spiegare che cosa sono le soluzioni elettrolitiche e gli elettroliti
Definire acidi e basi secondo la teoria di Bronsted e Lowry
Rappresentare l’equazione di scambio protonico tra un acido e una base
Scrivere la Ka di un dato acido e la Kb di una data base in soluzione acquosa
Scrivere l’equilibrio di autoionizzazione dell’acqua e l’espressione del Kw
Valutare la forza di un acido (o di una base) conoscendo i valori di Ka ( o di Kb)
Indicare che cosa rappresenta il pH di una soluzione
Determinare il pH di soluzioni di acidi forti e di basi forti la cui concentrazione è
espressa con potenze di dieci
Descrivere a livello particellare la reazione di neutralizzazione
Svolgere calcoli stechiometrici relativi a una reazione di neutralizzazione acido-base
Definire l’idrolisi acida e l’idrolisi basica
Contenuti:
• Reazioni con scambio di protoni
• Equilibri acido base
Attività di laboratorio:
• Titolazione acido base
Verifica di apprendimento:
tipologia questionario a risposta multipla, calcoli stechiometrici
peso 20 %
Unità B: EQUILIBRI DI OSSIDORIDUZIONE
Obiettivi
saper fare
X
X
X
X
X
X
X
X
X
U.O. : 10 h
Definire il numero di ossidazione
Stabilire il numero di ossidazione di un dato atomo singolo o combinato
Indicare come cambia il numero di ossidazione in un elemento che si ossida e in
elemento che si riduce
Definire una reazione di ossidoriduzione
Riconoscere una semi reazione di riduzione o una semi reazione di ossidazione
Bilanciare una reazione di ossidoriduzione con il metodo delle semi reazioni
Illustrare il criterio con cui sono ordinati i metalli e i loro ioni nella scala elettrochimica
Stabilire se una reazione di ossidoriduzione può avvenire in base alla posizione
occupata dalle specie chimiche reagenti nella scala elettrochimica
Definire una cella elettrochimica o pila
Definire una cella elettrolitica
Contenuti:
• Reazioni con scambio di elettroni
• Processi di ossido riduzione
• Elettrochimica
Attività di laboratorio:
• Tendenza ossidarsi o ridursi di alcuni metalli
Verifica di apprendimento:
tipologia questionario a risposta multipla, bilanciamento reazioni
peso 20 %
Verifica sommativa di fine modulo:
tipologia questionario a risposta multipla
sapere
X
X
peso 60 %
sapere
X
saper fare
X
X
X
X
X
X
X
X
X