SYLLABUS 2007
OBESITA’ E SALUTE DELLA DONNA
Prof. A. Pinchera
Dipartimento di Endocrinologia e Metabolismo, Ortopedia e traumatologia,
Medicina del Lavoro – Università degli Studi di Pisa
L‟obesità è una condizione cronica che deriva da gradi diversi di suscettibilità e
fortemente influenzata dall‟ambiente; da questa condizione morbosa conseguono
spesso alterazioni delle funzioni endocrina e metabolica
I fattori genetici rivestono un ruolo importante nel determinare la prevalenza
dell‟obesità in una popolazione. Un relativamente piccolo numero di geni appare
il principale regolatore della distribuzione del tessuto adiposo e della sua
quantità, mentre un numero ancora non determinato di geni “di suscettibilità“ può
produrre effetti minori che dipendono da interazioni intergeniche e con
l‟ambiente.
Da un punto di vista epidemiologico sono questi ultimi i fattori più rilevanti
perchè sono i responsabili del continuo, rapido incremento dell‟obesità e delle
patologie ad essa associate. Dalle più recenti indagini epidemiologiche condotte
nei paesi ad alto tenore economico emerge che la prevalenza dell‟obesità, in
costante aumento, interessa maggiormente il sesso femminile.
Il genere esercita profondi effetti sulla funzione endocrina e metabolica del
tessuto adiposo. Le donne hanno una più elevata percentuale di grasso corporeo
rispetto agli uomini e tendono ad immagazzinare il tessuto adiposo
preferenzialmente nella regione gluteo-femorale a differenza del sesso maschile
che presenta una distribuzione concentrata prevalentemente a livello addominale
e viscerale. La cellula adiposa del tessuto gluteo-femorale presenta caratteristiche
funzionali diverse rispetto a quella del tessuto viscerale. La gravidanza e
l‟allattamento sono eventi fisiologici associati ad una notevole spesa energetica.
Per questo motivo nella donna, il tessuto adiposo, in quanto riserva energetica, è
più rappresentato rispetto a quello dell‟uomo Le differenze nel metabolismo della
cellule adiposa viscerale nei due sessi scompaiono con la menopausa, che
potrebbe essere la causa della redistribuzione del tessuto adiposo con
preferenziale localizzazione a livello addominale nelle donne predisposte. Gli
estrogeni possono essere considerati i principali mediatori delle differenze
metaboliche dell‟adipocita relativamente al genere
Sebbene una massa critica di tessuto adiposo sia essenziale per il corretto
funzionamento del sistema riproduttivo femminile, è altresì noto che l‟obesità si
associa ad alterazioni della ciclicità mestruale e a ridotta fertilità.
Se l‟obesità insorge in età infantile, l‟epoca del menarca è in genere più precoce
ed i cicli sono spesso anovulatori ed irregolari. Le donne obese hanno un maggior
rischio di aborto nel primo trimestre e, se la gravidanza è a termine, partoriscono
con maggiore frequenza rispetto alla popolazione generale bambini macrosomici.
L‟epoca della menopausa è in genere più precoce nelle donne obese rispetto a
quelle normopeso.
La gravità dell‟obesità ed il tipo di distribuzione dell‟adipe sono fattori
importanti per la regolazione del sistema riproduttivo femminile. Molte donne
obese accumulano grasso in regione gluteo-femorale. Questo morfotipo si
caratterizza
per
aumentata
produzione
di
estrone,
conseguente
all‟aromatizzazione degli androgeni, spesso non adeguatamente controbilanciata
da un corrispondente aumento dell‟attività progestinica. Questa situazione
ormonale rappresenta un fattore di rischio importante per lo sviluppo di
carcinoma uterino.
Le donne obese con prevalente accumulo di grasso viscerale sono invece esposte
ad un ambiente ormonale più androgenico, secondario ad aumentata produzione
di androstenedione e testosterone, e alla
riduzione della concentrazione di
SHBG, a cui consegue un‟aumentata biodisponibilità di testosterone. Il
meccanismo sotteso alla ridotta produzione di SHBG nell‟obesità non è noto ma
è possibile che l‟iperandrogenismo e l‟iperinsulinismo abbiano un ruolo
importante.
Le donne obese con morfotipo androide hanno quindi, oltre che un aumentato
rischio di carcinoma uterino, anche una maggiore probabilità di complicanze
cardiovascolari legate al profilo steroideo di tipo maschile.
Infine l‟obesità può essere l‟esito di una modalità di alimentazione patologica
nell‟ambito di un disturbo della condotta alimentare. I disturbi della condotta
alimentare rappresentano una categoria di seri disturbi psichiatrici, più frequenti
nel sesso femminile, che causano un notevole disagio sia negli individui affetti
che nelle famiglie coinvolte.
In conclusione, il sovrappeso e l‟obesità costituiscono fattori di rischio per lo
sviluppo di malattie cardio-vascolari, metaboliche e alcune forme di cancro con
conseguente aumentato rischio di mortalità. Al contrario, il calo ponderale è
associato ad una loro riduzione. Ne consegue che le variazioni del peso corporeo
hanno un impatto sullo stato di salute e sulla qualità di vita della donna.
La neuropsicoendocrinologia della sessualità femminile
Romano Forleo
Se questo titolo fosse stato messo ad una lezione del mio corso di specializzazione in ostetricia e
ginecologia (1958-62) le persone sarebbero cadute dalle nuvole : “di cosa ci vuoi parlare?” o
piuttosto “questa non è materia per ginecologi!”.
Attualmente mi è stato richiesto di fare la lezione introduttiva al Congresso SIGO di Napoli sul
tema “ Il ginecologo dinanzi ai problemi d‟amore e mal d‟amor” ed affronterò non solo problemi di
psicofisiologia e patologia sessuale, non solo i temi del comportamento sessuale , che da Kinsey in
poi affliggono la sessuologia, ma come riuscire a penetrare l‟immaginario erotico, attraverso le
tecniche della narrative-based-medicine. e cercare così di mettersi a disposizione della donna .
Ricordando però , come diceva Ovidio nella sua splendida “arte amatoria”, che “.non sum preceptor
amoris”.Nessuno di noi lo è , o lo sarà mai, anche se probabilmete potremmo poter dare qualche
iudea per la vita sessuale della coppia sulla base delle conoscenze che si stanno accumulando,
grazie alle neuroscienze.
L‟endocrinologia ostetrica nasce con gli studi fondamentali sulla unità-feto-placentare di
Dicfalusy e dei suoi allievi Italiani, Benagiano , Mancuso e dell‟Acqua. Quella ginecologica dagli
studi della biosintesi steroidea di Dorfman e Greenblat, poi di Sommerville e Collins al Chelsea
Hospital for Women di Londra (il più antico ospedale del mondo ad essere dedicato solo a patologie
femminili), ove hanno poi lavorato Forleo e Bottiglioni e Flamigni.
La endocrinologia ginecologica ebbe una rilevante spinta dalla possibilità di impiego delle
gonadotropine estratte dalle urine di donna in menopausa da quel geniale chimico della Serono che
fu Donini. Ma fu la scoperta dei neurotraspettitori e dei neurormoni, della sintesi del GnRH e dagli
studi di neuroendocrinologia ,di cui Genazzani è stato maestro, che portarono alla nascita della
neuroendocrinologia delle riproduzione anche nel nostro Paese..
La vecchia divisione fra mente e cervello (“l‟errore di Cartesio”) stava cadendp sottp le eclatanti
scoperte delle neuroscienze, che ponevano in discussione le teorie psicodinamiche di Freud, nella
loro derivazione metapsicologiche e comportavano una completa revisione della psicosomatica
ginecologica ,In ostetricia il vissuto della gravidanza , le problematiche dell‟attaccamento di coppia
, oltre alla revisione critica dei rapporti genitoriali, davano al ginecologo una spinta verso una
“umanizzaziuone della nascita”, richiamando il ginecologo ed essere “medico della persona e non di
organi ed apparati”:
Ed in nome della unità della persona che la neuropsicoendocrinologia della riproduzione e della
sessualità diviene materia fondamentale della professione ostetrico-ginecologica:
Estrogeni: indicazioni
G. Morgante, A. Delia, MC Musacchio, V. De Leo
Dipartimento di Pediatria, Ostetricia e Medicina della Riproduzione,
Istituto di Ostetricia e Ginecologia, Siena.
Gli estrogeni sono ormoni sessuali steroidei, derivati cioè dal nucleo di base del colesterolo,
prodotti dall‟ovaio, dal surrene e, per conversione di altri precursori steroidei, anche dai tessuti
periferici. Circolano nel sangue in forma libera, biologicamente attiva, o legati a una globulina detta
SHBG (Sex Hormone Binding Globuline); vengono metabolizzati e resi idrosolubili a livello
epatico, quindi escreti dal rene. Tra le decine di tipi di estrogeni prodotti dall‟organismo, i principali
per quantità e attività biologica sono l‟estradiolo, l‟estrone e l‟estriolo: il primo, e più importante, è
prodotto durante l‟età fertile della donna; l‟estrone è caratteristico della menopausa e deriva dalla
metabolizzazione periferica dell‟androstenedione; l‟estriolo è sintetizzato in quantità elevata dalla
placenta, durante la gravidanza. Nell‟ovaio, che è la maggiore sede di produzione di estrogeni,
soltanto le cellule della granulosa del follicolo possiedono l‟enzima (aromatasi) per sintetizzarli a
partire dagli androgeni. Gli estrogeni vengono secreti durante tutto il ciclo mestruale, ma soprattutto
nella prima metà di esso, detta appunto fase follicolare o estrogenica; durante questa fase, la loro
produzione aumenta progressivamente, fino al picco di massima secrezione poche ore prima
dell‟ovulazione, cioè verso il quattordicesimo giorno del ciclo (in caso di cicli che durano 28
giorni). In seguito, la secrezione si mantieneintorno ai 70/80 pg/ml per tutta la fase luteale con una
notevole riduzione al momento della mestruazione.
Funzioni degli estrogeni nell'organismo femminile:
Gli estrogeni sia naturali che sintetici svolgono importantissime funzioni fisiologiche.
Innanzittutto regolano la maturazione sessuale intervenendo nello sviluppo dell'apparato genitale.
La loro massiccia secrezione in epoca puberale induce la chiusura delle cartilagini di coniugazione
delle ossa lunghe, terminando di fatto, la fase di accrescimento staturale.
Gli estrogeni stimolano lo sviluppo stromale della mammella e il mantenimento delle caratteristiche
femminili secondarie (crescita delle mammelle, distribuzione dei peli, voce, statura, ossatura,
distribuzione del grasso)
Permettono la fecondazione e la gravidanza, intervenendo nella regolazione del ciclo mestruale
Regolano la distribuzione del grasso corporeo, favorendone il deposito nelle anche, nelle natiche,
nelle cosce e nell'addome al di sotto dell‟ombelico.
Mantengono il trofismo osseo ed hanno quindi azione protettiva nei confronti dell'osteoporosi
Stimolano la sintesi di trigliceridi e l'aumento delle lipoproteine ad alta densità (HDL o colesterolo
buono) proteggendo le pareti vasali dal danno arteriosclerotico. Dato che le donne possiedono
elevati livelli di estrogeni fino alla menopausa il rischio di sviluppare malattie cardiovascolari è
considerevolmente basso e significativamente inferiore rispetto agli uomini e alle stesse donne in
perimenopausa.
Stimolano la lipolisi nel tessuto muscolare ed adiposo. Per questo motivo gli estrogeni migliorano la
prestazione degli sport di durata rispamiando il glicogeno muscolare a scapito degli acidi grassi
Regolano molte funzioni cerebrali fra cui l‟attenzione e la memoria.
Stimolano la sintesi epatica di numerosi enzimi e proteine (SHBG, angiotensinogeno).
In alcuni alimenti naturali, come la soia sono contenute sostanze che mimano gli effetti degli
estrogeni denominati fitoestrogeni.
Nonostante tutte queste benefiche proprietà un eccesso di estrogeni è pericoloso sia dal punto di
vista estetico che salutistico. Se da un lato questi ormoni favoriscono la disposizione in senso
femminile del tessuto adiposo, dall'altro espongono la donna al rischio di sviluppare alcune forme di
cancro come quello alla mammella, peggiorando l‟insulinoresistenza, l‟ ovaio policistico e la
sterilità.
Il modo più efficace per mantenere nella norma i livelli di estrogeni è tenere sotto controllo il
proprio peso corporeo. Nell'organismo femminile circa due terzi della produzione di estrogeni
avviene infatti nel tessuto adiposo grazie ad un enzima che converte gli androgeni prodotti dai
surreni in estrogeni.
Particolare attenzione è necessario porla al momento in cui si decide per una somministrazione di
estrogeni in età fertile ed in post menopausa. Oltre alle dosi è importante ricordarsi delle differenze
tra i vari estrogeni considerando che quelli di sintesi come l‟etinilestradiolo hanno una potenza
significativamente più elevata rispetto all‟estradiolo naturale e all‟estrone.
Progesterone: indicazioni
Cicinelli Ettore
4° U.O. di Ginecologia ed Ostetricia, Università di Bari
Dipartimento di Ginecologia, Ostetricia Neonatologia (DIGON), Università di Bari
Policlinico, Piazza Giulio Cesare 70124 Bari
Il progesterone (P) è l‟ormone nativo prodotto dal corpo dal corpo luteo e dalla placenta; i progestinici sono invece
molecole di sintesi, affini al P, realizzate per superare le difficoltà di somministrazione del P o per accentuare alcune
delle sue azioni. Il P in forma cristallina assunto per via orale viene quasi totalmente inattivato dal metabolismo
intestinale ed epatico (1). Tradizionalmente la via di somministrazione più impiegata è la via IM sia in formulazione
oleosa pronta che depot. Tuttavia, le iniezioni IM sono dolorose e mal accettate per lunghi trattamenti. Grazie
all‟impiego di particolari formulazioni farmaceutiche come la micronizzazione, che permette un rapido assorbimento
nel primo tratto intestinale, è oggi possibile la somministrazione del P per via orale. Tuttavia anche nella forma
micronizzata il P subisce un‟importante metabolizzazione che riguarda circa il 90% dell‟ormone assunto (1) con
formazione di metaboliti ridotti alcuni dei quali dotati di effetto sedativo ed ipnotico; pertanto, il P micronizzato per via
orale dovrebbe essere quindi assunto di sera.
In alternativa, negli ultimi anni si è progressivamente affermata la via di somministrazione vaginale. Il P per via
vaginale può essere somministrato in capsule, tavolette, crema, gel a rilascio controllato e in anello vaginale che
assicura il rilascio a lungo termine.
L‟epitelio vaginale ha una capacità metabolica inferiore a quello intestinale. La via vaginale inoltre permette di evitare
il first pass a livello epatico. Pertanto, dopo somministrazione vaginale in circolo si ritrova una minore quantità di
metabolici del P. Di particolare interesse è che per via vaginale è possibile ottenere una distribuzione preferenziale del P
all‟utero con elevate concentrazioni endometriali di P pur con bassi livelli sistemici di ormone (2,3). Il fenomeno della
comparsa di effetti endometriali superiori a quelli prevedibili sulla base delle concentrazioni sieriche di P è stato
denominato “first uterine pass effect” o “sistema portale vagino-uterino” (4).
Per quanto riguarda le indicazioni del progesterone bisogna sottolineare come da un punto di vista dell‟azione e degli
effetti metabolici nessun progestinico ripete in maniera perfetta gli effetti metabolici del P naturale a causa delle
peculiari affinità di legame ai diversi recettori per gli steroidi che i diversi progestinici possiedono in relazione alla loro
struttura chimica.
Pertanto, in base alla struttura chimica si distinguono progestinici derivati dal P (C21-progestinici o pregnani) ed i
derivati del testosterone (C19-progestinici) che a loro volta si distinguono in estrani (C-18) e gonani, privi del carbonio
in C18.
La somministrazione di farmaci ad attività progestinica è frequente nella pratica ostetrica e ginecologica (Tab.1)
Indizioni del P:
in riproduzione/gravidanza
- supporto della fase luteale nei programmi di riproduzione assistita
- prevenzione dell‟aborto
- trattamento dell‟aborto
- trattamento della minaccia di parto pretermine
- prevenzione della preaclampsia.
in ginecologia:
- controllo del ciclo mestruale
- trattamento della menorragie
- contraccezione
- terapia dell‟endometriosi
- della patologia iperplastica dell‟endometrio
- terapia ormonale sostitutiva.
Il P sulla base delle caratteristiche farmacologiche trova attualmente indicazioni assolute e relative. Indicazioni assolute
sono quelle in gravidanza a causa del potenziale rischio teratogeno degli steroidi sessuali di sintesi. Le indicazioni
relative sono tutte le altre in l‟impiego del P comunque presenta il vantaggio di somministrare l‟ormone naturale e
soprattutto quelle in cui è necessaria la somministrazione a lungo termine.
L‟analisi della letteratura ed i dati della cosiddetta medicina dell‟evidenza permette di definire il valore e l‟utilità della
somministrazione del P nelle diverse situazioni cliniche.
Progesterone per il supporto della fase luteale
Razionale: In riproduzione assistita la funzione del corpo luteo può essere alterata fai farmaci impiegati per la
stimolazione o dalle manovre per il pick-up ovocitario. La luteolisi è stata dimostrata insorgere più precocemente anche
nei cicli in cui invece che il GnRH agonista era impiegato l‟antagonista. Il supporto della fase luteale (LPS) consiste
nella stimolazione della produzione mediante somministrazione di hCG o nella semplice supplementazione di P.
Analisi della letteratura: Numerose metanalisi dimostrano che l‟LPS migliora l‟esito dei protocolli di IVF quando è
usato il GnRH agonista; recenti dati indicano l‟LPS anche nei cicli con GnRH antagonista. Una recente metanalisi di
Daya e Gunby (5) dimostra che la LPS con hCG è associata con un maggior rischio di iperstimolazione ovarica. Circa la
via di somministrazione del P con la via orale è stata riscontrata una riduzione del tasso di gravidanza. La via IM alla
dose di 50 mg/die è quella tradizionalmente impiegata. Negli ultimi anni la via vaginale è diventata sempre più popolare
con diverse formulazioni: capsule o compresse alla dose di 200 mg due o tre volte al giorno, gel a rilascio controllato
alla dose di 90 mg/die o anche recentemente un anello a lento rilascio.
Conclusioni: la LPS basata sulla sommnistrazione di P migliora i risultati dei cicli di IVF. Il P per via vaginale oggi
rappresenta una valida altenativa alle somministrazioni per via IM.
Progesterone nella prevenzione dell‟aborto:
Razionale: il P induce le trasformazioni secretive dell‟endometrio indispensabili perchè possa avvenire l‟impianto. Una
possibile causa di aborto potrebbe essere un‟inadeguata secrezione di P. Pertanto, la somministrazione di P nel primo
trimestre di gravidanza potrebbe ridurre il rischio di aborto spontaneo.
Analisi della letteratura: a prescindere dalla gravità e dal numero di precedenti aborti, non risultano differenze
significative di rischio abortivo tra donne trattate con progesterone, placebo o con nessun trattamento (OR 1.05, 95%,
CI 0.83-1.34) come di incidenza di effetti indesiderati sulla madre o sul neonato (6). Bisogna segnalare tuttavia un
report di un‟aumentata incidenza di ipospadia nei maschi (OR 3.7, CI 2.3-6) (7). In un sottogruppo di tre trias su donne
con poliabortività (più di 3 aborti consecutivi) il trattamento con progestinici ha ridotto significativamente il tasso di
abortività rispetto al placebo ed al non trattamento (OR 0.39, 95% CI 0.17 to 0.91). Nessuna differenza significativa è
invece risultata tra le diverse vie di somministrazione del progesterone (orale, IM,, vaginale).
Conclusioni: Non esiste nessuna evidenza che la somministrazione di routine del P riduca il rischio di abortività nel
primo e nel secondo trimestre. La somministrazione è invece indicata nelle donne con poliabortività con un trend di
aumento del tasso di natalità senza evidenza di aumento del rischio di effetti indesiderati (6,8).
Progesterone nel trattamento della minaccia di aborto:
Razionale: Il P viene prescritto in circa il 13-40% delle donne con minaccia di aborto. La somministrazione di P si basa
si di un‟ipotetica insufficienza del corpo luteo e sull‟effetto miorilassante sull‟utero.
Analisi della letteratura: L‟evidenza sull‟impiego del P è di bassa qualità. La meta-analisi di Oates-Whitehead della
Cochrane ha valutato l‟impatto della terapia con P in varie situazioni cliniche senza tuttavia fare un‟analisi separata per
la minaccia d‟aborto (6). La re-analisi (9) dei soli 4 studi di questa meta-analisi che hanno analizzato tale relazione (1013), (uno comprendente dati su 3 diversi regimi di terapia con P) (10) avendo l‟aborto come outcome, l‟RR è risultato
1.10 (95% CI 0.92- 1.31) per il gruppo del progesterone vs nessun trattamento. Nel solo studio in cui era stato
dimostrato il BCF all‟ecografia, l‟RR di abortività è risultato 1.09 (90% CI 0.90-1.33) per il gruppo del P (13).
Conclusioni: La somministrazione di P non sembra migliorare l‟outcome delle donne con minaccia di aborto. Tuttavia,
la somministrazione locale di P riduce soggettivamente il numero e intensità di crampi uterini più rapidamente del solo
riposo a letto (14) .
Progesterone e parto pretermine:
Analisi della letteratura: Una metanalisi della Cochrane (15) dimostra che la somministrazione di P riduce il rischio di
parto pretermine prima delle 37 settimane (RR 0.65, 95% CI 0.54-0.79) e delle 34 settimane (RR 0.15, 95% CI 0.040.64). I neonati hanno minore rischio di avere un peso inferiore ai 2500 g (4 studi, RR 0.63, 95% CI 0.49-0.81) o
un‟emorragia intraventricolare (RR 0.25, 95% CI 0.08-0.82).
Conclusioni: Il P IM è associate ad una riduzione del rischio di parto pretermine pima delle 37 sett., e ad un peso
neonatale inferiore ai 2500 g. Tuttavia, informazioni su altri importanti outcomes materni e neonatali derivano da un
solo trial (16). Maggiori dati sono necessari valutare l‟efficacia del P vaginale.
Progesterone in ginecologia:
In età pre-menopausale la più frequente indicazione è il controllo delle irregolarità del ciclo che si verificano negli anni
che precedono la menopausa; in tale periodo infatti si assiste alla comparsa di irregolarità della durata del ciclo e della
quantità del flusso mestruale dalla ipermenorrea alla menometrorragie. Il rationale della somministrazione del
progesterone e di progestinici in premenopausa è quello di contrastare l‟effetto proliferativo sull‟endometrio degli
estrogeni endogeni.
In linea di principio un progestinico per la perimenopausa dovrebbe avere le seguenti caratteristiche: a) attività antiestrogenica a livello dell‟utero a bassa dose; b) profilo recettoriale simile al P; c) assenza di interferenza con l‟azione
protettiva degli estrogeni a livello osseo, CNS e sistema cardiovascolare; d) sicurezza per la mammella. Il P e
probabilmente i suoi più diretti derivati come il diidrogesterone sono i progestinici più sicuri per quanto riguarda il
sistema cardiovascolare. Nessun progestinico di sintesi è ancora in grado di riprodurre in maniera assolutamente precisa
il profilo recettoriale del progesterone, dando quindi origine ad effetti nella maggior parte indesiderati. Molti
progestinici di sintesi infatti possiedono un‟affinità del recettore progesteronico molto più elevata di quella del
progesterone ma presentano anche affinità per il recettore glucorticoide e soprattutto per il recettore aldosteronico. Il
progesterone invece possiede un‟azione anti-mineralcorticoide. Recenti dati suggeriscono che il rischio mammario è
molecola-dipendente essendo maggiore per il MAP e NETA ed inferiore per il P (17).
Un approccio alternativo alla somministrazione sistemica del progestinico per via orale o transdermica, è rappresentato
dalla somministrazione locale intrauterina o vaginale. In un nostro recente studio clinico abbiamo ottenuto un tasso di
amenorrea dell‟82%, superiore a quello di altri schemi di HRT combinata continua, dopo un anno di terapia con
estradiolo transdermico alla dose di 0.050 mg/die e P gel vaginale a rilascio prolungato due volte alla settimana
(Crinone 4, 45 mg, Serono, Roma). La limitata esposizione sistemica che si ottiene con la via vaginale ha assunto una
notevole importanza clinica per la responsabilità che oggi si ascrive al progestinico per l‟incremento di rischio di
tumore della mammella in corso di HRT come suggerito dal WHI e Million Women Study.
In conclusione, gli attuali orientamenti sulla somministrazione del progestinico prediligono la somministrazione di P o
di molecole ad attività sempre più simili al P; in donne motivate la somministrazione vaginale o intrauterina può
rappresentare una valida alternativa in termini di efficacia, compliance e sicurezza. In riproduzione assistita ed in
gravidanza il P risulta efficace nella sostenere le prime fasi della gravidanza e nella prevenzione dell‟aborto ripetuto e
nella minaccia di parto pretermine.
Bibliografia
1.
2.
3.
4.
5.
6.
7.
8.
9.
10.
11.
12.
13.
14.
15.
16.
17.
NAHOUL K., DEHENNIN L., SHOLLER R.: Radioimmunoassay of plasma progesterone after oral
administration of micronized progesterone. J Steroid Biochem, 26: 241-9, 1987.
MILES R.A., PAULSON R.J., LOBO R.A., PRESS M.F., DAHMOUSH L., SAUER M.V.: Pharmacokinetics
and endometrial tissue levels of progesterone after administration by intramuscular and vaginal routes: a
comparative study. Fertil Steril, 62: 485-90, 1994.
CICINELLI E., DE ZIEGLER D., BULLETTI C., MATTEO M.G., SCHONAUER L.M., GALANTINO P.:
Direct transport of progesterone from vagina to the uterus. Obstet Gynecol 95: 403-6, 2002.
CICINELLI E., DE ZIEGLER D.: Transvaginal progesterone: evidence for a new functional “portal system”
flowing from the vagina to the uterus. Hum Reprod Update, 5: 365-72, 1999.
DAYA S, GUNBY J. Luteal phase support in assisted reproduction cycles. Cochrane Database of Systematic
Reviews 2004, Issue 3. Art. No.: CD004830. DOI: 10.1002/14651858.CD004830.
OATES-WHITEHEAD RM, HAAS DM, CARRIER JAK. Progestogen for preventing miscarriage. Cochrane
Database of Systematic Reviews 2003, Issue 4. Art. No.: CD003511. DOI: 10.1002/14651858.CD003511.
CARMICHAEL SL, SHAW GM, LAURENT C, CROUGHAN MS, OLNEY RS, LAMMER EJ. Maternal
progestin intake and risk of hypospadias. Arch Pediatr Adolesc Med. 2005 Oct;159(10):957-62.
DI RENZO GC, MATTEI A, GOJNIC M, GERLI S. Progesterone and pregnancy.. Curr Opin Obstet Gynecol.
2005;17(6):598-600.
SOTIRIADIS A, PAPATHEODOROU S, MAKRYDIMAS G. Threatened miscarriage: evaluation and
management BMJ 2004;329:152-155.
AL-SEBAI MA, DIVER M, HIPKIN LJ. The role of a single free beta-human chorionic gonadotrophin
measurement in the diagnosis of early pregnancy failure and the prognosis of fetal viability. Hum Reprod
1996;11: 881-8.
RELJIC M. The significance of crown-rump length measurement for predicting adverse pregnancy outcome of
threatened abortion. Ultrasound Obstet Gynecol 2001;17: 510-2.
BENNETT GL, BROMLEY B, LIEBERMAN E, BENACERRAF BR. Subchorionic hemorrhage in firsttrimester pregnancies: prediction of pregnancy outcome with sonography. Radiology 1996;200: 803-6.
PEDERSEN JF, MANTONI M. Prevalence and significance of subchorionic hemorrhage in threatened
abortion: a sonographic study. Am J Roentgenol 1990;154: 535-7.
DICKEY RP, OLAR TT, CUROLE DN, TAYLOR SN, MATULICH EM. Relationship of first-trimester
subchorionic bleeding detected by color Doppler ultrasound to subchorionic fluid, clinical bleeding, and
pregnancy outcome. Obstet Gynecol 1992;80: 415-20.
DODD JM, FLENADY V, CINCOTTA R, CROWTHER CA. Prenatal administration of progesterone for
preventing preterm birth. Cochrane Database of Systematic Reviews 2006, Issue 1. Art. No.: CD004947. DOI:
10.1002/14651858.CD004947.pub2.
MEIS PJ, KLEBANOFF M, THOM E, DOMBROWSKI MP, SIBAI B, MOAWAD AH, ET AL. Prevention
of recurrent preterm delivery by 17 alpha-hydroxyprogesterone caproate. New England Journal of Medicine
2003;348(24):2379-85.
FOURNIER A, BERRINO F, RIBOLI E, AVENEL V, CLAVEL-CHAPELON F: Breast cancer risk in
relation to different types of hormone replacement therapy in the E3N-EPIC cohort. Int J Cancer. 114(3), 448454 (2005).
Quando
Quandoeecome
comeeffettuare
effettuare ililfollow-up
follow-updurante
durantecontraccezione
contraccezione
ormonale
ormonale
““ the
the WHOSPR
WHOSPR promote
promote flexibility
flexibility of
of
contraceptive
contraceptive supply
supply with
with ease
ease of
of access
access
should
should problem
problem arise”
arise”
Visita
Visita di
di routine
routine per
per ilil follow-up
follow-up ogni
ogni anno
anno
Informare
Informare la
la paziente
paziente di
di anticipare
anticipare la
la visita
visita in
in
caso
caso di
di insorgenza
insorgenza di
di qualsiasi
qualsiasi problema
problema
Quando
Quando eecome
come effettuare
effettuareililfollow-up
follow-updurante
durante contraccezione
contraccezione
ormonale
ormonale
Modificazioni degli ematochimici in corso di CO
Effetti
Estrogenici
Dopo
Dopo 12
12 mesi
mesi nelle
nelle donne
donne aa basso
basso rischio
rischio
=
Protidemia
Glicemia
Dopo
Dopo 66 mesi
mesi nelle
nelle donne
donne con:
con:
Familiarità
Familiaritàper
peripertensione
ipertensione
Effetti
progestinici
nessuno
=
=
Effetti clinici
nessuno
=
Colesterolo
nessuno
TG
nessuno
HDL
nessuno
Familiarità
Familiaritàper
perdiabete
diabetemellito
mellito
LDL
nessuno
Anamnesi
Anamnesipositiva
positivaper
perGDM
GDM
Fibrinogeno
nessuno
=
Mishell
MishellDR,
DR,2001
2001
Le
Lemodificazioni
modificazionilipidiche
lipidichecorrelano
correlanocon
conilildosaggio
dosaggioestrogenico
estrogenicodel
del
CO
CO
TG
TG (mg/dL)
(mg/dL)
115
115
HDL
HDL
TG
TG
110
110
HDL
HDL (mg/dL)
(mg/dL)
70
70
65
65
105
105
100
100
60
60
95
95
55
55
90
90
85
85
50
50
80
80
75
75
contenuto
contenuto di
di
etinilestradiolo
etinilestradiolo
45
45
Upton
UptonG.V.
G.V.Fertil
FertilSteril
Steril1990
1990
Modificazioni
Modificazioni lipidiche
lipidiche ee progestinici
progestinici
DSG
DSG
LNG
LNG
Change
Changefrom
frombaseline
baseline
50
50
45
45
40
40
35
35
30
30
25
25
20
20
15
15
10
10
55
00
-5
-5
-10
-10
**
**
**
TG
VLDL
LDL
**
HDL
Knopp R.H. et al., Contraception 2001
Kn opp R.H . et al., Contraception 2 001
Le
Le modificazioni
modificazioni dei
deifattori
fattoridella
dellacoagulazione
coagulazionecorrelano
correlanocon
conilil
dosaggio
dosaggioestrogenico
estrogenicodel
del CO
CO
PT
PT
Effetto
Effetto di
di una
una pillola
pillola monofasica
monofasica contente
contente 20
20 mcg
mcg EE
EE
Variazioni
Variazioni dell’
dell’ AT
ATIII
III(%)
(%)
140
140
**
120
120
100
8080
60
^^
§§
6060
4040
60
40
40
2020
0
0
20
20
00
**
120
120
100
100
8080
100
basale
basale
33mese
mese
*P-value
*P-value==0.001
0.001
^^P-value
P-value==0.012
0.012
66mese
mese
12
12mese
mese
PTT
PTT
=
=
Fibrinogeno
Fibrinogeno
=
=
AT
AT III
III
=
=
Fattori
Fattori V,
V, VII,VIII,
VII,VIII, XX
=
=
Fibrinopeptide
Fibrinopeptide A
A
=
=
50
50 mcg
mcg
E’
E’ possibile
possibile l’dentificazione
l’dentificazione delle
delle pazienti
pazienti aa
rischio
di
CVD
durante
il
follow-up
rischio di CVD durante il follow-up ??
Variazioni
Variazionidella
dellaProteina
ProteinaCC(%)
(%)
160
160
140
140
^^
30
30 mcg
mcg
=
=
basale
basale
valori
valorinel
nelrange
rangedi
dinormalità
normalità
3 mese
3 mese
6 mese
6 mese
12 mese
12 mese
*P-value
*P-value==0.001
0.001
^P-value
^P-value==0.003
0.003
§P-value
=
0.002
§P-value = 0.002
“..No
“..No known
known coagulation
coagulation test
test can
can predict
predict the
the
development
development of
of venous
venous thrombosis
thrombosis during
during oral
oral
contraception.
contraception.
Many
Many markers
markers of
of increased
increased coagulation
coagulation activation
activation
are
are available
available (prothrombin
(prothrombin fragment
fragment 1+2,
1+2,
thrombin-antithrombin
thrombin-antithrombin complexes,
complexes, fibrinopeptide
fibrinopeptide A,
A,
D-dimers),
D-dimers), but
but their
their usefulness
usefulness has
has not
not been
been
demonstrated
demonstrated for
for this
this purpose…”
purpose…”
Conrad
ConradJ,J,Hum
HumReprod
ReprodUpdate
Update1999
1999
Ipertensione
Ipertensione arteriosa
arteriosa aa CO
CO
Follow-up
Follow-up durante
durante la
la contraccezione
contraccezione ormonale
ormonale
140
140
Ipertensione
Ipertensione
nel
nel 55 %
%
delle
delle donne
donne
Vecchie
Vecchie
pillole
pillole
120
120
100
100
80
80
60
60
++2-6
2-6mmHg
mmHg
40
40
20
20
0
0
41
41 casi
casi //
10.000
10.000 donne
donne
basso
basso
dosaggio
dosaggio
Speroff,
Speroff,Hum
HumReprod
ReprodUpdate
Update1999
1999
Conclusioni
Conclusioni
Non
Non esistono
esistono linee
linee guida
guida sul
sul follow
follow up.
up.
Una
Una visita
visita annuale
annuale èè più
più che
che sufficiente
sufficiente nelle
nelle
pazienti
pazienti aa basso
basso rischio
rischio
La
La paziente
paziente deve
deve essere
essere informata
informata di
di
anticipare
anticipare la
la visita
visita in
in caso
caso di
di cattivo
cattivo controllo
controllo del
del
ciclo
ciclo
Valutare
Valutarein
inquesto
questocaso
casodi
diaumentare
aumentareilildosaggio
dosaggioestrogenico
estrogenicooodi
di
cambiare
cambiarevia
viadi
disomministrazione
somministrazione
Ad
Ad ogni
ogni visita
visita èè raccomandata
raccomandata la
la misurazione
misurazione
della
della PA
PA
PS
PS PD
PD
PS
PS PD
PD
La
Lamisurazione
misurazionedella
dellaPA
PAdeve
deveessere
essereeseguita
eseguitaad
adogni
ognivisita
visitadi
di
follow-up
follow-up
U N I V E R S I T A’ D E G L I S T U D I D I S I E N A
Dipartimento di Pediatria, Ostetricia e Medicina della Riproduzione
Clinica Ostetrica e Ginecologica
Scuola permanente di formazione su:
Razionale dell’uso del contraccettivo orale in premenopausa
Marco Gambacciani, Atonia Pepe
Dipartimento di Ostetricia e Ginecologia, Centro della Menopausa, Azienda
Universitaria Ospedaliera Pisana,Via Roma 67, 56100 Pisa. Tel:050/99238,
fax:050/993058, email: [email protected]
Il periodo pre-menopausale comprende gli anni che precedono la menopausa, e
interessa donne relativamente giovani tra 40 e 50 anni. Tale periodo è caratterizzato dal
progressivo declino della funzione ovarica che diventa responsabile di un corollario di
disturbi da deficit estrogenico e/o progestinico quali alterazioni del flusso mestruale,
sintomi vasomotori, difficoltà a concentrarsi, alterazioni del ritmo sonno-veglia,
secchezza vaginale, riduzione del tono dell’umore, incremento ponderale, riduzione
della libido. La durata e l’intensità di questi sintomi è molto variabile. Le alterazioni
vasomotorie dipendono principalmente dalle variazioni dei livelli di estradiolo. Altri
sintomi quali le alterazioni del tono dell’umore possono essere già presenti in
premenopausa
anche
se
con
un’intensità
minore
rispetto
al
periodo
della
perimenopausa e postmenopausa. Inoltre, come conseguenza dell’iniziale decremento
della steroidogenesi gonadica si assiste ad un’attivazione del turnover metabolico
dell’osso con iniziale decremento della densità minerale. Da un punto di vista endocrino
la premenopausa è caratterizzata da una serie di alterazioni neuroendocrine centrali e
periferiche direttamente a livello degli organi deputati alla secrezione degli ormoni
steroidi. L’aumento di FSH nella fase premenopausale testimonia l’incipiente
esaurimento funzionale dell’ovaio, che necessita uno stimolo maggiore per garantire
ugualmente il reclutamento follicolare. Questo innalzamento di FSH è in grado,
inizialmente, di compensare la ridotta capacità secretoria dell’ovaio, garantendo
regolarità mestruale e cicli ovulatori. Nonostante che in questa fase l’estradiolo possa
presentare livelli preovulatori maggiori di quelli misurati in donne più giovani, i cicli si
fanno irregolari e sempre più frequentemente anovulatori., e tipica è la comparsa
dell’oligoamenorrea. Nel periodo riproduttivo avanzato, le modificazioni endocrine e del
patrimonio follicolare, rendono in gran parte ragione della riduzione della fertilità a
partire dai 35 anni di età. In presenza di FSH inferiori a 22 mUI/ml, esiste ancora la
possibilità di procreare; la possibilità di una gravidanza diminuiscono in presenza di
valori di FSH tra 20 e 30 mUI/ml. Con valori di FSH maggiori di 40 mUI/ml ed Estradiolo
inferiori a 22 pg/ml la percentuale di ovulazioni spontanee è al contrario inferiore al 5%.
In pre e perimenopausa si hanno modificazioni del ciclo mestruale (polimenorrea,
oligomenorrea, menorragie). La frequente comparsa di cilci anovulatori o con
insufficienza luteale può portare non soltanto ad alterazioni del ciclo mestruale, ma ad
un’iperstimolazione endometriale e miometriale, favorendo la comparsa di iperplasia
dell’endometrio e fibromatosi uterina sintomatica. Le alterazioni del flusso mestruale in
premenopausa devono sempre essere indagate, e occorre procedere sempre ad una
diagnosi differenziale (1-4).
Negli ultimi anni la percentuale di donne che in epoca pre e peri-menopausale
assume la pillola estro-progestinica sta lentamente ma progressivamente aumentando;
dati statistici relativi al 1998 evidenziano che ben il 9% delle donne di età superiore a 40
anni ha utilizzato la pillola contro il 3% di un decennio precedente. Tra i 35 ed i 39 anni
tale percentuale sale al 15%. Tale cambiamento dipende probabilmente dalla diffusa
consapevolezza prima del ginecologo e poi della popolazione femminile dei benefici
non contraccettivi aggiuntivi offerti dalla pillola (Tabella 1).
Le particolari condizioni e caratteristiche endocrinocliniche della premenopausa
rendono peculiare l’uso della pillola contraccettiva in questa fascia d’età. Specifiche
considerazioni possono essere fatte riguardo alcuni aspetti clinici.
TABELLA 1 : Benefici non contraccettivi dei contraccettivi ormonali estroprogestinici:
1.
correzione dei disturbi da deficit estrogenico
2.
controllo delle irregolarità mestruali
3.
prevenzione della demineralizzazione ossea e del rischio di fratture
4.
prevenzione di patologie pre-neoplastiche e neoplastiche: iperplasia
endometriale, carcinoma dell’endometrio, carcinoma dell’ovaio, carcinoma del coloretto.
Referenze
1.
Metcalf MG. Incidence of ovulation from the menarche to the menopause:
observations of 622 NewZealand women. NZ Med J.1983Aug24;96(738):645-8.
2.
Dennerstein L, Dudley EC, Hopper JL, Guthrie JR, Burger HG A prospective
population-based
study
of
menopausal
symptoms.
Obstet
Gynecol.
2000
Sep;96(3):351-8. PMID: 10960625
3.
Kurman RJ. The identification of stromal invasion in the distinction of atypical
endometrial hyperplasia from well differentiated adenocarcinoma.Verh Dtsch Ges
Pathol1991;75:3712.
4.
Santoro N. The menopausal transition.Am J Med. 2005 Dec 19;118(12 Suppl 2):813.
CONTRACCEZIONE ORALE E PATOLOGIA NEOPLASTICA
In premenopausa compaiono con maggiore frequenza alcune patologie preneoplastiche e neoplastiche dell’apparato genitale femminile sia a carico dell’
endometrio che dell’ ovaio. Il rischio di carcinoma ovarico e del carcinoma
dell’endometrio nelle utilizzatrici di pillola si riduce con l’aumentare della durata di
assunzione.. L’effetto protettivo inizia dopo pochi mesi di uso, è correlato alla durata di
assunzione e permane per 20 anni dopo la interruzione della pillola. Questa
considerazione è ovviamente importante quando l’assunzione del contraccettivo
avviene in pre-menopausa venendosi a garantire una protezione negli anni di maggiore
incidenza naturale del tumore.
Un numero sempre maggiore di evidenze sembrano indicare un effetto protettivo
svolto dai contraccettivi orali anche nei confronti del carcinoma colon retto. Dal
momento che l’incidenza anche di questo tumore aumenta dopo la menopausa, è
evidente come l’uso della pillola in pre-menopausa o in età riproduttiva avanzata possa
esercitare un importante effetto protettivo negli anni di maggiore incidenza (1-5)
REFERENZE
1)
Hankinson SE, Colditz GA, Hunter DJ, Spencer TL, Rosner B, Stampfer MJ, A
quantitative assessment of oral contraceptive use and risk of ovarian cancer. Obstet
Gynecol. 1992; 80:708-714.
2)
Schesselman JJ, Collins JA. The influence of steroids on gynecological cancers. In:
Fraser RPS, Lobo RA Whitehead MI eds Estrogens and progestogens in clinical
practice. London:Churchill Livingston, 1999:831,64.
3)
Narod SA, Risch H, Moslehi R, Dorum A et al, Oral contraceptives and the risk of
hereditary ovarian cancer. N Engl J Med 1998; 339:424.
4)
Grimes DA, Economy KE. Primary prevention of gynaecological cancers . Am J
Obstet Gynecol. 1995; 172:227-235.
5)
Fernandez E, La Vecchia C, Balducci A, Chatenoud L, Franceschi S, Negri E, Oral
contraceptives and colorectal cancer risk: a meta-analysis. Br J Cancer; 2001:84:722.
PATOLOGIA OSTEOARTICOLARE
L’osteoporosi è una malattia sistemica dello scheletro caratterizzata da una ridotta
massa ossea e da alterazioni qualitative (macro e microarchitettura, componente
minerale e proprietà meccaniche) che si accompagnano ad aumento del rischio di
frattura (1).
Per quanto entrambi i sessi vadano incontro a perdita di massa ossea per un fisiologico
processo di invecchiamento, questa progredisce più rapidamente nelle donne in età
postmenopausale (2,3).
La carenza estrogenica è un fattore chiave nella patogenesi dell’osteoporosi involutiva
nella donna, definita appunto come osteoporosi postmenopausale. Tutte le condizioni
cliniche caratterizzate da una carenza estrogenica risultano in una perdita di massa
ossea: l’assunzione di farmaci che inibiscono la produzione o l’effetto degli estrogeni
endogeni (GnRH-agonisti), l’amenorrea da esercizio fisico eccessivo, l’anoressia
nervosa e ovviamente la menopausa, sia essa naturale o chirurgica (4, 5).
La perdita di massa ossea inizia già nella premenopausa, in corrispondenza del
progressivo esaurimento della funzione ovarica che sul piano clinico si traduce nella
comparsa
di
irregolarità
mestruali
con
oligomenorrea.
L’oligomenorrea
in
premenopausa può quindi essere considerata un fattore di rischio per osteopenia ed
osteoporosi post-menopausale (6,7).
Questo suggerisce l’opportunità di iniziare lo
screening per l’osteoporosi in epoca premenopausale per le donne con oligomenorrea
(6,7). Entro i primi 3-5 anni dalla menopausa, la donna perde un’importante quota di
densità ossea (circa il 10%) (più velocemente in caso di menopausa chirurgica);
successivamente, la perdita rallenta ma continua indefinitamente, con il naturale
processo di invecchiamento (8). Il rapido incremento del turnover osseo, con
prevalenza del riassorbimento sulla formazione di osso, spiega la rapida perdita di
massa ossea che si verifica nei primi anni di menopausa. Con il passare degli anni,
l’entità dei due processi (riassorbimento e formazione) gradualmente raggiunge lo
stesso livello e la perdita di massa ossea rallenta (8).
La perdita di densità ossea menopausa-dipendente è più evidente inizialmente a livello
dei segmenti a prevalente componente trabecolare (es. colonna vertebrale), ma in
seguito diviene rilevante anche a carico dei tessuti ossei a struttura compatta (es. collo
femorale) (9,10, 11).
L'osso trabecolare è caratterizzato da una più ricca vascolarizzazione e risente più
precocemente di tutte le possibili modificazioni endocrino-metaboliche dell'individuo.
Quindi per il suo elevato turnover, l'osso trabecolare è il primo ad andare incontro ai
processi di osteoporosi postmenopausale, che invece compaiono più tardivamente a
livello
dell'osso
corticale.
Nel
tessuto
osseo
trabecolare,
prevalentemente
rappresentato a livello della colonna vertebrale, l'osteoporosi è caratterizzata da un
assottigliamento delle trabecole che appaiono più fini e frammentate. Nell'osso
compatto, tipico dello scheletro appendicolare, l'osteoporosi si manifesta con una
riduzione dello spessore della corticale e un allargamento dei canali haversiani, sino a
giungere nei casi estremi alla spongiosizzazione della compatta (12).
Contemporaneamente
all’effetto
sull’osso,
l’ipoestrogenismo
induce
modificazioni regressive anche a livello dei dischi intervertebrali (13). Nella donna
giovane, i dischi intervertebrali, in virtù delle loro proprietà viscoelastiche, sono in
grado di ammortizzare il carico a cui è sottoposta la colonna vertebrale e distribuire la
pressione in maniera uniforme sui piatti vertebrali. La perdita di altezza del disco
intervertebrale, dovuta verosimilmente ad una riduzione dell’idratazione del nucleo
polposo, si associa a riduzione delle sue capacità elastiche e di sostegno,
incrementando il rischio di frattura vertebrale (14). Queste modificazioni a carico del
disco intervertebrale si realizzano prevalentemente in perimenopausa e nei primi
cinque anni dalla menopausa (13). Esse possono essere considerate un fattore di
rischio per fratture osteoporotiche dei corpi vertebrali, indipendente dalla BMD e sono
prevenibili con terapia estrogenica sostitutiva (13,14).
Le fratture su base osteoporotica più comuni sono le fratture vertebrali da
compressione, le fratture del radio distale e del femore prossimale, che portano da sole
all’occupazione di circa il 20% dei letti delle divisioni ortopediche. È stato calcolato che
nei prossimi decenni, il progressivo invecchiamento della popolazione raddoppierà
l’incidenza delle fratture da osteoporosi, se non saranno prese adeguate misure
preventive (15,16,17). L’osteoporosi si configura, quindi, sempre più come una malattia
di grande rilevanza sociale (15). Si stima che, oggi, in Italia, ci siano circa 3,5 milioni di
donne ed 1 milione di uomini affetti da osteoporosi. Se si considera che nei prossimi 20
anni la percentuale della popolazione italiana al di sopra dei 65 anni d’età aumenterà
del 25%, è presumibile attendersi anche un proporzionale incremento dell’incidenza di
malattia. Attualmente, nella popolazione italiana oltre i 50 anni d’età, il numero di
fratture di femore è superiore alle 55.000 unità/anno. Alterazioni morfologiche vertebrali
sono state riscontrate in oltre il 20% degli ultra-65enni di entrambi i sessi (18,19). Nel
complesso il "life time risk" di andare incontro ad una tipica frattura osteoporotica è
attualmente del 40% (20). I pazienti con frattura del femore prossimale presentano
entro un anno dalla frattura una mortalità del 15-30% (21). Tra gli anziani, le fratture
osteoporotiche rappresentano una delle maggiori cause di mortalità, sostanzialmente
sovrapponibile a quella dovuta a ictus e a carcinoma mammario e ben 4 volte superiore
a quella per carcinoma endometriale.
Il 50% delle donne con frattura di femore
presenta, inoltre, una consistente riduzione del livello di autosufficienza e, in circa il
20% dei casi, richiede una istituzionalizzazione a lungo termine (22,23).
Studi prospettici hanno dimostrato che il rischio di frattura aumenta progressivamente
con il decremento della densità minerale ossea (BMD) (24). La definizione e la diagnosi
di osteoporosi è, quindi, imperniata sulla misurazione della BMD. La valutazione del
rischio di frattura viene effettuata con la misurazione della BMD, preferibilmente con
tecnica DXA, a livello della colonna vertebrale e del femore prossimale. Si dovrebbe
privilegiare la colonna lombare nelle donne in età perimenopausale (25, 24) e per la
verifica della risposta al trattamento antiosteoporotico e il femore prossimale nelle
donne anziane. Nella donna anziana, infatti, la DXA vertebrale può essere falsata da
artefatti dovuti alla presenza di lesioni artrosiche o calcificazIoni extrascheletriche.
Tuttavia, l’uso della misurazione della BMD per stabilire il rischio di frattura presenta un
alto valore predittivo positivo, ma un basso valore predittivo neg. Infatti, la metà circa
delle fratture da osteoporosi avvengono in soggetti con densità ossea risultata nei limiti
della norma (26).
Parallelamente alla DXA nel corso degli anni sono state sviluppate altre tecniche
non invasive e dotate di adeguata specificità che, invece dei raggi X, sfruttano gli
ultrasuoni. L’applicazione degli ultrasuoni può fornire, oltre ad una valutazione della
densità ossea, ulteriori informazioni sulla struttura, architettura e qualità dell’osso
(Quantitative Ultrasonometry, QUS), (27). Le sedi prescelte sono il calcagno o le falangi
delle mani, dove l'architettura trabecolare é del tutto simile a quella presente a livello
vertebrale e risente, quindi, precocemente delle alterazioni ormonali dovute
all’esaurimento della funzione endocrina dell’ovaio (27). Le apparecchiature di terza
generazione consentono di fare una valutazione qualitativa dell’architettura strutturale
dell’osso poichè la velocità con cui gli ultrasuoni attraversano l'osso é determinata sia
dalla sua densità, che dall'indice di elasticità, il quale a sua volta dipende dalle
caratteristiche strutturali della componente organica dell’osso ed è intimamente legato
alla resistenza dell'osso agli stress meccanici (28).
L'obiettivo di questo esame è, come per la DXA, la precoce identificazione delle
modificazioni che si verificano a livello osseo e che da uno stato di osteopenia portano
gradualmente verso l'osteoporosi conclamata (27). Lo screening con metodiche ad
ultrasuoni può quindi essere proposto per identificare con una metodica non invasiva e
a basso costo un numero significativo di donne osteopeniche ad alto rischio per
osteoporosi nelle quali la prevenzione dovrebbe essere presa in considerazione prima
della menopausa (27).
La determinazione della massa ossea è necessaria in qualsiasi soggetto si reputi
presente un rischio di osteoporosi, al fine di ottimizzare i rapporti tra i costi e i benefici
per permettere una diagnosi precoce e per un’adeguata prevenzione. Per questi motivi,
in ogni donna, nel periodo perimenopausale, deve essere presa in considerazione
l’opportunità di misurare la densità ossea (27).
In ogni singolo soggetto il rischio di sviluppare osteoporosi dipende fondamentalmente
da due fattori: il picco di massa ossea e l’entità della perdita di massa ossea in
postmenopausa. L’entità del picco di massa ossea raggiunto da ogni donna dipende da
fattori genetici, ma anche da condizioni endocrino-metaboliche (come l’oligomenorrea
ipoestrogenica), dall’ esercizio fisico e dall’apporto di calcio nell’età evolutiva (29).
La prevenzione dell'osteoporosi può essere attuata sia ottimizzando il picco di massa
ossea (prevenzione primaria) sia riducendo l'entità della perdita correlata alla
menopausa e all'invecchiamento (prevenzione secondaria). Per prevenzione terziaria si
intendono, invece, tutte quelle misure terapeutiche tese a bloccare l'evoluzione della
malattia conclamata, cercando di ridurne le complicanze (fratture).
La prevenzione primaria dell’osteoporosi implica interventi di tipo educativo e/o
informativo a favore dell’adozione di uno stile di vita che coadiuvi il raggiungimento del
picco di massa ossea in età giovanile e il suo successivo preservamento nel tempo, con
particolare attenzione al periodo di transizione verso la menopausa in cui la
sedentarietà, il fumo e una scorretta alimentazione vanno ad aggravare gli effetti
deleteri sul metabolismo osseo indotti dal progressivo esaurimento della funzione
endocrina dell’ovaio (9).
Le donne in età premenopausale che presentano cicli oligomenorroici con deficit
estrogenico, sono possibili candidate al trattamento ormonale per la prevenzione
dell'osteopenia (7). La terapia estroprogestinica normalizza rapidamente sia il
riassorbimento che la formazione ossea, riportando in equilibrio il bilancio osseo; in
queste
donne
il
trattamento
può
avvalersi
efficacemente
delle
formulazioni
contraccettive a basso dosaggio (7).
E’ ormai consolidato che l’uso del contraccettivo orale in perimenopausa prevenga la
demineralizzazione ossea sia a livello vertebrale che radiale e femorale (30-32). Infatti, i
contraccettivi orali quando assunti in premenopausa o in epoca fertile avanzata
conferiscono una protezione contro il rischio di frattura femorale in postmenopausa (33).
Secondo uno studio caso-controllo effettuato in donne in epoca post-menopausale (5081 anni), quelle che avevano fatto uso della pillola presentavano una riduzione del 25%
del rischio di frattura del femore rispetto alle donne che non avevano mai assunto la
pillola (33). Ovviamente l’uso dei contraccettivi orali
riduce significativamente
l’incidenza di fratture osteoporotiche solo quando assunto in età premenopausale
correggendo l’incipiente stato di ipoestrogenismo. Nelle donne più giovani (di età
inferiore ai 40 anni), invece, l’uso della pillola non si associa ad un effetto protettivo
sull’osso, in quanto si sostituisce ad una funzione gonadica normale che di per sé è in
grado di mantenere in equilibrio il turnover osseo, alterato invece nelle donne
oligomenorroiche (33) (Fig.1). Inoltre, le diverse molecole progestiniche contenute in
pillole a basso dosaggio non modificano l’effetto protettivo esercitato da esse nei
confronti del depauperamento osseo tipico del periodo perimenopausale (34) (Fig.2).
Figura 1 Uso di contraccettivi orali e rischio di frattura d’anca:
studio caso controllo (1327 casi, 3312 Controlli)
ODDS RATIOS FOR HIP FRACTURE RISK
NEVER
use after age 40
use at ages 30-39
0,82
1
(0.57-1.16)
0,8
0,6
0,4
0,2
0
Michaelsson et al, Lancet May 1999
0,69
(0.51-0.94)
use before age 30
1,26
(0.76-2.09)
FIGURA 2 : Andamento della densità minerale ossea (BMD, gr/cm 2) in donne
normomestruate (n=15), oligomenorroiche (n=15), and oligomenorroiche trattate con
contraccettivi orali (n=15 in ciascun gruppo). I risultati sono espressi come percentuale
di variazione rispetto ai valori basali.
# p<0.05 vs i corrispondenti valori di base; * p<0.01 vs i corrispondenti valori di base e
quelli misurate in donne normomestruate e quelle trattate con contraccettivi orali. (
modificata da ref. 34)
REFERENZE
1) Consensus development conference: diagnosis, prophylaxis, and treatment of
osteoporosis. Am J Med. 1993; 94: 646-50.
2) Seifert-Klauss V et al. Influence of pattern of menopausal transition on the amount
of trabecular bone loss. Results from a 6-year prospective longitudinal study.
3) Riggs BL, Melton LJ. Evidence for two distinct syndromes of involutional
osteoporosis. Am J Med 1993; 75:899-901
4) Gambacciani M, Spinetti A, Piaggesi L, Cappagli B, Taponeco F, Manetti p, Teti GC,
La Commare P, Facchini V. Ipriflavone prevents the bone mass reduction in
premenopausal women treated with gonadotropin hormone-releasing hormone
agonists. Bone Miner. 1994 Jul;26(1):19-26
5) Gambacciani M et al. Postmenopausal osteoporosis and hormone replacement
therapy. Minerva Med. 2004 Dec;95(6):507-20. Review. English, Italian.
6) Gambacciani M et al. Bone loss in perimenopausal women: a longitudinal study.
Maturitas 1994 Mar;18(3):191-7.)
7) Gambacciani M et al. Longitudinal evaluation of perimenopausal bone loss: effects
of different low dose oral contraceptive preparations on bone mineral density.
Maturitas. 2006 May 20;54(2):176-80. Epub 2005 Dec 5.
8) Gambacciani M et al. Postmenopausal osteoporosis and hormone replacement
therapy. Minerva Med. 2004 Dec;95(6):507-20. Review. English, Italian.
9) Gambacciani M, Spinetti A, Taponeco F, Cappagli B, Maffei S, Manetti P, Piaggesi L,
Fioretti P. Bone loss in perimenopausal women: a longitudinal study.Maturitas. 1994
Mar;18(3):191-7.
10) Gambacciani M, Spinetti A, de Simone L, Cappagli B, Maffei S, Taponeco F, Fioretti
P. The relative contributions of menopause and aging to postmenopausal vertebral
osteopenia. J Clin Endocrinol Metab. 1993 Nov;77(5):1148-51.
11) Gambacciani M, Spinetti A., De Simone L., et al. Postmenopausal bone loss of the
proximal femur: estimated contribution of menopause and ageing. Menopause 1995; 2:
169-174.
12) Riggs BL, Wahner HW, Dunn WL, Mazess RB, Offord KP, Melton LJ III. Differential
changes in bone mineral density of the appendicular and axial skeleton with ageing. J
Clin Invest 67: 328-35, 1981.
13) Gambacciani M, Pepe A et al. The relative contributions of menopause and aging to
postmenopausal reduction in intervertebral disk height. In press.
14) Sorney-Rendu E et al. Disc space narrowing as a new risk factor for vertebral
fracture: the OFELY Study. Arthritis Rheum. 2006 Apr; 54(4): 1262-9.
15) Dennison E et al. Epidemiology of osteoporosis. Rheum Dis Clin North Am. 2006
Nov;32(4):617-29. Review.
16) Gallagher JC. Effect of early menopause on bone mineral density and fractures.
Menopause. 2007 May-Jun;14(3 Suppl):567-71
.
17) Reimers A et al. Hip fractures among the elderly: personal and contextual social
factors that matter. J Trauma. 2007 Feb;62(2):365-9.
18) O’Neill TW, Felsenberg D, Varlow J, et al. The prevalence of vertebral osteoporosis
in European men and women: the European Vertebral Osteoporosis Study. J Bone Min
Res 11: 1010-8, 1996.
19) Rossini M, Adami S. Farmacoecomnomia e trattamento dell’osteoporosi.
Farmacoeconomia 1: 5-11, 1999.
20) Melton LJ, Chrishilles EA, Cooper C, Lane AW, Riggs BL. Prospective: How many
women have osteoporosis? J Bone Miner Res 1992; 7: 1005-1010.
21) Browner WS, Seeley DG, Vogt TM, Cummings SR. Non-trauma mortality in elderly
women with low bone mineral density. Lancet 1991; 338: 355-358.
22) NOF. Osteoporosis: Review of the evidence for prevention, diagnosis, and
treatment and cost-effectiveness analysis. Study Report. Osteop Int. 1998; 8: (Suppl4).
23) Lyons AR. Clinical outcomes and treatment of hip fractures. Am J Med. 1997; 103:
51S-63S.
24) World health Organization 1994. Assessment of fracture risk and its
application to screening for postmenopausal osteoporosis. Technical Report
Series 843. Geneva
25) The Royal College of Physicians, The Osteoporosis: Clinical Guidelines for
prevention and treatment. The Lavenham press Ltd, 1999
26) Sorney-Rendu E et al. Identification of osteopenic women at high risk of fracture:
the OFELY study. J Bone Miner Res. 2005 Oct; 20(10): 1813-9. Epub 2005 Jun 20.
27) Gambacciani M et al. Quantitative ultrasound (QUS) of bone in the management of
postmenopausal women. Maturitas. 2004 Feb 20;47(2):139-49.
28) Gambacciani
M, Cappagli B, Genazzani AR et al. Quantitative bone
ultrasonometry in climacteric women. J Clin Densitom. 1998 Fall; 1(3):303-8.
29) Brown LB et al. Genetic and environmental influences on bone mineral density in
pre- and post-menopausal women. Osteoporos Int. 2005 Dec;16(12):1849-56. Epub
2005 Jul 5.
30) Gambacciani M, Spinetti A, Cappagli B, et al. Hormone replacement therapy in
perimenopausal women with a low dose oral contraceprive preparation effects on bone
mineral density and metabolism. Maturitas, 1994; 19:125-31.
31) Gambacciani M, Spinetti A, Taponeco F, Cappagli B, Piagesi L, Fioretti P,
Longitudinal evaluation of perimenopausal vertebral bone loss: effects of a low dose
oral contraceptive preparation on bone mineral dansity and metabolism. Obstet
Gynecol 1994;83:392-6
32) Gambacciani M, Ciaponi M, Cappagli B, et al . Longitudinal evaluation of
perimenopausal femoral bone loss: effects of a low dose oral contraceptive preparation
on bone mineral density and metabolism. Osteoporos Int. 2000; 11:544-8.
33) Michaelsson K, Baron JA, Farahmand BY, et al. Oral-contraceptive use and risk of
hip fracture: a case-control study. Lancet. 1999; 353:1481-1484.
34) Gambacciani M et al. Longitudinal evaluation of perimenopausal bone loss: Effects
of different low dose oral contraceptive preparations on bone mineral density. Maturitas.
2006 May 20;54(2):176-80.
Quali contraccettivi usare in perimenopausa? I contraccettivi a bassissimo
dosaggio garantiscono gli stessi vantaggi non contraccettivi?
L’uso dei contraccettivi a basso dosaggio (< 20 mcg di etinilestradiolo) è da
preferire nella donne di età superiore a 35 anni in cui non esistono controindicazioni
assolute all’uso di estro-progestinici, mentre è da evitare in donne di uguale età ma
fumatrici, ipertese, diabetiche, iperlipidemiche, con familiarità di primo grado per
malattia cardiovascolare . Nelle donne in cui esiste una controindicazione relativa o
assoluta all’assunzione degli estrogeni, è possibile suggerire l’uso di metodi
contraccettivi contenenti il solo progestinico, gravati peraltro da una percentuale
maggiore di insuccessi anticoncezionali ed uno scarso controllo della ciclicità
mestruale. Il contraccettivo con il solo progestinico può essere rivolto alle donne con
controindicazione agli estrogeni, anche se le irregolarità mestruali che spesso tali
metodi comportano potrebbero portare la donna a sottostimare l’importanza dei
sanguinamenti intermestruali così da far misconoscere la presenza di lesioni preneoplastiche o neoplastiche a carico dell’endometrio. La pillola al solo progestinico non
allevierebbe comunque l’iniziale sintomatologia climaterica da ipoestrogenismo.
AL contrario le pillole a basso dosaggio (EE 20 mcg ) hanno dimostrato un
ottimo controllo del ciclo con riduzione della durata e della quantità del flusso mestruale,
oltre ad un impattopositivo sulla sintomatologia vasomotoria e sulla qualità di vita
(benessere psicologico, sessuale, psico-sociale. (1-12)
Referenze
6)
Weiseberg E, Fraser IS, Perimenopausal mestrual disturbances, fertility and the need
of contraception. In : Wren BG, Nachtrgall LE, McGraw-Hilll Book Company; 1996:1-31.
7)
Stenchever MA, Risk of oral contraceptive use in women over 35. J Reprod Med,
193;38:1030-5.
8)
Root WB, Contraception for midlife women, NAACOGS Clin Issu perinat Womnes
Health Nurs. 1992;3: 227-35.
9)
Colls JP, Contraception during perimenopausal years is important issue for patients
and clinicians. Contracept Technol Update. 1984: 5:158-60.
10)
Casper RF, Dodin S, Reid RL, and Study Investigators. The effect of 20 mcg ethinyl
estradiol /1 mg norethindrone acetate , a low-dose oral contraceptive, on vaginal
bleeding patterns, hot flashes and quality of life in symptomatic perimenopausal women
. Menopause. 17; 4:139-147.
11)
David F.Archer, Lower doses of oral estrogen and progestogens as treatment for
postmenopausal women. Semin Reprod Med 2005;23:188-15.
12)
Shaaban MM, The perimenopause and contraception Maturitas 1996; 23:181-2.
Contraccettivi orali in perimenopausa e rischio metabolico
I primi studi effettuati in questo senso, dimostravano l’esistenza di una
associazione significativa tra uso di pillola ed un aumento degli episodi tromboembolici
e di ischemia miocardiaca. Tuttavia, questi studi non tenevano conto di molti fattori
confondenti come il fumo, il peso corporeo, l’anamnesi primaria positiva per eventi
cardiovascolari che negli studi successivi sono stati considerati invece fattori di
esclusione dall’arruolamento. Dati emersi dal WHI study e presentati al Annual
Meeting of the American Society of Reproductive Medicine, documentano una
riduzione di circa l’8% della patologia cardiovascolare in donne di età tra i 50 e 79 anni
che in passato avevano usato contraccettivi orali. Quando si parla di patologia
cardiovascolare e contraccettivi orali, va comunque ricordato che l’incidenza di tali
patologie quali l’infarto del miocardio, lo stroke ischemico e emorragico e la trombosi
venosa profonda in età riproduttiva è molto bassa e aumenta con il progredire dell’età.
L’incidenza di infarto del miocardio è 3 casi su un milione sotto i 35 anni e sale a 3 casi/
100,000 dopo i 35 anni. Ugualmente il rischio di stroke ischemico sale da 6
casi/1,000,000 a 20-24 anni a 16/1000,000 a 40-44 anni. Lo stroke emorragico aumenta
da 13 casi/1,000,000 a 20-24 anni a 46 casi/1000,000 a 40-44 anni. L’incidenza di
trombosi venosa profonda è di 32 casi/1,000,000 a 20-24 anni e sale a 59
casi/1,000,000 a 40-44 anni. L’uso della pillola in donne di età superiore ai 35 anni non
fumatrici non espone a maggior rischio cardiovascolare. Recentemente è stato riportato
che l’uso di pillola conrtaccettiva in età premenopausale si associa ad una riduzione
della malattia coronarica, dimostrata dalla angiografia in donne con sospetta ischemia
coronarica. Queste osservazioni suggeriscono che l’uso di contraccettivi orali in età
premenopausale possa prevenire la malattia coronarica.
L’uso della pillola deve comunque essere usato con cautela dopo i 35 anni in
donne che presentano fattori di rischio per tali patologie (fumo, emicrania, ipertensione,
storia familiare di trombosi venosa).
Dato che l’età di per se e la tendenza all’incremento ponderale possono essere fattori
di rischio potenziali per fatti tromboembolici è comunque preferibile la scelta di
contraccettivi a basso contenuto di etinilestradiolo (1-4)
REFERENZE
1.
The practice Committeee of the American Society of Reproductive Medicine.
Hormonal contraception: recent advances and controversies, Fertil Steril 2004;82:S26.
2.
Kovacs L. Oral contraception over the age of 40. AA NY Acad Sci. 2003; 997:194198.
3.
Stencher MA. Risks of oral contraceptive use in women over 35. J Reprod Med.
1993; 38:1030-1035.
4.
Bairey Merz CN, Johnson BD, Berga S, Braunstein G, Reis SE, Bittner V; WISE
Study Group. Past oral contraceptive use and angiographic coronary artery disease in
postmenopausal women: data from the National Heart, Lung, and Blood Institutesponsored Women's Ischemia Syndrome Evaluation. Fertil Steril. 2006 Apr 4
TESTOSTERONE, IPOGONADISMO MASCHILE, E DISTURBO DELLA
SESSUALITA’
F. Lotti, G. Corona, M. Maggi
Unità di Andrologia, Dipartimento di Fisiopatologia Clinica, Università di Firenze.
Corrispondenza:
Prof. Mario Maggi, Unità di Andrologia, Dipartimento di Fisiopatologia Clinica, Viale Pieraccini 6,
50139, Firenze. Tel.: +39-55-4271415. Fax: +39-55-4271413
e-mail: [email protected]
A) Sintesi e azione del testosterone
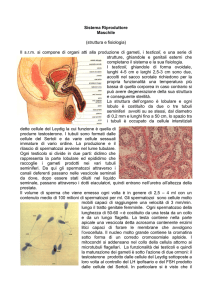
Il testicolo rappresenta l‟organo principe per la capacità riproduttiva e la salute sessuale maschile.
Esso sintetizza due prodotti, entrambi essenziali per una strategia riproduttiva vincente: il
testosterone, l‟androgeno più rappresentato nell‟organismo maschile, e gli spermatozoi.
Testosterone e spermatozoi sono prodotti in due aree distinte del testicolo, le cellule di Leydig e i
tubuli seminiferi, rispettivamente, che comunicano tra loro continuamente. L‟attività testicolare è,
infatti, regolata da fattori intra-testicolari (incluso il testosterone), e da fattori trofici extra-testicolari
prodotti dall‟ipofisi, come le gonadotropine LH e FSH, la cui secrezione è strettamente regolata dal
peptide ipotalamico GnRH [Figura 1]. Il testosterone circolante (T) si lega con elevata affinità ad
una proteina di trasporto, la globulina legante gli ormoni sessuali (“sex hormon binding globulin”,
SHBG). L‟SHBG, oltre al T, lega anche altri steroidi, come gli estrogeni, sebbene con minor
affinità. La frazione di T non legata alla SHBG è detta “T-libero”, ed è ritenuta la frazione
biologicamente attiva del T-totale. La misurazione del T-libero rappresenta il principale strumento
per valutare lo stato androgenico di un maschio. Tuttavia, misurare il T-libero non è così semplice,
perché i metodi diretti disponibili in commercio, che impiegano analoghi marcati del T, sono spesso
inaffidabili, e perché la separazione della frazione non legata del T mediante la tecnica della dialisi
all‟equilibrio risulta piuttosto indaginosa. Di conseguenza, ad oggi, il metodo principe per la
determinazione del T-libero è rappresentato dal calcolo della frazione libera del T [1] eseguito
impiegando una formula matematica [2, disponibile sul sito http: //www.issam.ch/freetesto.htm] che
tiene conto del valore della sua frazione totale e della sua quota legata all‟SHBG.
Il T esercita la sua azione biologica sui tessuti bersaglio mediante l‟interazione con specifici
recettori, i recettori androgenici. Nei tessuti bersaglio, l‟attività biologica del T può essere
ulteriormente amplificata dalla sua riduzione a diidrotestosterone (DHT), operata da due distinte
isoforme della 5-reduttasi (5R), la 5R tipo 1, che non è regolata dagli androgeni, e la 5R tipo
2, più strettamente modulata dagli androgeni [Figura 1]. Inoltre, il T e il suo precursore, il 4
androstenedione, possono essere trasformati dall‟enzima aromatasi P450 in altri metaboliti attivi,
quali l‟estrone e l‟estradiolo (E2). Quindi, il T esercita la sua azione biologica in parte come tale, in
parte mediante la sua riduzione a DHT o aromatizzazione a estrogeni [Figura 1]. Tuttavia, la
misurazione del DHT circolante è spesso considerata inutile, perché essa non riflette la produzione
dell‟ormone da parte dei tessuti bersaglio, mentre la misurazione dell‟E2 nel soggetto di sesso
maschile è spesso considerata inaffidabile, perché le metodiche disponibili per la sua misurazione
sono state concepite per rilevare il picco ovulatorio di E2 durante il ciclo mestruale femminile [3].
La Figura 1 riassume i principali effetti biologici del testosterone.
L‟asse ipotalamo-ipofisi-testicolo è mantenuto in equilibrio costante mediante il feedback negativo
operato dai prodotti testicolari sulla secrezione dell‟ormone ipotalamico GnRH e delle
gonadotropine ipofisarie. Il testosterone e i suoi metabolici attivi, DHT ed estrogeni, regolano
negativamente la secrezione di GnRH e LH, mentre fattori rilasciati dai tubuli seminiferi,
prevalentemente appartenenti alla famiglia delle inibine, determinano un feedback negativo
parallelo sull‟FSH. Un‟alterazione dell‟asse ipotalamo-ipofisi-testicolo è alla base
dell‟ipogonadismo maschile, definito come uno stato patologico caratterizzato da un deficit di
secrezione o attività biologica del T e da una diminuita produzione di spermatozoi.
B) Ipogonadismo maschile
La classificazione dell‟ipogonadismo maschile si basa generalmente sulla distinzione della specifica
sede dell‟asse ipotalamo-ipofisi-testicolo caratterizzata da un deficit funzionale. Si distinguono
un‟ipogonadismo primitivo, quando la sede disfunzionale è il testicolo, incapace di rilasciare i
propri prodotti, cui consegue un tentativo di compenso mediante l‟aumento della secrezione delle
gonadotropine da parte dell‟ipofisi, e un‟ipogonadismo secondario, quando la sede disfunzionale è
la regione ipotalamo-ipofisaria, cui consegue un‟inadeguata stimolazione da parte delle
gonadotropine ipofisarie su un testicolo sano. In base a queste considerazioni, i due tipi di
ipogonadismo considerati sono definiti rispettivamente ipogonadismo ipergonadotropo ed
ipogonadismo ipogonadotopo. Inoltre, una condizione clinica simile all‟ipogonadismo può derivare
anche da una ridotta sensibilità, o insensibilità, dei tessuti bersaglio al T e ai suoi metaboliti (DHT e
estrogeni), o da una ridotta biodisponibilità dell‟ormone, causata dall‟aumento dei livelli plasmatici
della sua proteina di trasporto, SHBG. Infine, l‟ipogonadismo può essere distinto in congenito o
acquisito più tardivamente, durante l‟infanzia o la vita adulta. La Tabella 1 riassume le principali
cause di ipogonadismo maschile, classificate in base alle caratteristiche sopra menzionate. E‟
interessante notare che i segni e i sintomi dell‟ipogonadismo sono abbastanza simili
indipendentemente dalla diversa sede di origine dell‟affezione [4]. Tuttavia, essi sono
profondamente diversi quando valutati in base all‟età di insorgenza dell‟ipogonadismo. In altre
parole, il fenotipo del paziente ipogonadico è più spesso condizionato dall‟età di insorgenza
piuttosto che dalla sede del deficit funzionale. Tali considerazioni sono riassunte in Figura 2. Nel
caso di un “ipogonadismo ad insorgenza molto precoce” (“very early onset hypogonadism”,
VEOH), che origina durante la vita fetale, la sintomatologia può rivelarsi persino drammatica,
manifestandosi con uno spettro fenotipico molto vario, che può includere soggetti con un aspetto
fisico quasi completamente femminilizzato (sindrome da insensibilità totale agli androgeni o difetti
enzimatici che portano al blocco della sintesi androgenica), fino a soggetti con difetti variabili di
virilizzazione (micropene, ipospadia, criptorchidismo), come nel caso di individui che presentano
un‟alterazione nella secrezione o nell‟attività del GnRH. Nel caso della comparsa
dell‟ipogonadismo in epoca peripuberale (“ipogonadismo a insorgenza precoce”, “early onset
hypogonadism”, EOH), a fronte di un più modesto difetto centrale o periferico (come nella S. di
Klinefelter), vi può essere un ritardo nello sviluppo puberale associato alla comparsa di un fenotipo
eunucoide, presenza di scarsi peli corporei, tono di voce acuto, testicoli, pene e prostata di piccole
dimensioni. Nel caso di un “ipogonadismo a insorgenza tardiva” (“late onset hypogonadism”,
LOH), i sintomi possono risultare relativamente modesti, insidiosi e difficili da riconoscere e, di
conseguenza, da trattare. Inoltre, nel caso di LOH, è spesso presente una compromissione organica
o funzionale che coinvolge contemporaneamente i testicoli, l‟ipofisi e l‟ipotalamo, per cui la sede di
origine della patologia è frequentemente poco chiara.
Mentre l‟EOH e, in particolare, il VEOH, sono patologie relativamente poco frequenti (sebbene non
così rare, presentando un‟incidenza variabile da 1:500 nuovi casi/anno per la S.di Klinefeklter a
1:100000 per la S. da insensibilità totale agli androgeni) e tali da richiedere la gestione da parte
specialisti esperti, il LOH è un disordine molto comune. Di conseguenza, i medici dovrebbero
imparare a riconoscere sempre di più le sue caratteristiche ed i suoi sintomi [4].
C) Ipogonadismo e disfunzione erettile
Il disturbo della sessualità può essere considerato il marchio dell‟ipogonadismo, essendo in qualche
modo presente in tutte le forme, indipendentemente dalla sede di origine e dall‟età di insorgenza.
Infatti, nel maschio adulto, il T è considerato il carburante ormonale del desiderio sessuale, ed
inoltre gioca un ruolo importante nel regolare altri aspetti della risposta sessuale maschile, come
l‟erezione peniena (sia spontanea, sia indotta da stimoli sessuali), la frequenza dei rapporti sessuali
e la masturbazione. E‟ stata riportata anche un‟associazione tra bassi livelli di T, eiaculazione
ritardata [5] e basso volume dell‟eiaculato (il T è il principale fattore trofico sia della prostata sia
delle vescichette seminali). La Figura 3 mostra l‟associazione tra i livelli di T e i sopra citati aspetti
della sessualità maschile in un‟ampia coorte di soggetti adulti afferenti al Servizio Ambulatoriale
dell‟Unità di Andrologia dell‟Università di Firenze.
Sebbene l‟associazione tra i livelli plasmatici di T e la frequenza di erezioni spontanee/notturne sia
sostenuta da diversi studi [6-9], la relazione tra livelli plasmatici di T ed erezioni indotte da stimoli
sessuali è meno evidente, o non del tutto documentata [4, 9-12]. Una possibile spiegazione di questo
fenomeno deriva da studi sperimentali. La più importante via coinvolta nell‟induzione dell‟erezione
peniena è quella nonadrenergica/noncolinergica (NANC), che, mediante il rilascio di ossido nitrico
(NO) conduce all‟incremento dei livelli intracellulari di GMP ciclico (cGMP), il principale secondo
messaggero implicato nel raggiungimento di uno stato di tumescenza del pene. E‟ interessante
notare che sia la formazione sia la degradazione del cGMP sono regolate dal T. Infatti, oltre al ben
noto ruolo del T nel regolare la formazione di NO [13-16], recenti evidenze sperimentali, ottenute
sia su roditori [16-19] sia nell‟uomo [18], hanno dimostrato che il T regola anche l‟espressione della
fosfodiesterasi di tipo 5 (PDE5), l‟enzima idrolitico coinvolto nella degradazione del cGMP. Questa
azione antitetica del T sembra spiegare il principale meccanismo con cui si realizza la regolazione
ormonale periferica dell‟erezione peniena. Poiché il T modula positivamente sia l‟inizio (NOS) sia
la fine (PDE5) del processo erettile, il suo effetto netto sull‟induzione dell‟erezione è modesto. Ne
deriva che la comparsa delle erezioni è ancora possibile in condizioni di ipogonadismo, dove una
diminuita formazione di cGMP, causata da una alterata produzione di NO, è controbilanciata da una
diminuita attività della PDE5 e da una diminuita idrolisi del cGMP. La principale azione fisiologica
del T è quindi quella di regolare temporalmente il processo erettile in funzione del desiderio
sessuale, in modo tale da finalizzare la comparsa dell‟erezione all‟atto sessuale. Questo è, molto
probabilmente, il principale motivo per cui il T controlla il processo di inizio (NOS) e di termine
(PDE5) dell‟erezione. Di conseguenza, l‟erezione peniena non è un fenomeno casuale, ma un
evento discreto, temporizzato, associato al desiderio sessuale e all‟eccitamento.
Il T presenta, inoltre, un effetto trofico sull‟architettura peniena, come è stato dimostrato in
esperimenti condotti su diverse specie animali [4, 19]. La deprivazione androgenica, condotta su
modelli sperimentali animali mediante castrazione chirurgica o medica, determina perdita di tessuto
muscolare liscio trabecolare ed incremento di matrice extracellulare, cui consegue una condizione
di fibrosi diffusa e di disfunzione erettile [4, 20-22]. Tale condizione viene solitamente ripristinata
dalla terapia con T [4, 19, 21]. Inoltre, è stato evidenziato come il T sia coinvolto anche nella
maturazione della composizione del tessuto penieno, promuovendo la differenziazione delle cellule
staminali pluripotenti verso la linea miogenica e inibendo quella orientata in senso adipogenico [2325]. L‟accumulo di cellule adipose subalbuginee nei corpi cavernosi è stato associato ad
un‟alterazione del meccanismo veno-occlusivo penieno [17].
In conclusione, gli androgeni rivestono un ruolo importante sia esercitando un‟azione trofica sul
tessuto penieno, sia modulando la sintesi e la degradazione del suo principale fattore rilasciante, il
cGMP (vedi ref. n. 4 per revisione).
D) Ipogonadismo e desiderio sessuale ipoattivo
La condotta sessuale maschile è un fenomeno molto complesso, influenzato, oltre che dall‟azione
degli androgeni, anche da fattori intrapsichici, relazionali, sociali e culturali. Tuttavia, c‟è ormai un
consenso generale sul fatto che il T sia un chiaro determinante della spinta sessuale e della
motivazione sessuale. Molti studi controllati e non controllati, condotti su popolazioni di maschi
ipogonadici, hanno dimostrato il ruolo inequivocabile del T nel ripristinare il desiderio sessuale,
l‟ideazione sessuale spontanea, e l‟attrazione per stimoli erotici [vedi per revisione ref. n. 26-28]. E‟
invece meno noto quali siano gli specifici siti cerebrali su cui il T agisce e con quale meccanismo
esso eserciti effetti positivi sulla sessualità nel cervello umano. Studi condotti su modelli animali
indicano chiaramente che nel Sistema Nervoso Centrale (SNC) sono presenti i recettori per gli
steroidi sessuali, e che il T regola l‟attività di diversi neurotrasmettitori coinvolti nella modulazione
della condotta sessuale, come la dopamina [29, 30]. Comunque, ad oggi, sono poche le
informazioni relative alla localizzazione dei recettori per gli steroidi sessuali nel SNC umano. I
recettori androgenici sono presenti in aree distinte del cervello umano, che includono le aree
temporale, preottica, frontale e prefrontale, l‟ipotalamo, l‟amigdala, il mesencefalo e il giro del
cingolo (Area di Brodman 24, BA24) [31-36]. Il giro del cingolo, in particolare, è una parte del
sistema limbico profondamente coinvolta nella modulazione comportamentale ed emozionale, e
risulta coinvolta anche nell‟eccitamento sessuale indotto dalla visione di filmati erotici, come
osservato in due diversi studi condotti mediante l‟impiego della tomografia ad emissione di
positroni (PET) [37] e della risonanza magnetica nucleare funzionale (fMRI) [39], rispettivamente.
E‟ interessante notare che il ripristino di normali livelli plasmatici di T in maschi ipogonadici che
lamentavano perdita del desiderio sessuale, determina, parallelamente al miglioramento della
sintomatologia dell‟ipogonadismo, anche un aumento della perfusione ematica nella BA24, nel
mesencefalo e nel giro frontale superiore (BA8), valutato utilizzando la tomografia a emissione di
singolo fotone (SPECT) [36]. Stoleru e collaboratori [37], in uno studio condotto mediante
l‟impiego della PET, avevano precedentemente identificato un‟altra area cerebrale sensibile agli
androgeni, descrivendo una chiara associazione positiva tra i livelli plasmatici di T e l‟attivazione
del giro occipitale mediano (BA37) durante la visione di filmati erotici, mentre con la visione di
filmati a contenuto neutro l‟associazione continuava ad essere significativa, ma in senso negativo.
L‟attivazione dell‟area 37 di Brodman indotta dalla visione di filmati erotici è stata confermata da
un ulteriore studio ed è stata correlata all‟elaborazione di stimoli visivi, soprattutto a contenuto
sessuale [39]. Dunque, molte aree cerebrali strettamente correlate alla spinta sessuale sono sensibili
agli androgeni, e in particolare al testosterone. Tuttavia, deve essere osservato che il desiderio e la
motivazione sessuale sono entità distinte, sebbene strettamente correlate, rispetto all‟eccitazione
sessuale. Quest‟ultima rappresenta, infatti, la componente cognitiva ed emozionale che conduce il
maschio alla soglia per iniziare un rapporto sessuale (sentirsi sessualmente eccitato), e include
l‟erezione peniena [40]. E‟ importante sottolineare che molti degli studi di diagnostica per immagini
cerebrale condotti sull‟uomo si sono rivolti principalmente allo studio dell‟eccitazione sessuale
piuttosto che al desiderio sessuale.
Lo studio dell‟associazione tra livelli androgenici e condotta sessuale è ulteriormente complicato
dal fatto che essi sono mutuamente dipendenti e possono dunque modularsi a vicenda. Infatti, non
soltanto il T modula l‟attività sessuale, ma quest‟ultima regola positivamente la produzione di T.
Una singola osservazione aneddotica pubblicata circa 40 anni fa sulla rivista Nature [41], ha aperto
questo secondo scenario. Un autoctono islandese osservò che, il giorno precedente e nel corso delle
visite occasionali alla sua amata, la sua barba cresceva più del solito [41]. Negli anni successivi,
solo sporadici studi hanno supportato questa osservazione, dimostrando che durante i rapporti
sessuali [42, 43], o nel corso della visione di filmati erotici [44], si realizzava un aumento dei livelli
di testosterone temporalmente correlato. Al contrario, altri studi rivolti a indagare l‟aumento dei
livelli ematici di testosterone indotti dall‟attività sessuale hanno dato una risposta negativa [45-49].
Tuttavia, Stoleru e collaboratori [50], prelevando campioni ematici ogni dieci minuti per dodici ore,
hanno dimostrato un incremento del rilascio pulsatile di LH, con conseguente aumento di
testosterone, immediatamente dopo la visione di filmati erotici. Su questa linea, negli ultimi anni, si
sono ottenuti risultati significativi a supporto dell‟ipotesi di una spinta alla produzione di
testosterone LH-mediato indotto dall‟attività sessuale [51-53].
In conclusione, il T regola strettamente la risposta erettile a stimoli sessuali, regolando sia la fase
iniziale che finale dell‟erezione, sincronizzandole con il desiderio sessuale, anch‟esso fortemente
modulato dagli androgeni. Ciò potrebbe spiegare perché, anche in assenza di T, è possibile il
verificarsi di erezioni peniene (come accade nei bambini e negli eunuchi); queste ultime, comunque,
non sono generalmente finalizzate all‟atto sessuale, a causa della scarsa motivazione sessuale
correlata ai bassi livelli di T.
REFERENZE BIBLIOGRAFICHE
1. Rosner W, Auchus RJ, Azziz R et al. Position statement: Utility, limitations, and pitfalls in
measuring testosterone: an Endocrine Society position statement. J Clin Endocrinol Metab.
2007;92:405-13.
2. Vermeulen A, Verdonck L, Kaufman JM. A critical evaluation of simple methods for the
estimation of free testosterone in serum. J Clin Endocrinol Metab. 1999;84:3666-72.
3. Nelson RE, Grebe SK, OKane DJ et al. Liquid chromatography-tandem mass spectrometry
assay for simultaneous measurement of estradiol and estrone in human plasma. Clin Chem.
2004;50:373-84.
4. Morelli A, Corona G, Filippi S et al. Which patients with sexual dysfunction are suitable for
testosterone replacement therapy? J Endocrinol. Invest. 2007 in press.
5. Corona G, Mannucci E, Petrone L et al. Psychobiological correlates of delayed ejaculation
in male patients with sexual dysfunctions. J Androl. 2006;27:453-8.
6. Schiavi RC, White D, Mandeli J et al. Hormones and nocturnal penile tumescence in healthy
aging men. Arch Sex Behav. 1993;22:207-15.
7. Granata AR, Rochira V, Lerchl A et al.. Relationship between sleep-related erections and
testosterone levels in men. J Androl. 1997;18:522-27.
8. Rochira V, Balestrieri A, Madeo B et al. Sildenafil improves sleep-related erections in
hypogonadal men: evidence from a randomized, placebo-controlled, crossover study of a synergic
role for both testosterone and sildenafil on penile erections. J Androl. 2006;27:165-75.
9. Montorsi F, Oettel M. Testosterone and sleep-related erections: an overview. J Sex Med.
2005;2:771-84.
10. Buvat J, Bou Jaoude G. Significance of hypogonadism in erectile dysfunction. World J
Urol. 2006;24:657-67.
11. Traish AM, Guay AT. Are androgens critical for penile erections in humans? Examining the
clinical and preclinical evidence. J Sex Med. 2006;3:382-404.
12. Gooren LJ, Saad F. Recent insights into androgen action on the anatomical and
physiological substrate of penile erection. Asian J Androl. 2006;8:3-9.
13. Vignozzi L, Corona G, Petrone L et al. Testosterone and sexual activity. J Endocrinol
Invest. 2005;28(3 Suppl):39-44.
14. Traish AM, Toselli P, Jeong SJ et al. Adipocyte accumulation in penile corpus cavernosum
of the orchiectomized rabbit: a potential mechanism for veno-occlusive dysfunction in androgen
deficiency. J Androl. 2005; 26: 242-8.
15. Morelli A, Filippi S, Zhang XH et al. Peripheral regulatory mechanisms in erection. Int J
Androl. 2005;28 (Suppl 2):23-7.
16. Morelli A., Filippi S., Vignozzi L et al. Physiology of erectile function: an update on
intracellular molecular processes. EAU-EBU Update Series. 2006;4: 96-108.
17. Zhang XH, Filippi S, Morelli A et al. Testosterone restores diabetes-induced erectile
dysfunction and sildenafil responsiveness in two distinct animal models of chemical diabetes. J Sex
Med. 2006;3:253-64.
18. Morelli A, Filippi S, Mancina R et al. Androgens regulate phosphodiesterase type 5
expression and functional activity in corpora cavernosa. Endocrinology. 2004;145:2253-63.
19. Traish AM, Park K, Dhir V et al. Effects of castration and androgen replacement on erectile
function in a rabbit model. Endocrinology. 1999;140:1861-8.
20. Traish AM, Munarriz R, O'Connell L et al. Effects of medical or surgical castration on
erectile function in an animal model. J Androl. 2003;24:381-7.
21. Traish AM, Kim NN. The physiological role of androgens in penile erection: regulation of
corpus cavernosum structure and function. J Sex Med. 2005;2:759-70.
22. Shen ZJ, Zhou XL, Lu YL et al. Effect of androgen deprivation on penile ultrastructure.
Asian J Androl. 2003;5:33-6.
23. Bhasin S, Taylor WE, Singh R et al. The mechanisms of androgen effects on body
composition: mesenchymal pluripotent cell as the target of androgen action. J Gerontol
2003;58:M1103-10.
24. Singh R, Artaza JN, Taylor WE et al. Androgens stimulate myogenic differentiation and
inhibit adipogenesis in C3H 10T1/2 pluripotent cells through an androgen receptor-mediated
pathway. Endocrinology. 2003;144:5081-8.
25. Singh R, Artaza JN, Taylor WE et al. Testosterone inhibits adipogenic differentiation in
3T3-L1 cells: nuclear translocation of androgen receptor complex with beta-catenin and T-cell
factor 4 may bypass canonical Wnt signaling to down-regulate adipogenic transcriptionfactors.
Endocrinology. 2006;147:141-54.
26. Bancroft J. The endocrinology of sexual arousal. J Endocrinol. 2005;186:411-27.
27. Christiansen K. Behavioural effects of androgen in men and women. J Endocrinol.
2001;170:39-48.
28. Bhasin S, Enzlin P, Coviello A et al. Sexual dysfunction in men and women with endocrine
disorders. Lancet. 2007;369:597-611.
29. Robbins A. Androgens and male sexual behaviour. From mice to men. Trends Endocrinol
Metab. 1996;7:345-50.
30. Kandeel FR, Koussa VK, Swerdloff RS. Male sexual function and its disorders: physiology,
pathophysiology, clinical investigation, and treatment. Endocr Rev. 2001;22: 342-88.
31. Rance NE, McMullen NT, Smialek JE et al. Postmenopausal hypertrophy of neurons
expressing the estrogen receptor gene in the human hypothalamus. J Clin Endocrinol Metab.
1990;71: 79-85.
32. Sarrieau A, Mitchell JB, Lal S et al. Androgen binding sites in human temporal cortex.
Neuroendocrinology. 1990;51: 713-6.
33. Puy L, MacLusky NJ, Becker L et al. Immunocytochemical detection of androgen receptor
in human temporal cortex characterization and application of polyclonal androgen receptor
antibodies in frozen and paraffin-embedded tissues. J Steroid Biochem Mol Biol. 1995; 55: 197-9.
34. Donahue JE, Stopa EG, Chorsky RL et al. Cells containing immunoreactive estrogen
receptor-alpha in the human basal forebrain. Brain Res. 2000;856:142-51.
35. Fernandez-Guasti A, Kruijver FP, Fodor M et al. Sex differences in the distribution of
androgen receptors in the human hypothalamus. J Comp Neurol. 2000; 425: 422-35.
36. Azad N, Pitale S, Barnes WE et al. Testosterone treatment enhances regional brain perfusion
in hypogonadal men. J Clin Endocrinol Metab. 2003;88:3064-8.
37. Stoleru S, Gregoire MC, Gerard D et al. Neuroanatomical correlates of visually evoked
sexual arousal in human males. Arch Sex Behav. 1999;28:1-21.
38. Park K, Seo JJ, Kang HK et al. A new potential of blood oxygenation level dependent
(BOLD) functional MRI for evaluating cerebral centers of penile erection. Int J Impot Res. 2001;13:
73-81.
39. Arnow BA, Desmond JE, Banner LL et al. Brain activation and sexual arousal in healthy,
heterosexual males. Brain. 2002;125:1014-23.
40. Sachs BD. Contextual approaches to the physiology and classification of erectilefunction,
erectile dysfunction, and sexual arousal. Neurosci Biobehav Rev. 2000;24:541-60.
41. Anonymous. Effects of sexual activity on beard growth in man. Nature.1970;226: 869–70.
42. Fox CA, Ismail AA, Love DN et al. Studies on the relationship between plasma testosterone
levels and human sexual activity. J Endocrinol. 1972;52: 51-8.
43. Dabbs JM Jr, Mohammed S. Male and female salivary testosterone concentrations before
and after sexual activity. Physiol Behav. 1992;52:195-7.
44. LaFerla JJ, Anderson DL, Schalch DS. Psychoendocrine response to sexual arousal in
human males. Psychosom Med. 1978;40:166-72.
45. Raboch J, Starka L. Reported coital activity of men and levels of plasma testosterone. Arch
Sex Behav. 1973;2:309-15.
46. Stearns EL, Winter JS, Faiman C. Effects of coitus on gonadotropin, prolactin and sex
steroid levels in man. J Clin Endocrinol Metab. 1973;37: 687-91.
47. Lee PA, Jaffe RB, Midgley AR Jr. Lack of alteration of serum gonadotropins in men and
women following sexual intercourse. Am J Obstet Gynecol. 1974;120:985-7.
48. Kraemer HC, Becker HB, Brodie HK et al. Orgasmic frequency and plasma testosterone
levels in normal human males. Arch Sex Behav. 1976;5:125-32.
49. Brown WA, Monti PM, Corriveau DP. Serum testosterone and sexual activity and interest in
men. Arch Sex Behav. 1978;7:97-103.
50. Stoleru SG, Ennaji A, Cournot A et al. A LH pulsatile secretion and testosterone blood
levels are influenced by sexual arousal in human males Psychoneuroendocrinology. 1993;18:20518.
51. Jannini EA, Screponi E, Carosa E et al. Lack of sexual activity from erectile dysfunction is
associated with a reversible reduction in serum testosterone. Int J Androl. 1999;22:385-92.
52. Carosa E, Benvenga S, Trimarchi F et al. Sexual inactivity results in reversible reduction of
LH bioavailability. Int J Impot Res. 2002;14:93-9.
53. Carosa E, Martini P, Brandetti F et al. Type V phosphodiesterase inhibitor treatments for
erectile dysfunction increase testosterone levels. Clin Endocrinol (Oxf). 2004;61:382-6.
54. Petrone L, Mannucci E, Corona G, Bartolini M, Forti G, Giommi R, Maggi M. Structured
interview on erectile dysfunction (SIEDY): a new, multidimensional instrument for quantification
of pathogenetic issues on erectile dysfunction. Int J Impot Res. 2003;15:210-20.
LEGENDE DELLE FIGURE
Figura 1. Sintesi e azione del testosterone nel maschio. Le frecce verdi rappresentano le vie
stimolatorie, le frecce rosse quelle inibitorie. SHBG: globulina legante gli ormoni sessuali (“sex
hormon binding globulin”); ER: recettore per gli estrogeni; 5R 1 & 2: 5 reduttasi tipo 1 e 5
reduttasi tipo 2.
Figura 2. Caratteristiche dell‟ipogonadismo maschile in funzione dell‟età di insorgenza della
patologia e del fenotipo del paziente E‟ mostrata anche una schematica incidenza
dell‟ipogonadismo nella popolazione maschile. La superficie dell‟ellisse riflette sulle ascisse (scala
logaritmica): età di insorgenza della patologia, e sull‟ ordinata (scala logaritmica): incidenza (a
destra) e fenotipo, variabile da femminile a maschile (a sinistra, indici arbitrari di virilizzazione) del
soggetto ipogonadico.VEOH: ipogonadismo a insorgenza molto precoce (“very early onset
hypogonadism”), es. ad esordio durante la vita fetale per deficit di sintesi o azione del testosterone
(es. ipoplasia delle cellule di Leydig di tipo 2, insensibilità totale agli androgeni o deficit di 17betaidrossisteroidodeidrogenasi, ellissi gialla) o deficit di secrezione o attività del GnRH (per le cause
vedere la Tabella 1, ellissi rossa). EOH: ipogonadismo a insorgenza precoce (“early onset
hypogonadism”), es. ad insorgenza nel periodo peri-puberale (es. S. di Klinefelter, ellissi blu).
LOH: ipogonadismo a insorgenza tardiva (“late onset hypogonadism”), es. nell‟età adulta o anziana
(definita anche andropausa, ellisse grigia). Adattata dalla ref. n. 4.
Figura 3. Livelli plasmatici di testosterone in 2218 pazienti con disturbo della sessualità afferenti
all‟Unità di Andrologia dell‟Università di Firenze. I parametri in ascissa sono stati valutati
attraverso l‟intervista strutturata SIEDY e la sua Appendice A (ref. n. 54): A) Desiderio sessuale
ipoattivo: no: il desiderio sessuale del paziente è invariato o aumentato; lieve: il desiderio sessuale è
moderatamente ridotto, ma in meno del 50% delle occasioni; moderato: il desiderio sessuale è
ridotto in più del 50% delle occasioni; grave: il paziente riferisce la totale assenza di desiderio
sessuale. B) Assenza di erezione durante un rapporto sessuale: no= < 25%, lieve= 26-50%,
moderato= 51-75% e severo= >75% delle occasioni). C) Riduzione nel numero delle erezioni
notturne: no: il paziente riferisce la presenza di erezioni spontanee notturne/al risveglio, lieve: le
erezioni notturne sono presenti, ma la loro frequenza è inferiore rispetto a quanto osservato
precedentemente; moderata: la frequenza delle erezioni notturne è ridotta di almeno il 50%; grave:
completa assenza di erezioni notturne. D) Frequenza di rapporti sessuali mensili. E) Frequenza di
masturbazione mensile. * p<0.01, **p<0.005, ***p<0.001, ****p<0.0001 vs. il primo punto.
Estratto da ref. n. 4 e 13 e osservazioni non pubblicate. TT= testosterone totale.
Recettore
androgenico
Ipofisi
Testosterone
Testicolo
Figura 1
Estrogeni
Completa
virilizzazione
Virilizzazione
Incidenza
Completa
femminilizzazione
Età (anni)
Figura 2
No Lieve Moderato Severo
Desiderio sessuale ipoattivo
No Lieve Moderato Severo
Perdita delle erezioni
correlate all’attività sessuale
Rapporti sessuali/mese
Figura 3
No Lieve Moderato Severo
Perdita delle erezioni
notturne
Masturbazione/mese
I.
TABELLA 1. Eziologia dell’ipogonadismo maschile
1) Deficit di produzione del testosterone
a) Patologie ipotalamiche ( gonadotropine, testosterone)
- Congenite
I)
Sindrome di Kallmann (include le mutazioni di KAL 1, FGFR1, PROK2,
PROKR2)
II)
Delezione del gene del GnRH
III) Mutazione della leptina e del recettore della leptina
IV) Mutazione di GPR-54
V) Mutazione del proormone convertasi 1
VI) Mutazione di DAX-1
VII) Mutazione di SF-1
VIII) Displasia setto-ottica (include la mutazione di Hesx-1)
II.
IX) Sindrome di Prader-Willi
III.
X) Sindrome di Laurence-Moon
IV.
XI) Sindrome di Bardet-Biedl
- Acquisite
I) Tumori ipotalamici
- Germinomi e altri tumori delle cellule germinali
- Gliomi
- Astrocitomi
- Craniofaringiomi
- Meningiomi
- Metastasi
II) Affezioni infiltrative and infettive
- Istiocitosi di Langerhans
- Sarcoidosi e tuberculosi, sifilide
- Encefalite
III) Trauma cranico
IV) Idiopatico
V) Disordini funzionali
- Iperprolattinemia (prolattinoma, ipotiroidismo, indotta da farmaci antidopaminergici
e serotoninergi, indotta da oppiacei)
- Fattizia
- Patologie severe/acute
- Esercizio strenuo (raro)
- Diabete mellito
- Sindrome metabolica
- Sindrome di Cushing
VI) Farmaci
- Estrogeni
- Steroidi anabolizzanti
- Progestinici (includono il ciproterone acetato)
b) Patologie ipofisarie ( gonadotropine, testosterone)
- Congenite
I) Deficit ormonale multiplo (include mutazioni di Prop1, LHX3, DAX-1)
II) Mutazioni del GnRHR
III) Mutazioni di FSH e LH
IV) Aplasia o ipoplasia ipofisaria
V) Emocromatosi
- Acquisite
I) Tumori ipofisari
- Adenomi funzionanti e non-funzionanti
- Craniofaringiomi
- Metastasi
- Tumori ematologici maligni
- Cisti di Rathke
II) Infiltrative
- Ipofisite primitiva
- Sarcoidosi e tuberculosi, sifilide
- Miceti, parassiti, virus
III) Trauma cranico
IV) Sella vuota
V) Vascolare
VI) Farmaci
- Analoghi del GnRH (agonisti e antagonisti)
- Estrogeni
- Steroidi anabolizzanti
- Progestinici (includono il ciproterone acetato e lo spironolattone)
VII) Radiazioni ionizzanti
c) Patologie testicolari ( gonadotropine ± testosterone)
- Congenite
I.
Sindrome di Klinefelter
II.
Deficit nella biosintesi del testosterone (STAR, 20-22 desmolasi, 3-HSD, 17HSD, 17-20 desmolasi,17-HSD)
III.
Disgenesia gonadica pura (46 XX e 46 XY)
IV.
Anorchia congenita
V.
Ipoplasia delle cellule di Leydig (includono il tipo I e II per mutazioni del
recettore dell‟LH/HCG)
VI.
Distrofia miotonica (include il tipo I e II)
VII.
Criptorchidismo (include mutazioni di INSL3 e LGR8)
VIII.
Aplasia germinale (Sindrome di Del Castillo, sindrome a sole cellule di Sertoli)
IX.
Microdelezioni del cromosoma Y
X.
Traslocazioni autosomiche
XI.
Mutazioni di FSHR
XII.
Adrenoleucodistrofia
- Acquisite
I) Orchite (include patologie autoimmuni)
II) Chemioterapia
- Agenti alchilanti
- Metotraxato
III) Inibitori della sintesi del testosterone
- Ketoconazolo
- Aminoglutetimide
- Mitotane
- Metirapone
IV) Irradiazione testicolare
V) Torsione testicolare bilaterale
VI) Varicocele
VII) Trauma testicolare bilaterale
VIII) Patologie croniche (incluse insufficienza renale, cirrosi epatica, diabete mellito)
2) Deficit della bioattività del testosterone ( gonadotropine,
testosterone)
- Congenite
I) Deficit dell‟aromatasi
II) Deficit della 5 reduttasi di tipo II
III) Alterazioni del recettore androgenico
- Sindromi da insensibilità totale gli androgeni
- Sindromi da insensibilità parziale gli androgeni
- Sindrome di Kennedy e altre sindromi con ripetizioni delle triplette CAG
-Acquisite
I) Blocco del recettore androgenico farmaco-indotto
- Antiandrogeni steroidei (ciproterone acetato, spironolattone)
- Antiandrogeni non-steroidei (flutamide, bicalutamide, nilutamide)
II) Blocco dell’attività 5 reduttasica farmaco-indotta
- Finasteride (tipo II)
- Dutasteride (tipo I e II)
III) Blocco del recettore estrogenico farmaco-indotto
- Clomifene, tamoxifene, raloxifene
IV) Blocco dell’attività aromatasica farmaco-indotta
- Letrozolo, anastrazolo, exemestano
V) Livelli aumentati di SHBG (Sex Hormone Binding Globulin)
- Farmaco indotta (antiepilettici, estrogeni, ormoni tiroidei)
- Ipertiroidismo
- Patologie epatiche
- Invecchiamento
Tabella 1. Eziologia dell’ipogonadismo maschile. Il pattern ormonale specifico è specificato tra
parentesi. E‟ da notare che le condizioni riportate in italico sono caratterizzate soltanto da un deficit
di produzione di spermatozoi e non da una alterata sintesi e/o attività del testosterone. KAL-1:
anosmina o proteina di Kallmann; FGFR-1: recettore del fattore di crescita dei fibroblasti di tipo 1
(fibroblastic growth factor receptor-1); PROK-2: prokineticina di tipo 2 (prokineticin-2); PROKR2: recettore della prokineticina di tipo 2 (prokineticin-2 receptor), GnRH: ormone di rilascio delle
gonadotropine (gonadotrophin releasing hormone); GPR-54: recettore 54 accoppiato alla proteina G
(G-protein-coupled receptor-54); DAX-1: gene 1 della regione critica sul cromosoma 1
dell‟ipoplasia surrenale congenita e dell‟inversione sessuale sensibile al dosaggio (dosage-sensitive
sex reversal congenital adrenal hypoplasia critical region on the X chromosome-1); SF-1: fattore
steroidogenico di tipo 1 (steroidogenic factor-1); HESX1: HESX homeobox 1; PROP-1: profeta di
Pit1 (prophet of Pit1, paired-like homeodomain transcription factor); LHSX-3: LIM homeobox 3;
GnRHR: recettore dell‟ormone di rilascio delle gonadotropine (gonadotrophin releasing hormone
receptor); FSH: subunità dell‟ormone follicolo-stimolante (follicle-stimulating hormone subunit); LH: subunità dell‟ormone luteinizzante (luteinizing hormone -subunit); STAR:
proteina di regolazione acuta della steroidogenesi (steroidogenic acute regulatory protein); 3-HSD:
3--idrossisteroidodeidrogenasi
(3--hydroxysteroid
dehydrogenase);
17-HSD:
17-idrossisteroidodeidrogenasi
(17--hydroxysteroid
dehydrogenase);
17-HSD:
17-idrossisteroidodeidrogenasi (17--hydroxysteroid dehydrogenase); INSL3: peptide simile
all‟insulina di tipo 3 (insulin like-3 peptide); LGR8: recettore 8 accoppiato alla proteina G,
contenente ripetizioni ricche di leucina, o recettore del peptide simile all‟insulina di tipo 3 (leucinerich repeat-containing, G protein-coupled receptor-8, o insulin like-3 peptide receptor); FSHR:
recettore dell‟ormone follicolo-stimolante (follicle-stimulating hormone receptor).
IL LIQUIDO SEMINALE
PAOLA PIOMBONI*#, FRANCESCA SERAFINI°#, LAURA GAMBERA°#
*Dip. di Chirurgia, Sezione Biologia, Università di Siena; °Dip. Pediatria, Ostetricia e medicina della Riproduzione, Università di
Siena; °#Centro per la Diagnosi e la Terapia della Sterilità di Coppia, Azienda Ospedaliera Universitaria Senese.
Il potenziale fecondante di un individuo dipende principalmente dalle caratteristiche del liquido
seminale. Per tutto l’arco della vita, numerosi fattori possono influenzare negativamente la capacità
riproduttiva di un uomo, determinando situazioni di infertilità transitorie o definitive . Errati stili di
vita o fattori ambientali possono determinare una riduzione della produzione spermatica e, di
conseguenza, della fertilità. Diverse patologie del tratto riproduttore maschile, come il
criptorchidismo, l’orchite ed il varicocele influiscono negativamente sulla struttura e sulla funzione del
testicolo stesso. Anche le infezioni del tratto riproduttivo maschile (epididimiti, prostatiti, etc.)
rappresentano un fattore di rischio importante così come traumi, torsioni, squilibri ormonali o malattie
sistemiche quali il diabete mellito, le epatopatie, le nefropatie, etc. Infine, nel 15% dei casi, alterazioni
cromosomiche o mutazioni di singoli geni possono essere responsabili dell’infertilità. In tutti questi casi,
è necessario valutare la qualità degli spermatozoi mediante l’analisi dei principali parametri quali
concentrazione, motilità e morfologia, riferiti a specifici valori di normalità. Tuttavia “normalità” non
implica necessariamente “fertilità”, dal momento che molte delle caratteristiche funzionali che
contribuiscono a definire la fertilità non sono del tutto note. Per questo si possono avere gravidanze
con liquidi seminali definiti “patologici”, e non averne con altri classificati come “normali”. Si deve poi
aggiungere il contributo della componente femminile alla fertilità di coppia: una partner con un elevato
potenziale di fertilità, infatti, può compensare deficit seminali considerevoli.
L’analisi del liquido seminale è in ogni caso il punto di partenza per una valutazione della fertilità
maschile e deve essere eseguita in strutture specializzate, in cui il personale, con una adeguata
preparazione in questo settore, sia in grado di interpretare esattamente i parametri seminali
fondamentali.
L’eiaculato è la risultante di componenti distinte, provenienti dal testicolo, dalle vie seminali e dalle
ghiandole annesse. Funzionalmente, le diverse componenti costituiscono un insieme il cui significato
biologico è quello di rendere lo spermatozoo capace di fecondare. L’eiaculato normalmente viene emesso
in quattro frazioni differenti: 1) la frazione pre-eiaculatoria, prodotta dalle ghiandole di Cowper e
Littrè, non presenta spermatozoi; 2) la frazione iniziale, di produzione prostatica, anch’essa non
contiene spermatozoi, rappresenta il 13-33% del volume dell’eiaculato, ha pH acido per l’elevata
concentrazione di fosfatasi acida e di acido citrico. 3) la frazione più ricca di spermatozoi proviene
dall’epididimo, dal deferente e dall’ampolla deferenziale. 4) la frazione terminale, la più abbondante,
rappresenta il 50-80% dell’eiaculato. È prodotta dalle vescicole seminali, perciò è ricca in fruttosio, ha
reazione alcalina e contiene spermatozoi prevalentemente immobili.
Il campione seminale deve essere raccolto, preferibilmente per masturbazione, dopo un periodo di
astinenza sessuale compreso tra 48 ore e 6 giorni . Dopo 30 minuti dalla raccolta, si esegue l’esame
macroscopico che consiste nella valutazione dell’aspetto, liquefazione, viscosità, volume e pH.
Successivamente si esegue l’osservazione microscopica che prevede la valutazione della concentrazione
e della motilità degli spermatozoi, della presenza di zone di agglutinazione tra spermatozoi, e
l’identificazione di altri tipi cellulari eventualmente presenti nell’eiaculato, quali cellule germinali
immature, leucociti e cellule epiteliali.
Un campione seminale in cui non si riscontrano spermatozoi si definisce azoospermico; se gli
spermatozoi sono evidenziabili solo dopo centrifugazione si parla di criptozoospermia. Il termine
oligozoospermia indica una concentrazione spermatica <20 milioni/mL, normozoospermia si riferisce ad
un numero compreso tra 20 e 250 milioni di spermatozoi/mL mentre polizoospermia si riferisce a
campioni di seme che presentano un numero >250 milioni/mL. La concentrazione spermatica è un
parametro fisiologicamente variabile ed alcuni fattori esogeni possono ridurla temporaneamente.
Quindi, qualsiasi parametro di valutazione del liquido seminale è da riferirsi esclusivamente al momento
in cui si esegue l’analisi stessa e nessuno ha valore definitivo, ma deve essere confermato da almeno due
esami eseguiti a distanza di 7-30 giorni.
I leucociti si riscontrano in quasi tutti gli eiaculati ed il tipo più comune è il granulocita neutrofilo.
L’elevata concentrazione di leucociti, nota come leucospermia, può indicare la presenza di una infezione
del tratto riproduttivo e può associarsi a riduzione del volume dell’eiaculato, della concentrazione e
della motilità degli spermatozoi, e ad alterazioni della funzionalità degli spermatozoi, conseguenti allo
stress ossidativo o all’azione citotossica delle citochine.
Talora è possibile osservare la presenza di zone di agglutinazione tra spermatozoi mobili; questo
fenomeno può essere correlato ad una infertilità immunologica che tuttavia deve essere identificata
mediante test specifici.
La motilità dello spermatozoo costituisce uno dei parametri qualitativi fondamentali nell’esame del
liquido seminale. Essa dipende sia da caratteristiche intrinseche allo spermatozoo (struttura del
flagello, attività enzimatica della dineina), sia da fattori estrinseci (composizione biochimica del mezzo
extracellulare in cui si trova lo spermatozoo: plasma seminale, muco cervicale, etc.). Con il termine
“motilità” si indicano fondamentalmente due concetti differenti: la motilità lineare progressiva e la
percentuale generale di spermatozoi dotati di movimento. La valutazione quantitativa della motilità
viene espressa come percentuale totale di spermatozoi mobili, mentre l’aspetto qualitativo, inteso come
tipo di velocità e direzione degli spermatozoi mobili, viene espresso in percentuale suddiviso nelle
diverse categorie cinetiche. La motilità è classificata secondo quattro diverse categorie: motilità attiva
di grado 3 o di “tipo a” caratterizzata da un movimento d’avanzamento dello spermatozoo rapido,
rettilineo e quantitativamente più importante rispetto allo spostamento laterale; motilità attiva di
grado 2 o di “tipo b” caratterizzato da un movimento progressivo più lento e frequentemente non
rettilineo; motilità attiva di grado 1 o “tipo c” caratterizzato da un movimento d’avanzamento minimo o
addirittura assente (in situ); motilità di grado 0 o “tipo d” comprende solo spermatozoi immobili. L’OMS
definisce un campione seminale “normale” quando almeno il 50% degli spermatozoi è dotato di motilità
progressiva (tipo a + tipo b) o si rileva un 25% di “tipo a”, mentre definisce astenozoospermico un
campione di seme che presenta una motilità inferiore (1).
Nei casi in cui la percentuale degli spermatozoi immobili sia superiore al 50%, è opportuno eseguire la
valutazione della vitalità spermatica, espressa in percentuale, utilizzando tecniche di colorazione
sopravitale (ad es. eosina Y). Si definisce necrozoospermico un campione con una percentuale di cellule
morte maggiori del 50%; d’altra parte la presenza di un elevato numero di elementi immobili vitali può
essere indicativa di difetti strutturali del flagello.
Per la valutazione della morfologia spermatica è necessario applicare criteri il più possibile rigidi, in
quanto la percentuale di spermatozoi morfologicamente normali è una delle variabili che meglio si
correla con la capacità fertilizzante di un eiaculato. La testa di uno spermatozoo normale deve
presentare una forma ovale, di lunghezza 4-5,5 μm e di larghezza 2,5-3,5 μm. La regione acrosomiale
ben definita occupa un’area tra il 40 e il 70% della testa. Non devono evidenziarsi difetti del collo, del
segmento intermedio o principale del flagello. Per valutare con accuratezza la percentuale di
spermatozoi con morfologia alterata, si devono contare un minimo di cento spermatozoi, ed definito
teratozoospermico un campione seminale che presenti una percentuale di spermatozoi
morfologicamente normale inferiore al 30% oppure, secondo il ristretto criterio di Kruger, una
percentuale di spermatozoi con anomalie superiore al 14% (1). Per analizzare le anomalie morfologiche si
utilizzano colorazioni specifiche e le più utilizzate sono Papanicolau modificata, Giemsa e BryanLeishman.
Un altro aspetto qualitativo importante da valutare è ad esempio la maturità nucleare, che può essere
evidenziata attraverso differenti metodi, quali il blu di anilina un colorante acido che colora di blu
intenso le teste degli spermatozoi immaturi legandosi agli istoni ricchi di lisina. La persistenza di
proteine nucleari ricche in lisina potrebbe indicare difetti di condensazione nucleare. Anche la
colorazione vitale con arancio di acridina è utilizzata per differenziare gli spermatozoi con cromatina
nucleare normale da quella anomala. In particolare, mediante questo test, possiamo distinguere gli
spermatozoi con DNA frammentato, a singola catena, da quelli normali.
Di fondamentale importanza, nei casi di infertilità, rimane comunque lo studio delle alterazioni
strutturali degli spermatozoi mediante microscopia elettronica. Con questa tecnica è stato possibile
dimostrare che due tipi di anomalie appaiono più gravi e frequenti: le alterazioni del complesso
acrosomiale e quelle dell’apparato assonemale. Entrambe queste strutture, in differenti modi, risultano
coinvolte nella motilità spermatica, nella capacità di riconoscere e penetrare nell’ovocita e nel processo
di fecondazione.
La manifestazione più estrema dei difetti acrosomiali è la totale assenza dell’acrosoma oppure la
presenza di un complesso acrosomiale di dimensioni fortemente ridotte, mentre per quanto riguarda
l’assonema, i casi più estremi comprendono l’agenesia del flagello o l’assenza totale dell’ assonema.
Poiché tali anomalie si riscontrano nell’intera popolazione spermatica di un individuo, si suppone che esse
abbiano un’origine genetica, che induce un difettoso assemblaggio dei componenti assonemali o di quelli
acrosomiali.
Anche gli altri componenti citoscheletrici assonemali, (ponti della guaina centrale, proiezioni, legami
radiali, legami periferici) e periassonemali, (guaina fibrosa, fibre accessorie, colonne striate) coinvolti
nella motilità spermatica, sono stati esaminati in microscopia elettronica a trasmissione nei pazienti
infertili ed è stato dimostrato essere affetti da una serie di alterazioni responsabili di una riduzione
della motilità o di una completa immotilità. Importanti e frequenti difetti riguardano la cromatina non
completamente condensata o in disfacimento, i mitocondri non organizzati a formare la guaina
mitocondriale e la membrana plasmatica che può risultare frammentata. Queste anomalie strutturali,
che si manifestano in percentuali variabili in una popolazione spermatica, sembrano manifestazioni
secondarie a situazioni patologiche più generali e non sembrano correlate a specifiche mutazioni
geniche. Con questo tipo di approccio è stato possibile caratterizzare le anomalie strutturali degli
spermatozoi di soggetti infertili con grave teratospermia associata a specifiche patologie andrologiche
quali varicocele (2), criptorchidismo (3) e infezioni (4). Le caratteristiche ultrastrutturali dei singoli
organelli spermatici, in particolare quelle acrosomiali e nucleari, possono influire significativamente
sull’esito delle tecniche di procreazione assistita (5, 6, 7). Inoltre, specifiche anomalie della forma del
nucleo e dello stato della cromatina possono rivelare la presenza di apoptosi, un’affezione
estremamente frequente negli spermatozoi degli uomini infertili ed evidentemente implicata nel
fallimento della riproduzione assistita. Questa patologia è caratterizzata da frammentazione del DNA
che può essere dimostrata mediante marcatura delle estremità libere del DNA (tecnica TUNEL).
Per una completa valutazione della qualità degli spermatozoi oltre all’analisi morfologica e funzionale
può essere opportuno esaminare la presenza di eventuali anomalie della segregazione cromosomica
mediante FISH (Fluorescence In Situ Hibridization), tecnica che consente di analizzare un elevato
numero di nuclei spermatici in tempi abbastanza brevi. L’analisi FISH in pazienti infertili affetti da
varicocele ha dimostrato che le frequenze delle disomie e delle diploidie sono generalmente più elevate
rispetto ai valori di riferimento, indicando un errato processo di segregazione meiotica (8). Nei
soggetti infertili con difetto genetico “displasia della guaina fibrosa” a carico del flagello spermatico la
FISH ha evidenziato una aumentata frequenza delle disomie e delle diploidie dei cromosomi 18, X, ed Y
(9), suggerendo che in presenza di gravi difetti assonemali non solo le strutture citoscheletriche del
flagello, ma anche il processo di segregazione meiotica risultano alterati. Anche in pazienti infertili con
inversione pericentrica del cromosoma 9, riarrangiamento cromosomico strutturale considerato un
polimorfismo, è stato dimostrato un incremento delle diploidie spermatiche associato ad anomalie dei
principali parametri seminali quali concentrazione, morfologia e motilità (10). Infine l’esame FISH
eseguito negli spermatozoi di uomini infertili prima e dopo 3 mesi di terapia con FSH ricombinante ha
evidenziato che il miglioramento della morfologia e motilità spermatica si accompagna ad una
diminuzione statisticamente significativa delle percentuali delle aneuploidie.
In conclusione, l’analisi del liquido seminale fornisce informazioni di base sul numero, sulla motilità e la
morfologia degli spermatozoi, parametri che talora non sono del tutto sufficienti per un corretto
inquadramento clinico. In alcuni casi è quindi opportuno approfondire l’indagine mediante analisi più
sofisticate, quali microscopia elettronica, valutazione della maturità nucleare e FISH, allo scopo di
individuare le cause delle alterazioni riscontrate ed eventualmente intervenire con una idonea terapia
per migliorare la qualità degli spermatozoi.
Referenze
1. World Health Organization, WHO laboratory manual for the examination of human semen and
semen-cervical mucus interaction, 4th ed, Cambridge: Cambridge University Press; 1999.
2. B. Baccetti, A.G. Burrini, S. Capitani et al., Studies on varicocele. 1. Submicroscopical and
endocrinological features. J Submicr Cytol Pathol (1991) 23: 659–65.
3. B. Baccetti, E. Bigliardi, M. Vegni-Talluri et al., The fine structure of the testis in the cryptorchid
man. In: J.R. Bierich and A. Giarola, Editors, Proc Serono Symposia, 25, Academy Press, New York
(1979), pp. 91–123.
4. B. Baccetti, A.G. Burrini, R. Bilenchi et al., Ultrastructural and biochemical alterations in human
spermatozoa and correlation of some of them with microbial infections. In: G. Spera and L. Gnessi,
Editors, Unexplained infertility: basic and clinical aspects, Raven Press (1989), pp. 139–148 Serono
Symposia 62 .
5. P. Piomboni, E. Strehler, S. Capitani et al., Submicroscopic mathematical evaluation of spermatozoa
in assisted reproduction. 2. In vitro fertilization (Notulae seminologicae 7). J Assisted Reprod and
Genetics (1996) 13: 635–46.
6. E. Strehler, S. Capitani, G. Collodel et al., Submicroscopic mathematical evaluation of spermatozoa in
assisted reproduction. I. Intracytoplasmic sperm injection (Notulae seminologicae 6). J Submicrosc
Cytol Pathol (1995) 27: 573–86.
7. E. Strehler, K. Sterzik, M. De Santo et al., Submicroscopic mathematical evaluation of spermatozoa
in assisted reproduction. 3. partial zona dissection (PZD) (Notulae Seminologicae 12). J Submicrosc
Cytol Pathol (1997) 29: 387–91.
8. Baccetti BM, Bruni E, Capitani S, Collodel G, Mancini S, Piomboni P, Moretti E. Studies on varicocele
III: ultrastructural sperm evaluation and 18, X and Y aneuploidies. J Androl. (2006) 27:94-101.
9. Baccetti B, Collodel G, Gambera L, Moretti E, Serafini F, Piomboni P. Fluorescence in situ
hybridization and molecular studies in infertile men with dysplasia of the fibrous sheath. Fertil Steril.
(2005) 84:123-29.
10. Collodel G, Moretti E, Capitani S, Piomboni P, Anichini C, Estenoz M, Baccetti B. TEM, FISH and
molecular studies in infertile men with pericentric inversion of chromosome 9. Andrologia (2006)
38:122-7.
Cause genetiche di infertilità maschile
Prof. C. Foresta
Le cause genetiche di infertilità hanno una prevalenza di circa il 15% negli uomini infertili e di
circa il 10% nelle donne infertili. Le alterazioni genetiche riscontrate sono sia alterazioni
cromosomiche che mutazioni di singoli geni. La selezione naturale impedisce molto spesso la
trasmissione di mutazioni che causano infertilità, ma tale meccanismo viene meno con
l‟utilizzazione delle tecniche di riproduzione assistita. Esiste pertanto il rischio di trasmissione di
difetti genetici nei figli, ed in effetti è stato ormai dimostrato che i figli nati da fecondazioni in vitro
presentano un aumentato rischio di malformazioni congenite ed alterazioni cromosomiche.
L‟identificazione di possibili fattori genetici è quindi pratica clinica e diagnostica di routine nel
management della coppia infertile e nella coppia candidata a tecniche di fecondazione assistita.
Alterazioni cromosomiche
La prevalenza delle alterazioni cromosomiche è elevata nei soggetti infertili e correla con la conta
spermatica. L‟incidenza generale delle aberrazioni cromosomiche nei maschi infertili è del 2-8%,
con una media del 5%. Questa frequenza arriva al 15% nei soggetti azoospermici. Le alterazioni dei
cromosomi sessuali sono le più frequenti, ma esiste anche tutta una serie di alterazioni di numero e
di struttura dei cromosomi autosomici. I dati più recenti della letteratura indicano che i figli nati da
ICSI hanno un maggior rischio di alterazioni dei cromosomi sessuali, con un rischio relativo di circa
3. La metà di queste alterazioni cromosomiche nei nati da fecondazioni assistite viene trasmessa dai
padri e l‟altra metà dalle madri.
L‟alterazione cromosomica più frequente è rappresentata dalla sindrome di Klinefelter, in
forma pura 47,XXY o in forma di mosaicismo (46,XY/47,XXY). La prevalenza della sindrome di
Klinefelter è molto elevata, circa il 5% nella gravi oligozoospermia e il 10% nelle azoospermie.
Altre alterazioni dei cromosomi sessuali includono il cariotipo 47,XYY, la sindrome del maschio
46,XX, le alterazioni strutturali del cromosoma Y e le traslocazioni Y-autosoma.
Le aberrazioni autosomiche comprendono le traslocazioni robertsoniane (soprattutto tra i
cromosomi 13;14 e 14;21) e le traslocazioni reciproche, che incidono entrambe per lo 0.5-1.0%
nell‟infertilità maschile.
È importante sottolineare che i soggetti che presentano alterazioni cromosomiche costitutive
determinate con l‟analisi del cariotipo producono un‟alta percentuale di spermatozoi con alterazioni
cromosomiche. Tali aneuploidie si possono determinare mediante analisi FISH degli spermatozoi
(vedi sopra).
Delezioni del cromosoma Y
Le microdelezioni del cromosoma Y (non visibili all‟analisi standard del cariotipo, ma solo con
metodiche di biologia molecolare) rappresentano la causa genetica molecolare più frequente di
infertilità maschile, con una prevalenza del 10-15% nelle azoospermie non ostruttive e gravi
oligozoospermie. Le microdelezioni possono comprendere tre regioni, AZFa, AZFb o AZFc.
Quest‟ultima rappresenta la regione che più frequentemente viene rimossa, comprendendo circa il
60% delle delezioni. La maggior parte dei pazienti con delezioni delle regioni AZFa e AZFb sono
azoospermici e non producono spermatozoi. Circa il 60% dei pazienti con delezione AZFc invece
presenta spermatozoi nel liquido seminale o nel testicolo. Tali soggetti sono quindi candidati a
tecniche di fecondazione assistita, ma hanno un‟alta probabilità di trasmettere delle anomalie
genetiche ai figli. Infatti gli spermatozoi di questi soggetti portano la stessa delezione del
cromosoma Y riscontrata nei linfociti periferici e quindi trasmettono la condizione di infertilità ai
figli maschi. Gli spermatozoi però hanno anche un‟aumentata incidenza di aneuploidie spermatiche
(vedi sopra) con conseguente rischio di trasmissione anche di alterazioni cromosomiche, come la
sindrome di Klinefelter o la sindrome di Turner.
Una delezione particolare scoperta di recente è quella che coinvolge solo una parte della
regione AZFc (delezioni parziali AZFc). In questo caso l‟effetto fenotipico è più lieve, potendo
risultare non soltanto in azoospermia o grave oligozoospermia, ma anche in oligozoospermia
moderata. Tali delezioni rappresentano quindi un fattore di rischio per l‟infertilità e possono essere
trasmesse mediante fecondazioni in vitro.
Mutazioni geniche
Diverse centinaia di geni regolano lo sviluppo sessuale, la determinazione del sesso e la
spermatogenesi. Negli ultimi anni è entrata a far parte della pratica clinica l‟analisi di alcuni di
questi geni importanti per l‟infertilità maschile, sia al fine di migliorare l‟impostazione diagnostica
che di offrire un‟accurata consulenza genetica pre-fecondazioni assistite.
Il gene CFTR causa la fibrosi cistica, che rappresenta la malattia autosomica più frequente
nei paesi occidentali. In questi paesi la frequenza dei portatori sani è molto elevata (1/25).
Attualmente sono state dimostrate oltre 900 mutazioni in questo gene: tra le mutazioni che causano
fibrosi cistica l‟80% è rappresentata dalla delezione di tre paia di basi F508. Più del 95% dei
soggetti con fibrosi cistica presenta un‟azoospermia ostruttiva ed il 60-70% dei soggetti con assenza
bilaterale di vasi deferenti (CBAVD) senza sintomi di fibrosi cistica ha un amutazione del gene
CFTR. La prevalenza di mutazioni nei soggetti infertili non selezionati è più bassa, di circa il 5%. I
soggetti con infertilità di mutazione del gene CFTR sono candidati a fecondazione assistita con
recupero di spermatozoi dal testicolo o dall‟epididimo. Vista la gravità della malattia fibrosi cistica,
l‟alta incidenza di portatori sani nella popolazione generale e l‟alta prevalenza di mutazione nei
soggetti infertili, è ormai diventata pratica clinica comune lo screening per mutazioni del gene
CFTR almeno in uno dei due componenti la coppia in previsione di tecniche di riproduzione
assistita.
Il gene per il recettore degli androgeni (AR) è localizzato sul cromosoma X e media l‟azione
del testosterone e del DHT. Mutazioni di questo gene causano una alterata funzione del recettore
androgenico con conseguente sindrome da insensibilità agli androgeni (AIS) di vario grado. I
pazienti con mutazioni gravi dell‟AR presentano una AIS completa con fenotipo femminile.
Mutazioni più lievi invece causano una AIS moderata il cui unico segno può essere rappresentato
dall‟infertilità maschile da danno alla spermatogenesi. Nei soggetti infertili infatti la prevalenza
delle mutazioni del gene AR è del 2-3%. Anche questi soggetti, presentando quindi una
azoospermia o grave oligozoospermia, sono candidati a tecniche di fecondazioni assistita. Il rischio
di trasmissione è limitato alle figlie femmine, che diventano pertanto portatrici della mutazione e
potranno trasmettere ai loro figli la medesima mutazione e quindi la stessa patologia di loro padre.
Il gene INSL3 regola la discesa del testicolo durante la vita fetale agendo sul gubernaculum
per mezzo del suo specifico recettore LGR8. Negli ultimi anni diversi studi hanno individuato
mutazioni dei geni INSL3-LGR8 nei soggetti criptorchidi o ex-criptorchidi, con una prevalenza del
4-5%. Molto spesso questi soggetti presentano anche una infertilità da testicolopatia primaria come
conseguenza del criptorchidismo. Tuttavia studi recenti sembrerebbero indicare un ruolo del sistema
INSL3-LGR8 anche nella spermatogenesi e mutazioni di questi geni sono stati ricontrati nei
soggetti con infertilità idiopatica o con tumore del testicolo.
Fisiopatologia dell’ipofisi
F.Mantero e E.Zulian
U.O. Endocrinologia,Dipartimento di Scienze Mediche e Chirurgiche,
Università di Padova
FISIOLOGIA IPOFISARIA:
l‟ipofisi puo‟ essere considerata la piu‟ importante ghiandola endocrina,in quanto controlla e regola la
secrezione della maggior parte delle altre ghiandole a secrezione interna.Essa è a sua volta al centro di un
complesso sistema di regolazione,sia da parte di strutture superiori(ipotalamo e strutture corticali-releasing
hormones e neurotrasmettitori) sia da parte di ormoni periferici tramite meccanismi di feed-back a vari
livelli.
Un quadro schematico riassuntivo dei vari assi ipotalamo-ipofisi-ghiandole bersaglio è illustrato nella
figura allegata.
)
FISIOPATOLOGIA DELL’ADENO- E DELLA NEUROIPOFISI
L’adenoipofisi può essere sede di patologie neoplastiche primarie o, più raramente, di metastasi di tumori a
diversa localizzazione. I tumori ipofisari primari sono per lo più adenomi e solo eccezionalmente sono
descritti carcinomi. In rapporto alle dimensioni gli adenomi ipofisari vengono suddivisi in microadenomi(con
diametro < 10 mm) e macroadenomi(con diametro >10 mm). Gli adenomi ipofisari vengono anche
classificati in base all’estensione (intrasellari ed extrasellari) e alla eventuale infiltrazione di strutture
circostanti quali dura, osso, seno cavernoso (non-invasivi ed invasivi).
La prevalenza dei tumori ipofisari nella popolazione generale è di circa 200 casi per milione di individui
(22). Tuttavia va rilevato che circa il 20% dei soggetti asintomatici che eseguono TAC o RMI per altra
ragione sono portatori di un adenoma ipofisario di diametro maggiore di 3 mm.
Questa alta prevalenza di microadenomi asintomatici è del tutto sovrapponibile ai dati autoptici.
Circa la metà degli adenomi ipofisari è costituita dai prolattinomi mentre i tumori non-funzionanti e quelli
secernenti GH rappresentano circa il 20-25% (Tabella 1).
Tabella 1: Frequenza degli adenomi ipofisari in rapporto alle loro caratteristiche secretive
PRL secernenti (PRL-omi) 40-50 %
non secernenti (NFPA) 20-25%
GH-secernenti (GH-omi)20-25 %
ACTH-secernenti (ACTH-omi) 8-10 %
gonadotropinomi (Gn-omi) 1-2 %
tireotropinomi (TSH-omi) 1-2 %
Per quanto riguarda i prolattinomi (40-50%dei tumori ipofisari), la loro prevalenza è stimata attorno a 60100 casi per milione. Va quindi sottolineato che solo in una minoranza dei casi l’ iperprolattinemia, che è
assai frequente essendo riscontrabile nel 25-30% delle donne con disordini del ciclo mestruale, è sostenuta
da prolattinomi; all’origine vi può essere un adenoma ipofisario clinicamente non funzionante, una lesione
ipotalamica (malformativa, neoplastica, metastatica, granulomatosa), lo stress, venipuntura,
l’iperprolattinemia può essere secondaria a cause fisiologiche (gravidanza), iatrogene (farmaci) o ad altre
patologie (ipotiroidismo, insufficienza renale, lesione della parete toracica), a stimolazione del capezzolo,
può essere idiopatica e talora può comparire nel quadro di MEN I. Mentre per i macroprolattinomi la
frequenza è uguale nei due sessi, i microPRL-omi sono circa 20 volte più frequenti nel sesso femminile.
L’iperprolattinemia si manifesta con alterazioni del ciclo mestruale e galattorrea nella femmina, deficit
erettile, ridotta libido e ginecomastia nel maschio, infertilità, difetti visivi, cefalea.
L‟acromegalia è una malattia rara (prevalenza di 40/70 casi per milione), che colpisce entrambi i sessi con
una lieve prevalenza di quello femminile (F/M: 4/1). L‟adenoma ipofisario GH secernente (macroadenoma
75%, microadenoma 25%) è la causa più frequente di acromegalia, e solo raramente sono stati descritti casi
sostenuti da una eccessiva produzione di GHRH da parte di tumori ipotalamici o ectopici (carcinoide
polmonare, pancreatico). Le caratteristiche cliniche dell‟acromegalia sono dovute agli effetti locali di
compressione intra o extra sellare sulle strutture circostanti e agli effetti diretti o indiretti della ipersecrezione
di GH e fattori di crescita ad esso correlati: la deformazione delle ossa facciali, la proliferazione ossea, la
tumefazione dei tessuti molli delle mani e dei piedipresentano uno sviluppo lento e insidioso, altre
caratteristiche cliniche sono iperidrosi, macroglossia, disturbi del campo visivo, oligomenorrea, impotenza,
ridotta tolleranza glucidica o diabete mellito, fibromi cutanei, ipertensione arteriosa e cardiomiopatia, gozzo,
osteoartrosi, sindrome del tunnel carpale, apnea del sonno e associazione con neoplasie.
Anche per gli adenomi ACTH secernenti è stata riscontrata una prevalenza del sesso femminile (F/M: 4/1),
con diagnosi soprattutto tra i 20 e i 40 anni di età. Gli adenomi ACTH secernenti (microadenomi 95%,
macroadenomi 5%) rappresentano il 60-70% della totalità degli ipercortisolismi e l’85 % degli ACTH
dipendenti (all’origine di un’ ipercortisolismo ACTH dipendente vi può essere anche l’iperplasia delle
cellule ipofisarie ACTH secernenti, la sindrome di Cushing da ACTH ectopico da tumore neuroendocrino—
carcinoide polmonare, pancreatico, timico, microcitoma polmonare, carcinoma midollare della tiroide,
feocromocitoma; la causa infine può essere occulta). Tra i sintomi di sospetto della sindrome di Cushing
ricordiamo: obesità centripeta, facies lunare, gibbo dorsale, accumulo del grasso in sede sovraclaveare,
aspetto caratteristico della cute (ipotrofica, ecchimosi, strie rubrae, acne, difficoltà di guarigione delle ferite),
ipotrofia muscolare, irsutismo, oligomenorrea, edemi, astenia, labilità emotiva, depressione, psicosi,
ipertensione arteriosa, intolleranza glucidica e diabete mellito, osteoporosi, trombofilia,
immunosoppressione.
L’inappropriata secrezione di TSH da adenoma ipofisario (macroadenoma 92%spesso invasivo,
microadenoma 8%) è un’evenienza rara che si manifesta con gozzo diffuso (95%), ipertiroidismo franco
(50%) con fT3 e fT4 elevato e TSH non soppresso, difetti visivi (40%), disturbi mestriali e galattorrea
Per quanto riguarda infine gli adenomi non funzionanti, la malatttia ha uguale frequenza nel maschio e nella
femmina. Per la mancanza di segni specifici, la diagnosi viene generalmente posta più tardivamente quando
l’adenoma è ad uno stadio di macroadenoma e sono già presenti segni legati all’espansione dell’adenoma.
Le manifestazioni cliniche comuni ai diversi tumori ipofisari sono quelle dovute alla presenza di una massa
endocranica occupante spazio e sono rappresentate da: cefalea (a sede retroorbitaria, frontotemporale, o al
vertice) dovuta alla pressione su strutture algogene meningee; alterazioni oculari sostenute da compressione
delle vie ottiche (con riduzione del campo visivo e possibile atrofia ottica) che sono assai frequenti nei
portatori di macroadenomi con espansione sovrasellare e costituiscono uno dei sintomi di presentazione più
comuni soprattutto negli adenomi non secernenti, o da compressione del III, IV e VI nervo cranico (con ptosi
palpebrale, strabismo, diplopia); idrocefalo nei tumori ad estensione sovrasellare con obliterazione dei
forami di Monroe (cefalea generalizzata, vomito, e sintomi ipotalamici quali diabete insipido, bulimia od
anoressia, sonnolenza od insonnia, disregolazione termica, disforia, torpore e disorientamento
temporospaziale); rinoliquorrea (rara) e ipopituitarismo (difetti uni o pluritropniici).
A questo quadro clinico comune, che si presenta nella sua complessità, soprattutto in presenza di
macroadenomi, si associano i quadri specifici delle sindromi da eccesso ormonale, quali l’acromegalia,
l’amenorrea-galattorrea, la sindrome di Cushing e l’ipetiroidismo da inappropriata
secrezione di TSH, dovuti alla ipersecrezione di specifiche tropine ipofisarie.
L‟ipopituitarismo è una condizione patologica caratterizzata da una secrezione scarsa o totalmente assente
di uno o più ormoni ipofisari. Può essere sia un evento primitivo, causato dalla distruzione dell‟ipofisi
anteriore che un fenomeno secondario dovuto a una mancanza di fattori ipotalamica stimolanti o inibenti
l‟ipofisi (tabella 2)
Tabella 2: Eziologia dell’ipopitutitarismo
Lesioni espansive SNC
Adenomi ipofisari (macroadenomi non secernenti per effetto massa sulle tropine ipofisarie, talora reversibile dopo la
rimozione della lesione, o secernenti sia per effetto massa nel caso di macroadenoma sia per effetto funzionale dei
microadenomi)
Lesioni ipotalamiche tumorali (craniofaringioma, disgerminoma, linfoma) o cerebrali
Lesioni ipotalamiche granulomatose (istiocitosi X, sarcoidosi, TBC , malattia di Wegener)
Apoplessia ipofisaria
Cisti della tasca di Rathke
Ipofisite
Metastasi cerebrali
Chirurgia ipofisaria/Neurochirurgia
Radioterapia
Ipofisaria
Ipotalamica
Ca. nasofaringeo
Trauma cranico/emorragia subaracnoidea
Malattie genetiche (mutazione di Prop-1 e Pit-1)
Idiopatica
Post partum (sindrome di Sheean)
Empty sella
Encefalopatia ischemica
Tali cause eziologiche coinvolgono generalmente più di una tropina ipofisaria ma esistono forme isolate
determinenti ipopituitarismo selettivo. La più frequente interessa le gonadotropine e si manifesta con deficit
dello sviluppo puberale. Le cause più frequenti di questo ipogonadismo ipogonadotropo (caratterizzato da
bassi livelli di LH, FSH e steroidi sessuali) dipendono da assenza funzionale della secrezione di GnRH da
parte dei neuroni ipotalamici (sdr di Kallmann associata ad anosmia) o da un difetto della sua azione per
mutazione di un recettore ipofisario. La condizione di ipogonadismo ipogonadotropo può essere anche di
tipo funzionale (psicogena, nutrizionale, dismetabolica).
L‟ipopituitarismo si manifesta con astenia, deficit della funzione sessuale (amenorrea, calo della potenza
sessuale), cefalea, difetti visivi o campimetrici ed è possibile l‟associazione con il diabete insipido.
Diabete insipido
E‟ un disordine che risulta dal deficit dell‟azione di ADH ed è caratterizzato dal passaggio di una gran
quantità di urina molto diluita. questo disordine deve essere distinto da altri stati poliurici come ad esempio
la polidipsia primaria e la diuresi osmotica. Il diabete insipido centrale (o neurogeno) è dovuto al deficit
dell‟ipofisi posteriore nel produrre adeguate quantità di ADH, il diabete insipido nefrogeno si ha quando il
rene non è in grado di rispondere all‟ADH circolante. La risultante incapacità del rene di concentrare porta
alla perdita di grandi quantità di urina diluita. Questo provoca disidratazione cellulare ed extracellulare che
stimolano la sete e causa la polidipsia.
Tabella 3. Classificazione:
Diabete insipido centrale o neurogenico
ipofisectomia, completa o parziale
chirurgia per la rimozione dei tumori soprasellari
idiomatica
familiare
tumori e cisti (intra e soprasellari)
istiocitosi
granulomi
infezioni
granulomi
infezioni
interruzione della perfusione
autoimmune
Diabete insipido nefrogenico
malattie renali croniche
ipokaliemia
mancata introduzione di proteine
ipercalcemia
anemia falciforme
sindrome di Siogren
farmaci (litio fluoro, demeclociclina, colchicina)
difetti congeniti
familiare
FISIOPATOLOGIA TIROIDEA: CASI CLINICI
Prof. F. Pacini
La tiroide è una ghiandola endocrina posta nella regione anteriore del collo al davanti e
lateralmente alla laringe ed ai primi anelli tracheali, il cui compito principale è quello di
produrre ormoni iodati. L’unità funzionale della tiroide è il follicolo tiroideo, costituito da un
singolo strato di cellule epiteliali (tireociti) che circonda il lume contenente una sostanza
vischiosa denominata “colloide”. La tireoglobulina (Tg) è il principale costituente proteico della
colloide ed è il precursore degli ormoni tiroidei. Gli ormoni tiroidei (tiroxina T4 e
triiodotironina T3 controllano importanti processi biologici quali, nella vita fetale lo sviluppo
del sistema nervoso centrale, nell’età evolutiva l’accrescimento corporeo e, nell’età adulta, la
regolazione di numerose funzioni metaboliche. La T4 è prodotta esclusivamente dalla ghiandola
tiroide, mentre solo il 20% della T3 circolante è direttamente secreto dalla tiroide e la quota
rimanente deriva dalla trasformazione periferica della T4 in T3.
Il costituente principale degli ormoni tiroidei è lo iodio che, assunto con gli alimenti,
viene incorporato nella tiroide dal circolo ematico. Affinché la tiroide possa sintetizzare e
secernere quantità sufficienti di ormoni è necessario che l’apporto iodico giornaliero sia
adeguato, ovvero che sia almeno uguale a 150 mg al giorno. La tiroide è infatti avida di iodio e
capta tutto lo iodio a disposizione in circolo, mediante un trasportatore tiroideo dello iodio
(sodium iodine symporter, NIS) che è presente sulla membrana basolaterale dei tireociti. Una
volta internalizzato nel tireocita, lo ione ioduro attraversa la cellula tiroidea e, raggiunta la
membrana apicale, viene esportato nel lume del follicolo. Nella colloide lo iodio viene
incorporato nei radicali tirosinici della Tg. Questo processo, denominato organificazione dello
iodio, è catalizzato dalla tireoperossidasi (TPO), un enzima sintetizzato dai tireociti ed espresso
sulla loro membrana apicale. Lo iodio viene così depositato come tiroxina o T4 (contenente
quattro molecole di iodio) o come triiodiotironina o T3 (contenente tre molecole di iodio),
nell’ambito della molecola di tireoglobulina. Il rilascio degli ormoni tiroidei da parte del tireocita
avviene mediante l’internalizzazione della Tg (endocitosi) contenuta nella colloide seguita dalla
degradazione lisosomiale della stessa e dal rilascio degli ormoni tiroidei dalla membrana
basolaterale dei tireocita nel circolo ematico.
Nel sangue gli ormoni tiroidei si trovano in gran parte legati alle proteine (Thyroxine
binding globulin TBG, la thyroxine binding pre-albumin TBPA e l’albumina) e solo lo 0.030.05% della T4 e lo 0.3-0.5% della T3 circolano in forma libera. La forma ritenuta attiva
dell’ormone è quella libera (FT3, FT4), pertanto la funzione tiroidea è più strettamente
correlata alla concentrazione di ormone circolante libero che legato. Gli ormoni tiroidei
esplicano i loro effetti prevalentemente attraverso il legame a recettori nucleari. Regolano
quindi l’espressione genica, promuovendo la trascrizione di acidi ribonucleici messaggeri
(mRNA) tessuto-superfici, il cui messaggio è tradotto in proteine con funzioni enzimatiche o
strutturali.
La sintesi e la secrezione degli ormoni tiroidei sono principalmente regolate dal TSH,
ormone sintetizzato e secreto a livello dell’ipofisi anteriore. Il TSH si lega ad uno specifico
recettore presente sulla membrana dei tireociti e induce la sintesi delle proteine coinvolte nella
produzione degli ormoni tiroidei nonché la crescita del tireocita e l’endocitosi della
tireoglobulina. La stimolazione del TSH determina pertanto l’aumento della sintesi e della
secrezione degli ormoni tiroidei circolanti. La produzione del TSH è a sua volta regolata dalla
concentrazione sierica degli ormoni tiroidei venendosi così a determinare un meccanismo di
regolazione a “feedback” negativo. L’alterazione di questo equilibrio porta a due opposte
condizioni patologiche, l’ipotiroidismo e l’ipertiroidismo.
In condizioni di ridotta produzione di ormoni tiroidei, mancando il meccanismo inibitorio
sulla secrezione del TSH, la sintesi e la secrezione di questo ormone aumentano nel tentativo
di compensare la ridotta produzione degli ormoni tiroidei. Pertanto nell’ipotiroidismo primitivo i
livelli sierici di TSH sono elevati mentre quelli degli ormoni tiroidei sono bassi (ipotiroidismo
franco) o normali (ipotiroidismo sub-clinico). Al contrario, l’eccesso degli ormoni tiroidei
determina la soppressione del TSH da parte dell’ipofisi. Ne consegue che nell’ipertiroidismo
primitivo il TSH sierico è indosabile mentre gli ormoni tiroidei sono elevati o normali
(ipertiroidismo sub-clinico).
La causa più frequente di ipotiroidismo primitivo è quella legata all’infiltrazione
linfocitaria della tiroide che si osserva nella tiroide autoimmune, oppure all’asportazione
chirurgica della tiroide o alla sua distruzione mediante iodio radioattivo. Un’altra causa di
ipotiroidismo primitivo è quella dovuta ad alterazioni genetiche delle proteine responsabili della
sintesi e della secrezione degli ormoni tiroidei. Ad esempio le alterazioni a carico del NIS
(proteina di trasporto dello iodio) sono responsabili di una ridotta captazione dello iodio da
parte dei tireociti con conseguente ridotta sintesi degli ormoni tiroidei. Un’alterazione a carico
della TPO (enzima responsabile della organificazione dello iodio) determina invece una ridotta
organificazione dello iodio che esita in una condizione di ipotiroidismo. In genere, in tali
condizioni, l’ipotiroidismo è accompagnato da gozzo (aumento di volume della tiroide). Tali
difetti molecolari sono comunque tra le cause più rare di ipotiroidismo, così come lo sono i
difetti di secrezione del TSH (ipotiroidismo centrale).
Una severa carenza alimentare di iodio può essere responsabile di un fenotipo simile a
quello che si osserva nei difetti molecolari. Essendo lo iodio il costituente principale degli
ormoni tiroidei, un suo ridotto apporto alimentare comporta una ridotta produzione degli
ormoni tiroidei con secrezione compensatoria di TSH. Permanendo la carenza iodica, il continuo
stimolo esercitato dal TSH è responsabile di alterazioni organiche a carico della ghiandola
tiroidea quali l’ipertrofia e l’iperplasia delle cellule follicolari tiroidee con conseguente
ingrandimento della ghiandola stessa. Inizialmente si tratta di un ingrandimento diffuso che,
tuttavia, nel corso degli anni, può evolvere verso la forma nodulare e successivamente portare
ad un quadro di ipertiroidismo da gozzo nodulare tossico.
Nelle aree a normale apporto iodico, la causa più frequente di ipertiroidismo è invece
quella autoimmune (morbo di Basedow). Il meccanismo patogenetico che sta alla base di
questa forma di ipertiroidismo è la presenza di anticorpi rivolti contro il recettore del TSH
(Trab). Tali anticorpi sono in grado di legare e attivare il recettore stesso stimolando così la
crescita tiroidea e la produzione di ormoni da parte della tiroide. L’unica alterazione molecolare
in grado di determinare ipertiroidismo è rappresentata dalle mutazioni attivanti il recettore del
TSH che sono responsabili dell’ipertiroidismo che si osserva nel gozzo nodulare tossico e
nell’adenoma tossico, due condizioni frequenti in aree geografiche di grave carenza iodica.
Anche alcuni farmaci contenenti iodio (amiodarone) o mezzi di contrasto iodato possono
determinare un aumento della sintesi o della secrezione degli ormoni tiroidei con vari
meccanismi. Raramente l’ipertiroidismo è dovuto ad aumentata secrezione di TSH
(ipertiroidismo secondario o centrale).
FISIOPATOLOGIA DEGLI IPERANDROGENISMI
Antonio Cianci, Marco Farina.
Dipartimento di Scienze Microbiologiche e Scienze Ginecologiche – Sezione di Ginecologia –
Università degli Studi di Catania, C/o Ospedale Santo Bambino, Catania.
_______________
Gli androgeni costituiscono una componente fisiologica indispensabile per gli organismi di sesso
femminile, rappresentando i principali precursori degli estrogeni e partecipando direttamente al
determinismo dei caratteri sessuali secondari ed alla genesi dell‟identità e del comportamento
sessuale. Esercitando numerosi ed importanti effetti metabolici, intervengono, inoltre, nella
regolazione di svariate funzioni a carico dell‟organismo femminile.
Un'adeguata e bilanciata produzione ovarica e surrenalica di questa frazione ormonale risulta
essenziale per l‟espletamento e la modulazione di importanti funzioni fisiologiche quali:
1) il mantenimento e la regolazione dei normali processi steroidogenetici, come precursori
fondamentali per la produzione globale degli steroidi sessuali;
2) l‟induzione del processo di atresia follicolare successiva alla selezione del follicolo
dominante;
3) il trofismo di alcuni tessuti (in particolar modo il tessuto cutaneo, osseo e muscolare);
4) la modulazione della libido e della procettività sessuale, in sinergia con i fattori psicoemotivi e socio-comportamentali.
Una condizione di iperandrogenismo, tuttavia, conseguente ad un eccesso della quota steroidea o
ad un incremento della sua attività biologica, può determinare conseguenze negative alquanto
rilevanti, che, il più delle volte, vanno ben oltre gli aspetti estetici investendo, accanto alla funzione
riproduttiva, anche la sfera psichica ed i rapporti interpersonali. Non meno importanti appaiono le
ripercussioni a carico dell‟assetto metabolico e, in epoche successive della vita, del rischio
cardiovascolare.
Tale evenienza appare ancora più importante in considerazione del fatto che ben il 10% delle
donne in età adolescenziale presenta disturbi riconducibili ad un‟eccessiva azione androgenica,
anche se i valori di prevalenza possono essere assai diversi a seconda dei criteri diagnostici
utilizzati.
Con il termine di iperandrogenismi si definiscono tutte quelle condizioni clinico-patologiche
caratterizzate dalla presenza di livelli circolanti sovrafisiologici di steroidi androgenici e/o
l‟aumentata sensibilità recettoriale nei loro confronti, a carico dei tessuti target, con conseguente
esaltazione dell‟effetto biologico terminale. (1) Si identificano, invece, con stati di
iperandrogenismo le condizioni patologiche, ad eziologia multifattoriale, caratterizzate da:
1) abnorme crescita pilifera in zone cutanee normalmente glabre e/o con pochi follicoli piliferi
(viso, torace, addome, glutei, linea alba, ecc.) nonché aumentata velocità di accrescimento
delle strutture pilifere; (2)
2) aumentata produzione sebacea a livello cutaneo (in zone normalmente ricche di ghiandole
sebacee) (3) ed a livello del cuoio capelluto;
3) alopecia; (4)
4) gradi variabili di insulino-resistenza e/o iperinsulinemia; (5)
5) riduzione dei livelli di colesterolo HDL, e modifica del suo rapporto con il colesterolo
totale;
6) Sovvertimento dei regolari processi di follicologenesi ovarica, con aumentata atresia
follicolare e fallita selezione e dominanza del follicolo pre-ovulatorio; incremento dello
stroma ovarico, ispessimento dell‟albuginea e formazione di microcisti follicolari. (6)
Escludendo l‟eziologia neoplastica e iatrogena, le cause cosiddette funzionali di
iperandrogenismo si caratterizzano, generalmente, per un‟eziopatogenesi multifattoriale. (Tab. 1)
La Sindrome dell’ovaio policistico (PCOS) rappresenta, indubbiamente, la causa più frequente di
iperandrogenismo in epoca postpuberale. Questa complessa disendocrinia, che presenta caratteri di
cronicità ed automantenimento, si caratterizza per un profondo sovvertimento dei principali
meccanismi di feed-back intra- ed extra-ovarici, manifestandosi con una grande variabilità clinica,
endocrino-metabolica e morfologica.
Fra tutte le cause di iperandrogenismo, risulta essere la più importante sotto il profilo
eziopatogenetico e prognostico, associandosi, con elevata frequenza, a dismetabolismi caratteristici,
quali dislipidemia (bassi livelli di colesterolo HDL, alterato rapporto colesterolo totale/colesterolo),
ridotta tolleranza ai carboidrati, insulino-resistenza, sovrappeso ed obesità.
A tal proposito l‟obesità si associa frequentemente ad una condizione clinica di
iperandrogenismo. Il tessuto adiposo è infatti implicato nel metabolismo di una grande quantità di
colesterolo che in parte viene convertito in androgeni. Con l'aumento ponderale si assiste ad
un‟aumentata resistenza all'azione dell'insulina che partecipa all'iperandrogenismo condizionando la
funzione di aromatizzazione degli androgeni ed il rilascio delle gonadotropine.
È ben nota anche l'azione di facilitazione all'iperandrogenismo indotta dalla prolattina (PRL). Il
rallentamento dell'attività aromatasica a livello ovarico si può, infatti, rendere responsabile
dell'elevazione dei livelli circolanti di PRL, giustificando il suo incremento nelle condizione di
aumentata sintesi androgenica. (6-7)
Anche gli ormoni tiroidei interferiscono sul controllo metabolico e sulle sintesi di molte sostanze
tra cui gli ormoni steroidei e, a livello epatico, della loro proteina vettrice (SHBG). L'ipertiroidismo
fa aumentare la sintesi di SHBG, accelerando quella degli steroidi, tra cui gli androgeni. Il risultato
finale si identifica nell‟aumento delle quote libere circolanti, e quindi biologicamente attive, di
questi ormoni. Nell'ipotiroidismo la situazione appare lievemente diversa, potendosi osservare una
riduzione della sintesi di SHBG ed una modesta variazione dei livelli degli steroidi, che risultano in
un incremento delle quote libere steroidee e degli androgeni in particolare. (7)
Ove non sia possibile evidenziare una chiara patologia surrenalica od ovarica e non risulti,
all'anamnesi, l'assunzione di farmaci condizionanti la manifestazione clinica, si parla di “irsutismo
idiopatico”.
Alla luce di un adeguato inquadramento diagnostico è necessario, peraltro, sottolineare che,
alcune delle forme in un primo momento considerate idiopatiche possono essere successivamente
ricondotte ad una delle cause sopraccitate, con particolare riferimento alle forme fruste "late onset"
di iperplasia surrenalica congenita.
La diagnosi di irsutismo idiopatico viene posta, comunque, in esclusione. Sotto tale
denominazione rientra, infatti, un complesso clinico-sintomatologico rappresentato
fondamentalmente da un grado variabile di irsutismo, ma anche (possibilmente ma non
necessariamente) dalla concomitante evidenza di manifestazioni acneiche/seborroiche e di alopecia,
anche in presenza di cicli eumenorroici.
È certamente riconosciuto che il marker più sensibile di aumentata produzione androgenica sia
rappresentato dall'irsutismo; in circa il 40% delle donne affette da alopecia è possibile, infatti,
evidenziare una condizione di iperandrogenismo. (8) Nelle forme idiopatiche (percentualmente
abbastanza frequenti) i comuni esami ormonali di screening, così come la valutazione
ultrasonografica degli annessi, non mettono in evidenza nulla di patologico rispetto a quanto
abitualmente si evidenzia nelle donne sane.
Sul piano clinico e strumentale, le condizioni di iperandrogenismo troveranno delle sequele
sintomatologiche peculiari, rispettivamente caratterizzate da:
1)
2)
3)
4)
5)
gradi variabili di irsutismo;
presenza di manifestazioni cutanee acneiche e seborroiche ed alopecia fronto-temporale;
gradi variabili di sovrappeso od obesità con possibile riduzione della tolleranza ai glucidi;
aumentato rischio di patologia vascolare a carattere ischemico;
alterazioni ciclo-mestruali a carattere prevalentemente oligomenorroico, amenorroico o, più
raramente, con presenza di sanguinamenti uterini disfunzionali, accompagnati da condizioni
di anovularietà cronica ed infertilità
Tale sintomatologia è presente raramente in tutta la sua interezza, nella stessa paziente, mentre più
frequentemente si assiste al manifestarsi di un‟ampia variabilità clinica dei sintomi, sia per
l'influenza di fattori ambientali e comportamentali, sia, soprattutto, per la differente sensibilità
periferica agli androgeni da parte dei tessuti e delle strutture bersaglio.
Anche la diagnosi biochimica può risultare difficoltosa, dal momento che molte donne
iperandrogeniche presentano livelli circolanti di androgeni apparentemente normali. Oltretutto,
l‟individuazione di criteri biochimici precisi è resa ardua dalla variabilità dei livelli ormonali nel
corso del ciclo mestruale e dalla scarsa confrontabilità delle misure effettuate con metodiche di
laboratorio differenti.
Endpoint primario nell‟iter diagnostico dell‟iperandrogenismo femminile è rappresentato dalla
discriminazione tra le cause organiche e quelle funzionali. Le prime, infatti, richiedono un rapido
inquadramento ed una terapia tempestiva, dal momento che ogni ritardo si renderebbe responsabile
di un sensibile aggravamento del quadro clinico. Un più approfondito e dovizioso approfondimento
diagnostico è invece giustificato e più auspicabile per il corretto inquadramento eziopatologico delle
forme funzionali. (9)
Ai fini di un corretto inquadramento diagnostico è, inoltre, necessario distinguere e classificare le
pazienti iperandrogeniche in base alla modalità di insorgenza temporale del quadro clinico
sintomatologico, potendosi venire a configurare due ben distinte situazioni. (Figg. 1-2)
Una rapida insorgenza del corteo sintomatologico (nell‟arco di un periodo compreso tra qualche
mese dopo, e non più di un anno dal menarca), con una quasi assoluta mancanza di precedenti
manifestazioni iperandrogeniche, dovrebbe indirizzare l‟attenzione dello specialista verso un
tumore ovarico o surrenalico steroido-secernente che, nel sospetto di una patologia oncologica
dovrebbero imporre un approfondimento ecografico e/o tomografico.
La stragrande maggioranza dei casi che possono giungere alla nostra osservazione è, tuttavia,
costituita da pazienti che manifestano una sintomatologia insorta più lentamente nel tempo, con
enormi variabilità interindividuali, da uno a cinque anni. Questa categoria di donne riferisce uno o
più segni clinici di dipendenza iperandrogenica, come quali acne/seborrea ed irsutismo, lamentando
soprattutto disordini della ciclicità mestruale, difficoltà nel rimanere gravide o consistenti
incrementi ponderali.
La conoscenza dei vari meccanismi patogenetici costituisce la base teorica per il trattamento dei
vari quadri clinici degli iperandrogenismi.
La terapia degli stati di iperandrogenismo femminile è obbligatoriamente un trattamento "longterm".
Soprattutto nelle condizioni patologiche caratterizzate da irsutismo ed alopecia, difatti, i tempi di
risposta clinica alla terapia sono strettamente correlati alle varie fasi di crescita pilifera (anagen,
telagen, ecc.) che, a loro volta, corrispondono a periodi funzionali differenti della singola unità pilosebacea. Sono inoltre presenti delle influenze stagionali che possono condizionare sia i tempi che
l'entità del risultato terapeutico. Abitualmente, sul piano clinico, le manifestazioni
acneiche/seborroiche rispondono più precocemente (3-4 mesi) rispetto all‟irsutismo e/o all‟alopecia
(risultati apprezzabili si hanno intorno, o a partire dal 6° mese di terapia).
È dunque importante che il medico identifichi e sottolinei alla paziente gli iniziali segnali degli
effetti terapeutici, sia per valutare più correttamente la risposta clinica, sia per rassicurare la
paziente stessa, (la quale normalmente si aspetta dal trattamento un "effetto rasoio", immediato).
Inoltre, la scelta del dosaggio e del tipo di associazione farmacologica è comunque relativa alla
situazione individuale ed alla risposta terapeutica al prodotto utilizzato. Tuttavia, le formulazioni a
basso dosaggio, e a dosi decrescenti nel tempo, permettono sia una somministrazione più
prolungata, sia una maggiore latenza di ricomparsa della sintomatologia dopo la sospensione della
terapia.
Essendo il trattamento degli stati di iperandrogenismo femminile esclusivamente di tipo
sintomatico, è infatti pressoché inevitabile il ripresentarsi della sintomatologia a distanza di tempo
variabile dalla sospensione della terapia.
Tab. 1: Iperandrogenismo: eziopatogenesi
ALTERATA FUNZIONE OVARICA
FORME PRIMITIVE
FORME SECONDARIE
ORGANICHE
o Tumori ovarici androgeno secernenti
o Iperprolattinemia
o Acromegalia
FUNZIONALI
o PCOS
o Iperattività citocromo P450
o Ipertecosi
o Iperinsulinemia
o Tumori LH secernenti
ALTERATA FUNZIONE SURRENALICA
FORME PRIMITIVE
FORME SECONDARIE
ORGANICHE
o Tumori surrenalici
FUNZIONALI
o Deficit di 3-OH-steroido-deidrogenasi,
21-idrossilasi e 11-idrossilasi
o Resistenza periferica al cortisolo
o Ipersecrezione ACTH
- Adenomi ipofisari
- Iipersecrezione ipofisaria funzionale
- Ipersecrezione ectopica paraneoplastica
o Iperprolattinemia
IRSUTISMO IDIOPATICO
Fig. 1: Orientamento diagnostico dell‟iperandrogenismo in base alla modalità di insorgenza
temporale: forme insorte rapidamente. (modificato da Genazzani AD. (24))
IPERANDROGENISMO INSORTO RAPIDAMENTE
17-OH-PROGESTERONE
TESTOSTERONE
> 2 ng/mL
< 2 ng/mL
NEOFORMAZIONE
OVARICA ?
IPERANDROGENISMO
DA PCOS ?
MASSA ANNESSIALE
PALPABILE
> 200 ng/DL
< 200 ng/DL
TEST all’ACTH
SOPRRESS. con DXM
ESCLUSIONE
IPERPL. SURRENALICA
da DEFICIT 21-IDROSSILASI
MASSA ANNESSIALE
NON PALPABILE
RISPOSTA
NORMALE
RISPOSTA ANOMALA
ECOGRAFIA, RMN ,
MARKERS TUMORALI
NEOFORMAZIONE
OVARICA ?
ESCLUSIONE
IPERPL. SURRENALICA
da DEFICIT 21-IDROSSILASI
INTERVENTO
CHIRURGICO
IPERPLASIA
SURRENALICA da
DEFICIT 21-IDROSSILASI
Fig. 2: Orientamento diagnostico dell‟iperandrogenismo in base alla modalità di insorgenza
temporale: forme insorte lentamente. (modificato da Genazzani AD. (24))
IPERANDROGENISMO INSORTO LENTAMENTE
TESTOSTERONE, DHEA-S, 17-0HPROGESTERONE
DHEA-S > 2 mcg/mL
17-OH-P > 200 ng/dL
17-OH-P < 200 ng/dL
TEST all’ACTH
Soppress. con DXM
RISPOSTA
NORMALE
ESCLUSIONE
IPERPLASIA SURRENALICA
“late onset”
da DEFICIT ENZIMATICO
ESCLUSIONE
IPERPLASIA SURRENALICA
“late onset”
da DEFICIT ENZIMATICO
PRL
RISPOSTA
ANOMALA
IPERPLASIA SURRENALICA
“late onset”
da DEFICIT ENZIMATICO
PRL
< 25 ng/mL
PRL
> 25 ng/mL
PCOS
IPER PRL
DISFUNZIONALE o da
ADENOMA IPOFISARIO
TEST al TRH e IMAGING SELLA TURCICA
Bibliografia
1- Bardin CW, Lipsett M. Testosterone and androstenedione blood production rates in normal
women and women with idiopathic hirsutism and polycystic ovaries. J Clin Invest
1967;46:891.
2- Ferriman D, Gallwey JD. Clinical assessment of body hair growth in women. J Clin
Endocrinol Metab 1961;21:1440-7.
3- Carmina E, Lobo RA. Evidence for increased androsterone metabolism in some
normoandrogenic women with acne. J Clin Endocrinol Metab1993;76:1111.
4- Reid RL, Van Vugt DA. Hair loss in the female. Obstet Gynecol Survey 1988;43:135.
5- O'Meara NM, Blackman JD, Ehrman DA, Barnes RB, Jaspan JB, Rosenfeld RL, Polonsky
KS. Defects in Beta-cells function in functional ovarian hyperandrogenism. J Clin
Endocrinol Metab 1993;76:1241.
6- Franks S. Polycystic ovary syndrome: a changing perspective. Clin Endocrinol 1989;31:87.
7- Yen SSC, Jaffe RB. Reproductive Endocrinology. Philadelphia, PA: WB Saunders Co.
1991.
8- Futterweit W, Dunaif A, Yeh HC, Kingsley P. The prevalence of hyperandrogenism in 109
consecutive female patients with diffuse alopecia. J Am Acad Dermatol 1988; 19:831.
9- Bruni V, Dei M, Magnani L, Piciocchi L, Verni A, Vicini I. Iperandrogenismo e
adolescenza. In: Genazzani AR. eds. Aggiornamento Permanente in Ostetricia e
Ginecologia – Iperandrogenismo e policistosi ovarica. Pacini Medicina Editore
4(1)2000:41-53.
UNIVERSITA’ degli STUDI di CATANIA
Facoltà di Medicina e Chirurgia
Dipartimento di Scienze Microbiologiche e Scienze Ginecologiche
- Sezione di Ginecologia -
ANDROGENS
Sexual identity genesis
Secondary sexual characters determininism
Maintainance and regulation of
steroidogenesis (sexual steroids precursors)
Maintainance of skin, muscle and bone
trophism
Control of libido patways
FISIOPATOLOGIA DEGLI
IPERANDROGENISMI
Prof. Antonio Cianci
10% of reproductive age women complain with symptoms related
to excessive production or excessive androgenic activity
Microb & Gynecol Science Dept. UNIVERSITY OF CATANIA – Prof . A. CIANCI
METFORMIN
POSSIBLE MECHANISM OF INSULIN STIMULATION OF
OVARIAN CYTOCROME P450c17 (ALPHA) ACTIVITY
AND ANDROGEN PRODUCTION
Plasma 17-OHP response to HCG
PITUITARY
THECA CELL
CHOLESTEROL
LH
PROGESTERONE
17alphaHYDROXILASE
+
+
17-alpha-HYDROXIPROGESTERONE
PREGNENOLONE
STEP INVOLVING
P450c17
17, 20 LYASE
+
ANDROSTENEDIONE
INSULIN
17-beta-REDUCTASE
TESTOSTERONE
RESPONSE AFTER METFORMIN TREATMENT WAS
SIGNIFICANTLY LOWER (p<0.05) THAN BEFORE
Nestler et al, N Engl J Med, 1996
Microb & Gynecol Science Dept. UNIVERSITY OF CATANIA – Prof . A. CIANCI
Microb & Gynecol Science Dept. UNIVERSITY OF CATANIA – Prof . A. CIANCI
ANDROGENS ACTION AT THE LEVEL OF
HAIR-SEBACEOUS FOLLICLE
THERAPEUTIC OPTIONS
A
Total Testosteron
SHBG-binded
Testosteron
FREE TESTOSTERON
ORAL CONTRACEPTIVES
GnRH ANALOGUES
B
C
DHT
Azziz R, 1989 - Semin Reproduct Endocrinol
Imperato-McGinley J, 1993 - J Clin Endrocrinol Metab
Murphy AA, 1990 - Fertil Steril
Pye RJ, 1997 - Br Med J
Sebaceous production – body hair growth
Androgens receptor antagonists
CIPROTERONE ACETATE
FLUTAMIDE
5-reductase
Androgen
receptor
at sebaceous
gland level
Ovarian androgens production inhibitors
5-reductase inhibitors
FINASTERIDE
DUTASTERIDE
D
Insulin sensiters
METFORMIN
ACARBOSE
Microb & Gynecol Science Dept. UNIVERSITY OF CATANIA – Prof . A. CIANCI
Microb & Gynecol Science Dept. UNIVERSITY OF CATANIA – Prof . A. CIANCI
ETIOPATHOGENESIS
SHBG CONCENTRATIONS IN RELATION TO
EE DOSAGE IN OC
-
Archer DF, Contraception 1997
+
SHBG, IGFBP-1
250
-
200
LH
+
+
+
Obesity
Hyperinsulinemia
+
+
OC
+
P<0.001
150
100
50
+
0
+
Androgens
nM/L
-
baseline
-
Androgens
6 mesi
15 mcg
20 mcg
Microb & Gynecol Science Dept. UNIVERSITY OF CATANIA – Prof . A. CIANCI
30 mcg
Microb & Gynecol Science Dept. UNIVERSITY OF CATANIA – Prof . A. CIANCI
“THE PROGESTINIC-TREE”
ANTI-ANDROGENIC ACTIVITY
PURE
AGONIST
ANTIESTROGENIC
ACTIVITY
ESTOGENIC
ACTIVITY
Progesteron CPA
CMA
LNG
DNG
DRSP
ANTIANDROGENIC
ACTIVITY
LNG
DSG ANDROGENIC
ACTIVITY
GSD
GLUCOCHORTICOID
ACTIVITY
Clormadinon
CPA
NETA
MPA
MGA
Dienogest
Mouse
prostare
reduction
(%)
TMG
NOM ac
40
100
20
15
DRSP
ANTI-MINERAL_
CHORTICOID
ACTIVITY
Progesteron
Drospirenon
Sitruk-Ware 2005 - Climacteric
Microb & Gynecol Science Dept. UNIVERSITY OF CATANIA – Prof . A. CIANCI
30EE/DRSP:
Effects on hirsutism in affected PCOS women
Microb & Gynecol Science Dept. UNIVERSITY OF CATANIA – Prof . A. CIANCI
30EE/DRSP:
Effects on hirsutism in affected PCOS women
F-G SCORE
20
60
16
*
12
50
40
Severe
Moderate
Low
No
% 30
8
20
4
0
10
Before
Guido et al, 2004 – J Clin Endocrinol Metab
6th
12th cycles
* P<0.01 vs baseline
Microb & Gynecol Science Dept. UNIVERSITY OF CATANIA – Prof . A. CIANCI
0
Before
6th
12th
Guido et al, 2004 – J Clin Endocrinol Metab
Microb & Gynecol Science Dept. UNIVERSITY OF CATANIA – Prof . A. CIANCI
ORAL CONTRACEPTION AND PCOS
Hirsutism Score in previous treatment with OC
alone and during GNRH-a + OC therapy
Ciotta, Cianci ’96 (Fertil Steril)
30
POSSIBILITY OF ASSOCIATION WITH:
25
*
20
ANTIANDROGENS
15
*
10
INSULIN SENSITIZERS
5
0
GnRH ANALOGUE
Basal
6 months
CPA + EE
Microb & Gynecol Science Dept. UNIVERSITY OF CATANIA – Prof . A. CIANCI
Microb & Gynecol Science Dept. UNIVERSITY OF CATANIA – Prof . A. CIANCI
THERAPEUTIC OPTIONS
A
B
Androgens receptor antagonists
Inverted sequential
regimen (according to
HAMMERSTEIN)
5-reductase inhibitors
Low Dosage +
GnRH-A
FINASTERIDE
DUTASTERIDE
D
CIPROTERONE ACETATE
Low Dosage
CIPROTERONE ACETATE
FLUTAMIDE
C
RECEPTOR ANTAGONISTS
Ovarian androgens production inhibitors
ORAL CONTRACEPTIVES
GnRH ANALOGUES
Low dosage +
Oral
contraceptives
Insulin sensiters
METFORMIN
ACARBOSE
12 months
LA + CPA + EE
> Acne/seborrhoea
Mild hirsutism
Hirsutism score > 15 (FG scrore)
Alopecia androgenica
Impaired tolerance to E (> 20 g)
Poor responders
Carmina ’97 (Human Reprod)
Same effectiveness vs GnRH-A
(secondary choice in severe cases for
the absence of pituitary suppression)
Kaiser ‘91 (Geburts-hilfe-Frauenheilkd)
Microb & Gynecol Science Dept. UNIVERSITY OF CATANIA – Prof . A. CIANCI
Microb & Gynecol Science Dept. UNIVERSITY OF CATANIA – Prof . A. CIANCI
THERAPEUTIC OPTIONS
RECEPTOR ANTAGONISTS
CIPROTERONE ACETATE
A
Ovarian androgens production inhibitors
ORAL CONTRACEPTIVES
GnRH ANALOGUES
Side effects
Long-term therapies with CPA + Estrogens
Headache
Nausea
Depression
Weight increase
Epatic function impairment
Increase in triglicerid blood level
Corvol ’75 (Endocrinology)
Microb & Gynecol Science Dept. UNIVERSITY OF CATANIA – Prof . A. CIANCI
B
Androgens receptor antagonists
CIPROTERONE ACETATE
FLUTAMIDE
C
5-reductase inhibitors
FINASTERIDE
DUTASTERIDE
D
Insulin sensiters
METFORMIN
ACARBOSE
Microb & Gynecol Science Dept. UNIVERSITY OF CATANIA – Prof . A. CIANCI
Steroid values during therapy with
FLUTAMIDE + OC
Gonadotrophin values during therapy
with FLUTAMIDE + OC
Ciotta, Cianci ’94 (Fertil Steril)
Ciotta, Cianci ’94 (Fertil Steril)
600
25
500
400
*
*
300
200
mcg/mL
* *
pg/mL
mUI/ml
* *
10
0
0
Basal
4 Months
LH
Basal
8 Months
4 Months
2
0
8 Months
Basal
DHT
FSH
8 Months
Microb & Gynecol Science Dept. UNIVERSITY OF CATANIA – Prof . A. CIANCI
THERAPEUTIC OPTIONS
Hirsutism score in previous treatment with CO alone
and during FLUTAMIDE PLUS OC therapy
A
Ciotta, Cianci ’94 (Fertil Steril)
Ovarian androgens production inhibitors
ORAL CONTRACEPTIVES
GnRH ANALOGUES
34,5
B
24,5
Androgens receptor antagonists
CIPROTERONE ACETATE
FLUTAMIDE
14,5
C
5-reductase inhibitors
4,5
basal
4 months
FINASTERIDE
DUTASTERIDE
8 months
D
period of treatment
PR EV I O U S T HER A PY W I T H O C s A LO N E
Insulin sensiters
METFORMIN
ACARBOSE
F LU T A M I D E PLU S O C s
Microb & Gynecol Science Dept. UNIVERSITY OF CATANIA – Prof . A. CIANCI
Microb & Gynecol Science Dept. UNIVERSITY OF CATANIA – Prof . A. CIANCI
Levels of LH and FSH in idiopathic hirsutism
treated with placebo or FINASTERIDE
Levels of tT and DHT in idiopathic hirsutism
treated with placebo or FINASTERIDE
Ciotta, Cianci ’95 (Fertil Steril)
Ciotta, Cianci ’95 (Fertil Steril)
6
0,8
5
0,7
4
0,6
3
2
*
*
*
*
0,5
400
350
300
pg/mL
ng/mL
mUI/mL
4 Months
SHBG
Microb & Gynecol Science Dept. UNIVERSITY OF CATANIA – Prof . A. CIANCI
-5,5
3
1
100
5
*
4
20
15
*
5
0,4
250
0,3
150
1
0,2
100
0
0,1
50
Basal
3 Months 6 Months
9 Months
FSH - PLACEBO
LH - PLACEBO
FSH - FINASTERIDE
LH - FINASTERIDE
Microb & Gynecol Science Dept. UNIVERSITY OF CATANIA – Prof . A. CIANCI
*
200
*
*
0
0
Basal
3
6
9
tT - PLACEBO
tT - FINASTERIDE
Basal
3
6
9
DHT - PLACEBO
DHT - FINASTERIDE
Microb & Gynecol Science Dept. UNIVERSITY OF CATANIA – Prof . A. CIANCI
THERAPEUTIC OPTIONS
Hirsutism Score in idiopathic hirsutism treated
with placebo or FINASTERIDE
Ciotta, Cianci ’95 (Fertil Steril)
A
Ovarian androgens production inhibitors
ORAL CONTRACEPTIVES
GnRH ANALOGUES
25
20
*
15
*
B
CIPROTERONE ACETATE
FLUTAMIDE
C
10
Androgens receptor antagonists
5-reductase inhibitors
FINASTERIDE
DUTASTERIDE
5
0
Basal
3 months
6 months
Placebo
9 months
Finasteride
METFORMIN
Clinical and Endocrine Parameters
AGE (years)
BMI (Kg/m2)
LH (IU/l)
FSH (IU/l)
Oestradiol (pmol/l)
Testosterone (nmol/l)
17OHP (nmol/l)
Free Testosterone (pmol/l)
Androstenedione (nmol/l)
SHBG (nmol/l)
Fasting insulin concentr. (pmol/l)
AUCinsulin (pmol/l/min)
29 ± 4
28.3 ± 3.1
11.2 ± 1.4
5.3 ± 0.8
185 ± 38
2.2 ± 0.4
4.1 ± 05
43 ± 4
12 ± 3
64 ± 10
108 ± 24
65850 ± 11.220
Insulin sensiters
METFORMIN
ACARBOSE
Microb & Gynecol Science Dept. UNIVERSITY OF CATANIA – Prof . A. CIANCI
Basal
(n = 9)
D
After Metmorfin
(n = 9)
28.1 ± 3.2
10.6 ± 1.9
5.6 ± 1
178 ± 45
2.1 ± 0.3
3.9 ± 0.4
35 ± 4*
11.4 ± 2.9
97 ± 15*
99 ± 34.8
45900 ± 8700*
*P <0.05 versus basal
Microb & Gynecol Science Dept. UNIVERSITY OF CATANIA – Prof . A. CIANCI
NEW PERSPECTIVES
?
Clinical, endocrine and metabolic effects
of ACARBOSE, an -GLUCOSIDASE
INHIBITOR, in PCOS patients with
increased insulin response and normal
glucose tolerance
Lilliana Ciotta, Aldo E. Calogero, Marco Farina,
Vincenzo De Leo, Antonio La Marca, Antonio Cianci.
HUMAN REPRODUCTION – Vol 16, No 10 pp. 2066-2072, 2001
Microb & Gynecol Science Dept. UNIVERSITY OF CATANIA – Prof . A. CIANCI
NEW PERSPECTIVES
PRE
Microb & Gynecol Science Dept. UNIVERSITY OF CATANIA – Prof . A. CIANCI
CONCLUSIONS
INSULIN-SENSITIZERS AGENTS
POST
3 MONTHS
AGE (years)
BMI (Kg/m2)
HIRSUTISM SCORE
ACNE/SEBORRHOEA SCORE
LH (mIU/mL)
FSH (mIU/mL)
T (ng/dL)
ANDROSTENEDIONE (ng/dL)
DHEAS (mcg(dL)
PRL
17-alphaOH-P (ng/dL)
SHBG (nmol/L)
INSULINOGENIC INDEX
20.6 ± 0.7
22.84 ± 0.52
20.93 ± 0.99
2.1 ± 0.15
10.0 ± 0.6
6.5.± 0.5
96 ± 3
249 ± 12
264.7 ± 15.6
8.5 ± 0.6
89 ± 6
41.1 ± 2.5
1.52 ± 0.09
22.57 ± 0.47
20.07 ± 0.93
1.13 ± 0.12*
6.6 ± 0.4*
5.7 ± 0.5*
54 ± 4*
182 ± 8*
252.7 ± 14.6
7.3 ± 0.4
75 ± 6
54.7 ± 1.7*
0.66 ± 0.03*
OUR DATA CONFIRM THAT
HYPERINSULINEMIA PLAYS A KEY
PATHOGENETIC ROLE IN THE OVARIAN
ANDROGEN OVERPRODUCTON OF PCOS
REDUCTION OF HYPERINSULINEMIA AMELIORATE
THE ANDROGEN EXCESS OF PCOS
*P <0.05 versus basal
Microb & Gynecol Science Dept. UNIVERSITY OF CATANIA – Prof . A. CIANCI
Microb & Gynecol Science Dept. UNIVERSITY OF CATANIA – Prof . A. CIANCI
Obesità e ciclo mestruale
Paolo Moghetti
Sezione di Endocrinologia e Metabolismo
Dipartimento di Scienze Biomediche e Chirurgiche
Università di Verona
La nozione che il peso corporeo può influenzare la funzione riproduttiva femminile è ben
consolidata. Già nel 1970 Frisch e Revelle avevano osservato che per una normale ciclicità
mestruale era indispensabile una quantità critica di tessuto adiposo, anche se all‟epoca i meccanismi
che potevano essere responsabili di questo fenomeno rimanevano oscuri. In una visione finalistica
non appariva tuttavia sorprendente che fra gli adattamenti, sviluppati nel corso dell‟evoluzione,
conseguenti ad uno stato di carenza di riserve energetiche vi potesse essere la messa a riposo della
funzione riproduttiva, date le potenziali difficoltà che questa condizione può determinare in
rapporto alle esigenze di una eventuale gravidanza. Oggi sappiamo che i meccanismi alla base delle
alterazioni riproduttive spesso presenti nei soggetti con peso ridotto sono verosimilmente ascrivibili
alla ridotta secrezione da parte del tessuto adiposo di leptina e altre adipochine. Questi ormoni
giocano un ruolo chiave nell‟informare i centri superiori sullo stato di replezione energetica
dell‟organismo.
Studi epidemiologici più recenti hanno evidenziato che i disturbi della funzione riproduttiva
presentano una relazione ad U con il BMI. La figura 1 riporta i risultati di un‟analisi condotta
sull‟ampia coorte del Nurses‟ Health Study e mostra come il rischio di infertilità riconducibile a
disturbi ovulatori sia maggiore nelle donne con valori di BMI inferiori a 18 kg/m 2 ma soprattutto in
quelle con BMI aumentato e già a partire da valori ai limiti superiori della norma. Il fenomeno è
comunque più evidente sopra i 30 kg/m2, raggiungendo nell‟obesità franca valori di rischio relativo
circa 2 volte e mezzo superiori a quello della popolazione con peso normale.
Se la presenza di una relazione fra funzione riproduttiva femminile ed eccesso ponderale è chiara, i
meccanismi che sottendono questo fenomeno sono ancora controversi. Una spiegazione, almeno
parziale, è data dalla possibile coesistenza di questi aspetti nell‟ambito della sindrome dell‟ovaio
policistico (PCOS). L‟obesità è infatti un comune riscontro nelle pazienti con PCOS e questa
condizione è tipicamente caratterizzata da oligo-anovulazione cronica. Anche se i dati
epidemiologici sulla PCOS restano limitati dalla eterogeneità delle casistiche e dalle insufficienti
dimensioni dei campioni esaminati, si stima che la prevalenza di obesità o sovrappeso in questi
soggetti raggiunga valori intorno al 60%. Inoltre, anche nei soggetti con BMI normale vi è spesso
un relativo eccesso di grasso viscerale.
I meccanismi che legano eccesso ponderale a PCOS restano tuttavia ancora mal definiti e sono
probabilmente molteplici. Queste pazienti sono spesso insulinoresistenti e una larga messe di dati
indica che l‟insulinoresistenza, con l‟iperinsulinemia compensatoria che l‟accompagna, costituisce
un importante meccanismo patogenetico alla base della sindrome. In questo contesto, l‟obesità
potrebbe fungere da fattore facilitante l‟insulinoresistenza e attraverso questa determinare, in
soggetti predisposti, le manifestazioni tipiche della PCOS - in primo luogo iperandrogenismo e
disturbi ovulatori. Un„altra possibilità è che l‟eccesso di androgeni che caratterizza questi soggetti
costituisca il meccanismo iniziale che favorisce un accumulo di adipe a livello centrale, con
induzione secondaria di insulinoresistenza.
La presenza, nelle ragazze obese, di aumentati livelli di testosterone e bassi livelli di SHBG già
negli stadi precoci dello sviluppo puberale suggerisce che l‟eccesso di tessuto adiposo sia
verosimilmente un meccanismo iniziale di questo processo. In ogni caso gli stretti legami che
esistono fra questi aspetti possono rendere conto di un circolo vizioso che, qualunque sia il
problema iniziale, tende a mantenere ed aggravare le diverse manifestazioni tipiche della sindrome.
Nel caso dell‟obesità il ruolo svolto dalle adipochine nel determinare le alterazioni del ciclo
mestruale e più in generale delle funzioni riproduttive resta ancora poco chiaro. E‟ stato esaminato
il potenziale ruolo di leptina, adiponectina, resistina e di altri elementi di questa ampia categoria.
Gli studi condotti in proposito non hanno finora dato risultati chiarificatori. Le nostre conoscenze su
questo complesso sistema di regolazione ormonale restano peraltro ancora limitate.
Non vi è dubbio che, indipendentemente dal suo ruolo primitivo o secondario, l‟obesità rappresenta
in molte donne affette da PCOS un elemento clinico e fisiopatologico importante. Diversi recenti
dati indicano che la presenza di obesità si associa a quadri di maggior gravità della sindrome.
Inoltre nelle donne con PCOS obese sono più frequenti le alterazioni metaboliche che caratterizzano
molte di queste pazienti. In particolare, il rischio di sviluppare precocemente alterazioni della
tolleranza ai carboidrati (IGT o diabete tipo 2), ipertensione e altri aspetti della sindrome metabolica
appare nettamente incrementato nelle pazienti con PCOS obese. E‟ verosimile che sia soprattutto in
relazione a questi disordini metabolici che in tali soggetti sono più spesso presenti alterazioni di
diversi indici precoci di potenziale maggior rischio cardiovascolare, come gli indici di flogosi
cronica e di disfunzione endoteliale, anche se manca ancora la dimostrazione che tale rischio sia
effettivamente aumentato in questa patologia. Va tenuto presente, in ogni caso, che l‟epoca della
vita in cui le pazienti giungono al medico per gli aspetti tipici della PCOS è molto più precoce
rispetto a quella in cui è verosimile possano svilupparsi le complicanze cardiovascolari. Inoltre,
anche l‟iperandrogenismo è spesso più severo, in queste donne, in presenza di obesità.
Le interrelazioni fra obesità, aspetti metabolici ed aspetti endocrini sono in ogni caso molto
complesse. La figura 2 schematizza i risultati dell‟analisi delle componenti applicata agli aspetti
caratteristici della sindrome dell‟insulinoresistenza in un campione di 255 donne iperandrogeniche.
In questa analisi i diversi aspetti della sindrome dell‟insulinoresistenza risultano raggruppati in tre
componenti principali, quella centrale, che contiene il BMI fra i suoi parametri, e quelle
dell‟iperglicemia e dell‟ipertensione, legate a quella centrale rispettivamente attraverso
l‟iperinsulinemia e l‟eccesso ponderale. Questi dati sono in accordo con quanto già osservato nella
popolazione generale del Framingham Study. Includendo gli aspetti endocrini tipici della PCOS a
questa analisi, si osserva una quarta componente, anch‟essa associata a quella centrale attraverso
l‟iperinsulinemia. Ma i livelli di testosterone libero compaiono anche in altre componenti, a
suggerire dei nessi molto complessi in questa patologia fra iperandrogenismo e alterazioni
metaboliche.
E‟ importante notare che tutti gli approcci che determinano calo ponderale, nelle donne obese con
PCOS, dalla dieta ipocalorica, ai farmaci anti-obesità fino alla chirurgia bariatrica - nelle pazienti
con obesità massiva, migliorano non solo gli aspetti metabolici ma anche quelli riproduttivi di
queste pazienti, consentendo in molti casi il ripristino di cicli regolari e ovulatori e la riduzione dei
livelli di testosterone. Inoltre, va ricordato che l‟efficacia della metformina e di altri strumenti
terapeutici è ridotta e il rischio di complicanze di una eventuale gravidanza è aumentato nei soggetti
con obesità grave. L‟approccio terapeutico alla PCOS deve quindi sempre comprendere il tentativo
di correggere l‟eventuale eccesso ponderale.
Fig. 1.
Fig 2.
Componenti della sindrome dell’insulinoresistenza
in 255 donne iperandrogeniche
Core
Iperglicemia
Ipertensione
lipidi
glicemia
insulina
BMI
pressione
testosterone
testosterone
testosterone
17OHP
dopo GnRH-a
PCOS
Da Zanolin et al, Diabetes Care 2006
Sicurezza dell’HRT a basse dosi
M.C.Musacchio, A. Delia, G. Morgante, V. De Leo
Clinica Ostetrica e Ginecologica
Università degli Studi diSiena
Per terapia ormonale sostitutiva (Hormone replacement Therapy, HRT) si intende la
somministrazione alla donna in menopausa degli ormoni che le gonadi femminili non
sono più in grado di produrre in misura adeguata per la sua salute. I benefici di tale
trattamento sono noti ormai da tempo e consistono nel contrastare i sintomi precoci e
nell‟esercitare un‟azione preventiva sulle manifestazioni tardive da carenza
estrogenica.
Recentemente, tuttavia, la pubblicazione dei due ben noti studi WHI (Women‟s
Health Initiative) e Million Women Study ha messo fortemente in dubbio l‟azione
preventiva dell‟HRT sul sistema cardiovascolare e ha generato il timore di un impatto
globale negativo sulla salute della donna, soprattutto per quanto riguarda il rischio di
sviluppare il carcinoma della mammella, portando di fatto ad una drastica riduzione
dell‟utilizzo della terapia ormonale sostitutiva (1,2). Per questo motivo l‟attuale
orientamento è quello di trattare esclusivamente le pazienti con sintomi vasomotori o
quelle affette da menopausa precoce, personalizzando la terapia con le dosi efficaci
più basse possibili e per breve periodo, in modo da ridurre al massimo i rischi e gli
effetti collaterali. D‟altra parte, sono ancora pochi gli studi che confermano
l‟efficacia e la sicurezza e dell‟HRT a basse dosi.
Alcuni autori hanno riportato risultati analoghi con 1 mg di E2 quanto con 2 mg nel
ridurre i sintomi vasomotori e quelli urogenitali tipici del periodo post-menopausale
(3,4). Inoltre, la terapia ormonale sostitutiva a basse dosi in associazione con calcio e
vitamina D si è rivelata efficace anche nell‟incrementare la densità ossea a livello
della colonna vertebrale e del collo del femore, riducendo in maniera significativa i
markers di turnover osseo (4). Recentemente, un effetto preventivo sulla
demineralizzazione ossea è stato riscontrato anche con dosaggi di HRT ultra-ridotti
(0.014 mg/die) somministrata per via transdermica (5). Non sono ancora disponibili,
tuttavia, studi che dimostrino una riduzione dell‟incidenza di fratture con la terapia
ormonale a basse dosi. Buoni risultati sono stati ottenuti anche con la riduzione del
dosaggio del tibolone (2.5 mg) sia sulla sintomatologia vasomotoria che sulla densità
ossea. Dopo 6 mesi di terapia con tibolone 2.5 mg, infatti, è stata osservata una
migliore densità ossea a livello delle vertebre lombari (6).
L‟utilizzo dei dosaggi ormonali più bassi si è rivelato efficace anche nel ridurre
l‟incidenza di alcuni effetti collaterali riscontrati con le dosi più alte, quali la
mastodinia e le irregolarità mestruali (4,7).
Per quanto riguarda l‟impatto del dosaggio della terapia ormonale sostitutiva sul
carcinoma della mammella, alcuni autori, in passato, hanno indicato come tale rischio
correlasse con il dosaggio degli estrogeni: più alto era il dosaggio, maggiore era il
rischio (8). Studi più recenti, tuttavia, non hanno confermato questi dati (9,10).
D‟altra parte, nel 2002 una metanalisi di 9 studi prospettici ha preso in
considerazione 663 donne che hanno sviluppato il carcinoma della mammella e 1765
donne sane e ha riscontrato come il rischio di sviluppare questa neoplasia fosse
significativamente più alto nelle donne con livelli plasmatici più alti di estrogeni
endogeni e più basso in quelle che avevano i livelli più alti di SHBG (11). Il famoso
studio WHI, pubblicato lo stesso anno, analizzava i dati ricavati dalla valutazione di
16.000 donne in postmenopausa metà delle quali sono state trattate con estroprogestinici (0.625 CEE + MPA 2.5 mg) e l‟altra metà trattate con placebo. Dopo 5
anni di trattamento lo studio segnalava un incremento significativo del rischio di
sviluppare carcinoma della mammella nel gruppo trattato con E/P (RR: 1.24) (1). Il
million Women study, pubblicato un anno più tardi, segnalava, invece, un RR di
carcinoma della mammella in donne trattate con E/P pari a 1.45 per 1 anno di utilizzo
e 1.74 per un periodo di utilizzo di 5 anni (2). Tali dati non mostravano differenze
significative in relazione al diverso dosaggio di estrogeni utilizzato. Entrambi questi
studi, tuttavia, presentavano dei limiti considerevoli: il WHI aveva arruolato donne in
postmenopausa di età avanzata (età media 63 anni), con un BMI elevato (BMI medio
28.5 kg/m2); il million women study, invece, era uno studio osservazionale i cui dati
erano stati raccolti attraverso un questionario, senza nessuna ulteriore valutazione di
follow-up, e che aveva arruolato le donne in maniera del tutto casuale, includendo
anche quelle con un‟alta prevalenza di fattori di rischio per tumore mammario.
Queste considerazioni hanno portato ad interpretare con cautela le conclusioni tratte
dagli autori, anche se non hanno impedito un atteggiamento più prudente nei
confronti della prescrizione dell‟HRT. Recentemente, infine, è stato segnalato come
la terapia ormonale a basse dosi determini un minor incremento della densità
radiologica della mammella rispetto alle dosi più alte, facilitando la diagnosi precoce
del carcinoma della mammella (12).
Per quanto riguarda, invece, l‟impatto del dosaggio della terapia ormonale sostitutiva
sulle patologie cardiovascolari, il WHI aveva segnalato un incremento del rischio di
sviluppare malattia coronarica (RR 1.29), ictus (RR 1.41) e fenomeni tromboembolici
(RR 2.11) in donne che assumevano 0.625 mg CEE + 2.5 mg MPA nei primi 5 anni
di assunzione (1). Tali dati, tuttavia, riguardavano, come abbiamo visto, donne di età
avanzata, per lo più obese o in sovrappeso, il 35% delle quali effettuava terapia
antiipertensiva al momento dell‟arruolamento. Studi successivi non hanno indicato
differenze significative nel rischio di patologie cardiovascolari per diversi dosaggi di
CEE nell‟HRT (0.3, 0.625 e 1.125 mg di CEE) (13). Per quanto riguarda, invece, gli
effetti sui fattori di rischio cardiovascolari, come le lipoproteine LDL e HDL, l‟HRT
tradizionale riduceva significativamente i livelli di colesterolo LDL e incrementava
quelli di colesterolo HDL. Alcuni studi hanno segnalato che anche i dosaggi più bassi
di E2 (1 mg e 0.625 mg) determinano simili effetti benefici sull‟assetto lipidico,
mentre un effetto trascurabile sembra essere esercitato dal dosaggio di 0.3 mg (4,14).
Alcuni autori hanno affermato che esiste un periodo “finestra” ideale per la
somministrazione dell‟HRT: quando quest‟ultima viene somministrata precocemente
dopo la menopausa in donne senza aterosclerosi essa riduce il rischio di patologie
cardiovascolari. Se invece viene somministrata più tardi, nelle donne più “anziane”
con patologia aterosclerotica già in atto allora il rischio di sviluppare patologia
cardiovascolare negli anni successivi è più alto (15,16).
In conclusione, in attesa di ulteriori studi che comprovino la validità e confermino i
risultati del WHI e del Million Women Study, l‟European Medicine Evaluation
Agency conclude che la terapia ormonale sostitutiva può essere prescritta in pazienti
in perimenopausa con considerevole sintomatologia vasomotoria e neurovegetativa,
personalizzandola in relazione al principio attivo e alla modalità di somministrazione,
utilizzando il dosaggio efficace più basso possibile e controllandola periodicamente.
Bibliografia
1) Writing Group For The Women‟s Health Initiative Investigators. Risks and
benefits of estrogen plus progestin in healthy postmenopausal women: principal
results from the women‟s health initiative rendomized controlled trial. JAMA
2002; 288:321-333.
2) Million Women Study Collaborators. Breast cancer and hormone-replacement
therapy in the Million Women Study. Lancet 2003; 362: 419-427.
3) Heikkinennen JE, Vaheri RT, Ahomaki SM et al Optimizing continous-combined
hormone replacement therapy for postmenopausal women: a comparison of six
different treatment regimens. Am J Obstet Gynecol 2000; 182:560-567.
4) Peeyananjarassri K, Baber R. Effects of low-dose hormone therapy on
menopausal
symptoms,
bone
mineral
density,
endometrium,
and
the
cardiovascular system: a review of randomized clinical trials. Climateric 2005;
8:13-23.
5) Ettinger B. Unopposed ultra-low-dose: a new approach to osteoporosisprevention.
Suppl J Fam Practice 2004; S17-S19.
6) Osmanaqaoqlu MA, Osmanaqaoqlu S, Osmanaqaoqlu T, et al. Effect of different
preparation of hormone therapy on lipid and glucose metabolism, coagulation
factors, and bone mineral density in overweight and obese postmenopausal
women. Fertil Steril 2005; 84:384-93.
7) Archer DF, Dorin M, lewis V et al. Effects of lower doses of conjugated equine
estrogens and medroxy-progesterone acetate on endometrial bleeding. Fertil Steril
2001; 75:1080-1087.
8) Dupont WD, Page DL. Menopausal estrogen replacement therapy and breast
cancer. Arch Intern Med 1991; 151:67-72.
9) Collaborative Group on Hormonal Factors in Breast Cancer. Breast cancer and
hormone replacement therapy: collaborative reanalysis of data from 51
epidemiological studies of 52.705 women with breast cancer and 108411 women
without breast cancer. Lancet 1997; 350: 1047-1059.
10) Chlebowski RT, Hendrix SL, StefanicK ML et al. For the WHI investigators,
influence of estrogen plus progestin on breast cancer and mammography in
healthy post-menopausal women. The women‟s health initiative randomized trial.
JAMA 2003; 289:3243-3253.
11) The endogenous hormones and breast cancer collaborative. Endogenous sex
hormones and breast cancer in postmenopausal women: reanalysis of nine
prospective studies. J Natl Cancer Inst 2002; 94:606-616.
12) Christodoulakos GE, Lambrinoudaki IV, Vourtsi AD, et al. The effect of low
dose hormone therapy on mammographic breast density. Maturitas 2006; 54:7885.
13) Grodstein F, Manson JE, Stampfer MJ. Hormone therapy and coronary heart
disease: the role of time since menopause and age at hormone initiation. J
Women‟s Health 2006; 15:35-44.
14) Wakatsuki A, Okatani Y, Ikenoue N, et al. Effect of lower dose of oral
conjucated equine estrogen on size and oxidative susceptibility of low-density
lipoprotein particles in postmenopausal women. Circulation 2003; 108:808-813.
15) Hodis HN, Mack WJ, Azn SP et al. For the women‟s estrogen-progestin lipidlowering hormone atherosclerosis regression trial research group, hormone
therapy and the progression of coronary artery atherosclerosis in postmenopausal
women. N England Med 2003; 349: 535-545.
16) Hodis HN, mack WJ, Lobo RA. For the estrogen in the prevention of
atherosclerosis trial research group, estrogen in the prevention of atherosclerosis.
A randomized, double-blind, placebo-controlled trial. Ann Int Med 2006; 135:
939-953.
Amenorree: fisiopatologia
Stefano Luisi, Lucia Lazzeri, Chiara Cavicchioli, Claudia Mangani, Laura Trento,
Raffaele Battista, Francesco Calonaci, Felice Petraglia
Clinica Ostetricia e Ginecologica, Dipartimento di Pediatria, Ostetricia e Medicina della
Riproduzione,Università di Siena
Introduzione
Si definisce come amenorrea primaria o primitiva il mancato menarca all‟età di 17 anni.
L‟amenorrea secondaria, molto più frequente della precedente, quando la mestruazione scompare,
dopo la presenza di flussi mestruali più o meno regolari. Per un migliore inquadramento delle
amenorree è utile una loro classificazione in base alle cause (Tabella 1).
Cause ipotalamiche
Amenorrea psicogena
E‟ tipica delle ragazze giovani e sottoposte a stress cronico. E‟ un‟amenorrea secondaria
conseguente ad una insufficiente produzione di GnRH ipotalamico con conseguente ridotta
produzione di gonadotropine ipofisarie, senza lesioni organiche a carico dell‟asse ipotalamo-ipofisiovaio. Ne consegue spesso una difettosa maturazione follicolare e quindi anovulazione. Il ripristino
della serenità psicologica o il cessare dell‟evento stressante in genere portano al ripristino del ciclo
mestruale. In questo gruppo rientrano anche le forme di amenorrea causate da stress fisico (sport,
danza) e da stress metabolico (dimagrimento, anoressia). In funzione dell‟età precoce di inizio di
tali disturbi e/o attività stressogena l‟amenorrea potrà essere anche primaria.
Anoressia nervosa
E‟ un disordine psico-neuro-endocrino che colpisce giovani ragazze sotto i 25 anni, di classe sociale
medio-alta, con personalità spesso introverse e complesse. L‟amenorrea si manifesta durante una
dieta con perdita di peso ed è di tipo secondario. Il quadro neuroendocrino è caratterizzato anche in
questo caso da un‟alterato rilascio di GnRH e di gonadotropine. Il recupero del peso entro i limiti
accettabili risolve generalmente l‟amenorrea, anche se la terapia dell‟anorressia nervosa è molto
complessa e deve essere fondamentalmente di tipo psicologico/psichiatrico.
Cause ipofisarie
Adenomi ipofisari prolattino-secernenti e sindromi iperprolattinemiche
Definizione e patogenesi L‟amenorrea iperprolattinemica è un tipo di amenorrea che in circa il 50%
dei casi si associa a galattorrea, cioè alla secrezione spontanea dal capezzolo di una secrezione
lattiginosa al di fuori del periodo dell‟allattamento. E‟ necessario ricordare tutte quelle cause
fisiologiche di iperprolattinemia che è importante escludere al fine di una corretta diagnosi. Oltre
che in gravidanza e durante l‟allattamento, ci sono infatti altre situazioni quali il sonno, l‟esercizio
fisico, lo stress, la suzione del capezzolo e l‟attività sessuale, che possono fisiologicamente
determinare iperincrezioni di prolattina. Essa può avere diversi substrati etiopatogenetici: può essere
causata sia da tumori dell‟ipofisi (adenomi prolattino-secernenti), sia da una serie di fattori non
neoplastici quali l‟ipotiroidismo, la cirrosi epatica e l‟assunzione di alcuni farmaci. Tra i farmaci
iperprolattinemici occorre ricordare alcuni antidepressivi, antiemetici, antistaminici e ipotensivi,
capaci di agire sul sistema nervoso centrale provocando una ridotta produzione di dopamina o il
blocco del suo recettore, che a sua volta determina un aumento di prolattina ipofisaria.
L‟iperprolattinemia riduce la produzione di FSH ed LH, con conseguente diminuizione della
steroidogenesi ovarica ed amenorrea. L‟iperprolattinemia però si associa, oltre che all‟amenorrea,
anche a turbe più generali della sfera riproduttiva come l‟anovulazione e la sterilità.
Diagnosi Il problema principale consiste nella diagnosi differenziale delle iperprolattinemie
tumorali da quelle funzionali. In tutti i casi è dunque necessario dosare la prolattina plasmatica con
metodica radioimmunologica, effettuando sia un dosaggio basale, sia un prelievo dopo 30 minuti, in
modo da eliminare gli errori dovuti allo stress del prelievo stesso. In presenza poi di valori di
prolattina persistentemente elevati (> 60 ng/ml), dopo aver escluso un ipotiroidismo con il dosaggio
di TSH, fT3 ed fT4, verrà eseguita una TAC o una RM della sella turcica nei casi in cui la paziente
presenti cefalea e emianopsia bitemporale secondari a compressione del chiasma ottico.
Terapia La terapia etiologica avrà lo scopo di eliminare la causa dell‟iperprolattinemia. Questo
obiettivo può essere facilmente raggiunto nell‟ipotiroidismo, con un opportuno trattamento
sostitutivo e nelle forme iatrogene, interrompendo l‟assunzione del farmaco responsabile. Nei casi
di microadenomi ipofisari la terapia medica si fa preferire alla terapia chirurgica che invece risulta
elettiva nei casi di macroadenomi con compressione del chiasma ottico e cefalea. La terapia medica
è basata sull‟utilizzo di alcuni farmaci derivati dalla segale cornuta, dotati di attività agonista sui
recettori della dopamina (bromocriptina e cabegolina). Questi farmaci sono in grado di inibire la
sintesi ed il rilascio di prolattina agendo sia a livello ipotalamico, sia a livello ipofisario; inoltre,
grazie alla loro capacità di inibire l‟attività mitotica delle cellule lattotrope, risulta molto efficace
nel ridurre le dimensioni dell‟adenoma stesso.
Cause ovariche
Sindrome dell‟ovaio policistico (PCOS)
Definizione ed epidemiologia Può essere considerato il più comune disturbo endocrino femminile
interessando più del 10% delle donne in età riproduttiva. Patognomoniche di questa sindrome sono
l‟iperandrogenismo e l‟anovularietà cronica. Dal punto di vista endocrino nella PCOS si assiste alla
produzione aumentata di ormoni steroidei da parte dell‟ovaio in risposta alle gonadotropine; queste
pazienti hanno un iprandrogenismo LH dipendente e una diminuzione della dismissione di FSH da
parte dell‟ipofisi: questo si traduce in una non adeguata maturazione follicolare ; l‟aumentato
livello sierico di LH induce inoltre una iperplasia delle cellule della teca dell‟ovaio favorendo
l‟eccesso della secrezione di androgeni ovarici. Le pazienti affette da PCOS presentano inoltre un
elevato livello plasmatici di estrogeni a causa della aumentata conversione periferica
dell‟androstenedione circolante prodotto in eccesso in estrone.
Diagnosi Le manifestazioni cliniche possono essere variamente associate e con diversa frequenza;
sono la sterilità o infertilità da mancanza di ovulazione, l‟irsutismo che compare in genere in età
perimenarcale e che si rileva nel 65% dei casi, l‟obesita che si rileva nel 40% dei casi, le alterazioni
mestruali tra cui la più frequente è l‟oligoamenorrea , l‟acne che compare in età perimenarcale per
poi aggravarsi, la virilizzazione che è più frequente nelle forme a componente surrenalica. L‟esame
clinico evidenzia in queste pazienti i segni dell‟iperandrogenismo, ma per una corretta diagnosi è
necessario ricorrere all‟ecografia ovarica e ad alcuni esami di laboratorio: all‟esame ecografico si
rilevano ovaie di volume aumentato con presenza di almeno dieci piccoli follicoli di diametro
compreso tra 2 e 8 mm distribuiti prevalentemente in periferia.
Gli esami di laboratorio mostrano:
1. elevati livelli sierici di LH con aumento della pulsatilità
2. concentrazioni di FSH normali o ridotte (rapporto LH/FSH 2.5)
3. E2 normale o aumentato
4. iperprolattinemia (nel 15% dei casi i livelli di prolattina solo modicamente aumentati)
5. livelli circolanti di androgeni aumentati (androstenedione, DHEA).
Come tutte la patologie in cui la causa è sconosciuta, non esiste per la PCOS una terapia eziologia
ma solo l‟obiettivo di regolarizzare i cicli mestruali, curare la sterilità, curare i segni clinici di
iperandrogenismo.
Terapia
Per correggere i segni dell‟iperandrogenismo, sono utilizzati:
- lo spironolattone riduce la sintesi degli androgeni a livello ovario oltre ad avere un effetto
ipotensivo e diuretico;
- il ciproterone acetato, la finasteride e la flutamide vengono usati in pazienti con assetto
epatico normale.
Per la correzione dei disturbi del ciclo mestruale si ricorre generalmente ad un estroprogestinico. Il
farmaco di scelta per l‟induzione dell‟ovulazione in queste pazienti è attualmente il clomifene
citrato; vengono usati anche ipoglicemizzanti orali come la metmorfina.
Cause uterine
Malformazioni congenite
La forma più grave è la Sindrome di Rokitansky- Kuster- Hauser che è caratterizzata dalla presenza
di ovaie normali, corni uterini atresici generalmente senza cavità e aplasia vaginale in assenza di
alterazioni del cariotipo e di alterazioni dello sviluppo dei caratteri sessuali secondari. Possono
essere presenti anche malformazioni dell‟apparato urinario. La funzione ovarica di queste pazienti è
normale e la diagnosi definitiva viene posta generalmente con l‟esame ecografico e con la
laparoscopia solo nei casi dubbi. La terapia in queste pazienti è chirurgica e mira a permettere alla
donna di avere rapporti sessuali.
Sinechie e aderenze intrauterine
La forma più conosciuta di disturbi mestruali da causa acquisita uterina è la Sindrome di Asherman
che è caratterizzata dalla presenza di sinechie o aderenze che tendono ad obliterare in maniera più o
meno completa la cavità uterina. Le aderenze sono per lo più conseguenza di raschiamenti ripetuti
oppure stati di endometrite sia di tipo tubercolare che favoriti dalla presenza in cavità uterina di
dispositivi intrauterini a scopo contraccettivo. La sintomatologia varia a seconda della sede delle
sinechie e comprende dismenorrea, oligomenorrea, ipomenorrea. La diagnosi di certezza viene
raggiunta tramite l‟isterocopia che può anche permettere di procedere alla eliminazione delle
sinechie in maniera mirata.
Tabella 1: Classificazione delle amenorre in base alle cause
1.
Cause ipotalamiche
Amenorrea psicogena e da stress cronico
- Funzionali
Anoressia nervosa
- Organiche
Neoplasie e traumi ipotalamici
Sindrome di Kallman o displasia olfatto-genitale
2.
Cause ipofisarie
Adenomi ipofisari prolattino secernenti e sindromi iperprolattinemiche
Necrosi ipofisaria o Sindrome di Sheehan
Sindrome della sella vuota
3.
Cause ovariche
Sindrome dell‟ovaio policistico
Menopausa precoce e sindrome dell‟ovaio resistente
Disgenesie gonadiche
Neoplasie ovariche ormono secernenti
4.
Cause uterine
Malformazioni congenite (Sindrome di Rokitansky-Kuster-Hauser)
Sinechie congenite o acquisite (Sindrome.di Asherman)
5.
Cause vaginali
Agenesia/atresia vaginale e sindromi polimalformative
Imene imperforato
6.
Cause extragenitali
Sindrome di Cushing
Epatopati
Ipo-ipertiroidismo
Diabete
Alterazioni ponderali (obesità e magrezze)
Scompenso cardiaco
TERAPIA PROGESTINICA ED ESTROPROGESTINICA PER IL DOLORE
PELVICO ASSOCIATO AD ENDOMETRIOSI
Raffaella Daguati* M.D.
Edgardo Somigliana* M.D., Ph.D.
Paola Viganò* Ph.D.
Paolo Vercellini* M.D.
*Clinica Ostetrica e Ginecologica, Istituto „Luigi Mangiagalli‟, Università di Milano
Corrispondenza:
Paolo Vercellini
Clinica Ostetrica e Ginecologica II, Istituto Luigi Mangiagalli
Università di Milano
Via Commenda12, 20122 Milano
Tel: +39.02.5503.2917; Fax: +39.02.5503.233; e-mail: [email protected]
ABSTRACT:
E‟ stata eseguita una ricerca bibliografica per identificare tutti gli studi pubblicati in lingua Inglese
sull‟utilizzo dei progestinici per il trattamento dell‟endometriosi. Lo scopo dello studio é di chiarire
il razionale biologico del trattamento e definire quali farmaci possono essere utilizzati, i loro
dosaggi, le vie di somministrazione, la loro efficacia e tollerabilità. I progestinici sono in grado di
prevenire l‟impianto e la crescita dell‟endometrio regurgitato inibendo l‟angiogenesi e l‟espressione
delle metalloproteinasi, inoltre hanno proprietà anti-infiammatorie in grado di ridurre lo stato
infiammatorio creato dall‟attività metabolica dell‟endometrio ectopico e la conseguente risposta
immune. I contraccettivi orali aumentano la bassa attività apoptotica dell‟endometrio delle donne
con endometriosi. Inoltre, attraverso lo stabilirsi di cicli anovulatori, amenorrea, decidualizzazione
e di un clima estro-progestinico stabile contribuiscono alla quiescenza della malattia.
I progestinici sono efficaci nel controllo della sintomatologia dolorosa in circa tre donne su quattro
con endometriosi e la loro efficacia non sembra essere inferiore a quella ottenuta delle altre terapie
usate solitamente per questa patologia.
Formulazioni diverse possono essere somministrate per via orale, intramuscolare, sottocutanea,
intra-vaginale o intra-uterina, ognuna con specifici vantaggi e svantaggi. Il trattamento medico
gioca un ruolo importante nella strategia terapeutica delle pazienti con endometriosi solo se
somministrato per un lungo periodo di tempo. Data la loro buona tollerabilità, bassi costi, e scarsi
effetti metabolici i progestinici devono essere considerati come terapia di scelta ed attualmente
rappresentano l‟unica alternativa sicura ed efficace alla chirurgia. Tuttavia, la loro efficacia
contraccettiva limita il loro utilizzo a donne che non desiderano gravidanze a breve termine
Il ruolo della laparoscopia nel trattamento medico dell'endometriosi deve essere radicalmente
rivisto. Infatti, l'osservazione diretta della pelvi non è essenziale prima dell'inizio di terapie, in
quanto la diagnosi non-chirurgica si è dimostrata sufficientemente affidabile. Le linee guida
dell'American College of Obstetricians and Gynecologists così come quelle del Royal of
Obstetricians and Gynaecologists suggeriscono che in assenza di masse annessiali, combinazione
estro-progestiniche possono essere assunte senza il bisogno di eseguire una laparoscopia
preliminare.
In conclusione, l'esperienza dimostra che una seconda laparoscopia non è importante sia dal punto
di vista clinico che dal punto di vista sperimentale perchè serve solo ad appurare ciò che è
inevitabile: non abbiamo bisogno della laparoscopia per sapere che gli impianti endometriosici sono
"sopravissuti" alla terapia medica. L'endometriosi non è una patologia maligna e l'uso sistematico
di un follow-up laparoscopico dovrebbe essere rimosso dalla pratica clinica.
REFERENCES
1.Vercellini P, Fedele L, Pietropaolo G, Frontino G, Somigliana E, Crosignani PG. Progestogens
for endometriosis: forward to the past. Hum Reprod Update 2003;9:387-96.
2. Olive DL, Pritts EA. Treatment of endometriosis. N Engl J Med. 2001;345:266-75.
3. Harrison RF, Barry-Kinsella C.Efficacy of medroxyprogesterone treatment in infertile women
with endometriosis: a prospective, randomized, placebo-controlled study. Fertil Steril 2000;74:2430.
4. Bergqvist A, Theorell T. Changes in quality of life after hormonal treatment of endometriosis.
Acta Obstet Gynecol Scand 2001;80:628-37.
5. Fedele L, Arcaini L, Bianchi S, Baglioni A, Vercellini P. Comparison of cyproterone acetate and
danazol in the treatment of pelvic pain associated with endometriosis. Obstet Gynecol
1989;73:1000-4.
6.Vercellini P, De Giorgi O, Mosconi P, Stellato G, Vicentini S, CrosignaniPG. Cyproterone acetate
versus a continuous monophasic oral contraceptive in thetreatment of recurrent pelvic pain after
conservative surgery for symptomatic endometriosis. Fertil Steril 2002;77:52-61.
7. Vercellini P, Aimi G, Panazza S, De Giorgi O, Pesole A, Crosignani PG. A levonorgestrelreleasing intrauterine system for the treatment of dysmenorrhea associated with endometriosis: a
pilot study. Fertil Steril 1999;72:505-8.
8.Fedele L, Bianchi S, Zanconato G, Portuese A, Raffaelli R. Use of a levonorgestrel-releasing
intrauterine device in the treatment of rectovaginal endometriosis. Fertil Steril 2001;75:485-8.
9.Vercellini P, Trespidi L, Colombo A, Vendola N, Marchini M, Crosignani PG. A gonadotropinreleasing hormone agonist versus a low-dose oral contraceptive for pelvic pain associated with
endometriosis. Fertil Steril 1993;60:75-9.
10. Parazzini F, Di Cintio E, Chatenoud L, Moroni S, Ardovino I, Struzziero E, et al. Estroprogestin
vs. gonadotrophin agonists plus estroprogestin in the treatment of endometriosis-related pelvic pain:
a randomized trial. Gruppo Italiano per lo Studio dell'Endometriosi. Eur J Obstet Gynecol Reprod
Biol 2000;88:11-4.
11. Sulak PJ, Cressman BE, Waldrop E, Holleman S, Kuehl TJ. Extending the duration of active
oral contraceptive pills to manage hormone withdrawal symptoms. Obstet Gynecol 1997;89:179-83.
Le terapie ormonali della fibromatosi uterina
Prof. F. Petraglia, Clinica Ostetrica e Ginecologica
Dipartimento di Pediatria, Ostetricia e Medicina della Riproduzione
Università degli Studi di Siena
1. Introduzione
La fibromatosi uterina o leiomiomatosi rappresenta il più comune tumore benigno delle cellule
muscolari lisce del miometrio. Si ritrova in circa il 20-40% delle donne in età fertile, può essere
unico, ma molto spesso si tratta di formazioni multiple.
I leiomiomi sono classificati in base alla loro localizzazione nell‟utero: 1) sottosierosi, localizzati
sotto la sierosa uterina, peduncolati o sessili; 2) intramurali si ritrovano nello spessore
miometriale ; 3) sottomucosi, localizzati sotto la mucosa uterina, sessili o peduncolati.
I tumori sottosierosi ed intramurali rappresentano la maggior parte (95%) dei leiomiomi; il
rimanente 5% è rappresentato dai sottomucosi.
I fibromi si sviluppano spesso come masse pelviche subcliniche e la loro sintomatologia è
piuttosto varia. Le donne affette da fibromatosi lamentano: menorragia, forti dolori addominali,
incontinenza urinaria, costipazione e disturbi dell‟alvo. Possono inoltre rappresentare una causa di
ridotta capacità riproduttiva e di complicanze della gravidanza.
La presenza del fibroma uterino è sospettata sulla base di una visita ginecologica bimanuale che
riveli un utero aumentato di volume, fisso, a superficie irregolare e consistenza duro-fibrosa. Gli
ultrasuoni confermano il sospetto. La progressione verso il leiomiosarcoma maligno è rara.
2.Il trattamento della fibromatosi uterina
Ad oggi esistono numerose soluzioni a questo tipo di patologia, sia chirurgiche che mediche.
Le tecniche chirurgiche vanno dalla classica laparotomia con miomectomia sino alla isterectomia
totale; un nuovo approccio chirurgico è rappresentato dalla laparoscopia con la quale è possibile
ottenere lo stesso risultato finale della laparotomia con minore ospedalizzazione e rapido ritorno
alla normale vita di relazione. L‟accesso vaginale, utilizzabile quando i leiomiomi non sono di
grosso volume, ha gli stessi risultati chirurgici di quello addominale. I leiomiomi sottomucosi
possono essere rimossi con resezione isteroscopica.
In fase di sperimentazione ci sono i cosiddetti metodi alternativi, come la miolisi e
l‟embolizzazione dell‟arteria uterina, che potrebbero rappresentare ulteriori opzioni terapeutiche
se offrissero sicurezza ed efficacia in un follow-up a lungo termine.
La terapia medica risulta meno invasiva, ma il risultato finale non è sempre buono, in quanto i
leiomiomi possono ritornare alle dimensioni pre-trattamento
La crescita del fibroma uterino si ferma e regredisce dopo la menopausa, quando i livelli di
ormoni sessuali circolanti scendono, suggerendo una loro dipendenza dagli ormoni ovarici, anche
se il loro meccanismo d‟azione non è stata ancora completamente chiarito.
Gli estrogeni hanno ricevuto particolare attenzione come fattore principale dello sviluppo dei
fibromi uterini. I recettori estrogenici(ER) α e β, sono presenti nei fibromi così come nel normale
tessuto uterino. L‟espressione degli ER α è maggiore nel tessuto leiomiomatoso rispetto a quello
normale adiacente, e ciò si verifica durante tutto il ciclo mestruale. L‟espressione degli ER β,
invece, è la stessa o anche inferiore rispetto al tessuto miometriale normale.
L‟attività di stimolo esercitata dal progesterone è ancora oggetto di studio anche se sono evidenti i
risultati di riduzione del volume dei miomi con farmaci antiprogestinici invece, non è stata ancora
completamente chiarita.
I principali trattamenti ormonali tendono alla soppressione della secrezione degli ormoni sessuali
ovarici (menopausa iatrogena).
Analoghi del GnRH
Tutti gli analoghi agonisti del GnRH (GnRHa) esplicano la loro azione attraverso una “down
regulation” dei recettori ipofisari del GnRH con drastiche riduzioni di LH e FSH e di
conseguenza della secrezione di ormoni gonadici e sulla maturazione di gameti.
L‟attività degli GnRHa è utilizzata per la completa eliminazione degli effetti stimolatori degli
ormoni gonadotropi e\o gonadici, sul sistema riproduttivo o su tessuti patologici.
Sono formulate vie di somministrazione intranasale o iniezioni intramuscolari o sottocutanee a
lento rilascio.
Il regime di terapia più frequente prevede la somministrazione del farmaco per 3 mesi, con
iniezioni mensili ripetibili alla ricorrenza dei sintomi.
Il marcato ipoestrogenismo, indotto dai GnRHa, produce una significativa riduzione del volume
del fibroma uterino in una percentuale di casi compresa tra il 35% e il 65% con studi condotti a
doppio-cieco con placebo.
Gli effetti collaterali del farmaco sono soprattutto i sintomi vasomotori (vampate di calore),
l‟insonnia, la variabilità d‟umore, la cefalea e la secchezza vaginale. Nei casi in cui il trattamento
si prolunghi nel tempo, la perdita di osso è un effetto collaterale di frequente riscontro.
L‟aggiunta di ormoni steroidei al GnRHa (add-back therapy) è stata adoperata per minimizzare
gli effetti collaterali legati al GnRHa, come le vampate di calore, le variazioni delle lipoproteine e
la perdita di osso. Basse dosi di estrogeni inibiscono i sintomi menopausali senza stimolare la
crescita dei miomi uterini.
GnRH ANTAGONISTI
Gli antagonisti possono offrire vantaggi sugli analoghi del GnRH (GnRHa). L‟impiego
dell‟antagonista produce la desensibilizzazione delle gonadotropine con occupazione competitiva
del recettore LH-RH, con immediata riduzione dei livelli di LH e FSH e la conseguente riduzione
dei livelli di E2, che potrebbero portare ad un miglioramento dell‟emorragia e restringimento
delle dimensioni dell‟utero, particolarmente nei miomi sottomucosi.
La massima riduzione è stimata entro 14 gg di trattamento, più breve di quella ottenibile con il
GnRHa. Anche la funzionalità ovarica può essere ripristinata molto più velocemente.
Nei casi si reazioni di intolleranza locale si dovrebbero prescrivere analoghi e non antagonisti.
Danazolo
L‟efficacia di un trattamento di danazolo a breve termine per la fibromatosi uterina è
un‟osservazione ben riconosciuta. .Il danazolo è un progestinico ben assorbito per via orale, con
un‟emivita di circa 15 ore nell‟uomo, descritto come un “androgeno selettivo”.
Il danazolo metabolizza, per buona parte, per via epatica, riportando da lieve a moderato danno
epatocellulare in molte pazienti. E‟ dunque sconsigliato in presenza di disfunzione epatica.
I maggiori effetti collaterali della terapia con danazolo sono, in ordine di frequenza: aumento del
peso, edema, riduzione del volume mammario, acne, cute grassa, irsutismo, cambiamento del
tono di voce, cefalea, vampate di calore, modificazioni della libido, crampi muscolari. Più dei ¾
delle pazienti va incontro a 1 o più di tali effetti collaterali, anche se è difficile che venga
interrotta la terapia per tale motivo (400-800 mg/die).
I risultati sono buoni ma sono molti anche gli effetti collaterali. Gli effetti del danazolo sul
volume uterino sono inferiori o simili a quelli degli agonisti del GnRH o del mifepristone,
escludendolo quindi, come prima scelta.
Il danazolo offre una buona alternativa ai GnRHa nelle donne ad alto rischio di osteoporosi, per le
quali è necessario evitare uno stato di ipoestrogenismo.
Inoltre, il danazolo potrebbe essere prescritto dopo una terapia di 3 mesi con GnRHa, per
mantenere più a lungo gli effetti terapeutici. Utile anche l‟utilizzo del danazolo per via vaginale
per ridurre l‟entità degli effetti collaterali, mantenendo le capacità terapeutiche a dosi minori
(200-400 mg/die).
Gestrinone
Il gestrinone è uno steroide trienico, con proprietà antiestrogeniche e antiprogestiniche, è un
derivato sintetico dell‟etinil-nor-testosterone, riduce il volume dell‟utero e ferma le emorragie.
Inoltre,i benefici sono prolungati nel tempo.
La somministrazione è di 2.5-5 mg (per os o ovuli vaginali), 2-3 volte la settimana.
In molte donne il gestrinone induce amenorrea anche per tutta la durata della terapia. Sono stati
riferiti alcuni effetti collaterali, reversibili, associati alla lieve androgenicità, come l‟aumento di
peso, seborrea e acne. Meno comuni l‟irsutismo, raucedine, e aumento della libido, che
coinvolgono solo il 10-20% delle pazienti e dipendono dalla dose e durata del trattamento. Sono
possibili anche alterazioni dei livelli di colesterolo LDL.
Nell‟89% dei casi, dopo una terapia di un anno, le dimensioni dell‟utero si sono mantenute ridotte
per 18 mesi dopo la fine del trattamento. Non sono stati riscontrati effetti collaterali sulla densità
ossea.
Antiprogestinici (RU 486)
RU486, o mifepristone, è uno steroide sintetico con attività antiprogestinica e
antiglucocorticoidea.
E‟ il primo antiprogestinico che abbia un reale utilizzo clinico, e la maggior parte degli studi su
questa nuova classe di farmaci si è basata sull‟uso di RU486.
Sarebbe particolarmente utile possedere un antiprogestinico puro, per quelle patologie che
richiedono un lungo tempo di somministrazione, come l‟endometriosi e il leiomioma, anche se in
questi casi l‟effetto antiglucocorticoideo non è necessario, e forse dannoso.
Gli antagonisti potrebbero agire bloccando la funzionalità recettoriale in molti punti.
Il meccanismo con il quale RU486 produce una modificazione di volume del leiomioma è ancora
sconosciuto. L‟effetto del RU486 sul flusso sanguigno potrebbe essere mediato dalle sue stesse
attività antiprogestiniche e antiglucocorticoidee, o essere imputato ad altri fattori sconosciuti.
I dati sulla tollerabilità del mefipristone sono stati ottenuti da studi riguardanti gli effetti abortivi
del farmaco. Quando presenti, gli effetti collaterali includono nausea, vomito, dolore addominale,
e stanchezza.
I pochi studi disponibili sul trattamento con mifepristone, rivelano una buona efficacia e molti di
loro individuano un simile comportamento, nella riduzione delle dimensioni dell‟utero, con gli
analoghi del GnRH.
Modulatori selettivi dei recettori del progesterone (SPRM)
I SPRM hanno proprietà di agonitsa ed antagonista del progesterone a seconda del tessuto
bersaglio. Ci sono tre diversi tipi di recettori del progesterone a livello intracellulare: α (α
omodimero), β (β omodimero) and αβ (α-β-recettore eterodimero). Ognuno dei SPRM ha una
diversa affinità in relazione alle isoforme dei recettori.
I SPRM hanno evidenziato un‟azione antiproliferativa diretta sull‟endometrio spesso dose
dipendente. A livello cellulare, il progesterone induce la crescita delle cellule
leiomiomatose, come suggerito dall‟aumento dell‟espressione dei markers di proliferazione
durante la fase luteale. L‟azione del progesterone sembra mediata da EGF o IGF-I e
attraverso i recettori dell‟estradiolo; inibisce l‟apoptosi in colture di cellule leiomiomatose e
quindi può contribuire alla crescita del mioma. Queste caratteristiche dei SPRM giustificano
il loro uso nel trattamento dei miomi uterini. E‟ interessante notare che il loro uso non è
associato ad ipoestrogenismo e perdita di osso.
STRATEGIE FUTURE
Somatostatina
Lanreotide (30 mg) è un analogo della somatostatina a lungo effetto, ha mostrato una riduzione
spontanea della secrezione di GH in soggetti sani. E‟ stato sperimentato in 7 donne con miomi
uterini. Dopo 3 mesi di terapia è stata stimata ,ecograficamente, una riduzione significativa del
volume, sia uterino, che del leiomioma, mantenedosi anche a distanza di 3 mesi dalla sua
interruzione.
Lo studio dell‟RNAm di recettori dell‟ormone della crescita (GH) nel miometrio e nei miomi, ha
permesso di ipotizzare un possibile ruolo del GH nello sviluppo dei fibromi.
E‟ probabile che i maggiori effetti anabolici del GH siano mediati da fattori come l‟insulin-like
growth factors (IGFs) e la Somatomedina e che siano prodotti non solo del fegato ma anche di
molti altri tessuti
IGF-I e i suoi recettori sono stati ritrovati sia nel miometrio che nel leiomioma., ma è in
quest‟ultimo che è stata evidenziata maggiore espressione.
SERM
I selective estrogen receptor modulator (SERM) sono modulatori selettivi dei recettori
estrogenaci e rappresentano una nuova classe di farmaci, utilizzata nella osteoporosi
postmenopausale. Essi si legano ai recettori estrogenici e mostrano attività agonista o antagonista
tessuto-specifica.
Raloxifene e tamoxifene, possono inibire l‟attività stimolatoria degli estrogeni e aumentare
l‟espressione dei recettori progestinici. Quindi, agendo come antagonisti estrogenici sul tessuto
miometriale, questa classe di farmaci è ritenuta utile nel trattamento d‟importanti patologie
ginecologiche.
Tali farmaci, impiegati per un anno, hanno mostrato una significativa riduzione dell‟incidenza di
fibromi uterini nel 40-60% dei casi e una riduzione del volume di quelli già esistenti.
Il trattamento con SERMs è stato spesso associato alla formazione di cisti ovariche,
modificazioni endometriali e sintomi come vampate di calore e vertigini, occasionali crampi
muscolari, nausea e gastralgia.
Questi dati pongono dunque il raloxifene tra i farmaci più efficaci nelle donne in post-menopausa
affette da miomatosi uterina.
CONCLUSIONI
Le recenti conoscenze sulla fisiopatologia dei miomi uterini confermano il ruolo degli ormoni
steroidei e dei fattori di crescita sulla loro genesi ed evoluzione. Si stanno sperimentando nuove
strategie per modulare selettivamente l‟azione degli estrogeni e del progesterone.
La perdita di controllo di alcuni geni specifici sul tessuto miomatoso, offre un nuovo spunto di
ricerca su strategie farmacologiche per una terapia genica e per la prevenzione.
Inibire l‟azione dei fattori di crescita sul miometrio sarà l‟obiettivo delle terapie future. Anche gli
analoghi della somatostatina e l‟interferone hanno riscontrato successo ma non sono stati
sperimentati ancora a sufficienza
Tutti questi risultati suggeriscono che il futuro trattamento non chirurgico dei leiomiomi uterini
sarà indirizzato verso il blocco di specifici fattori di crescita che regolano la proliferazione e la
produzione di collagene nelle cellule muscolari lisce uterine
Sono questi i presupposti per rafforzare la terapia non chirurgica dei leiomiomi.
Aborto spontaneo ricorrente
A. Caruso, S. De Carolis, S. Garofalo, A. Botta.
Università Cattolica del Sacro Cuore. Roma
INTRODUZIONE
L‟aborto ricorrente è definito come la presenza di 3 o più eventi consecutivi, ma il termine viene
oggi utilizzato anche per definire una coppia con 2 o più aborti spontanei consecutivi. L‟incidenza
di donne con aborto ricorrente è aumentata negli ultimi decenni; attualmente essa si aggira intorno
al 3 %, rispetto allo 0.8-1 % circa, riferito negli anni passati. Il rischio che possa ripetersi un aborto
spontaneo successivo é pari al 13.5 % dopo 1 episodio, al 24.4 % dopo 2 episodi e al 33.1 % dopo 3
episodi.
Diverse condizioni materne, cliniche o sub-cliniche, possono essere individuate quali fattori
eziologici di aborto ricorrente; tuttavia, circa la metà dei casi rimane ancora inspiegata o “sine
causa”.
CAUSE GENETICHE. Nelle coppie con aborto ricorrente la prevalenza di un genitore portatore di
riarrangiamento bilanciato (traslocazione reciproca e robertsoniana, inversione) è stimata intorno al
3-5%, con una diretta proporzionalità tra il numero di aborti spontanei e la frequenza di
riarrangiamenti cromosomici parentali (1,2, 3).
CAUSE INFETTIVE. Non sono riportati dati convincenti riguardo al ruolo delle infezioni delle vie
genito-urinarie nell‟eziopatogenesi dell‟aborto spontaneo ricorrente. La terapia antibiotica non
sembra influenzare l‟andamento della gravidanza in donne con storia di poliabortività
CAUSE ANATOMICHE. Anomalie congenite uterine. Le più comuni anomalie congenite uterine
sono dovute a difetti di fusione durante l’embriogenesi. E’ stato riferito in letteratura che il 10-30%
delle donne con aborto spontaneo ricorrente possa presentare anomalie congenite dell’utero. Tale
patologia si associa più frequentemente alle perdite fetali del II trimestre di gravidanza. Anomalie
acquisite. I leiomiomi uterini sono da considerarsi causa non frequente di aborto ricorrente; i miomi
sottomucosi ed intracavitari sono ritenuti una possibile causa di perdite fetali ricorrenti.
L’incontinenza cervicale é ritenuta responsabile di circa il 16% degli aborti spontanei del secondo
trimestre.
CAUSE ENDOCRINE. Deficit della fase luteale. Si ritiene che nelle donne con deficit della fase
luteale il corpo luteo produca una quantità di progesterone insufficiente a preparare l‟endometrio
all‟impianto; questo potrebbe dipendere da un eccesso di ormone luteinizzante o anche da uno stato
iperandrogenico. Attualmente il deficit della fase luteale è ritenuto responsabile di aborto spontaneo
ricorrente in una percentuale variabile tra il 10 ed il 40 % (4).
Distiroidismi. E‟ oggi ritenuto poco probabile un nesso tra distiroidismi e patologia abortiva. E‟,
tuttavia, auspicabile un ottimo controllo della funzionalità tiroidea prima di affrontare una
gravidanza. La presenza di anticorpi antitiroide (anti-tireoglobulina, anti-perossidasi tiroidea)
identificati durante la gravidanza iniziale o immediatamente dopo, si associa ad un rischio
aumentato di perdite fetali. Essi rappresentano tuttavia un marker di insuccesso riproduttivo (5).
Sindrome dell’ovaio policistico (PCO).Tale sindrome è stata più spesso correlata a condizioni di
sterilità, piuttosto che di abortività ricorrente, tuttavia la sindrome dell‟ovaio policistico,
diagnosticata con esame ecografico (8, 9), é stata riscontrata nel 36-56 % delle donne con storia di
aborto ricorrente, percentuale significativamente più elevata del gruppo di controllo.
Diabete mellito. E‟ da escludere un nesso tra abortività ricorrente e diabete, se non nelle forme più
gravi e scompensate, che sono poco frequentemente osservate in gravidanza, grazie ad un più
diffuso “compenso pre-concezionale”(6).
Nelle donne con poliabortività l‟esecuzione di una curva da carico con 75 g di glucosio può essere
ritenuta opportuna qualora si sospetti una intolleranza glucidica (ad es. familiarità per diabete,
obesità, PCO, sospetta sindrome da insulino-resistenza etc.).
TROMBOFILIE CONGENITE. Gli stati trombofilici sono un gruppo di disordini genetici della
cascata della coagulazione che comportano un rischio aumentato di trombosi. Le principali
condizioni trombofiliche sono il deficit di proteina C anticoagulante, il deficit di proteina S
anticoagulante, il deficit di antitrombina III, la positività per il fattore V Leiden e la resistenza alla
Proteina C attivata, la mutazione G20210A del gene della protrombina, l‟iperomocisteinemia.
Numerose segnalazioni suggeriscono l‟associazione tra le trombofilie congenite e complicanze
ostetriche, tra cui l‟aborto ripetuto (7,8,9, 10).
Una recente metanalisi (10) ha evidenziato che il Fattore V Leiden, la resistenza alla Proteina C
attivata e la mutazione G20210A del gene della Protrombina, sono associate all‟abortività ricorrente
del 1° trimestre, mentre il Fattore V Leiden, la mutazione G20210A della Protrombina, e il deficit
di Proteina S si associano alle perdite fetali tardive non ricorrenti.
A. CAUSE AUTOIMMUNI. Alcune malattie autoimmuni, come il Lupus eritematoso sistemico
(LES) e la sclerodermia sistemica progressiva, possano essere associate con un‟aumentata incidenza
di aborto ricorrente e di perdite fetali.
B. La sindrome da anticorpi antifosfolipidi è una causa certa di poliabortività (11-12) .
E‟ stata riscontrata occasionalmente una percentuale significativa (circa 15%) di positività per gli
ANA in donne con poliabortività (13). Si é osservato che, in assenza di trattamento specifico,
l’esito delle gravidanze è lo stesso sia nelle donne ANA positive che in quelle ANA negative.
L‟aborto ricorrente può essere una prima manifestazione della malattia celiaca sub-clinica. Le
donne con morbo celiaco non diagnosticato presentano un rischio di aborto ricorrente e di neonati
con basso peso alla nascita di circa 9 volte maggiore rispetto a donne celiache trattate.
La percentuale di aborto in donne celiache diminuisce significativamente dopo una dieta priva di
glutine (14), da ciò ne deriva l‟importanza di identificare tale malattia anche dal punto di vista della
vita riproduttiva.
FATTORE PSICOLOGICO
La prevalenza del fattore psicologico potrebbe, secondo alcuni autori, essere responsabile di una
certa quota di aborto ricorrente. Alcuni studi hanno evidenziato un miglioramento dell‟esito della
gravidanza in donne con storia di aborto ricorrente sottoposte ad un assistenza del tipo “tender
loving care” rispetto a quelle senza questo tipo di assistenza (15).
ABORTO SPONTANEO RICORRENTE SINE CAUSA
La causa dell‟aborto ricorrente rimane sconosciuta in circa il 50% delle coppie affette, pur dopo
aver vagliato un completo iter diagnostico.
Va considerato che le possibilità di avere un nato vivo nella gravidanza successiva oscilla tra il 30 e
l‟80 % dei casi a seconda del numero di aborti, della eventuale presenza di un nato vivo nella storia
ostetrica e dell‟età materna.
BIBLIOGRAFIA
1. Velasquez P, Youlton R: Spontaneous abortion: cytogenetic study of 609 cases. Rav
Med Chil 1997, 125(3): 317-22
2. Pantzar JT, Allanson JE, Kalousek DK, Poland BJ: Cytogenetic findings in 318 couples
with repeated spontaneous abortion: a review of experience in British Columbia. Am J
med Genet 1984; 17(3): 615-20
3. Lasana MC, Hogge WA, Kubic C, Blancato J, Hoffman EP: Higly skewed Xchromosome inactivation is associated with idiopatic recurrent spontaneous abortion.
Am J Human Genet 1999; 65:252-54
4. American College of Obstetricians and Gynecologists. Management of recurrent early
pregnancy loss. Practice Bulletin n.94, 2001
5. Stagnaro-Green A. Thyroid autoimmunity and thr risk of miscarriage. Best Pract Res
Clin Endocrinol Metab. 2004, 18: 267
6. Lididell HS, Sowden K, Farquhar CM: Recurrent miscarriage: screening for polycystic
ovaries and subsequent pregnancy outcome. Aust N Z J Obstet Gynecol 1997; 37:402-6
7. Preston FE, Rosendaal FR, Walker ID, et al.: Increased fetal loss in women with
heritable thrombophilia. Lancet 1996; 348:913-16
8. Lindoff C, Ingermarsson I, Martinsson G, Segelmark M, Thyssel , Astedt B:
Preeclampsia is associated with a reduced response to activated protein C. Am J Obstet
Gynecol 1997; 176:457-60
9. De Carolis S, Ferrazzani S, De Stefano V, Garofalo S, Fatigante G, Rossi E, Leone G,
Caruso A. Inherited thrombophilia: treatment during pregnancy. Fetal Diagn Ther 2006,
21(3): 281-6
10. Robertson L et al. Thrombophilia in pregnancy: a systematic review. Br J Haematol,
2006 Jan;132(2):171-96.
11. De Carolis S, Caruso A, Ferrazzani S, Carducci B, De Santis L, Mancuso S. Poor
pregnancy outcome and anticardiolipin antibodies Fetal Diagn Therapy 1994; 5: 296-299
12. Caruso A, De Carolis S, De Simone N: Antiphospholipid antibodies in obstetrics: new
complexities and sites of action. Hum Reprod Update 1999; 5:267-76
13. Ogasawara M, Kajiura S, Katano K, Aoyama T, Aoki K. Are serum progesterone levels
predective of recurent miscarriage in future pregnancies. Fertil Steril 1997; 68:806-9
14. Gasbarrini A, Sanz Torre E, Trivellini C, De Carolis S, Caruso A, Gasbarrini G:
Recurrent spontaneous abortion and intrauterine fetal growth retardation as symptoms of
coeliac disease. Lancet 2000; 356:399-400
15. Stray-Pedersen B, Stray-Pedersen S: Etiologic factors and subsequent reproductive
performance in 195 couples with a prior history of habitual abortion. Am J Obstet
Gynecol 1984; 148:140
INFERTILITA' FEMMINILE
Prof. Ivo Noci
Centro di Fisiopatologia della Riproduzione umana
Università di Firenze
Come ci dicono i dati ESHRE, una "chiara" causa femminile si ha nel 45 % dei casi di
infertilità di coppia: 27% difetti dell'ovulazione, 14% danno tubarico, 5% endometriosi. Ma in
quell'ulteriore 30% di casi in cui non c'è una apparente spiegazione, e che viene etichettato come
'sine causa' , c'è molto spesso un contributo femminile importante, in termini di malfunzione
tubarica, di endometriosi/adenomiosi minime, di fattore cervicale.
Quindi all'interno della infertilità di coppia si trova molto facilmente una componente
femminile.
Passando da una valutazione negativa (quella della infertilità) ad una positiva (quella della
fertilità), il "contributo" della donna alla fertilità di coppia riguarda i seguenti aspetti:
1. L'ovulazione
2. La qualità ovocitaria
3. L'utero (= la cavità uterina)
4. Le tube
1. LA OVULAZIONE
Indubbiamente, se una donna non ovula, una gravidanza non è possibile.
Ma per poter costituire un problema all'interno della fertilità di una coppia, occorre che la
mancanza di ovulazione sia abituale, cronica. Infatti, come è stato ben codificato dal Royal College
of Obstetrics & Gynecology, anche in donne che presentano mestruazioni regolari (ritmo 25-35
giorni) il 9% dei cicli ovarici sono privi di ovulazione: come dire, quindi, che l'evento
anovulazione è 'normale' che ci sia 1-2 volte all'anno. E' però vero, di massima, che una donna che
mestrua regolarmente, di solito ovula.
Della ovulazione, abbiamo solo prove indirette; tra queste, la determinazione in fase
midluteinica del progesterone è più accurata rispetto a tutti gli altri metodi, compresa la
(stressantissima per la donna) misurazione della temperatura basale. Come suggerito dall'OMS,
valori midluteinici di progesterone > 18 nmol/L sono indicativi di ovulazione, in quanto questo
valore corrisponde al 25° percentile della popolazione esaminata.
Se la nostra paziente non ovula (= presenta una anovulazione abituale, cronica) si può parlare di
fattore ovulatorio di infertilità; e ci si deve indirizzare al diagnostico, perché solo così possiamo
eseguire una terapia specifica ed efficace.
In sintesi, una anovulazione può avere una causa cronica ipotalamica (oligo/amenorrea MAP
negativa, valori di FSH/LH nella norma/bassi, PRL nel range di normalità; accurata diagnosi ad
esclusione di cause anatomiche centrali; terapia, induzione dell'ovulazione singola con FSH + LH);
può essere legata ad una iperprolattinemia (esclusione di adenomi ipofisari; terapia con
dopaminergici); può dipendere da un difetto del feed-back positivo degli estrogeni (oligo/amenorrea
MAP positiva, valori di FSH/LH nella norma, PRL nel range di normalità; terapia, induzione
dell'ovulazione con citrato di clomifene); o, situazione di gran lunga più frequente, può essere
legata ad una PCOS.
La PCOS (polycistic ovary syndrome) è caratterizzata clinicamente da anovulazione cronica
associata a segni clinici di iperandrogenismo; spesso, ma non costantemente, sono anche presenti
obesità e oligomenorrea. Relativamente tipico il pattern endocrino (androgeni >, possibile
inversione del rapporto FSH/LH) così come quello ecografico (iperecogenicità centrale, follicoli
disposti alla periferia dell'ovaio come a corona di rosario). Frequente è la presenza di disturbi
metabolici (iperinsulismo), per cui devono essere sempre cercati (determinazione di glicemia e
insulinemia) e curati. Quanto alla terapia, se c'è tempo (= se la donna è 'sufficientemente' giovane) è
indicata all'inizio una correzione ponderale/metabolica, alla quale deve fare seguito l'induzione
dell'ovulazione con citrato di clomifene, e solo alla fine e in caso di ripetuto fallimento delle misure
precedenti si deve ricorrere all'arma delle gonadotropine esogene. Ovviamente, trattandosi di una
coppia che non riesce ad avere una gravidanza, deve essere studiato anche il marito, e non deve
esserre trascurata una valutazione della pervietà tubarica. Esiste la possibilità di una terapia
chirurgica (resezione a cuneo delle ovaie; 'ovarian drilling') ma la tendenza recente è quella di
ritenerle una misura "estrema", per la inevitabile riduzione del patrimonio follicolare che comporta,
e che non è più ritenuta accettabile.
2. LA QUALITA' OVOCITARIA
Un aspetto che sta emergendo sempre di più come problematica, in relazione all'età sempre più
avanzata in cui si inizia la ricerca di una figlio, è rappresentato dalla qualità ovocitaria. Infatti,
'inutile' che la donna ovuli, se ovula un ovocita di bassa qualità, cioè un ovocita che difficilmente
viene fertilizzato o/e che difficilmente può completare il proprio impianto a causa delle aneuploidie
dell'embrione che si è costituito.
Una quantità sempre più numerosa di letteratura biologica mette in evidenza che dopo i 40 anni
si ha un deterioramento della qualità degli ovociti, dovuto a frammentazione del DNA e ad
anomalie nella formazione del fuso acrosomale.
Facile quindi la diagnosi di bassa qualità ovocitaria: l'età della paziente di 40 o più anni.
Ovviamente, non esiste una terapia valida (ovodonazione, illegale in Italia) anche se la induzione di
una ovulazione multipla può offrire qualche vantaggio: nel senso che di fronte ad un 'pool' di
ovociti ovulati, è possibile che ce ne sia uno di qualità 'sufficiente'.
3. L' UTERO
Abbiamo già detto che parlando di utero dovremmo parlare in realtà di cavità uterina: questo
perchè altri aspetti sono o 'vecchi' o 'troppo nuovi'.
'Vecchi': la insufficienza luteinica (LPD, luteal phase defect). Cavallo di battaglia nella
Medicina della riproduzione degli anni '80, oggi si ritiene o che non esista (difficile ed insicura la
diagnosi: un po' come per il fattore cervicale ed il PCT) o che comunque non sia causa di infertilità
di coppia, ma, forse, di abortività abituale.
'Troppo nuovi': solo recentemente si sta tornando ad analizzare il ruolo di alcune proteine
dell'endometrio nel processo dell'impianto embrionario. Ma tutto questo è solo ricerca clinica, per il
momento.
Tornando allora alla cavità uterina, qualsiasi cosa la deformi può interferire con la fertilità della
donna, costituendo appunto fattore uterino di infertilità. Fibroma uterini sottomucosi, polipi
dell'endometrio, sinechie, malformazioni mulleriane dell'utero : sono le possibili cause di un fattore
uterino, anche se incidono in modo differente. Infatti, mentre le prime tre sono più un ostacolo
all'impianto embrionario e perciò sono cause dirette di non inizio di una gravidanza, l'ultima è più
causa di fallimenti della gravidanza iniziata (aborti, parti pretermine, ritardo di crescita).
Lo strumento diagnostico più adeguato per una corretta valutazione del fattore uterino di
infertilità è rappresentato dall'isteroscopia, anche se sono utili sia la ecografia transvaginale che la
isterosalpingografia.
4. LE TUBE
Data la funzione cruciale svolta dalle tube nelle fasi iniziali di una gravidanza (riserva di
spermatozoi; pick-up ovocitario; fertilizzazione dell'ovocita; 'prima sede' per l'embrione, per 3
giorni) si capisce come una malfunzione tubarica si associ a infertilità. E qui nasce uno dei dilemmi,
o -se vogliamo- dei crucci della Medicina della riproduzione di oggi: quello della funzione delle
salpingi.
Nel senso che dobbiamo contentarci di esami di pervietà tubarica (cioè, e in termini molto
grossolani, tube probabilmente aperte o probabilmente chiuse) quando invece avremmo bisogno di
esami in grado di mostrarci la funzione di queste strutture, cioè molto di più.
Comunque, nel 12-33% delle coppie infertili la donna ha una impervietà tubarica, pur in assenza
di sintomi clinici di infezione pregressa; perciò, la pervietà delle tube deve essere sempre valutata.
Lo studio della pervietà tubarica si pone, di massima, come indagine di secondo livello: nel senso
che è 'inutile' in alcune situazioni cliniche come ad esempio un fattore maschile severo che richieda
una fertilizzazione assistita.
Lo studio della pervietà tubarica si può eseguire con due distinte metodiche: la
isterosalpingografia (ISG) e la videolaparoscopia (VLD).
Come è stato ben codificato dal Royal College of Obstetrics & Gynecology, la decisione se
proporre alla paziente una o l'altra delle due tecniche, dipende dal tipo di rischio di patologia
tubarica che la paziente stessa presenta. Se la donna è ad alto rischio di patologia tubarica, l'esame
di prima scelta è rappresentato dalla VLD; se invece il rischio di patologia tubarica è basso, è
sufficiente la ISG. Un esame più recente, in grado di dare risultati sovrapponibili a quelli della ISG,
che non impiega RX e che si può eseguire in modo molto più agevole e totalmente ambulatoriale è
rappresntatto dalla sonoisteroscopia (SIS). L'unico punto debole della SIS è la soggettività della
lettura, perciò dipende molto dalla cultura e dalla abilità dell'operatore.
Una paziente si definisce ad alto rischio tubarico in presenza di una o più delle seguenti
condizioni: dismenorrea/dispareunia intense; pregressa chirurgia pelvica; utilizzo di IUD; storia
clinica di PID; sterilità decorrente da oltre 3 anni; età 'avanzata' (>35 anni, secondo il Royal
College).
Terapia di elezione di un fattore tubarico è rappresentata dai programmi di fertilizzazione in
vitro; mentre una laparoscopia operativa è riservata ad operatori esperti e solo a situazioni cliniche
particolari.
Induzione dell’ovulazione
V. De Leo, M.C. Musacchio
Clinica Ostetrica e Ginecologica
Università degli studi di Siena
L‟induzione dell‟ovulazione consiste nell‟utilizzo di specifici farmaci somministrati
secondo schemi terapeutici per il trattamento dell‟infertilità nelle donne affette da
anovulazione cronica. Essa viene inoltre utilizzata nelle tecniche di fecondazione
assistita per ottenere numerosi follicoli ed un numero adeguato di ovociti
fertilizzabili.
L‟anovulazione cronica è una condizione che può essere associata a diverse patologie
che causano amenorrea primaria o secondaria. L‟amenorrea primaria è spesso
determinata da patologie ipotalamiche, come la sindrome di Kallmann, in cui si
realizza un ipogonadismo ipogonadotropo causato dalla soppressione della secrezione
pulsatile di GnRH (1). In questi casi l‟induzione dell‟ovulazione può essere
determinata attraverso la somministrazione di GnRH pulsatile o gonadotropine. Il
GnRH viene somministrato attraverso una micropompa ad infusione, con modalità
pulsatile, per via sottocutanea o endovenosa, alla dose di 5-10 g ogni 60-90 minuti.
La durata ottimale della terapia prevede la somministrazione del GnRH fino alla
comparsa della mestruazione o alla positivizzazione del hCG; in alternativa la
terapia può essere sospesa dopo l‟ovulazione ed in questo caso il supporto della fase
luteale si ottiene mediante la somministrazione di hCG (2000 UI) ogni 3 giorni o
progesterone. Per difficoltà organizzative, tuttavia, spesso in tali pazienti l‟ovulazione
viene indotta attraverso la somministrazione di gonadotropine, ricordando che in
questi casi oltre all'‟FSH è necessario somministrare anche LH per indurre
un‟adeguata steroidogenesi e maturità follicolare. Rispetto al trattamento con GnRH
pulsatile, l‟utilizzo delle gonadotropine presenta una maggiore compliance da parte
della paziente ma un rischio maggiore di iperstimolo e di gravidanze multiple (1,2).
Nei casi, invece, di amenorrea ipotalamica funzionale, in cui la soppressione della
produzione del GnRH è determinata dall‟alterazione del controllo neuroendocrino
che si realizza in caso di stress, di esercizio fisico intenso o di malnutrizione, i
farmaci di prima scelta nell‟induzione dell‟ovulazione sono le gonadotropine
ricombinanti o l‟hMG, in associazione a terapie comportamentali e dietetiche (3).
L‟anovulazione cronica associata ad amenorrea secondaria caratterizza, invece, nella
maggior parte dei casi condizioni in cui si realizza un‟iperprolattinemia e la sindrome
dell‟ovaio micropolicistico (PCOS). L‟iperprolattinemia inibisce l‟attività del GnRH
attraverso l‟induzione di una maggiore secrezione di dopamina e oppioidi che
esercitano un effetto inibitorio sull‟asse ipotalamo-ipofisi-ovaio e può essere
determinata da patologie organiche ipotalamiche o ipofisarie, ipotiroidismo,
assunzione di farmaci che bloccano i recettori della dopamina o ne impediscono la
ricaptazione. In presenza di patologie organiche la somministrazione di farmaci
dopaminoagonisti come la bromocriptina o la cabergolina è in grado di ridurre i
livelli di prolattina e di ripristinare la funzione gonadica. In particolare, la
cabergolina, alla dose di 0.25-2.0 mg/settimana, è meglio tollerata della
bromocriptina e induce meno effetti collaterali (4).
La sindrome dell‟ovaio micropolicistico è una patologia in cui l‟anovulazione cronica
è spesso associata ad oligoamenorrea, irsutismo ed acne. Inoltre, la maggior parte di
queste pazienti presenta insulino-resitenza ed obesità. L‟induzione dell‟ovulazione in
questo caso prevede atteggiamenti diversi in base al BMI e alla presenza o meno
dell‟insulino-resitenza (5,6).
Il clomifene citrato è il farmaco maggiormente utilizzato nel trattamento
dell‟induzione dell‟ovulazione nelle donne affette da PCOS e sicuramente il farmaco
di prima scelta nelle pazienti con PCOS magre non insulino-resitenti. Si tratta di un
antiestrogeno il cui principale meccanismo d‟azione sembra essere legato
all‟aumentata produzione di gonadotropine FSH e LH da parte dell‟ipofisi. E‟ di
solito somministrato alla dose di 50-200 mg nei primi 5-10 giorni del ciclo per 3-6
cicli di trattamento. Il clomifene induce l‟ovulazione in circa l‟80% delle donne
affette da PCOS, ma soltanto il 30-40% di queste otterrà la gravidanza. Questa
discrepanza sembra essere il risultato dell‟effetto antiestrogenico esercitato dal
farmaco sull‟endometrio e sulla produzione di muco cervicale (6).
Nelle pazienti obese con PCOS la perdita di peso corporeo del 5-10% è in grado di
indurre cicli ovulatori nel 55-100% delle pazienti nell‟arco di 6 mesi, e per questo
motivo dovrebbe essere considerata la terapia di prima scelta (6). In tali pazienti,
inoltre, come in quelle insulino-resistenti, ottimi risultati si sono ottenuti con la
somministrazione di farmaci insulinosensibilizzanti, come la metformina e i
tiazolidinedioni. Un‟incidenza di gravidanza del 39% è stata riportata quando la
metformina è usata come unica terapia (7), mentre la gravidanza si è verificata
nell‟89% dei casi quando è stata somministrata in associazione con clomifene citrato
nelle donne obese con PCOS clomifene resistenti (7).
Nei casi in cui non c‟è risposta al trattamento con clomifene e metformina si impone
l‟impiego terapeutico dell‟FSH esogeno secondo i protocolli terapeutici step-up o
step-down. Il protocollo step-up prevede la somministrazione di FSH a dosi crescenti.
Questo protocollo comporta lo sviluppo contemporaneo di più follicoli ed anche un
rilevante rischio di provocare una sindrome da iperstimolazione ovarica (OHSS). Il
protocollo step-down, invece, è stato elaborato con lo scopo di “mimare”
l‟andamento dell‟FSH endogeno nella fase follicolare. Si inizia somministrando alte
dosi di FSH che vengono poi dimezzate durante il reclutamento ed accrescimento dei
follicoli ovarici. Rispetto allo step-up, lo step-down garantisce l‟impiego di minori
quantità di FSH, una minore durata del trattamento, ed una più bassa incidenza di
OHSS. Recentemente è stato dimostrato che la terapia combinata metformina-FSH
sembra essere associata ad una risposta dell‟ovaio più fisiologica con un minor
reclutamento follicolare ed una più bassa incidenza di OHSS (8). Inoltre, l‟impiego
combinato FSH-metformina sembra essere correlato ad una migliore qualità degli
ovociti e degli embrioni nelle donne che si sottopongono a FIVET (9).
Per quanto riguarda le tecniche di procreazione assistita, l‟induzione della
superovulazione è finalizzata all‟ottenimento di una crescita multifollicolare. In
questi casi la scelta tra i diversi protocolli terapeutici tiene conto, oltre all‟eventuale
presenza delle patologie già menzionate, anche dell‟età della donna (< o > 35 anni) e
dei valori basali di FSH (< o > 10 mUI/ml).
Per le pazienti che devono sottoporsi a rapporti mirati o inseminazione intrauterina
con età < ai 35 anni e FSH < 10 mUI/ml l‟induzione dell‟ovulazione viene effettuata
con clomifene citrato o con gonadotropine a basse dosi (75-150 UI) fino alla
somministrazione di hCG. Nelle pazienti di età superiore o con FSH più alto è
consigliabile invece utilizzare dosaggi di gonadotropine più alti e secondo alcuni
aggiungere LH (10).
Nella superovulazione per tecniche FIVET/ICSI, invece, l‟obiettivo principale è
controllare il picco endogeno di LH al fine di prevenire la luteinizzazione precoce e
la deiscenza non controllata dei follicoli, in modo da ottenere un numero adeguato di
ovociti fertilizzabili. A tal fine si possono utilizzare farmaci agonisti o antagonisti del
GnRH in associazione con i farmaci induttori (11).
Gli agonisti del GnRH sono composti di sintesi strettamente correlati alla struttura
chimica dello stesso. L‟effetto degli agonisti del GnRH si manifesta in due tempi:
fase stimolatoria (flare-up), la cui durata è di 1-2 settimane, che induce elevate
concentrazioni di FSH, LH e di estrogeni; fase soppressiva durante la quale si
raggiunge la desensibilizzazione dell‟ipofisi con riduzione della produzione delle
gonadotropine e degli steroidi gonadici. I differenti protocolli terapeutici attraverso i
quali possono essere utilizzati si basano proprio sul loro duplice meccanismo
d‟azione: protocollo lungo, in cui gli agonisti sono somministrati in fase luteale
media del ciclo precedente la stimolazione; protocollo corto, in cui gli agonisti
vengono somministrati in fase follicolare precoce contemporaneamente alle
gonadotropine fino al giorno dell‟hCG; protocollo ultra-corto, in cui gli agonisti
vengono somministrati contemporaneamente alle gonadotropine nella fase follicolare
precoce e interrotti dopo tre giorni. Il protocollo più utilizzato è quello lungo, che
determina l‟eliminazione del picco preovulatorio di LH, una bassa concentrazione di
androgeni, lo sviluppo di un maggior numero di follicoli, un miglior tasso di
gravidanze e una migliore programmazione dei cicli di stimolazione. Gli svantaggi
sono rappresentati da una maggiore durata dei cicli di stimolazione, un alto dosaggio
delle gonadotropine utilizzate, un rischio non trascurabile di iperstimolazione ovarica
e una possibile comparsa dei sintomi da privazione estrogenica (11).
Gli antagonisti del GnRH, introdotti nei protocolli di stimolazione più recentemente,
somministrati in dosi multiple o singole durante la fase follicolare tardiva dei cicli di
stimolazione con gonadotropine (6° giorno del ciclo o quando il follicolo maggiore
raggiunge il diametro medio di 14-13 mm) bloccano i recettori ipofisari per il GnRH
determinando una più rapida e completa inibizione della secrezione di LH. Questo
può determinare il recupero di un minor numero di ovociti rispetto ai protocolli con
GnRH agonisti ma, secondo alcuni autori, di migliore qualità (12,13). Inoltre, i
protocolli che prevedono l‟utilizzo dei GnRH-antagonisti prevedono, rispetto
all‟impiego degli agonisti secondo il protocollo lungo, una minore durata e dosi
minori del trattamento con gonadotropine, un numero inferiore di follicoli sviluppati
il giorno del pick-up ovocitario e quindi la riduzione dell‟incidenza della sindrome di
iperstimolazione ovarica e degli effetti collaterali legati al deficit estrogenico
(11,14,15). Per quanto riguarda il pregnancy rate diversi studi che hanno confrontato
gli agonisti con gli antagonisti non hanno rilevato differenze significative
nell‟utilizzo dei due farmaci (16-18). Nelle poor responders, tuttavia, cioè quelle
pazienti in cui si realizza la formazione di 4 follicoli o i livelli massimi di E2 non
superano i 500 pg/ml per ciclo di stimolazione, oppure in cui i livelli basali di FSH
sono superiori a 25 mUI/ml, alcuni autori raccomandano l‟utilizzo degli antagonisti
per l‟assenza di desensibilizzazione ipofisaria (11).
Per quanto riguarda le gonadotropine, sono disponibili gonadotropine urinarie, come
quelle menopausali umane (hMG) ottenute da urine di donna in postmenopausa (75
UI di FSH e 75 UI di LH), FSH urinario (75 UI di FSH e meno di 1 UI di LH), HCG
urinario ad azione prevalentemente LH simile e gonadotropine ricombinanti che
contengono esclusivamente FSH, LH o hCG ottenuti con tecniche di DNA
ricombinante. Attualmente si tende sempre più a utilizzare protocolli in cui la dose
delle gonadotropine viene modulata a seconda della risposta individuale della
paziente, fino ad arrivare alla sospensione dell‟induzione e alla somministrazione di
hCG, quando i livelli di estradiolo raggiungono livelli maggiori di 800 e inferiori a
1500 pg/ml e si osservano almeno due follicoli di diametro = o > ai 15-20 mm (10,
11).
Per quanto riguarda il tipo di gonadotropine da utilizzare, recenti evidenze indicano
nell‟FSH ricombinante il farmaco di scelta per un minor numero di fiale da utilizzare
e tempi più brevi di risposta ovarica (10,11).
Bibliografia
1) The Practice Committee of the American Society for Reproductive Medicine.
Current evaluation of amenorrhea. Fertil Steril 2004;82(suppl 1): S33-9.
2) Master-Hunter T, Heiman DL. Amenorrhea: evaluation and treatment. Am Fam
Physician 2006; 73(8): 1374-82.
3) Kalantaridou S, Makrigiannakis A, Zoumakis E, Chrousos G. Stress and the
female reproductive system. J Reprod Immunol 2004;62(1-2):61-8.
4) Ascoli P, Cavagnini F. Hypopituitarism. Pituitary 2006;9(4):335-42.
5) Carmina E, Lobo RA. Polycystic ovary syndrome (PCOS): arguably the most
common endocrinopathy is associated with significant morbidity in women. J Clin
Endocrinol Metab 1999; 84:1897–1899.
6) De Leo V, La Marca A, Petraglia F. Insulin-lowering agents in the management of
polycystic ovary syndrome. Endocr Rev 2003; 24, 633-667.
7) Nestler JE et al. Effects of metformin on spontaneous and clomiphene-induced
ovulation in the polycystic ovary syndrome. N Engl J Med 1998;338:1876-80.
8) De Leo V et al Effects of metformin on gonadotrophin-induced ovulation women
with polycystic ovary syndrome. Fertil Steril 1999; 72: 282-285.
9) Stadtmauer LA et al Metformin treatment of patient with polycystic ovary
syndrome undergoing in vitro fertilization improves outcomes and is associated
with modulation of the insulin-like growth factors. Fertil Steril 2001; 75: 505-509.
10)H. Al-Inany, M. Aboulghar, R. Mansour and G. Serour, Meta-analysis of
recombinant versus urinary derived FSH an update, Hum Reprod 18 (2003), pp.
305–313.
11) Muasher SJ, Abdallah RT, Hubayter ZR. Optimal stimulation protocols for in
vitro fertilization. Fertil Steril 2006;86 (2):267-73.
12) Liu HC, Lai YM, Davis O, Berkeley AS, Graf M, Grifo J et al. Improved
pregnancy outcome with gonadotropin releasing hormone agonist (GnRH-a)
stimulation is due to the improvement in oocyte quantity rather than quality. J
Assist Reprod Genet 1992; 9:338-342.
13) Takahashi K, Mukaida T, Tomiyama T, Goto T, Oka C. GnRH antagonist
improved blastocyst quality and pregnancy outcome after multiple failures of
IVF/ICSI-ET with a GnRH agonist protocol. J Assist Reprod Genet 2004; 21:31722.
14) Olivennes F, Cunha-Filho JS, Fanchin R, Bouchard P and Frydman R The use of
GnRH antagonists in ovarian stimulation. Hum Reprod Update 2002; 8:279-290.
15) Tarlatzis BC, Fauser BC, Kolibianakis EM, Diedrich K, Rombauts L, Devroey P.
GnRH antagonists in ovarian stimulation for IVF. Hum Reprod Update 2006; 12:
333-340.
16) European Orgalutran Study Group. Treatment with the gonadotropin-releasing
hormone antagonist ganirelix in women undergoing ovarian stimulation with
recombinant follicle stimulating hormone is effective, safe and convenient results
of a controlled, randomized, multicentre trial, Human Reprod 2000; 15 1490–
1498.
17) European and Middle East Orgalutran Study Group. Comparable clinical
outcome using the GnRH antagonist ganirelix or a long protocol of the GnRH
agonist triptorelin for the prevention of premature LH surges in women
undergoing ovarian stimulation. Hum Reprod 2001; 16,644-651.
18)North American Ganirelix Study Group. Efficacy and safety of ganirelix acetate
versus
leuprolide
acetate
in
women
hyperstimulation. Fertil Steril 2001; 75: 38–45.
undergoing
controlled
ovarian