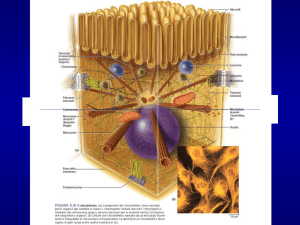
Il Citoscheletro
Conferisce alla cellula
• La capacità di muovere materiale/vescicole ecc.
• Organizzazione organelli all’interno
• Resistenza alla pressione
• Morfologia definita
• Divisione cellulare
• Movimento cellulare
Struttura non statica ma altamente dinamica
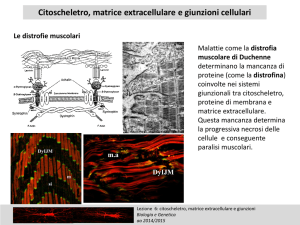
Filamenti intermedi si ancorano ai desmosomi
Distribuiti in tutto il volume della cellula e formano un reticolato che abbraccia
il nucleo.
Sono i più robusti: in grado di sopportare tensioni meccaniche da stiramento.
Alla periferia si attaccano alla membrana plasmatica in corrispondenza di
giunzioni tra cellule chiamate desmosomi: unione giunzionale tra membrane
plasmatiche sul lato esterno di cellule adiacenti.
Testa globulare
Filamenti intermedi
Coda globulare
I domini globulari interagiscono con altre strutture nel citosol
Plectina che lega i filam intermedi a microfilamenti di actina e ai microtubuli
In queste cellule esaminate a EM i filamenti di actina sono stati rimossi.
Proteina plectina verde si intercala tra microtubuli rossi e filamenti intermedi azzuri
Filamento
intermedio
plectina
microtubulo
Filamenti intermedi della lamina nucleare
• Sono costituiti da LAMINE
• Nucleo si disgrega nella divisione cellulare insieme alla lamina
anche che viene fosforilata, mentre la defosforilazione al termine
della divisione le fa riassociare assemblare.
• Fosfo-defosforilazione TESTE GLOBULARI dei filamenti
intermedi
• Mutazioni genetiche associate a mancanza di lamine
- Progeria invecchiamento precoce da danno al nucleo,
apoptosi generalizzata
- Neuropatie
- Cardiomiopatie
Sam Burns
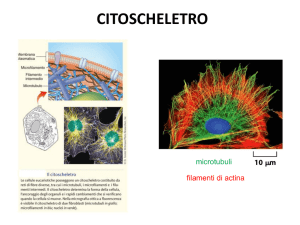
Microtubuli
Centro organizzatore di microtubuli
Centrosoma, parte del fuso mitotico
Componenti di ciglia e flagelli
Il Citoscheletro
•
•
•
•
•
•
•
•
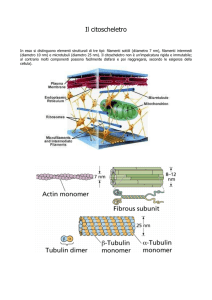
I microtubuli sono cilindri cavi e rigidi, formati per polimerizzazione di subunità dimeriche di
tubulina. Sono strutture dotate di polarità, avendo una estremità "meno" a crescita relativamente
lenta e una estremità "più" a crescita relativamente rapida.
I microtubuli trovano come punto di nucleazione appositi centri organizzatori, come il centrosoma,
da cui crescono verso l'esterno. Le estremità meno dei microtubuli sono immerse in questo centro
organizzatore.
Molti microtubuli cellulari si trovano in uno stato labile e dinamico, in cui si alternano fasi di
allungamento a fasi di accorciamento. Queste transizioni, chiamate nel complesso instabilità,
dinamica, dipendono dall'idrolisi del GTP legato ai dimeri di tubulina.
Ogni dimero di tubulina porta legata strettamente una molecola di GTP che si idrolizza a GDP
dopo che la tubulina ha polimerizzato nel microtubulo. L'idrolisi di GTP riduce l'affinità tra
dimeri adiacenti e quindi la stabilità del polimero facendolo dissociare a una estremità.
I microtubuli possono essere stabilizzati da proteine che catturano l'estremità più: questo
fenomeno influenza la disposizione dei gruppi di microtubuli nella cellula.
Le cellule contengono molte proteine che si associano ai microtubuli, li stabilizzano, li legano ad
altri componenti cellulari e li adattano a funzioni specifiche.
Le chinesine e le dineine sono proteine motrici che utilizzano l'energia di idrolisi dell'ATP
per spostarsi unidirezionalmente lungo i microtubuli. Esse trasportano vescicole
membranose specifiche ed altri carichi, mantenendo in questo modo l'organizzazione spaziale del
citoplasma.
Le ciglia e i flagelli eucariotici contengono un fascio di microtubuli stabili. Il loro battito si deve al
piegamento dei microtubuli, prodotto da una proteina motrice detta dineina ciliare.
Estremità
beta tubulina-più
in accrescimento
Beta tub
Estremità
alpha tubulina-meno
accresce lentamente
centrosomi fatti di una matrice di proteine su cui sono adagiate strutture
ad anello composte da tubulina gamma. Al centrosoma è attaccata
l’estremità meno (alpha tubulina), mentre la più in accrescimento è diretta
e polimerizza verso la periferia. Nei centrosomi ci sono anche i centrioli
composti da un cilindretto di microtubuli più corti.. e sono orientati
perpendicolarmente tra loro
• I MT accrescono o si accorciano rapidamente secondo
un’instabilità dinamica
• Dai centri di nucleazione sul centrosoma si dipartono a raggiera
una serie di MT in allungamento estremità + e altrettanti si
depolimerizzano verso l’estremità -.
• Solo se estremità più è ancorata ad un organello o coniugata con
una proteina che ne impedisce la depolimerizzazione il MT è
stabile (capping proteins, cappuccio)
COLCHICINA impedisce la polimerizzaizone, lega dimeri liberi di tubulina
VINCRISTINA VINBLASTINA lo stesso
farmaci anti-tumorali ANTIMITOTICI
TAXOLO impedisce la depolimerizzazione, si salda ai MT polimeri
INSTABILITA’ DINAMICA
CIGLIA
•
•
•
•
0,25 micron di diametro
Rivestite da membrana plasmatica
Ciglia epitelio del tratto respiratorio umano sospinge corpi estranei
polveri ecc in gola per farle smaltire dall’apparato digerente
eliminandole dal corpo. Concentrazione di miliardo di ciglia per
centimetro quadrato.
Spostano fluidi
Epitelio ciliato che riveste le vie respiratorie
Flagello
Flagello sezione trasversale in EM
MT disposti in 9 periferici e 2 centrali
Ciascuno dei periferici è composto da 2 MT a cui sono associate due file di molecole di dineina
che prendono contatto con il doppietto di MT adiacenti e li fanno slittare uno sull’altro
e il flagello si flette
Microvilli cellula
Epitelio intestinale
Protrusioni sulle superficie
Per movimento
Fasci contrattili
citoplasmatici
Anello contrattile per la
Divisione cellulare
Citodieresi
Il Citoscheletro
•
•
•
•
•
•
•
•
I filamenti actinici sono polimeri elicoidali formati da molecole di actina. Sono più flessibili dei
microtubuli e spesso si osservano disposti in fasci o reti annesse alla membrana plasmatica.
I filamenti actinici sono strutture polarizzate con un capo a crescita rapida e uno a crescita lenta;
allungamento e accorciamento sono controllati tramite l’idrolisi dell’ATP legato a ciascun
monomero actinico.
La versatilità funzionale dei filamenti actinici nella cellula dipende da numerose proteine che
legano l’actina. Esse controllano la polimerizzazione dei filamenti actinici, legano trasversalmente
i filamenti in reti lasse o in fasci rigidi, li attaccano alle membrane e li spostano uno rispetto
all’altro.
Una rete di filamenti actinici sotto la membrana plasmatica forma il cortex cellulare, responsabile
della forma e dei movimenti di superficie, compresi quelli che avvengono quando la cellula striscia
lungo una superficie.
Tutta una serie di proteine che legano l'actina è necessaria per far procedere il margine guida di
una cellula migrante, per farla aderire al substrato e farle spostare la sua massa dal margine
posteriore in avanti. Tutti questi processi sono innescati da stimoli che agiscono via proteine che
legano GTP.
Le miosine sono proteine motrici che usano l'energia di idrolisi dell'ATP per spostarsi lungo i
filamenti actinici; esse possono usarli come cremagliere per trasportare organelli o farli scorrere
uno sull'altro nei fasci contrattili.
Nel muscolo, filamenti di actina e miosina in gran numero, allineati e sovrapposti, generano la
contrazione scorrendo gli uni sugli altri.
La contrazione muscolare viene innescata da un rialzo improvviso della concentrazione citosolica
di Ca2+, che manda un segnale all'apparato contrattile tramite proteine che legano ioni calcio.
Estremità più e meno. Come per i MT, il legame di un monomero di actina a
cui è associato ATP è più veloce dell’idrolisi di ATP ad ADP che rende la
catena instabile e favorisce la dissociazione. Quindi il filamento si accresce.
La polimerizzazione a differenza dei MT dipende dalla concentrazione di
monomeri di actina:
• se la conc. libera è alta accrescimento sia all’estremità più che alla meno.
• se la conc. libera è intermedia si accresce solo l’estremità più e la meno
viene idrolizzata con ADP.
Dato che ADP destabilizza, il filamento perde subunità al meno mentre si
accresce alla più. Quindi un singolo monomero si sposta dalla più alla meno
questo movimento viene detto TREADMILLING.
Quindi il filamento actina può rimanere di lunghezza costante se la velocità di
assemblaggio è uguale al disassemblaggio alla meno. Mentre i MT sono più
dinamici nel senso che la loro lunghezza può variare più drasticamente
• Falloidina stabilizza l’actina impedendone la
depolimerizzazione
• Latrunculin si lega ai monomeri e impedisce la
polimerizzazione
• Actina libera è sempre molta (metà della concentrazione, 5%
delle proteine totali).
• Abbiamo detto che se la conc. di monomeri è alta si ha
polimerizzazione alle due estremità. Come mai non si
polimerizza tutta quella libera?
• Ci sono delle proteine tipo PROFILINA che si legano ai
monomeri impedendone la polimerizzazione. Esistono altre
proteine invece che promuovono la polimerizzazione tipo le
Arp2/3 e formins
Profilina
Rho GTPasi
Plasma membrane and leading edges: acBn filaments RhoA ROCK Rac1 PAK PI4-­‐5 K cdc42 WAVE N-­‐WASP Dia Par6/PKC IQGAP gCOP RalA PI4,5P2 Myosin II LIMK cofilin Arp2/3 clip170 Lgl Ac8n polym Lamellipodia Ac8n polym GSK/APC Ac8n polym Filopodia MT Memb Trafficking Myosin/Ac8n filaments Golgi orient Centrosome orient Sec5/6 Par3 Fibra muscolare
È una cellula-sincizio
La triade nella cellula muscolare
Ganglio DRG
Sensitivo dorsale
Nervi cranici
Motorio ventrale




![[ XI ] INDICE GENERALE Riconoscimento e interazioni tra cellule](http://s1.studylibit.com/store/data/001175494_1-9062ea75af318561914dbe68aa0e27ca-300x300.png)