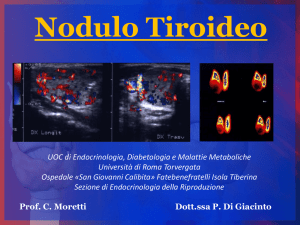
Patologia Sistematica II
Fisiopatologia della tiroide
Costanzo Moretti
Unità di Endocrinologia
Fatebenefratelli - Isola Tiberina
(3,5 – 4 mm)
Embriologia ed ontogenesi
La filogenesi, embriogenesi ed alcuni aspetti della
funzione tiroidea sono strettamente interconnessi
con il tratto gastrointestinale
Questo
Q
t peduncolo
d
l allungandosi
ll
d i
formerà il dotto tireoglosso che nel
corso dello sviluppo andrà a
dissolversi frammentandosi circa
due mesi dopo il concepimento
Nel punto di origine del dotto tireoglosso resta una
piccola fossetta alla giunzione del terzo mediale e
posteriore della lingua il foramen caecum.
Le cellule della parte inferiore del dotto si
differenziano in tessuto tiroideo formando il
lobo piramidale della ghiandola
Da un punto di vista funzionale le cellule
acquisiscono la capacità di formare
tireoglobulina al 29 giorno di gestazione
mentre la capacità di concentrare iodio e
sintetizzare tiroxina iniziano verso la 11
settimana in modo TSH-indipendente.
TSH indipendente. La
organizzazione del feed-back HPT si
verifica intorno alla 26 sett di gravidanza
Principali sedi di
t
tessuto
t tiroideo
ti id
ectopico per errori
di riassorbimento
del dotto
tireoglosso
g
Il peso è tra 15 e 25 gr
Il flusso sanguigno
varia tra 4 e 6 ml
minuto per grammo di
tessuto
Ruolo di T3 e T4 nella controregolazione di TRH e TSH
Il follicolo tiroideo
200 µm
• La funzione della ghiandola tiroide è quella di generare la
quantità di ormone tiroideo necessaria per venire incontro alla
domanda dei tessuti periferici
• Questo
Q esto richiede
ichiede l’uptake
l’ ptake giornaliero
gio nalie o da parte
pa te della tiroide
ti oide di
sufficienti quantità di iodio e la loro ossidazione grazie alle
tireoperossidasi (TPO) per consentire la sintesi di circa 110 nmol
(85 µg) di tiroxina (T4) che a sua volta richiede la sintesi di
appropriate quantità di un omodimero glicoproteico di 660 kd la
tireoglobulina
• La tiroglobulina contiene specifici residui di tirosina che sono
iodinati alla p
porzione apicale
p
delle cellule follicolari tiroidee p
per
formare mono e diiodotirosina (DIT)
pp
catalizzato dalle TPO di 2 molecole di DIT
• L’accoppiamento
porterà alla formazione della tiroxina (T4) che insieme alla
triiodotirosina (T3) viene accumulata nella colloide
St tt
Struttura
del
d l TRH
Ingrandimento di una
a to adiog afia di ibridazione
autoradiografia
ib ida ione
in situ di RNAm di proTRH nel
nucleo paraventricolare (NPV)
di animali eutiroidei e
ipotiroidei
Sistema di regolazione del setpoint per la controregolazione della sintesi di RNAm
per il proTRH nei neuroni ipofisiotrofici del NPV in condizioni di digiuno
Struttura
St
tt
del
d l gene che
h codifica
difi per lla catena
t
beta
b t del
d l
TSH e mutazioni riscontrate in pazienti affetti da
ipotiroidismo congenito centrale
Principali fattori che interagiscono nella regolazione di
sintesi e secrezione di TSH
stimolazione
inibizione
Fattori coinvolti nella sintesi di TSH
Agenti stimolanti
Thyrotropin releasing hormone (TRH)
Thyrotropin-releasing
Prostaglandins (?)
α-adrenergic agonists (? Via TRH)
Opioids (humans)
Arginin-vasopressin (AVP)
Glucagon-like peptide 1 (GLP-1)
Galanin
Leptin
Glucocorticoids (in vitro)
Agenti inibenti
Thyroid hormones and analogues
Dopamine
p
Gastrin
Opioids (rat)
Glucocorticoids (in vivo)
Serotonin
Cholecystokinin (CCK)
Gastrin-releasing peptide (GRP)
V
Vasopressin
i (AVP)
Neuropeptide Y (NPY)
Interleukin 1β and 6
T mo necrosis
Tumor
nec osis facto
factor α
cinetica dello ioduro I-
Blood
Organificazione dello iodio
Ossidazione TPO-mediata
TPO mediata dello ioduro ed
incorporazione dei prodotti intermedi nelle
iodotirosine ormonalmente inattive MIT e
DIT
COUPLING
Ormoni tiroidei nei
tessuti periferici
Azione sulla cellula
bersaglio
PATOLOGIA EUFUNZIONALE
Il 4-7%
4 7% della popolazione adulta presenta un nodulo tiroideo
palpabile. 1 su 20 di questi è maligno (2-4 ogni 100.000
persone/anno corrispondenti all’1% di tutti i tumori)
80% noduli colloidi,
cisti, tiroiditi
Nodulo clinicamente apparente
6 4%
6.4%
1.5%
10 15% noduli
10-15%
follicolari
5% neoplasie
INCIDENZA
Nodulo clinicamente apparente
6.4%
1.5%
Nodulo clinicamente nascosto
• In differenti studi ecografici il 50% di soggetti
negativi all
all’esame
esame clinico sono affetti da
almeno un nodulo della tiroide (Hegedus L.
NEJM 2004)
• In differenti studi autoptici il 37
37-57%
57% di soggetti
presenta noduli della tiroide (Rice CO Arch Surg
1932)
• In pazienti con un singolo nodulo il 20-48% ne
presenta altri all’esame ecografico (TAN GH Ann
Intern Med 1984)
Principali cause di presenza di noduli tiroidei
Benigni
•Gozzo semplice multinodulare
•Tiroidite linfocitaria di Hashimoto
•Cisti colloide semplice
•Cisti emorragica
•Adenoma follicolare
macrofollicolari
microfollicolari
•Adenoma a cellule di Hurthle
Maligni
•Carcinoma papillifero
•Carcinoma follicolare
minimamente o largamente
invasivo
a cellule di Hurthle
•Carcinoma midollare
•Carcinoma anaplastico
•Linfoma primario della tiroide
•Carcinoma metastatizzato
In soggetti eutiroidei con nodulo solitario
sospettare
p
un carcinoma
Elevato sospetto
1.
2.
3.
4.
5
5.
Storia familiare di carcinoma midollare della tiroide o di
neoplasia endocrina multipla
Nodulo molto fisso alla palpazione che non è mobile rispetto
alle strutture adiacenti
Paralisi delle corde vocali
Linfoadenopatia regionale
M t t i a distanza
Metastasi
di t
Moderato sospetto
1.
2.
3
3.
4.
5.
Età maggiore di 20 e minore di 70 anni
Sesso maschile
Storia di irradiazione della testa e del collo
Nodulo superiore a 4 cm di diametro
Sintomi di compressione, inclusa disfagia, disfonia,
raucedine dispnea e tosse
raucedine,
Patogenesi
Cellula follicolare tiroidea
Vantaggio di crescita
1
ONCOGENI
2
GENI TUMORE
SOPPRESSIVI
Nodulo tiroideo tossico
TSH
TSH-R
AC
Gs
GTP
GPD
ATP
cAMP
PKA
Proliferazione
(divisione cellulare)
G-GTP
GTPasi
G-GDP
N
Sintesi di T3 e T4
P
Citoplasma
Cellula follicolare tiroidea
Nodulo tiroideo tossico
?
TSH-R
AC
Gs
GTP
GPD
ATP
cAMP
PKA
Aumento della
velocità di
divisione cellulare
G-GTP
GTPasi
G-GDP
N
Aumento della
sintesi di T3 e T4
P
Citoplasma
Cellula follicolare tiroidea
Nodulo tiroideo tossico
TSH
TSH-R
AC
Gs
GTP
Arg201
Glu227
GPD
ATP
cAMP
PKA
Aumento della
velocità di
divisione cellulare
G-GTP
GTPasi
G-GDP
N
Aumento della
sintesi di T3 e T4
P
Citoplasma
Cellula follicolare tiroidea
Carcinoma papillifero
TSH
TSH-R
AC
Gs
RET
NTRK1
Neurotrophic factor R
NGF- R
ATP
TK ++
Errore nel
meccanismo di
divisione cellulare
G-GTP cAMP
PKA
N
Citoplasma
Cellula follicolare tiroidea
Oncogeni e Geni tumore soppressivi nelle neoplasie tiroidee
Neoplasie
Anomalia genica
Anomalie geniche di
incerta importanza
Nodulo funzionalmente autonomo
Mutazione attivante il TSH-R o
Mutazione Gsα che diminuidce la
attività GTPasica
Nodulo colloide
Nodulo monoclonale?
Adenoma follicolare
Mutazioni del protoncogene RAS
Overespressione di c-myc e c-fos
Anormalità di PTEN
Carcinoma papillifero
Riarrangiamento di RET
(RET/PTC) – riarrangiamento di
NTRK1 (TRK) Mutazione attivante
BRAF (V599E)
Ipermetilazione RASSF1A tumor
Carcinoma follicolare
Fusione PAX8-PPAR gamma
Mutazioni attivanti RAS
Frequenti sequenze tumorespecifiche LOH nel genoma
Carcinola anaplastico
Mutazioni attivanti P53 tumor
Carcinoma midollare
suppression gene
Mutazioni attivanti RET
suppression gene
Valutazione laboratoristica
Soppresso?
TSH
Elevato?
FT3
FT4
FT3
FT4
ABTPO
ABTG
Tireoglobulina, Calcitonina
IMAGING
1
Scintigrafia
I123
I131
Technezio-pertecnetato99m
IMAGING
2
Ecografia
1.
2.
3.
Identifica accuratamente noduli non palpabili
Valuta il volume dei noduli
Differenzia le cisti semplici a basso potenziale
di malignità dai noduli solidi che presentano
un 5% di rischio di malignità
Paziente con nodulo tiroideo
ECO
TSH plasmatico
normale
soppresso
pp
SCINTIGRAFIA
FNAC
Maligno
5%
Sospetto
10%
Chirurgia
Nodulo
Ipercaptante
Benigno
70%
ND
15%
Follow-up
Osservazione
ogni 6 mesi
Trattamento
131I