I tumori del Distretto
Cervico - Cefalico
Dr Antonio Frassoldati
Maggio 2012
Neoplasie Testa – Collo
(Classificazione Anatomica)
ü Cavità nasali – seni paranasali
ü Faringe (Rinofaringe – Orofaringe – Ipofaringe)
ü Laringe ( Sovraglottica – Glottica – Sottoglottica)
ü Cavità orale
ü Ghiandole salivari
90% Ca Spinocellulari
Melanomi
Linfomi
10% Sarcomi
Altri istotipi
Neoplasie Testa – Collo
(Classificazione Terapeutica)
ü Cavità nasali – seni paranasali
ü Rinofaringe
ü Laringe ( Sovraglottica – Glottica – Sottoglottica)
Faringe (Orofaringe – Ipofaringe) Cavità orale
ü Ghiandole salivari
Tumori del Rinofaringe
Tumori del Rinofaringe: incidenza/mortalità
ü
0.6 % di tutte le neoplasie (65.000 nuovi casi/anno in tutto il mondo)
ü
Insorge nella popolazione più giovane, inclusi i bambini, picco di
incidenza nella fascia d'età compresa tra 55 e 64 anni
ü
La disseminazione della malattia in strutture adiacenti, il coinvolgimento
dei linfonodi regionali, e le metastasi riguardano circa il 70% dei pazienti
ü
I tassi di sopravvivenza relativa per il carcinoma rinofaringeo è risultata
pari al 73% ad un anno e al 43% a 5 anni per gli adulti
Tumori del Rinofaringe
Sottotipi istologici:
TIPO 1
Carcinoma squamocellulare cheratinizzante
TIPO 2 Carcinoma non cheratinizzante
a)carcinoma non cheratinizzante differenziato
b)carcinoma indifferenziato (carcinoma indifferenziato di tipo rinofaringeo)
TIPO 3
Carcinoma spinocellulare basaloide
L'istotipo WHO 1 si ritrova con una frequenza da un terzo alla metà dei casi
nelle popolazioni a basso rischio, quali quelle nordamericane.
Tumori del Rinofaringe
Principali fattori di rischio:
ü Espressione del virus di Epstein Barr
EBV è legato al sottotipo istologico WHO 2
Le proteine virali LMP-1 e LMP-2 (proteine latenti di membrana)
agiscono sull'espressione cellulare e sulla crescita cellulare,
portando alla crescita maligna e altamente invasiva della malattia
LMP-1 è anche associata con lo sviluppo della cascata
metastatica, riducendo l'adesione cellulare, promuovendo la
degradazione della matrice extracellulare e della membrana
basale e aumentando il grado di neovascolarizzazione
ü Consumo di pesce e cibi in salamoia
Tumori del Rinofaringe
Diagnosi:
Segni e sintomi
ü
I tumori rinofaringei possono esordire senza produrre alcun segno o
sintomo.
ü
Perdita unilaterale dell'udito.
ü
Sanguinamento Ostruzione nasale.
ü
Adenopatie cervicali.
ü
Cefalea.
ü
Interessamento dei nervi cranici.
Tumori del Rinofaringe
Diagnosi:
Stadiazione
ü
Fibroscopia con biopsie
ü
RMN piu’ sensibile e specifica rispetto TC per la visualizzazione
dell'invasione dei tessuti molli esterni al rinofaringe, per metastasi
linfonodali L-C e nell'identificazione di un interessamento a livello
della base cranica
ü
PET-TC maggiore sensibilità nel riscontro di metastasi a distanza
(sino al 40% in pazienti con coinvolgimento linfonodale bulky).
ü
Concentrazione plasmatica di EBV DNA .
Tumori del Rinofaringe
Diagnosi:
Stadiazione
Tumori del Rinofaringe
Trattamento
n
Stadi iniziali (I e II)
→ SOP 5-a: 80-90%
→ RT ± CHT
n
Stadi avanzati (III e IV)
→ SOP 5-a: 60-70%
→ Modalità combinate
CHTRT
RT
NeoadCHTàCHTRT
n
Mal recidiva/metastastica
→ Terapia medica
→ SOP 1-a: 18-20%
→ SM: 6-8 mesi
Neoplasie Testa – Collo
(Classificazione Terapeutica)
ü Cavità nasali – seni paranasali
ü Rinofaringe
ü Laringe ( Sovraglottica – Glottica – Sottoglottica)
Faringe (Orofaringe – Ipofaringe) Cavità orale
ü Ghiandole salivari
Neoplasie Testa – Collo
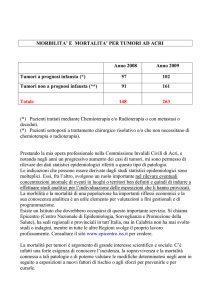
Incidenza/Mortalità
5-6% di tutte le neoplasie (616000 nuovi casi/anno in tutto il mondo)
60% dei pazienti presenta malattia avanzata all’esordio (stadi III-IV)
Neoplasie Testa – Collo
Incidenza/Mortalità in Europa
Incidenza
N.casi (x1000)
%
Cavo orale/faringe
97.8
3.4
Laringe
46.1
1.6
Mortalità
N.casi (x1000)
%
Cavo orale/faringe
40.1
2.3
Laringe
24.5
1.3
143000 nuovi casi/anno
68000 decessi/anno
Boyle & Ferlay, Ann. Oncol., 2005
Principali fattori di rischio
75%
ü Abuso di alcool
à LARINGE, ORO-IPOFARINGE
ü Abitudine tabagica
à LARINGE, ORO-IPOFARINGE
ü Infezione da HPV (16-18)
à OROFARINGE
Comuni a neoplasie
di altri distretti:
Polmone
Esofago
Frequenti neoplasie
primitive multiple:
Sincrone O
Metacrone
Genoma di HPV
Trasformazione maligna HPV-relata
ü
HPV E6 lega e inattiva la proteina p53 , interferendo con la normale
attività antitumorale di p53 (attivazione di meccanismi di riparazione
dei danni al DNA, regolazione del ciclo cellulare, induzione
dell’apoptosi in cellule con danni irreparabili al DNA);
ü
HPV E7 lega e inattiva la proteina pRB , interferendo con la normale
attività antitumorale di pRB (regolazione del ciclo cellulare e sulla
proliferazione cellulare, blocco della sintesi del DNA); liberazione di
E2F che promuove la fase S in continuo;
ü
P16 codificata dal gene oncosoppressore CDKN2A, solitamente
inibito da RB; se RB non attiva (azione della HPV E7) induce una
iperespressione di p16
Perdita del controllo sulla proliferazione cellulare
à Trasformazione maligna
Studio multicentrico francese
220 pts SCC tonsilla
Prevalenza HPV-pos 57%
Età media HPV-pos 60 anni
Prevalenza HPV-pos > donne
53% singolo HPV-type
4% più di un HPV-type
HPV16-pos 89%
Guily et al, Head and Neck Oncology, 2011
Caratteristiche SCCOP HPV-positivi
ü
ü
ü
ü
ü
ü
ü
ü
ü
ü
Pazienti più giovani di circa 5-10 anni rispetto agli HPV-negativi
> maschi (3:1)
Localizzati prevalentemente nelle sottosedi tonsilla e baselingua
Frequentemente
carcinoma
squamoso
non-cheratinizzante
scarsamente differenziato con aspetti basaloidi
Stadio III-IV con T1-2, N2-3
Spesso manca l’associazione con altri fattori di rischio quali il fumo
e l’alcool
Minor incidenza di tumori primitivi secondari
SCCOP HPV-positivi sono a trasmissione sessuale.
Migliore prognosi e migliore risposta ai trattamenti
Fumo ha impatto negativo sulla prognosi anche dei HPV-positivi
OS
DFS
VALORE PROGNOSTICO
SITO-SPECIFICO
Review 37 studi (Outcome – Head and Neck tumors - HPV status)
ü
ü
ü
ü
Aumento di OS (HR 0,85) e DFS (HR 0,62) nei SCCHN HPV-pos
HPV-pos: 28% tutte le sedi, 40% nei orofaringei
SCCOP HPV-pos >DFS (HR 0,51)
Nessuna differenza in OS nei pazienti SCC non-OP in base al HPV status
ECOG2399 phase II prospective trial: 96 casi SCCHN (orofaringe e laringe)
stadio III e IV sottoposti a 2 cicli di IC à CRT per pz in risposta vs Chirurgia
in pz in progressione. Chirurgia in tutti i pz con persistenza di malattia.
HPV +
HPV +
OS
PFS
ü Dopo IC: RR 82% vs 55% in HPV-pos
Beneficio > Orofaringe
ü Dopo CRT: RR 84% vs 57% in HPV-pos Beneficio anche nei fumatori
ü 2-years OS: 95% vs 62% in HPV-pos
ü 2-years PFS: 86% vs 53% in HPV-pos
Fakhry et al, J Natl Cancer Inst 2008
Studio retrospettivo
107 SCCOP primari o recidivati trattati con RT o Chirurgia + RT
HPV-DNA viral load byRT- PCR
P16, p53 e pRB expression IHC
Follow-up mediano 32 mesi
ü Classe I: 39% (viral load 0/human genome)
ü Classe II: 37% (viral load 3,6 copie/hg)
ü Classe III: 23% (viral load 46 copie/hg)
ü Tumori primari
ü Malattia più avanzata (basso T ma
elevato N)
ü Scarsamente differenziati
ü Bassa abitudine tabagica/alcolica
RECURRENCE RATE
DFS
OS
III
III
5-y local RR classe III: 14% (vs 45% classe I e 74% classe II)
5-y OS classe III: 79% (vs 20% classe I e 18% classe II)
5-y DFS classe III:75% (vs 15% classe I e 13% classe II)
Classe III > Radiosensibilità
III
ü
ü
ü
ü
ü
ü
156 pts SCCHN stadio I-IV
trattati con RT a frazionamento
standard
P16 utilizzato come marker
surrogato di infezione da HPV
Controllo
loco-regionale
di
malattia a 5-y: 58% vs 28% in
HPV-pos
5-y OS: 62% vs 26% in HPV-pos
5-y DSS: 72% vs 34% in HPV-pos
Conclusioni
ü
SCCOP HPV-pos entità biologica distinta
ü
HPV-pos prognosi migliore per maggior risposta ai trattamenti
(principalmente a RT, meno a CT) con meccanismo ancora poco
definito:
v
v
Fattori legati al paziente: giovane età, minor esposizione al fumo, minor
comorbilità
Fattori legati al tumore: risposta immune agli antigeni virali, presenza di
apoptosi mediata dalla p53 wild-type
ü
HPV-pos basso rischio potrebbero beneficiare di “attenuated
therapies”, trattamenti meno aggressivi che avrebbero un impatto
inferiore sulla qualità di vita senza compromettere sopravvivenza
ü
Ruolo del vaccino
v
v
ü
Esteso a tutti gli adolescenti
Sia contro infezione, sia nel setting adiuvante per ridurre il rischio di
recidiva locale o a distanza
Mancano studi prospettici
Tumori del distretto Cervico-Cefalico
Storia Naturale:
Inizialmente paucisintomatico
Dolore riflesso ( otalgia da neoplasia ipofaringea )
Sanguinamento
Sintomi correlati con la sede d’insorgenza
ü alterazione della motilità della lingua ( neoplasia pavimento orale)
ü disfonia (neoplasia ipofaringe e laringe)
ü disfagia ( neoplasia del cavo orale e dell’ipofaringe)
Tumori del distretto Cervico-Cefalico
Sottotipi istologici:
Carcinoma squamocellulare (90%)
Altri istotipi (10%)
ü
ü
ü
ü
ü
ü
ü
Carcinoma Verrucoso
Carcinoma Basaloide
Carcinoma Adenosquamoso
Carcinomi Mucoepidermoidi
Tumori Delle Ghiandole Salivari Minori
Melanomi
Linfomi
Tumori del distretto Cervico-Cefalico
Fattori Prognostici:
Fattori Legati al Tumore
ü Stadio di malattia
ü Sede d’insorgenza ( ipofaringe > glottide)
ü Interessamento linfonodale > estensione del T
Fattori legati all’istologia
ü Grading
Fattori legati alla biologia molecolare
ü EGF-R
ü P53
Tumori del distretto Cervico-Cefalico
Diagnosi:
Stadiazione
ü
Fibroscopia con biopsie
ü
RMN più sensibile e specifica rispetto TC per la visualizzazione
dell'invasione dei tessuti molli esterni, per metastasi linfonodali L-C e
nell'identificazione di un interessamento a livello della base cranica
ü
TC utile nello studio della laringe, e dell’interessamento osseo
ü
PET-TC maggiore sensibilità nel riscontro di metastasi a distanza
Tumori del distretto Cervico-Cefalico
Diagnosi:
Stadiazione
Modalità terapeutiche e risultati attuali
n
Stadi iniziali (I e II)
→ SOP 5-a: 60-90%
→ CH, RT
n
Stadi avanzati (III e IV)
→ Modalità combinate
→ SOP 5-a: 30-40 %
Resecabili: > 60% Rec LR, 20% Met, 10-40% secondi tumori
Non resecabili: SOP 5-a < 10%, maggioranza † < 18 mesi
n
Mal recidiva/metastastica
→
→
→
Terapia medica
SOP 1-a: 18-20%
SM: 6-8 mesi
Modalità terapeutiche
Pz Operabili
CHR
CHRT
RT±CHT
RT: radioterapia
CHRT.chemiradioterapia
CHR: chirurgia
Pz Non Operabili
RT
CHRT
RT
CHR salvataggio
Modalità terapeutiche
RT±CHT post-operative
A comparative analysis of
concurrent postoperative
radiation plus chemotherapy
trials of the EORTC and
RTOG
Bernier J, et al, N Engl J Med, 350:1945-52,2004
Modalità terapeutiche
Concomitant chemotherapy
MACH-NC: effetto aggiunta CT
MACH-NC
Meta-Analysis of Chemotherapy
in Head & Neck Cancer
Sopravvivenza globale
Pignon
JP et al Radiat Oncol 92 4-14, 2009
Current standard treatment in locally
advanced SCCHN
Concomitant chemotherapy
Absolute benefit of 6.5% at 5 years
Pignon JP et al Radiat Oncol 92 4-14, 2009
Current standard treatment in locally
advanced SCCHN
Concomitant chemotherapy
Absolute benefit of 6.2% at 5 years
Pignon JP et al Radiat Oncol 92 4-14, 2009
Current standard treatment in locally
advanced SCCHN
Pignon JP et al Radiat Oncol 92 4-14, 2009
Current standard treatment in locally
advanced SCCHN
Concomitant chemotherapy
Pignon JP et al Radiat Oncol 92 4-14, 2009
MACH-NC-2004 ASCO
Survival benefit in base a tipo di CT
Tipo di CT
Riduzione rischio
morte (%)
CDDP
26
No CDDP
10
Mono-CT (con CDDP)
22
Poly-CT (con CDDP)
18
Pignon JP et al Radiat Oncol 92 4-14, 2009
MACH-NC-2004 ASCO
Survival benefit con terapia neo-adiuvante
Tipo di CT
Riduzione rischio
morte (%)
CDDP/FU
12
No CDDP
-1
Pignon JP et al Radiat Oncol 92 4-14, 2009
La terapia a bersaglio molecolare o “target
therapy”
La conoscenza sempre più approfondita dei meccanismi
che sostengono la nascita, la progressione e la diffusione
delle neoplasie ha permesso di sviluppare trattamenti
mirati che bloccano specificatamente (o quasi) le cellule
tumorali, agendo a livello di bersagli molecolari ben
identificati.
Ma…
“Just because you know the target, doesn’t make
something a good drug”
Espressione di EGFR nei tumori solidi
Colon-retto
Polmone
(NSCLC)
Testa-collo
(SCC)
Cancro del colon-retto
(avanzato)
75-82%
Cancro del polmone
(NSCLC)
40-91%
Tumori testa e collo
(SCCHN)
90-100%
Cancro gastrico
33-74%
Cancro ovarico
35-70%
The EGFR (ErbB) family
Ligands
EGF
TGF-α
Amphiregulin
β-cellulin
HB-EGF
Epiregulin
No specific
ligands often acts as
dimer partner
Heregulins
NRG2
NRG3
Heregulins
β-cellulin
Extracellular
Cysteine-rich
Receptor domain
Membrane
Intracellular
Tyrosine kinase
domain
K
K
K
K
erbB1
HER1
EGFR
erbB2
HER2
neu
erbB3
HER3
erbB4
HER4
Wells 1999
Attivazione del recettore
TK activation
Receptor Ligand
Hetero/homo
expression binding
and tyrosine
dimerization
transphosphorylation
1
Signal
2
3
4
Ligand
transduction
5
Receptor
internalization
6
P
P
P
P
P
P
P
P
Cell-cycle progression
Degradation or
reexpression
P
P
P
P
Clathrin
pit
7 Degradation or
reexpression
Survival
Proliferation
Clathrin
pit
Degradation
EGF
TGFα
EGFR
erbB2
erbB3
erbB4
tyrosine
kinase
Effetti pleiotropici
attivazione di EGFR
y p GRB2
y p PKAI
SOS
ras raf
MEK
yp
Resistenza a
chemioterapia
RT e OT
PLCγ
PTEN
y
PI-3K
p
MAPK
Cyclin
D1
AKT
VEGF
CDK
Bcl-2
Angiogenesi
Rb
Sopravvivenza,
anti-apoptosi
Proliferazione cell.
Invasione
metastasi
Tortora et al., 2003
Strategie di inibizione di EGFR/ErbB1
ü
AcMo bloccanti il sito per
iligandi o la dimerizzazione
ü
Inibitori TK
ü
Antagonisti competitivi dei
recettori
ü
Ligandi-tossine
o
coniugati con tossine
ü
Oligonucleotidi antisenso
ü
Vaccini
Cetuximab (Erbitux®)
Gefitinib (Iressa®)
Erlotinib (Tarceva®)
Ac
Anticorpi
monoclonali
Inibitori
TK
Antagonisti
recettore
Blocco
ligandi
L’espressione di EGFR come fattore
prognostico
L’epressione di EGFR correla con prognosi sfavorevole,
ridotta sopravvivenza e/o maggiore tendenza alla
metastasi
Prognosis
Survival
Risk of
metastasis
References
Colorectal
Poor
-
Increased
Hemming (1992)
Lung (NSCLC)
Poor
Poor
Decreased OS
-
Increased
Ohsaki (2000)
Pavelic (1993)
Head & Neck
(SCCHN)
Poor
Decreased DFS
Decreased OS
-
Grandis (1998)
Maurizi (1996)
Tumor type
L’espressione di EGFR è inoltre legata a minore
responsività e/o aumentata resistenza alla chemioterapia
Buoni motivi per una terapia anti-EGFR
ü
Overespressione di EGFR e del ligando TNFα in 80-90%
di SCCHN. La co-espressione di recettore e ligando può
suggerire un meccanismo di regolazione autocrina della
crescita tumorale
ü
Aumentati livelli di mRNA e proteina EGFR nelle lesioni
displastiche e nella mucosa normale circostante.
Suggerisce che l’up-regulation di EGFR sia un evento
precoce
ü
Amplificazione genica e overespressione indotte da
ipossia
EGFR è un potente mediatore di
radioresistenza e chemioresistenza
Meccanismi:
ü
Aumentati livelli Bcl-2 down-regulation della risposta
apoptotica indotta da RT o CT
ü
Attivazione dei meccanismi di riparo del DNA
riparazione del potenziale danno letale da RT o CT
ü
Up-regulation delle cicline con attivazione della
proliferazione cellulare aumento della quota di cellule
in fase radioresistente del ciclo cellulare
Disegno dello studio
Pazienti con diagnosi di SCCHN localmente avanzato (stadi III e IV)
suscettibili di trattamento con finalità radicali
Stratificazione per: KPS (60-80 vs 90-100), stato linfonodale (N0 vs N+),
dimensioni T (T1-T3 vs T4), RT (concomitante vs 1 fr/die vs 2 fr/die)
RT
(213 pz)
Random
RT+Cetuximab
(211 pz)
Cetuximab: loading dose 400 mg/mq 1 settimana prima di RT,
poi 250 mg/mq/settimana
End point primario: controllo loco-regionale di malattia
End point secondari: OS, PFS, RR, safety
Bonner et al., NEJM, 2006
Risultati
Locoregional
control (%)
RT
RT+
cetuximab
1 anno
55
63
2 anni
41
50
3 anni
34
47
<0.01
Durata
mediana (m)
14.9
24.4
0.005
P value
Bonner et al., NEJM, 2006
Risultati
PFS
RT
RT+
cetuximab
HR
P value
Durata mediana (m)
12.4
17.1
0.7
0.006
Tasso a 2 anni (%)
37
46
Durata mediana (m)
29.3
49
0.74
0.03
Tasso a 3 anni (%)
45
55
OS
0.05
Bonner et al., NEJM, 2006
HR=.068
HR=0.68
p=0.005
P=
Controllo loco-regionale di malattia
RT+cetuximab vs RT
47% vs 34% (tasso % a 3 anni)
24.4 vs 14.9 (durata mediana mesi)
HR=0.68, p=0.005
Overall survival
RT+cetuximab vs RT
55% vs 45% (tasso % a 3 anni)
49 vs 29.3 (durata mediana mesi)
HR=0.74, p=0.03
Bonner et al., NEJM, 2006
Conclusioni
ü
Nel trattamento di SCCHN localmente avanzato cetuximab
associato a RT migliora il controllo loco-regionale della
malattia e riduce la mortalità, senza aumentare gli effetti
tossici da RT
ü
Tale beneficio viene ottenuto con la sola aggiunta di un
agente molecolare alla RT
ü
Il vantaggio assoluto (a 3 anni) rispetto alla sola RT è del
10%, paragonabile a quello ottenibile con l’associazione di
chemio-radioterapia, in assenza di tossicità aggiuntive
ü
Le curve di controllo loco-regionale e sopravvivenza
mantengono una consistente divergenza, suggerendo che
l’effetto additivo del cetuximab alla RT persista a lungo anche
dopo la fine del trattamento
Meccanismi di resistenza a EGF-R
inhibithors
Modalità terapeutiche
Induction CHEMOTHERAPY
MACH-NC: effetto aggiunta CT
MACH-NC
Meta-Analysis of Chemotherapy
in Head & Neck Cancer
Sopravvivenza globale
Pignon
JP et al Radiat Oncol 92 4-14, 2009
Current standard treatment in locally
advanced SCCHN
Concomitant vs Induction chemotherapy
Pignon JP et al Radiat Oncol 92 4-14, 2009
Effetti della CT di induzione
ü
Elevato tasso di risposte (60-90% con CR>30%)
ü
Riduzione della frequenza metastasi a distanza
(beneficio assoluto 8-10%)
ü
Nessun effetto su OS tranne che in sottogruppi
ü
Tumori non resecabili di orofaringe, ipofaringe, cavo orale
(GSTTC)
ü
Tumori operabili dell’orofaringe (GETTEC)
ü
Pazienti trattati con CDDP/FU
NEJM, 357:17, 1705-1715, 2007
Disegno studio TAX 324
Studio randomizzato fase III, open-label
501 pazienti con SCCHN istologicamente o citologicamente confermato,
localmente avanzato (stadi III e IV, no metastasi), non resecabile
Random
TPF
PF
Txt 75 mg/mq g 1
Cddp 100 mg/mq g 1
FU 1000 mg/mq gg 1-4
q3w per 3 cicli
Cddp 100 mg/mq g 1
FU 1000 mg/mq gg 1-5
q3w per 3 cicli
Chemioradioterapia
(RT+cbdca AUC 1.5
settimanale)
Disegno studio TAX 324
Studio randomizzato fase III, open-label
Trattamento radiante:
Entro 3-8 settimane dall’inizio del III ciclo di induzione
• 70-74 Gy su T
• 50 Gy su linfonodi NON patologici
• 60-74 Gy su linfonodi patologici (in base a planned neck dissection)
Chemioterapia concomitante:
Carboplatino AUC 1.5 settimanale (max 7 cicli)
Chirurgia:
Da 6 a 12 settimane dal completamento di chemio-RT in
con:
• stadio iniziale N2 e risposta parziale a CT di induzione
• stadio N3
• malattia residua dopo chemio-RT
pazienti
Disegno studio TAX 324
ü
Primary end-point:
Overall survival
ü
Secondary end-points:
PFS
Response rate dopo CT di induzione
Tossicità
Stratificazione dei pazienti in base a sede del T, stato linfonodale
(N0/N1 vs N2/N3), istituzione
Caratteristiche dei pazienti
Risultati TAX 324
OS
TPF
PF
HR
P value
Durata mediana (m)
71
30
0.70
0.006
Tasso a 2 anni (%)
67
55
Durata mediana (m)
36
13
0.71
0.002
Tasso a 2 anni (%)
53
42
PFS
Overall Survival
TPF vs PF
71 vs 30 (durata mediana mesi)
67% vs 55% (tasso a 2 anni)
62% vs 48% (tasso a 3 anni)
HR=0.70
p=0.006
PFS
TPF vs PF
36 vs 13 (durata mediana mesi)
53% vs 42% (tasso a 2 anni)
49% vs 37% (tasso a 3 anni)
HR=0.71 p=0.002
*follow-up mediano 42 mesi
Conclusioni studio TAX 324
ü Significativo aumento di OS e PFS in tutti i sottogruppi di
pazienti
ü Riduzione del 30% del rischio di progressione di malattia e di
morte
ü Aumentato controllo loco-regionale di malattia
ü Nessuna differenza nella incidenza di metastasi a distanza
ü Maggior tossicità ematologica e mucosale (maggior
incidenza di disfagia, odinofagia, diarrea), alopecia
TAX 324
Tossicità
NEJM, 357:17, 1695-1704, 2007
Disegno studio EORTC
Fase III, multicentrico, randomizzato, stratificato
358 pazienti con SCCHN istologicamente o citologicamente confermato,
localmente avanzato (stadi III e IV, no metastasi), non resecabile
Random
TPF
PF
Txt 75 mg/mq g 1
Cddp 75 mg/mq g 1
FU 750 mg/mq gg 1-5
q3w max 4 cicli
Cddp 100 mg/mq g 1
FU 1000 mg/mq gg 1-5
q3w max 4 cicli
177 pz
181 pz
Rivalutazione
Disegno studio EORTC
Fase III, multicentrico, randomizzato, stratificato
I pazienti non in progressione passano al trattamento
radiante, entro 4-7 settimane dall’ultimo ciclo di CT, con le
seguenti modalità:
ü radioterapia convenzionale (66-70 Gy)
ü radioterapia accelerata (max 70 Gy)
ü radioterapia iperfrazionata (max 74 Gy)
NB: schema di radioterapia scelto dal centro
partecipante prima dell’ingresso nello studio
Disegno studio EORTC
ü
Primary end-point:
Progression-free survival
ü
Secondary end-points:
Overall survival
ORR dopo CT di induzione e dopo RT
Durata risposta, TTF
Tossicità, QOL
Studio EORTC
Caratteristiche dei
pazienti
Risultati studio EORTC
PFS
Durata mediana (m)
TPF
PF
HR
P value
11
8.2
0.72
0.007
18.8
72
10.5
15.4
14.5
59
7.8
11.6
0.73
0.74
0.02
0.006
0.003
0.08
OS
Durata mediana (m)
ORR a CT+RT (%)
TTF (mesi)
Durata risposta (m)
∆=2.8 mesi
PFS
TPF vs PF
11 vs 8.2 (durata mediana mesi)
HR=0.72 p=0.007
∆=4.3 mesi
OS
TPF vs PF
18.8 vs 14.5 (durata mediana mesi)
HR=0.723 p=0.02
*Follow-up mediano 32.5 mesi
Studio EORTC
Tossicità in corso
di CT
Conclusioni studio EORTC
ü
La terapia di induzione con aggiunta di docetaxel migliora
PFS e OS in pazienti con SCCHN non resecabile
ü
Nel gruppo trattato con TPF si ha riduzione di rischio di PD
e di morte pari al 28%, con aumento del PFS di 2.8 mesi
ü
TPF risulta meglio tollerato rispetto al classico PF (minor
incidenza di stomatiti, nausea, vomito, diarrea, ma maggior
incidenza di neutropenia febbrile e alopecia)
Radioterapia nelle Neoplasie Testa – Collo
Nell’Ultimo secolo le potenzialità curative della radioterapia nei tumori
solidi sono enormemente aumentate
La tolleranza dei tessuti normali rimane comunque la maggiore
limitazione al rilascio di dose adeguate
Guadagno Terapeutico
=
Aumento del controllo tumorale e della sopravvivenza senza un
parallelo aumento degli effetti collaterali indesiderati
Radioterapia nelle Neoplasie Testa – Collo
Interazione tra Radioterapia e Chemioterapia
Radioterapia nelle Neoplasie Testa – Collo
Interazione tra Radioterapia e Chemioterapia
a livello cellulare
Radioterapia nelle Neoplasie Testa – Collo
Interazione tra Radioterapia e Chemioterapia
a livello molecolare
Radioterapia nelle Neoplasie Testa – Collo
Nuove Tecniche: IMRT
Semiin Radit Oncol, 14:103-109, 2004
Radioterapia nelle Neoplasie Testa – Collo
Nuove Tecniche: IMRT
A: Tecnica Tradizionale
B: IMRT
Radioterapia nelle Neoplasie Testa – Collo
Nuove Tecniche: IMRT
Radioterapia nelle Neoplasie Testa – Collo
Nuove Tecniche: IMRT
Eisbruch A, ASTRO 2003, course 211
Chemioradioterapia:
Tossicità
The
Intergroup
trial
Standard
radiotherapy
Standard radiotherapy
+ cisplatin 100mg/m2
q 3 wks
All grade IIIV toxicities
50%*
90%*
Toxic
deaths
2%
4.5%
* = P<0.0001
Adelstein DJ et al; J. Clin. Oncol. 2003;21:92-98
Chemoradiation significantly increases acute
toxicity
Acute adverse effects: grade 3 or higher
77% with CRT vs 34% with RT alone (p<0.001)
80
Subjects (%)
RT alone (n=231)
60
Combined RT + cisplatin (n=228)
40
20
0
s
g
ic ract
ne
ct
in tion
ia)
ic
ia
in
gu
a
t
g
a
k
g
i
a
r
r
m
t
m
o
S
t
o
l
c
h
b
o
m
e
ol
ne
ro ary
st
GI
A
em esop d vo
nf
u
o
at
I
r
n
r
e
i
m
m
N
n
pe
xe
ur
d
a
(
p
H e ous
o
n
t
a
U
c
nd
ni
x a use
a
u
e
l
n
G
y
M
g
Na
ar
ry
h
a
P
liv
a
S
Cooper JS, et al. N Engl J Med 2004;350:1937–1944
Chemoradiation: percentage of treatmentrelated deaths after primary treatment
6%
15%
9%
10%
45%
21%
9%
disease progr.
2nd primary
comorbidiities
tr.related (early)
tr.related (late)
unknown
Argiris A, et al. Clin Cancer Res 2004;10:1956–1962
La complessità del paziente con Neoplasie
Testa-Collo
Scheduling
Chemotherapy
Pain
Radiotherapy
Mucositis
Malnutrition
Neutropenia
Infections
(pneumonitis)
Aspiration
Xerostomia
Anemia
Emesis
Dehydration
Electrolyte
imbalances
Cardiac
abnormalities
Renal function
alterations
REDUCTION OF DOSE INTENSITY, is the major
cause of treatment failure besides the intrinsic
resistance of cancer
We lose more than 30% of elderly (and
probably the same of unfit) pts. How we
manage them?
n
C-mab + RT!
Pignon JP et al Radiat Oncol 92 4-14, 2009
Tossicità relative ai trattamenti
RADIOTERAPIA
CHEMIOTERAPIA
TERAPIA CON TKi
ACUTE
ü Dermatite da raggi ed edema
ü Faringodinia, Disfagia completa
ü Disgeusia/Ipogeusia
ü Stomatiti/Mucositi/Candidosi
ü Nausea, vomito, inappetenza
ü Diarrea
ü Rush cutaneo acneiforme
TARDIVE
ü Xerostomia
üDanni dentari, necrosi
mandibolare
ü Danni masticazione, trisma
ü Danni oculari e uditivi
ü Edema laringeo persistente
Candidosi e mucosite
del cavo orale
Rush cutaneo
acneiforme da Cetuximab
Dermatite da raggi di
grado severo
Management of EGFR inhibitor-related
skin reactions
Typical time course of possible skin reactions
Acne-like rash
Dry skin, fissures
Paronychia
Weeks
1
2
3
4
5
6
7
8
9
Treatment suggestions
Topical
Anti-acne creams
Moisturizing
creams*
+/- topical
antibiotics
Systemic
+/- tetracyclines
antihistamines in
case of pruritus
* Topical corticosteroids if necessary.
Topical
antiseptics
>10
ü
Limitano un adeguato supporto nutrizionale
ü
Comportano l’insorgenza di una rilevante problematica di dolore a
livello locale
ü
Rischio di complicanze infettive
ü
Modificano la qualità di vita del paziente, compromettono la sua
compliance e possono indurre a riduzione dosi/interruzione del
trattamento
Risulta necessario...
ü
Prima di intraprendere il trattamento radioterapico sottoporsi ad
un’accurata igiene dentaria e ortopantomografia
ü
ELIMINARE FUMO E ALCOOL à più elevato profilo di tossicità
acuta, riduzione della probabilità di cura, aumento di comorbilità à
minor sopravvivenza globale
ü
Utilizzare farmaci per contrastare il dolore (FANS, paracetamolo,
oppiacei), applicare antinfiammatori ed anestetici locali, oltre a gel
per rivestire e proteggere la mucosa
ü
Prevenire e curare le sovrainfezioni con nistatina locale, antimicotici
ed antibiotici per via sistemica
ü
Evitare alimentazione a base di cibi speziati, piccanti, acidi o irritanti
per la mucosa orale, assumere integratori alimentari
ü
Eseguire valutazione nutrizionale e monitorare peso corporeo à
uno scarso stato nutrizionale è un fattore prognostico negativo e
riduce la qualità di vita!
ü
Atteso un calo ponderale di circa il 10%del peso corporeo iniziale
ü
Valutazione nutrizionale periodica, se MALNUTRIZIONE (calo
ponderale >10%, BMI < 18, albuminemia < 3 g/l) indicazione a
nutrizione enterale/parenterale
Posizionamento di
PEG/PICC
PEG (Gastrostomia Endoscopica Percutanea)
Permette di mantenere maggiormente la funzionalità del
tratto digestivo e di avere una più facile gestione nel
paziente domiciliare
PICC o CVC
Può essere posizionato da personale medico o
infermieristico adeguatamente addestrato (PICC), non
necessita di competenze di tipo chirurgico o
anestesiologiche
Grazie a questi ausili e ad un’attenta valutazione clinica,
la percentuale di pazienti che sono costretti ad interrompere
i trattamenti a causa delle tossicità associate è molto ridotta.
La valutazione del paziente in ambito
multidisciplinare permette di assicurare un percorso
terapeutico ottimale finalizzato alla
cura della MALATTIA e al supporto del MALATO
Caso clinico 1
ü
Z.C., 41 anni, donna, non fattori di rischio
ü
In maggio 2009 insorgenza di tumefazione angolomandibolare dx a lento accrescimento e febbricola
ü
Presenza di ipertrofia tonsilla palatina dx (2x1,1x3,4 cm)
ü
Adenopatie omolaterali al II-III-V livello, la maggiore
delle quali di 1,5x2,3x3,3 cm
ü
Diagnosi istologica di carcinoma squamocellulare G3
dell’orofaringe, HPV positiva per l’istotipo 16 (settembre
2009)
ü
Stadio cT2 (ris T4) cN2b Mx
ü
RM
all’esordio:
tonsilla
palatina destra appare aumentata
di volume ( dm 2 x 1.1 x 3.4 cm ),
anteriormente giunge a contatto
con la base della lingua,
posteriormente con la parete
posteriore
dell'orofaringe
e
medialmente contrae rapporti con
il muscolo pterigoideo interno.
Linfonodi
marcatamente
aumentati di volume a livello della
catena cervicale media (livello II),
inferiore (livello III) e accessori
spinali (livello V) di destra, di cui i
maggiori (dm rispettivo di 1.5 x
2.3 x 3.3 cm e 1.1 x 0.8 x 1.5 cm).
T
N
Programma terapeutico
ü
Chemioterapia di induzione secondo schema TPF
(docetaxel, cisplatino, 5-fluorouracile) per 3 cicli
ü
A seguire chemio-radioterapia concomitante, con
erogazione di 66 Gy totali su sede di T e N, e
somministrazione di cisplatino 100 mg/mq d 1,22,43
del trattamento radiante. Trattamenti terminati in
gennaio 2010.
Valutazione pre-RT
RM dicembre 2009:
ü
Pressoché
normalizzata la morfologia, l' intensità
di segnale e l' impregnazione
contrastografica della regione tonsillare
dx.
Pressoché
normalizzate
le
dimensioni dei linfonodi laterocervicali
omologhi, nessuno dei quali presenta
segni di necrosi.
ü
PET:
ipermetabolismo glucidico a
livello della tonsilla palatina dx e di
linfonodi omolaterali del livello II del
collo.
ü
Fibroscopia:
negativa per reperti
sospetti. Palpazione base lingua e
loggia tonsillare dx nella norma.
Palpazione collo: microadenopatia a
(circa 0.5 cm) al II livello di dx.
Evoluzione
RM aprile 2010:
ü
non alterazioni di
morfologia ed intensità del segnale a
carico dell'orofaringe
ü
PET giugno 2010:
aree di
patologico.
negativa per
ipermetabolismo glucidico
ü
Quadro di risposta completa.
ü
All’ultimo follow-up (ottobre 2010) la
paziente si è presentata in ottime
condizioni generali, senza evidenza di
malattia orofaringea o linfonodale.
ü
Orofaringoscopia:
ü
non reperti
sospetti; palpazione loggia tonsillare dx
nella norma. Palpazione del collo
apprezzabile linfoadenopatie bilaterali
senza caratteri sospetti.
Residuano solo modesta disfagia per cibi
solidi, ipogeusia, xerostomia.
Caso clinico 2
ü
A.F., donna, 73 anni, fumatrice
ü
Da circa 2 mesi presenza di disfagia ingravescente per i
solidi, con calo ponderale di 5-6 kg e sintomatologia
dolorosa (necessità di Fentanyl TTS 25 mcg)
ü
Orofaringoscopia:
lesione
ulcero-vegetante
che
impegna la loggia tonsillare sx e si estende
cranialmente a emipalato molle e duro, coinvolgendo
l’ugola e superando la linea mediana; base lingua
palpatoriamente normale
ü
Fibroscopia: bombè emipalato sx; medializzazione
parete laterale sx dell’orofaringe
ü
Adenopatia fissa 3x2 cm liv. Ib-II sx; linf. II liv. dx 1 cm
Caso clinico 2
ü
Biopsia: carcinoma
squamocellulare G3
ü
TC:
ü
Stadio di malattia:
neoformazione disomogenea
di 5 cm che interessa oro e
ipofaringe sx, con obliterazione del
grasso prevertebrale; pacchetti
adenopatici con diametro max 3 cm
(liv. I-II sx)
M0
T4a N2c
Programma terapeutico
ü
Radioterapia a dosi radicali (70 Gy) associata a
cetuximab (400 mg/mq loading dose 1 settimana
prima dell’inizio della RT, poi 250 mg/mq/settimana)
ü
Chirurgia di recupero su eventuale residuo di malattia
ü
Chemioterapia non consigliabile per età > di 70 anni
(efficacia del trattamento diminuisce con l’età, dopo i
70 aa né la RT a frazionamento non convenzionale
né la CT concomitante sono superiori alla RT
standard)
Evoluzione
ü
RM:
ü
PET:
ü
Fibroscopia:
non evidenza di malattia a
livello orofaringeo; nettissima
riduzione delle adenopatie, con a
sx 2 piccoli linfonodi di 9 e 11 mm
(palpabili)
linfonodi iperattivi in sede
l.c. sx, s.c. dx e mediastinica
non segni di
malattia in orofaringe
Evoluzione
ü
Intervento di svuotamento linfonodale l.c. sx (livelli II-IV,
12 linfonodi asportati)
ü
Non evidenza di cellule neoplastiche in nessuno dei
linfonodi rimossi
ü
Persistenza di marcata tossicità tardiva da trattamento,
con edema diffuso e stenosante di epiglottide, aritenoidi
e laringe sovraglottica, disfagia per i solidi e xerostomia
marcata
ü
Quadro di remissione completa di malattia