I.I.S.S. “BOSCARDIN” – VICENZA
A.S. 2016/2017
CHIMICA MATERIALI E BIOTECNOLOGIE
Articolazione: BIOTECNOLOGIE SANITARIE
Programmazione di dipartimento di
CHIMICA ORGANICA E BIOCHIMICA
classe QUINTA
*saperi di base
Argomenti
Conoscenze
Abilità/Capacità
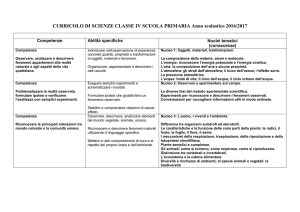
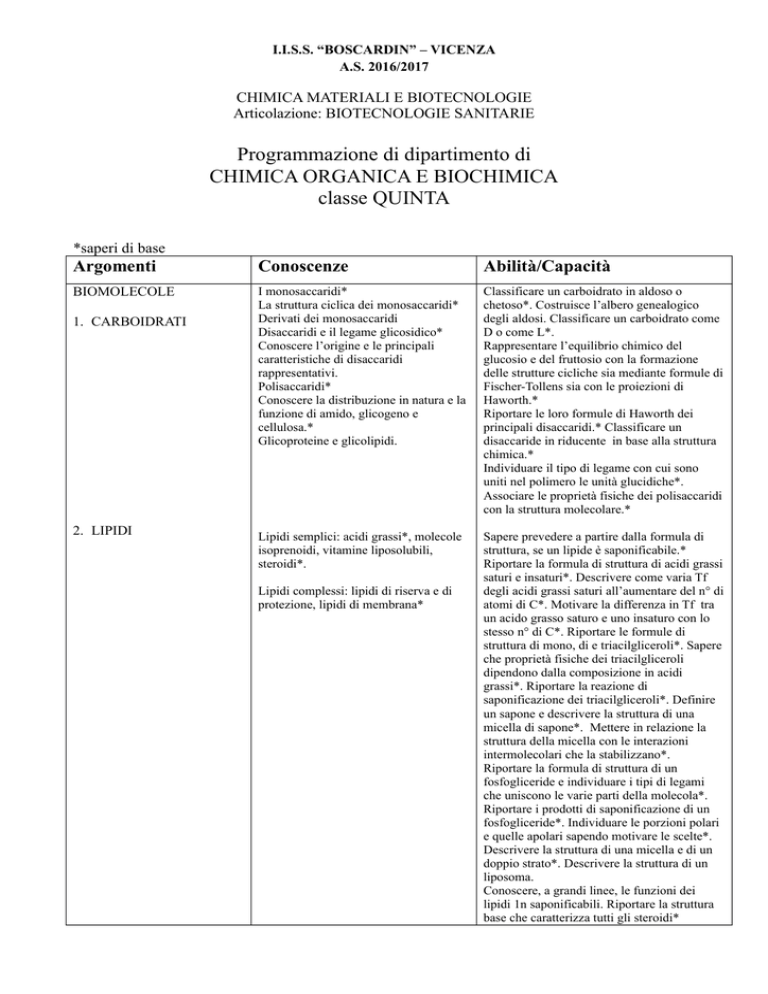
BIOMOLECOLE
I monosaccaridi*
La struttura ciclica dei monosaccaridi*
Derivati dei monosaccaridi
Disaccaridi e il legame glicosidico*
Conoscere l’origine e le principali
caratteristiche di disaccaridi
rappresentativi.
Polisaccaridi*
Conoscere la distribuzione in natura e la
funzione di amido, glicogeno e
cellulosa.*
Glicoproteine e glicolipidi.
Classificare un carboidrato in aldoso o
chetoso*. Costruisce l’albero genealogico
degli aldosi. Classificare un carboidrato come
D o come L*.
Rappresentare l’equilibrio chimico del
glucosio e del fruttosio con la formazione
delle strutture cicliche sia mediante formule di
Fischer-Tollens sia con le proiezioni di
Haworth.*
Riportare le loro formule di Haworth dei
principali disaccaridi.* Classificare un
disaccaride in riducente in base alla struttura
chimica.*
Individuare il tipo di legame con cui sono
uniti nel polimero le unità glucidiche*.
Associare le proprietà fisiche dei polisaccaridi
con la struttura molecolare.*
Lipidi semplici: acidi grassi*, molecole
isoprenoidi, vitamine liposolubili,
steroidi*.
Sapere prevedere a partire dalla formula di
struttura, se un lipide è saponificabile.*
Riportare la formula di struttura di acidi grassi
saturi e insaturi*. Descrivere come varia Tf
degli acidi grassi saturi all’aumentare del n° di
atomi di C*. Motivare la differenza in Tf tra
un acido grasso saturo e uno insaturo con lo
stesso n° di C*. Riportare le formule di
struttura di mono, di e triacilgliceroli*. Sapere
che proprietà fisiche dei triacilgliceroli
dipendono dalla composizione in acidi
grassi*. Riportare la reazione di
saponificazione dei triacilgliceroli*. Definire
un sapone e descrivere la struttura di una
micella di sapone*. Mettere in relazione la
struttura della micella con le interazioni
intermolecolari che la stabilizzano*.
Riportare la formula di struttura di un
fosfogliceride e individuare i tipi di legami
che uniscono le varie parti della molecola*.
Riportare i prodotti di saponificazione di un
fosfogliceride*. Individuare le porzioni polari
e quelle apolari sapendo motivare le scelte*.
Descrivere la struttura di una micella e di un
doppio strato*. Descrivere la struttura di un
liposoma.
Conoscere, a grandi linee, le funzioni dei
lipidi 1n saponificabili. Riportare la struttura
base che caratterizza tutti gli steroidi*
1. CARBOIDRATI
2. LIPIDI
Lipidi complessi: lipidi di riserva e di
protezione, lipidi di membrana*
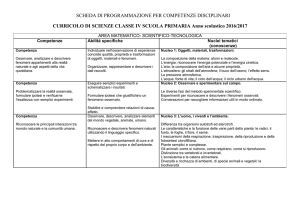
3. AMMINOACIDI E
PROTEINE
L e D amminoacidi*. Classificazione
degli amminoacidi*. Comportamento
acido-base degli amminoacidi*. Ioni
dipolari*. Il punto isoelettrico*. Il
legame peptidico*. Peptidi e polipeptidi.
Proteine. Classificazione delle
proteine*. Struttura primaria, secondaria
e terziaria dei poliptidi*. Struttura
quaternaria delle proteine*.
Denaturazione delle proteine*. Proteine
globulari e fibrose.*
Riportare la formula di struttura di un L-αamminoacido generico.* Riportare la formula
di struttura degli AA più semplici. Identificare
dalla formula di struttura la classe di
appartenenza dell’AA*. Calcolare il punto
isoelettrico di un AA*. Prevedere la specie
prevalente di un AA al variare del pH.
Spiegare la rigidità del legame peptidico*.
Classificare le proteine in base alla
composizione, alla conformazione e alla
funzione*.
Spiegare la stabilità dell’ α-elica* e del
foglietto β*
4.NUCLEOTIDI E ACIDI
NUCLEICI
Struttura di nucleosidi e nucleotidi.*
Oligonucleotidi e polinucleotidi.
Struttura del DNA*. Gli RNA e la loro
struttura. Denaturazione e rinaturazione
del DNA*.
Altre funzioni dei nucleotidi:
trasporto di energia (ATP)
cofattori (NAD, NADP, FAD, FMN)
messaggeri intracellulari (cAMP,
cGMP)
Riportare le formule di struttura dei
carboidrati che formano i nucleotidi*.
Riportare la formula di struttura della
pirimidina e della purina. Classificare le basi
come puriniche e pirimidiniche*. Descrivere
la struttura molecolare dei nucleosidi e dei
nucleotidi*. Sapere quali basi sono presenti
nel DNA e nell’RNA*. Riportare un filamento
di DNA (forma sintetica) con la corretta
polarità*. Saper descrivere la doppia elica*.
Sapere quali basi si appaiano nel doppio
filamento e motivare*.
Sapere che il DNA si impacchetta assieme a
proteine specifiche a formare la cromatina.
Descrivere le strutture dell’m-RNA e del tRNA*. Correlare struttura e funzione dei
principali tipi di RNA.
Identificare nella catalisi enzimatica il cardine
delle trasformazioni biochimiche
intracellulari *
Individuare nella sequenzialità degli enzimi
l’elemento costitutivo delle vie metaboliche.
Riportare l’equazione di M.M.*, riportare il
grafico vi/[S]*, individuare graficamente
vmax, vmax/2 e Km*. Classificare gli inibitori
in reversibili e irreversibili sulla base del tipo
di legame tra inibitore ed enzima*.
Classificare gli inibitori sulla base del
meccanismo d’azione*. Descrivere il
meccanismo dell'inibizione competitiva
dell'inibizione incompetitiva e non
competitiva*.
Descrivere la struttura di un enzima
allosterico*. Riportare e descrivere il
diagramma vi/[S], individuare graficamente
vimax, vimax/2 e K0,5*..
Descrivere i meccanismi di regolazione
enzimatica *.
Correlare struttura e funzione dei principali
componenti della membrana cellulare*.
Classificare le proteine di membrana.
Descrivere la struttura delle membrane
cellulari.* Descrivere il modello a mosaico
fluido delle membrane cellulari.* Le funzioni
della membrana cellulare.* Classificare la
diffusione in semplice e facilitata e descrivere
le condizioni chimico-fisiche per la loro
realizzazione.* Il trasporto attivo*.
Classificare il trasporto attivo sulla base della
forma di energia utilizzata.*
Da metà settembre - ottobre
(21 ore)
• GLI ENZIMI
Ottobre/novembre (12 ore)
• LA MEMBRANA
CELLULARE
Novembre (10 ore)
Caratteristiche generali. Nomenclatura e
classificazione*. Natura chimica. Siti
attivi e siti allosterici*. Interazione
enzima substrato secondi i principali
modelli*. Energia di attivazione*.
Cinetica enzimatica, equazione di M.M.,
effetto della concentrazione del
substrato e dell’enzima sulla velocità di
reazione*. Effetto degli inibitori
enzimatici, temperatura e, pH su vi
Regolazione dell’attività enzimatica:
modificazioni nella produzione,
modificazioni post-traduzionali,
compartimentazione, regolazione
allosterica, proteolisi*.
Composizione chimica: proteine e lipidi
di membrana. Struttura: modello a
mosaico fluido.*
Passaggio di soluti attraverso la
membrana: diffusione semplice,
facilitata e trasporto attivo.*
Endocitosi.
• BIOENERGETICA E
METABOLISMO
Dicembre (12 ore)
ΔH, ΔS, ΔG. Reazioni spontanee, di
equilibrio e non spontanee*. ΔG° e
ΔG°’.* Relazione tra ΔG°’ e Keq*. Le
molecole ad alto contenuto energetico:
molecole fosforilate (ATP,
fosfoenolpiruvato, 1,3-difosfoglicerato,
fosfocreatina) e non fosforilate (acilCoA). L’ATP come trasportatore
universale di energia. Additività del ΔG
di reazioni consecutive. Reazioni
accoppiate*. Redox biologiche*. Il
potenziale di riduzione standard*.
Relazione tra ΔG e ΔE. L’ossidazione
della sostanza biologica*. Le ossido
reduttasi e i loro coenzimi: NAD,
NADP, FAD, FMN*.
Metabolismo, catabolismo e
anabolismo. Convergenza delle vie
cataboliche. Divergenza delle vie
anaboliche*. Metabolismo energetico*.
• METABOLISMO
GLUCIDICO
Gennaio/febbraio (18 ore)
La glicolisi*. I processi fermentativi di
interesse industriale. La fermentazione
lattica nel muscolo*. Regolazione
enzimatica della glicolisi*.Regolazione
ormonale della glicolisi. Glicogeno.
Glicogenosintesi e glicogeno lisi*.
Regolazione ormonale di
glicogenosintesi e glicogenolisi.* Shunt
dell’esosomonofostato. Gluconeogenesi.
Il ciclo di Krebs*. La regolazione del
Ciclo*. Resa energetica del catabolismo
glucidico.
• METABOLISMO DEGLI
ACIDI GRASSI E DEGLI
AMMINOACIDI
Febbraio/marzo (19 ore)
Digestione e assorbimento dei lipidi.*
Utilizzazione dei trigliceridi. La beta
ossidazione*. Le reazioni della
ossidazione. La resa energetica della
beta ossidazione*. Digestione e
assorbimento delle proteine*. L’impiego
degli amminoacidi. La
transamminazione e la deamminazione
ossidativa degli amminoacidi*. Il ciclo
dell’urea. La degradazione degli
amminoacidi.
La biosintesi degli amminoacidi.
La biosintesi degli acidi grassi*. Il
trasporto dell’acetilCoA dalla matrice
mitocondriale al citosol. Biosintesi dei
triacilgliceroli. Cenni alla biosintesi del
colesterolo. Trasporto dei lipidi nel
sangue
Definire il criterio di spontaneità delle
reazioni chimiche*.
Descrivere la struttura dell’ATP e motivare
l’elevato ΔG°’ di idrolisi*. Associare l’elevato
ΔG°’ di fosfoenolpiruvato, 1,3difosfoglicerato, fosfocreatina a particolari
strutture chimiche.
Definire il ruolo delle reazioni accoppiate nel
metabolismo*.
Riconoscere il ruolo dell’ATP come
intermediario energetico tra catabolismo e
anabolismo*.
Spiegare come l’ATP fornisce energia alla
cellula*
Riportare le diverse modalità con cui gli
elettroni vengono trasferiti nelle redox*.
Descrivere la struttura del coenzimaA.
Descrivere la struttura dei coenzima NAD,
NADP, FAD e FMN e spiegare come
funzionano i principali coenzimi come
trasportatori di elettroni* Descrivere in
termini generali le vie cataboliche e le vie
anaboliche*
Spiegare le correlazioni energetiche tra
catabolismo e anabolismo*.Conoscere i
donatori e gli accettori di elettroni nei
principali processi bioenergetici.
Descrizione dettagliata dei passaggi della
glicolisi con riferimento a formule di struttura
ed enzimi coinvolti*. Individuare e motivare
l’irreversibilità di alcune tappe.*Spiegare il
bilancio energetico della glicolisi*.
Gluconeogenesi: tappe comuni e non con la
glicolisi. Descrivere la sintesi del glicogeno e
la sua demolizione e la regolazione ormonale
di entrambe le vie.*
Comprendere il significato biologico della via
dei pentoso fosfati.
Comprendere il significato biochimica dei
processi fermentativi*
Riportare lo schema del ciclo di Krebs:
descrizione dettagliata dei passaggi* con
riferimento a formule di struttura ed enzimi
coinvolti.
Descrivere il ruolo degli ormoni nella
mobilizzazione dei trigliceridi negli
adipociti.* Descrivere le modalità di
passaggio dell’Acil-CoA attraverso la
membrana mitocondriale interna.
Saper spiegare la β-ossidazione degli acidi
grassi con descrizione dettagliata dei
passaggi.*
Conoscenza delle formule di struttura dei
corpi chetonici*.
Spiegare la funzione dei corpi chetonici.
Saper riportare esempi di reazioni di
transamminazione e deamminazione
ossidativa*. Mettere in relazione la modalità
di eliminazione dell’azoto in funzione della
disponibilità di acqua*. Riportare la formula
di struttura dell’urea e dedurre caratteristiche
chimico-fisiche della molecola.* Conoscere le
modalità di trasporto dell’azoto nel sangue*.
Descrivere a grandi linee il ciclo dell’urea e
• I MITOCONDRI E LA
FOSFORILAZIONE
OSSIDATIVA
Marzo/aprile (16 ore)
11. SINTESI PROTEICA
Aprile/maggio (10 ore)
Struttura del mitocondrio* Principali
processi biochimici dei mitocondri
Principali componenti della catena
respiratoria e loro funzioni nel trasporto
di elettroni e protoni*; la formazione del
gradiente elettrochimico*; il complesso
dell’ATP-sintasi e l’utilizzo del
gradiente protonico*.
Bilancio energetico finale del
catabolismo aerobico dei carboidrati*.
Le traslocasi della membrana
mitocondriale.
Regolazione della fosforilazione
ossidativa*.
Dogma della biologia molecolare*.
Il codice genetico*.
La struttura dei ribosomi di procarioti*,
eucarioti*, mitocondri e cloroplasti
Attivazione degli AA e formazione di
AA-tRNA*. Gli stadi centrali della
sintesi proteica*: formazione del
complesso d’inizio, allungamento della
catena peptidica, termine della sintesi.
Modifiche post-traduzionali*
l’equazione chimica complessiva con il
relativo bilancio energetico*.
Classificare gli amminoacidi in cheto genetici
e glucogenetici in base al destino metabolico.*
Fare esempi di precursori di amminoacidi non
essenziali.*
Descrivere il trasporto dell’acetil-CoA dalla
matrice mitocondriale al citosol utilizzando lo
schema. Comprendere le condizioni
metaboliche che determinano la biosintesi
degli acidi grassi*. Descrivere a grandi linee il
processo biosintetico. Affrontare il bilancio
energetico della biosintesi dell’acido
palmitico.
Spiegare il meccanismo generale di
funzionamento dell’accoppiamento
chemiosmotico*.
Descrivere il bilancio energetico totale del
catabolismo aerobico del glucosio*.
Spiegare il significato e le eccezioni del
dogma della biologia molecolare*.
Descrivere dettagliatamente le vari fasi della
biosintesi proteica* con riferimento ai
meccanismi specifici e fattori coinvolti.
I seguenti temi, trattati dagli studenti in classe terza e quarta nella materia Microbiologia, saranno oggetto di
ripasso.
14 ore (maggio)
LE ESIGENZE
MICROBICHE
METODI FISICI E CHIMICI
DELLA
STERILIZZAZIONE
MICROORGANISMI DI
INTERESSE
BIOTECNOLOGICO
RISCHIO CHIMICO E
BIOLOGICO NELL’USO DI
MICROORGANISMI
CRESCITA MICROBICA
Le esigenze dei microorganismi: principi nutrizionali e fonti di approvvigionamento;
parametri chimico/fisici importanti per la crescita microbica.
Classificazione dei terreni di coltura e principali componenti
Struttura della curva di crescita microbica
Controllo della crescita microbica: metodi di sterilizzazione chimici e fisici.
Agenti antimicrobici fisici: alte temperature, basse temperature, radiazioni
elettromagnetiche.
Agenti antimicrobici chimici: disinfettanti e antimicrobici, farmaci antimicrobici. La
resistenza agli antibiotici.
Lieviti. Batteri. Virus
Fattori di rischio nel laboratorio microbiologico. Il rischio biologico. Classificazione degli
agenti biologici.
Determinazione del numero: conta microbica fisica e conta biologica.
La curva di crescita. Aspetti matematici.
132 ore totali comprendenti le lezioni e le attività di laboratorio, le ore da dedicare a verifiche scritte e
orali e alle attività di recupero in itinere (per le quali sono previste 8 ore)
LABORATORIO
Si prevede lo svolgimento di esperienze connesse con i contenuti teorici sviluppati nei moduli suindicati.
In particolare il dipartimento ha concordato l'esecuzione comune delle seguenti esperienze:
•
•
•
•
•
•
•
•
•
•
•
Ripasso ed eventuale esecuzione di esperienze non svolte dell'anno precedente.
Estrazione del DNA dalla cipolla o frutta
Attività enzima “catalasi”.
Estrazione e purificazione per via acida della caseina.
Coagulazione enzimatica del latte.
Estrazione identificazione del colesterolo e fosfolipidi del tuorlo d’uovo.
Effetto della concentrazione dell’enzima e del calore di denaturazione sulla velocità di reazione
dell’enzima invertasi.
Attività enzima “tirosinasi”.
Diffusione e osmosi attraverso una membrana selettivamente permeabile.
Misurazione CO2 espirata in diverse condizioni fisiologiche.
Fermentazione del saccarosio.
L’attività di laboratorio si propone in questa disciplina il raggiungimento dei seguenti obiettivi:
(*contenuti e abilità da conseguire per il livello base)
Conoscere e applicare le norme di sicurezza nel laboratorio chimico;*
Conoscere e saper utilizzare strumenti di laboratorio e vetreria;*
Individuare e gestire le informazioni per organizzare le attività sperimentali;*
Effettuare l’elaborazione dati delle esperienze proposte;*
Interpretare dati e risultati sperimentali in relazione a semplici modelli teorici di riferimento;*
Redigere relazioni tecniche e documentare le attività individuali e di gruppo relative a situazioni
professionali;*
Controllare progetti e attività, applicando le normative sulla protezione ambientale e sulla sicurezza