Nomenclatura
Ogni specie chimica viene indicata con un nome univoco. Le
regole della nomenclatura sono pubblicate dalla IUPAC
(International Union of Pure and Applied Chemistry). Esiste
una nomenclatura tradizionale che e’ ancora utilizzata
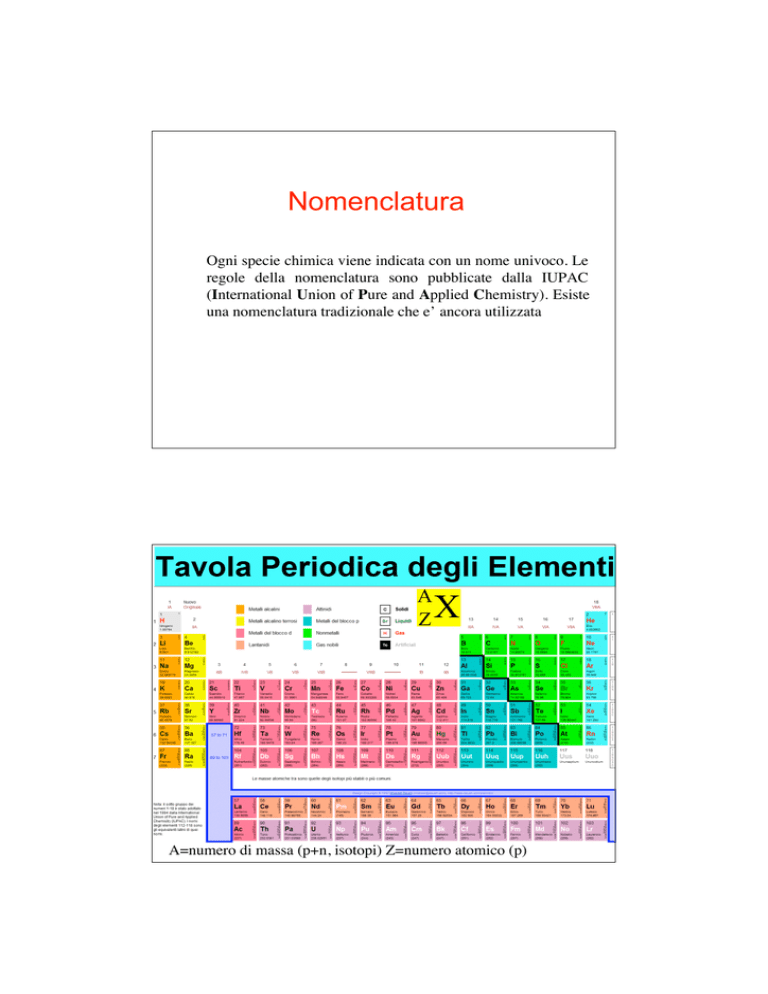
A
Tavola periodica
X
Z
A=numero di massa (p+n, isotopi) Z=numero atomico (p)
1) Indicare i numeri quantici n e l per i seguenti orbitali: 2s; 4d; 3p;
5f; 7p; 1s.
2) Indicare quale dei seguenti orbitali non esiste: 2p; 7s; 3f; 5d; 2d;
2s; 1p.
3) Indicare quale tra le seguenti quaterne di numeri quantici non
descrive correttamente lo stato di un elettrone in un atomo (i numeri
indicano nell’ordine, n, l, ml, ms):
q 1, 1, 0, -1/2
q 3, 2, -2, +1/2
q 4, 0, 0, +1/2
q 2, 1, -1, -1
q 6, 4, +4, -1/2
q 1, 0, +1, -1/2
q 4, -1, +1, +1/2
q -1, 0, 0, +1/2
4) Scrivere le configurazioni elettroniche dello stato fondamentale
degli elementi del gruppo 13.
5) Scrivere le configurazioni elettroniche dello stato fondamentale
degli elementi del gruppo 16.
6) Scrivere le configurazioni elettroniche dello stato fondamentale
degli elementi del gruppo 17.
7) Scrivere le configurazioni elettroniche dello stato fondamentale
degli elementi del gruppo 1.
Valenza
La valenza di un elemento in un composto
rappresenta il numero di legami che tale elemento
instaura con atomi di altri elementi, o anche il
numero di elettroni ceduti, acquistati o messi in
compartecipazione dall’elemento del composto
considerato
Elementi: zerovalenti
H, Cl, Br…: monovalenti
Ca in CaCl2, Mg in MgF2: bivalenti
N in NH3, P in PH3: trivalenti
C in CH4: tetravalenti
La valenza coincide con il
numero di atomi di
idrogeno, o di altri atomi
equivalenti che un elemento
può legare o sostituire
Elettroni di Valenza
Gli elettroni più esterni di un atomo sono chiamati di “Valenza”,
mentre quelli più interni sono chiamati elettroni del “Nocciolo”
Elemento
Elettroni
Elettroni di
del nocciolo valenza
Gruppo nel
sistema
periodico
Na
1s22s22p6
3s1
1A, 1
Si
1s22s22p6
3s23p2
4A, 14
Ti
1s22s22p6
4s23d2
4B, 4
4s24p3
5A, 15
3s23p6
As
1s22s22p6
3s23p63d10
Gli elettroni di valenza si possono rappresentare con il
simbolo di Lewis nel quale gli elettroni vengono
rappresentati con puntini
Li
Be
B
C
N
O
F
Ne
Tutti gli elementi tendono a raggiungere la configurazione elettronica
del gas nobile più vicino (s2p6 o s2 per quelli vicino all’elio).
Gli elementi tendono a raggiungere la configurazione elettronica ad
ottetto s2p6, condividendo, strappando o cedendo elettroni (regola
dell’ottetto di Kossel).
Riempimento orbitali
Composti neutri o ioni complessi a struttura
covalente
(il trasferimento di elettroni non é completo)
H2 + Cl2
2 HCl
legame covalente H-Cl con trasferimento parziale di elettroni da H a Cl
H Cl
Hδ+-Clδ-
La carica di ciascun atomo dovrebbe essere espressa da un numero
frazionario di difficile determinazione
Definizione di numero di ossidazione: rappresenta la carica formale,
espressa in numero di elettroni, che nella formazione di un composto
l’atomo cede o assume, schematizzando il composto come completamente
ionico ed assegnando gli elettroni di legame all’atomo più elettronegativo.
Elettronegatività: tendenza di un atomo ad attrarre a sé gli elettroni
quando si lega con altri atomi
Numero di ossidazione
Composti covalenti - Trasferimento elettronico non completo
HCl
attribuzione formale degli elettroni di legame al Cl (più elettroneg.)
H
Cl
carica formale +1 n.o. H = +1
carica formale -1 n.o. Cl = -1
Composti ionici - Trasferimento elettronico completo
CuCl2
il n.o. di ciascun ione coincide con la carica dello ione stesso
Cu
Cl
Cu2+ carica effettiva +2
Cl- carica effettiva -1
n.o. Cu = +2
n.o. Cl = -1
Regole per la determinazione del numero di ossidazione
Il n.o. di un atomo di una qualsiasi specie chimica allo stato
elementare é uguale a zero
Na, Fe, C, H2, Cl2 , P4, S8 , ecc.
n.o. = 0
Il n.o. di un qualsiasi ione monoatomico é uguale alla carica
dello ione
Ione
n.o.
Na+
+1
Ba2+
+2
Fe3+
+3
Br-1
S2-2
Il n.o. dell’idrogeno nei suoi composti é sempre uguale a +1, ad
eccezione degli idruri in cui é uguale a -1
n.o.H = +1
n.o.H = -1
HCl, H2 O, HNO3, NH3, NH4+, ecc.
NaH, CaH2 , B2H6, ecc.
Il n.o. dell’ossigeno nei suoi composti é sempre uguale a -2,
ad eccezione dei perossidi in cui é uguale a -1 e dei composti
con il fluoro in cui é uguale a +2
n.o.O = -2
n.o.O = -1
n.o.O = +2
H2O, BaO, H2SO4, Cl2O 5, ecc.
H2O 2 , Na2O2, ecc.
OF2
Regole per la determinazione del numero di ossidazione
La somma algebrica dei n.o. di tutti gli atomi in un composto neutro deve
essere uguale a zero
La somma algebrica dei n.o. di tutti gli atomi in uno ione poliatomico (NH4+,
SO42-, PO43-, ecc.) deve essere uguale alla carica dello ione
Gli elementi dei gruppi 1, 2, 3 del sistema periodico nei loro composti hanno
sempre n.o. positivo che si identifica con il numero di appartenenza del
gruppo
Gruppo
1
2
3
n.o.
+1
+2
+3
Il n.o. massimo di un atomo di un elemento non può essere superiore al numero
del gruppo di appartenenza
Gruppo
n.o.MAX
14 (IVA)
+4
15 (VA)
+5
16 (VIA)
+6
17 (VIIA)
+7
Esempi di calcolo del numero di ossidazione
___________________________________________________________________________
1) Calcolare il numero di ossidazione del Mn nel KMnO4.
_________________________
K
n.o. +1
O
n.o. -2
La molecola è neutra per cui:
n.o. Mn + n.o. K + 4 n.o. O = 0
Mn
n.o. +7
___________________________________________________________________________
2) Calcolare il numero di ossidazione del P nel H2PO4-.
_________________________
H
n.o. +1
O
n.o. -2
La molecola è elettricamente carica (-1) per cui:
2 n.o. H + n.o. P + 4 n.o. O = -1
P
n.o. +5
Esempi di calcolo del numero di ossidazione
3) Calcolare il numero di ossidazione dell’azoto N nei seguenti composti.
NO
NO2
HNO3
N2O5
_________________________
NO
n.o. N
+2
NO2
n.o. N
+4
HNO3
n.o. N
+5
N2O5
n.o. N
+5
____________________________________________________________________
4) Calcolare il numero di ossidazione del cromo Cr nei seguenti composti.
Cr2O3
Cr2O72_________________________
Cr2O3
n.o. Cr
+3
Cr2O72n.o. Cr
+6
Nomenclatura chimica
Ioni
Monoatomici
Cu2+
Poliatomici
H3 O+
Composti binari
Sali binari
Ossidi
Perossidi
Idruri
Idrossidi
Idracidi
NaCl
CO
H2 O2
NaH
NaOH
HCl
Composti ternari
Acidi ossigenati (ossoacidi)
H2SO4
Sali di acidi ossigenati
CaSO4
Nel caso in cui siano presenti due denominazioni la nuova nomenclatura verrà
esposta a sinistra mentre quella tradizionale a destra
Ioni positivi (cationi)
Ioni positivi monoatomici
Ione + nome del metallo + stato di ossidazione
notazione di Stock
suffisso oso (n.o. ↓) o ico (n.o. ↑)
Li+
3p
3n
2e
Cu2+
Cu+
Fe3+
Fe2+
Na+
Ca2+
Zn2+
Ione rame (II)
Ione rame (I)
Ione ferro (III)
Ione ferro (II)
Ione sodio
Ione calcio
Ione zinco
Ione rameico
Ione rameoso
Ione ferrico
Ione ferroso
Ione sodio
Ione calcio
Ione zinco
Ioni positivi poliatomici,
Ione + nome dell’elemento legato all’idrogeno + desinenza onio
Eccezione:
H3O +
PH4+
Ione ossonio
Ione fosfonio
NH 4+
Ione ammonio
Ioni negativi (anioni)
Ioni negativi monoatomici
Ione + nome dell’elemento + desinenza uro (in inglese ide)
BrFS2P3N3-
Ione bromuro
Ione fluoruro
Ione solfuro
Ione fosfuro
Ione nitruro
HC4N3Ione
Ione
Ione
idruro carburo nitruro
P3S2ClIone
Ione
Ione
fosfuro solfuro cloruro
BrIone
bromuro
Ioni negativi poliatomici
Ione + nome dell’elemento + desinenza uro
S22C22CN-
Ione disolfuro
Ione (di)carburo
Ione cianuro
O2OHO2 2H-
Ione ossido
Ione idrossido
Ione perossido
Ione idruro
O2FIone
Ione
ossido fluoruro
IIone
ioduro
Eccezioni:
ione ossidrile
Nelle formule, il costituente elettropositivo deve essere posto per primo, per
esempio:
KCl,
CaSO4,
Al(NO3)3
Nel caso di composti binari tra non metalli, secondo la pratica corrente, deve
essere posto per primo il costituente che precede nella serie:
B, Si, C, Sb, As, P, N, H, Te, Se, S, At, I, Br, Cl, O, F.
H
H
B
F
C
N
O
Si
P
S
Cl
As
Se
Br
Sb
Te
I
O
At
perciò:
NH3 e non H3N
CH4 e non H4C
Composti binari
Composti formati da due sole specie atomiche
La desinenza uro viene assunta dall’elemento più elettronegativo
NaCl
KI
NaF
LiH
AlN
SiC
GaAs
CdSe
Si3N 4
Cloruro di sodio
Ioduro di potassio
Fluoruro di sodio
Idruro di litio
Nitruro di alluminio
Carburo di silicio
Arseniuro di gallio
Seleniuro di cadmio
Nitruro di silicio
Eccezione:
i composti dell’ossigeno vengono chiamati ossidi anziché ossigenuri
Ossidi doppi
CaO
CO
CO2
SO3
SO2
NO
NO2
Ossido di calcio
Ossido di carbonio
Diossido di carbonio
Triossido di zolfo
Diossido di zolfo
Ossido di azoto
Diossido di azoto
Anidride carbonica
Anidride solforica
Anidride solforosa
BaTiO3
Triossido di bario e titanio(IV)
Titanato di bario
Perossidi
H2 O 2
Na2O 2
perossido di idrogeno
perossido di sodio
acqua ossigenata
Indicazione del numero di atomi nei composti
prefissi mono, di, tri, tetra, penta, esa, epta….
Mono spesso si omette; inoltre si omettono i prefissi quando la valenza dell’elemento è
una sola
OF2
CaCl2
CS2
(Di)fluoruro di ossigeno
(Di)cloruro di calcio
(Di)solfuro di carbonio
Quando gli elementi presentano più n.o.
notazione di Stock (per l’elemento meno elettronegativo)
suffisso oso (n.o. ↓) o ico (n.o. ↑)
FeCl2
FeCl3
CuCl
CuCl2
SnCl2
SnCl4
Composti intermetallici
TiSi2
Cloruro di ferro (II)
Dicloruro di ferro
Cloruro di ferro (III)
Tricloruro di ferro
Cloruro di rame (I)
(Mono)cloruro di rame
Cloruro di rame (II)
Dicloruro di rame
Cloruro di stagno (II)
Dicloruro di stagno
Cloruro di stagno (IV)
Tetracloruro di stagno
Cloruro ferroso
Cloruro ferrico
Cloruro rameoso
Cloruro rameico
Cloruro stannoso
Cloruro stannoso
Disiliciuro di titanio
Idrossidi
Composti formati da un catione metallico e da uno o più gruppi OH- che ne
neutralizzano la carica.
Idrossido + nome del metallo + stato di ossidazione
notazione di Stock
suffisso oso (n.o. ↓) o ico (n.o. ↑)
NaOH
Idrossido di sodio
Mg(OH)2
Idrossido di magnesio
Fe(OH)3
Idrossido di ferro(III)
Idrossido ferrico
Fe(OH)2
Idrossido di ferro(II)
Idrossido ferroso
Idracidi
Composti formati dall’idrogeno con elementi non metallici dei gruppi 16 e 17)
regole per i composti binari
Acido + nome dell’elemento non metallico + suffisso idrico
HCl
HBr
HF
H2S
HCN
Nomi d’uso
H2O
NH3
PH3
AsH3
SbH3
SiH4
B2H 6
N2H 4
Cloruro di idrogeno
Bromuro di idrogeno
Fluoruro di idrogeno
Solfuro di diidrogeno
Cianuro di idrogeno
Acido cloridrico
Acido bromidrico
Acido fluoridrico
Acido solfidrico
Acido cianidrico
Acqua
Ammoniaca
Fosfina
Arsina
Stibina
Silano
Diborano
Idrazina
Composti ternari
Acidi ossigenati (ossoacidi)
Composti formati da un atomo di un elemento legato (con legami covalenti) ad uno o
più gruppi OH e ad eventuali atomi di ossigeno.
Acido + nome dell’elemento + stato di ossidazione (suffisso oso per n.o. ↓ o ico per
n.o. ↑)
Acido + nome dell’elemento + suffisso ico + stato di ossidazione (notazione di Stock)
+ numero di atomi di ossigeno (prefissi di, tri, …)
HNO3
Acido triossonitrico (V)
Acido nitrico
HNO2
Acido diossonitrico (III)
Acido nitroso
H2SO4
Acido tetraossosolforico (VI)
Acido solforico
H2SO3
Acido triossosolforico (IV)
Acido solforoso
Quando il non metallo presenta più di due n.o.
uso dei prefissi per (n.o. ↑) e ipo (n.o. ↓)
HClO4
Acido tetraossoclorico (VII)
Acido perclorico
HClO3
Acido triossoclorico (V)
Acido clorico
HClO2
Acido diossoclorico (III)
Acido cloroso
HClO
Acido (mono)ossoclorico (I)
Acido ipocloroso
Acidi con un diverso contenuto di H2O vengono indicati con i prefissi:
orto (maggior numero molecole H2O)
meta (minor numero molecole H2O)
H3PO4
Acido ortofosforico Acido tetraossofosforico (V)
n H3PO4 - n H2O
(HPO3 ) n
Acido metafosforico Acido triossofosforico (V)
H4SiO4
Acido ortosilicico Acido tetraossosilicico (IV)
n H4SiO4 - n H2O
(H 2 SiO3) n
Acido metasilicico Acido triossosilicico (IV)
Gli acidi meta hanno una struttura polimerica. L’acido che si ottiene da due molecole di
acido orto - una molecola di H2 O è indicato con il prefisso di (vecchia nomenclatura piro)
2 H3PO4 - H2O
H4 P 2 O 7
Acido difosforico
Acido eptaossodifosforico (V)
2 H2SO4 - H2O
H2 S 2 O 7
Acido disolforico
Acido eptaossodisolforico (VI)
2 H3CrO4 - H2O
H4Cr2O 7
Acido dicromico
Acido eptaossodicromico (V)
Ossoanioni
Ione + nome dell’elemento + stato di ossidazione (suffisso ito per n.o. ↓ o ato per n.o. ↑)
Ione + nome dell’elemento + suffisso ato + stato di ossidazione (notazione di Stock) +
numero di atomi di ossigeno (prefissi di, tri,…)
SO42-
Ione tetraossosolfato (VI)
Ione solfato
SO32-
Ione triossosolfato (IV)
Ione solfito
NO3-
Ione triossonitrato (V)
Ione nitrato
NO2-
Ione diossonitrato (III)
Ione nitrito
SiF6 2-
Ione esafluorosilicato (IV)
Quando il non metallo presenta più di due n.o.
uso dei prefissi per (n.o. ↑) e ipo (n.o. ↓)
ClO4ClO3ClO2ClO-
Ione tetraossoclorato (VII)
Ione triossoclorato (V)
Ione diossoclorato (III)
Ione monossoclorato (I)
Ione perclorato
Ione clorato
Ione clorito
Ione ipoclorito
ClOIone
ipoclorito
CO32Ione
carbonato
NO2Ione
nitrito
NO3Ione
nitrato
SO32Ione
solfito
SO42Ione
solfato
ClO2Ione
clorito
ClO3Ione
clorato
BrOBrO2Ione
Ione
ipobromito bromito
ClO4Ione
perclorato
BrO3BrO4Ione
Ione
bromato perbromato
Nomi tradizionali degli anioni ammessi dalla IUPAC insieme a quelli dell’acido
corrispondente
Ione
Acido
BO33-
Borato
H3BO3
Borico
CO32-
Carbonato
H2CO3
Carbonico
SiO44-
(Orto)silicato
H 4SiO4
(Orto)silicico
NO2-
Nitrito
HNO2
Nitroso
NO3-
Nitrato
HNO3
Nitrico
PO43-
(Orto)fosfato
H 3PO4
(Orto)fosforico
SO32-
Solfito
H2SO3
Solforoso
SO42-
Solfato
H2SO4
Solforico
ClO-
Ipoclorito
HClO
Ipocloroso
ClO2-
Clorito
HClO2
Cloroso
ClO3-
Clorato
HClO3
Clorico
ClO4-
Perclorato
HClO4
Perclorico
CrO42-
Cromato
H 2CrO4
Cromico
Cr2O7
2-
Dicromato
H 2 Cr2O7
Dicromico
MnO42-
Manganato
H 2MnO4
Manganico
MnO4-
Permanganato
HMnO4
Permanganico
Sali degli acidi ossigenati
Composti formati dall’anione di un ossoaciddo e da un metallo
nome del corrispondente ossoacido + nome del catione
CaSO 4
tetraossosolfato (VI) di calcio
Solfato di calcio
CaSO 3
triossosolfato (V) di calcio
Solfito di calcio
NaNO3
Triossonitrato (V) di sodio
Nitrato di sodio
NaNO2
Diossonitrato (III) di sodio
Nitrito di sodio
Sali con atomi di idrogeno
Idrogeno + nome del sale corrispondente
NaHCO3 idrogenotriossocarbonato (IV) di sodio Bicarbonato di sodio
KHSO3
idrogenotriossosolfato (IV) di potassio Bisolfito di potassio
NaH2PO4 diidrogenotetraossofosfato (V) di sodio












