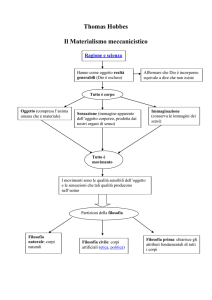
Appunti su calore e temperatura
TEMPERATURA (T): è una grandezza fisica che misura lo stato termico di un
corpo cioè lo stato di agitazione delle particelle che lo compongono o anche la loro
energia cinetica media.
Due corpi hanno temperature diverse se provocano sensazioni termiche diverse, che
sono però soggettive. Per misurare oggettivamente la temperatura per mezzo di
termometri, si sfrutta il fenomeno, quasi universale, della dilatazione del volume dei
corpi all'aumentare della loro temperatura.
L'acqua è una sostanza che non rispetta tale regola.
Infatti ha la sua massima densità a 4 °C: quindi se riscaldiamo l'acqua da 0 °C a 4 °C,
essa si contrae invece di espandersi e diventa più densa. Ciò accade perché le
molecole dell'acqua allo stato solido erano disposte su un reticolo cristallino in modo
ordinato e con ampi spazi vuoti, ora allo stato liquido possono avvicinarsi
maggiormente, diminuendo così gli spazi vuoti. Oltre i 4 °C l'acqua torna a
espandersi e quindi la sua densità a ridursi, come è possibile vedere dalla figura
seguente.
Tale comportamento dell'acqua ha importanti conseguenze ecologiche nei laghi,
soprattutto alle latitudini più elevate. Infatti quando d'inverno le temperature si
abbassano, l'acqua dei laghi in superficie si raffredda più di quella in profondità ed
essendo più densa tende a finire sul fondo, mentre quella degli strati più profondi,
meno densa perché più calda, tende a risalire verso la superficie. Alla fine l'acqua del
lago sarà tutta a circa 4 °C. Un ulteriore abbassamento della temperatura porta al
congelamento dello strato più superficiale del lago, senza ulteriore possibilità di moti
verticali. Quindi l'acqua in un lago inizia a congelare in superficie mentre quella
sottostante è a circa 4 °C. Il ghiaccio e la neve che si depositano in superficie
fungono anche da isolanti, limitando l'ulteriore formazione di ghiaccio. In questo
modo viene garantita la sopravvivenza degli organismi acquatici, pesci in primis. Se i
laghi dovessero invece iniziare a congelarsi sul fondo, si potrebbe osservare
l'integrale solidificazione delle loro acque, con inverni particolarmente lunghi e
freddi, con nessuna garanzia di sopravvivenza per le specie acquatiche.
CALORE o ENERGIA TERMICA (Q): è l'energia trasferita tra due corpi a causa
della loro differenza di temperatura. Si misura in calorie (cal) o joule (J). Da ricordare
che 1 cal = 4,186 J. Il calore si trasmette in tre modi: conduzione, convezione,
irraggiamento.
PRINCIPIO ZERO DELLA TERMODINAMICA: se due corpi hanno diversa
temperatura, il calore fluisce da quello più caldo a quello più freddo, fino a quando
entrambi i corpi raggiungono la stessa temperatura. Quindi due corpi in contatto
termico, ossia che consentono fra loro un passaggio di calore, sono in equilibrio
quando hanno la stessa temperatura.
CALORE SPECIFICO (cs): è la quantità di energia (=calore) assorbita (o ceduta) da
1 Kg di materiale che provoca un aumento (o diminuzione) della temperatura di 1 K.
Tale definizione considera il fatto che la massa e la temperatura nel S.I. sono appunto
espresse rispettivamente in Kg e K. Da notare che nella prassi i valori del calore
specifico sono espressi usando, oltre a cal, g e °C.
LEGGE FONDAMENTALE DELLA TERMOLOGIA: Q = cs . m . (T2-T1)
con Q = calore, cs = calore specifico, m = massa, T 2 = temperatura finale, T1 =
temperatura iniziale .
Q è dunque il calore che occorre fornire ad un corpo, di massa m e con un certo
calore specifico (cs), per innalzare la sua temperatura da T1 a T2 °C.
Si osserva che, se non varia il materiale considerato, c s è una costante quindi il calore
Q da fornire è direttamente proporzionale alla massa m del corpo e alla differenza
(ΔT) fra la temperatura iniziale e quella finale: maggiori saranno la massa e la
differenza di temperatura, maggiore sarà la quantità di calore da fornire al corpo.
prof. Luigi Cenerelli a.s. 2015-16