A
0
ress
Agenzia Regionale
per i Servizi Sanitari
Ente Strumentale della Regione Piemonte
istituito con L.R. n. 10 del 16.03.1998
PERCORSO
DIAGNOSTICO
TERAPEUTICO
ASSISTENZIALE DELLE
MALATTIE TIROIDEE
Agenzia Regionale per i Servizi Sanitari - Regione Piemonte
2010
SOMMARIO
1. DESCRIZIONE GENERALE DEL DOCUMENTO ...............................................
1.1 Il Committente..............................................................................................
1.2 Il Gruppo di lavoro ........................................................................................
1.3 Coordinamento del Gruppo di Lavoro ..............................................................
1.4 Stesura e revisione del Documento……………………………………………………………….
1.5 Abbreviazioni usate nel testo..........................................................................
1.6 Premessa......................................................................................................
2
2
2
2
3
3
4
2. METODOLOGIA.............................................................................................. 6
2.1 Metodologia di lavoro………………………………………………………………………………….. 6
2.2 Ricerca della letteratura ................................................................................. 6
2.3 Valutazione delle Linee Guida ......................................................................... 6
2.4 Il percorso di riferimento................................................................................ 7
3. CRITERI DI ELEGGIBILITÀ E DI INCLUSIONE.............................................
3.1 Criteri di eleggibilità.......................................................................................
3.2 Criteri di inclusione ed esclusione ...................................................................
8
8
8
4. LE MALATTIE TIROIDEE: INQUADRAMENTO CLINICO................................
9
5. LINEE GUIDA E LETTERATURA DI RIFERIMENTO .......................................
5.1 Linee Guida ..................................................................................................
5.2 Letteratura di riferimento ...............................................................................
5.3 Valutazione Linee Guida con metodo AGREE....................................................
5.4 Livelli di prove scientifiche e grading delle raccomandazioni ..............................
11
11
11
13
14
Diagrammi a matrice.……………………………………………………………………………………… 16
6. IL PERCORSO DI RIFERIMENTO ..................................................................
6.1 Malattie tiroidee disfunzionali (ipertiroidismo) ..................................................
6.2 Malattie tiroidee disfunzionali (ipotiroidismo) ...................................................
6.3 Malattie tiroidee nodulari ...............................................................................
19
19
23
27
7. INDICATORI .................................................................................................. 35
8. APPENDICE………………………………………………………………………………………………….
8.1 Terapia chirurgica delle tireopatie ...................................................................
8.2 Radioterapia metabolica delle tireopatie…………………………………………………………
8.3 Classi di priorità…………………………………………………………………………………………..
36
36
39
40
AReSS Piemonte
PDTA Malattie Tiroidee
1
1. DESCRIZIONE GENERALE DEL DOCUMENTO
1.1 IL COMMITTENTE
Assessorato alla Tutela della Salute e Sanità - Regione Piemonte
1.2 IL GRUPPO DI LAVORO
Gianluca Aimaretti
Giorgio Borretta
Enrico Brignardello
Margherita Burchio
Maurilio Deandrea
Roberto Diecidue
Guido Gasparri
Paolo Piero Limone
Mauro Maccario
Giovanni Mensa
Marco Migliardi
Pier Giorgio Nasi
Tommaso Novo
Fabio Orlandi
Nicola Palestini
Riccardo E. Pellerito
Andrea Pizzini
Ornella Testori
Bruno Torchio
Andrea Veltri
Endocrinologo, AOU Maggiore Novara
Endocrinologo, AO S.Croce Cuneo
Endocrinologo, AOU S.Giovanni Battista Torino
Assessorato Tutela della Salute e Sanità, Regione Piemonte
Endocrinologo, AO Ordine Mauriziano Torino
Epidemiologo, Servizio Sovrazonale Epidemiologia ASL TO3
Chirurgo, AOU S.Giovanni Battista Torino
Endocrinologo, AO Ordine Mauriziano Torino
Endocrinologo, AOU S.Giovanni Battista Torino
Chirurgo, AO Ordine Mauriziano Torino
Laboratorio Analisi, AO Ordine Mauriziano Torino
Chirurgo, AO Ordine Mauriziano Torino
CPSE Ambulatori, AO Ordine Mauriziano Torino
Endocrinologo, PO Gradenigo
Chirurgo, AOU S.Giovanni Battista Torino
Medicina Nucleare, AO Ordine Mauriziano Torino
MMG ASL-TO2
Medicina Nucleare, AO SS. Antonio Biagio Alessandria
Anatomopatologo, AO Ordine Mauriziano Torino
Radiologo, AOU S. Luigi Gonzaga Orbassano
Alla redazione di questo Documento hanno inoltre collaborato:
- il prof. Giuseppe Boccuzzi (Endocrinologo, AOU S.Giovanni Battista Torino);
- la dr.ssa Manuela Motta (Anatomopatologa, AO Ordine Mauriziano Torino);
- il dr. Marco Volante (Anatomopatologo, AOU S. Luigi Gonzaga Orbassano).
1.3 COORDINAMENTO DEL GRUPPO DI LAVORO
Paolo Piero Limone
Enzo C. Farina
Endocrinologo, AO Ordine Mauriziano Torino
A.Re.S.S. Piemonte, Referente di Progetto
Si ringrazia la Sig.ra Angelica Palma per il coordinamento delle attività di Segreteria.
AReSS Piemonte
PDTA Malattie Tiroidee
2
1.4 STESURA E REVISIONE DEL DOCUMENTO
Data prima stesura………
Data stesura definitiva…
Numero revisione…………
19/05/2009
29/11/2010
01
1.5 ABBREVIAZIONI USATE NEL TESTO
TERMINE
131
I
99m
Tc
AbTg
AbTPO
AGREE
ASL
BRAF
CT
18
FDG-PET
FMTC
FNAB
FPTC
fT3
fT4
HBME
ICD
LG
MEN2
MIVAT
MMG
MTC
PCR
PDTA
PEI
PPAR
R-TSH
RAS
RET-PTC
RF
SDO
Tg
TRAb
TRIAC
TSH
VES
DESCRIZIONE
Iodio 131
Tecnezio 99
Antibodies anti-Thyroglobulin
Antibodies anti-Thyroid Peroxydase
Appraisal of Guidelines for Research & Evaluation
Azienda Sanitaria Locale
Serine/threonine-protein kinase
Calcitonina
Tomografia ad emissione di positroni con Fluoro-DesossiGlucosio
Familial Medullary Thyroid Carcinoma
Fine Needle Aspiration Biopsy
Familial Papillary Thyroid Carcinoma
Triiodotironina libera
Tiroxina libera
Human Bone Marrow Endothelial
International Classification of Diseases
Linea Guida
Neoplasia endocrina multipla di tipo 2
Minimally Invasive Video-Assisted Thyroidectomy
Medico di Medicina Generale
Medullary Thyroid Cancer
Proteina C Reattiva
Percorso Diagnostico Terapeutico Assistenziale
Percutaneous Ethanol Injection
Peroxisome Proliferator-Activated Receptor
TSH Reflex Test
Rat Sarcoma
Rearranged during Transfection - Papillary Thyroid Carcinoma
RadioFrequenza
Scheda di Dimissione Ospedaliera
Tireoglobulina
Thyrotropin Receptor Antibodies
TriIodothyroacetic Acid
Thyroid Stimulating Hormone
Velocità di Eritrosedimentazione
AReSS Piemonte
PDTA Malattie Tiroidee
3
1.6 PREMESSA
Uno dei principali obiettivi dell’assessorato alla Tutela della Salute e Sanità e dell’Agenzia
Regionale per i Servizi Sanitari (A.Re.S.S.) in Piemonte è di promuovere l’integrazione
organizzativa e clinica tra le Aziende sanitarie nell’ottica di un miglioramento continuo della qualità,
favorendo l’uniformità, la congruità e la continuità degli interventi.
Il Percorso Diagnostico Terapeutico Assistenziale (PDTA) è uno strumento di “Clinical
Governance” che, attraverso un approccio per processi, consente di strutturare e integrare attività
e interventi in un contesto in cui diverse specialità, professioni e aree d’azione (territorio, ospedale
ecc.) sono coinvolte nella presa in cura del cittadino che presenta problemi di salute. Il PDTA
consente inoltre di valutare la congruità delle attività svolte rispetto agli obiettivi, alle LG di
riferimento e alle risorse disponibili conducendo, attraverso la misura delle attività e degli esiti, al
miglioramento dell’efficacia e dell’efficienza di ogni intervento.
La decisione di definire dei PDTA relativi alla patologia tiroidea nasce soprattutto dalla
elevata prevalenza di questa condizione nella nostra Regione, tradizionalmente area di endemia
gozzigena a causa della carenza di iodio. Inoltre, l’introduzione negli ultimi anni di tecniche
diagnostiche progressivamente più raffinate (determinazione del TSH con metodiche ultrasensibili,
ecografia ad elevata risoluzione) ha fatto sì che vengano sempre più spesso identificate disfunzioni
subcliniche oppure piccole formazioni nodulari non rilevabili all’esame clinico; ciò ha determinato
un sensibile incremento di condizioni cliniche un tempo non diagnosticabili (o diagnosticate più
tardivamente), comportando problematiche nuove nella gestione clinica, con un frequente ricorso
a consulenze specialistiche. Trattandosi di patologie a prevalente gestione ambulatoriale (se si
escludono le situazioni neoplastiche avanzate, quelle che richiedono un trattamento chirurgico o
radiometabolico, o quelle correlate alle complicanze, soprattutto cardiovascolari) e considerando le
problematiche sopraccitate, vi è purtroppo una carenza di dati epidemiologici precisi.
Per quanto riguarda la PATOLOGIA NODULARE, dati recenti (seppur non riferiti
specificamente al nostro territorio) indicano che la prevalenza di patologia nodulare di rilievo
palpatorio è compresa fra il 3 e il 7% della popolazione, mentre all’esame ecografico o al riscontro
autoptico può raggiungere il 50%. Per quanto riguarda il Piemonte, in un’indagine condotta negli
studenti di età compresa tra 11 e 15 anni (Saggiorato 2006) si è osservato una prevalenza di
gozzo del 3,9%; dati relativi ad altre regioni italiane indicano una frequenza di patologia nodulare
intorno al 30% nella popolazione della V e VI decade.
Il principale problema clinico dei nodi tiroidei è la differenziazione tra patologia neoplastica
e non. Mentre i nodi tiroidei sono nell’insieme piuttosto frequenti, la percentuale di quelli che
risultano maligni è relativamente esigua, anche se viene riportata in aumento. Sebbene il
carcinoma della tiroide rappresenti l'1-2% della patologia neoplastica, meno dell’1% di tutte le
morti per cancro sono ad esso imputabili, in quanto la maggior parte di questi tumori dimostra
scarsa aggressività e ha quindi una prognosi favorevole. Vi sono comunque alcune forme (quali il
carcinoma midollare) che, seppur relativamente rare, sono però di difficile trattamento: in questi
casi una diagnosi precoce modifica nettamente le possibilità di eradicazione della malattia e la
conseguente prognosi.
I dati del registro Tumori della Regione Piemonte riferiti alla città di Torino indicano, per i
tumori della tiroide (ICD-10: C73), una prevalenza al 31/12/2004 (dal 1985) di 43,3 casi/100.000
nei maschi e di 149,3/100.000 nelle femmine. L’incidenza annua mostra una tendenza all’aumento
negli anni, in particolare nelle donne: tra il 2004 e il 2006 è risultata di 6,4 nei maschi e di
17,9/100.000 nelle femmine. Infine la mortalità annua (sempre riferita al periodo 2004-2006) è
risultata pari a 0,7/100.000 nei maschi e 1,4/100.000 nelle femmine.
AReSS Piemonte
PDTA Malattie Tiroidee
4
Circa gli aspetti epidemiologici relativi alla PATOLOGIA DISFUNZIONALE, dati provenienti
dagli Stati Uniti (US Preventive Task Force 1996), in accordo con quanto precedentemente
segnalato da altri studi, stimano una prevalenza delle alterazioni funzionali della tiroide
clinicamente manifeste (iper- e ipotiroidismo) tra l’1 ed il 4% della popolazione adulta e
adolescente, mentre l’incidenza annuale risulta dello 0,05 - 0,1% per l’ipertiroidismo e dello 0,08 0,2% per l’ipotiroidismo.
Per quanto riguarda i ricoveri ospedalieri, da un esame delle SDO della nostra Regione
relative all’anno 2008, si evince che i ricoveri per patologia tiroidea costituiscono lo 0,5% dei
ricoveri totali (0,6% dei ricoveri ordinari, 0,4% dei ricoveri in Day-Hospital).
La frequenza della patologia tiroidea è dimostrata anche dal gran numero di richieste di
esami di laboratorio per esterni effettuati nella nostra Regione, come riportato nella seguente
Tabella:
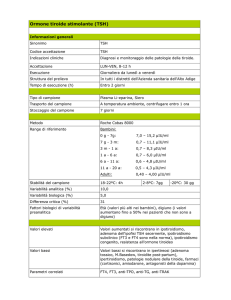
Esame
TSH
fT4
fT3
Calcitonina
Tg
AbTg
AbTPO
TRAb
TOTALE
2006
2007
2008
2009
n°
627.881
% TSH
100,0
n°
675.846
% TSH
100,0
n°
755.393
% TSH
100,0
n°
803.069
% TSH
100,0
509.481
81,1
538.751
79,7
579.713
76,7
547.310
68,1
434.256
69,2
446.610
66,1
455.563
60,3
401.145
49,9
18.889
3,0
21.207
3,1
25.191
3,3
27.967
3,4
29.813
4,7
30495
4,6
33.105
4,3
29.903
3,7
67.962
10,8
71.446
10,6
76.399
10,1
73.610
9,1
n.d.
n.d.
79.405
11,7
85.156
11,2
83.525
10,4
21.106
3,4
22.917
3,4
23.887
3,1
23.334
2,9
1.709.388*
-
1.887.127
-
2.034.407
-
1.989.963
-
n.d.=non disponibile; *=escluso AbTPO; %TSH=indica il numero degli esami posto 100 il valore del TSH
Occorre rilevare che le richieste di questi esami non sempre seguono criteri di
appropriatezza, il che può comportare l’esecuzione di esami inutili o la mancata esecuzione di
esami necessari ad un corretto inquadramento o follow-up dei pazienti affetti o con sospetta
patologia tiroidea.
Per quanto riguarda questo Documento, si è deciso di inserire la patologia tiroidea
suddividendola in due principali capitoli, patologia nodulare e disfunzionale (per i dettagli si
rimanda al paragrafo sull’inquadramento clinico), per i quali sono stati realizzati percorsi separati;
considerando tuttavia la possibilità di embricamento delle due condizioni, è stata prevista la
possibilità del “passaggio” di un paziente da un percorso all’altro.
La realizzazione del presente PDTA, riferito alle Malattie della Tiroide, è stata quindi promossa
dall’A.Re.S.S. con l’obiettivo di offrire a tutti gli operatori interessati nel processo di diagnosi e cura
di tale patologia linee di indirizzo semplici e applicabili su tutto il territorio regionale, i cui obiettivi
principali sono:
• Costruzione del percorso ottimale nel processo diagnostico e di follow-up delle tireopatie,
con particolare attenzione all’appropriatezza delle richieste degli esami di laboratorio.
• Identificazione dei criteri standard minimi necessari per la diagnosi ed il follow-up delle
tireopatie.
• Diagnosi precoce delle neoplasie tiroidee.
• Identificazione degli attori responsabili e dei ruoli all’interno del PDTA.
• Identificazione di indicatori di processo per la verifica dell’implementazione del PDTA.
AReSS Piemonte
PDTA Malattie Tiroidee
5
2. METODOLOGIA
2.1
METODOLOGIA DI LAVORO
L’elaborazione di questo Documento si avvale del supporto metodologico fornito dal
documento propedeutico “Raccomandazioni per la costruzione di percorsi Diagnostico Terapeutici
Assistenziali e Profili Integrati di Cura nelle Aziende Sanitarie della Regione Piemonte” (A.Re.S.S.
2007).
Il processo di elaborazione del Documento si è sviluppato attraverso le seguenti fasi:
• individuazione di un gruppo di esperti multiprofessionale e multispecialistico;
• ricerca della letteratura scientifica con una strategia in grado di rintracciare le evidenze
scientifiche, le LG, le revisioni sistematiche più recenti;
• valutazione delle LG con il metodo AGREE (AGREE 2002);
• valutazione delle prove scientifiche raccolte in base al sistema di grading presente nelle LG
adottate;
• definizione del percorso assistenziale, contenente le raccomandazioni derivate da LG e consigli
derivati dal parere di esperti del Gruppo di Lavoro (percorso di riferimento);
• discussione della bozza del Documento, redazione finale del Documento.
2.2
RICERCA DELLA LETTERATURA
La ricerca è stata effettuata nei siti di Società Scientifiche italiane e internazionali dell’area
di competenza:
a)
b)
c)
d)
e)
f)
g)
h)
i)
j)
American Association of Clinical Endocrinologists (AACE).
American Thyroid Association (ATA).
Associazione Europea di Medicina Nucleare (EANM).
Associazione Italiana della Tiroide (AIT).
Associazione Italiana di Medicina Nucleare (AIMN).
Associazione Medici Endocrinologi (AME).
Endocrine Society, British Thyroid Association (BTA).
European Thyroid Association (ETA).
Società Italiana di Endocrinologia (SIE).
Società Italiana di Ultrasonologia in Medicina e Biologia (SIUMB).
a)
b)
c)
d)
e)
f)
National Guidelines Clearinghouse.
PubMed/Pubmed Guidelines.
Sistema Nazionale Linee Guida (SNLG).
CMA Infobase.
NeHS Guidelines Finder.
Scottish Intercollegiate Guidelines Network (SIGN).
e delle Agenzie e Organizzazioni di produzione e disseminazione di LG:
2.3
VALUTAZIONE DELLE LINEE GUIDA
Le LG individuate sono state valutate con il metodo AGREE.
AReSS Piemonte
PDTA Malattie Tiroidee
6
2.4
IL PERCORSO DI RIFERIMENTO
Il percorso di riferimento è il PDTA raccomandato e rappresenta la pianificazione logica e
cronologica degli interventi necessari e ottimizzati per la diagnosi e la terapia.
Le raccomandazioni desunte dalle LG sono precedute da un simbolo grafico (Î), il testo è
in corsivo, e sono seguite dalla sigla della LG (vedi paragrafo 5.3) e dai livelli di evidenza e
raccomandazione (vedi paragrafo 5.4). Esempio:
ÎI pazienti con ipertirodismo subclinico non trattato dovrebbero essere seguiti a lungo termine
con controlli di fT4 e TSH ogni 6-12 mesi [BTA III-B].
In alcuni limitati casi, gli estensori di questo PDTA hanno ritenuto necessario formulare
raccomandazioni; tali raccomandazioni riportano la sigla [Co.Est.] (Consenso degli Estensori).
AReSS Piemonte
PDTA Malattie Tiroidee
7
3. CRITERI DI ELEGGIBILITÀ E DI INCLUSIONE
3.1
CRITERI DI ELEGGIBILITÀ
I criteri individuati nella scelta delle tireopatie d’interesse nella costruzione di questo PDTA
sono i seguenti:
- elevata prevalenza della patologia;
- disomogeneità nell’approccio diagnostico e terapeutico con frequenti inappropriatezze nelle
richieste degli esami, soprattutto in fase di screening (in parte legate alla mancanza di LG,
soprattutto relative alla patologia disfunzionale, in parte legate alla insufficiente conoscenza
delle LG laddove disponibili, in particolare relativamente alla patologia nodulare).
3.2
CRITERI DI INCLUSIONE ED ESCLUSIONE
3.1 - CRITERI DI INCLUSIONE
Considerata la sommaria suddivisione della patologia tiroidea nei due capitoli della
patologia nodulare e disfunzionale, vengono incluse le seguenti tipologie di pazienti:
• Riscontro clinico (alla palpazione) di formazioni nodulari della tiroide, isolate o nell’ambito di
un gozzo multinodulare.
• Riscontro incidentale (in corso di esami strumentali non volti alla tiroide) di formazioni
nodulari della tiroide.
• Sintomi suggestivi di iper- o di ipotiroidismo.
3.2 - CRITERI DI ESCLUSIONE
• Formazioni nodulari cistiche evidenziate ecograficamente, <5 mm, senza aggetti parietali
(purché tutta la tiroide sia stata esaminata in modo accurato).
• Tutte le condizioni di emergenza che richiedono accertamenti immediati, ad es. emergenze
cardiovascolari (fibrillazione atriale, tromboembolismi, scompenso cardiaco acuto, stato
edemigeno diffuso, ecc.), compressione cervico-mediastinica.
• Limitatamente alla patologia disfunzionale, i pazienti di età <14 anni.
AReSS Piemonte
PDTA Malattie Tiroidee
8
4. LE MALATTIE TIROIDEE: INQUADRAMENTO CLINICO
Per una semplificazione dell’approccio clinico, si è suddivisa la patologia tiroidea nei due
capitoli della patologia nodulare e di quella disfunzionale, ricordando comunque come tra queste
non vi sia sempre una netta separazione: la patologia nodulare può associarsi a iper- o a
ipofunzione tiroidea, così come in condizioni cliniche in cui prevale l'aspetto disfunzionale può
essere presente una patologia nodulare non strettamente correlata alla disfunzione e che può
dunque richiedere una valutazione diagnostica specifica.
La patologia nodulare può essere neoplastica o non neoplastica. Quest’ultima è
rappresentata per lo più da:
1) gozzo non tossico (che può manifestarsi con aspetto sia pluri- che uninodulare);
2) cisti semplici;
3) cisti emorragiche (generalmente si tratta di nodi colloidocistici nel cui ambito si verificano
fenomeni emorragici, anche se occasionalmente possono presentarsi in questo modo i carcinomi
papillari);
4) tiroiditi.
Nell'ambito dei nodi neoplastici, nei paesi con adeguato apporto iodico il carcinoma
differenziato rappresenta l’85% dei casi e l’istotipo prevalente è quello papillare (60-80%); nelle
aree di endemia gozzigena il carcinoma follicolare ha comunque una prevalenza non trascurabile.
Data la grande diffusione dell'ecografia, sono di riscontro sempre più frequente lesioni
neoplastiche di piccole dimensioni, <1 cm di diametro, definite microcarcinomi; si tratta di solito di
carcinomi papillari. Il workup diagnostico non si differenzia sostanzialmente da quello dei tumori di
maggiori dimensioni: il problema principale risiede nella decisione di sottoporre ad accertamento
bioptico nodi di dimensioni <1 cm.
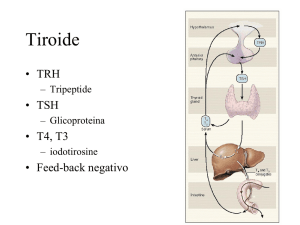
Per quanto riguarda la patologia disfunzionale, per ipertiroidismo si intende una
iperfunzione della ghiandola tiroidea che determina tireotossicosi. Per tireotossicosi si intende la
sindrome clinica derivata dalla presenza di:
- aumento assoluto (oltre il range di normalità) dei livelli in circolo degli ormoni tiroidei
(tireotossicosi conclamata);
- aumento relativo dei livelli in circolo degli ormoni tiroidei (ancora nel range di normalità)
testimoniato dalla presenza di TSH inibito, in presenza di funzione ipofisaria integra (tireotossicosi
subclinica).
La tireotossicosi può essere presente anche in assenza di ipertiroidismo (tiroidite,
assunzione di ormoni tiroidei). Per semplificare, nel presente documento verrà usato il termine di
Ipertiroidismo per intendere comunque anche la tireotossicosi.
Le patologie tiroidee che si manifestano più comunemente con ipertiroidismo sono:
1) il gozzo diffuso tossico (Morbo di Basedow o ipertiroidismo autoimmune);
2) il gozzo multinodulare tossico;
3) il nodo unico iperfunzionante (adenoma tossico).
Data l’eccezionalità delle forme di ipertiroidismo secondario, tali patologie non sono
considerate nel presente PDTA.
Per ipotiroidismo si intende invece il quadro clinico determinato da una ipofunzione della
ghiandola tiroidea. L’ipotiroidismo è nel 95% dei casi primario, cioè dovuto ad una causa agente
direttamente sulla tiroide (nella maggioranza dei casi si tratta di una tiroidite autoimmune), mentre
nel restante 5% la causa è un danno (infiammatorio, neoplastico, traumatico, ecc.) della ghiandola
ipofisaria (ipotiroidismo secondario).
AReSS Piemonte
PDTA Malattie Tiroidee
9
Sia l'ipertiroidismo sia l'ipotiroidismo possono manifestarsi in forme fruste, note come ipero ipotiroidismo subclinico, caratterizzate da valori normali delle frazioni libere degli ormoni
tiroidei circolanti e da livelli di TSH rispettivamente ridotti oppure aumentati. Dato l'estensivo
ricorso ad esami di funzionalità tiroidea nell’ambito di esami “generali” anche in pazienti che non
manifestano sintomi tipici di alterata funzione tiroidea, queste condizioni sono di riscontro sempre
più frequente e, dato l'impatto epidemiologico, sollevano comunque problematiche cliniche
concernenti soprattutto l'opportunità di trattare oppure no questi pazienti.
Nella maggioranza delle situazioni cliniche, il TSH è in grado di evidenziare precocemente le
alterazioni funzionali tiroidee anche in fase preclinica; non bisogna tuttavia dimenticare che il TSH
può risultare normale in presenza di patologia ipofisaria o di resistenza periferica agli ormoni
tiroidei; tali alterazioni vanno dunque indagate quando il valore del TSH non correla con il quadro
clinico del paziente.
AReSS Piemonte
PDTA Malattie Tiroidee
10
5. LINEE GUIDA E LETTERATURA DI RIFERIMENTO
5.1 LINEE GUIDA
La ricerca ha evidenziato diversi documenti; in alcuni casi si tratta di Statement, Consensus
Conference; in altri casi le LG non forniscono indicazioni utili o sono state ritenute
metodologicamente poco valide.
Per la patologia nodulare, le LG AACE/AME/ETA (2010) sono state ritenute le migliori e
sono state utilizzate come riferimento principale.
Per la patologia funzionale, le LG BTA (2006) sono l’unico documento che ha la struttura di
una LG con grading strutturato della valutazione della letteratura e delle raccomandazioni: sono
state quindi utilizzate come riferimento principale.
Gli altri documenti sono inseriti nella Bibliografia di riferimento.
TIREOPATIE DISFUNZIONALI
1. British Thyroid Association 2006 - UK guidelines for the use of thyroid function tests. On-line
(27/10/2010): www.british-thyroid-association.org/info-forpatients/Docs/TFT_guideline_final_version_July_2006.pdf
TIREOPATIE NODULARI
1. AACE/AME/ETA. Task Force on Thyroid Nodules. American Association of Clinical Endocrinologists,
Associazione Medici Endocrinologi & European Thyroid Association. Medical guidelines for clinical
practice for the diagnosis and management of thyroid nodules. Endocr Pract 2010;16(suppl 1):3-43.
On-line (27/10/2010): www.aace.com/pub/pdf/guidelines/ThyroidGuidelines.pdf
5.2 LETTERATURA DI RIFERIMENTO
METODOLOGIA
1. AGREE: uno strumento per la valutazione della qualità delle linee guida cliniche. Regione EmiliaRomagna, Agenzia Sanitaria Regionale, Centro di documentazione per la salute, 2002.
2. AReSS Piemonte. Raccomandazioni per la costruzione di percorsi diagnostico Terapeutici Assistenziali
(PDTA) e profili integrati di cura (PIC) nelle Aziende Sanitarie della Regione Piemonte, 2007. On-line
(27/10/2010): www.aress.piemonte.it/Contenuti/4/6/DocRaccomandazioniPDTA-PIC.pdf
PARTE GENERALE
1. Helfland M. U.S. Screening for subclinical thyroid dysfunction in non-pregnant adults – A summary of
the evidence for the U.S. Preventive Services Task Force. Ann Int Med. 2004;140:128-41. On-line
(27/10/2010): http://www.annals.org/content/140/2/128.full.pdf+html
2. Saggiorato E, Arecco F, Mussa A, Sacerdote C, Rossetto R, Origlia C, Germano L, Deandreis D,
Orlandi F and Piedmont Goiter Study Committee. Goiter prevalence and urinary iodine status in
urban and rural/mountain areas of Piedmont region. J Endocrinol Invest 2006;29(1):67-73.
TIREOPATIE DISFUNZIONALI
1. Alberta Toward Optimized Practice 2008 - Clinical practice guideline: investigation and management
of primary thyroid dysfunction. On-line (27/10/2010):
www.topalbertadoctors.org/informed_practice/clinical_practice_guidelines/complete%20set/Thyroid
%20Dysfunction/thyroid_guideline.pdf
AReSS Piemonte
PDTA Malattie Tiroidee
11
2. American Association of Clinical Endocrinologists - Medical guidelines for clinical practice for the
evaluation and treatment of hyperthyroidism and hypothyroidism. Endocrine Practice 2002;8:457-9.
Col NF, Surks MI, Daniels GH. Subclinical thyroid disease. Clinical applications. JAMA 2004;291:23943.
3. Dottorini ME, Inglese E. Salvatori M, Signore A, Squatrito S, Vitti P. Il trattamento metabolico
dell’ipertiroidismo. Linee Guida SIE-AIMN-AIFM, 2005. On-line (27/10/2010):
www.aimn.it/pubblicazioni/LG/LG_ipertiroidismo_05.pdf
4. Ladenson PW, Singer PA, Ain KB, et al. American Thyroid Association Guidelines for detection of
thyroid dysfunction. Arch Intern Med 2000;160:1573-5.
5. Muller AF, Berghout A, Wiersinga WM. Thyroid function disorders. Guidelines of the Netherlands
Association of Internal Medicine. Netherlands Journal of Medicine 2008,66:134-42.
6. Ontario Association of Medical Laboratories - Guideline for the use of laboratory tests to detect
thyroid dysfunction - July, 2007. On-line (27/10/2010):
www.oaml.com/PDF/FINALTSH%20Guideline%20July%2018,%2007.pdf
7. PNLG. Linee guida nazionali - Raccomandazioni per la diagnostica delle malattie tiroidee, 2003. Online (27/10/2010): www.snlg-iss.it/lgn_diagnostica_malattie_tiroidee
8. Surks MI, Ortiz E, Daniels GH, et al. Subclinical thyroid disease. scientific review and guidelines for
diagnosis and management. JAMA 2004;291:228-38. On-line (27/10/2010): http://jama.amaassn.org/cgi/reprint/291/2/228
TIREOPATIE NODULARI
1. Baloch ZW, Fleisher S, LiVolsi VA, Gupta PK. Diagnosis of "follicular neoplasm": a gray zone in
thyroid fine-needle aspiration cytology. Diagn Cytopathol 2002;26:41-4.
2. Bartolazzi A, Orlandi F, Saggiorato E, Volante M, Arecco F, Rossetto R, Palestini N, Ghigo E, Papotti
M, Bussolati G, Martegani MP, Pantellini F, Carpi A, Giovagnoli MR, Monti S, Toscano V, Sciacchitano
S, Pennelli GM, Mian C, Pelizzo MR, Rugge M, Troncone G, Palombini L, Chiappetta G, Botti G,
Vecchione A, Bellocco R; Italian Thyroid Cancer Study Group (ITCSG). Galectin-3-expression analysis
in the surgical selection of follicular thyroid nodules with indeterminate fine-needle aspiration
cytology: a prospective multicentre study. Lancet Oncol 2008;9:543-9.
3. Borget I, De Pouerville G, Schlumberger M. Calcitonin Determination in patients with nodular thyroid
disease. J Clin Endocrinol Metab, 2007; 92:425-7.
4. British Thyroid Association, Royal Colloge of Physicians, 2007. Guidelines for the management of
thyroid cancer, second edition. On-line (27/10/2010): www.british-thyroidassociation.org/news/Docs/Thyroid_cancer_guidelines_2007.pdf
5. Cooper DS, Doherty GM, Haugen BR, et al. Revised American Thyroid Association management
guidelines for patients with thyroid nodules and differentiated thyroid cancer. Thyroid 2009,19:1-48.
6. Cooper DS, Doherty GM, Haugen BR, Kloos RT, Lee SL, Mandel SJ, Mazzaferri EL, McIver B, Pacini F,
Schlumberger M. Revised American Thyroid Association Management Guidelines for patients with
thyroid nodules and differentiated thyroid cancer. Thyroid 2009;19:1167-214.
7. Gruppo di lavoro SIAPEC-IAP. Consenso italiano sulla gestione clinica del paziente con patologia
nodulare tiroidea: nodulo tiroideo - consensus istologico. 2007. On-line (27/10/2010):
www.citologia.novilab.it/docs/NoduloTiroideo-Citologia.pdf
8. Pacini F, Schlumberger M, Dralle H, et al. European consensus for the management of patients with
differentiated thyroid carcinoma of the follicular epithelium. Eur J Endocrinol 2006;154:787-803.
9. Papanicolaou S. Guidelines of the Papanicolaou Society of Cytopathology for the examination of fineneedle aspiration specimens from thyroid nodules. The Papanicolaou Society of Cytopathology task
force on standards of practice. Modern Pathology 1996;9:710-5.
10. Robbins KT, Clayman G, Levine PA, Medina J, Sessions R, Shaha A, Som P, Wolf GT, and the
Committee for Head and Neck Surgery and Oncology, American Academy of Otolaryngology-Head
and Neck Surgery. Neck dissection classification update. Arch Otolaryngol Head Neck Surg
2002;128:751-8.
11. SIE-AIMN-AIFM. Carcinoma differenziato della tiroide. Linee Guida per il trattamento ed il follow-up,
2004. On-line (27/10/2010): www.societaitalianadiendocrinologia.it/file/lineeguida-k-tir.pdf
AReSS Piemonte
PDTA Malattie Tiroidee
12
12. Solbiati L. Tiroide e Paratiroidi. In: Aliotta A, Ferraioli G, Livraghi T. Standard per una corretta
esecuzione dell’esame ecografico - XXI Congresso Nazionale SIUMB. Journal of Ultrasound, 2009,
suppl. On-line (27/10/2010): www.siumb.it/files/doc/linee_guida_esame_ecografico.pdf
13. Tuttle RM, Lemar H, Burch HB. Clinical features associated with an increased risk of thyroid
malignancy in patients with follicular neoplasia by fine-needle aspiration. Thyroid 1998;8:377-83.
14. Vitti P, Rago T, Elisei R, Papini E, Orlandi F, Belfiore A, Pacini F. Gestione clinica del paziente con
patologia nodulare tiroidea: Consenso Italiano - Documento di Consenso SIE-AIT. L’Endocrinologo
2008; 9 (Suppl. 4):1-16.
15. Yang J, Schnadig V, Logrono R, Wasserman PG. Fine-needle aspiration of thyroid nodules: a study of
4703 patients with histologic and clinical correlations. Cancer 2007;111:306-15.
5.3 VALUTAZIONE LINEE GUIDA CON METODO AGREE
AACE
AACE/AME/ETA 2010. Task Force on Thyroid Nodules. American Association of Clinical Endocrinologists,
Associazione Medici Endocrinologi & European Thyroid Association. Medical guidelines for clinical practice for
the diagnosis and management of thyroid nodules.
AREA
PUNTEGGIO
1 Obiettivo e motivazione
12/12
2 Coinvolgimento delle parti in causa
15/16
3 Rigore della elaborazione
23/28
4 Chiarezza e presentazione
13/16
5 Applicabilità
7/12
6 Indipendenza editoriale
8/ 8
Giudizio complessivo
Fortemente raccomandata
Raccomandata (con riserva)
Non raccomandata
Non so
X
BTA
British Thyroid Association 2006 - UK Guidelines for the Use of Thyroid Function Tests.
AREA
PUNTEGGIO
1 Obiettivo e motivazione
9/12
2 Coinvolgimento delle parti in causa
14/16
3 Rigore della elaborazione
19/28
4 Chiarezza e presentazione
11/16
5 Applicabilità
3/12
6 Indipendenza editoriale
5/ 8
Giudizio complessivo
Fortemente raccomandata
Raccomandata (con riserva)
Non raccomandata
Non so
X
AReSS Piemonte
PDTA Malattie Tiroidee
13
5.4
LIVELLI DI PROVE SCIENTIFICHE E GRADING DELLE
RACCOMANDAZIONI
Le prove scientifiche raccolte sono state valutate in base al sistema di grading adottato
dalle LG utilizzate.
AACE
AACE/AME/ETA. Task Force on Thyroid Nodules. American Association of Clinical Endocrinologists,
Associazione Medici Endocrinologi & European Thyroid Association. Medical guidelines for clinical practice for
the diagnosis and management of thyroid nodules. Endocr Pract 2010;16(suppl 1):3-43.
Evidenze e Raccomandazioni = Mechanick JL et al. Ad Hoc Task Force for Standardized Production of Clinical
Practice Guideline. Endocr Prat 2004;10:353-61.
AReSS Piemonte
PDTA Malattie Tiroidee
14
BTA
British Thyroid Association 2006 - UK Guidelines for the Use of Thyroid Function Tests.
Evidenze e Raccomandazioni = AHCPR 1992, AHRQ 1994
AReSS Piemonte
PDTA Malattie Tiroidee
15
AReSS Piemonte
PDTA Malattie Tiroidee
16
AReSS Piemonte
PDTA Malattie Tiroidee
17
AReSS Piemonte
PDTA Malattie Tiroidee
18
6. IL PERCORSO DI RIFERIMENTO
6.1 MALATTIE TIROIDEE DISFUNZIONALI
(IPERTIROIDISMO)
6.1.1 - CRITERI DI INCLUSIONE ED ESCLUSIONE
CRITERI di INCLUSIONE. Rientrano in questo PDTA i soggetti adulti che presentano segni
e/o sintomi suggestivi di ipertiroidismo in assenza di patologie tiroidee note:
Sintomi:
- ansia, nervosismo;
- sudorazione profusa;
- ipersensibilità al caldo;
- cardiopalmo, palpitazioni;
- affaticabilità, astenia;
- calo ponderale;
- aumento dell’appetito;
- dispnea;
- diarrea.
Segni:
- tachicardia, extrasistolia, fibrillazione atriale;
- gozzo;
- tremori;
- esoftalmo, edema orbitario.
I pazienti accedono al PDTA tramite il MMG.
CRITERI di ESCLUSIONE. Tutte le condizioni di emergenza che richiedono accertamenti
immediati, ad es. emergenze cardiovascolari correlate alla fibrillazione atriale (tromboembolismi,
scompenso cardiaco acuto).
6.1.2 - PATOLOGIA DISFUNZIONALE IN GRAVIDANZA
Il MMG deve escludere la presenza di gravidanza in atto nelle pazienti in età fertile con
sospetto ipertiroidismo. Data la complessità e le peculiarità dell’ipertiroidismo in gravidanza questo
argomento non è considerato in questo Documento.
6.1.3 - VISITA
Il MMG deve raccogliere i dati anamnestici ed obiettivi relativi al sospetto di ipertiroidismo
ed alle patologie associate che possano avere una relazione con l’eventuale disfunzione tiroidea e
definire l’entità del sospetto.
Anamnesi Familiare
Verificare la presenza di tireopatie o malattie autoimmuni nei parenti.
Anamnesi Patologica
Considerare ed eventualmente ricercare la presenza di affezioni in cui la presenza di ipertiroidismo
possa peggiorarne il quadro clinico: cardiopatie, osteoporosi, patologie sistemiche neoplastiche/
AReSS Piemonte
PDTA Malattie Tiroidee
19
flogistiche croniche con importante compromissione della salute. Si deve inoltre valutare la
consistenza dei sintomi riferiti e se questi possano essere giustificati da patologie note.
Anamnesi farmacologica.
Amiodarone, interferone e litio possono dare ipertiroidismo. Il rapporto rischio/beneficio della
continuazione di tali trattamenti va stabilita con lo specialista endocrinologo di concerto con lo
specialista che li ha prescritti (cardiologo, neurologo, ecc.).
Î Tutti i pazienti in trattamento con amiodarone o litio dovrebbero effettuare un controllo della
funzione tiroidea prima dell’inizio del trattamento e quindi essere monitorati ogni 6-12 mesi
durante il trattamento (per l’amiodarone fino ad un anno dopo la cessazione del trattamento) [BTA
III-B].
Deve inoltre essere indagata l’eventuale assunzione di farmaci tireomimetici (ormoni tiroidei o loro
analoghi, es. TRIAC) o iodio a dosi farmacologiche, ad esempio a scopo dimagrante. Tali sostanze
vanno sospese ed il paziente deve essere successivamente rivalutato.
Esame Obiettivo
È indicato rilevare il peso corporeo (e le sue recenti variazioni), la pressione arteriosa, la frequenza
ed il ritmo cardiaco, la morfologia tiroidea e la presenza eventuale di: soffi cardiaci e segni di
scompenso
cardiocircolatorio;
oftalmopatia
Basedowiana
(esoftalmo,
infiammazione
corneale/congiuntivale, edema periorbitario, alterata motilità oculare, diplopia ed altri disturbi
visivi); adenopatie cervicali.
TIROIDITE SUBACUTA
La tiroidite subacuta, per la sua peculiarità, non viene trattata in questo PDTA. Deve essere
sospettata in base alla presenza di una sintomatologia dolorosa cervicale, per lo più intensa,
localizzata al giugulo sia spontanea sia provocata, eventualmente associata a disfagia, febbre,
malessere generale e aumento degli indici infiammatori (VES, PCR). In genere è presente una
tumefazione visibile, che è l’origine primaria della sintomatologia dolorosa. Il paziente deve essere
inviato con urgenza all’endocrinologo (classe di priorità U).
VALUTAZIONE DELLA PROBABILITÀ DI IPERTIROIDISMO
- Alta probabilità di ipertiroidismo: in caso di segni e sintomi evidenti di ipertiroidismo è
indicata la richiesta immediata di visita specialistica endocrinologica (classe di priorità U oppure B),
con valutazione di TSH, fT3, fT4, AbTPO, TRAb, ed ecografia della tiroide.
Î I livelli di AbTPO e TRAb, non indispensabili, andrebbero comunque richiesti per una migliore
valutazione della causa dell’ipertiroidismo; tali accertamenti saranno in seguito utili per le
specifiche decisioni terapeutiche, soprattutto in caso di elementi clinici non decisivi a favore
dell’una o dell’altra condizione (Basedow o gozzo nodulare) [BTA II-B]. ÎSe il paziente presenta
marcati sintomi di attivazione adrenergica può essere indicato l’inizio immediato di terapia con
beta-bloccante per un rapido controllo dei sintomi [BTA II] (a meno che i beta-bloccanti non
risultino controindicati, come nell’asma bronchiale, nel blocco atrio-ventricolare, nell’insufficienza
cardiaca grave).
- Non alta probabilità di ipertiroidismo: negli altri casi non conclamati, si raccomanda
l’esecuzione del dosaggio del TSH con modalità “reflex”.
6.1.4 - SOSPENSIONE E RIVALUTAZIONE (TIREOMIMETICI)
In presenza di sintomi suggestivi di ipertiroidismo, l’uso di ormoni tiroidei (al di fuori di un
trattamento per ipotiroidismo o per carcinoma differenziato della tiroide), di farmaci con effetti
tireomimetici (derivati degli ormoni tiroidei, es. TRIAC) o di sostanze iodate va sospeso e il
paziente va seguito nel tempo e rivalutato.
AReSS Piemonte
PDTA Malattie Tiroidee
20
6.1.5 - TSH REFLEX
Il TSH è il parametro primario nella diagnosi di ipertiroidismo, in presenza di funzione
ipofisaria integra. I livelli di fT4 e fT3 danno un’indicazione dell’entità dell’affezione. Un valore
ridotto di TSH indica la presenza di ipertiroidismo:
- CONCLAMATO in caso di valori elevati degli ormoni tiroidei;
- SUBCLINICO in caso di valori normali degli ormoni tiroidei.
La specificazione R-TSH (TSH Reflex Test, secondo le direttive regionali - D.G.R. n° 219688 del 30 settembre 2008) stabilisce che, in caso di TSH <0,45 µU/mL, venga automaticamente
effettuato da parte del Laboratorio il dosaggio di fT4 e, se questo risultasse normale, quello di fT3.
I livelli di TSH sono il riferimento per le ulteriori decisioni cliniche (per l’interpretazione dei risultati,
stante la variabilità interlaboratorio dovuta ai diversi metodi analitici, si devono tenere presenti i
valori di riferimento forniti da ciascun laboratorio):
- Valori di TSH ridotto, indipendentemente dai livelli di fT3 e fT4, in assenza di nota o
sospetta alterazione funzionale ipofisaria, confermano l'ipertiroidismo. È indicata la richiesta
di visita endocrinologica in classe B con la contestuale richiesta di ecografia tiroidea e dei
test di autoimmunità tiroidea (TRAb e AbTPO). Questi ultimi accertamenti diagnostici,
essendo in grado di suggerire la causa dell’ipertiroidismo, Î non sarebbero indicati di
routine ma possono essere utili per la scelta del trattamento [BTA II-B], in particolare in
presenza di un quadro clinico-sintomatologico non eclatante e poco specifico per l'eziologia.
- Valori di TSH superiori alla norma determinano il passaggio al PDTA dell’ipotiroidismo.
- Valori di TSH nella norma escludono la presenza di patologia disfunzionale tiroidea.
NB:
1. In casi molto rari vi può essere un aumento dei livelli di fT4 e/o fT3 in presenza di livelli di TSH normali o
aumentati: tale condizione può configurare un quadro di “inappropriata” secrezione di TSH, determinato
dalla presenza di un adenoma ipofisario TSH-secernente (Ipertiroidismo Secondario) o da una resistenza
recettoriale a livello ipotalamo-ipofisario agli ormoni tiroidei. In tali condizioni il TSH-reflex può quindi fornire
informazioni fuorvianti.
2. Si ricorda che la normalità del TSH non esclude la presenza di tireopatie nodulari o autoimmunitarie e di
ipotiroidismo secondario.
6.1.6 - VISITA ENDOCRINOLOGICA
Lo specialista endocrinologo deve valutare:
- la presenza di ipertiroidismo CONCLAMATO o SUBCLINICO;
- l’EZIOLOGIA dell’ipertiroidismo (gozzo uni-, multi-nodulare tossico o morbo di Basedow, ecc.);
- la presenza di specifici FATTORI DI RISCHIO (particolari condizioni in cui il riconoscimento e il
trattamento precoci della malattia hanno un valore peculiare): età avanzata, cardiopatia
aritmogena, osteoporosi, ecc.
Si raccomanda il trattamento specifico (tireostatico) in presenza di:
- ipertiroidismo conclamato;
- ipertiroidismo subclinico in concomitanza con i fattori di rischio suddetti (quando non sia del tutto
evidente l’esistenza di una forma transitoria di tiroidite); in assenza dei fattori di rischio il
trattamento va individualizzato caso per caso. In questo ambito le raccomandazioni degli esperti
non sono univoche.
Il trattamento specifico non è raccomandato in caso di ipertiroidismo subclinico da tiroidite.
In tale condizione, in genere, l’ipertiroidismo è lieve e transitorio. ÎIl trattamento standard
dell’ipertiroidismo in caso di tiroidite è inefficace o controindicato [BTA II-B].
6.1.7 - FOLLOW-UP (PAZIENTI NON TRATTATI)
Nei pazienti con ipertiroidismo subclinico, senza patologia nodulare e senza fattori di rischio
AReSS Piemonte
PDTA Malattie Tiroidee
21
o associati, deve essere previsto un follow-up a lungo termine, con eventuale diradamento dei
controlli in presenza di una situazione persistentemente stabile.
ÎI pazienti con ipertirodismo subclinico non trattato dovrebbero essere seguiti a lungo termine
con controlli di fT4 e TSH ogni 6-12 mesi [BTA III-B].
Si ricorda che l’R-TSH deve essere riservato alla diagnostica iniziale e non deve essere
utilizzato nel corso del follow-up.
6.1.8 - TERAPIA INIZIALE
Î I pazienti con conferma biochimica di ipertiroidismo dovrebbero generalmente iniziare la
terapia con i farmaci tireostatici (tionamidi: metimazolo o propiltiouracile); ciò non è indispensabile
nelle forme lievi di ipertiroidismo quando si è deciso di effettuare un trattamento definitivo con
radioiodio [BTA II].
Î L’entità dell’aumento dei livelli di fT3 e fT4 fornisce un’indicazione della gravità
dell’ipertiroidismo e dovrebbe essere interpretato nel contesto del quadro clinico per graduare la
posologia [BTA III-B].
Nella pratica clinica italiana il trattamento di prima linea è nella maggioranza dei casi quello
farmacologico con i farmaci tireostatici (il metimazolo è l’unico in commercio in Italia; in caso di
intolleranza, è possibile ricorrere al propiltiouracile che viene distribuito direttamente dalle
Farmacie delle ASL). Per la posologia e le modalità di somministrazione vedi 6.1.10. In casi
selezionati, in presenza di ipertiroidismo lieve, può essere presa in considerazione già in prima
battuta la terapia radiometabolica (vedi 6.1.10).
6.1.9 - SCINTIGRAFIA TIROIDEA
In presenza di ipertiroidismo nodulare è indicata l’esecuzione della scintigrafia. In presenza
di ipertiroidismo non nodulare, la sua esecuzione (richiesta con classe di priorità U oppure B) può
essere utile per:
- discriminare tra ipertiroidismi a bassa e ad alta captazione;
- valutare i parametri dosimetrici e l’eleggibilità alla terapia con 131I.
Ulteriori informazioni sono riportate nel paragrafo 6.3.4.
6.1.10 - TERAPIA DEFINITIVA
La terapia definitiva dell’ipertiroidismo può essere medica, radioterapica o chirurgica. La
scelta del trattamento non è al momento basata su chiare raccomandazioni derivate da evidenze
scientifiche. La scelta è quindi in genere effettuata in base all’esperienza e alla disponibilità delle
diverse competenze specialistiche locali (endocrinologica, chirurgica e di medicina nucleare), in
accordo con il paziente. I redattori di questo PDTA suggeriscono quanto segue.
TERAPIA MEDICA
Il trattamento medico può essere usato a breve termine per la preparazione al trattamento
definitivo radioterapico o chirurgico, oppure a medio termine (6-18 mesi) nella speranza di indurre
una remissione definitiva in caso di ipertiroidismo da morbo di Basedow. Tale evenienza è inferiore
al 50% dei casi; la recidiva di ipertiroidismo anche subclinico dopo mesi di trattamento deve far
considerare la necessità di trattamento definitivo chirurgico o radioterapico.
Occasionalmente la terapia medica può essere definitiva (paziente anziano con limitata aspettativa
di vita in cui le altre terapie sono controindicate o non proponibili).
Modalità
Somministrare metimazolo, 5-20 mg/die in 2-3 somministrazioni giornaliere, con progressiva
AReSS Piemonte
PDTA Malattie Tiroidee
22
riduzione della posologia nel tempo fino ad arrivare nel corso di settimane-mesi alla minima
posologia di 2,5-5 mg/die.
Î La funzione tiroidea dovrebbe essere valutata ogni 4-6 settimane dopo l’inizio del trattamento
con tionamidi. Nella maggior parte dei casi il valore di fT4 è il parametro di scelta per guidare la
terapia [BTA II-B].
Nel corso del trattamento, l’adeguamento posologico va fatto in base alla risposta clinica e ai livelli
di fT3, fT4 e TSH (si ribadisce che l’R-TSH deve essere riservato alla diagnostica iniziale e non
deve essere utilizzato nel corso del follow-up). La caduta dei livelli di fT4 deve far prontamente
ridurre la posologia del metimazolo.
Non è necessario monitorare altri parametri clinici nel corso della terapia con metimazolo. In caso
di sospetto stato flogistico/settico è indicato valutare i livelli di leucociti neutrofili per la possibilità,
pur remota, di un effetto tossico leucopenizzante del farmaco.
RADIOTERAPIA METABOLICA con 131I (vedi Appendice)
La terapia radiometabolica con 131I rappresenta una valida opzione terapeutica per
l’ipertiroidismo da morbo di Basedow; è l’opzione terapeutica principale per questa affezione negli
Stati Uniti. In Europa è prescritta con maggior frequenza nei pazienti che presentano una recidiva
dell’ipertiroidismo dopo uno o due cicli di trattamento medico con tionamidi, evento che si verifica
alla sospensione del trattamento in oltre il 50% dei pazienti.
È l’indicazione elettiva nei pazienti ipertiroidei non trattabili con la terapia farmacologica (per
allergia, effetti collaterali o scarsa compliance) o chirurgica (per rischio elevato dovuto a patologie
concomitanti o per rifiuto del paziente). In casi selezionati, in presenza di ipertiroidismo lieve, può
essere presa in considerazione già in prima battuta.
È opportuno evitare il trattamento con 131I al di sotto dei 18 anni, ed in particolare in età
prepuberale, salvo che in casi selezionati.
TERAPIA CHIRURGICA (vedi Appendice)
Î In attesa dell’intervento chirurgico è sempre necessario un trattamento medico
tireostatico per normalizzare la funzione tiroidea [BTA II].
La tiroidectomia è raccomandata di rado nei pazienti con morbo di Basedow. Le indicazioni
comprendono in genere il gozzo voluminoso relativamente resistente al trattamento con 131I, la
gravidanza in atto quando l’ipertiroidismo non è controllato dal trattamento tireostatico, la grave
oftalmopatia, le recidive dopo trattamento medico. Più frequente è l’indicazione nel gozzo uni- e
multinodulare tossico, soprattutto quando di grandi dimensioni o con nodi sospetti.
6.2 MALATTIE TIROIDEE DISFUNZIONALI
(IPOTIROIDISMO)
6.2.1 - CRITERI DI INCLUSIONE ED ESCLUSIONE
CRITERI di INCLUSIONE. Rientrano in questo PDTA i soggetti adulti che presentano segni
e/o sintomi suggestivi di ipotiroidismo:
Sintomi:
- astenia e adinamia;
- sonnolenza;
- intolleranza al freddo;
Segni:
AReSS Piemonte
PDTA Malattie Tiroidee
23
I
secchezza della cute;
eloquio rallentato;
edema palpebrale;
fragilità capelli e unghie;
disturbi della memoria;
stipsi;
voce rauca.
pazienti accedono al PDTA tramite il MMG.
CRITERI di ESCLUSIONE. Condizioni di emergenza che richiedono accertamenti immediati,
ad es. emergenze cardiovascolari correlate allo scompenso cardiaco, stato edemigeno diffuso,
anasarca.
6.2.2 - PATOLOGIA DISFUNZIONALE IN GRAVIDANZA
Il MMG deve escludere la presenza di gravidanza in atto nelle pazienti in età fertile con
sospetto di ipotiroidismo. Data la peculiarità dell’ipotiroidismo in gravidanza questo argomento non
è considerato nel presente Documento.
6.2.3 - VISITA
Il MMG deve raccogliere i dati anamnestici e obiettivi relativi al sospetto di ipotiroidismo e
alle patologie associate che possano avere una relazione con l’eventuale disfunzione tiroidea.
Anamnesi Familiare
Verificare la presenza di tireopatie o malattie autoimmuni nei parenti.
Anamnesi Patologica
Considerare ed eventualmente ricercare la presenza di affezioni in cui la presenza di ipotiroidismo
possa peggiorarne il quadro clinico: cardiopatie, patologie sistemiche neoplastiche/flogistiche
croniche con importante compromissione della salute.
Valutare la consistenza dei sintomi riferiti e determinare se questi non siano giustificati da
patologie note.
Ricercare la positività anamnestica di malattie/traumatismi dell’area ipotalamo-ipofisaria e la
presenza di sintomatologia suggestiva di ipofunzione o lesione ipofisaria (alterazione del campo
visivo, ipogonadismo, ipopituitarismo, iperprolattinemia).
Anamnesi farmacologica.
Amiodarone, interferone e litio possono indurre ipotiroidismo. In genere la presenza di
ipotiroidismo non deve comportare l’automatica sospensione del farmaco ma il rapporto
rischio/beneficio della continuazione di tali trattamenti andrà stabilita con lo specialista
endocrinologo di concerto con lo specialista che li ha prescritti (cardiologo, neurologo, ecc.).
Î Tutti i pazienti in trattamento con amiodarone o litio dovrebbero avere un controllo della
funzione tiroidea prima dell’inizio del trattamento e quindi essere monitorati ogni 6-12 mesi
durante il trattamento (per l’amiodarone fino ad un anno dopo la cessazione del trattamento) [BTA
III-B].
Esame Obiettivo
È indicato rilevare il peso corporeo (e le sue recenti variazioni), la pressione arteriosa, la frequenza
ed il ritmo cardiaco, gli eventuali segni di scompenso cardiocircolatorio, la morfologia tiroidea. Si
deve inoltre ricercare l’eventuale presenza di segni suggestivi di ipofunzione o lesione ipofisaria
(alterazione del campo visivo, ipogonadismo, ipopituitarismo, iperprolattinemia).
AReSS Piemonte
PDTA Malattie Tiroidee
24
È indicata l’esecuzione dell’R-TSH; in questi pazienti l’effettuazione di una ecografia può
essere utile per una miglior definizione morfo-volumetrica e strutturale della ghiandola, ma non è
indispensabile ai fini della decisione di intraprendere una terapia sostitutiva.
6.2.4 - TSH REFLEX
In caso di sospetto di ipotiroidismo, in assenza di alterazioni note o sospette della funzione
ipofisaria, si raccomanda l’esecuzione del dosaggio dell’R-TSH.
Il TSH è il parametro primario nella diagnosi di ipotiroidismo, in presenza di funzione
ipofisaria integra. I livelli di fT4 danno indicazione dell’entità dell’affezione. Un valore aumentato di
TSH indica la presenza di ipotiroidismo:
- CONCLAMATO in caso di valori ridotti di ormoni tiroidei;
- SUBCLINICO in caso di valori di ormoni tiroidei nella norma.
La specificazione R-TSH (TSH Reflex Test, secondo le direttive regionali - D.G.R. n° 219688 del 30 settembre 2008) stabilisce che, in caso di TSH >3,5 µU/mL, venga automaticamente
effettuato da parte del Laboratorio il dosaggio di fT4 e di AbTPO, e, se quest’ultimo risultasse
normale, quello di AbTg. Per l’interpretazione dei risultati, stante la variabilità interlaboratorio
dovuta ai diversi metodi analitici, si devono tenere presenti i valori di riferimento forniti da ciascun
laboratorio.
Î La determinazione dei livelli anticorpali anti-tiroide in soggetti con ipotiroidismo subclinico aiuta
a definire il rischio di evoluzione verso l’ipotiroidismo conclamato [BTA III-B].
-
-
I livelli di TSH sono il riferimento per le ulteriori decisioni cliniche:
Valori di TSH inferiori alla norma, escludendo gli Ipotiroidismi Secondari (vedi nota),
determinano il passaggio al percorso dell’ipertiroidismo.
Valori di TSH nella norma escludono la presenza di patologia disfunzionale tiroidea.
In caso di TSH compreso tra 4,5 e 10 µU/mL (ipotiroidismo subclinico) è indicata la
ripetizione del dosaggio di TSH e di fT4. Î I pazienti con ipotiroidismo subclinico debbono
ricontrollare i livelli di TSH e di fT4 per escludere cause transitorie di TSH elevato [BTA IIIB]. In caso di conferma di ipotiroidismo subclinico è indicata la richiesta di visita
endocrinologica.
Valori di TSH >10 µU/mL documentano un ipotiroidismo meritevole di trattamento; è
inoltre indicata una visita endocrinologica.
NB:
In rari casi vi può essere una riduzione dei livelli di fT4 e/o fT3 in presenza di livelli di TSH normali o ridotti;
tale condizione può essere dovuta a Ipotiroidismo Secondario (determinato dalla presenza di un danno
funzionale ipofisario da varia causa - in tale condizione il TSH-reflex può quindi fornire informazioni
fuorvianti) oppure a malattie sistemiche non tiroidee o interferenze farmacologiche (in tale condizione il TSHreflex può evitare inutili approfondimenti).
6.2.5 - TERAPIA SOSTITUTIVA
La terapia dell’ipotiroidismo consiste nella somministrazione di tiroxina sintetica alla dose di
1-1,6 µg/kg/die. La posologia iniziale deve essere tanto più bassa (12,5-25 µg/die) e l’incremento
posologico tanto più lento (aumenti di 12,5-25 µg/die ogni 2-4 settimane) quanto più il paziente
sia anziano e/o affetto da cardiomiopatia cronica/scompenso cardiaco e/o quanto più i livelli di TSH
siano elevati.
Î I target primari del trattamento sostitutivo con l-tiroxina sono il benessere del paziente e il
raggiungimento di valori di TSH entro il range di norma [BTA III-B].
Î La misurazione sia di fT4 sia di TSH è richiesta per ottimizzare la terapia sostitutiva con ltiroxina [BTA IV-C].
AReSS Piemonte
PDTA Malattie Tiroidee
25
Î Non c’è evidenza consistente per raccomandare l’uso di un trattamento combinato con tiroxina
e triiodotironina rispetto ad un trattamento con sola tiroxina [BTA Ib-A].
6.2.6 - VISITA ENDOCRINOLOGICA
L’endocrinologo deve valutare la gravità del quadro clinico e la possibile esistenza o rischio
di sviluppo di una patologia poliendocrina autoimmune al fine di impostare una valutazione
diagnostica specifica di tale condizione.
In presenza di ipotiroidismo SUBCLINICO deve valutare la presenza di specifiche
CONDIZIONI DI RISCHIO in cui il riconoscimento e il trattamento precoci della malattia hanno un
valore peculiare: cardiopatia ipocinetica, elevato rischio cardiovascolare, gozzo nodulare in crescita
volumetrica. In tali casi può essere indicato iniziare il trattamento sostitutivo (vedi 6.2.5).
Î Se la concentrazione di fT4 è normale e il TSH aumentato ma <10 µU/mL il trattamento
con tiroxina non è raccomandato di routine. Può essere indicato se presente gozzo e nelle donne
che cercano la gravidanza [BTA II-B]. Si raccomanda comunque il trattamento specifico
(sostitutivo) dell’ipotiroidismo subclinico in presenza di:
- TSH >10 µU/mL;
- TSH <10 µU/mL:
- in gravidanza o in caso di desiderio di gravidanza;
- in presenza di elevato rischio cardiovascolare;
- in caso di sintomatologia importante, persistente e non secondaria ad altre cause.
Nell’ambito dell’ipotiroidismo subclinico le raccomandazioni degli esperti sono comunque
contraddittorie.
6.2.7 - FOLLOW-UP (IN TERAPIA)
Nei pazienti con ipotiroidismo in terapia deve essere previsto un controllo del TSH a 2-3
mesi dal raggiungimento del target posologico e deve essere predisposto un follow-up ad vitam
con controlli annuali del TSH. Si ricorda che l’R-TSH deve essere riservato alla diagnostica iniziale e
non deve essere utilizzato nel corso del follow-up.
In caso di gravidanza, di modificazioni importanti del peso corporeo o di prolungati
trattamenti farmacologici potenzialmente interferenti con i livelli degli ormoni tiroidei (ormoni
sessuali, inibitori di pompa protonica, carbonato di calcio, ecc.) è indicato rivalutare i livelli di TSH
ed eventualmente richiedere una visita endocrinologica.
Î Il periodo minimo per raggiungere una concentrazione stabile dopo un cambiamento posologico
della tiroxina è di due mesi e la valutazione della funzione tiroidea non dovrebbe pertanto essere
richiesta prima di questo periodo [BTA IIb-B].
Î I pazienti stabilizzati in trattamento sostitutivo con tiroxina a lungo termine dovrebbero avere
un controllo annuale dei livelli del TSH [BTA III-B].
6.2.8 - FOLLOW-UP (NON IN TERAPIA)
Nei pazienti con ipotiroidismo subclinico non in terapia deve essere previsto un follow-up a
lungo termine con controlli del TSH. Si ribadisce che l’R-TSH deve essere riservato alla diagnostica
iniziale e non deve essere utilizzato nel corso del follow-up.
Î I pazienti con ipotiroidismo subclinico che hanno positività degli Ab anti-perossidasi dovrebbero
avere un controllo annuale di TSH; i pazienti Ab anti-perossidasi negativi un controllo ogni 3 anni
[BTA IV-C].
AReSS Piemonte
PDTA Malattie Tiroidee
26
6.3 MALATTIE TIROIDEE NODULARI
6.3.1 - CRITERI DI INCLUSIONE / ESCLUSIONE
CRITERI DI INCLUSIONE.
- Riscontro clinico (alla palpazione) di formazioni nodulari tiroidee, isolate o nell’ambito di un gozzo
multinodulare.
- Riscontro strumentale di formazioni nodulari della tiroide, anche in corso di esami non rivolti alla
tiroide stessa; in assenza di evidenze che gli “incidentalomi” tiroidei abbiamo comportamento
clinico diverso dai nodi clinicamente manifesti, le indicazioni di percorso valgono per entrambe le
condizioni.
CRITERI DI ESCLUSIONE.
- Formazioni nodulari cistiche evidenziate ecograficamente <5 mm, senza aggetti parietali (purché
tutta la tiroide sia stata esaminata in modo accurato).
6.3.2 - VISITA
Comprende l’anamnesi, l’esame obiettivo e la richiesta di esami di laboratorio e di una
ecografia tiroidea. Le informazioni cliniche e l’ecografia tiroidea sono essenziali per la
stratificazione del rischio, cioè per valutare la probabilità che un nodo sia benigno o maligno.
In caso di riscontro di un nodulo tiroideo in una donna gravida o in presunto stato di
gravidanza, di massima si consiglia l'applicazione del presente PDTA, fatte salve le precauzioni
legate allo stato gravidico, in particolare per quanto riguarda l'assoluta astensione da indagini
radioisotopiche; nell'ipotesi in cui venisse diagnosticata una neoplasia, date le problematiche
peculiari, la scelta delle opzioni terapeutiche dovrà essere affrontata in ambito altamente
specialistico, e comunque sempre discussa con la paziente.
Anamnesi:
1. Età.
2. Sesso.
3. Familiarità per patologia tiroidea benigna o maligna: struma, Neoplasie Endocrine Multiple tipo
2 (MEN2), carcinoma midollare familiare della tiroide (FMTC).
4. Pregressi trattamenti radioterapici che abbiano interessato la regione anteriore del collo, in
particolare se eseguiti in età pediatrica (per linfomi, iperplasia timica, ecc.).
5. Modalità di insorgenza e velocità d’accrescimento del nodo.
6. Dolore (se associato a comparsa improvvisa del nodo è indicativo di emorragia intracistica).
7. Sintomatologia compressiva (tosse, disfonia, dispnea, disfagia).
Esame obiettivo
1. Caratteristiche dei nodi palpabili (sede, dimensioni, consistenza, mobilità/fissità,
dolorabilità, presenza di linfoadenopatie laterocervicali).
2. Ricerca di segni clinici di ipertiroidismo.
Le caratteristiche cliniche associate a maggiore rischio di carcinoma tiroideo sono:
- pregressa radioterapia in regione cervicale;
- familiarità per MEN2 o FMTC;
- nodo in progressivo accrescimento;
- nodo duro e fisso alla palpazione;
- disfonia, disfagia o dispnea persistenti;
- linfoadenopatia laterocervicale;
- età <20 o >70 anni;
- sesso maschile.
AReSS Piemonte
PDTA Malattie Tiroidee
27
Qualora le caratteristiche sopra elencate si associno a rapido accrescimento, nel sospetto clinico di
carcinoma anaplastico, il paziente deve essere inviato ad una visita endocrinologica con procedura
d’urgenza (classe di priorità U).
6.3.3 - ESAMI
Esami di laboratorio
In tutti i casi di tireopatia nodulare è indicata l’esecuzione di esami di laboratorio finalizzati ad
identificare eventuali alterazioni della funzionalità tiroidea. Per l’interpretazione dei risultati, stante
la variabilità interlaboratorio dovuta ai diversi metodi analitici, si devono tenere presenti i valori di
riferimento forniti da ciascun laboratorio.
1. R-TSH ÎLa valutazione funzionale iniziale avviene mediante la determinazione del solo
TSH [AACE 3-A]. A tal proposito si ricorda che nella Regione Piemonte è disponibile il
sistema R-TSH (TSH Reflex Test - D.G.R. n° 21-9688 del 30 settembre 2008) che consente
di integrare l’eventuale alterazione del TSH con ulteriori parametri; in particolare, viene
automaticamente effettuata la determinazione di fT4 (ed eventualmente di fT3) in caso di
TSH <0,45 µU/mL, e di fT4, ABTPO (ed eventualmente di AbTg) in caso di TSH >3,5
µU/mL.
2. CALCITONINA ÎLa determinazione dei livelli sierici di calcitonina (marcatore sensibile e
specifico per il carcinoma midollare tiroideo) è imperativa nei pazienti con familiarità per
carcinoma midollare della tiroide o per neoplasia endocrina multipla di tipo 2 (MEN2) [AACE
2-A]. L’utilità della determinazione di routine in tutti i pazienti con noduli tiroidei è ancora
dibattuta; i dati della letteratura indicano una prevalenza di MTC tra lo 0,4% e l’1,4% di
questi pazienti. Considerando peraltro che:
a) un consistente numero di lavori scientifici indica che la determinazione della
calcitonina nella valutazione dei pazienti affetti da patologia nodulare tiroidea ha un
rapporto costo/beneficio analogo a quello di altri programmi di screening ampiamente
accettati (Borget 2007, Cheung 2007);
b) il dosaggio della calcitonina nell’inquadramento iniziale del paziente con nodulo
tiroideo consente diagnosi più precoci di carcinoma midollare, con interventi terapeutici più
tempestivi e radicali;
c) alcuni documenti di consenso, come l’European Consensus Statement (Pacini
2006) e il documento SIE/AIT (Vitti 2008) si esprimono a favore del dosaggio routinario
della CT;
d) la LG di riferimento riporta che la misurazione basale della calcitonina può essere
un utile test nella valutazione iniziale dei nodi tiroidei [AACE 3-B],
Î gli estensori del presente PDTA raccomandano il dosaggio della calcitonina sierica nella
valutazione iniziale del paziente con nodulo tiroideo [Co.Est.].
Nell’interpretazione dei risultati deve essere considerata la possibilità che l’aumento della
calcitonina sia sostenuto da tumori endocrini pancreatici o polmonari o che vi siano “falsi
positivi” dovuti ad insufficienza renale cronica, terapia con inibitori della pompa protonica,
tireopatie autoimmuni, consumo di alcool, anticorpi eterofili anticalcitonina.
In caso di CT elevata il paziente deve essere inviato a visita specialistica (suggerito grado di
urgenza B).
3. TIREOGLOBULINA I livelli di tireoglobulina correlano con le dimensioni della tiroide
piuttosto che con i caratteri morfologici delle lesioni tiroidee. La determinazione della
tireoglobulina non aggiunge informazioni significative e non è raccomandata ai fini
dell’inquadramento diagnostico dei noduli tiroidei.
AReSS Piemonte
PDTA Malattie Tiroidee
28
Ecografia
Î L’ecografia tiroidea è indicata nei pazienti ad alto rischio di neoplasia o in presenza di
noduli palpabili o di linfoadenopatie sospette per neoplasia [AACE 3-B]. L’ecografia è il metodo più
sensibile per identificare le formazioni nodulari della tiroide, misurarne le dimensioni e definirne la
struttura. L’elastografia è una tecnica promettente, ma non è di uso corrente e al momento non ha
indicazioni nella valutazione iniziale di questi pazienti.
Modalità di esecuzione e di refertazione dell’ecografia tiroidea
1. È opportuno che chi esegue un’ecografia, oltre all’esame clinico, raccolga alcuni dati
anamnestici essenziali:
- stato funzionale tiroideo;
- terapia in atto;
- precedenti ecografie o color-Doppler della tiroide;
- precedenti scintigrafie;
- precedenti trattamenti radianti;
- precedenti interventi chirurgici;
- precedenti trattamenti con metodiche ablative (alcool, Laser, RF).
2. L’apparecchiatura ecografica deve essere di medio-alto livello tecnologico, impiegando
sonde lineari con frequenze ≥7,5MHz per il B-mode, con modulo color-Doppler.
3. Î Il Referto ecografico deve prevedere [AACE 3-B]:
- Informazioni globali sulla ghiandola: sede, morfologia, dimensioni (diametro massimo anteroposteriore dei singoli lobi e dell’istmo), ecogenicità, ecostruttura parenchimale, vascolarizzazione,
rapporti con la trachea, impegno retrosternale.
- Informazioni sui nodi (in caso di nodi multipli la descrizione non deve essere limitata al nodo di
maggiori dimensioni, o “dominante”, ma deve porre particolare attenzione al/ai nodi con caratteri
associati a rischio di malignità):
- struttura: cistica (semplice o complessa), solida (ipo-, iso-, iperecogena rispetto al tessuto
circostante), mista;
- margini: regolari, irregolari, sfumati;
- “orletto” (presente, assente, ecogenicità);
- presenza di micro- o macrocalcificazioni;
- vascolarizzazione (ipo-, iso-, ipervascolare rispetto al tessuto circostante; prevalentemente
periferica, prevalentemente intralesionale);
- infiltrazioni dei tessuti vicini.
- Descrizione dei linfonodi regionali (valutare le stazioni linfonodali dal livello 2 al 6).
- Formulazione di una ipotesi diagnostica.
6.3.4 - SCINTIGRAFIA TIROIDEA
La scintigrafia tiroidea è l’unico esame strumentale in grado di fornire indicazioni sulle
caratteristiche funzionali della tiroide o di una sua parte. Deve essere eseguita preferibilmente
prima di un eventuale trattamento tireostatico o per lo meno entro i primi 15 giorni dall’inizio della
terapia. Occorre tenere presente che il potere risolutivo della scintigrafia è di circa 1 cm.
Modalità di esecuzione
La scintigrafia tiroidea può essere effettuata con 99mTc, 123I o 131I. Ciascuno di questi radiofarmaci
ha vantaggi e svantaggi.
99m
Tc - Vantaggi: poco costoso, facilmente reperibile, rapida esecuzione dell’esame;
svantaggi: è captato ma non organificato dalla tiroide, scarsa qualità di immagine se bassa
captazione.
AReSS Piemonte
PDTA Malattie Tiroidee
29
123
I - Vantaggi: migliore visualizzazione del tessuto tiroideo retrosternale, migliori immagini
se bassa captazione, possibile valutazione della dismissione tiroidea reale dello iodio; svantaggi:
alto costo, di più difficile reperibilità, tempo di imaging più lungo.
131
I - Lo studio con 131I non è raccomandato per studi di routine; è prevalentemente
utilizzato nella valutazione della tireotossicosi a bassa captazione o nello studio preliminare della
terapia radiometabolica.
Indicazioni
- nodo tiroideo singolo o gozzo plurinodulare, con valori di TSH inferiori al minimo della norma, per
escludere l’autonomia funzionale (in casi selezionati e nelle aree a più alta carenza iodica può
trovare indicazione anche con TSH nei limiti della norma):
- gozzo voluminoso con sospetto impegno retrosternale;
- sospetto di tessuto tiroideo ectopico (sublinguale, tireoglosso, intratoracico);
- sospetto di agenesia tiroidea nel neonato;
- in presenza di nodi follicolari per identificare l’adenoma follicolare funzionante;
- per distinguere le tireotossicosi ad alta captazione da quelle a bassa captazione (tiroiditi,
saturazione iodica);
- valutazione pre-trattamento terapeutico con 131I.
Controindicazioni:
- gravidanza in atto;
- allattamento al seno (eventuale interruzione se l’esame è ritenuto indispensabile).
Î La scintigrafia è indicata se il TSH è inferiore al limite minimo della norma o se si sospetta
tessuto tiroideo ectopico o gozzo retrosternale [AACE 3-B].
6.3.5 - RIVALUTAZIONE
Pazienti con calcitonina normale, TSH non soppresso o TSH soppresso con scintigrafia
negativa per nodi “caldi”, devono essere rivalutati per stabilire se vi sia indicazione ad ulteriori
approfondimenti oppure al solo follow-up. In presenza di nodi con elementi clinici e/o
ultrasonografici di sospetto o di nodi voluminosi potenzialmente compressivi, vi è indicazione ad
eseguire ulteriori accertamenti. Negli altri casi è giustificato indirizzare il paziente ad un
programma di follow-up.
6.3.6 - FOLLOW-UP
Consiste in un controllo annuale ecografico e del TSH. Si ricorda che l’R-TSH deve essere
riservato alla diagnostica iniziale e non deve essere utilizzato nel corso del follow-up. L’ecografia di
follow-up deve prevedere le stesse modalità di esecuzione e refertazione già citate, per consentire
un adeguato confronto di tutti i parametri rilevati. La frequenza dei controlli può essere ridotta in
presenza di una situazione persistentemente stabile.
6.3.7 - VISITA ENDOCRINOLOGICA
La visita specialistica ha lo scopo di valutare in modo integrato i dati disponibili di ogni
singolo paziente per orientare le successive scelte diagnostiche-terapeutiche.
In particolare l’esame citologico su agoaspirato, unitamente all’ecografia, rappresenta il
principale strumento diagnostico per la selezione delle formazioni nodulari da avviare all’intervento
chirurgico. La sua indicazione va posta in base alle seguenti considerazioni:
- nodo unico vs. nodi multipli: il rischio di carcinoma non è significativamente diverso;
- dimensione: la probabilità che un nodo tiroideo sia maligno è indipendente dalle sue dimensioni;
occorre tenere presente che le dimensioni di un carcinoma sono considerate uno dei fattori
AReSS Piemonte
PDTA Malattie Tiroidee
30
prognostici; peraltro una minoranza di microcarcinomi (<1 cm) può manifestare andamento
aggressivo;
- “cisti complesse”: la maggior parte delle formazioni nodulari ad ecostruttura mista
(prevalentemente cistica) è costituita da lesioni benigne; tuttavia la FNAB è indicata perché alcune
forme maligne (soprattutto di tipo papillare) possono presentarsi con caratteri cistici.
INDICAZIONI ALLA FNAB Î La FNAB è indicata [AACE 3-B]:
- nei nodi di diametro <1 cm con caratteri ultrasonografici di rischio neoplastico (se la FNAB
è tecnicamente fattibile); la coesistenza di due o più criteri ecografici di sospetto aumenta
sensibilmente il rischio di carcinoma tiroideo;
- nei nodi di diametro >1 cm, solidi, ipoecogeni all’ecografia (*);
- nei nodi di qualsiasi dimensione in soggetti ad alto rischio di carcinoma tiroideo (pregressa
irradiazione del collo; MEN2, FMTC, FPTC, pregresso intervento per carcinoma della tiroide;
elevati livelli di calcitonina in assenza di fattori interferenti);
- nei nodi di qualsiasi dimensione con caratteri ultrasonografici suggestivi di sviluppo
extracapsulare o con sospette metastasi linfonodali (in questo caso eseguire FNAB anche
sui linfonodi e praticare dosaggio della Tg sul liquido di lavaggio);
- nei noduli riscontrati incidentalmente alla 18FDG-PET previa valutazione nel contesto clinico
generale.
Î Gli estensori del presente PDTA raccomandano che tutti i criteri ultrasonografici di rischio
neoplastico vengano applicati anche ai nodi di diametro > 1 cm [Co.Est.].
Î I noduli funzionalmente autonomi eccezionalmente sono maligni e non è necessario sottoporli
ad agoaspirato [AACE 4-B], salvo pazienti in età pediatrica o in presenza di segni sospetti di
malignità. Questi pazienti rientrano nel PDTA dell’iperfunzione tiroidea.
Nel gozzo plurinodulare la FNAB deve essere effettuata sul/sui nodo/i con caratteristiche cliniche o
ecografiche sospette (che non coincide necessariamente con il nodo di maggiori dimensioni).
6.3.8 - CITOASPIRATO
Î L’esame citologico è considerato l’indagine più accurata per confermare/escludere il
sospetto diagnostico di neoplasia nell’ambito della patologia nodulare tiroidea e per selezionare i
pazienti in funzione della terapia. Nonostante l’elevata accuratezza diagnostica (95%), questo
esame non raggiunge comunque il 100% di sensibilità e specificità [AACE 3-B]
Î Si raccomanda di eseguire la FNAB sotto guida ecografica, poiché la diagnosi citologica
risulta più affidabile [AACE 3-B].
Il referto citologico deve descrivere il quadro morfologico e fornire, ove possibile, una
conclusione diagnostica sulla base della classificazione adottata: l’eterogeneità della terminologia e
della modalità di stesura del giudizio diagnostico con le possibili difficoltà di interpretazione del
referto viene superata utilizzando categorie di rischio codificate e omogenee, che andranno poi
valutate in un contesto clinico-strumentale più completo.
Le classificazioni attualmente più utilizzate, soprattutto in Europa, alle quali si raccomanda
di attenersi, prevedono complessivamente cinque categorie, indicate con la sigla TIR o THY. Gli
estensori del presente PDTA suggeriscono di utilizzare le LG SIAPEC. In ogni caso il patologo
dovrebbe indicare la LG a cui si riferisce.
* In evidente analogia con i nodi di diametro <1 cm, gli estensori di questo Documento ritengono che la concomitanza
di altri caratteri ecografici di rischio neoplastico costituisca indicazione alla FNAB anche nei nodi >1 cm (vedi
raccomandazione seguente).
AReSS Piemonte
PDTA Malattie Tiroidee
31
TIR 1 - Non Diagnostico per inadeguatezza tecnica di striscio, fissazione, colorazione o per non
rappresentatività cellulare.
Î Si raccomanda che per esprimere un giudizio diagnostico vi siano almeno 6 gruppi di 10-20
cellule tireocitarie ben conservate appartenenti alla lesione [AACE 4-D].
Generalmente si tratta di materiale proveniente da nodi cistici con cellularità scarsa o assente,
lesioni sclerotiche benigne o maligne, capsula spessa o calcifica, lesioni necrotiche, errori di
campionamento.
Nodi cistici colloidei e/o emorragici e aree di tiroidite con tappeto di elementi linfoidi, anche se non
rappresentativi secondo quanto sopra riportato, possono rientrare nella successiva categoria della
benignità (TIR 2) (Papanicolau 1996).
I referti non diagnostici non dovrebbero superare il 15-20% (Papanicolaou 1996).
TIR 2 - Negativo per Cellule Maligne
Questa categoria include il gozzo, le cisti, le tiroiditi e qualsiasi altra patologia inquadrabile in una
proliferazione benigna.
TIR 3 - Neoformazione Follicolare
Comprende adenomi/carcinomi follicolari (anche nella variante oncocitica), casi di carcinoma
papillare a variante follicolare, nodi di tipo iperplastico ad architettura microfollicolare; la categoria
rappresenta il 20% circa delle lesioni aspirate: di queste il 20% risulta istologicamente maligna
(Baloch 2002; Yang 2007; Tuttle 1998).
L’utilizzo di metodiche immunoistochimiche (galectina-3, citocheratina-19, HBME-1, ecc.) o
molecolari (ad esempio mutazioni/riarrangementi dei geni BRAF, RET-PTC, PPAR-gamma, RAS),
anche se non applicabile nella pratica routinaria, è in grado di fornire, ad integrazione dello studio
citologico, ulteriori informazioni in termini di stratificazione del rischio di malignità (Bartolazzi
2008).
In centri dotati di particolare esperienza in citologia tiroidea, la categoria TIR 3 può essere
ulteriormente suddivisa in due sottoclassi definite rispettivamente “lesione follicolare/atipia di
significato indeterminato” e “neoplasia follicolare”, che definiscono due gruppi di lesioni con
differente rischio di malignità.
TIR 4 - Sospetto di Malignità
Comprende: a) preparati con cellularità adeguata caratterizzata da quadri suggestivi ma che non
soddisfano pienamente i criteri per una diagnosi di malignità certa; b) preparati con scarsa
cellularità ma con caratteristiche cellulari fortemente suggestive per malignità.
TIR 5 - Positivo per Cellule Maligne
Comprende preparati con cellularità adeguata e caratteristiche cellulari fortemente indicative di
carcinomi papillari, midollari, anaplastici, linfomi e metastasi.
6.3.9 - RIVALUTAZIONE SPECIALISTICA
Obiettivo della rivalutazione clinica è prendere visione dell’esito dell’esame citologico e
definire il successivo percorso diagnostico-terapeutico alla luce del quadro clinico complessivo.
A discrezione dello specialista Î può essere considerata l’esecuzione di una scintigrafia nel gozzo
multinodulare, anche in presenza di TSH non soppresso, per escludere aree di autonomia
funzionale [AACE 3-B].
AReSS Piemonte
PDTA Malattie Tiroidee
32
TIR 1
Generalmente è raccomandabile la ripetizione dell’esame. A giudizio dello specialista, possono
essere scelte l’opzione chirurgica oppure l’inserimento in un programma di follow-up, in base alla
presenza o meno di elementi clinici o strumentali di sospetto neoplastico o di sintomatologia
compressiva.
TIR 2
Identifica con elevatissima probabilità una lesione benigna. A giudizio dello specialista, possono
essere scelte l’opzione chirurgica oppure l’inserimento in un programma di follow-up. I criteri che
guidano tale scelta sono la presenza di manifestazioni compressive o comunque la presenza di
criteri clinici fortemente sospetti per malignità.
Î In caso di sintomatologia compressiva, in alternativa all’opzione chirurgica ed in casi selezionati,
possono essere considerate l’alcolizzazione percutanea (PEI) (nodo cistico) [AACE 1-B], la
radioterapia metabolica con
131
I o la termoablazione ecoguidata (nodo solido).
Î La terapia di routine con L-tiroxina non è raccomandata [AACE 1-B]; Î in casi selezionati
(preferibilmente soggetti giovani con noduli piccoli in accrescimento), si può proporre terapia
medica con L-tiroxina a dosi tali da ottenere una moderata soppressione del TSH [AACE 1-B].
Il programma di follow-up prevede annualmente il controllo clinico, ecografico e del TSH (in caso
di terapia con tiroxina controllo di TSH, fT4).
L’agoaspirazione sotto guida ecografica può essere ripetuta nel tempo ed è raccomandata se il
nodulo aumenta di volume in modo significativo o in caso di variazioni delle caratteristiche cliniche
o ecografiche.
TIR 3
In questa categoria rientrano noduli in cui la citologia non consente di distinguere con certezza le
lesioni benigne da quelle maligne. La LG di riferimento non raccomanda la ripetizione della FNAB.
In linea generale è indicato l’intervento chirurgico, opzione che deve comunque essere discussa
con il paziente e valutata alla luce del contesto clinico-strumentale e del rischio neoplastico
stimato. La LG di riferimento non raccomanda, in linea generale, l’esecuzione di un esame
istologico estemporaneo intraoperatorio. La scelta di soprassedere alla tiroidectomia (basata sulla
presenza di caratteri clinici, ultrasonografici e citologici favorevoli) deve essere condivisa con il
paziente e presuppone una informazione adeguata ed esaustiva.
In caso di livelli di TSH ridotti, anche se non francamente soppressi, può essere indicata
l’esecuzione di una Scintigrafia Tiroidea allo scopo di identificare noduli iperfunzionanti
misconosciuti, per i quali non è indicato l’intervento chirurgico (se non per la risoluzione
dell’iperfunzione).
TIR 4
L’indicazione è chirurgica, da valutare comunque alla luce del rapporto rischio-beneficio. La LG di
riferimento raccomanda, in linea generale, l’esecuzione di un esame istologico estemporaneo
intraoperatorio.
TIR 5
L’indicazione è chirurgica, da valutare comunque alla luce del rapporto rischio-beneficio.
6.3.10 - FOLLOW-UP
Il follow-up prevede un controllo annuale dell’ecografia e di TSH (non reflex); il follow-up
può essere condotto sia dallo specialista sia dal MMG. In caso di nodi con citologia TIR 3 il follow AReSS Piemonte
PDTA Malattie Tiroidee
33
up deve essere particolarmente attento, ed è raccomandata una periodica rivalutazione
specialistica.
Î Si consiglia la ripetizione della FNAB in caso di comparsa di ulteriori caratteristiche
cliniche o ultrasonografiche di sospetto, oppure di aumento di volume >50% [AACE 3-B].
L’asportazione chirurgica (oppure altre opzioni terapeutiche quali l’alcolizzazione oppure la
termoablazione) potrà essere praticata in caso di aumento volumetrico del/dei nodo/i associato a
sintomatologia compressiva o disturbo estetico.
6.3.11 - INTERVENTO CHIRURGICO (vedi Appendice)
L’intervento chirurgico è indicato in tutti i pazienti con istologia TIR 4-5, è in genere
consigliato nei TIR 3, mentre nei TIR 1-2 l’indicazione dipende dalla valutazione dello specialista
(vedi 6.3.9).
Î In tutti pazienti da sottoporre ad intervento chirurgico per gozzo nodulare è indicata la
determinazione dei livelli di calcitonina (se già non eseguita) per evitare il rischio di un trattamento
chirurgico inadeguato [AACE 3-B].
Î In tutti pazienti da sottoporre ad intervento chirurgico per carcinoma tiroideo è consigliata la
determinazione preoperatoria della Tg per escludere falsi negativi. [AACE 3-B]; questo ha rilevanza
ai fini del follow-up postchirurgico di questi pazienti.
6.3.12 -TRATTAMENTO POSTCHIRURGICO E FOLLOW-UP
I pazienti operati per neoplasia tiroidea dovranno essere sottoposti a visita
endocrinologica (ed eventualmente a rivalutazione collegiale con chirurgo, medico nucleare,
radioterapista, oncologo, anatomopatologo) per definire il successivo iter terapeutico, determinato
dal tipo di intervento praticato, dal tipo istologico del tumore e dallo staging. La gestione del
paziente ed il follow-up dovranno avvenire esclusivamente presso Centri Specializzati.
6.3.13 - TERAPIA SOSTITUTIVA
Nei pazienti sottoposti a tiroidectomia totale (o near-total) per patologia benigna, è
necessario instaurare una terapia sostitutiva con L-tiroxina sin dai giorni immediatamente
successivi all’intervento (vedi 6.2.5)
6.3.14 - FOLLOW-UP
Nei pazienti operati per nodi benigni è consigliato un programma di follow-up che dovrà
essere mirato al monitoraggio della terapia sostitutiva nel caso residui ipotiroidismo, alla
identificazione di ipotiroidismo che dovesse manifestarsi a distanza di tempo nei pazienti sottoposti
ad interventi parziali, alla identificazione di eventuali recidive di patologia nodulare. Il follow-up
può essere condotto sia dallo specialista sia dal MMG.
In caso di ipotiroidismo post-chirurgico, una volta raggiunti i livelli ottimali di TSH (che
andranno inizialmente valutati a distanza di 2-3 mesi) si potrà passare ad un controllo annuale
(vedi 6.2.7).
6.3.15 - VISITA SPECIALISTICA (sospetto ca. midollare)
La gestione dei pazienti affetti o con sospetto carcinoma midollare della tiroide deve
avvenire in ambito altamente specialistico e non è oggetto di questo Documento.
AReSS Piemonte
PDTA Malattie Tiroidee
34
7. INDICATORI
L’iniziale definizione degli Indicatori ha tenuto conto sia della rilevanza dei presunti
scostamenti dal percorso di riferimento, sia della possibilità di ottenere i dati necessari per la
costruzione dell’indicatore stesso.
La prima area individuata riguardava l’appropriatezza prescrittiva degli esami di laboratorio
(uso congruo della Tg, dell’fT3 e dell’AbTPO); volutamente si è scelto di non occuparsi dell’utilizzo
dell’R-TSH poiché già oggetto di un altro Documento Regionale [Regione Piemonte - Documento
su appropriatezza prescrittiva per le analisi di laboratorio - 2008]. L’analisi dei dati a disposizione
ha però evidenziato che la costruzione di questi indicatori risulta impraticabile, non essendo
possibile ad esempio distinguere un TSH da un R-TSH o un fT3 eseguito in prima battuta da uno
eseguito a seguito di un R-TSH. La costruzione di questi indicatori potrebbe essere presa in esame
a seguito di modifiche del nomenclatore regionale.
La seconda area riguarda invece la verifica delle procedure ecografiche e citologiche; in
questi casi i dati vanno ricercati ad hoc presso le singole strutture che erogano le prestazioni, si
tratta quindi di indicatori che, sia pur con questo limite, possono essere utilizzati.
#1
Completezza del referto ecografico
Raccomandazione
Il referto ecografico deve prevedere le informazioni corrette e complete
sulla ghiandola e sui nodi (v. 6.3.3)
Numero referti ecografie tiroidee completi
Totale referti ecografie tiroidee
Studio ad hoc
Studio ad hoc
>95%
Descrizione numeratore
Descrizione denominatore
Fonte dati numeratore
Fonte dati denominatore
Valore soglia
#2
Adozione dei criteri di classificazione citologica SIAPEC
Raccomandazione
I referti anatomopatologici devono essere conformi ai criteri di
classificazione citologica SIAPEC (v. 6.3.8)
Numero referti citologici su materiale tiroideo conformi ai criteri
Totale referti citologici su materiale tiroideo
Studio ad hoc
Studio ad hoc
>95%
Descrizione numeratore
Descrizione denominatore
Fonte dati numeratore
Fonte dati denominatore
Valore soglia
#3
Proporzione di referti citologici TIR 1
Raccomandazione
Descrizione numeratore
Descrizione denominatore
Fonte dati numeratore
Fonte dati denominatore
Valore soglia
I referti TIR 1 non dovrebbero superare il 20% (v. 6.3.8)
Numero biopsie tiroidee con referto TIR 1
Totale biopsie tiroidee
Studio ad hoc
Studio ad hoc
≤20%
AReSS Piemonte
PDTA Malattie Tiroidee
35
8. APPENDICE
8.1 TERAPIA CHIRURGICA DELLE TIREOPATIE
8.1.1 - TIPI DI INTERVENTO SULLA TIROIDE
Per il trattamento chirurgico della patologia tiroidea sono ritenute attuali 3 opzioni:
1. LOBOISTMECTOMIA TOTALE. Consiste nell’asportazione completa di un lobo con l’istmo e
l’eventuale processo piramidale.
2. ISTMECTOMIA. Consiste nella resezione dell’istmo e dell’eventuale processo piramidale.
3. TIROIDECTOMIA TOTALE o quasi totale (“near total” secondo la letteratura anglosassone).
La loboistmectomia totale e la tiroidectomia totale o quasi totale richiedono, mono- o bilateralmente e
compatibilmente con la situazione anatomo-clinica, l’identificazione e la preparazione del nervo laringeo
ricorrente e il rispetto dell’integrità anatomica della branca esterna del nervo laringeo superiore e
dell’integrità anatomica e vascolare delle paratiroidi. Paratiroidi non isolabili, devascolarizzate o
accidentalmente escisse vanno autotrapiantate; la sede dell’autotrapianto è di regola il muscolo
sternocleidomastoideo.
Nella resezione quasi totale viene lasciata una minima porzione della capsula posteriore di uno o di entrambi
i lobi nell’area del legamento di Berry a protezione del nervo laringeo ricorrente o di una paratiroide. Questa
soluzione tecnica, talvolta indispensabile per salvaguardare l’integrità anatomica e funzionale delle strutture
menzionate, è equivalente alle resezioni mono- o bilaterali totali per quanto riguarda gli obiettivi terapeutici
dell’intervento purché il residuo parenchimale sia realmente minimo (≤ 1 g, corrispondente a un volume non
superiore a 1 cm3).
Negli ultimi anni si sono progressivamente diffuse TECNICHE DI TIPO MINI-INVASIVO, che vengono
solitamente distinte in: tecniche endoscopiche pure; tecniche mini-invasive “open”; tecniche endoscopiche
videoassistite. Le tecniche endoscopiche pure, che si avvalgono dell’insufflazione di gas, hanno
un’applicazione estremamente limitata. Più diffuse sono le tecniche non-endoscopiche mini-invasive
(“open”), che usufruiscono di accessi mini-cervicotomici e di strumenti della chirurgia tradizionale. La
tiroidectomia mini-invasiva video-assistita (MIVAT) è, invece, una tecnica completamente gasless, che si
avvale di un accesso chirurgico orizzontale centrale di 1.5-2 cm di lunghezza, di un’ottica da 5 mm e di
strumenti per la dissezione ideati specificamente.
8.2.2 - TIPI DI INTERVENTO SUI LINFONODI CERVICALI
La American Academy of Otolaryngology e la American Head and Neck Society (AAO-AHNS) hanno rivisto la
classificazione anatomo-topografica delle stazioni linfoghiandolari del collo, proponendo una suddivisione in
livelli e sublivelli (vedi Figura) che è al momento universalmente accettata.
AReSS Piemonte
PDTA Malattie Tiroidee
36
Si raccomanda di fare riferimento a tale classificazione nella definizione dei reperti operatori e delle exeresi
linfonodali.
I tumori maligni della tiroide, particolarmente i carcinomi papillifero e midollare, coinvolgono frequentemente
i linfonodi cervicali. La diffusione linfatica interessa principalmente il cosiddetto comparto cervicale centrale,
corrispondente al livello VI della classificazione AAO-AHNS, e il comparto laterocervicale omolaterale al
tumore, nel quale sono abitualmente coinvolti i livelli/sublivelli IIA, III, IV e VB. Nei tumori localmente
avanzati non è eccezionale la presenza di metastasi nel comparto laterocervicale controlaterale e nel
mediastino superiore.
1. DISSEZIONE LINFOGHIANDOLARE CENTRALE. Consiste nell’asportazione del connettivo e dei
linfonodi prelaringei, paratracheali (ricorrenziali) e pretracheali, seguendo dei limiti anatomici
costituiti lateralmente dalle guaine carotidee e caudalmente dall’arteria anonima. Impone una estesa
preparazione dei nervi ricorrenti verso il mediastino e non permette, salvo situazioni anatomiche
particolarmente favorevoli, di salvaguardare le paratiroidi inferiori (che, se riconoscibili, debbono
essere autotrapiantate). Con l’intento di minimizzare il potenziale incremento della morbilità
ricorrenziale e paratiroidea, negli ultimi anni si è andato affermando il concetto di DISSEZIONE
DELL’EMICOMPARTO CENTRALE OMOLATERALE al tumore, nella quale vengono preservati il
connettivo e i linfonodi paratracheali controlaterali alla lesione neoplastica; in questo modo il rischio
aggiuntivo della procedura viene limitato ad un solo nervo ricorrente e ad una sola paratiroide
inferiore.
2. DISSEZIONE LINFOGHIANDOLARE LATEROCERVICALE. Consiste nell’asportazione del connettivo e
dei linfonodi di (generalmente) più livelli/sublivelli compresi fra il II e il V, salvaguardando il m.
sternocleidomastoideo, la vena giugulare interna, i nervi accessorio spinale, ipoglosso, frenico e
vago, i principali rami anteriori del plesso cervicale e (a sinistra) il dotto toracico. La semplice
escissione dei linfonodi macroscopicamente coinvolti (node picking secondo la letteratura
anglosassone) non è più raccomandata perché lascia frequentemente metastasi residue.
La linfadenectomia viene definita profilattica, se attuata con l’intento di rimuovere possibili metastasi
infracliniche in assenza di evidenti localizzazioni secondarie; è terapeutica se il compartimento interessato
contiene linfonodi macroscopicamente patologici.
8.2.3 - SCELTA DELL’INTERVENTO SULLA TIROIDE - IPERTIROIDISMO
ADENOMA TOSSICO ISOLATO: loboistmectomia totale.
GOZZO MULTINODULARE TOSSICO: tiroidectomia totale; tiroidectomia subtotale con residuo monolaterale
solo di necessità, se vi sono dubbi sull’integrità anatomica del nervo laringeo ricorrente o sulla
vascolarizzazione delle paratiroidi.
M. DI BASEDOW: tiroidectomia totale eseguita di principio; tiroidectomia subtotale con residuo monolaterale
solo di necessità, se vi sono dubbi sull’integrità anatomica del nervo laringeo ricorrente o sulla
vascolarizzazione delle paratiroidi.
8.2.4 - SCELTA DELL’INTERVENTO SULLA TIROIDE - PATOLOGIA NODULARE
La scelta fra una chirurgia conservativa (loboistmectomia totale o istmectomia) e una tiroidectomia totale è
condizionata dalla situazione clinica (nodo unico / nodi multipli) e dal rischio neoplastico, definito
principalmente dalla citologia preoperatoria e dai livelli di calcitonina (basale ed eventualmente stimolata con
pentagastrina). Questo Documento non si occupa del trattamento del carcinoma midollare.
La presenza di NODI MULTIPLI è di per sé un’indicazione alla tiroidectomia totale. Una loboistmectomia
totale è peraltro giustificata se, in assenza di elementi di rischio neoplastico, un lobo è integro e il paziente
preferisce un intervento conservativo.
In presenza di un NODULO SOLITARIO vanno considerate le seguenti opzioni.
1. Rischio di malignità assente o non determinato (citologia TIR 1-2; calcitonina normale). Il trattamento
chirurgico è di regola conservativo e consiste per lo più in una loboistmectomia totale; l’istmectomia è
sufficiente per nodi di piccole dimensioni a sede strettamente istmica. Una tiroidectomia totale è indicata
nei pazienti con storia di esposizione a radiazioni ionizzanti, e va considerata in presenza di coesistente
patologia disfunzionale (ipotiroidismo autoimmune, considerando che in tale situazione l’ipofunzione è
AReSS Piemonte
PDTA Malattie Tiroidee
37
comunque scontata e che si prevengono recidive di malattia nel lobo controlaterale) o di spiccata
familiarità per gozzo (che condiziona un elevato rischio di recidiva).
2. Rischio di malignità intermedio o elevato (citologia TIR 3-4; calcitonina basale e/o stimolata patologica):
- Nodi con citologia TIR 3. Il trattamento chirurgico è di regola conservativo e consiste in una
loboistmectomia totale; l’istmectomia è adeguata in presenza di nodi di piccole dimensioni a
sede strettamente istmica. L’esame istologico estemporaneo è generalmente ritenuto non
dirimente e pertanto non è consigliato; il paziente deve quindi sapere che un’eventuale diagnosi
di malignità verrà fatta solo con l’esame istologico definitivo, e che in questo caso sarà
probabilmente necessario un reintervento per completare la tiroidectomia. Una tiroidectomia
totale di principio è indicata nei pazienti con storia di esposizione a radiazioni ionizzanti, o con
una coesistente patologia disfunzionale (ipotiroidismo autoimmune); va considerata (e discussa
col paziente) in presenza di elementi che aumentano il rischio neoplastico (familiarità per
neoplasie maligne della tiroide, positività dei marcatori immunocitochimici o molecolari, nodi di
dimensioni > 4 cm), o di spiccata familiarità per gozzo; può rappresentare infine la legittima
scelta di un paziente che non desidera rischiare una tiroidectomia totale in due tempi.
- Nodi con citologia TIR 4. Il trattamento chirurgico inizia con un loboistmectomia totale e prevede
un esame istologico estemporaneo; se positivo, la tiroidectomia potrà essere immediatamente
completata ed eventualmente integrata da una linfadenectomia. Il paziente deve essere
informato del fatto che l’esame istologico estemporaneo è soggetto a falsi negativi, e che in
questo caso potrà rendersi necessario il completamento della tiroidectomia con un successivo
intervento. Una tiroidectomia totale di principio è indicata o giustificata quando sussistono le
condizioni esposte nel punto precedente.
- Nodi associati a calcitonina elevata. Valori significativamente elevati di calcitonina implicano un
rischio di carcinoma midollare e impongono di principio una tiroidectomia totale completata da
una linfadenectomia centrale (vedi oltre), indipendentemente dai risultati della citologia
preoperatoria o di un esame istologico estemporaneo sul nodo.
3. Nodi con citologia TIR 5. Il trattamento di elezione di un carcinoma della tiroide è di regola la
tiroidectomia totale. Un intervento conservativo (loboistmectomia totale) è considerato sufficiente solo
per carcinomi papilliferi di dimensioni ≤ 1 cm, unifocali, intratiroidei, privi di caratteristiche istologiche di
aggressività e senza evidenza ecografica di metastasi linfoghiandolari, diagnosticati all’esame istologico
definitivo.
8.2.5 - SCELTA DELL’INTERVENTO SUI LINFONODI CERVICALI
CARCINOMI DIFFERENZIATI
La presenza di metastasi clinicamente evidenti impone una linfadenectomia terapeutica nel comparto
interessato. Se le metastasi sono apparentemente localizzate solo nel comparto laterale, è opportuno che la
dissezione linfoghiandolare includa anche il comparto centrale, per l’elevato rischio di metastasi infracliniche
in tale sede.
L’indicazione a una linfadenectomia profilattica del comparto centrale in caso di carcinoma papillifero è
dibattuta. Pesano a favore la documentata frequenza di metastasi infracliniche, l’oggettiva difficoltà di un
reintervento in questa sede in caso di malattia persistente/recidiva, la possibilità di una più precisa
stadiazione della malattia. Giocano contro il maggiore rischio di ipoparatiroidismo permanente (peraltro
ampiamente condizionato dall’esperienza del chirurgo) e l’assenza di documentati benefici in termini
prognostici. Va considerata soprattutto in presenza di tumori voluminosi (<3 cm) e/o localmente invasivi.
Una dissezione limitata all’emicomparto centrale omolaterale al tumore può rappresentare un buon
compromesso fra le contrastanti esigenze di radicalità chirurgica e di contenimento del rischio di
complicazioni.
Non sussistono indicazioni alla linfadenectomia profilattica nel comparto laterale del collo.
CARCINOMA MIDOLLARE
Le caratteristiche biologiche del carcinoma midollare impongono delle dissezioni linfoghiandolari molto
accurate ed estese; si raccomanda pertanto che questi casi vengano indirizzati a centri con adeguata
esperienza.
AReSS Piemonte
PDTA Malattie Tiroidee
38
8.2 RADIOTERAPIA METABOLICA DELLE TIREOPATIE
8.2.1 - AFFEZIONI TIROIDEE BENIGNE
INDICAZIONI AL TRATTAMENTO CON 131I
Morbo di Basedow
- recidiva di ipertiroidismo dopo ciclo di trattamento con farmaci antitiroidei;
- allergia, effetti collaterali o scarsa compliance ai tireostatici;
- rifiuto o rischio elevato alla terapia chirurgica.
Nota: nel caso sia presente oftalmopatia basedowiana l’obiettivo è la totale ablazione del tessuto tiroideo e
può rendersi necessario associare un trattamento corticosteroideo anche prolungato.
Adenoma tossico: il trattamento deve essere effettuato nella fase in cui l’adenoma inibisce il parenchima
extranodale.
Gozzo multinodulare tossico
Gozzo multinodulare non tossico di grandi dimensioni: citoriduzione di struma compressivo non operabile.
Ablazione residui ghiandolari post-tiroidectomia: in caso di orbitopatia grave (in fase inattiva).
NON INDICAZIONI AL TRATTAMENTO CON 131I
Tireotossicosi a bassa captazione:
- fase di tireotossicosi della tiroidite;
- fattizia o indotta da medicamenti (amiodarone, jodio).
Noduli sospetti per malignità.
CONTROINDICAZIONI
Assolute: gravidanza o allattamento in atto.
Relative: età <18 anni (la terapia è praticabile in casi selezionati).
PREPARAZIONE AL TRATTAMENTO
- escludere la gravidanza;
- evitare l’assunzione di composti iodurati a posologia farmacologica;
- fornire informazioni, istruzioni protezionistiche, prescrizioni mediche;
- sospendere i tireostatici, se possibile, per il periodo necessario alla ripresa della captazione tiroidea;
- personalizzare l’attività da somministrare (valutazione clinica e dosimetria).
DOPO IL TRATTAMENTO
Valutazione precoce per il controllo dei fenomeni attinici a breve termine. Previsione dell’efficacia del
trattamento e valutazione dei tempi e delle modalità del follow-up.
Gli effetti definitivi del trattamento sono attesi al 3°- 5° mese e richiedono spesso una rivalutazione mediconucleare.
8.2.2 - AFFEZIONI TIROIDEE MALIGNE
La terapia radiometabolica del carcinoma differenziato della tiroide si basa sulla somministrazione di Ioduro
di Sodio (131I) per l’irraggiamento selettivo di:
- residui tiroidei post-tiroidectomia (trattamento adiuvante);
- malattia residua post-tiroidectomia;
- recidiva locale;
- linfonodi loco-regionali metastatici;
- metastasi a distanza.
Viene effettuata in regime di ricovero (degenza protetta) in ragione della attività radianti in gioco.
La terapia radiometabolica consente inoltre di:
- trattare microscopiche lesioni tumorali non visualizzabili;
- aumentare la sensibilità e la specificità degli esami di follow-up grazie all’eliminazione dei residui tiroidei;
- effettuare una sensibile scintigrafia diagnostica totale corporea post-terapia (che può evidenziare metastasi
in precedenza occulte).
AReSS Piemonte
PDTA Malattie Tiroidee
39
È una PROCEDURA STANDARDIZZATA nel carcinoma differenziato della tiroide. La sola eccezione riguarda
soggetti con carcinoma tiroideo papillare unifocale di diametro <1 cm in assenza di metastasi e di invasione
della capsula tiroidea, senza anamnesi di esposizione radiante, senza istotipo sfavorevole (sottotipo a cellule
alte, a cellule colonnari, sclerosante diffuso). In questi casi alcuni centri scelgono di non trattare i pazienti
perché questa procedura non migliorerebbe una prognosi già di per sé eccellente.
In caso di recidiva locale, metastasi linfonodali loco-regionali o metastasi a distanza, la radioterapia
metabolica è in grado di eradicare la malattia o rallentarne la progressione. L’efficacia è superiore nei
soggetti con lesioni avidamente captanti 131I e nelle lesioni microscopiche o macroscopiche di più piccole
dimensioni. Una valutazione preliminare sulla possibilità di resezione chirurgica, anche solo parziale,
andrebbe sempre comunque effettuata.
È raccomandata la DOSIMETRIA PRELIMINARE con lo scopo di:
- determinare le attività radianti efficaci da somministrare ai residui tiroidei e/o a singole/multiple lesioni;
- valutare l’esposizione dell’organo critico (midollo osseo) ed incrementare l’attività radiante somministrabile
con minor rischio di severi effetti collaterali.
Prevede la PREPARAZIONE DEL PAZIENTE per raggiungere le condizioni ideali al trattamento:
- valutazione clinica e radioprotezionistica;
- sospensione prolungata della terapia farmacologia sostitutiva o iniezioni di TSH ricombinante;
- astensione da farmaci o altre sostanze iodate, dieta ipoiodica;
- esami di pre-ricovero.
Prevede un FOLLOW-UP medico-nucleare volto a valutare gli effetti radianti precoci e tardivi.
8.3 CLASSI DI PRIORITÀ
Classi di priorità in Regione Piemonte per visite specialistiche e prestazioni ambulatoriali (D.D. n° 375 del
10.07.2009).
CLASSE U
CLASSE B
CLASSE D
CLASSE P
Prestazione non rimandabile e urgente che deve essere garantita entro 48 ore dalla richiesta
(pazienti le cui condizioni di salute potrebbero aggravarsi rapidamente tanto da diventare
emergenza o compromettere lo stato di salute)
Prestazione da assicurarsi entro i 15 giorni dalla richiesta (pazienti le cui condizioni di salute
comportano un intenso dolore, o gravi disfunzioni, o grave disabilità, ma non hanno la
tendenza ad aggravarsi rapidamente al punto da diventare emergenti né l’attesa può
compromettere lo stato di salute)
Prestazione differibile, entro i 30 giorni per le prime visite, entro i 60 giorni per le prestazioni
diagnostiche (pazienti le cui condizioni di salute presentano minimo dolore, disfunzione o
disabilità, e non manifestano tendenza ad aggravarsi né l’attesa può compromettere lo stato
di salute)
Prestazione programmabile, non urgente (pazienti che non presentano dolore, disfunzione o
disabilità)
AReSS Piemonte
PDTA Malattie Tiroidee
40