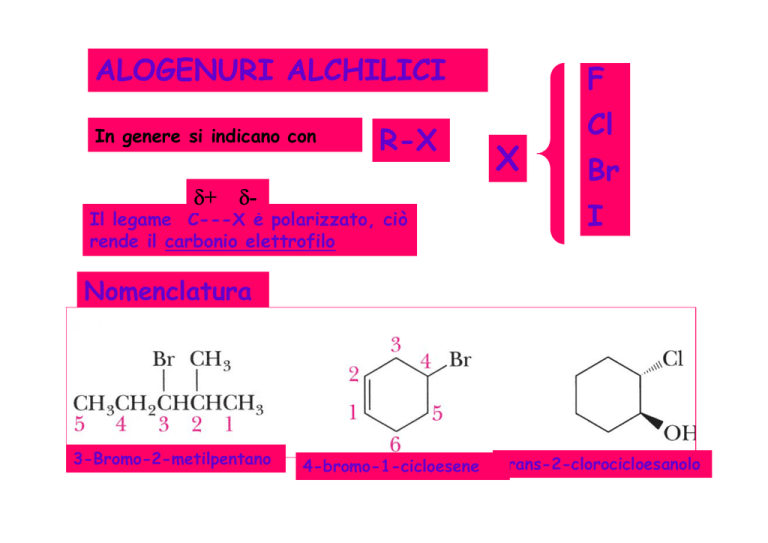
ALOGENURI ALCHILICI
In genere si indicano con
R-X
δ+ δ-
Il legame C---X è polarizzato, ciò
rende il carbonio elettrofilo
F
X
Cl
Br
I
Nomenclatura
3-Bromo-2-metilpentano
4-bromo-1-cicloesene
trans-2-clorocicloesanolo
Diclorometano
(cloruro di
metilene)
Triclorometano
(cloroformio)
1,1,1-tricloroetano tricloroetilene
Gli alogenuri alchilici hanno molte applicazioni:
solventi, pesticidi, farmaci, intermedi di reazione etc.
Cl
H
C
CCl3
Diclorodifeniltricloroetano
DDT
Cl
Clorofluorocarburi (CFC) e il buco dell’ozono
CCl3F, Freon-11
CCl2F2, Freon-12
Sono gas non tossici, inodori, non infiammabili e non
corrosivi. Trovano impiego nei sistemi di
refrigerazione Altri CFC son usati come gas per
aerosol e spray
Per azione della luce UV (negli strati alti
dell’atmosfera formano radicali che reagiscono con
O3 consumandolo
Oggi sono
prodotti questi
HCFC non dannosi
per l’ozono
ALCOLI, ETERI, TIOLI
Alcol: molecola
contenente un gruppo -OH
legato ad un carbonio sp3
Etere: composto
contenente un atomo di
ossigeno legato a due
carboni sp3
Tiolo: molecola
contenente un gruppo SH legato ad un carbonio
sp3
Nomenclatura Alcoli
Etanolo
(alcol etilico)
2-butanolo
1-propanolo
(alcol propilico)
2-metil-1-propanolo
(alcol isobutilico)
2-propanolo
(alcol isopropilico)
2-metil-2-propanolo
alcol terz-butilico
1-butanolo
cicloesanolo
CH2OH
fenilmetanolo
Primario
secondario
terziario
(alcol benzilico)
Dioli:
Composto con due gruppi ossidrilici su
carboni adiacenti ed ibridati sp3.
Nella nomenclatura comune sono
chiamati glicoli
1,2-etandiolo
1,2-propandiolo
1,2,3-propantriolo
(glicole etilenico)
(glicole propilenico)
(glicerina)
Tioli (mecaptani)
Etantiolo
Solfuri:
2-metil-1-propantiolo 2-mercaptoetanolo
Sono gli analoghi solforati degli
eterei
CH3-S-CH3
dimetilsolfuro
dietilsolfuro
Etere: composto
contenente un atomo di
ossigeno legato a due
carboni sp3
Etossieteno
(etere etilico)
2-metossi-2-metilpropano
(etere terz-butilmetilico)
trans-2etossicicloesanolo
-OR : alcossile (OCH3: metossile)
Eteri ciclici
Ossido di etilene Tetraidrofurano
Tetraidropirano
1,4-diossano
Eteri - Proprietà fisiche
Gli eteri sono composti polari ma non possono donare legame idrogeno.
Hanno dei punti di ebollizione più bassi rispetto agli alcoli
Deboli interazioni
dipolo-dipolo
Legame
idrogeno
Possono accettare un
legame idrogeno. Ciò facilita
la loro solubilità in acqua
ALDEIDI E CHETONI
Aldeide
Cheton
e
Sostanza caratterizzata dalla presenza di un
gruppo carbonilico (C=O) legato ad un atomo
di idrogeno ed in gruppo alchilico od arilico
Sostanza caratterizzata dalla presenza di un
gruppo carbonilico (C=O) legato a due gruppi
alchilici od arilici
Nomenclatura delle Aldeidi
Il nome dell’aldeide si ricava cambiando il suffisso –o dell’alcano in -ale
metanale
(formaldeide)
2-propenale
etanale
3-metilbutanale
(acetaldeide)
ciclopentancarbaldeide
benzaldeide
Nomenclatura dei Chetoni
Il nome del chetone si ricava cambiando il suffisso –
o dell’alcano in -one
Propanone
5-metil-3-esanone
2-metilcicloesanone
(acetone)
Acetofenone
Benzofenone
Regola per assegnare il nome (IUPAC)
Ordine di precedenza crescente di sei gruppi funzionali
Proprietà fisiche
Il gruppo carbonilico è polarizzato, ciò rende aldeidi e
chetoni molecole polari aventi, quindi, dei punti di
ebollizione maggiori dei composti non polari di pari peso
molecolare.
Il gruppo carbonilico è polarizzato in
ragione della differenza di
elettronegatività tra Carbonio ed
Ossigeno.
Alla stessa conclusione si
arriva evidenziando che il
carbonile è l’ibrido di due
strutture limite di
risonanza
CARBOIDRAT
I
Carboidrati
Il nome deriva dalla dalla formula Cn (H2O)n che
hanno molti membri di questa classe di sostanze
Chimicamente un carboidrato e un
poliidrossialdeide o un poliidrossichetone
I carboidrati vengono classificati come:
monosaccaridi,
Fruttosio
disaccaridi,
polisaccaridi
Saccarosio
Amido
Cellulos
a
Glucosio
Monosaccaridi (aldosi e chetosi)
Gliceraldeide
Diidrossiacetone
Conversione in
proiezione di Fischer
D-gliceraldeide
(R) gliceraldeide
[α] =
+13.5
L- gliceraldeide
[α] = -13.5
aldotriosi,
aldotriosi,
D-gliceraldeide
aldotetrosi,
aldotetrosi,
aldopentosi
aldopentosi
aldoesosi
aldoesosi
D-treosio
D-eritrosio
D-ribosio
D-arabinosio
D-xilosio
D-allosio D-altrosio
D-glucosio D-mannosio D-gulosio
idosio
D-
D-lixosio
D-galattosio D-talosio
2-chetotriosi,
2-chetotriosi,
diidrossiacetone
2-chetotetrosi,
2-chetotetrosi,
2-chetopentosi
2-chetopentosi
2-chetoesosi
2-chetoesosi
D-fruttosio
Disaccarid
i
αglucosidico
Maltosio
glucosio
β
glucosio
βgalattosidico
Lattosio
galattosio
glucosio
β
Disaccarid
i
Legame α-12-glicosidico
fruttosio
glucosio
Saccarosio
Polisaccaridi
Amido
α-(1-6)-glucosidico
α-(1-4)-glucosidico
Polisaccaridi
Cellulosa
β-(1-4)-glucosidico
Acidi Carbossilici
Caratterizzati
dalla presenza di
un gruppo
carbossilico
CH3
H
Ac. etanoico
Ac metanoico
(Ac.
Acetico)
(Ac. Formico)
Nomenclatura (IUPAC)
Il nome degli acidi carbossilici si ricava da quello degli
alcani togliendo la o e mettendo al suo posto il suffisso
oico e facendo precedere il nome dalla parola acido
H-COOH
ac. metanoico
ac. 3metilbutanoico
3
CH3COOH
2
1
CH3CH2COOH
ac. etanoico
ac. propanoico
ac. trans-3-fenilpropenoico
Acidi dicarbossilici
Ac
benzoico
Ac. 2-idrossibenzoico
(Ac. salicilico)
ossalico
succinico
glutarico
malonico
adipico
Nomenclatura comune
Quando si usano i nomi comuni si aggiungono spesso le
lettere greche α, β, γ, δ, ε per indicare la posizione dei
sostituenti
Ac. γidrossibutirrico
Gruppo acetile
Ac. α−amminopropionico
(Alanina)
Proprietà
fisiche
Formano dei legami idrogeno
intermolecolari molto forti
legame idrogeno
Hanno dei p. e. più
alti degli alcol,
aldeidi, chetoni di
pari peso molecolare
La solubilità in acqua diminuisce
all’aumentare del peso
molecolare
CH3-(CH2)8-COOH
Coda apolare
(idrofobica)
Aumenta
nella molecola
la parte
lipofila
Ac. decanoico
Testa
polare
(idrofilica)
Corpi chetonici e
diabete
Acido 3-ossobutanoico
Acido 3idrossibutanoico
Queste sostanze, dette corpi chetonici, sono normalmente
presenti nel sangue a conc. 0.01mM e sono prodotti
dall’acetil-CoA
Nelle persone affette da diabete la loro conc. aumenta anche
di 500 volte. La decarbossilazione spontanea del chetoacido
produce acetone, che non metabolizzato si accumula e si sente
nell’alito dei diabetici.
acetone
Dalla corteccia del salice all’Aspirina
H2O/H+
Salicina
Ac. acetil salicilico
ASPIRINA
Alcol salicilico
Acido salicilico
AMMINE
Sono composti basici derivati dell’ammoniaca in cui
uno o più idrogeni sono sostituiti da gruppi alchilici o
arilici
In ragione del numero di gruppi alchilici
(o arilici) le ammine si classificano
come:
ammoniaca
3aria
ammina
1aria
(metilammina)
(trimetilammina)
ammina
2aria
(dimetilammina)
ammina
Queste sono ammine alifatiche (hanno legati solo gruppi
alchilici)
Ammine aromatiche
anilina
N-metilanilina
benzildimetilammina
Ammine eterocicliche
alifatich
e
pirrolidina
piperidina
aromatiche
pirrolo
piridina
Anilina
4-nitroanilina
4-metilanilina
(p-toluidina)
anisidina)
3-metossianilina
(m-
Molti composti di origine naturale hanno gruppi
amminici. Molto spesso questi composti hanno un ruolo
chiave nel metabolismo cellulare.
Vitamina B6
adrenalina
Alcuni possono essere
Farmaci
Clorochina
Benzocaina
serotonina
Alcaloidi
Composti basici,
contenenti azoto, di
origine vegetale
Nicotina
cocaina
Morfina e analgesici correlati
Morfina
Codeina
acetilazion
e
Oppio papaverum
somniferum
Eroina
Nomenclatura delle ammine (IUPAC)
Il suffisso
ammina
CH3CH3
–o degli alcani è sostituito da -
Etano
2-propanammina
(2-amminopropano)
diamminoesano)
CH3CH2-NH2
Etananammina
(S)-1-feniletanammina
1,6-esandiammina
(1,6-
Proprietà fisiche delle ammine
Le ammine possono formare legami idrogeno
(sia donatori che accettori di legami idrogeno)
Legami idrogeno
Il legame idrogeno con l’azoto è
meno forte di quello con
l’ossigeno
I punti di
ebollizione degli
alcol omologhi sono
più alti
Amminoacidi
Un α-amminoacido
Forma
ionizzata sale
interno
(zwitterione)
Forma non
ionizzata
Il carbonio α è
asimmetrico
(chirale)
D-alanina
L-alanina
Gli α-amminoacidi sono le unità molecolari
(monomeri) che “costruiscono” le proteine (polimero)
Insulina umana: una proteina (piccola)
Gli amminoacidi proteici sono 20
ed hanno sempre chiralità L
Gli a.a. differiscono
per la catena laterale
R
Catene laterali non
polari
Catene laterali
polari
Catene laterali acide
Catene laterali basiche
Catene laterali non polari
Alanina
Glicina
Leuci
na
Fenilala
nina
Triptof
ano
Valin
a
Catene laterali polari
Aspara
gina
Glutam
mina
Serina
Treonina
Catene laterali acide
Acido
aspartico
Acido
glutammi
co
Cistei
na
Tiros
ina
Catene laterali basiche
Arginina
Istid
ina
Lisi
na
O
H 2N
CH
CH
O
C
OH
+
H 2O
H 2N
CH
CH
3
C
O-
+
H 3O +
3
a cid o
v a lo r i sp e rim e n ta li K a = 2 .0 5 * 1 0 -1 0
v a lo r i a ttesi (a c . clo ro p ro p io n ico ) K a = 1 0 -3
O
H 2N
CH
C
O
OH
+
H 2O
H 3N
CH
C
+
CH
3
CH
3
b a se
v a lo r i sp e rim e n ta li K b = 2 .2 4 * 1 0 -1 2
v a lo ri a ttesi (a m m in a p rim a ria ) K b = 1 0 -4
Ka è relativo all’acidita’ di NH3+
Kb è relativo alla basicità di coo-
OH
+
OH
-
Polipeptidi e proteine
Polipeptide
Proteina
Macromolecola contenente da dieci
a cento unità di amminoacidi
ciascuna legata all’altra da un
legame peptidico
Macromolecola contenente più di
cento unità di amminoacidi ciascuna
legata all’altra da un legame
peptidico
Come è fatto il legame peptidico e tra
quali funzioni degli amminoacidi si
realizza?
Il legame peptidico è un legame
ammidico
serina
alanina
Dipeptide:
serilalanina
Legame peptidico
Geometria del legame peptidico
Legame ammidico ha un parziale
carattere di doppio legame; c’è
impedita rotazione intorno ad
esso.
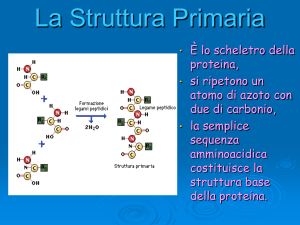
Struttura primaria di polipeptidi e
proteine
Rappresenta la sequenza degli a.a. lungo la
catena polipeptidica (ovvero l’ordine con cui
sono legati)
a.a N-terminale
a.a. C-terminale
Come si fa a conoscere la struttura
primaria?
Si procede in due tappe
Analisi qualitativa-quantitativa degli
a.a
Analisi della sequenza degli a.a.
Struttura secondaria di una
proteina
Descrive le particolari sistemazioni ordinate
(conformazioni) assunte dagli amminoacidi in particolari
regioni della proteina
Pauling propose due
tipi di strutture
secondarie
Struttura
Struttura
(o aa
ββ (o
pieghe)
pieghe)
Struttura
Struttura
(o ad
ad
αα (o
elica)
elica)
Sono i legami idrogeno che stabilizzano una
conformazione di una proteina
(popolipeptide)
Legame
idrogeno
Può essere intercatena o intracatena
Struttura terziaria di una
proteina
Si riferisce al tipo di avvolgimento o disposizione
complessiva che assume una catena proteica nello spazio
Struttura terziaria della
mioglobina.
Si individuano alcuni
tratti ad con struttura α
Oltre ad i legami idrogeno la struttura terziaria di
una proteina è “tenuta insieme” anche da legami
disolfuro
Insulina umana
Catene
laterali di
cisteine
Ox
Red
Legame
disolfuro
Struttura quaternaria di una proteina
La possiedono le proteine formate da più di una catena
polipeptidica. Indica la disposizione reciproca delle catene nello
spazio
Struttura quaternaria
dell’emoglobina